Таблетки от описторхоза для собак
Обновлено: 24.04.2024
Хронический холецистит — воспалительное заболевание желчного пузыря, сочетающееся с функциональными нарушениями и изменениями физико-химических свойств желчи.
Хронический холецистит — воспалительное заболевание желчного пузыря, сочетающееся с функциональными нарушениями (дискинезиями желчного пузыря и сфинктерного аппарата желчевыводящих путей) и изменениями физико-химических свойств желчи (дисхолией).
По данным различных авторов, больные хроническим холециститом составляют 17–19%, в индустриально развитых странах — до 20%.
Классификация
Согласно МКБ-10 выделяют:
Клиника
В клинике преобладает болевой синдром, который возникает в области правого подреберья, реже — в подложечной области. Боль иррадиирует в правую лопатку, ключицу, плечевой сустав, имеет ноющий характер, продолжается в течение многих часов, дней, иногда недель. Нередко на этом фоне возникает острая схваткообразная боль, обусловленная обострением воспаления в желчном пузыре. Возникновение боли и ее усиление чаще связано с нарушением диеты, физическим напряжением, охлаждением, интеркуррентной инфекцией. Обострению болевого приступа обычно сопутствуют повышение температуры тела, тошнота, рвота, отрыжка, понос или чередование поносов и запоров, вздутие живота, чувство горечи во рту.
Рвота — необязательный симптом хронического бескаменного холецистита и наряду с другими диспепсическими расстройствами (тошнота, отрыжка горечью или постоянный горький вкус во рту) может быть связана не только с основным заболеванием, но и с сопутствующей патологией — гастритом, панкреатитом, перидуоденитом, гепатитом. Часто в рвотных массах обнаруживают примесь желчи, при этом они окрашиваются в зеленый или желто-зеленый цвет.
Наблюдаются вялость, раздражительность, нарушение сна. Преходящая желтушная окраска склер и кожных покровов может наблюдаться в связи с затруднением оттока желчи из-за скопления слизи, эпителия или паразитов (в частности, лямблий) в холедохе.
При пальпации живота у больных хроническим холециститом определяются следующие симптомы.
Симптом Кера — в области проекции желчного пузыря, расположенной у места пересечения наружного края правой прямой мышцы живота с краем ложных ребер, появляется болезненность при глубокой пальпации во время вдоха.
Симптом Грекова–Ортнера–Рашбы — болезненность при поколачивании ребром кисти по правой реберной дуге.
Симптом Мерфи — осторожное, мягкое введение руки в зону желчного пузыря, и при глубоком вдохе пальпирующая рука вызывает резкую болезненность.
Симптом Мюсси — болезненность при надавливании на диафрагмальный нерв между ножками грудинно-ключично-сосцевидной мышцы справа.
Инструментальные и клинико-биохимические исследования
При хроническом холецистите в фазе обострения повышается СОЭ, возрастает количество лейкоцитов со сдвигом формулы влево, эозинофилия.
К рентгенологическим методам исследования относят холеграфию, которую проводят после перорального или внутривенного введения контрастного вещества. На снимках выявляются симптомы поражения желчного пузыря: удлинение, извитость, неравномерность заполнения (фрагментированность) пузырного протока, его перегибы.
В последние годы стали использовать комплексную методику, в которую, кроме холеграфии, включают холецистохолангиографию, ультразвуковое и радионуклидное сканирование, компьютерную томографию, лапароскопию. В ряде случаев по особым показаниям проводят лапароскопическую холецистографию. Применение этого метода позволяет просмотреть различные отделы желчного пузыря, отметить степень его наполнения, наличие спаек и сращений, деформаций, состояние стенки.
К неинвазивным методам исследования желчевыводящих путей относят ультразвуковое исследование (УЗИ).
УЗИ не имеет противопоказаний и может применяться в тех случаях, когда рентгенологическое исследование не может быть проведено: в острую фазу заболевания, при повышенной чувствительности к контрастным веществам, беременности, печеночной недостаточности, обструкции магистральных желчных путей или пузырного протока. УЗИ позволяет не только установить отсутствие конкрементов, но и оценить сократительную способность и состояние стенки желчного пузыря (утолщение, склерозирование).
Лечение
Режим
В период выраженного обострения больных нужно госпитализировать. При сильном болевом синдроме, особенно возникшем впервые или осложнившемся механической желтухой, угрозе развития деструктивного холецистита больных следует направлять в хирургическое отделение. При легком течении заболевания лечение проводят амбулаторно.
В период обострения больному рекомендуется постельный режим в течение 7–10 дней. Очень важно состояние психоэмоционального комфорта, особенно при гипертонической дискинезии желчевыводящих путей. При гипокинетической дискинезии постельный режим не рекомендуется.
Питание
В фазе обострения в первые 1–2 дня назначается питье теплой жидкости (некрепкий сладкий чай, соки из фруктов и ягод, разведенные водой, отвар шиповника, минеральная вода без газа) небольшими порциями до 6 стаканов в день, несколько сухариков. По мере улучшения состояния назначается в ограниченном количестве протертая пища: слизистые супы (овсяный, рисовый, манный), каши (манная, овсяная, рисовая), кисели, желе, муссы. Далее включается нежирный творог, нежирная отварная рыба, протертое мясо, белые сухари. Пища принимается 5–6 раз в день.
Многие специалисты рекомендуют в периоде обострения хронического холецистита 1–2 разгрузочных дня. Например:
После купирования обострения назначается диета № 5. Она содержит нормальное количество белков (90–100 г); жиров (80–100 г), около 50% жиров составляют растительные масла; углеводов (400 г), энергетическая ценность 2500–2900 ккал.
Питание дробное (небольшими порциями) и частое (5–6 раз в сутки), что способствует лучшему оттоку желчи.
При хронических холециститах полезны растительные жиры, масла. Они богаты полиненасыщенными жирными кислотами, фосфолипидами, витамином Е. Полиненасыщенные жирные кислоты (ПНЖК) (арахидоновая, линолевая) входят в состав клеточных мембран, способствуют нормализации обмена холестерина, участвуют в синтезе простагландинов, которые разжижают желчь, повышают сократительную способность желчного пузыря. Растительные жиры особенно важны при застое желчи.
Установлено антилитогенное свойство диеты, богатой растительной клетчаткой (яблоки, морковь, арбуз, дыня, помидоры). Целесообразно добавлять к пище пшеничные отруби — до 30 г в сутки. Их обдают кипятком, запаривают; затем жидкость сливают, разбухшие отруби добавляют в блюда по 1–2 столовых ложки 3 раза в день. Курс лечения — 4–6 недель. Овощи, фрукты, отруби способствуют отхождению желчи, уменьшают содержание в ней холестерина, снижают вероятность образования камней.
При гипертонусе желчного пузыря для уменьшения тонуса гладкой мускулатуры назначается диета, богатая магнием (пшеничная и гречневая каши, пшеничные отруби, пшено, хлеб, овощи).
Больным хроническим холециститом не рекомендуются продукты, оказывающие раздражающее действие на печень: мясные бульоны, животные жиры (кроме сливочного масла), яичные желтки, острые приправы (уксус, перец, горчица, хрен), жареные и тушеные блюда, изделия из сдобного теста. Запрещаются алкогольные напитки и пиво.
Купирование болевого синдрома в периоде обострения
При интенсивных болях в правом подреберье, тошноте и повторной рвоте назначают периферические М-холинолитики: 1 мл 0,1% раствора Атропина сульфата или 1 мл 0,2% раствора Платифиллина п/к. Они оказывают и противорвотное действие, уменьшают секрецию поджелудочной железы, кислото- и ферментообразование в желудке.
После купирования интенсивных болей препараты могут быть назначены внутрь: Метацин в дозе 0,004–0,006 г, Платифиллин — по 0,005 г на прием. При наличии противопоказаний можно рекомендовать селективный М-холинолитик Гастроцепин внутрь по 50 мг 2–3 раза в день.
Для купирования боли применяются также миотропные спазмолитики: 2 мл 2% раствора Папаверина гидрохлорида, 2 мл 2% раствора Но-шпы п/к или в/м 2–3 раза в день, 2 мл 0,25% раствора Феникаберана в/м. В начале приступа желчной колики боль может купироваться приемом 0,005 г Нитроглицерина под язык.
При упорных болях используют ненаркотические анальгетики: Анальгин 2 мл 50% раствора в/м или в/в в сочетании с Папаверином гидрохлоридом, Но-шпой и Димедролом; Баралгин 5 мл внутримышечно, Кеторол, Трамал, Триган-Д, Диклофенак. При некупирующихся болях приходится применять наркотические анальгетики: 1 мл 1% раствора Промедола в/м. Не следует применять морфин, т. к. он вызывает спазм сфинктера Одди, препятствует оттоку желчи, провоцирует рвоту. К наркотикам можно добавить 2 мл 0,25% раствора дроперидола в 200–300 мл 5% раствора глюкозы внутривенно капельно, паранефральные новокаиновые блокады.
При наличии у больного гипотонической дискинезии (монотонные тупые, ноющие боли, ощущение тяжести в правом подреберье) холинолитики и спазмолитики не показаны.
В этих случаях можно рекомендовать холекинетики (повышают тонус желчного пузыря, способствуют его опорожнению, уменьшают боль в правом подреберье): растительное масло по 1 столовой ложке 3 раза в день перед едой, ксилит или сорбит по 15–20 г на 1/2 стакана теплой воды 2–3 раза в день, 25% раствор магния сульфата по 1 столовой ложке 2–3 раза в день перед едой.
С этой же целью применяется синтетический гормональный препарат — холецистокинин октапептид (интраназально по 50–100 мкг), он дает и обезболивающий эффект.
При выраженном болевом синдроме у больного с гипотонической дискинезией целесообразно использовать ненаркотические анальгетики, а в дальнейшем — холекинетики.
Регулирующим влиянием на тонус желчевыводящих путей и противорвотным действием обладают метоклопрамид (Церукал) и домперидон (Мотилиум), который можно применять внутрь или в/м по 10 мг 2–3 раза в день.
Антибактериальная терапия (АБТ) в период обострения
АБТ назначается тогда, когда есть основания предполагать бактериальную природу заболевания (лихорадка, лейкоцитоз и др.).
стерилизует желчь и содержимое кишечника (откуда инфекция нередко поступает в желчный пузырь и вызывает воспаление);
Антибактериальные препараты, проникающие в желчь в очень высоких концентрациях
По данным Я. С. Циммермана, наибольшей концентрации в желчи достигают ампициллин и рифампицин. Это антибиотики широкого спектра действия, они оказывают влияние на большинство возбудителей холецистита.
Ампициллин — относится к полусинтетическим пенициллинам, подавляет активность ряда грамотрицательных (кишечная палочка, энтерококки, протей) и грамположительных бактерий (стафилококки и стрептококки). Хорошо проникает в желчные пути даже при холестазе, назначается внутрь по 0,5 г 4 раза в день или в/м по 0,5–1,0 г каждые 6 ч.
Оксациллин — полусинтетический пенициллин, оказывает бактерицидное действие преимущественно на грамположительную флору (стафилококк, стрептококк), но неэффективен в отношении большинства грамотрицательных бактерий. В отличие от пенициллина действует на пенициллиназообразующие стафилококки. Хорошо накапливается в желчи и назначается внутрь по 0,5 г 4–6 раз в день до еды или по 0,5 г 4–6 раз в день внутримышечно.
Оксамп (ампициллин + оксациллин) — препарат бактерицидного действия широкого спектра, подавляет активность пенициллиназообразующих стафилококков. Создает в желчи высокую концентрацию. Назначается по 0,5 г 4 раза в день внутрь или в/м.
Рифампицин — полусинтетический бактерицидный антибиотик широкого спектра действия. Рифампицин не разрушается пенициллиназой, но в отличие от ампициллина не проникает в желчные пути при застойных явлениях в них. Препарат принимается внутрь по 0,15 3 раза в день.
Эритромицин — антибиотик из группы макролидов, активен в отношении грамположительных бактерий, слабо влияет на грамотрицательные микроорганизмы, создает высокие концентрации в желчи. Назначается по 0,25 г 4 раза в день.
Линкомицин — бактериостатический препарат, влияющий на грамположительную флору, в том числе на пенициллиназообразующие стафилококки, и неактивный в отношении грамотрицательных микроорганизмов. Назначается внутрь по 0,5 г 3 раза в день за 1–2 ч до еды или внутримышечно по 2 мл 30% раствора 2–3 раза в день.
Препараты, проникающие в желчь в достаточно высоких концентрациях
Пенициллин (бензилпенициллин-натрий) — бактерицидный препарат, активный в отношении грамположительной флоры и некоторых грамотрицательных кокков, на большинство грамотрицательных микроорганизмов не действует. Не активен в отношении пенициллиназообразующих стафилококков. Назначается в/м по 500 000–1 000 000 ЕД 4 раза в сутки.
Феноксиметилпенициллин — назначается внутрь по 0,25 г 6 раз в сутки до еды.
Тетрациклины — обладают бактериостатическим действием как на грамположительную, так и на грамотрицательную флору. Назначаются внутрь по 0,25 г 4 раза в день.
Высокоэффективны полусинтетические производные тетрациклина. Метациклин принимают в капсулах по 0,3 г 2 раза в день. Доксициклин назначается внутрь в 1-й день по 0,1 г 2 раза в день, затем по 0,1 г 1 раз в день.
Антибиотики группы цефалоспоринов
Применяются цефалоспорины I поколения — цефалоридин (Цепорин), цефалотин (Кефлин), цефазолин (Кефзол); II поколения — цефалексин (Цепорекс), цефуроксим (Кетоцеф), цефамандол (Мандол); III поколения — цефотаксим (Клафоран), цефтриаксон (Лонгацеф), цефтазидим (Фортум).
Препараты I поколения угнетают большинство стафилококков, стрептококков, многие штаммы кишечной палочки, протея.
Цефалоспорины II поколения обладают более широким спектром действия на грамотрицательные бактерии, угнетают резистентные к препаратам I поколения кишечные палочки, различные энтеробактерии.
Еще более широким спектром действия обладают цефалоспорины III поколения, они подавляют, кроме перечисленных бактерий, сальмонеллы, шигеллы.
Кефзол — вводится в/м или в/в по 0,5–1 г каждые 8 ч. Цепорин — вводится в/м по 0,5–1 г каждые 8 ч. Клафоран — вводится в/м или в/в по 2 г 2 раза в день.
Препараты фторхинолонов
Обладают бактерицидными свойствами, препараты широкого спектра действия, достаточно хорошо проникающие в желчь. Назначаются при тяжелой инфекции желчевыводящих путей.
Абактал (пефлоксацин) — назначается внутрь по 0,4 г 2 раза в день во время еды или в/в капельно — 5 мл (0,4 г) в 250 мл 5% раствора глюкозы.
Таривид (офлоксацин) — назначается по 0,2 г 2 раза в день.
Ципролет (ципрофлоксацин) — назначается по 0,5 г 2 раза в день.
Производные нитрофурана
Подавляют как грамположительные, так и грамотрицательные микроорганизмы. Концентрация Фурадонина в желчи в 200 раз превосходит его содержание в сыворотке крови; Фурадонин подавляет также патогенную флору в желудочно-кишечном тракте, действует на лямблии. Фурадонин и Фуразолидон назначают по 0,1–0,15 г 3–4 раза в день после еды.
Хлорофиллипт
Это препарат, содержащий смесь хлорофиллов, находящихся в листьях эвкалипта, подавляет грамположительные и грамотрицательные микроорганизмы, в том числе и пенициллиназообразующие стафилококки. Назначается по 20–25 капель 1% спиртового раствора 3 раза в день.
При обострении хронического холецистита лечение антибактериальными средствами проводится в течение 7–10 дней.
Антибактериальные средства целесообразно сочетать с желчегонными препаратами, оказывающими бактерицидное и противовоспалительное действие (Циквалон по 0,1 г 3–4 раза в день перед едой; Никодин по 0,5 г 3–4 раза в день перед едой).
При обнаружении в желчи паразитов проводится антипаразитарная терапия. При наличии описторхоза, фасциолеза, клонорхоза наряду с эритромицином или Фуразолидоном назначают Хлоксил (по 2 г в виде порошка в 1/2 стакана молока через каждые 10 мин 3–5 раз в течение 2 дней подряд; проводят 2 курса с интервалами 4–6 месяцев).
При обнаружении стронгилоидоза, трихоцефалеза, анкилостомидоза проводится лечение Вермоксом — по 1 таблетке 2–3 раза в день в течение 3 дней, повторный курс назначается через 2–4 недели, применяется также Комбантрин по 0,25 г 1 раз в день в течение 3 дней.
При обнаружении лямблий в желчи проводится антилямблиозная терапия одним из следующих препаратов: Фуразолидон по 0,15 г 3–4 раза в день в течение 5–7 дней; Фазижин по 2 г на прием однократно; Трихопол (метронидазол) по 0,25 г 3 раза в день после еды в течение 5–7 дней; Макмирор по 0,4 г 2 раза в день в течение 7 дней.
Применение желчегонных средств
Классификация желчегонных средств (Н. П. Скакун, А. Я. Губергриц, 1972):
Препараты, стимулирующие желчеобразовательную функцию печени (т. е. стимулирующие образование печенью желчи) — истинные желчегонные (холеретики):

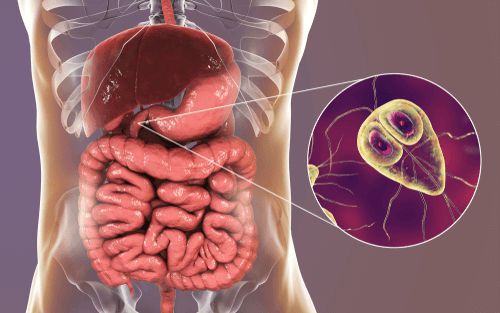
Опасное заболевание, спровоцированное гельминтозом – описторхоз, вызвано трематодами, относящимися к печеночным сосальщикам. Заражение собаки происходит при употреблении животным сырой рыбы, пораженной личинками сосальщика – метацеркариями.
Попадая в организм млекопитающего, не только собаки, но и кошки, человека, енота, медведя, метацеркарий, под действием желудочного сока и ферментативных веществ, вырабатываемых пищеварительным трактом, проникает в область поджелудочной железы, печени или протоков желчного пузыря. В подходящих для развития и роста тканях, трематода вырастает до взрослой особи, где может успешно существовать на протяжении 10-15 лет.
Гельминтоз проявляется различными клиническими признаками. Больное животное становится вялым, отмечается угнетенное состояние, снижается аппетит (в некоторых случаях напротив, аппетит становиться чрезмерным). Также отмечаются проблемы в работе пищеварительной системы, возникают запоры, сменяющиеся поносом.
При осмотре и пальпации, врач может отметить увеличение печени в объеме. Видимые слизистые оболочки, а в запущенных формах и кожные покровы, приобретают желтушный оттенок, что связано с патологическими изменениями в работе печени и желчного пузыря.
Пути заражения описторхозом у собаки

Печеночный сосальщик при проникновении внутрь, получает питание из тканей и сосудов печени. Соответственно, получая питание из сосудов, паразит выпускает в окружающие его ткани токсические вещества, продуцируемые в процессе жизнедеятельности. Это провоцирует изменение во всем состоянии организма животного.
Маленький по размерам паразит, становится причиной диагностируемых у домашних собак воспалений в области печени, дистрофических изменений гепатобилиарной системы, проблем в желчном пузыре и его ходах. Не редко на фоне описторхоза у собаки развиваются энтериты и желчнокаменная болезнь. Все это в результате при отсутствии лечения может стать причиной разрыва желчного пузыря, вплоть до гибели собаки. При первых признаках нарушений в здоровье любимца, рекомендуется незамедлительно обратиться за помощью в ветеринарную клинику.
Трематода, вызывающая описторхоз у домашних кошек и собак, при отсутствии на нее воздействия, способна существовать более 15 лет. Кошачья двуустка, второе название описторхоза, попадает в организм животного при употреблении сырой рыбы.
В зоне риска находятся питомцы, получающие в пищу не обработанную термическим способом речную рыбу. Особенно опасно поедание собаками карповых видов рыб.
От момента проникновения метацеркария в организм собаки до того периода, когда трематода станет взрослой особью проходит порядка полугода. В течение этого времени, паразит наносит серьезный вред тканям печеночных структур.
Что примечательно – даже после прохождения обязательного курса лечения, ткани печени и желчных ходов настолько поражены, что начинают выполнять свои функции с перебоями. Все это заканчивается регулярными воспалениями в печени, образованием фиброзных тканей и расширением желчных ходов. При попадании патогенной бактериальной микрофлоры, течение основного заболевания усугубляется.
Описторхоз у собак часто отягощается интоксикацией организма. На фоне постоянного выброса токсических веществ в кровяное русло, возникают аллергические реакции. Питомец подвержен постоянным заболеваниям, возникающим на фоне ослабления иммунной системы. Отсутствие лечения описторхоза может закончиться циррозов или злокачественными опухолями.
Симптомы описторхоза у собаки
Понять, что любимец заразился кошачьей двуусткой, на первых этапах развития не возможно. Пока не начались изменения в тканях печени, симптомов поражения не будет. В случае попадания нескольких метацеркариев в организм, симптомы развиваются значительно быстрее.
С развитием патологического процесса, отмечаются следующие изменения:
- постепенная, а порой и резкая утрата аппетита (в некоторых случаях, описторхоз вызывает усиление аппетита у собаки); и апатичность у питомца, истощение на фоне потери веса; видимых слизистых оболочек – желтушность;
- увеличение печени в размерах, что легко обозначается при пальпации области расположения органа; – сильная жажда;
- проблемы с пищеварением – констипации, сменяющиеся поносом;
- приступы тошноты и извержение желудочного содержимого (возникают при тяжелом течении патологии).
Аллергия развивается при описторхозе у домашнего питомца по причине интоксикации. Токсические вещества попадают в кровяное русло, вызывая ответную реакцию организма. Аллергическая реакция проявляется покраснениями на кожном покрове, изменением состояния шерсти. Шерстный покров любимца выглядит слипшимся и неухоженным, вплоть до образования участков облысения.
При хроническом протекании, симптомы развиваются слабо и постепенно. При этом осложнения в организме возникают не менее тяжелые, нежели при острой форме описторхоза у собаки. В результате постоянных нарушений на фоне активности трематоды, страдает печень животного. Природный фильтр организма страдает от дистрофических изменений, нередко развиваются гнойные формы перитонита. Поставить точный диагноз любимцу без предварительного осмотра и лабораторных исследований в условиях ветеринарной клиники – не возможно.
Квалифицированный ветеринарный врач обязательно проведет общеклинический осмотр, в основе которого будет пальпация печени. Описторхоз провоцирует уплотнение печени и изменение бугристой структуры.
С целью диагностики и постановки точного диагноза, специалист должен собрать детальный анамнез. Важна любая информация о стиле жизни, а особенно о питании любимца. Подтвердить подозрения на описторхоз можно путем лабораторной диагностики каловых масс животного. Для получения максимально точного результата, рекомендуется делать 2 исследования с перерывами между исследованиями в 7-10 дней.
Лечение описторхоза у собаки
На основании полученных данных, врач разрабатывает адекватную тактику лечения. Не достаточно будет только проведение дегельминтизации. Осложнения, возникшие в организме на фоне активности трематоды, требуют детального решения. Так, терапия должна включать в себя обязательную подготовку организма перед противопаразитарной обработкой и период реабилитации. Оказать поддержку организму очень важно, ведь от этого будет зависеть процесс восстановления пораженных тканей.
Препараты для поддержания работы печени – гепатопротекторы, очень важны для нормального функционирования организма. Важно введение витаминно-минеральных комплексов, иммуномодуляторы, а также желчегонных средств.
Если заболевание осложнено аллергическими проявлениями, собаке назначают антигистаминные средства. Дозировка лекарственных средств и длительность лечения, определяется квалифицированным специалистом исходя из индивидуальных характеристик пациента.
Полностью восстановить организм после длительного протекания заболевания, очень сложно, а порой не возможно. После противопаразитарной обработки, необходимо оказывать поддерживающую терапию и постоянно посещать ветеринара для отслеживания состояния любимца.
Важно уделить особое место правильному питанию при диагностированном описторхозе у собаки. Если собака получает натуральное питание, рекомендуется перевести ее на более сбалансированный сухой корм высокого качества. Это позволит не переживать за калорийность рациона.
С целью профилактики развития описторхоза у собаки, необходимо исключить из рациона употреблением животным сырой рыбы, которая предварительно не была отварена. При этом, важно понимать, что именно процесс варки позволяет уничтожить паразита, а вот замораживание не справится с этой задачей.
В рационе собаки не должно быть места для вяленой, плохо просоленной или сушеной рыбы. Не стоит забывать и о регулярных противопаразитарных обработках. Важно обучить своего питомца, чтобы он не подбирал мусор на улице.

В связи с большим потоком поступающих вопросов, бесплатные ветеринарные консультации временно приостановлены.
Что такое лямблиоз? Причины возникновения, диагностику и методы лечения разберем в статье доктора Александрова Павла Андреевича, инфекциониста со стажем в 14 лет.
Над статьей доктора Александрова Павла Андреевича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Лямблиоз — это острое и хроническое паразитарное заболевание человека в виде манифестных форм или носительства, вызываемое кишечными лямблиями, которые колонизируют слизистую оболочку преимущественно тонкого кишечника, нарушают процессы пристеночного пищеварения и способствуют развитию и усугублению поражения желудочно-кишечного тракта и других заболеваний.
Этиология
Возбудитель — лямблия. Данный род паразитов включает в себя шесть типов, но заболевание человека вызывает только один тип — кишечная лямблия (Giardia duodenalis, Giardia lamblia, Giardia intestinalis). Это жгутиковое микроскопическое простейшее, впервые описанное чешским медиком-анатомом Д.Ф. Лямблем в 1859 году. Оно имеет до восьми генетических подтипов, но для человека патогенны только А и В (также имеют подтипы).
Вид — Giardia lamblia
Возбудитель лямблиоза (кишечная лямблия) существует в виде двух жизненных форм:
- вегетативная (трофозоиты) — стадия активного размножения внутри организма;
- цистная — образуется при неблагоприятных условиях среды.
Трофозоиты — это анаэробные, грушевидные микроорганизмы размерами 9-18 мкм. Они обитают в верхних отделах тонкого кишечника. Подвижны (имеют характерное движение в виде вращения вокруг продольной оси — боковое движение), тело спереди расширено и закруглено, сзади сужено и заострено. Имеют в составе два ядра (между ними пролегают опорные нити — аксостили) и парные органоиды — четыре жгутика и два медиальных тела.
Трофозоиты не имеют цитостома — органа заглатывания пищи и пищеварительной вакуоли, поэтому они всасывают пищу, переваренную хозяином (в основном, углеводы), всей поверхностью тела. Это называется осмотическим питанием.
Как выглядят лямблии:
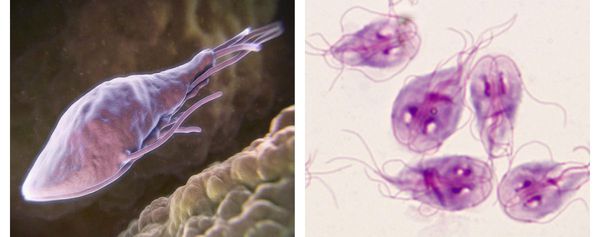
В передней их трети тела расположен присасывательный диск в виде специального углубления. С его помощью лямблии прикрепляются к ворсинкам слизистой оболочки тонкого кишечника. Цитоплазматическая мембрана задней поверхности имеет по краям булавовидные выросты, что также создаёт дополнительную прикрепляющую составляющую.
Размножаются путём продольного деления. Слабо устойчивы в условиях окружающей среды при покидании организма хозяина: при комнатной температуре даже в отсутствии агрессивных факторов быстро погибают.
Цистная форма неподвижна. Паразиты имеют овальную форму, лишены свободных жгутиков (сложно свёрнутые), их размеры достигают 10-14 мкм, окружены толстой, несколько отделённой от тела оболочкой (данная особенность имеет значение при распознавании вида).
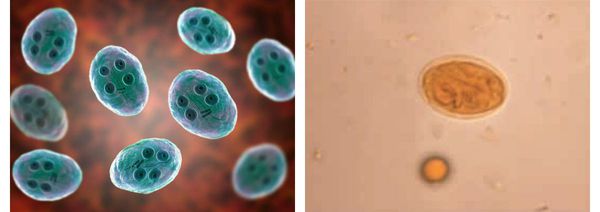
Зрелые цисты внутри имеют четыре ядра, незрелые — два ядра. Образуются в нижних отделах кишечника в процессе выхода из организма с фекалиями. Очень устойчивы во внешней среде: могут сохраняться месяцами в воде при температуре 4-20°C, при хорошей влажности способны сохраняться на контаминированных (обсеменённых) продуктах питания до недели. При кипячении цисты погибают мгновенно, а при высушивании и низкой влажности гибель наступает в течении суток. Устойчивы к бытовому хлорированию воды, действию щелочей и кислот, ультрафиолетовому излучению. Низкие температуры переносит относительно хорошо, но при этом снижая свою жизнеспособность. [1] [3] [6] [9]
Эпидемиология
Распространение заболевания повсеместное, преимущественно в странах с влажным тёплым климатом. Только официально выявляемые случаи в России приближаются к 150 тысячам в год.
Сезонность выражена неярко, некоторый всплеск заболеваемости отмечается в тёплое время года. Возрастной состав больных склоняется в сторону детей.
Источник заражения — люди (больные различными формами лямблиоза и паразитоносители), причём наибольшая заразность наблюдается в подостром периоде заболевания, когда в 1 г фекалий может содержаться до нескольких десятков миллионов цист. Лямблии животных (нечеловеческие типы паразитов) не имеют доказательной базы в плане распространения и заражения человека.
Факторами передачи паразитов выступает загрязнённая цистами термически не обработанная питьевая вода, пища, грязные руки (возможна прямая передача от человека к человеку). Определённую роль в передаче лямблий играют насекомые (тараканы, мухи) и животные (собаки, кошки) — они являются механическими переносчиками (паразиты располагаются на их теле, шерсти, лапках, транзитом в кишечнике).
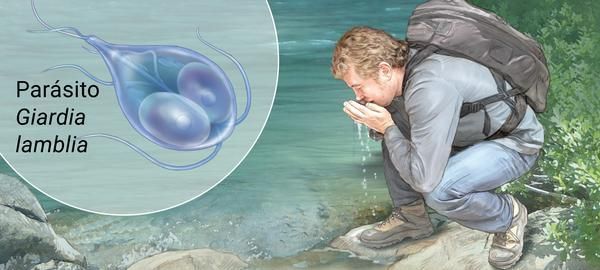
Механизм передачи — фекально-оральный (водный, пищевой и контактно-бытовой пути). Наиболее часто передача осуществляется:
- через водопроводную воду;
- при употреблении плохо промытых зелени и овощей (или промытых под водопроводной водой без последующей термической обработки);
- при нарушении правил санитарной гигиены, особенно в детских коллективах.
Доза заражения — от 10 до 100 цист (в зависимости от индивидуальных свойств иммунной реактивности кишечника). Возможны случаи невосприимчивости к паразитам: цисты лямблий, встречая агрессивно настроенную среду кишечника, проходят транзитом и выделяются в окружающую среду в неизменённом виде.
Иммунитет после лямблиоза нестойкий и ненапряжёный, возможно повторное заражение. Повышенный риск заболевания имеют лица с патологией иммунитета кишечника и дефицитом IgA. [2] [3] [5] [8] [10]
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы лямблиоза
Инкубационный период длится от нескольких дней до месяца и более. Чаще всего при заболевании не наблюдается вообще никаких клинических проявлений, особенно у взрослых.
К основным возможным симптомам лямблиоза относятся:
- Симптомы интоксикации и вегетативных изменений — повышенная утомляемость, плаксивость, раздражительность, нарушение ритма сна, головокружения, аритмии, субфебриллитет и другие.
- Симптомы поражения ЖКТ — дискомфорт и боли различной интенсивности и характера в различных отделах живота, тошнота, снижение аппетита, появление чувства горечи во рту, нарушения стула (запоры и поносы), налёт на языке и неприятный запах изо рта, снижение массы тела и другое.
- Симптомы поражения кожи — аллергические высыпания различного характера и локализации, атопический дерматит, бледность и шероховатость кожи, повышенная сухость покровов, хейлит (воспалительные изменения кожи губ и их слизистой), заеды (трещинки в уголках рта), нетипичное/неконтролируемое течение хронических патологий кожи.
- Усиление развития и обострения заболеваний, прямо не связанных с лямблиозом — бронхиальная астма, псевдоаллергические явления, гастриты, язвы желудка и двенадцатиперстной кишки, холецистит, неспецифический язвенный колит, артриты и другое.
- Симптомы мальабсорбции (потери питательных веществ) — авитаминозы, отставание в физическом и умственном развитии, дистрофия (эти проявления более характерны для детей).
Лямблиоз у детей
Как правило, у детей первыми симптомами лямблиоза становится появление субфебрильной или фебрильной температуры (37,1–38,0°C или 38,0–39,0°C), болей в животе, тошноты, иногда рвоты, метеоризма, жидкого стула. Живот при этом болезнен, вздут, урчит по ходу кишечника. Грудные дети становятся беспокойными, кричат, нарушается сон, симптомы лямблиоза усиливаются во время и после кормления, возможно появление аллергодерматозов и опрелостей. В динамике при отсутствии лечения это может приводить к нарушению роста и психоэмоционального развития, частым простудным или аллергическим заболеваниям, развитию хронических проблем органов ЖКТ.
У детей более позднего возраста и взрослых яркие симптомы лямблиоза наблюдаются редко — на первый план выходит постепенное развитие диспепсических явлений со стороны ЖКТ умеренного характера:
- метеоризм;
- дискомфорт и боли в животе преимущественно в околопупочной области и правом подреберье;
- нарушения стула в различных сочетаниях;
- появление налёта на языке;
- иногда горечь во рту и кожные проявления (усиление выраженности угревой сыпи, хронических полиэтиологических заболеваний, например, псориаза и дерматитов);
- возможны вегетативные расстройства, головные боли, головокружения, неустойчивость артериального давления, повышения температуры тела, чувствительность лимфоузлов.
Лямблиоз у беременных
Лямблиоз у беременных не имеет каких-либо специфичных отличий от лямблиоза у остальных людей, но может приводить к повышению риска развития у беременной В-12 дефицитной анемии и снижению веса плода (гипотрофии). [1] [3] [5] [7] [10]
Патогенез лямблиоза
Характерен так называемый "симптом манной крупы" — белёсые полусферические выбухания слизистой оболочки двенадцатиперстной кишки, представляющие собой зоны очагового отёка со скоплением увеличенного количества лейкоцитов.
Посредством механического раздражения и выделения паразитами продуктов жизнедеятельности (токсическое влияние) происходит стимуляция образования слизи, повышение регенераторной функции кишечника, нарушение выработки факторов нейрогуморальной регуляции пищеварения (холецистоцикин и других) и двигательной активности гепатогастродуоденальной области. Это ведёт к дезорганизации висцеро-висцеральных связей области двенадцатиперстной кишки, поджелудочной железы и желчевыводящей системы, а также к нарушению функционирования органов ЖКТ, нарушению микробиоценоза кишечника, активизации анаэробной флоры, расстройствам расщепления и всасывания белков, жиров, углеводов, витаминов и микроэлементов.
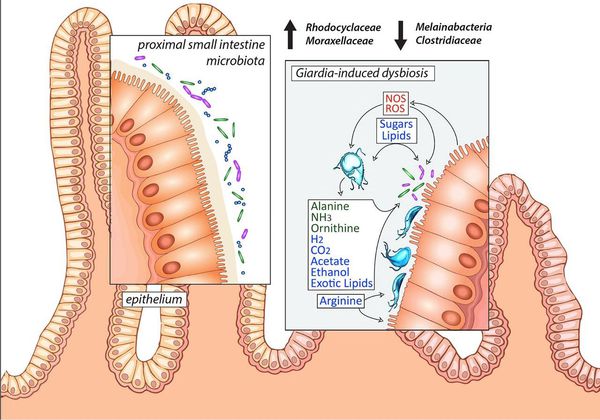
Возникает воспаление слизистой кишечника по типу реакций гиперчувствительности замедленного типа, происходит воздействие на иммунорегуляторные белки (мимикрия), снижение выработки иммуноглобулинов (в частности IgA) из-за нарушения всасывания белков и снижение фагоцитарной активности. Всё это в совокупности со всасываемыми продуктами жизнедеятельности лямблий становится причиной истощения иммунной системы (как кишечника, так и общего иммунитета), развития хронического поражения кишечника, провоцирует длительное обострение имеющихся хронических заболеваний и усугубление ряда аллергозависимых дерматозов. [1] [4] [7] [8]
Классификация и стадии развития лямблиоза
По клинической форме лямблиоз бывает:
- бессимптомным (носительство);
- кишечным — преимущественно симптомы кишечной формы, но можгут быть и гастритические проявления (дискомфорт в животе, неустойчивый стул, тошнота);
- билиарно-панкреатическим (рефлекторный) — дискомфорт в эпигастрии и правом подреберье, привкус горечи во рту, повышенная частота развития плохо контролируемых гастродуоденитов и панкреатитов;
- астено-невротическим — слабость, вялость, повышенная утомляемость, раздражительность, эмоциональная неустойчивость;
- токсико-аллергическим — периодические высыпания на теле, обострение хронических кожных заболеваний и бронхиальной астмы, эозинофилия;
- смешанным.
Течение лямблиоза бывает трёх типов:
- острым — до одного месяца;
- подострым — 1-3 месяца;
- хроническим — более трёх месяцев.
По наличию осложнений лямблиоз бывает:
Выделяют три степени заболевания:
Осложнения лямблиоза
Возможны специфические и неспецифические осложнения лямблиоза.
К специфическим относятся:
-
— зудящие обширные высыпания на теле;
- отёк Квинке — выраженный отёк подкожной клетчатки, иногда сопровождающийся зудоим и чувством удушья;
- офтальмопатия — нарушения восприятия органом зрения;
- артрит — дискомфорт и боли в суставах;
- гипокалиемическая миопатия — слабость определённых групп мышц.
К неспецифическим осложнениям относятся:
- наслоение интеркуррентных заболеваний (вторичная флора);
- белково энергетическая недостаточность (гипо- и авитаминоз, снижение веса, анемия и другие). [1][2][8][10]
Диагностика лямблиоза
Лабораторная диагностика лямблиоза включает в себя:
- Клинический анализ крови — в остром периоде наблюдается эозинофилия, базофилия и повышение СОЭ; в последующие периоды — умеренная эозинофилия или нормальное значение эозинофилов, иногда незначительная базофилия.
- Биохимический анализ крови — иногда отмечается повышение уровня общего билирубина и амилазы.
- Копроовоскопическое исследование кала — "золотой стандарт" диагностики. Оно позволяет выявить цисты (наиболее часто) и вегетативные формы лямблий (в редких случаях). В виду прерывистого цистообразования показано неоднократное исследование с некоторым интервалом (семь дней). Существует широко распространённое заблуждение о том, что кал нужно сдавать "тёплым" (свежим). На самом деле, в этом нет никакой необходимости. Так как данное исследование предполагает обнаружение цист лямблий, которые очень устойчивы во внешней среде, период от дефекации до исследования никоим образом не влияет на информативность результата анализа.
- Иммунохроматографический метод и ПЦР-диагностика кала (выявление антигенов и нуклеиновых кислот паразита) — имеет хорошую информативность и вполне может применяться в комплексе с другими методами исследований.
- ИФА-диагностика — малоинформативное исследование, так как локализация лямблий в просвете кишечника не создаёт условий для полноценного иммунного ответа, который наблюдается в основном у детей при остром заболевании, что создаёт значительное число ошибочных результатов как гипо-, так и гирпедиагностики.
- Дуоденальное зондирование (выявление вегетативных форм лямблий в двенадцатиперстной кишке) — может применяться в сложных диагностических случаях и при подозрении на коинвазирование (например, описторхами при описторхозе).
- УЗИ органов брюшной полости и ФГДС — позволяют выявить признаки нарушения моторики гепатобилиарной области. [2][3][5][6][9]
Дифференциальная диагностика предполагает исключение следующих заболеваний:
- паразитарные заболевания другой этиологии (как кишечной, так и внекишечной локализации);
- хронический гастродуоденит (симптомосходная симптоматика);
- кишечные инфекции (сальмонеллёз, дизентерия, ротавирус и другие);
- дисбиоз кишечника (сборное понятие, характеризующееся неустойчивостью стула, дискомфортом в животе различного характера, снижением веса и другими симптомами). [1][5][9]
Лечение лямблиоза
Лечение острой формы лямблиоза, которая возникает в основном у детей, должно осуществляться в стационаре и включать в первую очередь дезинтоксикационную и дегидратационную терапию, а также щадящее питание.
Медикаментозная терапия
При подтверждении диагноза проводится этиотропное лечение одним из противолямблиозных препаратов (нитрогруппа) в сочетании с желчегонными средствами, и лекарствами, улучшающими микрофлору кишечника.
При длительном хроническом течении в виду персистирующей колонизации лямблиями слизистой оболочки тонкого кишечника и местным иммунодефицитом курс лечения должен быть комплексным, включающим:
- диета (потреблять меньше углеводов);
- средства этиотропного воздействия (химиопрепарат);
- приём желчегонных препаратов;
- иммунотерапию (усиление фагоцитоза и восполнение дефицита IgA);
- устранение дисбиоза кишечника (пробиотики).
К сожалению, в последнее время всё чаще встречаются штаммы лямблий, устойчивых к различным видам противопаразитарной терапии, поэтому средняя вероятность успешной эрадикационного лечения не превышает 85%.
Гигиена при лечении лямблиоза
Лямблиоз редко передаётся между членами семьи, если соблюдать простейшие гигиенические правила: мыть руки после посещения уборной, перед едой и после контакта с животными.
Лечение народными средствами
Эффективность и безопасность методов народной медицины научно не доказана. Без адекватного лечения лямблиоз может привести к различным осложнениям: крапивнице, отёку Квинке, нарушениям зрения, артриту и слабости мышц.
Лечение лямблиоза у детей
Новорождённых от лямблиоза, как правило, не лечат, так как нет подходящих препаратов. В основном рекомендуется улучшать микрофлору и работу кишечника.
Детей старшего возраста лечат так же, как и взрослых, но подбирают необходимую дозировку и форму препарата.
Лечение лямблиоза у беременных
Беременным лечение, как правило, противопоказано (потенциальный вред препаратов превышает пользу от лечения), в основном предпочтение отдаётся улучшению флоры и работы кишечника.
Контроль излеченности
После курса лечения проводится паразитологический контроль методом копроовоскопии или ПЦР не ранее двух недель после завершения курса лечения длительностью в три месяца со сдачей анализа раз в месяц. [1] [3] [4] [5]
Прогноз. Профилактика
При назначении адекватного лечения прогноз благоприятен, осложнения редки.
Специфической профилактики не разработано. Основной упор следует делать на меры соблюдения санитарных норм:
Токсокароз — паразитарное заболевание, вызываемое миграцией личинок аскарид животных семейства псовых (T. canis ). Характеризуется длительным рецидивирующим течением и полиорганными поражениями иммунологической природы. Возбудителями токсокароза могут бы
Токсокароз — паразитарное заболевание, вызываемое миграцией личинок аскарид животных семейства псовых (T. canis ). Характеризуется длительным рецидивирующим течением и полиорганными поражениями иммунологической природы. Возбудителями токсокароза могут быть также личинки других аскарид — кошки (T. mystax), коровы, буйвола, (T. vitulorum). Однако роль этих возбудителей в патологии человека практически не изучена
Половозрелые формы T. canis — крупные раздельнополые черви длиной 4 — 18 см локализуются в желудке и тонком кишечнике животных (собак). Интенсивность инвазии у собак может быть очень высокой, особенно у молодых животных. Средняя продолжительность жизни половозрелых особей составляет 4 месяца, максимальная — 6 месяцев. Самка паразита за сутки откладывает более 200 тыс. яиц. В 1 г фекалий может содержаться 10 000—15 000 яиц, так что в почву попадают миллионы яиц, обусловливая тем самым высокий риск заражения токсокарозом.
 |
Яйца токсокар округлой формы, крупнее яиц аскариды (65—75 мкм). Наружная оболочка яйца толстая, плотная, мелкобугристая. Внутри яйца располагается темный бластомер.
Цикл развития возбудителя следующий. Выделившиеся яйца токсокар попадают в почву, где, в зависимости от влажности и температуры почвы, созревают за 5—36 суток, становясь инвазионными. Инвазионность яиц сохраняется в почве длительное время, в компосте — несколько лет.
Жизненный цикл токсокары сложный. Выделяют основной цикл и два варианта вспомогательных. Основной цикл происходит по схеме: окончательный хозяин (псовые) — почва — окончательный хозяин (псовые). Передача инвазии осуществляется геооральным путем. Вспомогательный цикл (вариант 1) идет трансплацентарно, в этом случае паразит в личиночной стадии переходит от беременной самки к плоду, в организме которого совершает полную миграцию, достигая в кишечнике щенка половозрелой стадии. Инвазированный щенок становится функционально полноценным окончательным хозяином, источником инвазии.
Вспомогательный цикл (вариант 2) осуществляется по цепи: окончательный хозяин (псовые) — почва — паратенический хозяин. Паратеническим (резервуарным) хозяином могут быть грызуны, свиньи, овцы, птицы, земляные черви. Человек также выступает в роли паратенического хозяина, но не включается в цикл передачи инвазии, являясь для паразита биологическим тупиком. Дальнейшее развитие возбудителя происходит при условии, что паратенический хозяин будет съеден собакой или другим окончательным хозяином. Механизм передачи инвазии при этом варианте — геооральный — ксенотрофный.
В зависимости от возраста хозяина реализуются разные пути миграции личинок токсокар. У молодых животных (щенков до 5 недель) почти все личинки совершают полную миграцию с достижением половозрелых форм в кишечнике и выделением яиц во внешнюю среду. В организме взрослых животных большая часть личинок мигрирует в соматические ткани, где сохраняет жизнеспособность несколько лет. В период беременности и лактации у беременных сук возобновляется миграция личинок. Мигрирующие личинки через плаценту попадают в организм плода. Личинки остаются в печени пренатально инвазированных щенков до рождения, а после рождения личинки из печени мигрируют в легкие, трахею, глотку, пищевод и попадают в желудочно-кишечный тракт, где через 3—4 недели достигают половозрелой стадии и начинают выделять во внешнюю среду яйца. Кормящие суки могут передавать щенкам инвазию также через молоко.
У человека цикл развития возбудителя, его миграция осуществляется следующим образом. Из яиц токсокар, попавших в рот, затем в желудок и тонкий кишечник выходят личинки, которые через слизистую оболочку проникают в кровеносные сосуды и через систему воротной вены мигрируют в печень, где часть из них оседает, инцистируется или окружается воспалительными инфильтратами, образуя гранулемы. Часть личинок по системе печеночных вен проходит фильтр печени, попадает в правое сердце и через легочную артерию — в капиллярную сеть легких. В легких часть личинок также задерживается, а часть, пройдя фильтр легких, по большому кругу кровообращения заносится в различные органы, оседая в них. Личинки токсокар могут локализоваться в различных органах и тканях — почках, мышцах, щитовидной железе, головном мозге и др. В тканях личинки сохраняют жизнеспособность многие годы и периодически, под влиянием различных факторов, возобновляют миграцию, обусловливая рецидивы заболевания.
- Географическое распространение и эпидемиология
Токсокароз — широко распространенная инвазия, она регистрируется во многих странах. Показатели пораженности плотоядных являются высокими во всех странах мира. Средняя пораженность собак кишечным токсокарозом, обследованных на различных континентах, составляет свыше 15%, но в некоторых регионах у части животных достигает 93%. По данным сероэпидемиологических исследований, от 2 до 14% обследованных практически здоровых лиц в различных очагах токсокароза имеют положительные иммунологические реакции на токсокароз. Распространенность инвазии в различных регионах точно неизвестна, поскольку токсокароз не подлежит обязательной регистрации. Совершенно очевидно, что токсокароз имеет широкую геграфию распространения, и число больных значительно выше официально регистрируемых.
| Токсокароз широко распространен и регистрируется во многих странах. Средняя пораженность кишечным токсокарозом собак, обследованных на различных континентах, составляет свыше 15%, но в некоторых регионах достигает 93%. По данным сероэпидемиологических исследований, от 2 до 14% обследованных практически здоровых лиц в различных очагах токсокароза имеют положительные иммунологические реакции на токсокароз |
- Патогенез и патологическая анатомия
Патогенез токсокароза сложный и определяется комплексом механизмов в системе паразит — хозяин. В период миграции личинки травмируют кровеносные сосуды и ткани, вызывая геморрагии, некроз, воспалительные изменения. Ведущая роль принадлежит иммунологическим реакциям организма в ответ на инвазию. Экскреторно-секреторные антигены личинок оказывают сенсибилизирующее действие с развитием реакций немедленного и замедленного типов. При разрушении личинок в организм человека попадают соматические антигены личинок. Аллергические реакции проявляются отеками, кожной эритемой, увеличением резистентности дыхательных путей к вдыхаемому воздуху, что клинически выражается развитием приступов удушья. В аллергических реакциях принимают участие тучные клетки, базофилы, нейтрофилы, но основную роль играют эозинофилы. Пролиферация эозинофилов регулируется Т-лимфоцитами при участии медиаторов воспалительных реакций, выделяемых сенсибилизированными лимфоцитами, нейтрофилами, базофилами. Образующиеся иммунные комплексы привлекают в очаг поражения эозинофилы. Вокруг личинок токсокар кумулируются сенсибилизированные Т-лимфоциты, привлекаются макрофаги и другие клетки — формируется паразитарная гранулома.
Патоморфологическим субстратом токсокароза является выраженное в различной степени гранулематозное поражение тканей. При интенсивной инвазии развиваются тяжелые гранулематозные поражения многих органов и систем, которые при повторных заражениях могут стать хроническими. При токсокарозе находят многочисленные гранулемы в печени, легких, поджелудочной железе, миокарде, лимфатических узлах, головном мозге и других органах.
Наиболее характерным лабораторным показателем является повышенное содержание эозинофилов в периферической крови. Относительный уровень эозинофилии может колебаться в широких пределах, достигая в ряде случаев 70 — 80% и более. Повышается содержание лейкоцитов (от 20х109 до 30х109 на 1 л). При исследовании пунктата костного мозга выявляется гиперплазия зрелых эозинофилов. У детей нередко отмечается умеренная анемия. Некоторые исследователи отмечают прямую корреляцию между тяжестью клинических проявлений инвазии и уровнем эозинофилии и гиперлейкоцитоза периферической крови. Характерным лабораторным признаком является также ускорение СОЭ, гипергаммаглобулинемия. В случаях поражения печени наблюдается повышение билирубина, гиперферментемия.
В хронической стадии болезни острые клинические и лабораторные признаки затухают. Наиболее стабильным лабораторным показателем остается гиперэозинофилия периферической крови.
Выделяют субклиническое, легкое, среднетяжелое и тяжелое течение токсокароза. Возможна так называемая бессимптомная эозинофилия крови, когда явные клинические проявления инвазии отсутствуют, но наряду с гиперэозинофилией выявляются антитела к антигенам T.canis.
Одной из наиболее серьезных проблем, связанных с токсокарозом, является его взаимосвязь с бронхиальной астмой. При сероэпидемиологических исследованиях установлено, что у больных бронхиальной астмой нередко обнаруживаются антитела к антигенам T.canis классов Ig G и Ig E. В зависимости от остроты паразитарного процесса, его длительности и длительности клинических проявлений бронхиальной астмы преобладает тот или другой класс иммуноглобулинов. Имеются клинические наблюдения, свидетельствующие об улучшении течения бронхиальной астмы или выздоровлении после ликвидации токсокарозной инвазии.
Паразитологический диагноз устанавливается редко и только по наличию в тканях характерных гранулем и личинок и их идентификации при исследовании биопсийного и секционного материала. Это возможно при пункционной биопсии печени, легких, оперативном вмешательстве. Обычно диагноз токсокароза устанавливается на основании данных эпидемиологического анамнеза, клинической симптоматики и гематологических проявлений. Используют также иммунологические реакции, позволяющие выявлять антитела к антигенам токсокар. Обычно применяют ИФА с секреторно-экскреторным антигеном личинок токсокар второго возраста. В настоящее время в России выпускается коммерческий диагностикум. Диагностическим титром считают титр антител 1:400 и выше (в ИФА). Титр антител 1:400 свидетельствует об инвазированности, но не болезни. Титр антител 1:800 и выше свидетельствует о заболевании токсокарозом. Практика показывает, что прямая корреляция между уровнем антител и тяжестью клинических проявлений токсокароза существует не всегда. Не всегда имеется и корреляция между уровнем антител и гиперэозинофилии крови.
При постановке диагноза и определении показаний к специфической терапии следует учитывать, что токсокароз протекает циклически с рецидивами и ремиссиями, в связи с чем возможны значительные колебания клинических, гематологических и иммунологических показателей у одного и того же больного.
М. И. Алексеева и соавт. (1984) разработали алгоритм диагностики токсокароза, основанный на оценках в баллах значимости клинических симптомов и сопоставлении клинико-эпидемиологических и лабораторных показателей. Этот метод может быть перспективен при проведении массовых обследований населения.
Дифференциальный диагноз проводят с миграционной стадией других гельминтозов (аскаридоз, описторхоз), стронгилоидозом, эозинофильной гранулемой, лимфогранулематозом, эозинофильным васкулитом, метастазирующей аденомой поджелудочной железы, гипернефромой и другими заболеваниями, сопровождающимися повышенным содержанием эозинофилов в периферической крови. Следует иметь в виду, что у больных с системными лимфопролиферативными заболеваниями и серьезными нарушениями в системе иммунитета иммунологические реакции могут быть ложно положительными. В этих случаях необходим тщательный анализ клинической картины заболевания.
| При интенсивной инвазии развиваются тяжелые гранулематозные поражения многих органов и систем, которые при повторных заражениях могут стать хроническими |
Глазной токсокароз. Патогенез этой формы токсокароза до конца не ясен. Существует гипотеза об избирательном поражении глаз у лиц с инвазией низкой интенсивности, при которой не развивается достаточно выраженная иммунная реакция организма из-за слабого антигенного воздействия небольшого числа поступивших в организм личинок токсокар.
Эта форма токсокароза чаще наблюдается у детей и подростков, хотя описаны случаи заболевания и у взрослых.
Для токсокароза характерно одностороннее поражение глаз. Патологический процесс развивается в сетчатке, поражается хрусталик, иногда параорбитальная клетчатка. В тканях глаза формируется воспалительная реакция гранулематозного характера. Патологический процесс часто принимают за ретинобластому, проводят энуклеацию глаза. При морфологическом исследовании обнаруживают эозинофильные гранулемы, иногда — личинки токсокар.
Клинически поражение глаз протекает как хронический эндофтальмит, хориоретинит, иридоциклит, кератит, папиллит. Глазной токсокароз — одна из частых причин потери зрения.
Диагностика глазного токсокароза сложна. Количество эозинофилов обычно нормальное или незначительно повышено. Специфические антитела не выявляются или выявляются в низких титрах.
Разработано недостаточно. Применяют противонематодозные препараты — тиабендазол (минтезол), мебендазол (вермокс), медамин, диэтилкарбамазин. Эти препараты эффективны в отношении мигрирующих личинок и недостаточно эффективны в отношении тканевых форм, находящихся в гранулемах внутренних органов.
Минтезол (тиабендазол) назначают в дозах 25—50 мг/кг массы тела в сутки в три приема в течение 5—10 дней. Побочные явления возникают часто и проявляются тошнотой, головной болью, болями в животе, чувством отвращения к препарату (в настоящее время препарат в аптечную сеть России не поступает).
Вермокс (мебендазол) назначают по 200 —300 мг в сутки в течение 1—4 недель. Побочные реакции обычно не наблюдаются.
 |
Медамин применяют в дозе 10 мг/кг массы тела в сутки повторными циклами по 10 — 14 дней.
Диэтилкарбамазин назначают в дозах 2 — 6 мг/кг массы тела в сутки в течение 2 — 4 недель. (В настоящее время препарат в России не производится, не закупается за рубежом. — Прим. ред.)
Альбендазол назначают в дозе 10 мг/кг массы тела в сутки в два приема (утро — вечер) в течение 7 — 14 дней. В процессе лечения необходим контроль анализа крови (возможность развития агранулоцитоза) и уровня аминотрансфераз (гепатотоксическое действие препарата). Небольшое повышение уровня аминотрансфераз не является показанием к отмене препарата. В случае нарастающей гиперферментемии и угрозы развития токсического гепатита требуется отмена препарата.
Критерии эффективности лечения: улучшение общего состояния, постепенная регрессия клинических симптомов, снижение уровня эозинофилии и титров специфических антител. Следует отметить, что клинический эффект лечения опережает положительную динамику гематологических и иммунологических изменений. При рецидивах клинической симптоматики, стойкой эозинофилии и положительных иммунологических реакциях проводят повторные курсы лечения.
Прогноз для жизни благоприятный, однако при массивной инвазии и тяжелых полиорганных поражениях, особенно у лиц с нарушениями иммунитета, возможен летальный исход.
Включает соблюдение личной гигиены, обучение детей санитарным навыкам.
Важным профилактическим мероприятием является своевременное обследование и дегельминтизация собак. Наиболее эффективно преимагинальное лечение щенков в возрасте 4 — 5 недель, а также беременных сук. Для лечения собак используют противонематодозные препараты. Необходимо ограничение численности безнадзорных собак, оборудование специальных площадок для выгула собак.
Следует улучшить санитарно-просветительскую работу среди населения, давать информацию о возможных источниках инвазии и путях ее передачи. Особого внимания требуют лица, по роду деятельности имеющие контакты с источниками инвазии (ветеринарные работники, собаководы, землекопы и другие).
Читайте также:

