Таблетки от вич из европы
Обновлено: 15.04.2024
Общая информация
Более 20 лет прошло с тех пор, как на фармацевтическом рынке появился новый класс антиретровирусных препаратов — ненуклеозидные ингибиторы обратной транскриптазы (ННИОТ). В 1996 году американское Управление по санитарному надзору по качеству пищевых продуктов и медикаментов FDA одобрило невирапин, в 1997 году — делавирдин, а годом позже — эфавиренц. Однако, у значительной части пациентов с помощью ННИОТ не удалось добиться оптимального терапевтического ответа вследствие накопленной устойчивости вируса к монотерапии и/или неоптимальных режимов комбинированной терапии, поэтому усилия учёных всего мира были направлены на разработку новых молекул, с улучшенным профилем устойчивости. И они увенчались успехом.
Сегодня FDA одобрено применение пяти ННИОТ [1]:
-
;
- делавирдина;
- эфавиренца;
- этравирина;
- рилпивирина.
Представители ННИОТ принадлежат к разным классам ЛС по химической структуре, но имеют общий уникальный механизм действия: их взаимодействие с обратной транскриптазой ВИЧ-1 запускает цепь изменений, подавляющих активность этого фермента. Для ННИОТ характерна специфичность к ВИЧ-1, что делает их селективными ингибиторами вируса [1, 2].
Сегодня разрабатываются ННИОТ следующего, третьего поколения. Для улучшения приверженности лечению и снижения риска ошибок в дозировках при приёме препаратов была создана комбинация эфавиренц + два НИОТ (эмтрицабин и тенофовир) в одной таблетке, которую принимают один раз в день.
Фармакологическое действие
По всей видимости, ННИОТ вмешиваются в различные этапы реакций обратной транскриптазы ВИЧ-1. За счёт этого препараты блокируют активность РНК- и ДНК-зависимой ДНК-полимеразы, вызывая разрушение активного центра фермента [1, 2].
ННИОТ не оказывают значимого ингибирующего эффекта на ДНК-полимеразу клеток эукариот, таких как ДНК-полимеразы человека.
Следует отметить, что большинство ННИОТ не активны в отношении ВИЧ-2 — второго серотипа вируса иммунодефицита, который встречается гораздо реже ВИЧ-1 (преимущественно в Африке), является менее вирулентным и агрессивным по сравнению с первым серотипом [2]. При этом, исследования in vitro демонстрируют активность этравирина в отношении ВИЧ-2 [3].
Устойчивость к ННИОТ
ВИЧ-инфекция характеризуется очень высокой скоростью репликации: вирус производит от 1 до 10 миллиардов новых вирусных частиц в день у нелеченного инфицированного. Наряду со специфическими свойствами обратной транкриптазы ВИЧ, а также большой длиной вирусного генома (около 10 000 нуклеотидов) это создаёт предпосылки к высокой частоте развития мутаций: мутантный ген в каждом положении нуклеотида в вирусном геноме вырабатывается каждый день.
Как правило, развитие мутаций тесно связано с неоптимальной схемой лечения, например, монотерапией. Оно также ставит под угрозу эффективность последующих схем антиретровирусной терапии, поскольку в каждом классе препаратов наблюдается перекрёстная резистентность [4].
Мутации в домене гена обратной транскриптазы изменяют способность ННИОТ связывать фермент. Устойчивость препаратов первого поколения была связана с мутациями в нескольких кодонах. Однако, чтобы вызвать клиническую неэффективность делавирдина, эфавиренца или невирапина, достаточно наличия мутации К103N или Y181C [4].
Препараты второго поколения более устойчивы, для развития резистентности к ним необходимо более одной мутации. Клинические исследования выявили 17 мутаций устойчивости, связанных со снижением ответа на терапию этравирином [5]. Различные мутации в разной степени влияют на восприимчивость вирусов к этравирину. Рилпивирин, будучи препаратом с более высоким генетическим барьером, чем ННИОТ первого поколения, всё же связан с более частыми случаями развития устойчивости по сравнению с этравирином [6].
Фармакокинетика ННИОТ
ННИОТ демонстрируют значительную индивидуальную фармакокинетическую вариабельность. Все одобренные в настоящее время препараты этой группы используют систему цитохрома Р450 для метаболизма и оказывают или индукционное, или ингибирующее действие на определённые изоферменты (например, CYP3A4, CYP2C9). Это приводит к значительному потенциалу лекарственного взаимодействия [7].
За исключением невирапина, ННИОТ в существенной степени связываются с белками (98–99 %), в первую очередь с альбумином и альфа-кислотным гликопротеином. Периоды полураспада ННИОТ в сыворотке крови довольно продолжительны и составляют от 25 до 55 часов, за исключением делавирдина, имеющего более короткий период полувыведения (2–11 часов) [7].
Побочные эффекты
Самым частым побочным эффектом ННИОТ считается сыпь: она развивается в течение первых нескольких недель терапии и проходит при продолжении лечения. Все препараты этого класса, за исключением этравирина, обладают определённой гепатотоксичностью. Так, делавирдин и эфавиренц могут повышать уровень трансаминаз, в то время как невирапин способен вызывать тяжёлое поражение печени, включая некроз [8].
Эфавиренц способен вызывать неблагоприятные реакции со стороны центральной нервной системы — бессонницу, яркие сновидения, головокружение, спутанность создания и галлюцинации. Рилпивирин также связан с неврологическими побочными эффектами, но реже, чем эфавиренц [6].
Устойчивость к побочным эффектам со стороны ЦНС на фоне приёма эфавиренца обычно возникает после нескольких недель терапии. Их можно корректировать за счёт приёма препарата перед сном и отказа от применения во время еды. Лишь у небольшого числа пациентов воздействие на ЦНС может сохраняться и даже потребовать отмены препарата [9].
Использование эфавиренца также связано с повышением риска суицидов примерно в два раза по сравнению с плацебо. Они присутствуют как в начале лечения, так и при длительном применении. К группам риска по развитию суицидальной наклонности на фоне лечения эфавиренцом относятся пациенты, принимающие психоактивные препараты, имеющие психиатрический анамнез, с массой тела менее 60 кг, а также употребляющие инъекционные наркотические средства [10].
Особенности отдельных ННИОТ
Невирапин
Используется, как минимум, в сочетании с двумя другими антиретровирусными препаратами. Относительно безопасен при беременности. Хорошо проникает через гематоэнцефалический барьер, подвергается печёночному метаболизму (период полувыведения — 28 часов). Препарат индуцирует и собственный метаболизм, поэтому дозу увеличивают постепенно. В начале терапии его назначают один раз в день, а спустя две недели увеличивают кратность приёма до двух раз в день (при хорошей переносимости) [1, 4, 10].
Как правило, невирапин применяется в странах третьего мира, в том числе и для антиретровирусной терапии во время беременности. Результаты исследований показали, что он превосходит зидовудин по эффективности при однократном введении во время родов, однако приводит к развитию резистентности у леченных матерей, что может отрицательно повлиять на терапевтический ответ антиретровирусной терапии в дальнейшем [1, 8].
Делавирдин
Принадлежит к семейству бис (гетеро-арил) пиперазинов, открытых учёными компании Upjohn Laboratories. Имеет более объёмную кристаллическую структуру по сравнению с другими ННИОТ, благодаря чему выступает за пределы гидрофобного кармана, с которым связывается. Это объясняет его особый профиль устойчивости. Мутация, связанная с развитием резистентности к делавирдину, расположена на участке места связывания ННИОТ с карманом. Она вызывает гиперчувствительность ко всем другим препаратам этой подгруппы [1, 4].
Как и невирапин, делавирдин применяют в схемах лечения, когда возникает резистентность, которую невозможно предотвратить. Сегодня этот препарат назначают крайне редко.
Эфавиренц
Представитель подкласса бензоксазинов, открытый исследователями Merck в 1995 году. В отличие от невирапина и делавирдина, был изучен в исследованиях III фазы в качестве компонента лечения ННИОТ и продемонстрировал высокую эффективность.
Этравирин
Принадлежит к семейству диарилпиримидиновых соединений, стал результатом многолетних исследовательских усилий учёных из компаний Janssen Research Foundation и Tibotec, направленных на открытие новых ННИОТ с оптимальным профилем устойчивости и повышенным генетическим барьером для развития резистентности. In vitro демонстрирует более высокий генетический барьер устойчивости по сравнению с невирапином и эфавиренцем [4].
Период полувыведения этравирина составляет 41 час. Препарат назначают два раза в день после еды. Самый распространённый побочный эффект — сыпь, которая, как правило, появляется в течение первых 6 недель терапии. Также на фоне применения нередко развивается периферическая нейропатия [1, 10].
Обладает активностью против штаммов ВИЧ, резистентных к ННИОТ. Из-за потенциально значительных побочных эффектов не применяют в комбинации с другими ННИОТ. Обладает аддитивной противовирусной активностью в комбинации с ингибиторами протеазы ВИЧ, нуколеозидными ингибиторами обратной транскриптазы, а также с ингибитором слияния энвуфиртидом [4].
Рилпивирин
Ещё одно соединение, ставшее результатом дальнейшей оптимизации в рамках ННИОТ, направленной на создание препарата с лучшим профилем устойчивости. In vitro демонстрирует профиль резистентности и генетический барьер, сопоставимый с таковым у этравирина. Отличается высокой биодоступностью, в том числе по сравнению с этравирином. Фармакокинетические свойства позволяют применять один раз в день. Переносится лучше, чем эфавиренц, с более низкой частотой невропсихиатрических нежелательных явлений, сыпью, меньшим количеством липидных нарушений [4, 10].
История антиретровирусной (АРВ) терапии едва разменяла третий десяток, но это был колоссальный путь. Если в 1996 году пациентам были доступны только токсичные и малоэффективные лекарства, которые нужно было пить каждый день и горстями, то уже сейчас вовсю испытывают инъекции, способные подавлять размножение вируса на несколько месяцев. Но это на западе.
Если вы живете в России, то таблетки все еще нужно пить каждый день и (часто) горстями. Тем временем, весь мир стремительно переходит на комбинированные препараты. Сейчас их нельзя назвать революцией в терапии ВИЧ-инфекции, но комбинированные формы - их еще называют таблетками “все в одном” – определенно гораздо лучше обычной АРВ-терапиии.
Во-первых, они берут количеством: для подавления вирусной нагрузки человек принимает всего одну таблетку в день вместо четырех – восьми. Благодаря этому людям, живущим с ВИЧ, не приходится подчинять свое расписание приёму лекарств, не приходится таскать с собой мешок таблеток на случай, если ночуешь не дома, не приходится испытывать столько дискомфорта при проглатывании таблеток (да, для некоторых людей это стресс), не приходится ловить на себе косые взгляды и объяснять случайным людям особенности своего диагноза.
Приверженность к лечению – аккуратный и ежедневный прием лекарств –главное условие успешной терапии ВИЧ-инфекции. Чтобы ее достичь, таблеток в схеме должно быть меньше.
Плохая новость: в России пока недоступны все комбинированные формы, которые есть в мире. Но нужно подготовиться к тому, что когда-то они будут и у нас. Поэтому мы решили вспомнить историю таблеток “все в одном” с момента их появления.
Все больше исследований доказывают, что терапия ВИЧ-инфекции таблетками “все в одном” показывает лучшие результаты, чем схемы с несколькими таблетками, прежде всего, благодаря большей приверженности: у таких пациентов меньше случаев прерываний терапии и достоверно чаще отмечается неопределяемая вирусная нагрузка. Широкое внедрение “монорежимов” – это не прихоть, а необходимость.
Атрипла
Препарат одобрен Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) США 12 июля 2006 года.
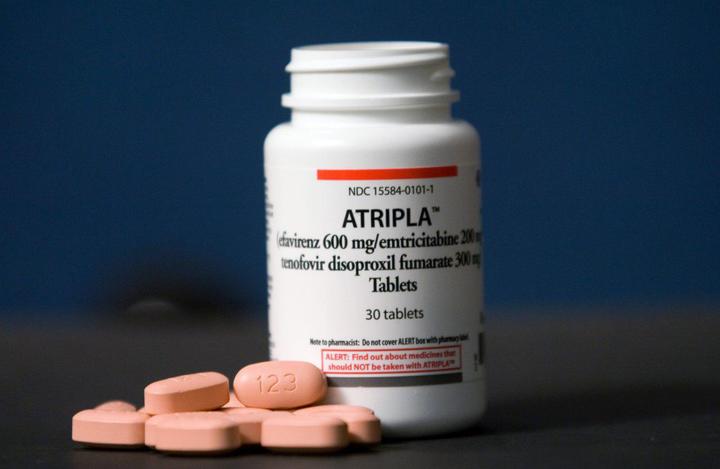
Ветеран монорежима представляет собой комбинацию из 200 мг эмтрицитабина, 300 мг тенофовира дизопроксила фумарата (TDF) и 600 мг эфавиренза. Препарат имеет ряд побочных эффектов. Среди них головокружение, головная боль, боли в животе. Длительный прием TDF может негативно влиять на состояние костей и почек. Препарат рекомендуют принимать на пустой желудок или с пищей (нежирной) – в зависимости от реакции организма. Лекарство также может взаимодействовать с другими препаратами.
Несмотря на все недостатки, Атрипла остается одним из двух препаратов “все в одном”, которые доступны в России.
Эвиплера/ Комплера
Препарат одобрен FDA в августе 2011 года.
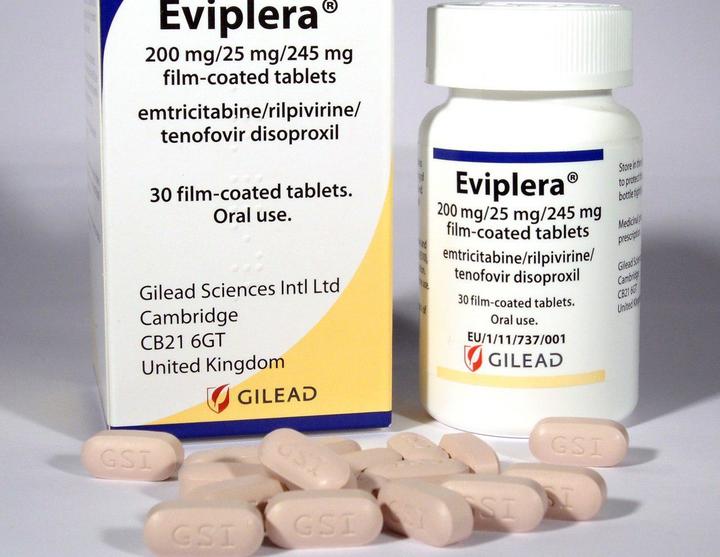
Содержит 200 мг эмтрицитабина, 300 мг TDF и 25 мг рилпивирина. Принимают с едой. Препарат подходит как для новичков, которые раньше не принимали терапию, так и для тех, кто хочет перейти на него с другой схемы лекарств.
Побочные эффекты (повышенный уровень холестерина, потеря аппетита, депрессия, слишком яркие сны, тошнота, рвота, головные боли) выражены меньше, чем у Атриплы, за счет содержания рилпивирина вместо эфавиренза.
Эвиплеру стоит с осторожностью принимать с препаратами против эпилепсии (карбамазепин, окскарбазепин, фенобарбитал), антибиотиками для лечения туберкулеза (рифампицин, рифабутин) и со зверобоем. Действие препарата также могут блокировать лекарства от изжоги (Гевискон, Ренни), препараты из группы омепразола. Поэтому пациентов настоятельно просят сообщать врачу, принимают ли они лекарства для желудка, даже если это происходит не ежедневно.
Второй и пока последний в списке препарат, доступный в России.
Стрибилд (Стрибильд)
Препарат одобрен FDA в августе 2012 года.
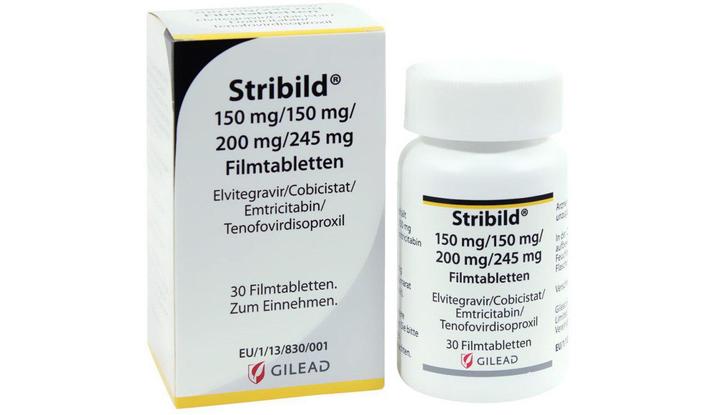
Комбинация 200 мг эмтрицитабина, 300 мг TDF, 150 мг элвитегравира и 150 мг кобицистата (препарат-бустер). Принимают один раз в день с едой.
Побочные эффекты схожи с Эвиплерой. Противопоказано пить препарат одновременно с добавками, содержащими кальций, железо, магний, алюминий или цинк. Промежуток между приемом должен составлять не менее 4 часов. Совместный прием гормональных препаратов требует консультации специалиста.
Триумек (Трайомек)
Препарат одобрен FDA в августе 2014 года.
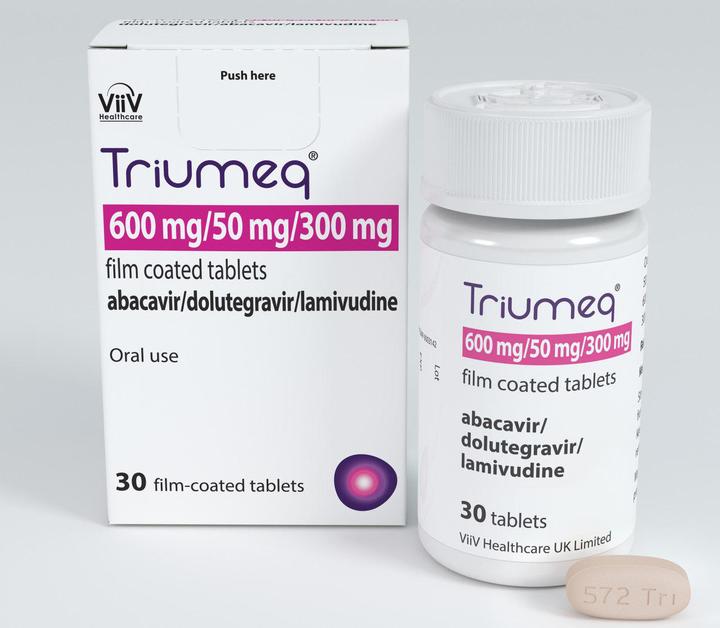
Объединяет 50 мг долутегравира, 600 мг абакавира и 300 мг ламивудина. Лекарство нужно принимать с едой или без еды, но лучше утром, поскольку вечерний прием долутегравира может вызвать бессонницу.
Помимо стандартных побочных эффектов (сонливость, депрессия, головная боль) выделяют боли в суставах, ринит, кашель, желудочный рефлюкс и потерю аппетита. Как и Стрибилд, Триумек плохо сочетается с препаратами кальция и железа. Кроме того, абакавир и долутегравир могу вызывать аллергическую реакцию.
Генвойя
Препарат одобрен FDA в ноябре 2015 года.
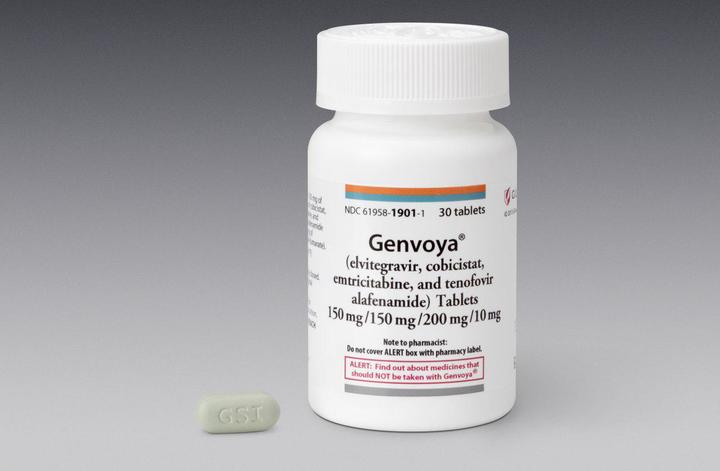
Генвойя – это 200 мг эмтрицитабина, 10 мг тенофовира алафенамида (TAF), 150 мг эльвитрагравира и 150 мг кобицистата. Принимается с едой.
Побочные эффекты фактически аналогичны тем, что наблюдаются у Стрибилда, но с небольшой разницей. В составе Генвойи содержится так называемый “новый” тенофовир. При равном противовирусном эффекте и практически одинаковой цене, схема с TAF имеет значительно меньше побочных эффектов. Благодаря этому FDA исключило из аннотации к препарату предупреждение о негативном воздействии на костную ткань. Стоит отметить, что в США уже обновляют рекомендации по лечению ВИЧ-инфекции, где Стрибилд отходит на второй план как устаревший, а предпочтение отдают Генвойе.
Одефси
Препарат одобрен в марте 2016 года.
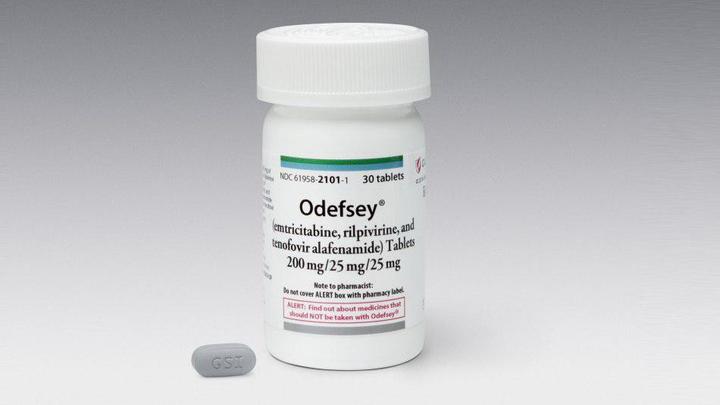
Состоит из 25 мг рилпивирина, 200 мг эмтрицитабина и 25 мг TAF. Аналог Эвиплеры/Комплеры, но с “новым” тенофовиром вместо “старого”.
Принимают один раз в день с пищей. Побочные эффекты и рекомендации по лекарственной сочетаемости аналогичны Эвиплере. Одефси, как и Генвойя, гораздо меньше влияет на состояние почек и костей за счет содержания TAF.
Не рекомендуется применять совместно с омепразолом (препарат для лечения гастрита и язвы). Кроме того, некоторые антибиотики для лечения туберкулеза могут снижать уровень TAF.
Юлука (Джулука)
Препарат одобрен FDA в ноябре 2017 года.

Первый полный безнуклеозидный режим терапии, в котором содержится только два препарата вместо трёх и более, как в стандартных схемах лечения ВИЧ-инфекции. Содержит 50 мг долутегравира и 25 мг рилпивирина. Подходит для продолжения терапии пациентов, чья вирусная нагрузка стабильно подавлена последние полгода или дольше.
Побочные эффекты те же, что и у долутегравира и рилпивирина. Но уже сейчас специалисты FDA отмечают, что токсичность препарата ниже, чем у классических схем из трех-четырех препаратов. Это связано с меньших количеством действующих веществ и отсутствием в схеме нуклеозидных (нуклеотидных) аналогов.
Перед началом приёма стоит исключить мутации вируса, которые ведут к резистентности к рилпивирину.
Биктарви
Препарат одобрен FDA в феврале 2018 года.
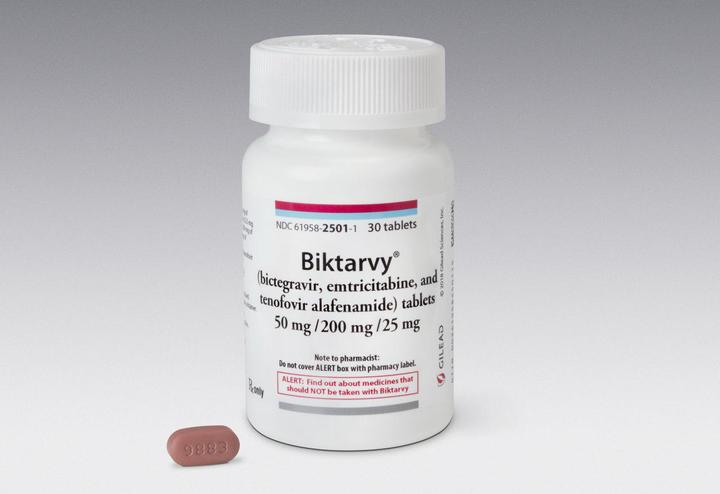
Содержит 200 мг эмтрицитабина и 25 мг TAF и 50 мг нового препарата под названием биктегравир. Известно, что производитель биктегравира пока не собирается выпускать его в форме отдельной таблетки – только в составе комбинированной формы.
Новый препарат считается одним из самых минимальных по количеству действующего вещества. При приеме "Биктарви" рекомендуют контролировать функцию почек.
Symfi и Symfi Lo
Препарат одобрен FDA в марте 2018 года.

Symfi включает 600 мг эфавиренза, 300 мг ламивудина и (внезапно) 300 мг TDF. Symfi Lo содержит 400 (а не 600) мг эфавиренца, 300 мг ламивудина и 300 мг TDF. Принимать рекомендуют натощак.
За счёт содержания TDF препарат может вызывать проблемы с почками и костями. У некоторые пациентов на фоне приёма препарата развивается депрессия.
У Symfi Lo лучше переносимость, благодаря меньшей дозе эфавиренза.
Symtuza
Препарат одобрен FDA в июле 2018 года.
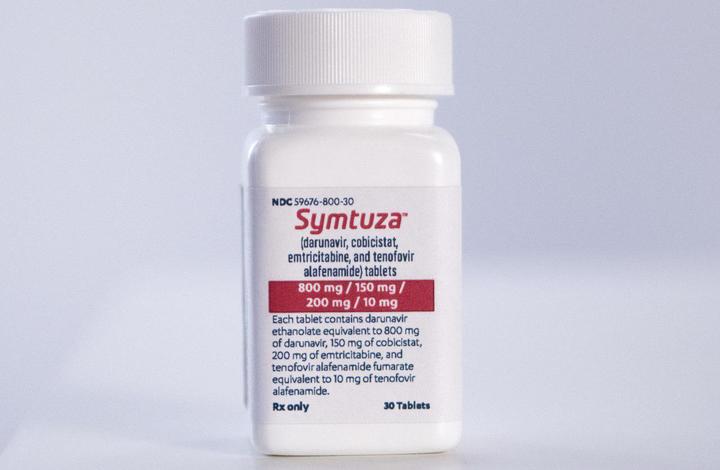
Новейший препарат включает 800 мг дарунавира, 150 мг кобицистата, 200 мг эмтрицитабина и 10 мг TAF.
Противопоказания и побочные эффекты аналогичны препаратам с теми же действующими веществами. Однако токсичное влияние на почки и скелет ниже, благодаря малому содержанию тенофовира.
При этом, кобицистат может усиливать действие других препаратов, потенциально увеличивая риск серьезных побочных эффектов.

Компания Excision BioTherapeutics объявила о том, что Управление по контролю за качеством пищевых продуктов и медикаментов США (FDA) одобрило заявку на проведение первой и второй фаз клинических испытаний нового лекарственного препарата против хронической ВИЧ-инфекции. Испытания EBT-101, в основе которого лежит технология редактирования генома CRISPR/Cas, на безопасность, переносимость и эффективность у добровольцев с ВИЧ типа 1 начнутся в конце 2021 года. Участники исследования будут распределены на три группы для определения наилучшей дозировки.
Новая технология мгновенно вызвала большой энтузиазм в медицине — главным образом из-за потенциала в клеточной терапии. Впрочем, с помощью CRISPR-терапии только начинают лечить. В 2020 году стало известно о первых успешных клинических испытаниях: семь пациентов смогли вылечить от бета-талассемии — заболевания, связанного с низким содержанием гемоглобина в крови, еще три — от серповидноклеточной анемии, при которой эритроциты приобретают серповидную форму и вызывают боль, повреждение органов и инсульты.
Однако пока CRISPR-терапия остается чрезвычайно дорогостоящей — так, излечение серповидноклеточной анемии у одного пациента, по словам Дудны, стоит около двух миллионов долларов. При этом продолжается как усовершенствование самого CRISPR (появляются все новые и новые его варианты), так и способы его доставки: в июне стало известно о том, что систему впервые непосредственно доставили в клетки шести пациентов с транстиретиновым амилоидоизом — болезнью, при которой белок транстиретин накапливается в жизненно важных органах. Раньше терапия проходила ex vivo: клетки извлекались для редактирования, а затем вводились вновь.
В 2019 году исследователи из Университета Небраски совместно с коллегами из Университета Темпл продемонстрировали на гуманизированных мышах эффективность сочетания системы CRISPR и разработанной учеными противовирусной терапии с медленным высвобождением и долговременным действием (LASER ART). Через две недели после введения ВИЧ типа мышам начинали давать антиретровирусные препараты в наночастицах с замедляющей высвобождение лекарств оболочкой. LASER ART прекращалась через четыре недели, вслед за чем исследователи с помощью аденовирусов вводили CRISPR/Cas9. У всех мышей с такой комбинированной терапией снижалась вирусная нагрузка — однако полностью удалить ДНК ВИЧ удалось только у двух из семи. В настоящее время исследователи работают над LASER ART следующего поколения.
Уже в этом году исследователи из Пекинского университета предложили новый метод лечения ВИЧ, где для борьбы с заболеванием используются модифицированные с помощью CRISPR гемопоэтические стволовые клетки. Однако пока число клеток с выработанным иммунитетом в организме добровольца оказалось недостаточным.
Фото: M arco Bello / Reuters

Глава нью-йоркской фармацевтической компании Turing Мартин Шкрели всего за пару дней стал одним из самых порицаемых людей в США и главным топиком в Twitter-обсуждениях. В августе 2015 года молодой бизнесмен за 50 миллионов долларов выкупил патент на производство лекарства, применяемого для лечения ВИЧ-инфицированных больных, а уже в сентябре поднял стоимость одной таблетки с 13,5 до 750 долларов. Поступок предпринимателя вылился в бурную онлайн-дискуссию о расценках в фарминдустрии и моральных качествах игроков рынка, а за прецедентом пообещала пристально следить даже Хиллари Клинтон.
Теперь даже те, кто далек от проблем ВИЧ-инфицированных и больных СПИДом, а также слыхом не слыхивал про Daraprim (пириметамин), волей-неволей узнают про это лекарство и его нового производителя. Итак, средство используется для лечения токсоплазмоза — паразитарного заболевания, которое часто сопровождает ослабленный иммунитет, — то есть наиболее часто встречается у ВИЧ-инфицированных и больных СПИДом. Данным группам пациентов, как правило, требуется длительный курс лечения Daraprim. Как подсчитали эксперты из Американского общества специалистов по инфекционным болезням (Infectious Diseases Society of America), при новых ценах на препарат годичный курс приема лекарства обойдется в 634 тысячи долларов. При этом стоимость лечения данным лекарством не покрывается медицинской страховкой.
После заявления Клинтон стоимость акций Turing упала на пять процентов в ходе торгов на Нью-йоркской фондовой бирже.
Звони своему юристу, подавай на меня в суд,
Я буду улыбаться в зале суда и куплю тебе новый гардероб.
Я не хочу быть скупым,
Но такой уж я есть.
Популярности предпринимателю этот пост не прибавил.
Шкрели дал интервью CNBC, в котором объяснил, что лекарство Daraprim является устаревшим и обладает рядом побочных эффектов, которые фармацевты Turing надеются устранить в результате планируемых исследований (например, по словам предпринимателя, таблетки могут вызывать временное бесплодие у женщин). Бизнесмен также пообещал, что постарается добиться от страховых компаний, чтобы те сделали необходимость приема препарата страховым случаем и тем самым облегчили финансовое бремя пациентов. После выступления Шкрели по телевидению многие интернет-пользователи изменили свою точку зрения, о чем сообщили в Twitter.
Большинство освещавших тему англоязычных изданий сошлось во мнении, что в эти дни Шкрели стал самым ненавидимым человеком страны. СМИ также подчеркивают, что случай с Daraprim не уникален: игроки фармацевтического рынка часто удивляют ценообразованием именно в отношении жизненно важных лекарств. Авторы многочисленных материалов выражают надежду, что данный инцидент привлечет внимание к проблеме, которая носит более чем системный характер.
Читайте также:

