Таблетки от вич милан
Обновлено: 18.04.2024
С самого зарождения эпидемии ВИЧ медицинское научное сообщество было занято поиском эффективного способа предотвращения передачи ВИЧ-инфекции.
Кроме использования средств барьерной контрацепции (презервативов) существуют и иные способы обезопасить себя от ВИЧ-инфекции. Самый главный из них — PrEP, или так называемая доконтактная профилактика (ДКП).
Препараты PrEP — это те же вещества, которыми лечат ВИЧ, но принимаются они по усеченной, неполной схеме. Механизм действия ДКП прост: если лекарство успело попасть в организм заранее, то при попадании в него вируса оно способно убить ВИЧ еще до того, как тот успеет закрепиться в нем.
Защита, которую предлагает PrEP, достаточно надежна и приближается к 100 %, если принимать таблетки правильно.
Что это за таблетки?
Сразу стоит дать названия, существуют две схемы ДКП, которые рекомендованы для использования:
(в одной таблетке — тогда они называются Трувада, либо по отдельности);
Почему именно эти препараты? Для того чтобы ответить на вопрос, можно или нет использовать конкретное лекарство для ДКП, надо провести клиническое исследование. Без клинических исследований подтвердить такой тезис невозможно. Поэтому придерживаться стоит тех схем, которые уже были испытаны и утверждены в качестве PrEP.
Именно поэтому, когда мы говорим о доконтактной профилактике, как правило, речь идет о двух препаратах, как это уже было сказано: тенофовире и эмтрицитабине. Если вы обратитесь в аптеку, то их комбинация в одной таблетке будет стоить порядка 14 000 рублей. Однако допустимо применение и других апробированных для ДКП лекарств. Например, тенофовира и ламивудина. Эта схема также одобрена Всемирной организацией здравоохранения (ВОЗ), они, купленные по отдельности, будут стоить не 14 000, а порядка 1000 рублей.
Какой схемой воспользоваться — решать вам. В целом ДКП сейчас доступна в разных формах для пациентов с разным достатком, и самые дешевые ее схемы могут стоить не более двух тысяч рублей в месяц.
А можно подробнее про механизм действия?
Можно. Итак, доконтактная профилактика заключается в приеме двух препаратов, относящихся к классу ингибиторов обратной транскриптазы, ВИЧ-отрицательными людьми. То есть людьми, в чьем организме вируса пока еще нет.
Что делают эти препараты? На картинке ниже вы можете увидеть жизненный цикл вируса иммунодефицита, как он прикрепляется к клетке и вбрасывает внутрь нее свой генетический материал.
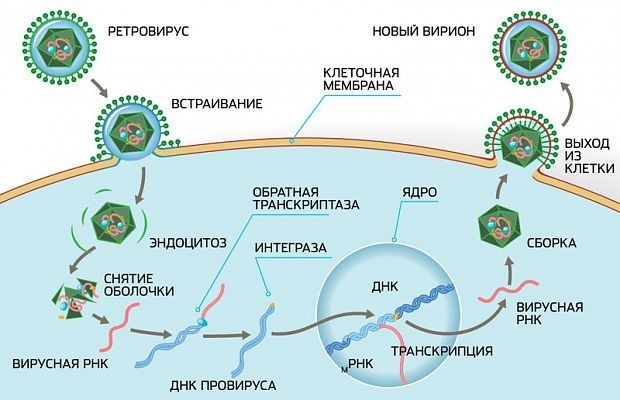
Этот генетический материал под воздействием особого фермента — обратной транскриптазы — запускает процесс репликации новых вирусов.
Два исследования — iPrEx и Partners (оба они проводились в США и Западной Европе) — продемонстрировали крайне высокую эффективность защиты PrEP, в отдельных случаях приближающуюся к 99 %.
В обоих лекарство тенофовир + эмтрицитабин, известное как Трувада, тестировалось на людях, относящихся к ключевым, то есть наиболее уязвимым для эпидемии, группам, — на мужчинах, практикующих секс с мужчинами, и трансгендерных женщинах (mtf). И именно у них этот метод профилактики показал свою наибольшую эффективность.
(Противо)показания к началу ДКП
В настоящее время в России ДКП одобрена Министерством здравоохранения в качестве дополнительного метода профилактики ВИЧ-инфекции и даже попала в клинические рекомендации, так что врач, пусть пока и не имеет возможности выдавать ее бесплатно, как выдаются препараты АРВТ, все же может легально рассказать своим пациентам, где можно приобрести необходимые таблетки, что для этого нужно сделать и как их принимать.
Главным противопоказанием к началу ДКП, конечно, является наличие у пациента ВИЧ-инфекции или симптомов, указывающих на так называемую острую фазу ВИЧ, которая имеет место примерно через две недели после проникновения вируса в организм.
Побочные эффекты
Безопасна ли ДКП? Да. Она безопасна. Оба режима одинаково эффективны. Всего в настоящий момент мы знаем лишь о семи случаях получения вируса на PrEP. А учитывая, что во всем мире примерно полмиллиона человек принимают доконтактную профилактику, семь случаев — это весьма немного.
Два из них были связаны с низкой приверженностью (пропуском приема профилактического препарата), два — с наличием резистентного к эмтрицитабину штамма ВИЧ. Два человека были инфицированы еще до начала доконтактной профилактики. Буквально недавно мировые СМИ сообщили о еще одном случае инфицирования ВИЧ на доконтактной профилактике. На этот раз вирус получил активист в Австралии, который более пяти лет принимал PrEP именно в разовом режиме.
Сейчас идет расследование этого инцидента, и мы пока не знаем точно, в чем была его причина. Что же касается побочных эффектов, они встречаются крайне редко и при должном внимании врача легко контролируются.
Долгосрочные эффекты, например деминерализация костной ткани, появляются не сразу, и, по большому счету, слишком бояться их не стоит. Деминерализация костной ткани, связанная с тенофовиром, проходит в течение, как правило, месяца после остановки приема и не является необратимой. То же самое касается снижения функции почек.
Когда он появится на наших прилавках — сказать сложно. Но в любом случае стоит помнить: даже если это лекарство и появится в России, ДКП — это не витамины, которые можно принимать самостоятельно. Любые побочные эффекты должен отслеживать врач, равно как и назначать сам препарат. Кому стоит обратиться к ДКП, а кому повременить? В идеале такое решение должен принимать не сам пациент в режиме самолечения, а специалист, обладающий достаточной квалификацией.
Как правильно приостановить прием ДКП?
Если вы мужчина или трансгендерная женщина и хотите безопасно прекратить прием доконтактной профилактики, вам необходимо принимать ДКП как минимум еще два дня после последнего рискованного полового контакта. И только через два дня в случае отсутствия в течение этого времени опасных контактов перестать пить таблетки.
Для женщин на ДКП необходимо как минимум семь дней приема ДКП после последнего рискованного контакта. Это связано с особенностями женского организма и того, как ведут себя препараты PrEP в нем.
Чтобы возобновить прием доконтактной профилактики, вы должны быть уверены в отсутствии рисков в период без ДКП. Если риски все же были, то необходимо сделать тест на ВИЧ. Но помните про период серонегативного окна — 4-6 недель с момента последнего риска.
Чтобы начать пить доконтактную профилактику на постоянной основе, необходимо непрерывно принимать ДКП на протяжении семи дней до первого рискованного контакта. Либо (только для мужчин) можно принять двойную дозировку, а затем каждые 24 часа принимать по одной дозе ДКП.
Постконтактная профилактика ВИЧ (ПКП)
Если опасный контакт все-таки случился, а вы не успели обезопасить себя ни с помощью презерватива, ни с помощью препаратов ДКП, и со времени контакта прошло не более 72 часов, избежать инфицирования вам может помочь так называемая постконтактная профилактика.
Заключается она в том, что в указанный срок вам необходимо начать прием препаратов, которыми обычно лечат ВИЧ-инфекцию, но, в отличие от PrEP, тут принимать лекарства придется в полной дозировке, такой, какую принимают люди, у которых уже диагностирована инфекция.
Многочисленными исследованиями доказано: если начать такой прием вовремя, есть большой шанс, что вирус не успеет закрепиться в организме и заболевания удастся избежать. Идеально начать прием лекарств в первые два часа или хотя бы в первые сутки после контакта. Чем позже будет начат такой прием, тем меньше вероятность, что терапия сработает.
Курс профилактики длится 28 дней, и по завершении его необходимо сделать тест, чтобы удостовериться в его эффективности.
Важно! Лекарства, которые вам придется принимать, по факту продаются БЕЗ РЕЦЕПТА, но найти их можно не в каждой аптеке. Поэтому времени на раздумья у вас немного. Возможно, на то, чтобы собрать необходимую комбинацию таблеток, у вас может уйти более суток, так что поиск стоит начать прямо сейчас.
Всего вам придется купить три препарата и принимать нужно будет все три. По отдельности они не работают.
Испытания лекарств от ВИЧ часто включает в себя аналитическое прерывание лечения, когда пациенты с ВИЧ прекращают прием антиретровирусной терапии (АРТ), чтобы ученые могли понаблюдать, как неконтролируемый вирус реагирует на исследуемые препараты.
Участие в такого рода клинических испытаниях может вызвать страх у человека с ВИЧ, который привык поддерживать неопределяемую вирусную нагрузку. Кроме того, предыдущее исследование, проведенное доктором Лау, показало, что многие люди с ВИЧ не были уверены в том, как работают эти испытания, и многие из них не были готовы к длительным периодам определяемой вирусной нагрузки.
Ученые работают над различными стратегиями излечения ВИЧ-инфекции. Некоторые методы нацелены на сокращение латентных резервуаров ВИЧ — инфицированных иммунных клеток, которые не производят новые вирионы в течение многих месяцев или лет. Другие виды терапии пытаются повысить способность иммунной системы контролировать вирус.
Существуют два типа исследований, основанных на прерывании лечения, которые используются для оценки потенциальной терапии: изучение времени до восстановления вирусной активности (TVR) и изучение контрольных точек. В исследованиях TVR после того, как участники прекращают АРТ, ученые измеряют время, необходимое, чтобы вирусная нагрузка сначала достигла обнаруживаемого уровня (50 копий/мл), а затем время, необходимое для достижения более высокого порога (часто 10 000 копий/мл), после чего участники возобновляют прием АРТ. Если тем, кто получает лечение, требуется больше времени для достижения этих пороговых значений по сравнению с контрольной группой, это указывает на то, что терапия замедляет восстановление вирусной активности. Исследования TVR часто используются для оценки методов терапии, нацеленной на резервуары, обычно они длятся всего несколько недель.
Исследования контрольных точек демонстрируют, насколько эффективно иммунная система участников контролирует ВИЧ самостоятельно. В этих гораздо более длительных исследованиях (до нескольких месяцев) исследователи позволяют вирусным нагрузкам участников достигать высоких уровней, имитируя острую фазу ВИЧ, чтобы проследить, сможет ли их иммунная система в дальнейшем снизить эту нагрузку. Порог для возобновления АРТ обычно устанавливается на высоком уровне (часто 100 000 копий/мл). Когда участники, получающие лечение, способны контролировать ВИЧ при более низких уровнях вирусной нагрузки и в течение более длительного времени, чем участники контрольной группы, это говорит о том, что терапия повышает их иммунитет против вируса.
Несмотря на то, что нет конкретных рекомендаций, определяющих, как планировать исследования с прерыванием лечения, группа ученых, занимающихся исследованием ВИЧ, встретилась в 2018 году, чтобы обсудить этические стороны и выработать методы для снижения риска. Прекращение АРТ во время этих исследований не просто подвергает участников риску длительных периодов определяемой, а в некоторых случаях и высокой вирусной нагрузки. Более высокие вирусные нагрузки также могут подвергать опасности и ВИЧ-отрицательных половых партнеров участников.
До сих пор в большинстве исследований риск снижался за счет небольшого числа участников и отсутствия контрольной группы, которая вместо лечения принимала неактивное плацебо. Включение контрольной группы важно, потому что это позволяет ученым сравнивать тех, кто принимает лекарства, с теми, кто находится на плацебо. Тем не менее научное сообщество обсуждало этичность использования контрольных групп в подобных испытаниях лекарств, потому что они подвергаются длительным периодам повышенной вирусной нагрузки в отсутствие каких-либо препаратов, даже экспериментальных.
Исследование
Доктор Лау и ее коллеги использовали данные предыдущих клинических испытаний для создания математических моделей, позволяющих оценить, как различные их параметры влияют на статистическую мощность испытания.
Статистическая мощность аналогична чувствительности. Например, тест на ВИЧ с чувствительностью 80% успешно идентифицирует вирус у 80% людей, которые на самом деле ВИЧ-положительны, но не выявит у остальных 20% ВИЧ-положительных людей. Когда клиническое испытание, оценивающее лечебную терапию, должно достигнуть статистической мощности в 80% (при условии, что терапия имеет реальную пользу для тех, кто ее принимает), в испытании будет 80-процентная вероятность обнаружить пользу и 20-процентная вероятность ее упустить.
Проще говоря, чем больше данных задействовано в испытании, тем большей статистической мощностью оно будет обладать. Такие факторы, как количество участников, число контрольных параметров, продолжительность испытания и частота анализов крови, влияют на статистическую мощность испытания.
Результаты пробного моделирования TVR
В отношении недавнего исследования TVR с участием 13 человек такая модель показала, что при мощности 80% исследование выявило бы только лечение со значительным снижением реактивации (от 70 до 80%). Чтобы исследование TVR выявило снижение реактивации на 30%, потребуется уже по 120 участников в группе терапии и в контрольной группе. Поскольку в большинстве исследований TVR задействовано малое число участников, они, вероятно, не устанавливают умеренных результатов терапии.
Может показаться нелогичным планирование исследования для выявления меньшего эффекта от лечения, когда конечной целью является поиск максимальной пользы (т. е. терапия, приводящая к 100% снижению реактивации). Тем не менее на начальных этапах поиска лекарства необходимо фиксировать даже умеренные результаты, чтобы решить, требует ли этот метод дальнейшего изучения.
Помимо рекомендации увеличить количество участников, команда предлагает использовать ретроспективные контрольные данные в дополнение к контрольным группам. Данные из предыдущих испытаний, в которых люди прерывали АРТ, могли бы повысить потенциал выявления умеренной пользы от лечения. Они смоделировали гипотетическое исследование TVR, в которое вошли 50 участников и 50 человек из контрольной группы. При мощности 80% эта конструкция может обнаруживать снижение реактивации до 43%. Добавление ретроспективных данных еще 150 участников позволило бы в том же испытании выявить снижение до 36%.
Такое моделирование также не показало практически никакого улучшения способности обнаруживать снижение реактивации при увеличении продолжительности испытаний TVR свыше пяти недель. После этого срока модель предсказала улучшение обнаружения не более чем на 1%. Точно так же они не обнаружили практически никакой пользы от проведения лабораторного мониторинга чаще, чем раз в неделю. Наблюдение за людьми два раза в неделю почти не помогло обнаружить снижение реактивации.
Ученые провели отдельный анализ для оценки максимального риска передачи ВИЧ во время исследований TVR на основе предыдущих данных. Они оценили максимальный риск передачи, предполагая, что участники занимались незащищенным сексом и что доконтактная или другие методы профилактики не использовались. Кроме того, если во время еженедельного мониторинга не сообщать пациенту показатель вирусной нагрузки сразу же, то участник, которому необходимо возобновить АРТ (если его вирусная нагрузка превысила 1000), скорее всего, отложит это до следующего еженедельного визита.
Было подсчитано, что в этом случае во время пятинедельного исследования TVR с порогом вирусной нагрузки 1000 для повторного начала АРТ максимальный риск передачи ВИЧ составил 3,6 на 1000 участников, занимающихся вагинальным сексом. При анальном сексе для вводящих партнеров максимальный риск составлял около 7 на 1000, а для принимающих партнеров — около 70 из 1000. Изменение схемы исследования, включающее экспресс-тестирование на вирусную нагрузку и возобновление АРТ в тот же день, снижает предполагаемый максимальный риск до 0,9, 1,8 и 18 на 1000 соответственно.
Результаты моделирования исследования по контрольным величинам
Исследования контрольных точек должны иметь достаточную статистическую мощность, чтобы отделять преимущества предлагаемой лечебной терапии от контроля после лечения. Используя результаты исследования CHAMP, ученые предположили, что исходный уровень контроллеров после лечения ниже 4%. Если целью исследования было определить увеличение количества контролеров до 20% (это означает, что терапия помогла людям, которые не являются естественными контроллерами, подавить вирус), их модель показала, что 24-недельное исследование со статистической мощностью 80% потребует участия 60 пациентов.
Из-за чрезвычайно высоких вирусных нагрузок в типичных исследованиях контрольных величин (до 100 000) авторы сравнили, как использование более консервативного порогового значения (1000) для возобновления АРТ повлияет на способность этих исследований обнаруживать увеличение числа контроллеров после лечения. CHAMP показало, что у 55% контроллеров после лечения первоначальные всплески вирусной нагрузки не превышали 1000 копий/мл, и в дальнейшем они сохраняли вирусную нагрузку ниже этого порога.
Используя эти данные, Лау и Кромер предположили, что использование порога в 1000 копий маскирует 45% естественных контроллеров после лечения, что может помешать обнаружить, когда терапия усиливает иммунный контроль участников над ВИЧ. Чтобы восстановить статистическую мощность, потребуется больше участников. Как и в приведенном выше примере, при мощности 80% и цели выявления 20-процентного повышение числа контроллеров после лечения свыше базового уровня 4%, более низкий порог вирусной нагрузки потребует увеличить количество участников с 60 до 120 как в лечебных, так и контрольных группах.
Как и в случае исследований TVR, ученые также оценили максимальный риск передачи ВИЧ во время определения контрольных величин, используя те же предположения, что и описанные выше (отсутствие стратегий профилактики и экспресс-тестирования на вирусную нагрузку, незащищенный секс, недельная задержка перед возобновлением АРТ). Из-за гораздо большей продолжительности испытаний и высоких пороговых значений вирусной нагрузки (для этого они сослались на исследование контрольных величин, в котором использовали данные 50 000 человек) они оценили максимальный риск передачи ВИЧ как 13 случаев на 1000 при вагинальных половых контактах, около 25 на 1000 — для вводящего партнера при анальном сексе, 214 на 1000 — крайне высокий — для принимающего партнера при анальном сексе.
Предлагаемая гибридная схема испытаний
Основываясь на собственном моделировании и оценках максимального риска передачи, ученые предлагают использовать гибридную модель для анализа прерывания лечения. В озвученной ими схеме прерывания будут начинаться с пятинедельного исследования TVR. Хотя оно, как правило, применяется, когда терапия нацелена на резервуары ВИЧ, у людей, отвечающих на терапию, направленную на усиление иммунитета, также будет наблюдаться более медленное восстановление вируса (если лечение было эффективным).
Начало испытания для оценки потенциального лечения с помощью исследования TVR подвергнет участников гораздо более коротким перерывам в лечении, что позволит исследователям определить, имела ли эта терапия достаточную эффективность, чтобы перейти к более длительному изучению заданных значений. Если медики согласятся с необходимостью дальнейшего исследования, а пациенты с вирусной нагрузкой ниже 1000 согласятся перейти к следующей фазе, они продолжат тщательное наблюдение в течение 24 недель или до тех пор, пока вирусная нагрузка участников не превысит 1000 копий/мл, после чего они возобновят АРТ.
Ученые рекомендуют провести экспресс-тестирование на вирусную нагрузку и возобновить АРТ в тот же день, чтобы свести к минимуму риск передачи инфекции. По их оценке, ограничение контрольной точки теми, кто уже демонстрирует контроль за вирусом, до вирусной нагрузки ниже 1000, снижение порога вирусной нагрузки для возобновления АРТ до 1000, ограничение продолжительности до 24 недель, а также включение тестирования по месту оказания медицинской помощи и возобновление АРТ в тот же день снижают максимальный риск передачи до 0,2 на 1000 при вагинальном сексе, до 0,35 на 1000 — для вводящего партнера при анальном сексе и до 3,1 на 1000 — для принимающего партнера при анальном сексе. И это значительное улучшение показателей по сравнению с оценкой, полученной в ходе традиционных исследований контрольных величин.
Если первоначальное исследование TVR показывает, что лечение не требует дальнейшего изучения (например, если не обнаружено позитивного эффекта), то ученые смогут избежать затрат на проведение длительного исследования контрольных величин.
Выводы
Ученые пришли к выводу, что в испытаниях лекарств недостаточно участников для обеспечения знаковой статистической мощности при умеренных результатах лечения. Поскольку чаще всего при испытаниях терапии также не используются контрольные группы, количественная оценка пользы лечения чрезвычайно сложна. Специалисты рекомендуют сотрудничать всем заинтересованным структурам для создания ретроспективной контрольной базы данных, которая позволила бы разработать схему испытаний, не полностью полагающуюся на контрольные группы плацебо. Тем не менее они отмечают, что задействование ретроспективных контрольных данных означает включение людей, которые с большей вероятностью начали АРТ во время хронической ВИЧ-инфекции, и тех, кто использует более старые схемы АРТ, которые могут действовать как искажающие факторы.
Тем не менее сокращение числа участников, получающих плацебо, снижение пороговых значений вирусной нагрузки, продолжительности испытаний и рисков передачи ВИЧ могут побудить большее число людей с ВИЧ участвовать в исследованиях с прерыванием лечения.
История антиретровирусной (АРВ) терапии едва разменяла третий десяток, но это был колоссальный путь. Если в 1996 году пациентам были доступны только токсичные и малоэффективные лекарства, которые нужно было пить каждый день и горстями, то уже сейчас вовсю испытывают инъекции, способные подавлять размножение вируса на несколько месяцев. Но это на западе.
Если вы живете в России, то таблетки все еще нужно пить каждый день и (часто) горстями. Тем временем, весь мир стремительно переходит на комбинированные препараты. Сейчас их нельзя назвать революцией в терапии ВИЧ-инфекции, но комбинированные формы - их еще называют таблетками “все в одном” – определенно гораздо лучше обычной АРВ-терапиии.
Во-первых, они берут количеством: для подавления вирусной нагрузки человек принимает всего одну таблетку в день вместо четырех – восьми. Благодаря этому людям, живущим с ВИЧ, не приходится подчинять свое расписание приёму лекарств, не приходится таскать с собой мешок таблеток на случай, если ночуешь не дома, не приходится испытывать столько дискомфорта при проглатывании таблеток (да, для некоторых людей это стресс), не приходится ловить на себе косые взгляды и объяснять случайным людям особенности своего диагноза.
Приверженность к лечению – аккуратный и ежедневный прием лекарств –главное условие успешной терапии ВИЧ-инфекции. Чтобы ее достичь, таблеток в схеме должно быть меньше.
Плохая новость: в России пока недоступны все комбинированные формы, которые есть в мире. Но нужно подготовиться к тому, что когда-то они будут и у нас. Поэтому мы решили вспомнить историю таблеток “все в одном” с момента их появления.
Все больше исследований доказывают, что терапия ВИЧ-инфекции таблетками “все в одном” показывает лучшие результаты, чем схемы с несколькими таблетками, прежде всего, благодаря большей приверженности: у таких пациентов меньше случаев прерываний терапии и достоверно чаще отмечается неопределяемая вирусная нагрузка. Широкое внедрение “монорежимов” – это не прихоть, а необходимость.
Атрипла
Препарат одобрен Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) США 12 июля 2006 года.
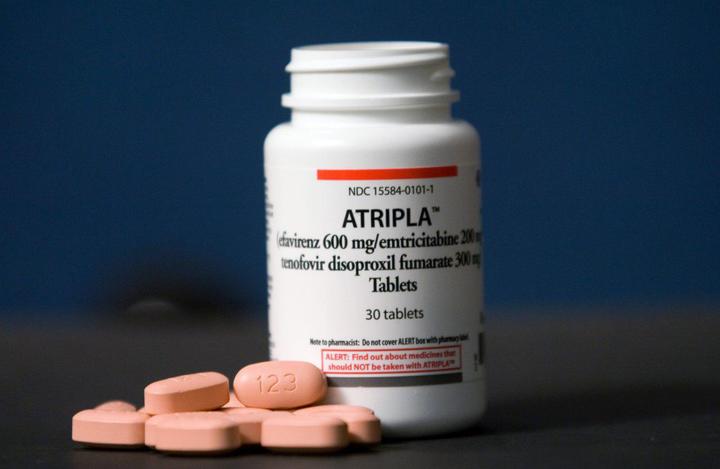
Ветеран монорежима представляет собой комбинацию из 200 мг эмтрицитабина, 300 мг тенофовира дизопроксила фумарата (TDF) и 600 мг эфавиренза. Препарат имеет ряд побочных эффектов. Среди них головокружение, головная боль, боли в животе. Длительный прием TDF может негативно влиять на состояние костей и почек. Препарат рекомендуют принимать на пустой желудок или с пищей (нежирной) – в зависимости от реакции организма. Лекарство также может взаимодействовать с другими препаратами.
Несмотря на все недостатки, Атрипла остается одним из двух препаратов “все в одном”, которые доступны в России.
Эвиплера/ Комплера
Препарат одобрен FDA в августе 2011 года.
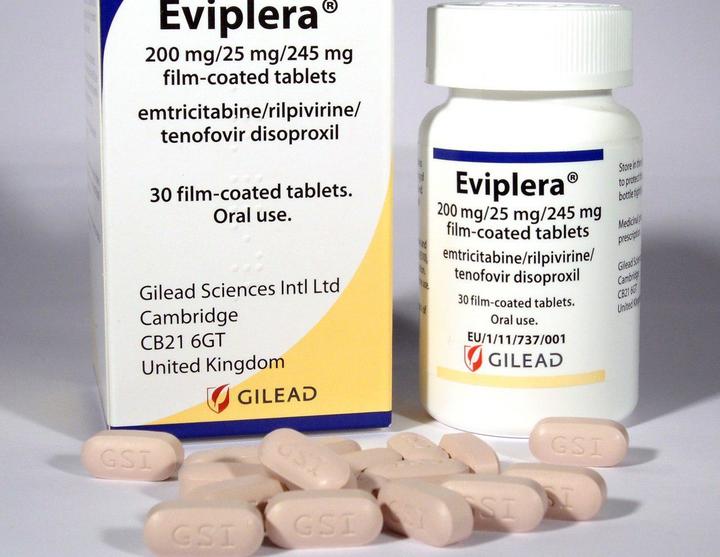
Содержит 200 мг эмтрицитабина, 300 мг TDF и 25 мг рилпивирина. Принимают с едой. Препарат подходит как для новичков, которые раньше не принимали терапию, так и для тех, кто хочет перейти на него с другой схемы лекарств.
Побочные эффекты (повышенный уровень холестерина, потеря аппетита, депрессия, слишком яркие сны, тошнота, рвота, головные боли) выражены меньше, чем у Атриплы, за счет содержания рилпивирина вместо эфавиренза.
Эвиплеру стоит с осторожностью принимать с препаратами против эпилепсии (карбамазепин, окскарбазепин, фенобарбитал), антибиотиками для лечения туберкулеза (рифампицин, рифабутин) и со зверобоем. Действие препарата также могут блокировать лекарства от изжоги (Гевискон, Ренни), препараты из группы омепразола. Поэтому пациентов настоятельно просят сообщать врачу, принимают ли они лекарства для желудка, даже если это происходит не ежедневно.
Второй и пока последний в списке препарат, доступный в России.
Стрибилд (Стрибильд)
Препарат одобрен FDA в августе 2012 года.
Комбинация 200 мг эмтрицитабина, 300 мг TDF, 150 мг элвитегравира и 150 мг кобицистата (препарат-бустер). Принимают один раз в день с едой.
Побочные эффекты схожи с Эвиплерой. Противопоказано пить препарат одновременно с добавками, содержащими кальций, железо, магний, алюминий или цинк. Промежуток между приемом должен составлять не менее 4 часов. Совместный прием гормональных препаратов требует консультации специалиста.
Триумек (Трайомек)
Препарат одобрен FDA в августе 2014 года.
Объединяет 50 мг долутегравира, 600 мг абакавира и 300 мг ламивудина. Лекарство нужно принимать с едой или без еды, но лучше утром, поскольку вечерний прием долутегравира может вызвать бессонницу.
Помимо стандартных побочных эффектов (сонливость, депрессия, головная боль) выделяют боли в суставах, ринит, кашель, желудочный рефлюкс и потерю аппетита. Как и Стрибилд, Триумек плохо сочетается с препаратами кальция и железа. Кроме того, абакавир и долутегравир могу вызывать аллергическую реакцию.
Генвойя
Препарат одобрен FDA в ноябре 2015 года.
Генвойя – это 200 мг эмтрицитабина, 10 мг тенофовира алафенамида (TAF), 150 мг эльвитрагравира и 150 мг кобицистата. Принимается с едой.
Побочные эффекты фактически аналогичны тем, что наблюдаются у Стрибилда, но с небольшой разницей. В составе Генвойи содержится так называемый “новый” тенофовир. При равном противовирусном эффекте и практически одинаковой цене, схема с TAF имеет значительно меньше побочных эффектов. Благодаря этому FDA исключило из аннотации к препарату предупреждение о негативном воздействии на костную ткань. Стоит отметить, что в США уже обновляют рекомендации по лечению ВИЧ-инфекции, где Стрибилд отходит на второй план как устаревший, а предпочтение отдают Генвойе.
Одефси
Препарат одобрен в марте 2016 года.
Состоит из 25 мг рилпивирина, 200 мг эмтрицитабина и 25 мг TAF. Аналог Эвиплеры/Комплеры, но с “новым” тенофовиром вместо “старого”.
Принимают один раз в день с пищей. Побочные эффекты и рекомендации по лекарственной сочетаемости аналогичны Эвиплере. Одефси, как и Генвойя, гораздо меньше влияет на состояние почек и костей за счет содержания TAF.
Не рекомендуется применять совместно с омепразолом (препарат для лечения гастрита и язвы). Кроме того, некоторые антибиотики для лечения туберкулеза могут снижать уровень TAF.
Юлука (Джулука)
Препарат одобрен FDA в ноябре 2017 года.

Первый полный безнуклеозидный режим терапии, в котором содержится только два препарата вместо трёх и более, как в стандартных схемах лечения ВИЧ-инфекции. Содержит 50 мг долутегравира и 25 мг рилпивирина. Подходит для продолжения терапии пациентов, чья вирусная нагрузка стабильно подавлена последние полгода или дольше.
Побочные эффекты те же, что и у долутегравира и рилпивирина. Но уже сейчас специалисты FDA отмечают, что токсичность препарата ниже, чем у классических схем из трех-четырех препаратов. Это связано с меньших количеством действующих веществ и отсутствием в схеме нуклеозидных (нуклеотидных) аналогов.
Перед началом приёма стоит исключить мутации вируса, которые ведут к резистентности к рилпивирину.
Биктарви
Препарат одобрен FDA в феврале 2018 года.
Содержит 200 мг эмтрицитабина и 25 мг TAF и 50 мг нового препарата под названием биктегравир. Известно, что производитель биктегравира пока не собирается выпускать его в форме отдельной таблетки – только в составе комбинированной формы.
Новый препарат считается одним из самых минимальных по количеству действующего вещества. При приеме "Биктарви" рекомендуют контролировать функцию почек.
Symfi и Symfi Lo
Препарат одобрен FDA в марте 2018 года.

Symfi включает 600 мг эфавиренза, 300 мг ламивудина и (внезапно) 300 мг TDF. Symfi Lo содержит 400 (а не 600) мг эфавиренца, 300 мг ламивудина и 300 мг TDF. Принимать рекомендуют натощак.
За счёт содержания TDF препарат может вызывать проблемы с почками и костями. У некоторые пациентов на фоне приёма препарата развивается депрессия.
У Symfi Lo лучше переносимость, благодаря меньшей дозе эфавиренза.
Symtuza
Препарат одобрен FDA в июле 2018 года.
Новейший препарат включает 800 мг дарунавира, 150 мг кобицистата, 200 мг эмтрицитабина и 10 мг TAF.
Противопоказания и побочные эффекты аналогичны препаратам с теми же действующими веществами. Однако токсичное влияние на почки и скелет ниже, благодаря малому содержанию тенофовира.
При этом, кобицистат может усиливать действие других препаратов, потенциально увеличивая риск серьезных побочных эффектов.

Ученые из Gilead Sciences разработали и протестировали антиретровирусный препарат нового класса — небольшую молекулу, которая нарушает работу белка капсида ВИЧ и препятствует размножению вируса на разных этапах. Исследователи провели первую фазу клинических испытаний с однократной инъекцией препарата — он оказался безопасным, эффективным и оставался в крови в течение полугода. Авторы статьи, опубликованной в журнале Nature, считают, что препарат будет полезен для пациентов, у которых выработалась множественная лекарственная устойчивость, а также для профилактики для людей из групп риска.
Современные антиретровирусные препараты спасают жизни миллионов людей с вирусом иммунодефицита человека (ВИЧ) и защищают тех, кто находится в группе риска, однако вирус активно мутирует и может приобретать устойчивость к лекарствам. Людям, вирус которых резистентен к нескольким классам антиретровирусных препаратов, сложно, а иногда и невозможно подобрать лечение. Кроме того, лекарства в форме таблеток необходимо принимать ежедневно, а пропуски повышают вероятность размножения и мутации ВИЧ. Поэтому необходимо искать препараты новых классов, которые будут действовать долго и подавлять вирус по другому механизму.
Ученые из американской биофармацевтической компании Gilead Sciences под руководством Стивена Янта (Stephen Yant) исследовали действие небольшой молекулы GS-6207 — ингибитора белка вирусного капсида. Сначала тестировали его влияние на скорость сборки капсида и на размножение ВИЧ в культурах различных иммунных клеток человека.
GS-6207 ускорял сборку белков капсида, из-за чего вирусные оболочки деформировались. Препарат оказался более действенным, чем все одобренные антиретровирусные препараты: его полумаксимальная эффективная концентрация для клеток, зараженных ВИЧ, составила 105 пикомолей на литр в культуре T-хелперов, 32 и 56 пикомолей на литр — в культуре первичных T-клеток и макрофагов. GS-6207 был эффективен против двух основных форм вируса — ВИЧ-1 и ВИЧ-2, в том числе против типов вируса, устойчивых к современным лекарствам. Кроме того, препарат практически не оказывал цитотоксического действия на человеческие клетки.

Капсиды ВИЧ: нормальный, при связывании с GS-6207, незрелый
John Link et al. / Nature, 2020
С помощью рентгеноструктурного анализа исследовали структуру GS-6207, связанного с белком капсида. Молекула по форме хорошо подходила участку белка, с которым соединялась, взаимодействовала с ним через электростатические и гидрофобные связи и соединяла два соседних мономера — получалась петля, которой нет в нормальной структуре белка.

Строение белка капсида и место связывания GS-6207
John Link et al. / Nature, 2020
Эксперимент с клетками на разных стадиях инфицирования показал, что GS-6207 эффективен как на ранних, так и на поздних этапах репликации вируса, хотя более действенен на ранней стадии. Сравнив динамику действия препарата с ингибиторами обратной транскриптазы и интегразы, исследователи предположили, что GS-6207 действует после обратной транскрипции, но до интеграции вирусной ДНК в геном. Возможно, препарат не дает вирусной ДНК проникнуть в ядро, так как этот процесс связан с белком капсида.
Ученые также оценили, как вирус вырабатывает устойчивость к ингибитору белка капсида. Для этого культуры клеток заражали ВИЧ-1 и добавляли к ним GS-6207, через некоторое время выделяли его и вводили в культуру клеток, растущих в среде с удвоенной концентрацией препарата. Процедуру повторяли десять раз в течение трех месяцев, на каждом этапе секвенировали вирусную РНК и определяли эффективность GS-6207.
После четвертой пересадки в среду с большей концентрацией препарата в белке капсида стали появляться мутации, из-за которых вирусы приобрели устойчивость к GS-6207, но не другим антиретровирусным лекарствам. У мутировавших вирусов была снижена способность к репликации.
Наконец, исследователи провели первую фазу клинических испытаний GS-6207 — рандомизированное, плацебо-контролируемое двойным слепым методом исследование. На первом этапе (исследовании однократных нарастающих доз) 32 здоровым добровольцам однократно вводили различные дозы препарата (от 30 до 450 миллиграмм, большую дозу вводили после того, как убедились, что предыдущая не вызывала нежелательных реакций), а восьми — плацебо. На втором этапе такие же дозы GS-6207 вводили 24 ВИЧ-положительным пациентам (еще восьми вводили плацебо)
GS-6207 оказался безопасным и хорошо переносимым - самыми серьезными побочными эффектами были покраснение и боль в месте укола, которые проходили через несколько дней. Среднее время полужизни вещества в организме составило 38 дней, оно медленно и продолжительно проникало в кровь из места введения. При дозе более 100 миллиграммов концентрация препарата в крови была эффективной (подавляла размножение вируса на 95 процентов) в течение 12 недель, а при дозе больше 300 миллиграмм — 24 недель. В зависимости от дозы у ВИЧ-инфицированных пациентов логарифм числа вирусных частиц в плазме снизился в 1,35-2,2 раза за девять дней.

Концентрация препарата в крови при разной дозе (по горизонтальной оси недели)
Читайте также:

