Типичная форма инфекции что это такое
Обновлено: 24.04.2024
Татьяна Владимировна Спичак, профессор, доктор медицинских наук:
В сегодняшней лекции я хотела бы коснуться ряда вопросов, связанных с атипичными инфекциями. Они по-прежнему продолжают волновать многих практикующих врачей. Ни для кого из нас не секрет, что успех лечения инфекции дыхательных путей в значительной мере определяется достоверностью этиологической диагностики.
С этим вопросом у нас, к сожалению, особенно в амбулаторной практике дело обстоит не очень благополучно. Если говорить о распространенности атипичных инфекций у детей, то литературные источники приводят нам достаточно большой разброс данных.
Мы знаем, что острый бронхит, как правило, обусловлен вирусной этиологией болезни. Что касается атипичных возбудителей, то с. Pneumonia и m. Pnemoniae диагностируют в 4% и 17% случаев.
При внебольничной пневмонии микоплазменная инфекция встречается у детей от 7% до 27%. А инфекция с. Pneumonia в 6% или 32%.
В последнее время большое внимание уделяется ассоциациям пневмококковой и атипичной инфекции, которые по данным наших зарубежных коллег составляют от 8% до 23%. Мы неспроста затрагиваем этот вопрос, потому что (как мы убедились на собственном опыте) ассоциация пневмококковой и микоплазменной инфекции действительно приводит к более тяжелому течению пневмонии по сравнению с монобактериальной этиологией пневмонии.
Всем хорошо известно, что этиологическая структура пневмонии имеет определенную возрастную зависимость, которая распространяется и на атипичные возбудители. По крайней мере, микоплазменную инфекцию чаще диагностируюn у детей 2-4-х лет и подростков.
С. Trachomatis, как правило, диагностируют у детей первого полугодия жизни. С. Pneumonia инфицирует чаще всего детей старше пяти лет. Хламидийная инфекция может произойти в любой последующий период жизни.
Появилось много литературных данных о роли хламидийной инфекции при бронхиальной астме у детей, особенно при ее тяжелом течении. Но если обратить внимание на представленную таблицу, мы видим очень большой разброс данных по частоте встречаемости хламидийной инфекции при бронхиальной астме. Причем зачастую несопоставимых из-за того, что используются разные методы исследований.
Кроме того, я хотела бы обратить внимание не только тех, кто получает из этой лекции просто информацию, но и тех, кто проводит подобные исследования. Очень важно иметь контрольную группу. К сожалению, во многих исследованиях это отсутствует.
Диагностика атипичных инфекций остается достаточно сложной по сегодняшний день. Это связано с тем, что при данных инфекциях отсутствуют специфические клинические и рентгенологические признаки, которые помогли бы нам в этиологической диагностике.
Главным образом это касается респираторно-хламидийной инфекции. Микоплазменную инфекцию мы еще можем как-то заподозрить по клиническим признакам, основываясь на своеобразных крепитирующих мелкопузырчатых влажных хрипах, нередко ассиметричных. По маловыразительной рентгенологической картине, при которой, как правило, мы наблюдаем усиление мелких элементов легочного рисунка. В большинстве случаев отсутствуют типичные легочные инфильтрации.
Основными методами диагностики атипичных инфекций являются лабораторные методы диагностики. Несмотря на большое число существующих методов, которые, казалось бы, должны нам помогать в диагностике этих инфекций, здесь тоже есть определенные проблемы.
Наибольшее распространение получили иммунологические методы исследования. В последнее время все чаще и шире используется полимеразная цепная реакция. Культуральный и морфологический методы используются, главным образом, в научных целях.
Я хотела бы обратить ваше внимание на то, что, несмотря на многообразие методов исследования, чувствительность и специфичность таковы, что ни один из методов не позволяет нам выявлять возбудитель в 100% случаев. Нам приходится пользоваться, как минимум, двумя методами исследования по более достоверной диагностике.
Есть проблема. Все перечисленные методы исследования могут нам давать либо ложноположительные, либо ложноотрицательные результаты. Это вполне естественно чревато либо лечением псевдобольных, либо распространением инфекции у нераспознанных больных.
Иммунологические методы основаны на использовании диагностикумы на основе родо- и видоспецифических антигенов. На выявлении специфических антител в сыворотке крови и секретах инфицированного организма в процессе иммунного ответа не внедрение возбудителей.
Из этих методов рекомендуется в настоящее время пользоваться методом микроиммунофлюоресценции (МИФ) и иммуноферментным анализом (ИФА).
Методы имеют безусловные достоинства. Прежде всего, возможность избежать ложноотрицательных результатов. В ряде случаев определить стадию заболевания. Но серьезным недостатком метода серологической диагностики является ретроспективная диагностика. Антитела класса М появляются лишь на пятый день от начала болезни.
Мы не можем ставить диагноз на основании данных методов исследования в более ранние сроки. Антитела класса М могут самостоятельно исчезнуть через 2-3 месяца, даже не прибегая к лечению. Что касается антител класса А, то они появляются гораздо позже – на 5 – 14 день – и тоже, как правило, исчезают через 2-3 месяца, но уже при условии проведения специальной терапии.
Если этого не происходит, то обнаружение антител класса А в более поздние сроки указывает на хроническую или персистирующую инфекцию.
Самыми последними появляются антитела класса G. На 15 – 20 день. Особенностью этих антител является то, что они могут сохраняться в низких титрах на протяжении ряда лет, отражая так называемую следовую реакцию после перенесенной инфекции.
Что касается диагностики микоплазменной инфекции, то следует обратить внимание на то, что при данной инфекции наблюдается длительная циркуляция АТ класса М. Для данной инфекции характерно большее развитие острых процессов. А реинфицирование отмечается редко.
Для выявления антигена возбудителя используют метод иммунофлюоресцентной микроскопии. К сожалению, этот метод не лишен недостатков, поскольку его чувствительность невысока, специфичность зависит от навыков персонала.
Полимеразная цепная реакция. Как известно, метод относится к молекулярно-биологическим. Основан на выявлении в составе биологического материала фрагментов ДНК или РНК, специфических для вида возбудителя. Этот метод отличает высочайшая чувствительность и специфичность. С помощью данного метода мы можем диагностировать на ранних стадиях болезнь и выявлять минимальное количество возбудителей вне зависимости от его жизнеспособности.
К сожалению, и этот метод не лишен недостатков. Мы имеем возможность получить и ложноположительные результаты в силу такой высокой чувствительности метода. Любая загрязняющая ДНК может дать нам такой результат.
Реакция может быть подавлена биологическим материалом. Это может привести к ложноотрицательному результату.
Показания к назначению лечения при атипичных инфекциях достаточно традиционные. Принято лечить острую инфекцию, реинфекцию и обострение хронической инфекции. Казалось бы, все просто. Но, к сожалению, достаточно непросто в реальной жизни определить стадию болезни и правильно сориентироваться с лечением, руководствуясь не только теми результатами, которые мы получаем на листах бумаги.
При диагностике респираторной хламидийной инфекции многие клиницисты до сих пор используют критерии Грейстона (Grayston G. T.). Они основаны на результатах реакции по определению специфических антител класса М и G. При выявлении специфических антител класса М и высоких титров антител класса G или при четырехкратном увеличении титра антител класса G в парных сыворотках можно говорить об острой инфекции.
При реинфекции хламидийной инфекции антитела класса М отсутствуют. Но наблюдается быстрое, буквально в течение одной-двух недель, появление антител класса G. Или также как при острой инфекции четырехкратное увеличение в парных сыворотках.
Но поскольку речь идет о лечении детей, то мы предъявляем особые требования к антибактериальным препаратам. Они должны быть не только эффективными, но и максимально безопасными. Наш выбор сводится к макролидным препаратам.
Я не буду останавливаться на классификации макролидов. Она вам прекрасно известна. Хочу еще раз подчеркнуть их уникальные свойства как группы антибактериальных препаратов. Они относятся к числу наиболее безопасных антибиотиков и являются тканевыми антибиотиками, поскольку концентрация в инфицированных тканях во много раз превышает сывороточные.
Фармакодинамика современных макролидов позволяет их назначать 2-3 раза в сутки, что повышает комлпаентность.
Данная группа препаратов обладает уникальным постантибиотическим эффектом. Даже после прекращения введения антибактериального препарата, сохраняясь в инфицированных тканях, препарат продолжает еще обеспечивать терапевтические концентрации в течение еще 5-7 дней.
По сравнению с четырнадцатью членами макролидов его характеризует низкая частота лекарственных взаимодействий, хороший профиль безопасности и низкий уровень приобретенной резистентности.
В отношении длительности курсового лечения при атипичных инфекциях принято во многих руководствах пользоваться десятидневными курсами лечения макролидными препаратами. Но некоторые руководства предлагают более длительные курсы лечения в течение 2-3 недель. Полагают, что это позволит осуществить профилактику персистирующей или хронической инфекции.
Подобное лечение острых инфекций может вызвать вполне оправданные возражения.
Что касается хронической инфекции (а здесь речь идет о хронической хламидийной инфекции), то приняты более длительные трехнедельные курсы лечения.
Оценка эффективности терапии осуществляется по исчезновению антигенового возбудителя, по снижению или исчезновению титра специфических антител. Я неспроста обращала ваше внимание на особенности динамики антителообразования при атипичных инфекциях. Контрольное исследование следует проводить не ранее, чем через 2-3 месяца.
В заключение я хотела бы привести результаты недавно завершенного нами исследования по определению этиологической структуры внебольничных пневмоний у детей и оценке эффективности рациональной антибиотиковой терапии.
Для этих целей мы использовали ПЦР-диагностику. Определили специфические антитела указанных классов методом ИФА.
Из 63-х детей у 57-ми был определен инфекционный патоген, что обеспечило 90,5% выявления этиологически значимого агента.
По совокупности лабораторных методов исследования современная этиологическая структура внебольничной пневмонии у детей по нашим данным выглядит следующим образом. Мы видим, что пневмококк остается лидирующим или весьма значимым типичным бактериальным патогеном при внебольничных пневмониях.
В то же время мы видим, что высока частота и микоплазменных инфекций при пневмонии у детей. Этого нельзя сказать о хламидийных пневмониях, потому что их частота не превышала в наших данных 14%. В каждом седьмом случае мы имели дело со смешанной бактериальной инфекцией при внебольничной пневмонии, обусловленной, главным образом, сочетанием пневмококка и микоплазменной инфекции.
Течение пневмонии было более тяжелым, чем при монопневмококковой инфекции.
Наши наблюдения (несмотря на то, что когда мы уточнили этиологию, группы оказались не такими многочисленными) позволили отметить особенности внебольничных пневмоний, на которые обращают внимание в современных руководствах. По крайней мере, в зарубежных.
Действительно в первые дни маловыразительная клиническая картина. Достаточно редко определяются хрипы и типичная физикальная симптоматика. Но у большинства детей присутствует синдром дыхательных расстройств. Это, в первую очередь, касается пневмококковых пневмоний. В меньшей степени это касается микоплазменной и хламидийной пневмонии.
Синдром дыхательных расстройств, который ведет в число наиболее достоверных диагностических и клинических признаков, в большей степени работает у детей до пяти лет. Дети с микоплазменной и хламидийной пневмонией в нашем наблюдении были школьного возраста.
При лечении внебольничных пневмоний мы поступали также, как поступают все практикующие врачи. Мы назначали антибактериальную терапию эмпирически, в соответствии с принципами рациональной антибиотиковой терапии до получения результатов проведенных нами биологических и других исследований.
В заключение я хотела бы сказать о том, что атипичные инфекции остаются достаточно хорошо распространенными у детей и подростков при инфекциях дыхательных путей. Если мы хотим повысить эффективность и улучшить диагностику атипичных инфекций, то нам надо обращать внимание на микробиологические лаборатории, на то оборудование, на котором они работают, и на приобретение качественных тест-систем.
Мы можем сказать, что макролидные антибиотики являются препаратами выбора при инфекции дыхательных путей и внебольничной пневмонии. В первую очередь, в период сезонных вспышек микоплазменной или хламидийной инфекции. А также у детей, имеющих признаки аллергии на бета-лактамные антибиотики.
Классификация ( формы ) инфекционных заболеваний. Экзогенные инфекции. Эндогенные инфекции. Регионарные и генерализованные инфекции. Моноинфекции. Микстинфекции.
Инфекционные болезни обычно сопровождаются нарушениями гомеостаза организма и его физиологических функций. Множество взаимодействующих параметров в системе конкретный возбудитель-конкретный организм находит отражение в различных формах инфекционного процесса и его вариантах. Другими словами, в зависимости от эпидемиологической ситуации, типа и свойств возбудителя (например, инфицирующей дозы, вирулентности и т.д.), состояния параметров гомеостаза человека, а также от конкретных особенностей взаимодействия возбудителя и организма инфицированного человека, инфекционный процесс может принимать различные формы (от клинически выраженных до бессимптомных, от суперинфекций до бактерионосительства). Ниже рассмотрены основные формы инфекционных процессов.
Экзогенные инфекции. Эндогенные инфекции.
Экзогенные инфекции развиваются в результате проникновения в организм патогенных микроорганизмов из внешней среды.
Эндогенные инфекции обычно развиваются в результате активации и, реже, проникновения условно-патогенных микроорганизмов нормальной микрофлоры из нестерильных полостей во внутреннюю среду организма (например, занос кишечных бактерий в мочевыводящие пути при их катетеризации). Особенность эндогенных инфекции — отсутствие инкубационного периода.

Регионарные инфекционные заболевания. Генерализованные инфекции
• Регионарные инфекционные заболевания — инфекционный процесс протекает в каком-либо ограниченном, местном очаге и не распространяется по организму.
• Генерализованные инфекционные заболевания развиваются в результате диссеминирования возбудителя из первичного очага, обычно по лимфатическим путям и через кровоток.
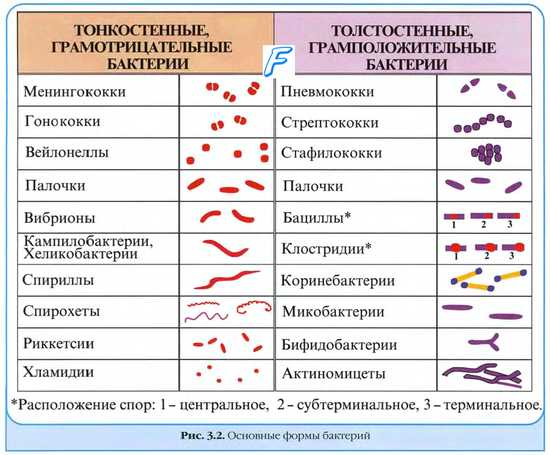
Моноинфекции. Микстинфекции ( миксты )
Моноинфекции — заболевания, вызванные одним видом микроорганизмов.
Смешанные инфекции ( микстинфекции, миксты ) развиваются в результате заражения несколькими видами микроорганизмов; подобные состояния характеризует качественно иное течение (обычно более тяжёлое) по сравнению с моноинфекцией, а патогенный эффект возбудителей не имеет простого суммарного характера. Микробные взаимоотношения при смешанных (или микст-) инфекциях вариабельны:
• если микроорганизмы активизируют или отягощают течение болезни, их определяют как активаторы, или синергисты (например, вирусы гриппа и стрептококки группы Б);
• если микроорганизмы взаимно подавляют патогенное действие, их обозначают как антагонисты (например, кишечная палочка подавляет активность патогенных сальмонелл, шигелл, стрептококков и стафилококков);
• индифферентные микроорганизмы не влияют на активность других возбудителей.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Основные понятия
Заражение — это состояние заражения макроорганизма микроорганизмом, результат антагонистических взаимоотношений между ними, возникающих в окружающей среде.
Инфекционный процесс — это процесс взаимодействия микроорганизма и макроорганизма со всеми изменениями, происходящими в последнем (в результате прямого или косвенного действия микроорганизма и его токсических и других продуктов).
Суперинфекция — из-за повторного заражения тем же патогеном у нелеченного пациента.
Повторное заражение — из-за болезни по той же причине вскоре после выздоровления.
Смешанная инфекция — заболевание вызывается 2 и более возбудителями.
Вторичная инфекция — при одной инфекции добавляется вторая инфекция, вызванная другим микроорганизмом.
Миксинфекция — заболевание как инфекционное, так и неинфекционное.
Эндогенная инфекция — заболевание вызывается микроорганизмами, которые встречаются в макроорганизмах (из нормальной, условно-патогенной флоры).
Внутрибольничная инфекция — заражение произошло во время оказания медицинской помощи больным.
Типы инфекций
Воздушные инфекции — ветряная оспа, корь, эпидемический паротит, грипп, скарлатина, дифтерия, коклюш, менингококковая инфекция, туберкулез, краснуха, оспа у обезьян, легионеллез.
Кишечные инфекции — полиомиелит, вирусный гепатит А, ротавирусный гастроэнтерит, холера, брюшной тиф, шигеллез, сальмонеллез, бруцеллез, орнитоз, лептоспироз, кампилобактериоз, иерсиниоз, ботулизм.
Трансмиссивные инфекции — сыпной тиф, болезнь Брилля-Цинсера, возвратный сыпной тиф, волёская лихорадка, малярия, висцеральный лейшманиоз, вирусный энцефалит, вирусная геморрагическая лихорадка, вирусные лихорадки, болезнь Лайма, чума, туляремия, лихорадка Ку, марсельская лихорадка, американский кожный лейшманиоз.
Инфекции оболочки — трахома, инфекционные дерматозы, бильхарциози, анкилостомидози, бешенство, сибирская язва, сап, стопа, содоку, болезнь кошачьих царапин, мелиоидоз, столбняк, газовая гангрена, бластомикоз, аспергиллез, кокцидиоидомикоз.
Инфекции, передающиеся половым путем — сифилис, гонококк, венерическая лимфогранулема, трихомониаз, инфекции HHV1 и HHV2, урогенитальный хламидиоз, урогенитальный микоплазмоз, чесотка.
Инфекции с множественными механизмами передачи — вирусные гепатиты B, C, D, G, ВИЧ- инфекция, листериоз, токсоплазмоз.
Инфекции с недостаточно ясным механизмом передачи — медленные инфекции, болезнь Крейтцфельда-Якоба — человеческий вариант, болезнь Кавасаки, болезнь Крейтцфельда-Якоба — животный вариант.
Какие назначения необходимы при подозрении на инфекцию нижних дыхательных путей? Какие патогенные факторы играют существенную роль? Как вести больных? Респираторные заболевания являются частой причиной обращения к врачу в Великобритании,
Какие назначения необходимы при подозрении на инфекцию нижних дыхательных путей?
Какие патогенные факторы играют существенную роль?
Как вести больных?
 |
Респираторные заболевания являются частой причиной обращения к врачу в Великобритании, причем в большинстве случаев они относятся к инфекционным [1]. Трем четвертям пациентов, обращающихся с признаками острого заболевания нижних дыхательных путей, врач общей практики назначает антибиотики, хотя лишь в немногих случаях удается выделить возбудителя и антибиотики или вообще не влияют, или мало влияют на естественный ход заболевания [2,3].
Назначая антибиотики, врач руководствуется ожиданиями пациента и старается действовать согласно определенной терапевтической стратегии, хотя зачастую, выписывая рецепт, чувствует, что при этом состоянии антибиотики будут неэффективны [4,5].
Причины, по которым пациент первый раз приходит на прием к своему врачу и затем повторно обращается за консультацией, довольно сложны и часто никак не соотносятся с течением болезни. Как правило, они обусловлены обеспокоенностью своим здоровьем или давлением со стороны друзей, семьи и сотрудников.
При необходимости назначить антибиотик для лечения инфекции нижних дыхательных путей обычно выбирают амоксициллин. Пациенты, повторно обращающиеся к врачу, скорее всего, получат другой антибиотик, например эритромицин или новейшее средство из группы макролидов, хинолонов или пероральный цефалоспорин [3,6].
Проведенные нами недавно исследования показали, что повторное обращение пациентов с инфекциями нижних дыхательных путей, уже получивших назначения на первичном приеме, никак не связано с антибиотикотерапией. Только у 4% таких больных сохранялась бактериальная инфекция и ни у одного из них не было устойчивости к амоксициллину [7]. Повторно приходить на прием побуждают пациентов немедицинские факторы, такие как привычка обращаться к врачу.
Таблица 1. Почему пациенты повторно обращаются к врачу при острой инфекции нижних дыхательных путей
- Пациент неверно представляет себе естественное течение болезни
- Пациент продолжает беспокоиться по поводу симптомов болезни
- Пациенту нравится ходить на прием к врачу
- По настоянию членов семьи, друзей, сотрудников
- У пациента появились соображения, касающиеся важности симптомов
- Инфекция хронизируется или к ней присоединяется другая инфекция
- Проявляется серьезное основное заболевание
При повторном обращении по поводу респираторного заболевания врач общей практики прежде всего должен попытаться установить причину такого обращения (табл. 1). Вполне возможно, что оно вызвано необоснованными ожиданиями пациента, и наилучшим средством здесь было бы объяснение нормальных сроков выздоровления от простуды. Или же есть какое-то основное заболевание, не распознанное на первичной консультации, например астма, недолеченное хроническое обструктивное легочное заболевание, рак или бронхоэктазы.
В том случае если врач считает, что причина в продолжающейся инфекции, необходимо определить возможного возбудителя и выбрать соответствующий антибиотик (табл. 2). Ниже мы обсудим некоторые сложные случаи, которые необходимо иметь в виду [8,9]. Однако нужно помнить, что наиболее распространенными возбудителями остаются Streptоcoccus pneumoniae и респираторные вирусы, а сложные случаи составляют скорее исключение, чем правило в ежедневной общей практике.
Пенициллин-резистентный Streptococcus pneumoniae. Хотя число случаев развития лекарственной устойчивости неуклонно возрастает и представляет серьезную проблему для целого ряда европейских стран, в Англии антибиотикорезистентность пока не считается причиной неудачного лечения инфекций дыхательных путей. Нужно убеждать врачей общей практики проводить пневмококковую вакцинацию населения, входящего в группу риска, а антибиотики назначать строго по показаниям и в адекватной дозе.
Амоксициллин-резистентный Haemophilus influenzae. Haemophilus influenza (Hi) является частой бактериальной причиной обострения хронических обструктивых заболеваний легких (ХОЗЛ), а также вызывает персистирующий бронхит у здоровых взрослых людей. Некоторые антибиотики, такие как эритромицин и цефалоспорины первого поколения, недостаточно эффективны в отношении Hi. Наличие b-лактамазы объясняет отсутствие реакции на амоксициллин. Такие штаммы называются амоксициллин-резистентными Hi (АRHi).
Таблица 2. Возможная причина отсутствия цикла терапии острой инфекции нижних отделов дыхательных путей, назначенной на первом приеме*
Заболеваемость, обусловленная АRHi, растет и составляет сегодня в Великобритании 10-25% общего числа респираторных заболеваний в зависимости от региона. В других странах, таких как Испания, Португалия и некоторые районы Франции, уровень лекарственной устойчивости гораздо выше — это нужно иметь в виду в тех случаях, когда пациент мог заразиться зарубежом.
Об этом возбудителе следует помнить, если у пациента с ХОЗЛ после лечения часто повторяющимися курсами амоксициллина сохраняются симптомы заболевания и гнойная мокрота. В данном случае целесообразным будет недельный курс хинолона или коамоксиклава. От назначения ципрофлоксацина следует воздержаться, если пациент принимает теофиллин.
Moraxella catarrhalis. Некоторым название этого микроорганизма может показаться незнакомым, поскольку раньше его относили к роду Neisseria вида Branhamella.
Это грамотрицательный диплококк, входящий в нормальную микрофлору молодых и пожилых людей. Вслед за Haemophilus influenza и Streptococcus pneumoniae он является третьей по распространенности причиной обострения ХОЗЛ и часто поражает пациентов с тяжелыми хроническими легочными заболеваниями или раком легких.
Обнаружение этого микроорганизма служит показателем тяжести процесса. Сообщалось о недавнем наблюдении 42 случаев пневмонии, вызванной M. catarrhalis, когда около половины пациентов погибло от основного заболевания в течение трех месяцев после обнаружения инфекции.
Важно и то обстоятельство, что практически все штаммы сегодня являются b-лактамазопродуцирующими и соответственно амоксициллинорезистентными. Имеется предположение, что b-лактамаза, продуцируемая M. Catarrhalis, обеспечивает устойчивость к амоксициллину в норме чувствительных респираторных возбудителей, таких как S. pneumoniae и H. influenzae. Проводимая терапия не отличается от той, которая применяется в случаях АРHi (см. выше).
Pseudomonas aeruginosa. Об этом возбудителе нужно помнить в связи с возможностью развития бронхоэктазов и кистозной болезни. Стоит один раз заразиться Pseudomonas aeruginosa, и рецидивы могут следовать один за одним. В настоящее время единственным эффективным пероральным средством является ципрофлоксацин, но к нему быстро развивается устойчивость, и пациентов приходится госпитализировать для проведения внутривенной антибиотикотерапии и физиотерапии.
Другие бактериальные возбудители. Изредка выделяют грамотрицательную кишечную палочку, или Staphylococcus aureus. Эти возбудители чаще связаны с больничными пневмониями, но иногда обнаруживаются у пациентов, недавно выписавшихся из больницы.
Под атипичными обычно подразумеваются инфекции, вызываемые Mycoplasma pneumoniae, Chlamydia psittaci, Chlamydia pneumoniae, Coxiella burnetti и Legionella pneumophila. Лихорадка Q, возбудителем которой служит Coxiella burnetti, встречается редко (как правило, в сельской местности), поэтому не будет упоминаться в дальнейшем. Все атипичные инфекции трудно поддаются распознаванию на ранних стадиях; серологические исследования, проведенные как в острый период, так и в период реконвалесценции, редко дают положительный ответ и не представляют клинической ценности.
Ни один из возбудителей атипичных инфекций не поддается воздействию b-лактамных антибиотиков, что объясняет отсутствие эффекта от назначения амоксициллина.
Mycoplasma pneumoniae. Эпидемия, вызванная этим возбудителем, случается каждые три-четыре года, и в такой период может составлять значительную часть всех респираторных заболеваний.
Обычно она охватывает школьников, студентов и людей среднего возраста; маленькие дети и старики страдают редко.
В отличие от бактериальных инфекций, заболевание начинается постепенно, через 10-14 дней после заражения, проявляясь сухим кашлем или выделением скудной чистой мокроты. Общее недомогание и повышение температуры тела обычно умеренные, при исследовании грудной клетки обнаруживаются незначительные изменения. Иногда такие проявления, как сыпь, буллезный мирингит, а также выявление холодовых агглютининов помогают поставить диагноз.
Микоплазменную инфекцию следует заподозрить, если взрослый человек, до этого не жаловавшийся на здоровье, при отсутствии серьезных патологических симптомов и признаков интоксикации не поддается лечению амоксициллином. В этом случае имеет смысл попробовать назначить антибиотик из группы макролидов; альтернативный подход — тетрациклины. Кашель, как правило, медленно поддается лечению.
Хламидии. Большинствo врачей общей практики время от времени сталкиваются со случаями пситаккоза, вызванного длительным контактом с какой-нибудь любимой домашней птичкой. В последние годы установлено, что наиболее распространенным возбудителем инфекций дыхательных путей является Chlamydia pneumoniae, передающаяся от человека к человеку [10]. Эта инфекция проявляется такими же стертыми симптомами, как и микоплазменная, среди которых выделяются кашель и фарингит. Но, в противоположность микоплазменной инфекции, данное заболевание поражает и пожилых людей, часто вследствие реинфекции.
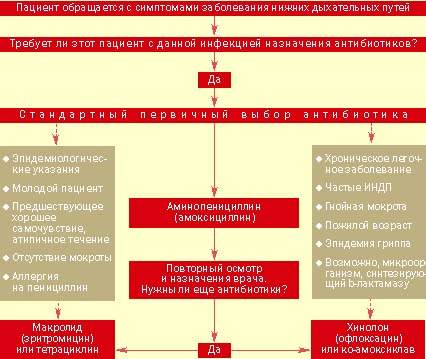 |
| Рисунок 2. Тактика ведения больного с выраженными клиническими показаниями для назначения антибиотиков при остром заболевании нижних дыхательных путей |
В некоторых исследованиях обнаружена связь между Chlamydia pneumoniaе и болезнями коронарных артерий и бронхиальной астмой, возможно обусловленная наличием хламидиального антигена, прикрепляющегося к эндотелию и эпителию. Рекомендуемое лечение — антибиотик из группы макролидов или тетрациклинов.
Legionella pneumophila. Болезнь легионеров все еще находится в центре внимания. Легионелла — редкий возбудитель пневмонии, развивающейся в местах большого скопления людей. Похоже, что легионелла не вызывает такие менее тяжелые заболевания дыхательной системы, как бронхит или инфекции верхних дыхательных путей. Состояние пациентов с болезнью легионеров достаточно тяжелое; обычно им требуется лечение в условиях стационара.
Известна связь этого заболевания с зараженными легионеллами источниками воды, поэтому упоминание пациента о заграничной поездке, пребывании в отеле или больнице, ванне джакузи помогает врачу общей практики правильно поставить диагноз. Нередко встречаются такие осложнения, как дыхательная недостаточность и энцефалит, поэтому все больные, даже в сомнительных случаях, должны быть направлены на госпитальное обследование.
- Практические советы по ведению больных с инфекциями дыхательных путей
Назначение антибиотиков. Подход к ведению больных с острыми инфекциями нижних дыхательных путей представлен на рис. 2. Ключевым моментом является принятие решения о назначении или неназначении антибиотиков. Большинство врачей общей практики считают необходимым применение антибиотиков при серьезных системных нарушениях, постоянном выделении гнойной мокроты, появлении местных признаков поражения легких и отягощенности предшествующими заболеваниями. Если уже решено использовать этот вид лечения, выбор нужного препарата не представляет особого труда.
 |
| Рисунок 3. Пациентам, входящим в группу риска, необходимо провести пневмококковую вакцинацию |
В большинстве случаев назначается амоксициллин. Согласно последним рекомендациям, доза амоксициллина принята равной 500 мг (а не 250 мг, как было раньше), чтобы снизить частоту развития резистентности пневмококков. Однако эта проблема лучше разрешается путем уменьшения общего количества назначений антибиотиков при инфекциях нижних дыхательных путей.
Врач общей практики не должен рекомендовать больному прием антибиотиков просто потому, что это самый легкий способ, или в случае, когда нет четких клинических показаний для их назначения. Проблемы резистентности возбудителей инфекций дыхательных путей решаются при назначении антибиотиков, обусловленном строгими показаниями. Снабжение пациентов простыми информационными листками значительно снижает необходимость повторных консультаций.
Литература
1. Office of Population Censuses and Surveys. Morbidity statistics from general practice: foutrh national study 1992. London: HMSO, 1995 (Series MB5;3).
2. Orr P. H., Scherer K., Macdonald A., Moffatt M. E. Randomosed placebo controlled trials of antibiotics for acute bronchitis: a critical review of the literature. J Fam Pract 1993; 36:507–512.
3. Macfarlane J. T., Holmes W. F., Macfarlane R. M., Lewis S. Contemporary use of antibiotics in 1089 adults presenting with acute lower respiratory tract illness in general practice in the UK: implications for developing managment guidelines. Respiratory Medicine, 1997; 91:427–434.
4. Holmes W. F., Macfarlane J. T., Macfarlane R. M., Lewis S. The influence of antibiotics and other factors on reconsultation for acute lower respiratory tract illness in primary care. Br J Gen Pract (in press).
5. Macfarlane J. T., Holmes W. F., Macfarlane R. M. Acutr lower respiratory tract illness in general practice; a study of the view on 787 patients and their influence on antibiotic prescribing. BMJ, 1997; 315:1211–1214.
6. Macfarlane J. T, Colville A., Guion A., Macfarlane R. M., Rose D. H. Prospective study of aetiology and outcome of adult lower respiratory tract infection in the community. Lancet, 1993; 341:511–514.
7. Macfarlane J., Prewett J., Rose D., Gard P., Guion A., Cunnigham R., Myint S. A prospective, case control study of the aetiology of community acquired lower respiratory tract infections in adult who felt to improve with initial antibiotics. BMJ, 1997; 315:1206–1210.
8. Venkatesan P., Innes J. A. Antibiotic resistance in common acute respiratory pathogenes. Thorax, 1995; 50:481–483.
9. Anon. Lower respiratory tract infections. MeReC Bulletin 1994; 5:5–8.
10. Torres A., ElEbiary M. Relevance of Chlamydia pneumoniae in community acquired respiratory infections. Eur Respir J, 1993; 6:7–8.
11. Macfarlane J. T., Holmes W. F., Macfarlane R. Reducing reconsultations for acute lower respiratory tract illness with an information leaflet. Br J Gen Pract, 1997; 47:710–722.
- заболевания, вызываемые неустановленным возбудителем (около 70% случаев);
- острые кишечные инфекции, вызываемые установленным возбудителем (около 20%);
- бактериальная дизентерия (около 10%).
Важно, что в наиболее обширную группу ОКИ неустановленной этиологии входят и большинство так называемых пищевых токсикоинфекций (ПТИ) — эту группу составляют приблизительно 20 этиологически разных, но патогенетически и клинически сходных заболеваний, не представляющих эпидемической опасности.
Более чем в половине случаев этиологию ОКИ не удается установить ни клинически, ни лабораторно. Эта задача, равно как и выбор патогенетического лечения, тем более не может быть решена (да и не ставится) на этапе догоспитальной помощи. Усилия врача скорой медицинской помощи (СМП) должны быть направлены на:
- коррекцию тяжелых нарушений жизненно важных функций организма больного;
- дифференцирование инфекционного, терапевтического или хирургического генеза заболевания;
- решение вопроса о необходимости госпитализации больного для специализированного лечения или проведения противоэпидемических мероприятий.
Клиническая картина ОКИ
ОКИ — заболевания различной этиологии и семиотики — объединяют общий для всех этих состояний, преимущественно фекально-оральный, способ передачи возбудителя и развитие вследствие этого характерного симптомокомплекса острой диареи (табл. 1).
ПТИ также относятся к БД, так как вызываются условно-патогенными бактериями и в ряде случаев имеют групповой, эксплозивный характер. Однако в подавляющем большинстве случаев ПТИ протекают спорадически с развитием острого гастрита, гастроэнтерита или гастроэнтероколита, с той или иной степенью обезвоживания и интоксикации и имеют благоприятный прогноз.
При диарее вирусной этиологии (ВД) целостность слизистой оболочки желудочно-кишечного тракта в большинстве случаев не нарушается и в процесс редко вовлекается толстая кишка. Инкубационный период, как правило, более короткий, чем при эпидемической БД. Острый вирусный гастроэнтерит, хотя и сопровождается лихорадкой и нарушением общего состояния больного, редко приводит к тяжелой интоксикации, развитию выраженной воспалительной реакции и дегидратации организма больного. К числу значимых дифференциальных критериев ВД можно отнести отсутствие при этих заболеваниях выраженной боли в животе, водянистый, а не слизисто-гнойный и кровавый характер испражнений. ВД нередко сопровождается острым респираторным заболеванием, особенно у детей. Продолжительность ВД редко превышает 3 дня, и в целом заболевание имеет благоприятный прогноз. Пациенты с относительно легким течением ВД в госпитализации не нуждаются.
Из ОКИ паразитарного происхождения (ПД) наибольшее клиническое значение имеют амебиаз и лямблиоз. Известно, что клиническая картина амебной дизентерии развивается приблизительно у 10% инфицированных амебой больных. Амебный колит характеризуется сильнейшей болью в животе, лихорадкой и кровавой диареей, которая чревата перфорацией толстой кишки. Генерализация амебиаза сопровождается септикопиемией с образованием абсцессов печени, легких или головного мозга и крайне неблагоприятным прогнозом для жизни больного. Заболевание носит эндемичный характер. Лямблиоз на территории России распространен очень широко и в 25-50% случаев приводит к развитию острого или хронического энтерита, сопровождающегося диареей. Наибольшую помощь в постановке доклинического диагноза при ПД может оказать тщательный сбор анамнеза настоящего заболевания и анамнеза жизни пациента, поскольку особую группу риска образуют лица, практикующие анальные сексуальные контакты.
В современной классификации ОКИ выделяют так называемые особые формы заболевания:
- диарея путешественников;
- диарея у мужчин-гомосексуалов;
- диарея у ВИЧ-инфицированных;
- антибиотико-ассоциированная диарея;
- синдром избыточного роста бактерий в желудочно-кишечном тракте.
Из особых форм ОКИ для практики врача СМП имеет значение лишь один из вариантов антибиотико-ассоциированной диареи — псевдомембранозный колит. Это заболевание развивается во время или значительно после приема антибактериальных препаратов и связано с колонизацией кишечника условно-патогенным микроорганизмом сlostridium difficile. Протекает псевдомембранозный колит с высокой лихорадкой, кровавой диареей, болью в животе и сопровождается существенной интоксикацией со всеми возможными осложнениями острой профузной диареи. При подозрении на псевдомембранозный колит больной должен быть госпитализирован в инфекционный стационар.
Доклиническая и дифференциальная диагностика ОД
Всестороннее изучение анамнеза настоящего заболевания является первым шагом в обследовании пациентов, имеющих характерные признаки ОКИ (табл. 1).
У больных необходимо выяснить:
- когда и как началось заболевание (например, внезапное или постепенное развитие заболевания, наличие инкубационного или продромального периода);
- характер испражнений (водянистые, кровянистые, с примесью слизи или гноя, жирные и т. д.);
- частоту стула, количество и болезненность испражнений;
- наличие симптомов дизентерии (лихорадка, тенезмы, примесь крови и/или гноя в испражнениях).
В беседе с больным очень важно установить наличие и, что особенно существенно, развитие субъективных и объективных проявлений обезвоживания (жажды, тахикардии, ортостатических реакций, уменьшения диуреза, вялости и нарушений сознания, судорог, снижения тургора кожи) и интоксикации (головной боли, тошноты, рвоты, мышечных болей).
На догоспитальном этапе ОКИ необходимо дифференцировать с рядом острых неинфекционных заболеваний хирургического, терапевтического, гинекологического и иного профиля. Единственной целью дифференциального диагноза в данном случае является выбор направления госпитализации больного. Основные критерии для проведения дифференциального диагноза отражены в предлагаемом нами алгоритме догоспитальной медицинской помощи (рис. 2).
Распространенность ошибочной диагностики ОКИ иллюстрируют данные DuPont H. L. (1997). Предоставленные автором данные анализа более 50 тысяч случаев госпитализации больных с ОКИ констатируют, что в 7,4% случаев этот диагноз был установлен при таких заболеваниях, как острый аппендицит, острый холецистопанкреатит, странгуляционная кишечная непроходимость, тромбоз мезентериальных сосудов, инфаркт миокарда, крупозная пневмония, декомпенсация сахарного диабета, гипертонический криз. Напротив, указанные выше заболевания были ошибочно диагностированы у больных с ОКИ в 11,1% случаев.
Догоспитальная терапия ОД
Наибольшую угрозу для пациентов с ОКИ представляет развитие дегидратации и ассоциированной с ней артериальной гипотензии на фоне интоксикации, провоцирующей падение артериального давления и нарушение функции центральной нервной системы. Объем догоспитальной терапии при ОКИ базируется на мониторинге жизненно важных функций организма больного: состоянии сознания и функции внешнего дыхания, уровне АД и гидратации пациента. При наличии соответствующего оснащения бригады СМП терапия клинически значимой гиповолемической и инфекционно-токсической артериальной гипотензии должна осуществляться под контролем центрального венозного давления. В соответствии со стандартными рекомендациями терапия на этом этапе направлена:
- на восстановление сердечного ритма;
- на оптимизацию объема циркулирующей крови;
- на устранение гипоксии и нормализацию кислотно-щелочного равновесия;
- на проведение инотропной/вазопрессорной терапии.
Для устранения гипоксии больному назначают оксигенотерапию газовой смесью с 35%-ным содержанием кислорода.
Регидратацию больного начинают с диагностики обезвоживания, тяжесть которой может варьировать от I до IV степени (табл. 2).
При дегидратации I и II степеней (85-95% больных ОКИ) восполнение потери жидкости может и должно осуществляться оральным путем. ВОЗ рекомендует применять для оральной регидратации растворы следующей прописи: 3,5 г NaCl, 2,5 г NaHCO3 (или 2,9 г цитрата натрия), 1,5 г KCl и 20 г глюкозы или ее полимеров (например, 40 г сахарозы, или 4 столовые ложки сахара, или 50-60 г вареного риса, кукурузы, сорго, проса, пшеницы или картофеля) на 1 л воды. Это позволяет получить раствор, содержащий приблизительно 90 ммоль Na, 20 ммоль K, 80 ммоль Cl, 30 ммоль HCO3 и 111 ммоль глюкозы. Можно с успехом использовать любой из готовых растворов для оральной регидратации (цитроглюкосалан, регидрон, гастролит). Количество выпитой жидкости должно в 1,5 раза превышать ее потери с испражнениями и мочой. Компенсация обезвоживания сопровождается очевидным уменьшением жажды, нормализацией диуреза и улучшением общего состояния больного.
Дегидратация III и IV степеней, выраженная тошнота или рвота, а также бессознательное состояние больного требуют неотложной инфузионной терапии. Для внутривенной регидратации используют полиионные кристаллоидные растворы: трисоль, квартасоль, хлосоль, ацесоль. Менее эффективно введение моноионных растворов (физиологического раствора хлорида натрия, 5%-ного раствора глюкозы), а также несбалансированных полиионных растворов (раствора Рингера, мафусола, лактасола). Коллоидные растворы (гемодез, реополиглюкин, рефортан) вводят только в случаях упорной гипотонии, после восстановления объема циркулирующей крови в целом. В тяжелых случаях инфузия водно-электролитных смесей начинается с объемной скоростью 70-90 мл/мин, при средней тяжести состояния больного — с объемной скоростью 60-80 мл/мин. В ряде случаев необходимая скорость инфузии обеспечивается путем одновременного вливания в 2-3 вены. После стабилизации артериального давления скорость инфузии снижается до 10-20 мл/мин. Для предотвращения прогрессирования обезвоживания, развития гемодинамической недостаточности, отека легких, пневмонии, ДВС-синдрома и острой почечной недостаточности объем жидкости, вводимой после стабилизации состояния больного, может составлять 50-120 мл на 1 кг веса.
Назначение антибактериальной терапии среднетяжелых и тяжелых ОКИ на доклиническом этапе не только не входит в задачи врача СМП, но и категорически противопоказано, поскольку может существенно ухудшить состояние больного и затруднить лабораторную верификацию возбудителя заболевания. Возрастающая угроза инфекций, вызванных антибиотико-резистентными штаммами микроорганизмов, наличие нежелательных реакций при применении антимикробных препаратов, суперинфекция, связанная с эрадикацией нормальной микрофлоры антибактериальными средствами, и возможность индукции антибиотиками некоторых факторов вирулентности у энтеропатогенов (например, индукция фторхинолонами фага, ответственного за продукцию шигеллезного токсина), заставляют тщательно взвешивать все за и против при решении вопроса об антимикробной терапии и назначать ее только после точной диагностики возбудителя ОКИ. В связи с вышеизложенным антибактериальные препараты особенно не рекомендуются при гастроэнтеритическом варианте ОД любой степени тяжести, при легком, стертом течении колитического варианта и в период реконвалесценции при любой форме кишечного заболевания.
Эмпирическое назначение антибиотиков возможно в случае легкопротекающей и среднетяжелой ОКИ любой этиологии, а также при диарее путешественников, наиболее вероятным возбудителем которой являются энтеротоксигенные штаммы E.coli или другие бактериальные патогены. В этом случае взрослым назначают фторхинолоны, а детям — ко-тримоксазол, применение которых позволяет сократить длительность заболевания с 3-5 до 1-2 дней. Этой категории больных, как правило, не нуждающихся в госпитализации, можно рекомендовать амбулаторный прием антисептиков кишечного действия: эрцефурила, интетрикса или энтероседива в стандартных дозах в течение 5-7 дней, а также препаратов неантимикробного действия, облегчающих течение диареи (табл. 3).
Столь же опасным, как антибиотики, в отношении усугубления интоксикации является применение при ОКИ любого клинического течения сильных противодиарейных препаратов (имодиума) и противотошнотных средств (церукала, торекана).
Особое значение при ОКИ имеет коррекция микробиоценоза кишечника пробиотиками, проводимая на различных этапах лечения: в остром периоде — в целях конкурентного вытеснения патогенной микрофлоры, у реконвалесцентов — для обеспечения реабилитационных процессов. Весьма эффективно раннее, не позже второго дня болезни, назначение бифидумбактерина форте в ударных дозах (по 50 доз 3 раза каждые 2 часа в первый день лечения) с последующим приемом поддерживающих доз (30 доз в день, по показаниям — до 6 дней).
Пробиотик IV поколения бифидумбактерин форте обеспечивает высокую локальную колонизацию слизистой оболочки кишечника, элиминацию патогенной и условно-патогенной микрофлоры. Положительный клинический эффект при сальмонеллезе средней тяжести отмечен через 1-2 дня, при тяжелом течении сальмонеллеза и дизентерии — к окончанию курса. Из пробиотиков, приготовленных на основе микроорганизмов рода Bacillus, препаратом выбора является биоспорин, назначаемый по 2 дозы 2-3 раза в день в течение 5-7 дней. Препарат обладает выраженным антибактериальным, антитоксическим и иммуномодуляторным действием, индуцирует синтез эндогенного интерферона, стимулирует активность лейкоцитов крови, синтез иммуноглобулинов. При преобладании энтеритического синдрома рекомендуется энтерол, получаемый из сахаромицетов Буларди. Он назначается по 250 мг 2 раза в день в течение 5 дней. В периоде реконвалесценции наряду с традиционными патогенетическими средствами (стимуляторами репарации, общего и местного иммунного ответа) целесообразно применение препаратов облигатной флоры, оптимально — бифидумбактерина форте, оказывающего стабилизирующее влияние на микробиоценоз кишечника и гомеостатические процессы.
Несмотря на расширение возможностей по верификации возбудителя и большой выбор методов этиопатогенетической терапии, появившихся в арсенале врача за последние 20 лет, ОКИ и сегодня по-прежнему сопряжены с высокой летальностью. Так, по данным Н. Д. Ющука, при ПТИ и сальмонеллезе летальность составляет около 0,1%, а при дизентерии — 1,4%, при этом причиной 20% летальных исходов при бактериальной дизентерии и 44,4% летальных исходов при всех остальных ОКИ является инфекционно-токсический шок. Причины столь высокой летальности, вероятно, кроются в неадекватной оценке прогноза и тяжести состояния больного ОКИ и неоказании ему, в том числе по причинам недостаточного инструментального, медикаментозного и информационного обеспечения, неотложной помощи именно на догоспитальном этапе. Хочется надеяться, что предложенный нами простой алгоритм догоспитальной медицинской помощи при ОД (рис. 2) окажется небесполезным для практикующих врачей и их пациентов.
Читайте также:

