Типичные места обитания кишечной палочки в лпу
Обновлено: 23.04.2024
Знакомьтесь с героиней нашего сегодняшнего повествования – синегнойной палочкой или Pseudomonas aeruginosa (P.aeruginosa).
Материалы предназначены исключительно для врачей и специалистов с высшим медицинским образованием. Статьи носят информационно-образовательный характер. Самолечение и самодиагностика крайне опасны для здоровья. Автор статей не дает медицинских консультаций: клинический фармаколог — это врач только и исключительно для врачей.
Автор: врач-клинический фармаколог Трубачева Е.С.
Знакомьтесь с героиней нашего сегодняшнего повествования – синегнойной палочкой или Pseudomonas aeruginosa (P.aeruginosa).
.jpg)
И, воспользовавшись ситуацией, мы поговорим о микробиологической безопасности лечебных учреждений, ведь именно этот возбудитель до сих является одним из лидеров внутрибольничных инфекций, особенно в условиях реанимационных, хирургических, онкологических и ожоговых отделений, и, казалось бы, эта проблема не решаемая. О том, как победить этого зверя-убийцу и не разорится, мы сегодня и поговорим.
Микробиологические аспекты
Pseudomonas aeruginosa – это аэробная грамотрицательная палочка, с одним или двумя полярно расположенными жгутиками, которая может расти и размножаться и в анаэробных условиях.
Это один из немногих возбудителей, который угадывается в прямом смысле носом – инфицированная рана издает совершенно неповторимое амбрэ, которое не перепутаешь ни с чем, если услышал хотя бы один раз. Причем больной обнаруживается в прямом смысле по запаху от двери не то, что палаты, а от входа в лечебное отделение. Для тех, кто пока ни разу не сталкивался, – он слышится как запах сладкой карамели с аммиаком, вызывающий отчетливые рвотные позывы (хотя последнее строго индивидуально). Некоторые ощущают его как аромат жасмина в аммиаке. Запах очень специфический и способен играть серьезную диагностическую роль, а уж если к нему в дополнение идут сине-зеленые повязки, и это не вылитый ранее флакон зеленки, то перед вами на 99,9% рана, инфицированная P.aeruginosa. Согласитесь, это важно, особенно в условиях как недостатка микробиологических лабораторий, так и широкого распространения возбудителя в стационарах.
Дикая почвенная синегнойка, являющаяся родоначальницей всех внутрибольничных форм, будет выглядеть следующим образом. Как вы можете видеть, убить ее можно абсолютно всем с применением обычных терапевтических дозировок. (картинка 1)
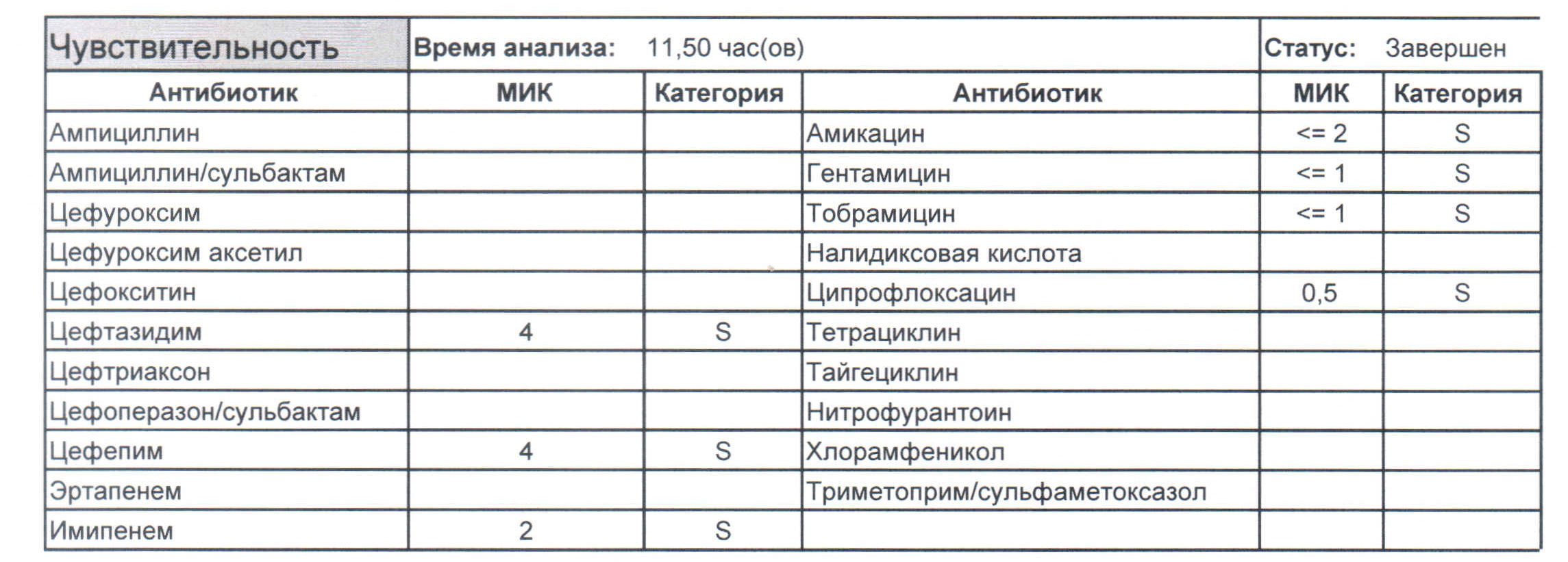
В природе синегнойная палочка обитает в почве и воде, при этом она непривередлива в плане питательных веществ (в дистиллированной воде растет и размножается до 2,5 месяцев, хотя и снижает свою активность в десять раз). Поэтому идеальной средой ее обитания будет та локализация в организме, где темно, тепло и сыро, а именно – раны, нижние дыхательные пути, мочевыводящие пути и все те полости, в которые можно установить катетеры. Конечно, самостоятельно палочка туда не заползет, у нее нет ножек, зато мы – медицинский персонал, не соблюдая правила обработки рук и имея единственного больного в отделении, к концу смены обсеменим всех, особенно если в ординаторских и сестринских используются общие, а не одноразовые бумажные, полотенца.
P.aeruginosa очень любит, когда вокруг нее тепло (30 – 37 0 С), темно и сыро. Соответственно, самое чистое время года с точки зрения риска принести дикую уличную палочку в стационар – это зима. И если зимой в вашем на 100% чистом стационаре с внутренним микробиологическим контролем вдруг пациент, простите, завонял – ищите любителя-огородника с рассадой на подоконнике. Достаточно такому садоводу-огороднику один раз по приходу на работу не отмыть правильно руки и пойти на перевязку – больной с синегнойной (или ацинетобактерной, а то и вообще микст) инфекцией на ровном месте будет обеспечен. А если все остальные так же правильно не помыли руки или вытерлись общим полотенцем – чистый стационар очень быстро станет стационаром с синегнойкой.
Синегнойная палочка является активным пленкообразователем. В этом процессе участвует вырабатываемая микробом внеклеточная слизь, покрывающая саму клетку тонким слоем. Процесс пленкообразования условного возбудителя наглядно показан на данном видео. Как мы обсуждали ранее, микробы – это не статичные существа, которые всю жизнь питаются и размножаются, они способны вести достаточно бурную социальную жизнь, и синегнойная биопленка тому наглядный пример, поэтому о ней стоит поговорить поподробнее. Когда палочка прикрепляется к поверхности, она тут же образует монослой из микроколоний, покрытых экзополисахаридом. Затем бактерии образуют множество пилей, которыми скрепляются в том числе и друг с другом и вся структура образует полисахаридную матрицу. Когда биопленка созреет (это занимает в среднем неделю), то она становится эластичной и упругой, напоминая резину или силиконовую стельку, и точно так же обеспечивает защиту включенных в нее микроорганизмов от воздействий антибиотиков, антисептиков, дезенфектантов и иммунных клеток организма хозяина. При этом внутри самой биопленки бактерии активно обмениваются факторами вирулентности и антибиотикорезистентности и отшнуровывающиеся в последующем от пленки новые палочки будут обладать всем набором факторов защиты, характерным для материнской биопленки. Так выглядит один из способов получения вооруженной до зубов внутрибольничной микрофлоры, которая убивает пациентов и которую фактически невозможно убить в пациентах в виду как недоступности для действующих агентов (биопленка), так и в виду наличия механизмов антибиотикорезистентности, вплоть до металло-бета-лактамаз, разрушающих все до одного существующих антибиотика и большое число антисептиков и дезенфектантов.
Почему же P.aeruginosa так полюбила больницы? Да потому что здесь, в отличие от дикой среды обитания, для нее созданы идеальные условия, как в плане климата и питательных веществ, так и в плане окружения – зверю практически не требуется бороться за свое выживание с другой микрофлорой, фактически всегда за счет своих свойств синегнойка получает селективное преимущество перед другими возбудителями, которых успешно травят антисептиками, антибиотиками, заключительной дезинфекцией и УФ-излучением, оставляя сегодняшней героине расчищенную от конкурентов территорию.
Где же в стационаре создаются условия для размножения и распространения инфекции? Для этого необходимо знать следующие свойства P.aeruginosa:
Таким образом, исходя из вышесказанного, любимыми местами обитания в стационарах являются все то, что создает оптимальную для обитания теплую и влажную среду, а именно:
- краны, раковины, кафель и стыки между ними у раковин и моек, сан. узлы, тряпочные общие полотенца ординаторских и сестринских
- медицинское оборудование, создающее теплую и влажную среду (аппараты ИВЛ, наркозные аппараты, аппараты для проведения диализа, испарители всех типов)
- кондиционеры открытого типа, хотя и за сплит-системами необходим постоянный уход и дезинфекция
- посуда для сдачи анализов
- руки мед. персонала
- общие, а не одноразовые полотенца
То есть любимыми отделениями для обитания в стационаре будут ожоговые и хирургические (практически все, а не только гнойная хирургия и травматология), отделения реанимации и интенсивной терапии и хирургический блок. Особняком стоят пульмонологические отделения с пациентами с муковисцидозом и онкологические стационары. При этом синегнойка может оказаться совершенно в любом отделении, переехав туда на руках медицинского персонала и разбежавшись по больным уже через тамошнее общее полотенце. Поэтому первый и главный шаг на пути борьбы с распространением синегнойной инфекции – это наши руки, точнее, правильная их обработка. После КАЖДОГО пациента. И не протирание полотенчиком на обходе, а полноценное мытье, после которого хотя бы самому себе можно сказать, что уж ты-то точно сделал все, что было возможно.
Клинические аспекты
Какие пациенты более всего чувствительны к P.aeruginosa и когда вообще ждать именно ее:
Какую патологию чаще всего вызывает (а лучше сказать, осложняет) P.aeruginosa
То есть почти любая область поражения и это говорит нам о крайней необходимости микробиологической диагностики, так как почти точно такой же набор может вызвать нозокомиальный золотистый стафилококк или ацинетобактер.
Эпидемиологические аспекты
Как уже выше было неоднократно сказано – P.aeruginosa умеет поражать практически все, до чего сможет добраться, а уж убивать, да в своих нозокомиальных формах, когда из биопленок вылупились и распространились супермутанты, тем более. Вопрос в том, что делать, ведь ситуация кажется безнадежной. Но это не так.
Вылечить больных мы, конечно, можем, но только в том случае, если перед нами дикая и непуганая P.aeruginosa с улицы. Если случилось так, что в вашем стационаре она живет годами и смогла инфицировать пациента (а сама она не может, ее надо донести на чьих-то медицинских руках или до пациента, или до аппарата, который используется у этого пациента), то тут фармакология почти бессильна, так как внутрибольничные палочки умеют разрушать все до одного антибиотика, имеющегося на рынке, а новых уже лет 10 не было, и неизвестно когда будут, если вообще будут. Поэтому единственным барьером встает эпидемиологический надзор. Причем синегнойку, в отличие от фекальной микрофлоры, из стационара выбить можно полностью, так как в норме она не является элементом нормальной микрофлоры человека, как та же кишечная палочка, клебсиелла или энтерококки, то есть в людях в норме она не живет.
Почему в этой статье нет антибиотикограмм устойчивых форм? Ответ до банальности прост – автор долгое время проработала в стационаре, свободном от синегнойки. Это достижимо, и от P.aeruginosa можно освободится даже в самом запущенном случае, что не будет стоить колоссальных денег, при том, что в перспективе высвобождаются действительно серьезные средства, которые ежегодно тратятся на тушение пожара антибиотиками, что в случае внутрибольничных инфекций равноценно тушению бензином. Для достижения полного антисинегнойного эффекта необходимо:
- Правильно мыть руки после каждого пациента
- Менять перчатки после каждого пациента (вместе с мытьем рук)
- Прекратить практику использования общих полотенец и полотенец на обходе
- Ввести тотальный микробиологический мониторинг
- Если есть эпидемиолог, с него требовать доступ к антисептикам и дезенфектантам нескольких видов, а также постоянное наличие одноразовых расходных материалов (это его вопрос, как он будет с начальством договариваться, но все одноразовое обязано быть одноразовым и в достаточных количествах – так как отодрать синегнойную пленку обычными методами, как вы видели, фактически нереально)
- В идеале всю группу антисинегнойных препаратов необходимо вывести из общебольничного оборота и назначать только специально обученным клиническим фармакологом. Таким образом, удастся снизить антимикробную нагрузку на внутрибольничную флору, уменьшить ее селективность и снизить вероятность селекции нозокомиальных штаммов самой P.aeruginosa
В заключении хотелось бы отметить еще раз – данная статья не про то, как победить синегнойку голыми руками антибиотиками. Этого еще пока никому не удавалось, так как проблема не в одном больном с диким возбудителем. От антибиотиков в этом деле зависит процента два в лучшем случае (приблизительно столько диких форм к вам может прийти за год). Проблема носит глубокий системный характер, и без усилий по освобождению всего стационара от P.aeruginosa, использование только и исключительно антибиотиков на каждый случай, особенно внутрибольничного инфицирования, будет сизифовым трудом с соответствующим печальным результатом.
Этой статьей мы начинаем рассмотрение представителей микробиологического мира, с которыми чаще всего встречаем в ежедневной клинической практике, и темой сегодняшнего разговора будет кишечная палочка, она же Escherichia coli (E.coli).
Материалы предназначены исключительно для врачей и специалистов с высшим медицинским образованием. Статьи носят информационно-образовательный характер. Самолечение и самодиагностика крайне опасны для здоровья. Автор статей не дает медицинских консультаций: клинический фармаколог — это врач только и исключительно для врачей.
Автор: Трубачева Е.С.,
врач – клинический фармаколог
Этой статьей мы начинаем рассмотрение представителей микробиологического мира, с которыми чаще всего встречаем в ежедневной клинической практике, и темой сегодняшнего разговора будет кишечная палочка, она же Escherichia coli (E.coli).
Микробиологические аспекты
E.coli относится к типичным представителям семейства Enterobacteriaceae, являясь грамотрицательной бактерией, факультативным анаэробом в составе нормальной кишечной микрофлоры человека. Но тут же становится патогеном, выбравшись из среды нормального обитания, хотя отдельные штаммы являются патогенными и для желудочно-кишечного тракта. То есть кишечная палочка относится к кишечным комменсалам, кишечным патогенам и внекишечным патогенам, каждый из которых мы кратко разберем.
К штаммам E.coli, действующим как кишечные патогены и встречающимся чаще других, относятся:
- Штамм серотипа O157:H7 (STEC O157) или так называемый энтерогеморрагический штамм E.coli, который является причиной 90% случаев геморрагических колитов и 10% случаев гемолитико-уремического синдрома. Встречается достаточно часто, а если вы работаете в стационарах плановой помощи, то это один из обязательных анализов для принятия решения о госпитализации, так что так или иначе он на слуху. Проблема инфицирования этим возбудителем связана с употреблением плохо термически обработанной пищи и передачи штамма контактным путем от человека к человеку, проще говоря, через руки.
- Второй крайне опасный высоко-патогенный штамм кишечной палочки – O104:H4, вызвавший в Германии 2011 году эпидемию с высоким уровнем смертности среди пациентов с пищевыми токсико-инфекциями вследствие развития гемолитико-уремического синдрома. Если помните, это была очень громкая история с перекрытиями границ для испанских огурцов, потом вообще для всей плодоовощной продукции из Европы в Россию, пока искали хотя бы источник, не говоря уж о виновнике тех событий. Окончательно виновными тогда были обозначены листья салата, в поливе которых использовалась вода с признаками фекального заражения, а затем речь пошла уже о пророщенных семенах, которые так же полили фекально-зараженной водичкой. Так вышли на конкретный штамм E.coli – O104:H4, который, подвергшись санации антибиотиком, выплескивает эндотоксин, вызывающий гемолиз и острую почечную недостаточность. В итоге – массовая летальность пациентов, получавших антибиотики.
Затем тот же штамм обнаружился при вспышке ПТИ в Финляндии, но к тому времени пациентов с диареями до появления микробиологических результатов перестали лечить бактерицидными антибиотиками и ситуация была купирована в зародыше.
И третий громкий (для нашей страны) случай – это массовое заболевание питерских школьников в Грузии, где так же был выявлен этот штамм (пресс-релиз Роспотребнадзора по данному случаю лежит здесь).
Когда кишечная палочка выступает внекишечным патогенном? Почти всегда, когда обнаруживается вне места своего нормального обитания.
- Заболевания мочевыводящий путей. Здесь E.coli является абсолютным лидером и играет ведущую роль в развитии:
- Острых циститов
- Пиелонефритов
- Абсцессов почек и
- Простатитов
Этот факт объясняется близким анатомическим расположением двух систем и огрехами в личной гигиене, что позволяет на этапе эмпирической терапии вышеперечисленных заболеваний сразу же назначать препараты, активные в отношении кишечной палочки.
- Заболевания желудочно-кишечного тракта:
- Диарея путешественников
- Интраабдоминальные абсцессы и перитониты, чаще всего носящие вторичный характер (прободение кишки в результате первичного заболевания, либо при дефектах оперативного вмешательства)
- Инфекции центральной нервной системы у очень ослабленных пациентов, результатом чего будет развитие менингитов. Встречается в основном у лиц старческого возраста и новорожденных. Кроме того, в случае внутрибольничного заражения менингит может развиться в результате плохой обработки рук медицинского персонала перед оперативным вмешательством или перевязками.
- Инфекции кровотока, а именно сепсис, как продолжение развития заболеваний мочевыводящих путей, ЖКТ и билиарного тракта вследствие метастазирования очага инфекции. Лечению поддается крайне тяжело, особенно если задействованы внутрибольничные штаммы, летальность чрезвычайно высокая.
- Инфекции кожи и мягких тканейкак следствие раневых инфекций после вмешательств на органах брюшной полости.
- Внутрибольничные пневмонии, вызванные устойчивыми штаммами кишечной палочки, целиком связаны с дефектами ухода за пациентом и фактором чистоты, точнее ее отсутствия, рук медицинского персонала или ухаживающих родственников. Факт внутрибольничного заражения доказывается элементарно, что будет наглядно продемонстрировано в следующем разделе.
- Послеродовые (и не только) эндометриты. Вынуждены упомянуть и эту патологию, так как инфицирование кишечной палочкой встречается все чаще и чаще, а большой настороженности нет. Как результат, можно очень сильно промахнуться с антибактериальной терапией и, как следствие, прийти к экстирпации органа в виду неэффективности антибиотикотерапии. Натолкнуть на мысль может более позднее, чем обычно, поступление и более агрессивное, чем обычно течение. Дополнительный осмотр прианальной области так же может натолкнуть на вероятность развития именно такого инфицирования.
(часть вторая) Практические вопросы диагностики и лечения.
Когда мы можем заподозрить, что перед нами пациент с инфекцией, вызванной кишечной палочкой?
- Пациенты с диареей, приехавшие из отпуска и все-таки смогшие прийти на прием (диарея путешественников или энтеротоксигенные штаммы E.coli).
- Пациенты со всеми заболеваниями мочевыделительной системы, в том числе беременные, но строго с наличием симптоматики (не надо лечить бессимптомную бактериурию, иначе вырастите резистентные штаммы и создадите проблему и себе, и женщине, и роддому в последующем).
- В стационарах – нозокомиальные пневмонии, послеоперационные менингиты, перитониты, сепсисы и т. д., носящие вторичный характер.
Подтвердить или полностью исключить кишечную палочку из возбудителей может только микробиологическое исследование. Конечно, в современных условиях микробиология уже становится практически эксклюзивом, но мы пришли учиться, а учится надо на правильных примерах, поэтому далее будет рассмотрен ряд антибиотикограмм, выполненных автоматизированными системами тестирования. Вдруг вам повезет, и в вашем лечебном учреждении все уже есть или в ближайшее время будет, а вы уже умеете с этим всем работать?
Если вы читаете данный цикл по порядку, то в базовом разделе по микробиологии был выложен ряд антибиотикограмм некоего микроорганизма в контексте нарастания антибиотикорезистентности, и это была наша сегодняшняя героиня – кишечная палочка.
- Начнем с дикого и крайне симпатичного штамма E.coli, который живет в кишечнике и обеспечивает синтез витамина К. С ним сталкиваются доктора амбулаторной службы у пациентов с инфекциями мочевыводящих путей или в случае госпитализации у пациентов, которые не получали антибиотики около года. И именно такую чувствительность мы имеем в виду, когда назначаем эмпирическую антибиотикотерапию
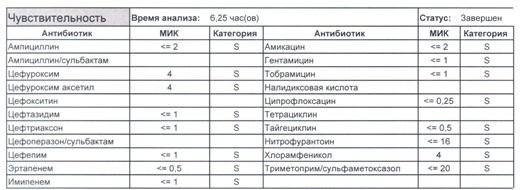
- Как видите, зверь чувствителен абсолютно ко всему, и это как раз тот случай, когда можно свободно пользоваться табличными материалами справочников или клинических рекомендаций, так как механизмы резистентности полностью отсутствуют.
- Если в ваши руки попал пациент, которого в течение последнего полугодия лечили антибиотиками пенициллинового ряда, то антибиотикограмма может выглядеть следующим образом.
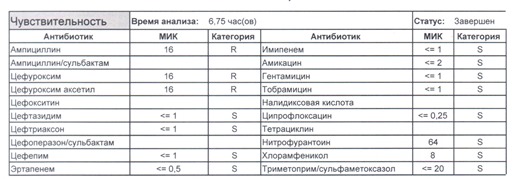
Если такая кишечная палочка окажется внекишечным патогенном, и перед вами будет беременная и ИМП (самый частый случай), то нам необходимо преодолеть резистентность к пенициллинам, то есть подавить деятельность пенициллиназ. Соответственно высокую эффективность продемонстрируют препараты с ингибиторами бета-лактамаз, чаще всего амоксициллина/клавуланат, как наиболее безопасный и эффективный. Единственное, пациентку необходимо предупредить, что в результате стимуляции рецепторов кишечника может развиться антибиотик-ассоциированная диарея.
- Отдельно хотелось бы обратить внимание на следующий штамм E.coli, как типичного обладателя бета-лактамаз расширенного спектра. И эти БЛРС чаще всего вырабатываются в результате неуемного использования цефалоспоринов третьего поколения и совершенно конкретного его представителя – цефтриаксона.
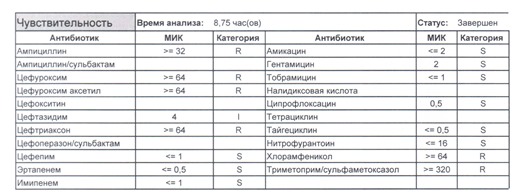
В каких ситуациях мы можем увидеть (или подумать) о таком звере:
- Пациент сам рассказывает, что получал цефтриаксон в промежутке полугодия
- Пациент был переведен из другого стационара (хотя там можно будет и следующую картинку обнаружить)
- Пациент ничего не получал, и вообще в больнице не лежал, но возбудитель попал с рук медицинского персонала, вызвав внутрибольничную инфекцию
- И самый простой случай – посев был взят в момент проведения терапии цефтриаксоном
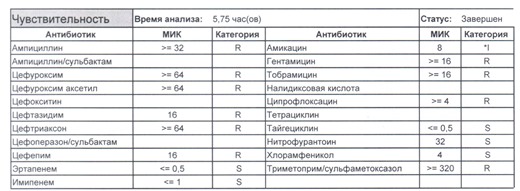
Подобный пациент не придет к вам своими ногами, его не увидит амбулаторная служба, это абсолютно стационарные больные, и если их привезут, то только из другого лечебного учреждения. Чаще всего это пациенты палат интенсивной терапии или реанимации, и такой возбудитель носит на 100% нозокомиальный характер.
Когда можем его обнаружить:
- вторичные перитониты,
- нозокомиальные пневмонии,
- пиелонефриты,
- послеоперационные менингиты,
- сепсис и т. п.
- Для эрадикации такого возбудителя нужен не просто отдельный обученный специалист и имеющая весь набор препаратов резерва аптека, но и напряженная работа эпидемиологической службы, так как подобный пациент должен быть изолирован в отдельную палату, а лучше изолятор (не подумайте, что бред – при правильной организации такие вещи вполне реальны) с проведением карантинных мероприятий, так как основная проблема появления подобного рода возбудителей в том, что они очень быстро разбегаются по всему корпусу (или стационару, если корпуса не изолированы) и обсеменяют все и вся, нанося вред другим ослабленным тяжелой болезнью пациентам и заселяя кишечники всего медицинского персонала.
- И еще одно крайне мерзкое свойство таких возбудителей – они умеют осуществлять горизонтальный перенос механизмов резистентности с другой флорой семейства Enterobacteriaceae, и даже если вы избавились от E.coli, неприятным сюрпризом может стать ее подруга клебсиелла, наносящая еще больший вред и по сути добивающая больного. Избавится полностью от этих возбудителей невозможно, для этого надо избавится от медицинского персонала как основных носителей, но контролировать можно – мероприятия подробно расписаны в действующих СанПиН 2.1.3.2630-10. Так что в случае выявления подобного возбудителя речь пойдет не только о лечении того пациента, у которого он обнаружен, но и проведения мероприятий по недопущению инфицирования всех остальных пациентов (а это, напомню, почти всегда ПИТ или ОРИТ), находящихся рядом.
- И в заключение необходимо упомянуть о панрезистентной E.coli, вооруженной полным спектром механизмов резистентности. В антибиотикограмме будут тотальные R, а МПК возбудителей пробьют все возможные потолки. К счастью для автора, она с таким зверем пока не сталкивалась, что связано с наличием работающей системы эпиднадзора, поэтому картинки не будет, хотя ее несложно представить. Такие пациенты, если кишечная палочка окажется патогеном, а не колонизатором (мало ли с чьих рук, например, в рану упала), к сожалению, почти не выживают, так как изначально являются крайне тяжелыми соматически, а кишечная палочка обычно подводит черту к их существования на бренной земле.
- Не допускать развития такой, не побоюсь этого слова, зверюги в ваших стационарах, а если появилась – гонять эпидемиологическую службу, чтобы избавляла руки и поверхности от такого рода заражения, что возможно только при условии наличия достаточного количества расходных материалов, перчаток и дезинфицирующих средств.
А теперь подведем небольшой итог нашего непростого разговора:
- Кишечная палочка – возбудитель очень серьезный и не следует его недооценивать. В ее типах также необходимо четко ориентироваться.
- В первую очередь о ней мы думаем при лечении инфекций мочевыводящих путей, особенно у беременных.
- Если перед нами пациент с признаками кишечной инфекции, то подход к терапии антибиотиками должен быть сугубо индивидуальным, и если состояние позволяет, то до получения микробиологии – вообще без антибиотиков. Если не позволяет – это должны быть бактериостатики.
- Мы никогда не лечим только анализ, и даже микробиологическое заключение, мы всегда лечим пациента со всем комплексом его симптомов и синдромов. Но микробиология помогает решить как дифференциально-диагностические задачи, что и позволяет отделить безусловный патоген от мирно живущего комменсала.
- Микробиологическая диагностика носит ключевое значение как для подтверждения самого возбудителя, так и для выбора необходимого антибиотика
- В случае выявления резистентных и панрезистентных возбудителей, помимо лечения самого пациента должна в полной мере задействоваться эпидемиологическая служба лечебного учреждения

Кишечная палочка представляет собой тип бактерий, который в больших количествах является опасным для человеческого организма. Данная бактерия имеет палочковидную форму. При этом данная бактерия считается нормальной для человеческого тела. Она располагается в желудочно-кишечном тракте.
Существует очень большое количество таких бактерий, которое превышает 100. Они объединены в 4 отдельных типа, которые отличаются между собой по особенностям жизнедеятельности и своему уровню патогенности. Морфологическая разница между теми, которые являются патогенными, и теми, которые таковыми не являются, на отсутствует.
Общая информация
Данные бактерии являются очень устойчивыми к воздействию окружающей среды, а также могут долгое время быть в почве, фекалиях и воде, что также может быть фактором риска при определенных обстоятельствах. Они могут быть также в пищевых продуктах и молоке. Они при этом также не имеют высокого уровня устойчивости, если на них воздействуют при помощи антисептических средств и не имеют устойчивости к кипячению, так что при термической обработке кишечная палочка погибает. Более того, даже прямое воздействие солнечных лучей способно убить такие палочки менее чем за минуту, что очень важно.
Часть кишечных палочек имеет возможность для передвижения при помощи специальных жгутиков. В некоторых ситуациях это не представляется возможным, ведь не все виды палочек имеют возможность к такого рода передвижению, что имеет принципиальное значение для обеспечения достаточно высокой скорости передвижения, достаточной для комфортного существования в среде.
В кишечнике человека
В нормальной ситуации кишечника есть возможность отследить наличие таких бактерий в количестве 1% от общего количества. Именно такая концентрация считается нормальной, что имеет принципиальное значение для поддержания хорошего состояния человеческого организма. Кишечник имеет определенное количество кислорода, который является для него вредным. Такие бактерии помогут его забирать, что очень важно для нормального функционирования человеческого тела.
Именно кишечные палочки ответственны за то, чтобы вырабатывать полезные для человека витамины группы В. Они также вырабатывают муравьиную кислоту, уксусную и даже молочную. Они оказывают влияние на всасывание кальция, билирубина, а также железа и прочих полезных веществ. Благодаря кишечным палочкам есть возможность также перерабатывать определенные составы, что очень важно.

В последние годы инфекционисты отмечают рост заболеваний, обусловленных нетрадиционными микроорганизмами. Особое место занимает протейная инфекция. Ее кишечная форма, вызванная бакетриями рода Протей — P. vulgaris протекает тяжелее у детей раннего возраста. Не менее опасны гнойно-воспалительные заболевания мочевыводящей системы, вызываемые P. mirabilis, P. rettgeri и P. morganii.
В греческой мифологии Протей – божество, способное менять облик. Отсюда название полиморфных, мелких, нитевидных палочек, отличающихся активной подвижностью. Размеры клеток составляют 0,5 — 3 мкм. P. morganii, P. rettgeri — менее полиморфны и малоподвижны.
Протейная инфекция: причины, развитие, опасность для организма
Возбудителями протейной инфекции являются грамотрицательные условно-патогенные микроорганизмы семейства энтеробактерий, которые присутствуют в нормальной микрофлоре кишечника, а также повсеместно распространены в воздухе, почве и воде. Бактерии рода Proteus в течение долгого времени не причислялись к возбудителям серьезных инфекционно-воспалительных заболеваний. Однако в связи с последними достижениями в области диагностики было обнаружено, что эти микроорганизмы способны вызывать трудно поддающиеся лечению патологии (протеозы), поражающие преимущественно ЖКТ и мочеполовую систему.
Протей – факультативный анаэроб, палочковидная, неспороносная, подвижная, грамотрицательная бактерия. В микробиологическом анализе кала протей встречается в комплексе с другими условно-патогенными бактериями семейства энтеробактерий. Кроме протея, в составе нормальной микрофлоры кишечника человека определяются: клебсиелла, энтеробактер, гафния, серратия, морганелла, провиденция, цитробактер. В 1 г кала должно быть меньше 10 4 общего количества этих бактерий. Большее количество перечисленных бактерий является признаком дисбактериоза.
В природе бактерии рода Proteus обнаруживаются: в сточных водах, в земле, в водоемах, на овощах, в разлагающихся органических веществах. Эти микроорганизмы — сапрофиты, они живут на слизистых оболочках, на коже, в кишечнике человека и животных. Протеи устойчивы во внешней среде и сохраняют жизнедеятельность в слабых растворах фенола и других средств. Выявлена также резистентность ко многим антибиотикам.
Причины протейной инфекции
Протейная палочка, присутствующая в кишечной микрофлоре в небольших количествах, не причиняет организму никакого вреда. При определенных обстоятельствах (снижение иммунитета, неправильное питание, длительный прием антибиотиков) она может активизироваться и начать интенсивно размножаться. Также инфицирующее количество этих бактерий способно проникнуть в организм из внешней среды.
Основными путями передачи инфекции являются пищевой и контактно-бытовой. Чаще всего заражение происходит при употреблении белковых продуктов (мяса, рыбы, молока, колбасы), которые хранились с нарушением надлежащих сроков и условий. Значительно реже инфицирование осуществляется через немытые руки, во время купания или при употреблении зараженной воды.
Инфицирование протеем может произойти через полуфабрикаты, сырые продукты или готовые блюда из мяса, рыбы, молока, колбасы, студня. В них происходит быстрое размножение бактерий с образованием токсинов. Реже отмечают водный путь передачи: при купании в загрязненных водоемах или употреблении инфицированной воды. Возможен и контактный путь передачи на инфицированных руках зараженного человека.
Развитие патологии
При непосредственном попадании протея в ЖКТ вместе с продуктами питания инфекционное заболевание развивается очень стремительно. Первые симптомы ярко выражены, а общая клиническая картина совпадает с проявлениями сильного пищевого отравления. При контактно-бытовом способе заражения развитие признаков инфекции обычно происходит медленнее.
Если инфекционный процесс протекает в легкой форме, больной испытывает слабость, у него отмечаются повышение температуры, рвота, боль в животе, частый водянистый стул, в котором могут обнаруживаться слизь и зеленые включения. При тяжелом течении заболевания приступы рвоты случаются около 10 раз за сутки и более, а температура обычно поднимается до 40°С.
При условии своевременного и адекватного лечения вся острая симптоматика протеоза легкой или средней степени тяжести исчезает спустя несколько дней, после чего больной быстро идет на поправку.
Протеи выделяют токсические вещества — эндотоксины с гемолитическими свойствами и с различной степенью биохимической активности. У штаммов P. vulgaris обнаружена лецитиназная активность. Протеи обладают способностью адгезии к уротелию при помощи ресничек. Отмечают, что резистентность к антибиотикам связана с адгезивной способностью уропатогенных протеев.
Острой кишечной протейной инфекцией, протекающей по типу гастроэнтерита, гастрита и колиэнтерита часто болеют дети раннего возраста с пониженным иммунитетом и после бесконтрольного назначения антибиотиков. Заболевание сопровождается симптомами токсикоза — повышением температуры, рвотой, метеоризмом, схваткообразными болями в животе, нарушением аппетита, кратковременными судорогами, появлением водянистого, зловонного, учащенного стула.
В тяжелых случаях могут развиться осложнения: гемолитико-уремический синдром, а также симптомы острой гемолитической тромбопении, анемии или острой почечной недостаточности.
Клинические проявления внутрибольничной инфекции протейной этиологии весьма разнообразны: поражения мочевыводящей системы, отиты, холециститы, нагноения ран и септические состояния. Попадание протеев в пупочную ранку новорожденного может привести к бактериемии или развитию менингита.
Данные заболевания могут развиться: при передаче возбудителя контактно-бытовым или воздушно-капельным путями, при заносе с катетером, другими урологическими инструментами.
Ультратонкий срез клетки Proteus alcalifaciens. Увеличение *83000
Если в мазках исследуемого материала (участки ожоговой ткани, гной, раневое отделяемое, испражнения) обнаруживаются грамотрицательные палочки, то бактериоскопический метод позволяет сделать предварительное заключение. Бактериологическим методом на средах определяют колонии протея в виде тонкого стелющегося налета. Активно размножаются протеи на белковой питательной среде вызывают гниение мяса, рыбы, других белковых продуктов.
Важнейшие профилактические меры — это соблюдение санитарного режима в детских учреждениях и стационарах, проведение общесанитарных мероприятий. Для профилактики протея каждому необходимо соблюдать правила личной гигиены, исключить потребление подозрительных продуктов в питании, избегать контактов с больными детьми и взрослыми.
При лечении протейной инфекции следует придерживаться лечебной щадящей диеты с исключением жареных, острых блюд, белковых продуктов. В острый период протейного инфицирования, при поражении желудочно-кишечного тракта — необходимо обеспечить восполнение потерянной жидкости. Полезно употреблять отвары трав – тысячелистника, алтея, зверобоя, ромашки, календулы; морсы, компоты с клюквой, черной смородиной, абрикосами, черникой, яблоками. Применять антибиотики можно только по назначению врача, в соответствии с данными анализов чувствительности бактерии протея к ним.
Обязательно нужно принимать препараты – пробиотики, пребиотики, синбиотики для восстановления нормальной флоры кишечника.
Синбиотические комплексы Нормофлорины, содержащий живые активные лакто- и бифидобактерии, секретирующие молочную, уксусную, масляную, пропионовую кислоты, оказывающие защитное, антисептическое, противовоспалительное, сорбционное действие – уменьшает интоксикацию, улучшает моторику кишечника, функцию печени, повышает иммунную реактивность. Это помогает в борьбе с протейной инфекцией, восстанавливает работу желудочно-кишечного тракта, общее самочувствие, повышает иммунитет.
Схема (возрастные дозировки для детей или взрослых): (взрослый) нормофлорин Л – 20 мл (при диарее) – 40 (при запорах) мл утром перед едой, Д — 40 мл вечером за 20 мин до еды, Б – 20-30 мл на ночь в клизме. При диарее в обед можно добавить Д – 30-40 мл, при запорах в обед + Л – 30-40 мл.
Курс приема нормофлоринов — 1 — 1,5 месяца, для выведения токсинов, патогенной микрофлоры, восстановления полезных собственных бактерий. Уникальный состав нормофлоринов, не содержащих белков коровьего молока, молочного сахара, консервантов позволяет при протейной инфекции успешно применять его у детей с первых дней жизни, беременных, кормящих, больных сахарным диабетом, аллергическими заболеваниями, т.е. у взрослых при любой сопутствующей патологии.
Опасность протейной инфекции

Протейная инфекция
Тяжелые формы патологии могут осложняться состояниями, требующими срочной госпитализации больного, такими как сильное обезвоживание, судороги, инфекционно-токсический шок.
protey_mirabilis
Помимо острых инфекций пищеварительной системы бактерии Proteus способны поражать другие органы, распространяясь через кровь или по лимфатическим сосудам. Очаг воспаления может локализоваться в мочеполовой системе, глазах, ушах, легких и даже в костной ткани или мозговых оболочках. Данные патологии достаточно часто переходят в хроническую форму с упорным рецидивирующим течением, которая тяжело поддается терапии.
Если протейная инфекция заносится на незажившие поверхности кожи и слизистых оболочек (послеоперационные раны, ожоги), вызванный ею воспалительный процесс значительно замедляет регенерацию тканей и снижает эффективность лечебных мероприятий.
Следует отметить, что даже незначительное превышение нормального количества протейной палочки в кишечной микрофлоре может негативно отразиться на состоянии здоровья. Так, если у человека имеются аутоиммунные болезни, существует высокий риск их обострения из-за возросшей активности протейной палочки. Атопический дерматит, астма, аллергические заболевания и другие иммунозависимые патологии могут впервые развиться или обостриться под воздействием бактерий Proteus.
Внутрибольничные инфекции – различные инфекционные заболевания, заражение которыми произошло в условиях лечебного учреждения. В зависимости от степени распространения различают генерализованные (бактериемию, септицемию, септикопиемию, бактериальный шок) и локализованные формы внутрибольничных инфекций (с поражением кожи и подкожной клетчатки, дыхательной, сердечно-сосудистой, урогенитальной системы, костей и суставов, ЦНС и т. д.). Выявление возбудителей внутрибольничных инфекций проводится с помощью методов лабораторной диагностики (микроскопических, микробиологических, серологических, молекулярно-биологических). При лечении внутрибольничных инфекций используются антибиотики, антисептики, иммуностимуляторы, физиотерапия, экстракорпоральная гемокоррекция и т. д.

Общие сведения
Внутрибольничные (госпитальные, нозокомиальные) инфекции - инфекционные заболевания различной этиологии, возникшие у пациента или медицинского сотрудника в связи с пребыванием в лечебно-профилактическом учреждении. Инфекция считается внутрибольничной, если она развилась не ранее 48 часов после поступления больного в стационар. Распространенность внутрибольничных инфекций (ВБИ) в медицинских учреждениях различного профиля составляет 5-12%. Наибольший удельный вес внутрибольничных инфекций приходится на акушерские и хирургические стационары (отделения реанимации, абдоминальной хирургии, травматологии, ожоговой травмы, урологии, гинекологии, отоларингологии, стоматологии, онкологии и др.). Внутрибольничные инфекции представляют собой большую медико-социальную проблему, поскольку утяжеляют течение основного заболевания, увеличивают длительность лечения в 1,5 раза, а количество летальных исходов - в 5 раз.

Этиология и эпидемиология внутрибольничных инфекций
Основными возбудителями внутрибольничных инфекций (85% от общего числа) выступают условно-патогенные микроорганизмы: грамположительные кокки (эпидермальный и золотистый стафилококк, бета-гемолитический стрептококк, пневмококк, энтерококк) и грамотрицательные палочковидные бактерии (клебсиеллы, эшерихии, энтеробактер, протей, псевдомонады и др.). Кроме этого, в этиологии внутрибольничных инфекций велика удельная роль вирусных возбудителей простого герпеса, аденовирусной инфекции, гриппа, парагриппа, цитомегалии, вирусных гепатитов, респираторно-синцитиальной инфекции, а также риновирусов, ротавирусов, энтеровирусов и пр. Также внутрибольничные инфекции могут быть вызваны условно-патогенными и патогенными грибами (дрожжеподобными, плесневыми, лучистыми). Особенностью внутригоспитальных штаммов условно-патогенных микроорганизмов служит их высокая изменчивость, лекарственная резистентность и устойчивость к воздействию факторов среды (ультрафиолета, дезинфектантов и пр.).
Источниками внутрибольничных инфекций в большинстве случаев выступают пациенты или медицинский персонал, являющиеся бактерионосителями или больными стертыми и манифестными формами патологии. Как показывают исследования, роль третьих лиц (в частности, посетителей стационаров) в распространении ВБИ невелика. Передача различных форм госпитальной инфекции реализуется с помощью воздушно-капельного, фекально-орального, контактного, трансмиссивного механизма. Кроме этого, возможен парентеральный путь передачи внутрибольничной инфекции при проведении различных инвазивных медицинских манипуляций: забора крови, инъекций, вакцинации, инструментальных манипуляций, операций, ИВЛ, гемодиализа и пр. Таким образом в медучреждении возможно заразиться гепатитами В, С и D, гнойно-воспалительными заболеваниями, сифилисом, ВИЧ-инфекцией. Известны случаи внутрибольничных вспышек легионеллеза при приеме больными лечебного душа и вихревых ванн.
Факторами, участвующими в распространении внутрибольничной инфекции, могут выступать контаминированные предметы ухода и обстановки, медицинский инструментарий и аппаратура, растворы для инфузионной терапии, спецодежда и руки медперсонала, изделия медицинского назначения многоразового использования (зонды, катетеры, эндоскопы), питьевая вода, постельные принадлежности, шовный и перевязочный материал и мн. др.
Значимость тех или иных видов внутрибольничной инфекции во многом зависит от профиля лечебного учреждения. Так, в ожоговых отделениях преобладает синегнойная инфекция, которая в основном передается через предметы ухода и руки персонала, а главным источником внутрибольничной инфекции являются сами пациенты. В учреждениях родовспоможения основную проблему представляет стафилококковая инфекция, распространяемая медицинским персоналом-носителем золотистого стафилококка. В урологических отделениях доминирует инфекция, вызываемая грамотрицательной флорой: кишечной, синегнойной палочкой и др. В педиатрических стационарах особую значимость имеет проблема распространения детских инфекций – ветряной оспы, эпидемического паротита, краснухи, кори. Возникновению и распространению внутрибольничной инфекции способствуют нарушение санитарно-эпидемиологического режима ЛПУ (несоблюдение личной гигиены, асептики и антисептики, режима дезинфекции и стерилизации, несвоевременное выявление и изоляция лиц-источников инфекции и т. д.).
К группе риска, в наибольшей степени подверженной развитию внутрибольничной инфекции, относятся новорожденные (особенно недоношенные) и дети раннего возраста; пожилые и ослабленные пациенты; лица, страдающие хроническими заболеваниями (сахарным диабетом, болезнями крови, почечной недостаточностью), иммунодефицитом, онкопатологией. Восприимчивость человека к внутрибольничным инфекциям увеличивается при наличии у него открытых ран, полостных дренажей, внутрисосудистых и мочевых катетеров, трахеостомы и других инвазивных устройств. На частоту возникновения и тяжесть течения внутрибольничной инфекции влияет долгое нахождение пациента в стационаре, длительная антибиотикотерапия, иммуносупрессивная терапия.
Классификация внутрибольничных инфекций
По длительности течения внутрибольничные инфекции делятся на острые, подострые и хронические; по тяжести клинических проявлений – на легкие, среднетяжелые и тяжелые формы. В зависимости от степени распространенности инфекционного процесса различают генерализованные и локализованные формы внутрибольничной инфекции. Генерализованные инфекции представлены бактериемией, септицемией, бактериальным шоком. В свою очередь, среди локализованных форм выделяют:
- инфекции кожи, слизистых и подкожной клетчатки, в т. ч. послеоперационных, ожоговых, травматических ран. В частности, к их числу относятся омфалит, абсцессы и флегмоны, пиодермия, рожа, мастит, парапроктит, грибковые инфекции кожи и др.
- инфекции полости рта (стоматит) и ЛОР-органов (ангина, фарингит, ларингит, эпиглоттит, ринит, синусит, отит, мастоидит)
- инфекции бронхолегочной системы (бронхит, пневмония, плеврит, абсцесс легкого, гангрена легкого, эмпиема плевры, медиастинит)
- инфекции пищеварительной системы (гастрит, энтерит, колит, вирусные гепатиты)
- глазные инфекции (блефарит, конъюнктивит, кератит)
- инфекции урогенитального тракта (бактериурия, уретрит, цистит, пиелонефрит, эндометрит, аднексит)
- инфекции костно-суставной системы (бурсит, артрит, остеомиелит)
- инфекции сердца и сосудов (перикардит, миокардит, эндокардит, тромбофлебиты).
- инфекции ЦНС (абсцесс мозга, менингит, миелит и др.).
Диагностика внутрибольничных инфекций
Критериями, позволяющими думать о развитии внутрибольничной инфекции, служат: возникновение клинических признаков заболевания не ранее чем через 48 часов после поступления в стационар; связь с проведением инвазивного вмешательства; установление источника инфекции и фактора передачи. Окончательное суждение о характере инфекционного процесса получают после идентификации штамма возбудителя с помощью лабораторных методов диагностики.
Для исключения или подтверждения бактериемии проводится бактериологический посев крови на стерильность, желательно не менее 2-3-х раз. При локализованных формах внутрибольничной инфекции микробиологическое выделение возбудителя может быть произведено из других биологических сред, в связи с чем выполняется посев мочи, кала, мокроты, отделяемого ран, материала из зева, мазка с конъюнктивы, из половых путей на микрофлору. Дополнительно к культуральному методу выявления возбудителей внутрибольничных инфекций используются микроскопия, серологические реакции (РСК, РА, ИФА, РИА), вирусологический, молекулярно-биологический (ПЦР) методы.
Лечение внутрибольничных инфекций
Сложности лечения внутрибольничной инфекции обусловлены ее развитием в ослабленном организме, на фоне основной патологии, а также резистентностью госпитальных штаммов к традиционной фармакотерапии. Больные с диагностированными инфекционными процессами подлежат изоляции; в отделении проводится тщательная текущая и заключительная дезинфекция. Выбор противомикробного препарата основывается на особенностях антибиотикограммы: при внутрибольничной инфекции, вызванной грамположительной флорой наиболее эффективен ванкомицин; грамотрицательными микроорганизмами – карбапенемы, цефалоспорины IV поколения, аминогликозиды. Возможно дополнительное применение специфических бактериофагов, иммуностимуляторов, интерферона, лейкоцитарной массы, витаминотерапии.
При необходимости проводится чрескожное облучение крови (ВЛОК, УФОК), экстракорпоральная гемокоррекция (гемосорбция, лимфосорбция). Симптоматическая терапия осуществляется с учетом клинической формы внутрибольничной инфекции с участием специалистов соответствующего профиля: хирургов, травматологов, пульмонологов, урологов, гинекологов и др.
Профилактика внутрибольничных инфекций
Основные меры профилактики внутрибольничных инфекций сводятся к соблюдению санитарно-гигиенических и противоэпидемических требований. В первую очередь, это касается режима дезинфекции помещений и предметов ухода, применения современных высокоэффективных антисептиков, проведения качественной предстерилизационной обработки и стерилизации инструментария, безукоснительного следования правилам асептики и антисептики.
Медицинский персонал должен соблюдать меры индивидуальной защиты при проведении инвазивных процедур: работать в резиновых перчатках, защитных очках и маске; осторожно обращаться с медицинским инструментарием. Большое значение в профилактике внутрибольничных инфекций имеет вакцинация медработников от гепатита В, краснухи, гриппа, дифтерии, столбняка и других инфекций. Все сотрудники ЛПУ подлежат регулярному плановому диспансерному обследованию, направленному на выявление носительства патогенов. Предупредить возникновение и распространение внутрибольничных инфекций позволит сокращение сроков госпитализации пациентов, рациональная антибиотикотерапия, обоснованность проведения инвазивных диагностических и лечебных процедур, эпидемиологический контроль в ЛПУ.
Читайте также:

