Токсико септические заболевания новорожденных мероприятия при вспышке
Обновлено: 18.04.2024
Пищевые токсикоинфекции - острые инфекционные заболевания, вызываемые условно-патогенными бактериями, продуцирующими экзотоксины. При попадании микроорганизмов в пищевые продукты в них накапливаются токсины, которые могут вызывать отравления человека.
Краткие исторические сведения
На протяжении многих веков человечеству было известно, что употребление в пищу недоброкачественных продуктов, прежде всего мясных, может приводить к развитию рвоты и поноса. После описания П.Н. Лащенковым (1901) клинической картины стафилококковой пищевой интоксикации было установлено, что заболевания с синдромами диареи и интоксикации могут вызывать условно-патогенные бактерии. В результате работ отечественных исследователей эти заболевания отнесены к группе пищевых токсикоинфекций.
Что провоцирует / Причины Пищевых токсикоинфекций :
Пишевая токсикоинфекция вызывает большая группа бактерий; основные возбудители - Staphylococcus aureus, Proteus vulgaris, Bacillus cereus, Clostridium perfringens, Clostridium difficile, представители родов Klebsiella, Enterobacter, Citrobacter, Serratia, Enterococcus и др. Возбудители широко распространены в природе, обладают выраженной устойчивостью и способны размножаться в объектах внешней среды. Все они являются постоянными представителями нормальной микрофлоры кишечника человека и животных. Нередко у заболевших не удаётся выделить возбудитель, так как клиническую картину пищевых токсикоинфекций в основном определяет действие микробных токсических субстанций. Под действием различных факторов внешней среды условно-патогенные микроорганизмы изменяют такие биологические свойства, как вирулентность и устойчивость к антибактериальным препаратам.
Эпидемиология
Источник инфекции - различные животные и люди. Наиболее часто это лица, страдающие гнойными заболеваниями (панарициями, ангинами, фурункулёзом и др.); среди животных - коровы и овцы, болеющие маститами. Все они выделяют возбудитель (обычно стафилококки), попадающие в пищевые продукты в процессе их обработки, где и происходит размножение и накопление бактерий. Эпидемиологическую опасность представляют как больные, так и носители возбудителей. Период заразности больных небольшой; относительно сроков бактерионосительства данные противоречивы.
Возбудители других токсикоинфекций (С. perfringens, В. cereus и др.) люди и животные выделяют во внешнюю среду с испражнениями. Резервуаром ряда возбудителей могут являться почва, вода и другие объекты внешней среды, загрязнённые испражнениями животных и человека.
Механизм передачи - фекально-оральный, основной путь передачи - пищевой. Для возникновения пищевых токсикоинфекций, вызываемых условно-патогенными бактериями, необходима массивная доза возбудителей либо определённое время для его размножения в пищевых продуктах. Чаще всего пищевые токсикоинфекции связаны с контаминацией молока, молочных продуктов, рыбных консервов в масле, мясных, рыбных и овощных блюд, а также кондитерских изделий, содержащих крем (торты, пирожные). Основным продуктом, участвующим в передаче клостридий, является мясо (говядина, свинина, куры и др.). Приготовление некоторых мясных блюд и изделий (медленное охлаждение, многократное подогревание и др.), условия их реализации способствуют прорастанию спор и размножению вегетативных форм. В эстафетной передаче возбудителя участвуют различные объекты внешней среды: вода, почва, растения, предметы быта и ухода за больными. Продукты, содержащие стафилококковый и другие энтеротоксины, по внешнему виду, запаху и вкусу не отличаются от доброкачественных. Заболевания протекают в виде спорадических случаев и вспышек. Их чаще регистрируют в тёплое время года, когда создаются благоприятные условия для размножения возбудителей и накопления их токсинов.
Естественная восприимчивость людей высокая. Обычно заболевает большая часть лиц, употреблявших контаминированную пищу. Помимо свойств возбудителя (достаточная доза, высокая вирулентность) для развития заболевания требуется ряд способствующих факторов как со стороны микроорганизма, так и макроорганизма (сниженная сопротивляемость, наличие сопутствующих заболеваний и др.). Более восприимчивы индивидуумы из группы риска: новорождённые, ослабленные лица, пациенты после хирургических вмешательств либо длительно получавшие антибиотики и др.
Основные эпидемиологические признаки. Заболевания, вызываемые условно-патогенными микроорганизмами, распространены повсеместно. Вспышки носят семейный характер или при контаминации пищи на предприятиях общественного питания, заболевания могут быть рассеяны среди населения. Число заболевших определяет количество лиц, употреблявших контаминированный пищевой продукт, и может существенно варьировать. В частности, весьма характерны групповые заболевания среди пассажиров морских судов, туристов и членов детских и взрослых организованных коллективов. Вспышки обычно носят взрывной характер. Каких-либо особенностей по социально-возрастному и половому составу не выявлено. Заболевания чаще регистрируют в летнее время. В зависимости от вида пищевого продукта среди заболевших преобладают дети или взрослые. Кроме пищевых возможны и бытовые вспышки, в большинстве случаев возникающие в больничных условиях. Вспышки внутрибольничных инфекций, вызываемых С. difficile, связаны с длительным применением антибиотиков. При водных вспышках как следствие фекального загрязнения одновременно с условно-патогенными микроорганизмами выделяют и другие возбудители острых кишечных инфекций.
Патогенез (что происходит?) во время Пищевых токсикоинфекций :
Общее свойство для всех возбудителей пищевых токсикоинфекций - способность вырабатывать различные типы экзотоксинов (энтеротоксинов) и эндотоксинов (липополисахаридных комплексов). Именно благодаря особенностям действия этих токсинов отмечают определённое своеобразие в клинических проявлениях пищевых токсикоинфекций, обусловленных различными возбудителями. На исключительно важную роль бактериальных токсинов в развитии пищевых токсикоинфекций указывает и относительно короткий инкубационный период заболевания.
В зависимости от типов токсинов они могут вызывать гиперсекрецию жидкости в просвет кишечника, клинические проявления гастроэнтерита и системные проявления заболевания в виде синдрома интоксикации.
Токсины бактерий реализуют своё действие через выработку эндогенных медиаторов (цАМФ, ПГ, интерлейкинов, гистамина и др.), непосредственно регулирующих структурно-функциональные изменения органов и систем, выявляемые у больных с пищевой токсикоинфекцией.
Сходство патогенетических механизмов пищевых токсикоинфекций различной этиологии обусловливает общность основных принципов в подходах к лечебным мероприятиям при этих заболеваниях, а также при сальмонеллёзе и кампилобактериозе.
Симптомы Пищевых токсикоинфекций :
Инкубационный период. Составляет, как правило, несколько часов, однако в отдельных случаях он может укорачиваться до 30 мин или, наоборот, удлиняться до 24 ч и более.
Вместе с тем, клинические проявления пищевых токсикоинфекций имеют некоторые различия в зависимости от вида возбудителя. Стафилококковой инфекции свойственны короткий инкубационный период и бурное развитие симптомов заболевания. В клинической картине доминируют признаки гастрита: многократная рвота, резкие боли в эпигастральной области, напоминающие желудочные колики. Характер стула может не меняться. Температура тела в большинстве случаев остаётся нормальной или кратковременно повышается. Выраженное снижение артериального давления, цианоз и судороги можно наблюдать уже в первые часы заболевания, но в целом течение болезни кратковременное и благоприятное, поскольку изменения кардиогемодинамики не соответствуют степени водно-электролитных расстройств. В случаях пищевых токсикоинфекций, вызванных Clostridium perfringens, клиническая картина, сходная с таковой при стафилококковой инфекции, дополняется развитием диареи с характерным жидким кровянистым стулом, температура тела остаётся нормальной. При пищевых токсикоинфекциях, вызванных вульгарным протеем, стул приобретает зловонный характер.
Осложнения
Наблюдают крайне редко; наиболее часто - гиповолемический шок, острая сердечно-сосудистая недостаточность, сепсис и др.
Диагностика Пищевых токсикоинфекций :
Дифференциальная диагностика
Пищевые токсикоинфекции следует отличать от сальмонеллёза и других острых кишечных инфекций - вирусных гастроэнтеритов, шигеллёзов, кампилобактериоза, холеры и др., а также от хронических заболеваний ЖКТ, хирургической и гинекологической патологий, инфаркта миокарда. Поскольку основные патогенетические механизмы и клинические проявления пищевых токсикоинфекций мало отличимы от таковых при сальмонеллёзе, в клинической практике часто ставят обобщённый предварительный диагноз пищевых токсикоинфекций, а выделение сальмонеллёза из этой общей группы проводят в случае его бактериологического или серологического подтверждения.
Лабораторная диагностика
Основу составляет выделение возбудителя из рвотных масс, промывных вод желудка и испражнений. При высеве возбудителя необходимо изучение его токсигенных свойств. Однако в большинстве случаев выделяемость незначительна, а обнаружение конкретного микроорганизма у больного ещё не позволяет считать его виновником заболевания. При этом необходимо доказать его этиологическую роль либо с помощью серологических реакций с аутоштаммом, либо установлением идентичности возбудителей, выделенных из заражённого продукта и от лиц, употреблявших его.
Лечение Пищевых токсикоинфекций :
Лечение пищевых токикоинфекций аналогично таковому при сальмонеллёзе; показаны промывание желудка, сифонные клизмы, раннее назначение энтеросорбентов (активированный уголь и др.), витаминов. При необходимости проводят регидратационную терапию. Этиотропное лечение при неосложнённом течении пищевых токсикоинфекций не показано.
Профилактика Пищевых токсикоинфекций :
Эпидемиологический надзор следует проводить в рамках надзора за кишечными инфекциями и внутрибольничными инфекциями.
В основе профилактики заболеваний лежит соблюдение санитарно-гигиенического и технологического режима, норм и правил заготовки, приготовления, хранения и реализации пищевых продуктов. Необходимо обеспечить ветеринарно-санитарный контроль над животными, способными контаминировать почву, воду и окружающие предметы возбудителями. Для предупреждения стафилококковых отравлений проводят мероприятия, направленные на уменьшение носительства стафилококков у работников пищевых предприятий (санация носителей стафилококка в носоглотке и на кожных покровах, лечение хронических воспалительных заболеваний миндалин и верхних дыхательных путей). Необходимо отстранение от работы, непосредственно связанной с обработкой пищевых продуктов и их изготовлением, лиц с гнойничковыми заболеваниями кожи, фарингитами, ангинами и другими проявлениями стафилококковой инфекции. Большое значение имеют контроль за соблюдением санитарно-гигиенического режима на пищевых предприятиях и лечебно-профилактических учреждениях, соблюдение правил личной гигиены, постоянное проведение санитарно-просветительной работы. Важно правильно хранить пищевые продукты, исключить размножение в них возбудителей пищевых токсикоинфекций. Чрезвычайно важны термическая обработка пищевых продуктов, кипячение молока и соблюдение сроков их реализации.
Мероприятия в эпидемическом очаге
Аналогичны таковым при других острых кишечных инфекциях. Диспансерное наблюдение за переболевшими не регламентировано.
К каким докторам следует обращаться если у Вас Пищевые токсикоинфекции :
Вас что-то беспокоит? Вы хотите узнать более детальную информацию о Пищевых токсикоинфекций , ее причинах, симптомах, методах лечения и профилактики, ходе течения болезни и соблюдении диеты после нее? Или же Вам необходим осмотр? Вы можете записаться на прием к доктору .
Это фактически заболевания, которые не имеют отношения к сепсису пупочного или другого происхождения. Наблюдаются обыкновенно в родильных домах. Возбудителями являются энтерококки, гемолитические стафилококки, сальмонеллы типа Бреслау, Хейдельберга и др. Их изолируют чаще всего со слизистых носа, полости рта, а также из испражнений. Заболевание начинается, как правило, между 5-м и 10-м днем после рождения, иногда и позднее - на 12-15-й день. Инкубационный период длится 6-8 дней. Нередко перед заболеванием ребенка наблюдается фебрильное состояние у матери. Неожиданно и резко падает вес ребенка, он отказывается от груди, появляется понос и быстро развивается обезвоживание. Вначале испражнения жидкие, зеленые, без слизи и кислой реакции. Позднее они приобретают гнилостный запах. Через 3-4 дня испражнения принимают оранжевое окрашивание. Такой оранжевый цвет испражнений остается до конца заболевания. Постепенно испражнения густеют и стул становится реже. Температура нормальная, субфебрильная, а в некоторых случаях и высокая. Кожа быстро бледнеет, приобретает серо-землистый цвет. В отдельных случаях наблюдаются явления склеремы и петехии, особенно у недоношенных детей, у которых вообще заболевание протекает тяжелее. Появляется быстро распространяющаяся молочница. Кроме того, наблюдается небольшой насморк, кашель, а при значительном падении веса и симптомы пневмонии со склонностью к абсцедированкю. Нередко наблюдаются и гнойные отиты. Сердечная деятельность ускорена, тоны сердца глухие. Артериальное давление падает. Живот вздувается. Заболевание продолжается 1-2 недели. При анализе крови отмечается лейкоцитоз с полинуклеозом, небольшой сдвиг лейкоцитарной формулы влево, изредка лейкопения, СОЭ ускорена. Выздоровление наступает медленно.
Профилактика принципиально не отличается от профилактики сепсиса. Контактных детей не выписывают до 8 дней. После выписки больных детей необходима тщательная дезинфекция помещений. Белье замачивают в 0,25% растворе хлорамина и стирают отдельно. После выписки ребенка немедленно уведомляют детскую консультацию. Бактериологическое исследование секрета из носоглотки и испражнений у обслуживающего персонала следует проводить чаще.
Антибиотическое лечение состоит в назначении ампициллина по 150- 200 мг на кг веса в сутки внутримышечно. Кроме ампицилина, назначают и гентамицин по 3 мг на кг веса в сутки внутримышечно. При кровоизлияниях и явлениях сердечной слабости назначают известные кровеостанавливающие и сердечные средства. При вздутии живота вводят газоотводную трубочку или подкожно назначают 0,2 мл простигмина. Лечение при осложнениях со стороны легких такое же, как при пневмонии. В этих случаях ребенку в палате обеспечивают достаточное количество свежего воздуха, а при необходимости назначают кислород.
58. Роль жен. консультации в изучении и устранении отрицательного влияния факторов производства на течение беременности
59. Влагалищное исследование в родах. Показания, методика выполнения, возможные осложнения
Влагалищное исследование в первом периоде родов производят при первом обследовании роженицы, после излития околоплодных вод, при возникновении осложнений у матери или плода. Первоначально производят осмотр наружных половых органов (варикозные узлы, рубцы и др.) и промежности (высота, старые разрывы и др.). При влагалищном исследовании выясняют состояние мышц тазового дна (упругие, дряблые), влагалища (широкое, узкое, наличие рубцов, перегородок), шейки матки. Отмечают степень сглаживания шейки (укорочена, сглажена), началось ли раскрытие зева и степень раскрытия (в сантиметрах), состояние краев зева (толстые, тонкие, мягкие или ригидные), наличие в пределах зева участка плацентарной ткани, петли пуповины, мелкой части плода. При целом плодном пузыре определяют степень его напряжения во время схватки и паузы. Чрезмерное его напряжение даже во время паузы указывает на многоводие, уплощение — на маловодие, дряблость — на слабость родовой деятельности. Определяют предлежащую часть плода и опознавательные пункты на ней. При головном предлежании прощупывают швы и роднички и по их отношению к плоскостям и размерам таза судят о позиции, предлежании, вставлении (синклитическое или асинклитическое), наличии сгибания (малый родничок ниже большого) или разгибания (большой родничок ниже малого, лоб, лицо).
Если предлежащая часть расположена высоко над входом в таз и недостаточно достижима для пальцев, находящихся во влагалище, то в таких случаях второй рукой исследующего надавливают через брюшную стенку на предлежащую часть, приближая ее ко входу в малый таз и делая ее, таким образом, доступной для исследования через влагалище. Если распознавание опознавательных пунктов на предлежащей части затруднено (большая родовая опухоль, сильная конфигурация головки, пороки развития) или неясно предлежание, производят исследование "полурукой" (четырьмя пальцами) или всей рукой, смазанной стерильным вазелином.
При влагалищном исследовании, помимо выявления опознавательных пунктов головки, выясняют особенности костной основы родовых путей, исследуют поверхность стенок малого таза (нет ли деформации, экзостозов и др.).
На основании влагалищного исследования определяют отношение головки к плоскостям таза.
Различают следующие положения головки: над входом в таз, малым или большим сегментом во входе в таз; в широкой или узкой части полости малого таза, в выходе таза.
Головка, располагающаяся над входом малого таза (рис. 5.22), подвижна, свободно перемещается при толчках (баллотирует) или прижата ко входу в малый таз. При влагалищном исследовании головка не препятствует ощупыванию безымянных линий таза, мыса (если он достижим), внутренней поверхности крестца и лонного сочленения.
Головка плода малым сегментом во входе в малый таз (рис. 5.23) неподвижна, большая часть ее находится над входом в таз, небольшой сегмент головки — ниже плоскости входа в таз. При применении четвертого приема наружного акушерского исследования концы пальцев сходятся, а основания ладоней расходятся. При влагалищном исследовании крестцовая впадина свободна, к мысу можно "подойти" лишь согнутым пальцем (если мыс достижим). Внутренняя поверхность лонного сочленения доступна исследованию.
Головка плода большим сегментом во входе в малый таз (рис. 5.24) означает, что плоскость, проходящая через большой сегмент головки, совпадает с плоскостью входа в малый таз. При наружном акушерском исследовании, проводимом четвертым приемом, ладони расположены либо параллельно, либо концы пальцев расходятся. При влагалищном исследовании обнаруживается, что головка прикрывает верхнюю треть лонного сочленения и крестца, мыс недостижим, седалищные ости легко прощупываются.
Если головка располагается в широкой части малого таза (рис. 5.25), то плоскость, проходящая через большой сегмент головки, совпадает с плоскостью широкой части таза. При влагалищном исследовании определяют, что головка наибольшей окружностью находится в плоскости широкой части полости таза, две трети внутренней поверхности лонного сочленения и верхняя половина крестцовой впадины заняты головкой. Свободно прощупываются IV и V крестцовые позвонки и седалищные ости, т.е. определяются опознавательные точки узкой части полости малого таза.
Если головка располагается в узкой части малого таза (рис. 5.26), то плоскость большого сегмента головки совпадает с плоскостью узкой части таза. Головка над входом в таз не прощупывается. При влагалищном исследовании обнаруживается, что верхние две трети крестцовой впадины и вся внутренняя поверхность лонного сочленения прикрыты головкой плода, седалищные ости достигаются с трудом.
Головка в выходе малого таза — плоскость большого сегмента головки плода находится в выходе таза. Крестцовая впадина полностью заполнена головкой, седалищные ости не определяются (рис. 5.27).
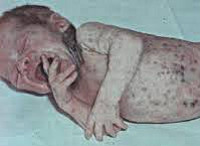
Сепсис новорожденных – генерализованная гнойно-септическая инфекция, характеризующаяся наличием первичного очага и циркуляцией инфекции в крови. Сепсис новорожденных проявляется признаками инфекционного токсикоза (температурной реакцией, вялостью, диспепсией, землистой окраской кожных покровов) и образованием гнойных метастатических очагов в различных органах (мозговых оболочках, легких, костях, печени и пр.). Диагноз сепсиса у новорожденных устанавливается на основании клинических критериев и выделения возбудителя при бактериологическом посеве крови. Лечение сепсиса новорожденных включает системную антибиотикотерапию, санацию первичного и метастатических гнойных очагов, посиндромную терапию.
Общие сведения
Сепсис новорожденных – общий инфекционный процесс, обусловленный попаданием условно-патогенной и гноеродной микрофлоры из локальных очагов в кровяное русло и сопровождающийся тяжелыми системными проявлениями. По данным зарубежной педиатрии, частота сепсиса новорожденных составляет 0,1-0,8%; среди недоношенных и детей с перинатальной патологией, находящихся в ОРИТ, - 14%. Неонатальная смертность, обусловленная сепсисом новорожденных, высока и стабильна – около 30-40%. Развитию сепсиса способствуют недостаточная сформированность барьерных механизмов и иммунитета у новорожденных, пограничные состояния периода новорожденности, патологическое протекание перинатального периода, сложность ранней диагностики септических состояний.

Причины
В настоящее время доминирующее место (около 50%) среди возбудителей сепсиса новорожденных принадлежит грамположительной флоре (главным образом, стафилококкам, гемолитическому стрептококку группы А). Чуть реже (до 40% случаев) выявляется грамотрицательная микрофлора (кишечная палочка, синегнойная палочка, клебсиелла и др.); в 10% этиологическими агентами выступает смешанная флора (часто ассоциация стафилококка с грибами Candida).
Со стороны матери факторами, способствующими бактериальной контаминации новорожденного, выступают бактериальный вагиноз, кольпиты, эндометрит. Большое значение имеет степень и характер иммуносупрессии у новорожденного, которые могут быть связаны с неполноценным питанием или приемом лекарств беременной, наследственным иммунодефицитом или ВИЧ-инфекцией. В отдельных случаях причиной вспышек сепсиса новорожденных становится несоблюдение санитарного режима в родильных или детских отделениях.
Классификация
По времени развития выделяют внутриутробный и постнатальный (ранний неонатальный и поздний неонатальный) сепсис новорожденных. Внутриутробный сепсис предполагает антенатальное или интранатальное инфицирование плода; при этом первичный гнойно-септический очаг располагается вне организма ребенка (чаще всего в его роли выступает плацентит, хорионит, хориоамнионит и т. д.). В случае постнатального сепсиса первичный гнойно-воспалительный очаг всегда располагается в организме самого новорожденного.
Ранний неонатальный сепсис новорожденных развивается в первые 4-ро суток жизни ребенка. Клинические течение заболевания обычно молниеносное, с быстрым развитием полиорганнной недостаточности, летальным исходом в 5-20% случаев. Поздний неонатальный сепсис новорожденных манифестирует на 5-й день и позднее. Характеризуется медленно прогрессирующим течением, возникновением вторичных септических очагов, 5-10%-ной летальностью.
Течение сепсиса новорожденных может быть молниеносным (3-7 дней), острым (до 4-8 недель), подострым (до 1,5-3 месяцев), затяжным (более 3 месяцев). С учетом локализации первичного септического очага и входных ворот различают: пупочный, кожный, легочный, ринофарингеальный, отогенный, риноконъюнктивальный, кишечный, урогенный, катетеризационный и др. виды сепсиса новорожденных. Сепсис новорожденных может протекать в форме септицемии или септикопиемии.
Симптомы сепсиса новорожденных
Септицемия или сепсис новорожденных без метастазов обычно развивается на фоне предшествующего мокнущего пупка, конъюнктивита, гнойничковой сыпи, опрелостей, стоматита. Предвестниками сепсиса новорожденных могут выступать вялость или беспокойство, снижение аппетита, обильные частые срыгивания, плохая прибавка в весе. В период разгара развивается температурная реакция (гипер- или гипотермия), отечный синдром или эксикоз, гипотрофия. Характерным признаком сепсиса новорожденных является грязновато-серый (землистый) оттенок кожных покровов, желтушность, мраморность кожи, сыпь.
Вследствие токсического поражения различных органов возникают гепатоспленомегалия, пневмопатия (тахипноэ, цианоз), кардиопатия (тахикардия или брадикардия, артериальная гипотензия), диспепсия, мочевой синдром (олигурия, анурия, ОПН), геморрагический синдром, надпочечниковая недостаточность. Чаще всего септицемия осложняется присоединением пневмонии, которая выступает как самостоятельное интеркуррентное заболевание.
Септикопиемия или сепсис новорожденных с гнойными метастазами характеризуется возникновением на фоне интоксикации вторичных очагов отсева в мозговых оболочках, легких, костях, печени, других органах. Чаще всего септикопиемия протекает с развитием гнойного менингита, абсцедирующей пневмонии, остеомиелита; реже – с формированием абсцесса печени, гнойного артрита, панофтальмита, медиастинита, флегмоны желудка или кишечника. В восстановительном периоде происходит санация пиемических очагов, стихание токсикоза, постепенное восстановление нарушенных функций.
Молниеносная форма сепсиса новорожденных протекает с развитием септического шока: стремительным ухудшением состояния ребенка, снижением температуры тела, брадикардией, кровоточивостью, отеком легких, острой почечной недостаточностью. Летальный исход при молниеносном течении сепсиса новорожденных наступает в течение 3-5 суток.
Диагностика сепсиса новорожденных
Диагноз сепсиса новорожденного может быть заподозрен неонатологом или педиатром на основании лихорадки свыше 3 дней или прогрессирующей гипотермии; гиперлейкоцитоза, сменяющегося лейкопенией; повышением содержания в крови маркеров инфекционного процесса (СРБ, интерлейкина-8, прокальцитонина).
Факт бактериемии при сепсисе новорожденных подтверждается путем посева крови на стерильность. Важное значение имеет выявление первичного гнойного очага и метастатических очагов, микробиологического исследование отделяемого из них (бактериологическое исследование мазка с конъюнктивы, мочи на микрофлору, соскоба/отделяемого с кожи на микрофлору, мазка из глотки, кала на дисбактериоз и т. п.).
Дифференциальная диагностика сепсиса новорожденных осуществляется с локализованными гнойно-воспалительными заболеваниями (пневмонией, медиастинитом, перитонитом, менингитом, энтероколитом), генерализованными вирусными инфекциями (цитомегалией, герпесом, энтеровирусной инфекцией) и микозами (кандидозом, аспергиллезом) и др. Для этого используются дополнительные лабораторные методы – ПЦР, ИФА, микроскопия.
Лечение сепсиса новорожденных
Терапия при сепсисе новорожденных проводится одновременно в нескольких направлениях и включает санацию септического и пиемических очагов, подавление циркуляции возбудителя в крови, коррекцию нарушенных функций.
Основу этиологического лечения сепсиса новорожденных составляет антибиотикотерапия: эмпирическая комбинированная до уточнения характера микрофлоры) и целенаправленная после получения антибиотикограммы. Противомикробные препараты вводятся внутривенно, в максимальных возрастных дозировках в течение 10-15 суток с последующей сменой. Чаще всего в клинической практике для лечения сепсиса новорожденных в различных сочетаниях используются цефалоспорины, аминогликозиды, аминопенициллины, карбапенемы и др.
С целью местного лечения гнойных очагов производится вскрытие фурункулов и абсцессов, перевязки с антибактериальными и ферментными препаратами; назначается УВЧ, СВЧ, электрофорез.
Патогенетическая терапия сепсиса новорожденных включает иммунокоррекцию (плазмаферез, гемосорбцию, введение иммуноглобулинов), проведение дезинтоксикационной терапии (внутривенной инфузии глюкозо-солевых растворов и свежезамороженной плазмы), адекватную кислородотерапию и т. д. При сепсисе новорожденных обязательно проводится мониторинг состояния жизненно-важных функций: АД, ЧСС, ЭКГ, КОС и газового состава крови, биохимических показателей (сахара крови, креатинина, электролитов), гематокрита.
В остром периоде сепсиса целесообразно пребывание новорожденных в кувезе, кормление материнским молоком, тщательный уход. В восстановительном периоде к лечению подключается гимнастика, массаж, лечебные ванны.
Прогноз и профилактика сепсиса новорожденных
Прогноз сепсиса новорожденных серьезный: летальность составляет от 30-40% до 60% среди глубоко недоношенных детей. У выздоровевших детей в отделенном периоде могут отмечаться частые ОРВИ, пиелонефрит, анемия, перинатальная энцефалопатия.
Профилактика сепсиса новорожденных включает выявление и санацию инфекций мочеполовой сферы у беременной, соблюдение противоэпидемических мероприятий медперсоналом родильных домов и отделений новорожденных, тщательный гигиенических уход за новорожденным, естественное вскармливание. Вопрос о сроках вакцинации новорожденных с сепсисом против туберкулеза и против гепатита В , проводимой в первые дни жизни, решается в индивидуальном порядке.
Септический шок – это тяжелое патологическое состояние, возникающее при массивном поступлении в кровь бактериальных эндотоксинов. Сопровождается тканевой гипоперфузией, критическим снижением артериального давления и симптомами полиорганной недостаточности. Диагноз ставится на основании общей клинической картины, сочетающей в себе признаки поражения легких, сердечно-сосудистой системы (ССС), печени и почек, централизации кровообращения. Лечение: массивная антибиотикотерапия, инфузия коллоидных и кристаллоидных растворов, поддержание деятельности ССС за счёт введения вазопрессоров, коррекция респираторных нарушений путем ИВЛ.
МКБ-10
Общие сведения
Септический шок (СШ) также называют инфекционно-токсическим (ИТШ). Как самостоятельная нозологическая единица патология впервые была описана в XIX веке, однако полноценное изучение с разработкой специфических противошоковых мер началось не более 25 лет назад. Может возникать при любом инфекционном процессе. Наиболее часто встречается у пациентов хирургических отделений, при менингококковой септицемии, брюшном тифе, сальмонеллезе и чуме. Распространен в странах, где диагностируется наибольшее количество бактериальных и паразитарных заболеваний (Африка, Афганистан, Индонезия). Ежегодно от ИТШ погибает более 500 тысяч человек по всему миру.

Причины
В абсолютном большинстве случаев патология развивается на фоне ослабления иммунных реакций. Это происходит у пациентов, страдающих хроническими тяжелыми заболеваниями, а также у людей пожилого возраста. В силу физиологических особенностей сепсис чаще диагностируется у мужчин. Список самых распространенных заболеваний, при которых могут возникать явления ИТШ, включает в себя:
- Очаги гнойной инфекции. Признаки системной воспалительной реакции и связанных с ней нарушений в работе внутренних органов отмечаются при наличии объемных абсцессов или флегмоны мягких тканей. Риск генерализованного токсического ответа повышается при длительном течении болезни, отсутствии адекватной антибактериальной терапии и возрасте пациента старше 60 лет.
- Длительное пребывание в ОРИТ. Госпитализация в отделение реанимации и интенсивной терапии всегда сопряжена с риском возникновения сепсиса и инфекционного шока. Это обусловлено постоянным контактом с резистентной к антибактериальным препаратам микрофлорой, ослаблением защитных сил организма в результате тяжёлой болезни, наличием множественных ворот инфекции: катетеров, желудочных зондов, дренажных трубок.
- Раны. Нарушения целостности кожных покровов, в том числе возникшие во время операции, существенно повышают риски инфицирования высококонтагиозной флорой. ИТШ начинается у больных с загрязненными ранами, не получивших своевременной помощи. Травматизация тканей в ходе оперативного вмешательства становится причиной генерализованной инфекции только при несоблюдении правил асептики и антисептики. В большинстве случаев септический шок возникает у пациентов, перенесших манипуляции на желудке и поджелудочной железе. Еще одна распространенная причина – разлитой перитонит.
- Приём иммунодепрессантов. Лекарственные средства, угнетающие иммунитет (меркаптопурин, кризанол), используются для подавления реакции отторжения после трансплантации органов. В меньшей степени уровень собственной защиты снижается при употреблении химиотерапевтических средств – цитостатиков, предназначенных для лечения онкологических заболеваний (доксорубицина, фторурацила).
- СПИД.ВИЧ-инфекция в стадии СПИДа приводит к развитию нетипичного сепсиса, спровоцированного не бактериальный культурой, а грибком рода Candida. Клинические проявления болезни характеризуется малой степенью выраженности. Отсутствие адекватного иммунного ответа позволяет патогенной флоре свободно размножаться.
Возбудитель сепсиса – грамположительные (стрептококки, стафилококки, энтерококки) и грамотрицательные (Enterobacter cloacae, Clostridium pneumoniae) бактерии. Во многих случаях культуры нечувствительны к антибиотикам, что затрудняет лечение пациентов. Септический шок вирусного происхождения в настоящее время вызывает споры специалистов. Одни представители научного мира утверждают, что вирусы неспособны стать причиной патологии, другие – что внеклеточная форма жизни может спровоцировать системную воспалительную реакцию, являющуюся патогенетической основой ИТШ.
Патогенез
В основе симптомов лежит неконтролируемое распространение медиаторов воспаления из патологического очага. При этом происходит активация макрофагов, лимфоцитов и нейтрофилов. Возникает синдром системного воспалительного ответа. На фоне этого снижается периферический сосудистый тонус, объем циркулирующей крови падает за счет повышения проницаемости сосудов и застоя жидкости в микроциркуляторном русле. Дальнейшие изменения обусловлены резким уменьшением перфузии. Недостаточное кровоснабжение становится причиной гипоксии, ишемии внутренних органов и нарушения их функции. Наиболее чувствителен головной мозг. Кроме того, ухудшается функциональная активность легких, почек и печени.
Помимо СВР в формировании септического шока важную роль играет эндогенная интоксикация. В связи со снижением работоспособности экскреторных систем в крови накапливаются продукты нормального обмена веществ: креатинин, мочевина, лактат, гуанин и пируват. Во внутренних средах повышается концентрация промежуточных результатов окисления липидов (скатол, альдегиды, кетоны) и бактериальных эндотоксинов. Всё это вызывает тяжелые изменения гомеостаза, расстройства кислотно-щелочного баланса, нарушения в работе рецепторных систем.
Классификация
Симптомы септического шока
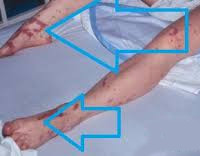
90% случаев СШ сопровождается дыхательной недостаточностью различной степени тяжести. Пациенты с декомпенсированным и терминальным течением болезни нуждаются в аппаратной респираторной поддержке. Печень и селезенка увеличены, уплотнены, их функция нарушена. Может отмечаться атония кишечника, метеоризм, стул с примесью слизи, крови и гноя. На поздних стадиях возникают симптомы диссеминированного внутрисосудистого свертывания: петехиальная сыпь, внутреннее и наружное кровотечения.
Осложнения
Септический шок приводит к ряду тяжелых осложнений. Наиболее распространённым из них считается полиорганная недостаточность, при которой нарушается функция двух и более систем. В первую очередь страдает ЦНС, легкие, почки и сердце. Несколько реже встречается поражение печени, кишечника и селезенки. Летальность среди пациентов с ПОН достигает 60%. Часть из них погибает на 3-5 сутки после выведения из критического состояния. Это обусловлено органическими изменениями во внутренних структурах.
Еще одним распространенным последствием ИТШ являются кровотечения. При формировании внутримозговых гематом у пациента развивается клиника острого геморрагического инсульта. Скопление экстравазата в других органах может приводить к их сдавлению. Уменьшение объема крови в сосудистом русле потенцирует более значимое снижение артериального давления. ДВС на фоне инфекционно-токсического шока становится причиной гибели пациента в 40-45% случаев. Вторичное поражение органов, спровоцированное микротромбозами, возникающими на начальном этапе формирования коагулопатии, отмечается практически у 100% больных.
Диагностика
- Осмотр и физикальное исследование. Реализуется непосредственно лечащим врачом. Специалист обнаруживает характерные клинические признаки шокового состояния. Для этого проводится тонометрия, визуальная оценка цвета кожных покровов, особенностей дыхательных движений, подсчет пульса и ЧДД, аускультация сердца и легких. При подозрении на наличие осложнений необходима оценка неврологического статуса на предмет симптоматики кровоизлияния в мозг.
- Аппаратное исследование. Имеет вспомогательное значение. Пациенту показан контроль состояния с использованием анестезиологического монитора. На экран устройства выводится информация о величине артериального давления, частоте сердечных сокращений, степени насыщения крови кислородом (при легочной недостаточности SpO2<90%) и коронарном ритме. На фоне нарушений дыхания и токсического поражения миокарда может отмечаться тахикардия, аритмия и блокады внутрисердечной проводимости.
- Лабораторное исследование. Позволяет выявить имеющиеся нарушения гомеостаза, сбои в работе внутренних органов. У пациентов с шоком септического происхождения обнаруживается повышенный уровень креатинина (> 0,177 ммоль/л), билирубина (>34,2 мкмоль/л), лактата (>2 ммоль/л). О нарушении коагуляции свидетельствует тромбоцитопения (
Лечение септического шока
Пациентам показана интенсивная терапия. Лечение проводят в отделениях ОРИТ с использованием методов аппаратной и медикаментозной поддержки. Лечащий врач – реаниматолог. Может потребоваться консультация инфекциониста, кардиолога, гастроэнтеролога и других специалистов. Требуется перевод больного на искусственную вентиляцию лёгких, круглосуточное наблюдение среднего медицинского персонала, парентеральное кормление. Смеси и продукты, предназначенные для введения в желудок, не используются. Все методы воздействия условно делятся на патогенетические и симптоматические:
- Патогенетическое лечение. При подозрении на наличие сепсиса больному назначают антибиотики. Схема должна включать в себя 2-3 препарата различных групп, обладающих широким спектром действия. Подбор медикамента на начальном этапе проводят эмпирическим путем, в соответствии с предполагаемой чувствительностью возбудителя. Одновременно с этим производят забор крови на стерильность и восприимчивость к антибиотикам. Результат анализа готовится в течение 10 дней. Если к этому времени подобрать эффективную лекарственную схему не удалось, следует использовать данные исследования.
- Симптоматическое лечение. Подбирается с учетом имеющейся клинической картины. Обычно больные получают массивную инфузионную терапию, глюкокортикостероиды, инотропные средства, антиагреганты или гемостатики (в зависимости от состояния свертывающей системы крови). При тяжелом течении болезни используют препараты крови: свежезамороженную плазму, альбумин, иммуноглобулины. Если пациент находится в сознании, показано введение анальгетических и седативных лекарств.
Прогноз и профилактика
Септический шок имеет неблагоприятный прогноз для жизни. При субкомпенсированном течении погибает около 40% больных. Декомпенсированная и терминальная разновидности оканчиваются гибелью 60% пациентов. При отсутствии своевременной медицинской помощи смертность достигает 95-100%. Часть больных умирает через несколько дней после устранения патологического состояния. Профилактика ИТШ заключается в своевременном купировании очагов инфекции, грамотном подборе антибиотикотерапии у хирургических больных, соблюдении антисептических требований в отделениях, занимающихся инвазивным манипуляциями, поддержке адекватного иммунного статуса у представителей ВИЧ-инфицированной прослойки населения.
2. Тактика ведения пациентов с сепсисом и септическим шоком в многопрофильном стационаре/ Сапичева Ю.Ю., Лихванцев В.В. – 2015.
Человека повсюду окружают миллиарды различных патогенов: бактерии, вирусы, грибки, которые пытаются пробить иммунные барьеры и поселиться в организме. У взрослых защитные функции тела развиты намного лучше, а в крови циркулируют антитела ко многим микробным антигенам, а вот малыши в этом плане совсем беззащитны, ведь они не сталкивались с возбудителями заболеваний. Инфекция у новорожденных вследствие несовершенства защитных сил, особенностей кожи и слизистых быстро проникает в организм, вызывая гнойно-воспалительные заболевания.
Гнойно-септические инфекции новорожденных – это инфекционно-воспалительные заболевания, возникшие в течении 30 первых дней жизни ребенка и характеризующиеся соответствующими клиническими проявлениями.
К основным наиболее распространенным нозологическим формам ГСИ новорожденных относятся:
- Инфекции дыхательных путей – внутрибольничные и внутриутробные пневмонии.
- Инфекции кожи и мягких тканей - маститы, везикулопустулезы, омфалиты.
- Инфекции глаз и слезного мешка- конъюнктивиты, дакриоциститы.
- Инфекции костей и суставов - остеомиелиты.
- Генерализованная форма- сепсис.
Внутрибольничные инфекции новорожденных - заболевания новорожденных, возникшие в период пребывания в стационаре и/или в течение максимального инкубационного периода инфекции после выписки (для ГСИ – 7 дней) и не имевшиеся в инкубационном или скрытом периоде во время внутриутробного развития.
По итогам 2016 года в ВКО показатель заболеваемости гнойно-септическими инфекциями среди новорожденных снизился на 13% и составил 4,2 (58 сл.) против 4,8 (67 сл.), при Республиканском показателе –1,7 (299 сл.).
По структуре заболеваемости снизилась доля заболевших внутриутробными инфекциями с 63% (42 сл.) в 2015г. до 53% (31 сл.) в 2016г., но в тоже время увеличилось количество заболевших новорожденных на участках с 37% (25сл.) в 2015г. до 45% (26 сл.) в 2016г.
ГСИ в раннем неонатальном периоде значительно ухудшает здоровье малыша и негативно сказываться на развитии его иммунной системы, поэтому с первых дней нужно соблюдать профилактические меры от гнойно-септических заболеваний.
Общие меры профилактики ГСИ в родильных стационарах:
- совместное пребывание матери и дитя
- колонизация кожных покровов и слизистых новорожденных осуществляется материнскими, а не госпитальными штаммами, вызывающими большинство ВБИ
- быстрее формируется нормальный биоценоз – фактор неспецифической защиты
- снижение интенсивности общения дитя с мед персоналом
- адекватное лечение соматических и инфекционных заболеваний, возникающих во время беременности
- раннее прикладывание к груди
- клинически оправданная ранняя выписка из род дома с последующим активным патронажем новорожденного и матери
- строгое соблюдение правил мытья рук
- строгое соблюдение рекомендуемых протоколов проведения лечебно-диагностических процедур
В домашних условиях профилактика заключается в следующем:
- частой влажной уборке помещения;
- соблюдении гигиены новорожденного;
- отсутствии контакта с больным и носителем;
- мытье рук перед касаниями лица или тела малыша.
Лечить малыша сложнее чем взрослого, ведь большинство лекарственных препаратов ему попросту не подходит, поэтому нужно избегать появления недугов. Профилактика болезней новорожденных поможет сохранить здоровье ребенка и укрепить его иммунитет.
Читайте также:

