Токсоплазмоз что это хламидиоз что это
Обновлено: 16.04.2024
Что такое токсоплазмоз? Причины возникновения, диагностику и методы лечения разберем в статье доктора Александрова Павла Андреевича, паразитолога со стажем в 14 лет.
Над статьей доктора Александрова Павла Андреевича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Токсоплазмоз — это острое и хроническое паразитарное заболевание человека в виде манифестных форм или носительства, вызываемое простейшими внутриклеточными паразитами — токсоплазмами, которые попадая в организм человека могут при условиях иммунодефицита поражать нервную ткань, среды глаза, сердечно-сосудистую и ретикулоэндотелиальную системы, вызывая поражение организма той или иной степени тяжести. Болезнь относится к группе TORCH-комплекса, т. е. вызывает врождённую патологию.
Этиология
Таксономия:
Вид — Toxoplasma gondii
Токсоплазмы обитают в мире в трёх формах:
- трофозоиты (тахизоиты);
- цисты (брадизоиты);
- ооцисты.
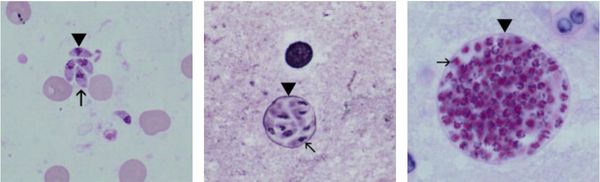
Трофозоиты достигают 4-7 мкм в длину и 2-4 мкм в ширину. Их тело по форме напоминает полумесяц с заострённым передним и закруглённым задним концами, состоит из пелликулы (покровной ткани) и различных органелл. Такие паразиты обитают во всех клетках млекопитающих кроме эритроцитов, размножаются путём деления. Могут создавать движение, активно проникая в клетки хозяина через клеточную мембрану или посредством фагоцитоза (захвата и переваривания клетки). Обнаруживаются в тканях в острой стадии инфекции. Их скопление внутри одной клетки называют псевдоцистой. Трофозоиты неустойчивы вне клетки и во внешней среде, быстро погибают при высушивании, прогревании и применении дезинфицирующих средств. Хорошо окрашиваются по Романовскому. Чувствительны к различным химиопрепаратам (сульфаниламидам, некоторым макролидам и другим).
Цисты размерами до 100 мкм отличаются плотной оболочкой, через которую не могут проникнуть антитела или лекарственные препараты. Внутри оболочки сосредоточено 3000-5000 паразитов, со временем они увеличиваются. Цисты формируются в организме хозяина (в основном в скелетных мышцах, миокарде и ЦНС) и живут там десятки лет. Чрезвычайно устойчивы к воздействиям внешних факторов. При адекватной иммунной системе могут пожизненно находиться в состоянии функционального покоя и не приносить никакого вреда организму человека.
Ооцисты играют основную роль в передаче инфекции. Они представляют собой овальные образования 10-12 мкм в диаметре. Их развитие и формирование длится 3-24 дня и проходит в слизистой оболочке тонкой кишки кошек. Затем в течение 7-20 дней паразиты выделяются с испражнениями, после этого срока новые фекалии кошки уже не заразны. За сутки с испражнениях животного выделяется до 10 миллионов ооцист. Спустя 2-3 дня при температуре 24 °C происходит споруляция ооцист — образование спор. При благоприятных условиях микроорганизмы сохраняются во внешней среде до года и дольше.
Существует множество штаммов токсоплазм, одни из которых отличаются высокой вирулентностью, а другие относительно маловирулентны. [1] [2] [7] [9]
Эпидемиология
Учитывая большое количество латентных форм, заболевание не поддаётся общему исчислению — им может быть заражено не менее 1,5 миллиардов человек. Только ежегодно регистрируется около 200 тысяч случаев внутриутробного инфицирования.
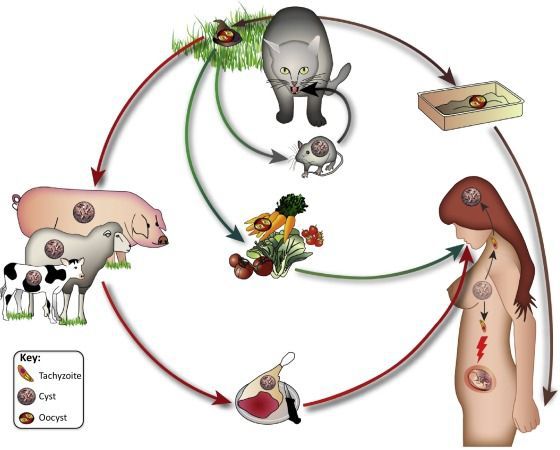
Распространение возбудителя повсеместное — токсоплазма обнаружена на всех материках. После заражения паразиты способны пожизненно сохранятся в организме большинства животных и птиц. Количество случаев приобретённого токсоплазмоза в разных странах колеблется: от 85 % во Франции и Мадагаскаре до 15 % в США и Англии.
- Фекально-оральный:
- водный и пищевой путь — при недостаточной термической обработке, чаще при употреблении сырого мяса и фарша;
- контактно-бытовой путь — при несоблюдении санитарных норм в повседневной жизни, например, при общении с кошками.
- Вертикальный путь (от матери к плоду) — преимущественно при первичном заражении матери во время беременности, часто у ВИЧ-инфицированных в стадии СПИДа.
- Артифициальный путь — при пересадке органов, в которых расположены цисты, пациенту с плохим иммунитету.
- Аэрогенный путь — при попадании инфицированной ооцистами пыли в рот человека.
- Контактный путь — при повреждении целостности кожных покровов. Встречается крайне редко, в основном у работников лабораторий и скотобоен, отмечен лишь в некоторых источниках, явного практического значения не имеет.
От человека к человеку заболевание не предаётся (кроме случаев каннибализма). Нельзя заразиться посредством укуса насекомых и при половом контакте.
Инфицирование токсоплазмой вызывает устойчивый пожизненный иммунитет к повторному заражению, однако известны случаи рецидива первичной инфекции при заражении другим высоковирулентным штаммом (у беременных, заразившихся при употреблении сырого мяса с другого континента). [1] [3] [5] [8] [9]
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы токсоплазмоза
Инкубационный период при манифестных формах (явных проявлениях болезни) длится от двух недель до двух месяцев.
Специфичных симптомов, характерных именно для токсоплазмоза, не существует.
В большинстве случаев приобретённого токсоплазмоза заболевание протекает бессимптомно или со стёртой клиникой, напоминающей нетяжёлое ОРЗ: кратковременная лихорадка, слабость, недомогание, повышение температуры до 38,0 °C, увеличение периферических лимфоузлов, небольшое увеличение печени и селезёнки.
Доказано, что токсоплазма может оказывать влияние на психику человека. Это выражается в учащении рискованных действий, снижении концентрации внимания, повышенной нервозности, у лиц с тяжёлым острым или длительным хроническим активным течением повышен риск развития шизофрении.
Иногда заболевание проявляется изолированной глазной формой — длительно текущие увеиты, иридоциклиты и хориоретиниты. Как правило, эти нарушения являются поздними проявлениями нераспознанного ранее врождённого процесса.
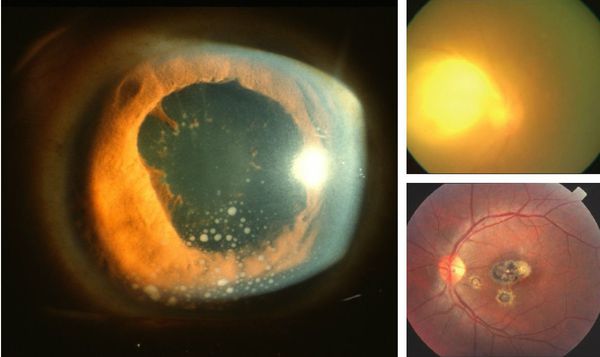
У людей с выраженным иммунодефицитом (ВИЧ, пересадка органов с последующей цитостатической терапией) возможно развитие генерализованного процесса с поражением нескольких органов (головного мозга, сердца, печени, почек, лёгких), нередко очень тяжёлого течения, проявляющегося в виде синдрома полиорганной недостаточности.
Токсоплазмоз у беременных может протекать в различных клинических вариантах и представляет опасность не столько для самой беременной (исключая тяжело протекающие патологии у беременных со СПИДом), сколько для плода.
При первичном заражении беременной токсоплазмозом имеет значение срок гестации:
- При инфицировании в первом триместре передача возбудителя плоду происходит лишь в 4 % случаев (к 13 неделе — в 6 %), но заканчивается, как правило, гибелью плода и выкидышем на ранних сроках. Если первичная инфекция у матери в первом триместре доказано, но выкидыш до 13 недели беременности не произошёл, то крайне высока вероятность, что внутриутробной передачи не было и ребёнок будет здоров.
- При инфицировании во втором триместре (особенно на 24-26 неделях) риск внутриутробной передачи резко возрастает и достигает 30-40 %, причём сопровождается развитием тяжёлых проявлений заболевания — одновременное увеличение селезёнки и печени, воспаление сосудистой оболочки и сетчатки глаза, поражения ЦНС в виде гидроцефалии, кальцификация, сыпь, миокардит, пневмония и другие.
- При заражении матери в третьем триместре передача инфекции ребёнку происходит с частотой до 90 %, однако проявления заболевания являются латентными или субклиническими и могут появиться спустя годы после рождения (отставание в развитии, нарушения зрения). [1][2][4][9]
Патогенез токсоплазмоза
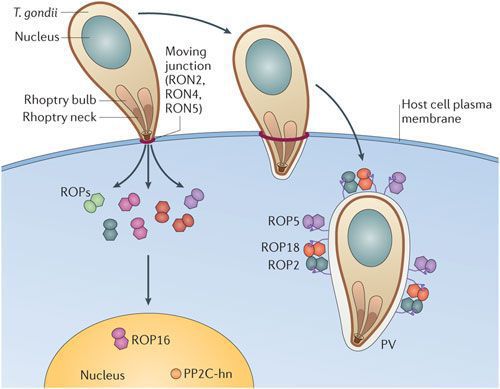
По мере развития и размножения токсоплазм поражённые клетки разрушаются, происходит заражение новых здоровых клеток, и при попадании возбудителя в кровоток паразиты разносятся по всему организму. Образуются некрозы с формированием фиброзной ткани и кальцификацией (отложение солей кальция в организме).
Под воздействием иммунитета безоболочечные трофозоиты превращаются в брадизоиты (оболочечные скопления токсоплазм), т.е. в тканевые цисты, которые сохраняются десятками лет в неактивном состоянии и при значительном снижении иммунитета способны к обратной трансформации с развитием обострения.
При первичной инфекции у беременных возбудитель проникает в ткани плода и вызывает воспалительный процесс, причём в разные периоды развития наблюдается различный характер воспаления: у эмбриона происходит лишь альтерация (дистрофия и некроз ткани без фиброза), в раннем фетальном периоде дополняется повышенным образованием соединительной ткани (фиброзом), а в позднем фетальном периоде присоединяется сосудистый компонент. Отсюда вытекают различные по характеру и тяжести поражения плода, которые зависят от сроков инфицирования матери. [1] [2]
Классификация и стадии развития токсоплазмоза
По течению процесса токсоплазмоз бывает:
- острым — до одного месяца;
- подострым - 1-3 месяц;
- хроническим — более трёх месяцев.
По клиническим признакам выделяют пять форм заболевания:
- Врождённый острый токсоплазмоз:
- манифестная форма (с указанием ведущих проявлений);
- субклиническая форма (с указанием способа верификации диагноза).
- Врождённый хронический токсоплазмоз:
- обострение / ремиссия;
- с резидуальными (остаточными) явлениями / без резидуальных явлений.
- Врождённый латентный токсоплазмоз.
- Приобретённый острый токсоплазмоз.
- Приобретённый хронический токсоплазмоз.
По степени тяжести заболевание бывает:
- лёгким;
- среднетяжёлым;
- тяжёлым (врождённая инфекция, токсоплазмоз при СПИДе).
По наличию осложнений выделяют:
- осложнённый токсоплазмоз;
- неосложнённый токсоплазмоз.
В Международной классификации болезней 10 пересмотра выделены шесть типов заболевания:
- B58.0 Токсоплазмозная окулопатия;
- B58.1 Токсоплазмозный гепатит (K77.0*);
- B58.2 Токсоплазмозный менингоэнцефалит (G05.2*);
- B58.3 Легочный токсоплазмоз (J17.3*);
- B58.8 Токсоплазмоз с поражением других органов;
- B58.9 Токсоплазмоз неуточнённый. [1][2][3]
Осложнения токсоплазмоза
При врождённой форме может возникнуть гидроцефалия, микроцефалия, задержка психомоторного развития и слепота. Эти осложнения сопровождаются увеличением или уменьшением размеров черепа, различными неврологическими расстройствами — косоглазием, судорогами, трудностью с сидением и держанием головы, рвотой и другими.
При глазной форме заболевания развивается слепота, снижение остроты зрения и воспалительные явления всех сред глаза. Причём возможно как рождение с грубыми дефектами зрения, так и появление воспалительных явлений и нарушения зрения спустя много лет после рождения.
Токсоплазмоз у иммунокомпрометированных людей осложняется шизофренией, токсоплазменный энцефалитом и полиорганной недостаточностью — тяжёлой патологией различных органов при выраженном иммунодефиците. При этом свойственна картина тяжёлого энцефалита. Прогноз, как правило, неблагоприятный. [1] [5] [8] [9]
Диагностика токсоплазмоза
Лабораторная диагностика:
- Клинический анализ крови: снижение уровня тромбоцитов, увеличение количества лимфоцитов и эозинофилов.
- Биохимический анализ крови: возможно повышение уровня трансаминаз и билирубина.
- Иммуноферментный анализ (ИФА):
- Выявление специфических антител класса M — острая инфекция или её реактивация. Имеет ряд недостатков — низкая специфичность, длительная циркуляция в организме, иногда до года после острого процесса. В сложных случаях уточнение следует производить при помощи метода "двойной сэндвич" или "иммунозахват" IgM ELISA.
- Выявление специфических антител класса G (клеток памяти) — носительство, инфицированность — появляются в среднем со второй недели заболевания и достигают пика на 1-2 месяце, сохраняются пожизненно, за исключением СПИД-ассоциированных заболеваний.
- Авидность IgG — уточнение давности заболевания. Недостатком является отсутствие стандартизации результатов, что зачастую приводит к различным ошибкам интерпретации. Наибольшее значение имеет высокая авидность, остальные результаты низкой и слабой авидности могут быть ошибочными и не должны трактоваться как недавно перенесённое заболевание при отсутствии других подтверждающих этот факт тестов.
- ПЦР-диагностика: выявление ДНК токсоплазмы в крови, других жидкостях и тканях человеческого организма. Особенно информативна в диагностике генерализованного, глазного и врождённого токсоплазмоза, в т. ч. в антенатальном периоде путём проведения амнио (не ранее 16 недель) и кордоцентеза (с 18 недели беременности).
- УЗИ-диагностика: внутриутробное выявление гидро- и микроцефалии, кальцификатов, гепатоспленомегалии и выраженной задержки развития. [1][2][4][5][6]
Дифференциальная диагностика
Токсоплазмоз — это инфекция с необычайно разнообразными проявлениями, поэтому ввиду неспецифичности проявлений основное место в дифференциальной диагностике отводиться лабораторному обследованию, а именно специфическим серологическим тестам.
Необходимо исключить следующие заболевания:
-
(ВЭБ-инфекцию) — боли в горле, преимущественное увеличение затылочных и заднешейных лимфоузлов, характерные изменения гемограммы (появление большого количества атипичных мононуклеаров и отсутствие столь выраженных изменений при врождённом течении), положительные IgM и ПЦР крови; — лимфоцитарный характер гемограммы, частое поражение слюнных желёз, положительные IgM, ПЦР крови;
- туберкулёз — длительное постепенное начало, лёгкий субфебрилитет (до 38,0 °C), ночная потливость, нездоровый румянец на щеках, кашель, специфические изменения в лёгких, положительные пробы на туберкулёз, выявление бациллы Коха в мокроте;
- лимфопролиферативные заболевания (лимфома Ходжкина, неходжкинские лимфомы) — специфические изменения при биопсии поражённой ткани (лимфоузлов);
- ВИЧ-инфекция — наличие факта возможного заражения, увеличение всех групп лимфоузлов, положительная серология;
- саркоидоз — специфические изменения в лёгких, положительные результаты гистологического исследования. [1][2][5]
Лечение токсоплазмоза
Большинство случаев приобретённого токсоплазмоза протекают в лёгкой или бессимптомной форме, они не регистрируются и, по-видимому, не нуждаются в каком-либо лечении.
Необходимость проведения специфической этиотропной терапии возникает лишь у некоторых групп пациентов:
- беременные с доказанным первичным инфицированием (в ряде случаев при реактивации хронической инфекции);
- дети с врождённой формой токсоплазмоза (при наличии явных клинических и лабораторных проявлений заболевания, субклинических и инаппарантных формах) — сроки и объём терапии зависят от конкретных данных;
- иммунокомпрометированные люди, у которых токсоплазмоз (острый или в фазе реактивации хронического процесса) протекает с выраженными клинико-лабораторными проявлениями. Основное направление воздействия в этом случае должно быть на устранение причины иммунодефицита, повышение уровня СД4 клеток.
Проведение лечения может осуществляться как в стационаре, так и амбулаторно в зависимости от выраженности процесса, реакции пациента на вводимые препараты, необходимости тех или иных вариантов патогенетического и симптоматического обеспечения. [1] [4] [7]
Прогноз. Профилактика
При приобретённом токсоплазмозе у иммунокомпетентных лиц прогноз благоприятный, у иммунокомпрометированных лиц (СПИД) прогноз серьёзен, нередки летальные исходы.
При врождённом токсоплазмозе исход заболевания зависит от сроков инфицирования плода:
- при инфицировании в первом триместре, как правило, происходит выкидыш;
- в более поздние сроки последствия варьируются от тяжёлых до резидуальных форм.
Основным методом профилактики приобретённого и врождённого токсоплазмоза является соблюдение санитарно-гигиенических правил, особенно беременными, не имеющими антител класса G к токсоплазмам:
- ограничение контакта с кошками;
- запрет на употребление сырого мяса, фарша и морепродуктов;
- тщательная промывка зелени, фруктов и овощей;
- мытьё рук перед едой;
- работа на приусадебном участке только в перчатках.
Для беременных особенно важен скрининг антител к токсоплазме, позволяющий выявить активно протекающее заболевание или риск его возникновения, а также вовремя провести медикаментозную профилактику острого токсоплазмоза беременной и снизить риск врождённой инфекции на 60 %. При отсутствии антител класса G в первом триместре необходимо отслеживать антитела IgM и IgG не только в тертьем, но и во втором триместре беременности.
В очаге токсоплазмоза противоэпидемические мероприятия не проводятся, вакцина на разработана. [2] [3]
Проведен анализ комплексной лабораторной диагностики у больных с сочетанной токсоплазмозно-хламидийной инфекцией при различных режимах лечения. Верификацию диагноза осуществляли на основании клинико-анамнестических данных, с учетом эпидемиологического анамнеза и подтверждали результатами иммуноферментного анализа – определение титров антител (IgG) в парных сыворотках с нарастанием в динамике и методом ПЦР (полимеразной цепной реакции). Для лабораторной диагностики сочетанной токсоплазмозно-хламидийной инфекции рекомендуется комплексный подход, заключающийся в применении нескольких лабораторно-диагностических методов: ИФА и ПЦР.

1. Анчупане И.С., Андерсоне Д.П., Милтиньш А.П. Патогенетическое обоснование корригирующей терапии больных хламидийно-трихомонадной инфекцией // Всесоюзный IX съезд дерматовенерологов. – М., 1991. – С. 6–7.
2. Бурова А.А., Абдуллаева С.А., Торганова Е.Н. Основные свойства возбудителя хламидиоза и его роль в развитии инфекций урогенитального тракта // Журнал микробиологии эпидемиологии и иммунобиологии. – М., 1999. – № 4. – С. 107–110.
5. Капранова Е.И., Белоусова Н.А., Мельникова Е.В. и др. Клиническое течение и диагностика внутриутробных инфекций у новорожденных // Эпидемиология и инфекционные болезни. – 1997. – № 1. – С. 27–30.
6. Кисина В.И., Забиров К.И. Урогенитальные инфекции у женщин (клиника, диагностика, лечение). – М., 2005.
7. Козлова В.И., Пухнер А.Ф. Вирусные, хламидийные и микоплазменные заболевания гениталий: Руководство для врачей. – М.: Филин, 1997. – 536 с.
8. Коробейникова Э.А. К вопросу о частоте и клинических особенностях урогенитального хламидиоза // Труды ИГМИ. – 1995. – № 33. – С. 166–168.
9. Орджоникидзе Н.В., Ушницкая Е.К. Диагностика внутриутробной инфекции // Акушерство и гинекология. – 2008. – № 5. – С. 12–14.
10. Щербо С.Н., Макаров В.Б., Дубинина И.Г. Диагностика хламидийной и гонококковой инфекции методом полимеразной цепной реакции // Клиническая лабораторная диагностика. – 1997. – № 7. – С. 6–9.
В последние годы в связи с увеличением инфекционных заболеваний урогенитального тракта большое внимание уделяется так называемому TORCH-комплексу (Toxoplasma gondii, Rubella, Cytomegalovirus, Herpes simplex virus и другие инфекции, среди них возбудители сифилиса, хламидиоза, гепатитов А и В, листериоза), характеризующемуся склонностью к субклиническому течению инфекции у взрослых, возможностью активации латентно текущей инфекции, трудностью клинической диагностики и необходимостью использования специальных лабораторных методов, выраженным тропизмом возбудителя к определенным органам и системам [3, 5, 6, 8, 9 ].
Развитию микстинфектологии способствует совершенствование методов диагностики, терапии и профилактики урогенитальных инфекций, значительное внимание уделяется разработке новых методов взятия материала от больных [1, 4]. До настоящего времени вопрос о влиянии микст-инфекции на течение заболевания, ее реинфекцию и персистенцию остается мало изученным [10]. Кроме того, все еще нет четкого алгоритма эффективной диагностики сочетанных инфекций, поскольку микробные ассоциации не только влияют на результаты лабораторных исследований, но и микст-инфекция приводит к несвоевременной диагностике [2, 7].
Цель исследования: оценка комплексной лабораторной диагностики у больных с сочетанной токсоплазмозно-хламидийной инфекцией.
Материалы и методы исследования
Всего под наблюдением находилось 78 больных в возрасте от 18 до 40 лет с сочетанной токсоплазмозно-хламидийной инфекцией, находившихся на стационарном лечении в Областной инфекционной больнице г. Караганды и амбулаторном наблюдении в поликлинике Карагандинского государственного медицинского университета. В исследование включены больные только женского пола с диагнозом сочетанная токсоплазмозно-хламидийная инфекция (хронический приобретенный токсоплазмоз и урогенитальный хламидиоз, вызванный Chlamydia trachomatis). Сочетанная инфекция отличалась полиморфизмом клинической симптоматики, формированием хронических форм заболевания, особенно у женщин репродуктивного возраста. Наряду с этим у женщин был отягощен акушерско-гинекологический анамнез (хронические воспалительные заболевания матки и придатков, невынашивание беременности, мертворождения, вторичное бесплодие).
Верификацию диагноза осуществляли на основании клинико-анамнестических данных, с учетом эпидемиологического анамнеза и подтверждали результатами иммуноферментного анализа – определение титров антител (IgG) в парных сыворотках с нарастанием в динамике и методом ПЦР (полимеразной цепной реакции). Материалом для ИФА исследования послужила кровь, для ПЦР – кровь и урогенитальные соскобы.
Результаты исследования и их обсуждение
Из-за отсутствия патогномоничных симптомов при микст-инфекции токсоплазмоза и хламидиоза решающую роль приобретали методы лабораторной диагностики: определение специфических антител (ИФА) и выявление самого возбудителя (ПЦР). Выделение возбудителя одним методом может давать ложноположительные и ложноотрицательные результаты, так как у каждого метода диагностики есть свои преимущества и недостатки. В связи с этим при обследовании больных мы применяли два метода лабораторной диагностики: ИФА и ПЦР.
В ходе исследования больные с сочетанной токсоплазмозно-хламидийной инфекцией были разделены на три группы в зависимости от проведенной терапии: I группа (исследуемая) – 26 больных получили комбинированный препарат (сульфадоксин+триметамин) + мидекамицин + иммуномодулятор циклоферон + хилак-форте; II группа (исследуемая) – 27 больных получили спирамицин + офлоксацин + циклоферон + хилак-форте; III группа (контрольная) – 25 больных получили традиционное лечение: спирамицин + доксициклин + циклоферон + хилак-форте.
В связи с этим эффективность проводимой терапии больных с сочетанной токсоплазмозно-хламидийной инфекции оценивалась по результатам клинического (регресс клинической симптоматики) и лабораторного обследования (по снижению титров специфических антител в ИФА, результатов ПЦР через 1 и 2 месяца после проведенного курса комплексного лечения).
С помощью метода ИФА мы установили, что 78 обследованных больных являлись серопозитивными, тогда как серонегативных лиц выявлено не было. По уровню показателя ИФА в I исследуемой группе обнаружены IgG к токсоплазмам и хламидиям у 26, во II исследуемой группе у 27 и в III контрольной группе у 25 больных. Во всех трех группах у этих же больных IgM отсутствовали. Вместе с тем не было больных с одновременным наличием маркеров активной формы IgM и обнаружением IgG.
При сочетанной токсоплазмозно-хламидийной инфекции ИФА на токсоплазмоз оценка показателя IgG к токсоплазмам была весьма вариабельной в зависимости от степени активации инфекции. Так, в I группе положительный показатель IgG был выявлен у 26 женщин, во II группе у 27 и в III группе у 25. Для дифференциальной диагностики и констатации активного инфекционного процесса у больных с высокими титрами IgG использовалось определение индекса авидности IgG (ИА). В связи с этим для исключения острой инфекции у больных с наиболее высокими титрами IgG и ярко выраженными клиническими проявлениями нами был определен индекс авидности. Так, в I исследуемой группе у 6 (23,1 %) пациенток, во II исследуемой группе у 4 (14,8 %) и в III контрольной группе у 5 (20 %) показатель ИА превышал 30 %, что свидетельствовало о нереальности инфицированности токсоплазмами в течение последних шести месяцев. В то же время во всех трех группах не было ни одного случая, при котором IgG – ИА оказался ниже 30,0 %, что исключало возможность инфицирования в течение последних шести месяцев.
При сочетанной токсоплазмозно-хламидийной инфекции ИФА на хламидиоз у этих же больных показал более высокие титры на антитела к хламидиям. Так, в I исследуемой группе слабо положительные титры выявлены у 4 (15,4 %) больных, положительные у 13 (50 %), резко положительные у 9 (34,6 %), во II исследуемой группе у 3 (11,1 %), 16 (59,3 %) и 8 (29,6 %), в III контрольной группе отмечен подъем показателя IgG соответственно у 5 (20 %), 12 (48 %) и 8 (32 %)ца 2)ийной инфекции до лечения.
Оценка эффективности лечения отслеживалась по снижению титров противотоксоплазмозных антител IgG и по снижению антихламидийных антител IgG через 1 месяц (табл.1).
После проведенного лечения во всех трех группах отмечалась положительная динамика, так в I группе больных отсутствие противотоксоплазмозных антител наблюдалось у 6 (23,1 %) человек, снижение титров IgG у 20 (76,9 %). Во II группе титры IgG стали отрицательными у 5 (18,5 %), снижение титров IgG у 22 (81,5 %), в III группе титры IgG не обнаруживались у 3 (12 %), снижение титров IgG у 22 (88 %). После проведенной терапии в I группе больных отсутствие антихламидийных антител наблюдалось у 14 (53,8 %) человек, снижение титров IgG у 12 (46,2 %); во II группе отрицательные результаты стали у 12 (44,4 %), снижение титров IgG у 15 (55,6 %); в III группе соответственно у 7 (28 %) и 18 (72 %). Следует отметить, что в трех группах отмечалось снижение титров IgG в 1,5-2 раза.
Результаты ИФА у больных с сочетанной токсоплазмозно-хламидийной инфекцией после лечения
Токсоплазмоз — это заболевание человека, вызванное микроскопическим одноклеточным паразитом Toxoplasma gondii. Отличается большим разнообразием клинических проявлений, в основном поражает:
- Нервную систему.
- Глаза.
- Скелетные и сердечную мышцы.
- Лимфатическую систему.
Возбудитель очень распространен в природе, его переносят несколько сотен видов животных и птиц, в том числе – домашних. Паразит легко проникает в организм, но часто не приводит к развитию острой инфекции. Заболевание обычно развивается у людей со сниженной иммунной реакцией – больных СПИДом и другими иммунодефицитными состояниями, при приеме иммуносупрессоров.
Возбудители заболевания, его источники
Наиболее опасным является внутриутробное инфицирование, которое нередко заканчивается выкидышем либо тяжелыми врожденными патологиями. По этой причине анализ на токсоплазмоз должен обязательно проводится при подготовке к беременности и вынашиванию ребенка.
По статистическим данным токсоплазма обнаруживается у 25-80% населения планеты. В отдельных регионах степень заражения достигает 95%.

Токсоплазма – внутриклеточный паразитический организм, который способен существовать в трех формах:
- Тахиозоиты. Имеют форму полумесяца и размер 2-4 мкм. Характерная особенность – при специальной окраске (по Романовскому-Гимзе) ядро приобретает красный цвет, а цитоплазма становится серо-голубой. В этой форме паразит проникает в клетки иммунной системы (макрофаги, фагоциты), в которых быстро размножается. После гибели клетки тахиозоиты высвобождаются и заражают здоровых макрофагов.
- Брадиозоиты (псевдоцисты). Это защитная форма токсоплазмы, в которой происходит большая часть жизнедеятельности возбудителя при нормальной иммунной реакции со стороны зараженного организма. Форма клетки брадиозоитов удлиненная, ядро смещено к одному из окончаний. Токсоплазмы в этой форме часто формируют тканевые псевдоцисты состоящие из множества клеток паразиты покрытых общей защитной оболочкой.
- Ооцисты. Эта форма токсоплазмы встречается только в эпителиальных клетках кишечника домашней кошки и ее диких родственников. Образуется в результате полового размножения паразита внутри клеток животного. Затем незрелые ооцисты выделяются в окружающую среду вместе с фекалиями. При достаточной температуре и притоке свежего кислорода ооцисты созревают в течение 2-7 дней. После завершения созревания ооцисты становятся способны заражать промежуточных хозяев токсоплазмы, в том числе – людей.
Основным источником заражения являются представители семейства кошачьих, в подавляющем большинстве – домашняя кошка. Механизм передачи паразита – фекально-оральный. Реализуется за счет:
- Употребления недостаточно термически обработанных мясных продуктов (особенно свинины и баранины).
- Через плохо вымытые овощи, зелень, фрукты.
- Несоблюдение правил личной гигиены (немытые руки).
Изредка возможно прямое заражение токсоплазмой через микроповреждения кожных покровов. От матери к ребенку паразит передается редко. В среднем одно заражение на 2-3,5 тыс. беременных. Наиболее вероятно инфицирование плода токсоплазмой если в процессе вынашивания организм беременной впервые столкнулся с паразитом.
Восприимчивость к токсоплазме крайне высока, для заражения достаточно единичных ооцист. Наиболее восприимчивы молодые люди, у пожилых (после 60 лет) паразит выявляется значительно реже.

Приобретенный токсоплазмоз, симптомы

Явные клинические симптомы у большей части заразившихся отсутствуют, болезнь сразу переходит в латентную фазу носительства. Инкубационный период составляет от 1 до 3 недель.
При проявлении выраженной клинической картины симптоматика нарастает медленно. Обычно болезнь начинается бессимптомно с увеличения региональных лимфатических узлов (паховых, подмышечных, шейных). Лимфоузлы эластичны, безболезненны, больные в этот период не предъявляют никаких жалоб.
После первой недели развития инфекционного процесса происходит увеличение селезенки и печени. Могут возникать ноющие боли в крупных мышечных группах нижних и верхних конечностей. У каждого пятого в этот период развивается хориоретинит проявляющийся в выпадении участков поля зрения.
Начиная со второй недели симптоматика поражения ЖКТ начинает затухать. Уменьшаются и быстро исчезают симптомы энтерита, снижается общая интоксикация организма. Одновременно развивается поражение:
- Опорно-двигательной системы. Усиливается болевой синдром в конечностях, суставах, возможно нарушение подвижности и мелкой моторики.
- Ретикулоэндотелиальной. Проявляется гепатолиенальным синдромом, мезаденитом.
- Сердечно-сосудистой. Нередко развиваются нарушения ритма сердечных сокращений, симптомы миокардита либо перикардита.
На 3-4 неделе заболевание завершается затуханием всех проявлений и переходом токсоплазмоза в бессимптомное носительство. При воздействии негативных факторов, ослабляющих иммунитет возможна манифестация заболевания с развитием вышеописанной клинической картины, которая снова переходит в латентную фазу.
Частые рецидивы острой формы токсоплазмоза, особенно на фоне иммуноподавляющих факторов, могут приводить к серьезным осложнениям. Чаще встречаются:
- Миокардиодистрофия.
- Психоневрологические патологии.
- Снижение интеллекта.
- Атрофия зрительного нерва вплоть до полной слепоты.
- Синдром хронической усталости.
Острый токсоплазмоз у женщин может приводит к нарушению менструального цикла, выкидышам и другим патологиям со стороны половой системы.
Хронический приобретенный токсоплазмоз – достаточно редкое явление, считается СПИД-ассоциированной формой заболевания. Протекает с периодическими обострениями, часто развиваются осложнения со стороны ЦНС в виде энцефалитов и поражения органов зрения.
Наиболее тяжелое следствие хронического токсоплазмоза – генерализованная инфекция в ходе которой быстро развивается полиорганная недостаточность, иногда данное осложнение завершается смертью больного.
Врожденный токсоплазмоз, возникающий при беременности

Возникает при проникновении паразита через плацентарный барьер и заражении плода. В большинстве случаев происходит при первичном заражении во время беременности, реже – при рецидиве токсоплазмоза связанном со снижением иммунитета. Основная группа риска – женщины, которые не были заражены токсоплазмой до наступления беременности. Если в результате контакта с возбудителем произойдет манифестация заболевания в процессе вынашивания плода – достаточно высока вероятность развития врожденного токсоплазмоза.
Процент выживаемости детей при внутриутробном инфицировании зависит от срока, на котором оно произошло:
- При инфицировании на первом триместре шанс на выживание плода – 15%
- На втором – 30%.
- На третьем – 60%
Даже если беременность успешно завершается, сохраняется крайне высокая степень развития врожденных патологий и врожденного токсоплазмоза. Болезнь протекает тяжело, особенно если инфицирование произошло на ранних сроках. Развивается характерная тетрада патологигй:
- Гидроцефалия.
- Двусторонний ретинохороидит.
- Задержка психофизического развития.
- Церебральные кальцификаты.
Прогноз в случае врожденного токсоплазмоза неблагоприятный, в большинстве случаев болезнь завершается смертью новорожденного либо тяжелой инвалидизацией. Даже если после внутриутробного заражения острая клиническая картина не возникла такие дети находятся в группе риска развития:
- Умственной недостаточности.
- Эпилепсии.
Возможно развития многих других патологий, которые проявляются спустя месяцы и годы после рождения. По этой причине острая форма токсоплазмоза, возникшая во время беременности – показание к проведению аборта даже на поздних сроках. При беременности необходимо сдавать массу анализов, которые помогают выявить наличие не только токсоплазмоза, но и ЦМВ-инфекции.
Показания к обследованию
Анализ чаще всего назначают в двух случаях:
- При планировании беременности в составе стандартного пакета лабораторной диагностики TORCH-инфекции.
- При подозрении на токсоплазмоз и определенных симптомах.
Также лабораторная диагностика используется при выявлении симптомов острого токсоплазмоза у взрослых либо детей.
В общей врачебной практике данный анализ назначают в случае проявления у пациентов специфических симптомов (нарушение зрения, судороги) а также ВИЧ-инфицированным.
Дифференциальная диагностика
Проводится с болезнями, симптомы которых схожи с острой и хронической формой токсоплазменной инфекции. В их число входят:
- Инфекционный мононуклеаз.
- Микоплазмоз.
- Хламидиоз.
- Цитомегалия.
- Туберкулез.
Также необходимо исключить онкологические патологии и системные заболевания (ревматизм, лимфогранулематоз). Окончательный диагноз устанавливается после получения результатов специфичных серологических исследований и ПЦР. Существует достаточно много лабораторных методик обнаружения специфических антител к токсоплазме. В их число входят:
- ИФА. Иммуноферментный анализ.
- РНИФ. Реакция непрямой иммунофлюоресценции. Становится позитивной с первой недели заболевания. Высокий титр антител может сохранятся до 15 лет.
- РСК. Реакция связывания комплемента. Становится положительной с 10-14 дня развития болезни, сохраняется на протяжении 2-3 лет.
Материал для исследования

Для обнаружения специфических антител к токсоплазме производится забор крови из вены, особой подготовки процедура не требует. Для проведения ПЦР-реакции подходит любой биологический материал – кровь, слюна, образцы тканей, другие биологические жидкости (ликвор, моча).
Если возникает потребность в диагностике токсоплазмоза у плода возможен забор крови из пупочного канатика. Процедура назначается редко потому что связана с высоким риском осложнений и преждевременного прерывания беременности. Более щадящая методика – взятие на анализ околоплодной жидкости путем пункции. Эти методики применяют в случае, когда результаты специфических анализов беременной с подозрением на токсоплазмоз не дают достаточной ясности диагноза.
Показания к применению различных лабораторных исследований и особенности интерпретации результатов у разных категорий обследуемых
В зависимости от категории пациента (возрастной группы, группы риска) показано применения различных наборов методик диагностики. Особенно важен правильный выбор диагностических методов в случае подозрений на токсоплазмоз у беременных женщин.
Обследование на токсоплазмоз при беременности
Если в процессе беременности у беременной выявлены симптомы которые могут свидетельствовать о развитии острого токсоплазмоза необходимо при помощи серологических методов установить уровень специфических иммуноглобулинов.
Для выявления острой стадии заболевания лучше всего подходит иммуноферментный метод (ИФА). Он наиболее точно показывает концентрацию IgM, повышение уровня которого свидетельствует о протекающем, либо недавно присутствовавшем остром токсоплазмозе.
Определение уровней IgG менее информативно так как эти антитела сохраняются долгое время после перенесенной инфекции и свидетельствуют скорее о носительстве, чем о недавнем заражении либо обострении. Женщины, перенесшие инфицирование токсоплазмой до беременности застрахованы от заражения плода и не входят в группу риска.
Также важно получение иммунологической картины в динамике, для чего специфические тесты проводятся не реже 1 раза в 2 недели. Изучение динамики изменений титров антител позволяют с большей точностью установить диагноз.
Нужно учитывать, что серологическая картина, свидетельствующая об инфицировании токсоплазмой не является 100% показанием для прерывания беременности. В этом случае потребуется проведение дополнительных анализов путем взятия крови плода из пупочного канатика и образцов амниотической жидкости пункционным методом.
Обследование новорожденных детей и детей раннего возраста
Направлено на раннее обнаружение возбудителя, до начала острой фазы врожденного токсоплазмоза и развития тяжелых осложнений. Назначается, когда есть подозрение на инфицирование токсоплазмой, включает в себя следующие тесты:
- Выделение паразита путем внесения материала из плаценты и пупочного канатика в живых мышей.
- Проведение ПЦР-анализа амниотической и люмбальной жидкостей.
- Компьютерная томография либо МРТ головы. Позволяет выявить на ранних стадиях специфические изменения в головном мозге, например, гидроцефалию.
Серологические методики также применяются, но они дают только дополнительную информацию. Иммунная система новорожденного недостаточно активна, часто неспособна выработать достаточно высокий титр специфических антител.
Обследование больных ВИЧ-инфекцией
Диагностика заключается в регулярном отслеживании титров иммуноглобулинов G серологическими методами. Титрование иммуноглобулинов M неинформативно так как у большинства ВИЧ-позитивных уровень антител этой группы крайне вариабелен.
В прямом выявлении возбудителя путем микроскопии образцов ткани либо заражения лабораторных животных как правило необходимости нет. Диагноз достаточно точно можно установить за счет серологической диагностики и наличия специфической клиники токсоплазмоза. У ВИЧ-позитивных больных она более выражена, что значительно упрощает постановку диагноза.
Обследование в Медарт

На базе медицинского центра Медарт выполняется полный комплекс серологических анализов для выявления токсоплазмы в организме пациента. Иммунологическое исследование с целью выявления специфических иммуноглобулинов входит в состав комплексных тестов ЗППП, предназначенных для пар, планирующих рождение ребенка. Возможно выполнения забора крови и других биологических жидкостей для установления наличия токсоплазмы и уточнения клинической картины протекания заболевания.
Высокоточное современное оборудование позволяет в кратчайшие сроки получить точные результаты исследований.
Преимущества медицинского центра Медарт:
- Квалифицированные специалисты.
- Возможность быстро получить точный результат исследования.
- Доступная стоимость.
На базе медцентра предоставляется полный комплекс услуг, от предварительного приема и консультаций до постановки и уточнения диагноза и назначения эффективных схем лечения и профилактики токсоплазмоза и других заболеваний.


При несвоевременном или отсутствующем лечении хламидиоз дает осложнения. У женщин это бесплодие, у мужчин – эпидидимит (воспалительный процесс в семенниках). Также к осложнениям хламидиоза относят – синдром Рейтера, простатит , сальпингит, эндометрит и многие другие.
Что такое хламидиоз: причины и особенности инфекции
Частота инфицирования хламидиями ниже, чем у гонореи, но, тем не менее хламидиоз является практически самым распространенным половым заболеванием. Ежегодно отмечается порядка 200 млн. новых заражений хламидиями. Причина хламидиоза — бактерии хламидии — Chlamydia trachomatis.
Внедряясь в организм, хламидии поражают в первую очередь мочеполовую систему человека и урогенитальный тракт. При этом хламидиоз может протекать как одиночная инфекция, так и в комбинации с другими инфекциями мочеполовой системы: трихомониазом, бактериальным вагинозом.
Хламидия – бактерия, внедряющаяся внутрь клетки и использующая ее вещества для питания и др. аспектов жизнедеятельности. Это энергетический паразит, не способный самостоятельно синтезировать АТФ. Размножение хламидий происходит делением, микроорганизм имеет собственную ДНК и РНК. В итоге клетки слизистой человека гибнут.
Сейчас носителями хламидий, является почти 1 млрд. человек. Как только обстоятельства изменятся — например, ослабнет иммунитет, хламидиоз тут же активизируется.
Как можно заразиться хламидиозом: одного раза достаточно
Широкое распространение заболевания объясняется тем, что его симптоматика часто не имеет яркой выраженности, и пациент длительное время может не подозревать о наличии у него хламидиоза.
Половой путь : вагинально, анально и орально ! Хламидиоз — половое заболевание, следовательно заразиться им можно во время незащищенного вагинального или анального полового акта. Существует вероятность передачи хламидиоза при оральном половом контакте, существенно повышающаяся при наличии повреждений слизистых оболочек.
При родах . Есть большой риск передачи хламидий от матери к ребенку во время родов, при прохождении новорожденного через родовые пути. В этом случае происходит инфицирование глаз и ротовой полости.
Симптомы
Инкубационный период инфекции составляет от – 1 недели, до – 2 месяцев, в течении этого времени инфекция распространяется в организме. У 45% мужчин и 65% женщин заболевание в этот период не дает никаких проявлений и может быть выявлено только при лабораторном исследовании биоматериалов.
При остром хламидиозе у мужчин и женщин наблюдаются разные симптомы. При этом женский организм более восприимчив к инфицированию – заражение происходит быстрее и последствия более серьезны.
Как проявляется хламидиоз у женщин
Проявления хламидиоза у женщин на различных этапах инфицирования сводится к следующим симптомам:
- Выделения из влагалища. Имеют слизистую структуру, возможно присутствие гноя. Могут иметь неприятный резкий запах.
- Появляются боли во время мочеиспускания, ощущение рези или жжения.
- Во время менструации возможно появление резких болей в области половых органов.
- Появление кровотечения между менструациями, кровь может быть как чистой, так и с примесью слизи.
- Субфебрильная температура, общая слабость организма, схожая с ощущениями во время простуды.
Даже один из симптомов — тревожный звоночек, при котором следует обязательно обратиться к гинекологу и сдать анализы на хламидиоз.
Как проявляется хламидиоз у мужчин
Хламидиоз у мужчин может давать следующие симптомы:
- Прозрачные слизистые выделения из мочеиспускательного канала.
- Наличие гноя в моче и ее помутнение.
- Изменяется цвет мочи, могут появиться кровянистые выделения, которые также могут присутствовать в семенной жидкости во время семяизвержения.
- Мочеиспускание сопровождается жжением или ощущением рези.
- Появляются спонтанные боли в области малого таза, поясницы, мошонки.
- Наблюдается субфебрильная температура (держится повышение от 37.1 до 38 град.).
- Общее физическое недомогание.
Бывает, что хламидии у мужчин образуют локальные колонии без общего заражения организма. Очаговые скопления без развития инфекционного заболевания, обусловлены сильным иммунитетом и сопротивляемость антител к воздействию хламидий. При этом мужчина остается заразным.

Оральный хламидиоз и его симптоматика
При заражении хламидиями во время орального секса или при передаче бактерий бытовым путем через посуду и т.д. развивается оральный хламидиоз, поражающий ротовую полость, горло, носоглотку. В данном случае, может наблюдаться следующая симптоматика заболевания:
- Постоянный неприятный запах изо рта.
- Носоглотка покрывается слизистыми отложениями.
- Постепенно слизь переходит на верхнее нёбо и язык.
- Наблюдается заложенность носа, сложности при дыхании.
- Увеличение миндалин, опухание задней стенки горла.
- Потеря вкусовых ощущений из-за наличия слизи на вкусовых рецепторах языка.
- Боль при нажатии на слизистую горла, неба или языка.
- Затрудненное дыхание из-за опухшего горла.
- Приступы удушья чаще всего проявляющиеся в вечернее время или в жаркий период.
Со временем, пациент теряет вкусовую чувствительность, а прием пищи сопровождается болью, появляющейся при проходе пищи через воспаленное горло. Развивается постоянное неприятное ощущение во рту. Допустимо спазматическое, непроизвольное подергивание языком.
Так как симптоматика хламидиоза достаточно расплывчата и зачастую напоминает проявления других заболеваний, необходимо при любых отклонениях (выделения, зуд, жжение) обратиться к врачу. У женщин это гинеколог , у мужчин – уролог .
Осложнения
Хламидиоз часто становится причиной серьезных заболеваний, являющихся осложнением болезни при неправильном или неэффективном лечении. В частности, были выявлены следующие последствия:
- Синдром Рейтера – наиболее серьезное осложнение, в ходе которого развиваются симптомы уретрита, конъюнктивита и артрита. На завершающих стадиях происходит деформация суставов — причина инвалидности на всю жизнь.
- Орхоэпидидимит – болезнь чревата мужским бесплодием из-за уничтожения клеток Лейдига, способствующих процедуре спермагенеза.
- Стриктура уретры – из-за появления рубцов на ткани, вызванных атакой хламидий, сужается и пережимается мочеиспускательный канал, что заканчивается резкими болями при мочеиспускании. Для исправления ситуации производится операционное вмешательство.
- Хронический простатит – хламидиоз оказывает комплексное негативное влияние на простату, способствует сужению протоков, уменьшает выработку секрета простаты, понижает уровень выработки тестостерона, что приводит к снижению потенции.
Описанные выше осложнения проявляются на стадиях запущенного хламидиоза, если лечение на начато вовремя. В большинстве случаев, осложнений можно избежать.
Хламидиоз при беременности
Хламидиоз оказывает серьезное влияние на ход беременности, может стать причиной широкого спектра проблем и сбоев в работе женского организма. В зависимости от того, на каком сроке беременности начался хламидиоз, можно столкнуться со следующими последствиями:
- Бластопатия – происходит отмирание плодного яйца, что заканчивается замершей беременностью , выкидышем .
- Эмбриопатия – аномалии в развитии маточных труб;
- Преждевременные роды. .
Если хламидиоз был перенесен до беременности, он может стать причиной сбоев нидации плодного яйца, что в абсолютном большинстве случаев приводит к женскому бесплодию . Учитывая все риски, проверка на хламидиоз является обязательной при планировании беременности, а также на различных этапах вынашивания ребенка, если появились признаки и симптомы присутствия хламидий в организме.
Даже если хламидиоз во время беременности не доставил значительных проблем, хламидии могут передаться ребенку во время родов. Самое серьезное осложнением у новорожденных, полученное из-за хламидиоза матери — неонатальная хламидийная пневмония. Это заболевание тяжело поддается лечению, имеет множество осложнений и высокую статистику смертности. Дети, родившиеся у матери с хламидиозом, должны в обязательном порядке проходить проверку на инфекцию в возрасте от 1 до 3 месяцев.
Как диагностируют хламидиоз: анализы на хламидии
На сегодняшний день разработано несколько эффективных методов диагностики хламидиоза, которые позволяют определить наличие инфекционного возбудителя даже в случае присутствия его в пробе в минимальных количествах. В качестве исследуемого материала могут применяться мазок, соскоб с поверхности половых органов, кровь, семенная жидкость и т.д. В медицинском центре Диана с целью диагностики хламидиоза не применяются экспресс-тесты, которые предоставляют ложные результаты.
Основные и наиболее высокоэффективные методики.
- Реакция иммунофлюоресценции (РИФ);
- Иммуноферментный анализ (ИФА);
- Полимеразная цепная реакция (ПЦР);
- Посев на хламидии.
Общий мазок (вероятность выявить наличие хламидий таким образом не более 15 %, поэтому применение данного анализа не эффективно, а вот выявить сопутствующие инфекции, усугубляющие проблему, он поможет). Про анализы на хламидиоз читайте здесь .
Стремясь к максимальной точности и информативности, предпочтение отдается высокотехнологичным методикам:
Иммуноферментный анализ крови (ИФА)
Методика позволяет достаточно точно установить стадию заболеваний и хламидийное происхождение, а также наличие микроорганизмов в других органах не относящихся к мочеполовой системе. Имеет сравнительно высокую точность исследования – до 60%. Может результативно проводиться только после начала выработки специфических антител к хламидиям – через 5-20 дней с момента инфицирования.
Это связано с тем, что ИФА и РИФ – иммуноферментный анализ и исследование реакции иммунофлюоресценции направлены не на выявление самого возбудителя хламидиоза, а на обнаружение специфических антител к данному конкретному антигену. Этого добиваются путем контролируемого образования комплексов антиген-антитело, которые в случае с методом РИФ мечены флуоресцентным веществом, что делает образовавшиеся комплексы светящимися. Это облегчает их обнаружение при микроскопическом исследовании материала.
В ходе исследований определяется концентрация антител групп IgM, IgA, IgG вырабатываемых организмом при защите от хламидийной инфекции на разных стадиях инфицирования организма. Исследование занимает достаточно немного времени и стоит недорого.
Полимеразная цепная реакция (ПЦР)
Метод ПЦР имеет высокую эффективность, и позволяет со 100% вероятностью говорить о том, есть хламидии в организме или их нет. Исследование основано на технологии выявления ДНК хламидий во взятом образце – соскоб с уретры, секрет предстательной железы, эякулят, осадок мочи, слюна, кровь и другие биоматериалы. Определение результатов, в зависимости от используемого оборудования занимает до 3 дней.
Запуская реакцию дублирования отрезков ДНК, специалист может за короткий временной промежуток получить генетическую цепочку инфекционного возбудителя в миллион раз удлиненную в сравнении с первичным отрезком. Это позволяет со стопроцентной точностью идентифицировать хламидии.
Методика имеет высокую точность, получение неверных результатов возможно только при нарушении технологии забора или транспортировке биоматериала.
Посев на хламидии
Микробиологическое исследование имеет 90% точность в выявлении хламидий в организме.
Посеяв образец биологического материала на специальную питательную среду и создав благоприятные условия для размножения и роста, через некоторое время удается получить полноценную колонию возбудителя. Идентифицировать инфекцию в этом случае несложно простым микроскопическим исследованием. Преимущество этой методики заключается в возможности постановки проб чувствительности возбудителя к различным антибиотикам. Это позволяет выбрать наиболее эффективный препарат для лечения хламидиоза.
Лечение хламидиоза
Так как возбудитель хламидиоза — внутриклеточная бактерия, то при лечении заболевания используются антибактериальные препараты (этиотропная терапия). Подбираются антибиотики, уничтожающие микроорганизмы выявленной группы. Назначить подходящие препараты может только компетентный специалист на основе проведенных анализов и после выявления типа хламидийных бактерий, области поражения и прогресса заболевания.
Кроме этого, если есть сопутствующие инфекции, могут применяться антибиотики, противогрибковые препараты, иммуномодуляторы. При наличии большого количества выделений потребуются противомикробные средства.
Как правило, препараты выписываются в форме таблеток, уколов, могут быть местного применения в виде вагинальных свеч для женщин. В большинстве случаев сочетается несколько лекарств и вспомогательных средств, также купирующих возможность развития осложнений или интоксикации организма. Лечение производится в домашних условиях. После прохождения курса терапии, по истечении 2-3 недель делается повторный анализ на хламидии и если бактерий не обнаружено, можно считать лечение успешным.
Важный нюанс — необходимость оповещения полового партнера о наличии хламидийной инфекции, так как с большой вероятностью партнер может быть заражен хламидиозом, что тоже потребует лечения с использованием тех же препаратов и методик. Врачи рекомендуют сдавать анализы обоим партнерам одновременно и вместе лечиться. Это позволит избежать вторичного заражения.
Профилактика хламидиоза
Для снижения риска появления хламидий и развития хламидиоза, рекомендуется придерживаться простых правил личной и интимной гигиены, а также осмотрительности в выборе половых связей. Защитят от хламидиоза:
- Использование презерватива во время полового акта.
- Отказ от случайных связей в пользу одного постоянного партнера.
- Соблюдение правил личной интимной гигиены, особенно после посещения общественных бань и саун.
Рекомендуется в обязательном порядке ежегодно сдавать анализ на хламидии и прочие инфекции, передающиеся половым ( ИППП , ЗППП) и неполовым путем. Также сдать анализ в обязательном порядке стоит при планировании беременности и повторить его в период вынашивания плода.
Использование средств контрацепции и соблюдение моральных норм при ведении половой жизни позволят значительно снизить риск заражения хламидиями и последующего развития хламидиоза у мужчин и женщин.
Где лечат хламидиоз в СПБ
Высококвалифицированные специалисты медицинского центра Диана, расположенного в Санкт-Петербурге, гарантируют точность исследования, кратчайшие сроки выполнения анализа, доступную расшифровку результата и разработку безопасной стратегии лечения выявленного заболевания.
Читайте также:

