Токсоплазмоз и сифилис что общего
Обновлено: 19.04.2024
Поражения печени, описанные в данной рубрике, являются проявлениями основного заболевания, а не самим заболеванием, то есть описывает одно из проявлений болезни, демонстрируя и раскрывая один из характерных признаков или симптомов основной болезни, а не саму болезнь.
Таким образом, код K77 является дополнительным кодом и может быть использован только после кода основного заболевания, например, после:
- Шистосомоз [бильгарциоз] (B65.0-B65.9).
Из данной подрубрики исключены:
- Алкогольный гепатит (K70.1);
Классификация
Амилоидоз
1. Выделяют 4 основные формы амилоидоза:
- амилоидоз, связанный с изменениями иммуноцитов;
- реактивный системный;
- наследственный;
- локализованный.
2. Исходя из локализации амилоида, выделяют 3 гистологических типа печеночного амилоидоза:
- I тип - интралобулярный;
- II тип - перипортальный;
- III тип - периваскулярный, смешанный.
Токсоплазмоз
Выделяют острую, хроническую, латентную и резидуальную формы врожденного токсоплазмоза. Поражение печени наиболее актуально при острой форме.
Различают также церебральные и висцеральные формы врожденного токсоплазмоза. Поражения печени характерны для висцеральной формы.
Этиология и патогенез
Токсоплазмоз
Считается, что внутриутробное заражение плода происходит, если мать инфицирована во время беременности. Антитела, циркулирующие в организме женщины до наступления беременности, обеспечивают надежную защиту плода от заражения. Заражение плода происходит путем трансплацентарной передачи.
Токсоплазмозные поражения печени (мезенхимальный гепатит с печеночной недостаточностью) формируются в основном при заражении матери в третьем триместре беременности. Поражения печени наблюдаются при остром течении токсоплазмоза и сочетаются с поражением других органов и систем (лимфатические узлы, почки, центральная нервная система).
В печени обнаруживается картина интерстициального гепатита с мелкими участками некрозов и перипортальной инфильтрацией, воспаления желчных протоков, вне- и внутрипеченочные холестазы Холестаз - нарушение продвижения желчи в виде застоя в желчных протоках и (или) проточках.
. Порой находят очаги экстрамедуллярного кроветворения.
Селезенка увеличена, с гиперплазией пульпы и обширной клеточной инфильтрацией.
Крайне редко обнаруживаются цисты или свободно лежащие паразиты. Характерные для токсоплазмоза изменения обнаруживаются в других органах и тканях.
Сифилис плода. Ранний врожденный сифилис (сифилис грудного возраста и сифилис раннего детского возраста).
Поражение плода сифилисом происходит на 5-м месяце беременности и сопровождается изменениями внутренних органов, а несколько позднее и костной системы.
Первичное и преимущественное поражение печени у таких плодов является подтверждением плацентарной теории передачи сифилиса потомству. Специфические признаки врожденного сифилиса внутренних органов плода носят большей частью диффузный воспалительный характер и проявляются мелкоклеточной инфильтрацией и разрастанием соединительной ткани. Распространенные и тяжелые поражения висцеральных органов плода часто делают его нежизнеспособным, что приводит к поздним выкидышам и мертворождениям.
Изменения в печени связаны с тем, что спирохета проникает в организм плода через пупочную вену. Макроскопически печень увеличенная, очень плотная, желто-коричневого или белесовато-коричневого цвета (так называемая "кремневая" печень).
Шистосомоз
Поражение печени часто вызывается шистосомами S. mansoni и S. japonicum. Основной локализацией паразитов являются венозные сплетения брюшной полости, что может обусловить кишечный или мочеполовой шистосомоз. Однако нередко эти проявления клинически не выражены, и изменения печени являются ведущими в картине болезни.
Патология печени развивается при попадании в нее яиц гельминтов через воротную вену. Тяжесть поражения печени в результате инвазии S. japonicum связана с большим количеством яиц, откладываемых этим гельминтом. Попав в мелкие разветвления воротной вены, яйца шистосом задерживаются в них и вызывают иммунологические и клеточные реакции в печени. Вокруг соответствующих участков портальной вены возникают инфильтраты из гистиоцитов и эозинофилов, замещающихся впоследствии фибробластами. Одновременно имеется гиперплазия купферовских клеток с расширением синусоидов. Пигмент шистосом поглощается клетками ретикулоэндотелия. При этом сами гепатоциты на ранней стадии болезни чаще остаются неизмененными, хотя и возможны небольшие участки их некроза.
Основным морфологическим проявлением заболевания являются гранулы вокруг яиц в ветвях воротной вены. В последующем происходит утолщение стенок портальных трактов с набуханием и дистрофией печеночных клеток по периферии долек в результате их ишемии. Далее прогрессирует фиброз ткани, характер и распространение которого зависят от локализации и величины пораженных ветвей воротной вены, иногда ограничиваясь одной долей.
На ранних стадиях увеличение селезенки носит реактивный характер. Позже в ней могут развиться фиброз или повторные инфаркты в результате тромбозов селезеночной вены.
Яйца шистосом, попадая в ветви портальной вены, образуют гранулёмы с нарушением кровотока в печени и портальной гииертензией. С увеличением продолжительности инвазии после разрушения и рассасывания яиц на месте гранулём развивается фиброз. Постепенно он прогрессирует вокруг более крупных ветвей воротной вены, приводя к характерным для этого заболевания изменениям - фиброзу Симмерса: на срезах печени появляются белые кольца вокруг ветвей воротной вены, которые похожи на мундштук глиняной трубки.
Эпидемиология
Признак распространенности: Редко
Амилоидоз. При реактивном амилоидозе печень поражается почти всегда, при наследственном - в 50% случаев. Поражение печени в целом наблюдается у 60-90% больных амилоидозом.
Врожденный сифилис
Распространенность существенно колеблется в различных регионах. В развивающихся странах заболеваемость ассоциирована с низким уровнем развития здравоохранения; в западных странах - с наркоманией и СПИД.
Расовых и гендерных различий не выявлено.
Шистосомоз
В зависимости от вида возбудителя, шистосомоз распространен в различных эндемических регионах (Африка, Ближний Восток, Дальний Восток, Южная Америка, Карибский бассейн, Индия, Турция).
Интенсивность и распространенность инфекции, в среднем, увеличиваются с возрастом и достигают пика обычно в возрасте от 10 до 20. лет. Несколько чаще поражаются мужчины (возможно, в связи с хозяйственной деятельностью).
Клиническая картина
Клинические критерии диагностики
гепатомегалия; спленомегалия; асцит; боль в правом подреберье; желтуха; лихорадка; гипотрофия; сыпь; слабость; гиперспленизм; увеличение живота
Нейрофиброматоз - болезнь Реклингхаузена. Врожденный токсоплазмоз, ЦМВ-инфекция и сифилис
Данный вил факоматоза характеризуется образованием многочисленных ней рофибром, которые растут из соедини тельнотканных оболочек нервов. Они могут возникать как на периферических нервах (вызывая профессирукнцие пе риферическис парезы), так и на спинномозговых корешках (корешковые симп томы).
При прорастании в спинной мозг могут наблюдаться признаки сдавления и син дром поперечною поражения спинноп мозга. При нейрофибромах, прорастаю ших через-межпозвоночное отверстие, рентгенологическое исследование в косой проекции выявляет его расширение и характерную картину опухоли в форме песочных часов, которая состоит из внутрипозвоночных и внепозвоночных узлов. Внутрипозвоночная часть опухоли может вызывать клинические симптомы опухоли. Расширение межпозвоночного отверстия можно выявить при рентгенографии позвоночника в косой проекции.
Внутричерепные опухоли обычно представлены шванномами преддверно-улиткового нерва, которые часто (но неточно) обозначают как невриномы слухового нерва. Эти опухоли нередко бывают двусторонними и проявляются клинической картиной объемного поражения мостомозжечковою угла. Могут наблюдаться также опухоли зрительною нерва и сетчатки (с нарушениями зрения), иногда они локализуются в веществе мозга, вызывая эпилептические припадки и другие признаки внутричерепного объемного процесса. Нейрофибромы могут малигнизироваться. У данной категории пациентов с повышенной частотой встречаются также менингиомы.
Врожденный токсоплазмоз. Заражение токсоплазмозом на ранней стадии беременности приводит во второй половине беременности к генершизованному поражению плода с последующим развитием энцефалита, вызывающего обшемозговые симптомы, припадки и гидроцефалию. В цереброспинальной жидкости выявляются изменения.
Врожденная цитомегаловирусная инфекция характеризуется следующими признаками:
• преждевременные ролы или иная патология родов,
• микроцефалия (ведущее проявление),
• гидроцефалия,
• припадки,
• парачичи,
• внутричерепные, особенно перивентрикулярные кальцификаты.
Прижизненный диагноз основан на цитологическом исследовании осадка мочи, выявлении вируса и положительной реакции связывания комплемента у новорожденного.
Врожденный сифилис с неврологическими проявлениями чаще наблюдается у детей, которые родились от матерей с ранними, а не поздними формами сифилиса. Трепонемные тесты в крови и ЦСЖ, как правило, положительны. Нередко наблюдается хориоретинит. Признаки позднего сифилиса (прогрессивного паралича, спинной сухотки) могут развиваться в течение 1 -го года жизни.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Желтуха у новорожденного ребенка при токсоплазмозе - клиника, диагностика
Неонатальные инфекции, вызываемые возбудителями комплекса TORCH (токсоплазмоза, краснухи, цитомегаловируса, герпеса и сифилиса), хорошо известны. Часто их сложно дифференцировать, т.к. клинические проявления у новорожденных и их матерей могут быть минимальными.
К сожалению, серьезные последствия у детей возможны даже в случае бессимптомного течения этих заболеваний. Известно, что подобные проблемы у новорожденных вызывают и другие инфекционные агенты, но в данной главе будут рассмотрены только врожденные инфекции, обусловленные Toxoplasma gondii, Treponema pallidum, вирусом краснухи, Herpes simplex и цитомегаловирусом. Частота возникновения этих инфекций высока — 0,5-2,5%.
Если острый токсоплазмоз возникает во время беременности, возбудитель инфекции Toxoplasma gondii может проникнуть через плаценту и вызвать поражение плода; чем раньше происходит этот переход через плаценту, тем более выражены признаки врожденной патологии у плода.
Инфекция у матери в течение I—II триместров беременности может быть умеренной или бессимптомной, тем не менее инфекция обусловливает возникновение врожденного токсоплазмоза антенатально с последующим тяжелым течением заболевания у новорожденного. В отличие от этой ситуации более позднее инфицирование беременной обычно приводит к субклинической инфекции плода или отсутствию таковой.
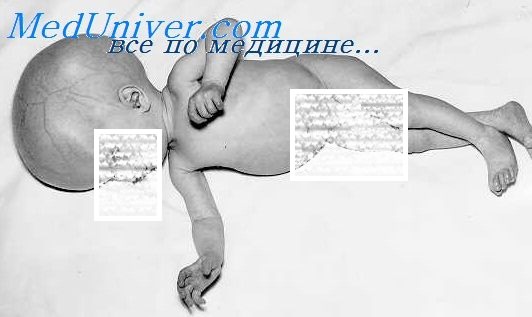
Новорожденный с врожденным токсоплазмозом
Признаки вызванной Т. gondii инфекции могут включать микроцефалию, хориоретинит, внутричерепные кальцификаты, менингоэнцефалит и задержку психомоторного развития. Паразит распространяется по организму хозяина, поражая в том числе и печень, но выделения токсоплазмы из ткани печени редки. У большинства новорожденных отмечают гепатоспленомегалию, но желтуха встречается нечасто.
При гистологическом исследовании в основном выявляют воспаление в перипортальной зоне и признаки выраженного экстрамедуллярного кроветворения. Гепатит может быть единственным проявлением заболевания. Описаны микрокальцификаты в печени на обзорных рентгенограммах брюшной полости. Серологическая диагностика предполагает тест на уровень иммуноглобулина М (IgM-ELISA), который высокочувствителен и специфичен для диагностики врожденного токсоплазмоза. Если инфекция персистирует в течение 2 мес жизни ребенка, диагностика основывается на тестах, выявляющих антитела класса IgG к Т. gondii.
Дети с подтвержденной инфекцией получают лечение сульфадиазином и пириметамином (тиндурином) в сочетании с фолиевой кислотой для профилактики токсического воздействия препаратов на кроветворение.
Алгоритмы пренатальной диагностики и профилактики врожденного токсоплазмоза окончательно не определены. У беременных, заболевших первичным токсоплазмозом, возможно пренатальное исследование околоплодных вод методом полимеразной цепной реакции (ПЦР). При диагностике врожденного токсоплазмоза ПЦР околоплодных вод имеет высокое предикторное значение, но низкую чувствительность.
Это означает, что отрицательный результат исследования не исключает заболевания плода. Вакцины против врожденного токсоплазмоза были апробированы на животных, но для разработки вакцины для человека необходимы дальнейшие исследования.
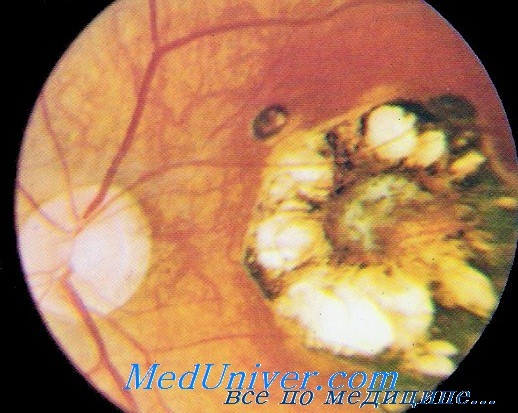
Хориоретинит (поражение глаз) при врожденном токсоплазмозе
Классификация инфекций головного мозга (ЦНС)
а) Классификация. Инфекционные заболевания можно разделить на врожденные/неонатальные и приобретенные. Эти категории, в свою очередь, могут быть подразделены на подгруппы на основании этиологии, например, бактериальные, вирусные, грибковые, паразитические заболевания и риккетсиозы.
Инфекционные болезни могут манифестировать в различных формах в зависимости от остроты процесса. Для некоторых заболеваний, например герпеса и энцефалита, характерно острое и молниеносное течение. Другие протекают в подострой или хронической форме (например, подострый склеротический панэнцефалит (ПСПЭ) и энцефалит Расмуссена).
б) Врожденные/неонатальные инфекционные заболевания:
1. Терминология. Врожденные инфекции головного мозга часто группируют вместе и просто именуют TORCH-инфекциями (сокращение от первых букв англоязычных терминов токсоплазмоза, краснухи, цитомегаловирусной и герпетической инфекций). При включении в эту группу сифилиса ее называютTORCH(S) или (S)TORCH.
Среди других врожденных инфекций выделяют синдром приобретенного иммунодефицита человека (СПИД) и лимфоцитарный хориоменингит (ЛХМ). Примерно 40% беременностей у ВИЧ-лоложительных матерей протекают с вертикальной передачей вируса плоду, но эта цифра значительно снижается при ВААРТ матерей и родоразрешении методом кесарева сечения.
2. Этиология. Большинство врожденных инфекционных заболеваний передается плоду трансплацентарным путем за исключением вируса герпеса, который передается ребенку во время родов. Большинство из них, за исключением двух (токсоплазмоза и сифилиса), имеют вирусную природу. Все они встречаются относительно редко за возможным исключением цитомегаловирусной инфекции (ЦМВИ) и герпетического энцефалита.
3. Патология. Трансплацентарная передача различных патогенов проявляется в виде ряда признаков, которые зависят как от инфекционного агента, так и времени инфицирования. Если инфицирование происходит на ранних этапах эмбрионального развития (например, в первом триместре), то наблюдается тенденция к невынашиванию или формированию врожденных пороков развития.
У выживших младенцев наблюдаются такие пороки развития, как нарушение миграции клеток и шизэнцефалия. При инфицировании на более поздних сроках преобладают энцефалокластические проявления. Встречается микроцефалия с явной деструкцией мозговой ткани и распространенной энцефаломаляцией. Для ЦМВИ, токсоплазмоза, ВИЧ-инфекции и врожденной краснухи характерны дистрофические паренхиматозные кальцификаты.

(а) Полученный при аутопсии макропрепарат головного мозга пациента, погибшего от острого бактериального менингита, крупный план: обратите внимание на вязкий гнойный экссудат, который заполняет борозды. Наблюдается отечность и диффузное набухание нижележащих извилин. Мягкая мозговая оболочка воспалена и гиперемирована, хорошо выражены кортикальные сосуды.
(б) При аутопсии определяются множественные пиогенные абсцессы. Разрыв крупного абсцесса, расположенного в глубоком белом веществе головного мозга, в полость желудочков привел к развитию вентрикулита.
в) Приобретенные инфекционные/воспалительные заболевания:
1. Бактериальные инфекции. Бактериальные патогены, которые часто приводят к развитию менингита, включают в себя Streptococcus pneumoniae, Neisseria meningitidis, Haemophilus influenzae, Listeria monocytogenes, Streptococcus В и E. coli.
- Менингит. Гнойный экссудат преимущественно в базальных цистернах является частым патологическим признаком менингита вне зависимости от специфического инфекционного агента. Экссудат может заполнять цистерны и субарахноидальные пространства. Контрастирование мягкой мозговой оболочки и субарахноидального пространства является наиболее частой находкой при диагностической визуализации. Часто развиваются такие осложнения, как гидроцефалия, эмпиема и васкулит с наличием или отсутствием инфаркта ткани головного мозга.
- Абсцесс. Абсцессы проходят четыре общие стадии развития: ранний и поздний церебрит и ранняя и поздняя инкапсуляция. На стадии раннего церебрита присутствует еще не локализованный очаг инфекции. Формируется неинкапсулированное объемное образование, состоящее из воспалительных клеток, отека, очагов некроза и петехиальных кровоизлияний. На стадии позднего церебрита очаги инфекции сливаются. Наблюдается центральный некроз со слабо очерченным ободком из воспалительных клеток, грануляционной ткани и фибробластов. За стадией позднего церебрита следует стадия ранней инкапсуляции.
2. Вирусные инфекции:
- Острые вирусные инфекции. Герпетический энцефалит (ГЭ) является наиболее частым неэпидемическим вирусным энцефалитом. Более 95% из них вызваны ВПГ-1 (оральный вирус герпеса). В настоящее время большинство эпидемических вирусных энцефалитов вызваны вирусом лихорадки западного Нила.
- Подострая и хроническая вирусная инфекция. Для многих вирусов характерен длительный инкубационный период и прогрессирование симптомов на протяжении нескольких месяцев или даже лет. Примером служит подострый склерозирующий панэнцефалит (ПСПЭ). Другим примером является прогрессирующая мультифокальная лейкоэнцефалопатия (ПМЛ), которая наблюдается при инфицировании вирусом JC (убиквитарный полиомавирус).

(а) Макропрепарат голов -ного мозга, полученный при аутопсии: определяются классические признаки острого герпетического энцефалита. Обратите внимание на склонность данной инфекции поражать лимбическую систему, что в данном случае представлено зонами геморрагического некроза в лобной доле и субфронтальной коре.
(б) Макропрепарат головного мозга, полученный при аутопсии: острый геморрагический некротический энцефалит, предположительно вирусной этиологии. Для многих неэпидемических вирусных энцефалитов характерна склонность к поражению базальных ганглиев, таламуса, среднего мозга и моста.
3. Другие инфекционные заболевания:
- Парабиозы. Нейроцистицеркоз (НЦЦ) стал самой распространенной паразитарной инфекцией ЦНС и самой частой причиной эпилепсии во всем мире. Несмотря на то, что большинство паразитов редко вызывают поражение головного мозга, оно рано или поздно возникает у большинства пациентов, инфицированных НЦЦ.
- Грибковые заболевания. Грибы распространены повсеместно и эндемичны для любой области земного шара. Большинство из них, например Aspergillus, инфицируют человека нечасто, в основном при вдыхании или при колотых ранениях. При возникновении грибкового заболевания у иммунокомпетентных лиц легкие поражаются чаще, чем головной мозг. Микозы ЦНС и диссеминированные системные микозы обычно развиваются у иммунокомпрометированных лиц. ВИЧ/СПИД и иммуносупрессивная терапия являются факторами, значительно увеличивающими предрасположенность пациента к оппортунистическим заболеваниям.
- Риккетсиозы, такие как пятнистая лихорадка Скалистых гор и Средиземноморская пятнистая лихорадка, обычно проявляются кожными высыпаниями. Инфицирование ЦНС встречается нечасто. Если же оно происходит, то для риккетсий характерна выраженная тропность к периваскулярным пространствам и возникновение инфарктоподобных поражений в базальных ганглиях.
- Спирохетозы. Спирохеты относятся к грамотрицательному типу бактерий. Среди этой группы патогенов сифилис и болезнь Лайма, вызываемые бактериями Treponema pallidum и Borrelia burgdorferi соответственно, встречаются наиболее часто. В США болезнь Лайма является наиболее частой трансмиссивной (клещевой) инфекцией. Нейроборрелиоз Лайма - вторичное поражение нервной системы на фоне системной инфекции, вызванной Borrelia burgdorferi.

(а) Макропрепарат голов -ною мозга, полученный при аутопсии: наблюдается туберкулезный менингит (ТБМ). ТБМ обычно характеризуется появлением вязких гноеподобных экссудатов, которые склонны располагаться в базальных цистернах. Визуализационная и патологоанатомическая картины при менингите в целом схожи вне зависимости от этиологии процесса.
(б) Макропрепарат головного мозга, полученный при аутопсии: определяются две нейроцистицеркозные кисты, расположенные в поверхностных бороздах. Нейроцистицеркозные кисты церебральной локализации наиболее часто расположены в субарахноидальных пространствах.
Что такое токсоплазмоз? Причины возникновения, диагностику и методы лечения разберем в статье доктора Александрова Павла Андреевича, паразитолога со стажем в 14 лет.
Над статьей доктора Александрова Павла Андреевича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Токсоплазмоз — это острое и хроническое паразитарное заболевание человека в виде манифестных форм или носительства, вызываемое простейшими внутриклеточными паразитами — токсоплазмами, которые попадая в организм человека могут при условиях иммунодефицита поражать нервную ткань, среды глаза, сердечно-сосудистую и ретикулоэндотелиальную системы, вызывая поражение организма той или иной степени тяжести. Болезнь относится к группе TORCH-комплекса, т. е. вызывает врождённую патологию.
Этиология
Таксономия:
Вид — Toxoplasma gondii
Токсоплазмы обитают в мире в трёх формах:
- трофозоиты (тахизоиты);
- цисты (брадизоиты);
- ооцисты.
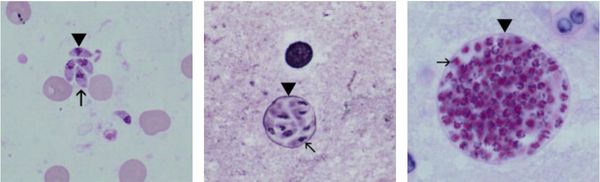
Трофозоиты достигают 4-7 мкм в длину и 2-4 мкм в ширину. Их тело по форме напоминает полумесяц с заострённым передним и закруглённым задним концами, состоит из пелликулы (покровной ткани) и различных органелл. Такие паразиты обитают во всех клетках млекопитающих кроме эритроцитов, размножаются путём деления. Могут создавать движение, активно проникая в клетки хозяина через клеточную мембрану или посредством фагоцитоза (захвата и переваривания клетки). Обнаруживаются в тканях в острой стадии инфекции. Их скопление внутри одной клетки называют псевдоцистой. Трофозоиты неустойчивы вне клетки и во внешней среде, быстро погибают при высушивании, прогревании и применении дезинфицирующих средств. Хорошо окрашиваются по Романовскому. Чувствительны к различным химиопрепаратам (сульфаниламидам, некоторым макролидам и другим).
Цисты размерами до 100 мкм отличаются плотной оболочкой, через которую не могут проникнуть антитела или лекарственные препараты. Внутри оболочки сосредоточено 3000-5000 паразитов, со временем они увеличиваются. Цисты формируются в организме хозяина (в основном в скелетных мышцах, миокарде и ЦНС) и живут там десятки лет. Чрезвычайно устойчивы к воздействиям внешних факторов. При адекватной иммунной системе могут пожизненно находиться в состоянии функционального покоя и не приносить никакого вреда организму человека.
Ооцисты играют основную роль в передаче инфекции. Они представляют собой овальные образования 10-12 мкм в диаметре. Их развитие и формирование длится 3-24 дня и проходит в слизистой оболочке тонкой кишки кошек. Затем в течение 7-20 дней паразиты выделяются с испражнениями, после этого срока новые фекалии кошки уже не заразны. За сутки с испражнениях животного выделяется до 10 миллионов ооцист. Спустя 2-3 дня при температуре 24 °C происходит споруляция ооцист — образование спор. При благоприятных условиях микроорганизмы сохраняются во внешней среде до года и дольше.
Существует множество штаммов токсоплазм, одни из которых отличаются высокой вирулентностью, а другие относительно маловирулентны. [1] [2] [7] [9]
Эпидемиология
Учитывая большое количество латентных форм, заболевание не поддаётся общему исчислению — им может быть заражено не менее 1,5 миллиардов человек. Только ежегодно регистрируется около 200 тысяч случаев внутриутробного инфицирования.
Распространение возбудителя повсеместное — токсоплазма обнаружена на всех материках. После заражения паразиты способны пожизненно сохранятся в организме большинства животных и птиц. Количество случаев приобретённого токсоплазмоза в разных странах колеблется: от 85 % во Франции и Мадагаскаре до 15 % в США и Англии.
- Фекально-оральный:
- водный и пищевой путь — при недостаточной термической обработке, чаще при употреблении сырого мяса и фарша;
- контактно-бытовой путь — при несоблюдении санитарных норм в повседневной жизни, например, при общении с кошками.
- Вертикальный путь (от матери к плоду) — преимущественно при первичном заражении матери во время беременности, часто у ВИЧ-инфицированных в стадии СПИДа.
- Артифициальный путь — при пересадке органов, в которых расположены цисты, пациенту с плохим иммунитету.
- Аэрогенный путь — при попадании инфицированной ооцистами пыли в рот человека.
- Контактный путь — при повреждении целостности кожных покровов. Встречается крайне редко, в основном у работников лабораторий и скотобоен, отмечен лишь в некоторых источниках, явного практического значения не имеет.
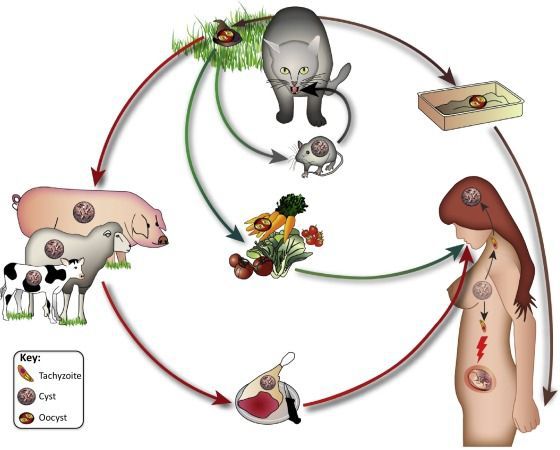
От человека к человеку заболевание не предаётся (кроме случаев каннибализма). Нельзя заразиться посредством укуса насекомых и при половом контакте.
Инфицирование токсоплазмой вызывает устойчивый пожизненный иммунитет к повторному заражению, однако известны случаи рецидива первичной инфекции при заражении другим высоковирулентным штаммом (у беременных, заразившихся при употреблении сырого мяса с другого континента). [1] [3] [5] [8] [9]
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы токсоплазмоза
Инкубационный период при манифестных формах (явных проявлениях болезни) длится от двух недель до двух месяцев.
Специфичных симптомов, характерных именно для токсоплазмоза, не существует.
В большинстве случаев приобретённого токсоплазмоза заболевание протекает бессимптомно или со стёртой клиникой, напоминающей нетяжёлое ОРЗ: кратковременная лихорадка, слабость, недомогание, повышение температуры до 38,0 °C, увеличение периферических лимфоузлов, небольшое увеличение печени и селезёнки.
Доказано, что токсоплазма может оказывать влияние на психику человека. Это выражается в учащении рискованных действий, снижении концентрации внимания, повышенной нервозности, у лиц с тяжёлым острым или длительным хроническим активным течением повышен риск развития шизофрении.
Иногда заболевание проявляется изолированной глазной формой — длительно текущие увеиты, иридоциклиты и хориоретиниты. Как правило, эти нарушения являются поздними проявлениями нераспознанного ранее врождённого процесса.
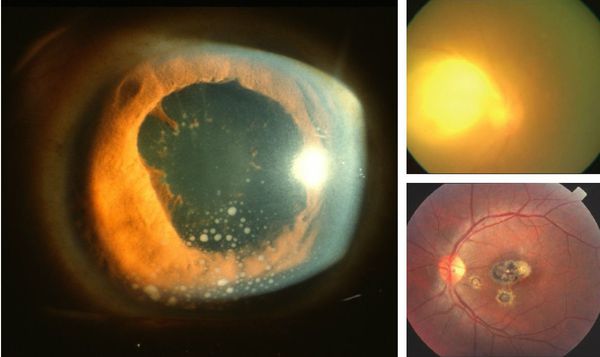
У людей с выраженным иммунодефицитом (ВИЧ, пересадка органов с последующей цитостатической терапией) возможно развитие генерализованного процесса с поражением нескольких органов (головного мозга, сердца, печени, почек, лёгких), нередко очень тяжёлого течения, проявляющегося в виде синдрома полиорганной недостаточности.
Токсоплазмоз у беременных может протекать в различных клинических вариантах и представляет опасность не столько для самой беременной (исключая тяжело протекающие патологии у беременных со СПИДом), сколько для плода.
При первичном заражении беременной токсоплазмозом имеет значение срок гестации:
- При инфицировании в первом триместре передача возбудителя плоду происходит лишь в 4 % случаев (к 13 неделе — в 6 %), но заканчивается, как правило, гибелью плода и выкидышем на ранних сроках. Если первичная инфекция у матери в первом триместре доказано, но выкидыш до 13 недели беременности не произошёл, то крайне высока вероятность, что внутриутробной передачи не было и ребёнок будет здоров.
- При инфицировании во втором триместре (особенно на 24-26 неделях) риск внутриутробной передачи резко возрастает и достигает 30-40 %, причём сопровождается развитием тяжёлых проявлений заболевания — одновременное увеличение селезёнки и печени, воспаление сосудистой оболочки и сетчатки глаза, поражения ЦНС в виде гидроцефалии, кальцификация, сыпь, миокардит, пневмония и другие.
- При заражении матери в третьем триместре передача инфекции ребёнку происходит с частотой до 90 %, однако проявления заболевания являются латентными или субклиническими и могут появиться спустя годы после рождения (отставание в развитии, нарушения зрения). [1][2][4][9]
Патогенез токсоплазмоза
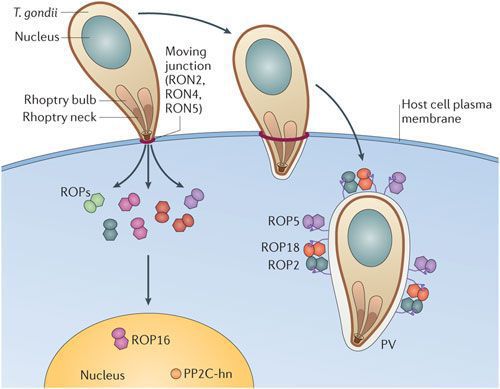
По мере развития и размножения токсоплазм поражённые клетки разрушаются, происходит заражение новых здоровых клеток, и при попадании возбудителя в кровоток паразиты разносятся по всему организму. Образуются некрозы с формированием фиброзной ткани и кальцификацией (отложение солей кальция в организме).
Под воздействием иммунитета безоболочечные трофозоиты превращаются в брадизоиты (оболочечные скопления токсоплазм), т.е. в тканевые цисты, которые сохраняются десятками лет в неактивном состоянии и при значительном снижении иммунитета способны к обратной трансформации с развитием обострения.
При первичной инфекции у беременных возбудитель проникает в ткани плода и вызывает воспалительный процесс, причём в разные периоды развития наблюдается различный характер воспаления: у эмбриона происходит лишь альтерация (дистрофия и некроз ткани без фиброза), в раннем фетальном периоде дополняется повышенным образованием соединительной ткани (фиброзом), а в позднем фетальном периоде присоединяется сосудистый компонент. Отсюда вытекают различные по характеру и тяжести поражения плода, которые зависят от сроков инфицирования матери. [1] [2]
Классификация и стадии развития токсоплазмоза
По течению процесса токсоплазмоз бывает:
- острым — до одного месяца;
- подострым - 1-3 месяц;
- хроническим — более трёх месяцев.
По клиническим признакам выделяют пять форм заболевания:
- Врождённый острый токсоплазмоз:
- манифестная форма (с указанием ведущих проявлений);
- субклиническая форма (с указанием способа верификации диагноза).
- Врождённый хронический токсоплазмоз:
- обострение / ремиссия;
- с резидуальными (остаточными) явлениями / без резидуальных явлений.
- Врождённый латентный токсоплазмоз.
- Приобретённый острый токсоплазмоз.
- Приобретённый хронический токсоплазмоз.
По степени тяжести заболевание бывает:
- лёгким;
- среднетяжёлым;
- тяжёлым (врождённая инфекция, токсоплазмоз при СПИДе).
По наличию осложнений выделяют:
- осложнённый токсоплазмоз;
- неосложнённый токсоплазмоз.
В Международной классификации болезней 10 пересмотра выделены шесть типов заболевания:
- B58.0 Токсоплазмозная окулопатия;
- B58.1 Токсоплазмозный гепатит (K77.0*);
- B58.2 Токсоплазмозный менингоэнцефалит (G05.2*);
- B58.3 Легочный токсоплазмоз (J17.3*);
- B58.8 Токсоплазмоз с поражением других органов;
- B58.9 Токсоплазмоз неуточнённый. [1][2][3]
Осложнения токсоплазмоза
При врождённой форме может возникнуть гидроцефалия, микроцефалия, задержка психомоторного развития и слепота. Эти осложнения сопровождаются увеличением или уменьшением размеров черепа, различными неврологическими расстройствами — косоглазием, судорогами, трудностью с сидением и держанием головы, рвотой и другими.
При глазной форме заболевания развивается слепота, снижение остроты зрения и воспалительные явления всех сред глаза. Причём возможно как рождение с грубыми дефектами зрения, так и появление воспалительных явлений и нарушения зрения спустя много лет после рождения.
Токсоплазмоз у иммунокомпрометированных людей осложняется шизофренией, токсоплазменный энцефалитом и полиорганной недостаточностью — тяжёлой патологией различных органов при выраженном иммунодефиците. При этом свойственна картина тяжёлого энцефалита. Прогноз, как правило, неблагоприятный. [1] [5] [8] [9]
Диагностика токсоплазмоза
Лабораторная диагностика:
- Клинический анализ крови: снижение уровня тромбоцитов, увеличение количества лимфоцитов и эозинофилов.
- Биохимический анализ крови: возможно повышение уровня трансаминаз и билирубина.
- Иммуноферментный анализ (ИФА):
- Выявление специфических антител класса M — острая инфекция или её реактивация. Имеет ряд недостатков — низкая специфичность, длительная циркуляция в организме, иногда до года после острого процесса. В сложных случаях уточнение следует производить при помощи метода "двойной сэндвич" или "иммунозахват" IgM ELISA.
- Выявление специфических антител класса G (клеток памяти) — носительство, инфицированность — появляются в среднем со второй недели заболевания и достигают пика на 1-2 месяце, сохраняются пожизненно, за исключением СПИД-ассоциированных заболеваний.
- Авидность IgG — уточнение давности заболевания. Недостатком является отсутствие стандартизации результатов, что зачастую приводит к различным ошибкам интерпретации. Наибольшее значение имеет высокая авидность, остальные результаты низкой и слабой авидности могут быть ошибочными и не должны трактоваться как недавно перенесённое заболевание при отсутствии других подтверждающих этот факт тестов.
- ПЦР-диагностика: выявление ДНК токсоплазмы в крови, других жидкостях и тканях человеческого организма. Особенно информативна в диагностике генерализованного, глазного и врождённого токсоплазмоза, в т. ч. в антенатальном периоде путём проведения амнио (не ранее 16 недель) и кордоцентеза (с 18 недели беременности).
- УЗИ-диагностика: внутриутробное выявление гидро- и микроцефалии, кальцификатов, гепатоспленомегалии и выраженной задержки развития. [1][2][4][5][6]
Дифференциальная диагностика
Токсоплазмоз — это инфекция с необычайно разнообразными проявлениями, поэтому ввиду неспецифичности проявлений основное место в дифференциальной диагностике отводиться лабораторному обследованию, а именно специфическим серологическим тестам.
Необходимо исключить следующие заболевания:
-
(ВЭБ-инфекцию) — боли в горле, преимущественное увеличение затылочных и заднешейных лимфоузлов, характерные изменения гемограммы (появление большого количества атипичных мононуклеаров и отсутствие столь выраженных изменений при врождённом течении), положительные IgM и ПЦР крови; — лимфоцитарный характер гемограммы, частое поражение слюнных желёз, положительные IgM, ПЦР крови;
- туберкулёз — длительное постепенное начало, лёгкий субфебрилитет (до 38,0 °C), ночная потливость, нездоровый румянец на щеках, кашель, специфические изменения в лёгких, положительные пробы на туберкулёз, выявление бациллы Коха в мокроте;
- лимфопролиферативные заболевания (лимфома Ходжкина, неходжкинские лимфомы) — специфические изменения при биопсии поражённой ткани (лимфоузлов);
- ВИЧ-инфекция — наличие факта возможного заражения, увеличение всех групп лимфоузлов, положительная серология;
- саркоидоз — специфические изменения в лёгких, положительные результаты гистологического исследования. [1][2][5]
Лечение токсоплазмоза
Большинство случаев приобретённого токсоплазмоза протекают в лёгкой или бессимптомной форме, они не регистрируются и, по-видимому, не нуждаются в каком-либо лечении.
Необходимость проведения специфической этиотропной терапии возникает лишь у некоторых групп пациентов:
- беременные с доказанным первичным инфицированием (в ряде случаев при реактивации хронической инфекции);
- дети с врождённой формой токсоплазмоза (при наличии явных клинических и лабораторных проявлений заболевания, субклинических и инаппарантных формах) — сроки и объём терапии зависят от конкретных данных;
- иммунокомпрометированные люди, у которых токсоплазмоз (острый или в фазе реактивации хронического процесса) протекает с выраженными клинико-лабораторными проявлениями. Основное направление воздействия в этом случае должно быть на устранение причины иммунодефицита, повышение уровня СД4 клеток.
Проведение лечения может осуществляться как в стационаре, так и амбулаторно в зависимости от выраженности процесса, реакции пациента на вводимые препараты, необходимости тех или иных вариантов патогенетического и симптоматического обеспечения. [1] [4] [7]
Прогноз. Профилактика
При приобретённом токсоплазмозе у иммунокомпетентных лиц прогноз благоприятный, у иммунокомпрометированных лиц (СПИД) прогноз серьёзен, нередки летальные исходы.
При врождённом токсоплазмозе исход заболевания зависит от сроков инфицирования плода:
- при инфицировании в первом триместре, как правило, происходит выкидыш;
- в более поздние сроки последствия варьируются от тяжёлых до резидуальных форм.
Основным методом профилактики приобретённого и врождённого токсоплазмоза является соблюдение санитарно-гигиенических правил, особенно беременными, не имеющими антител класса G к токсоплазмам:
- ограничение контакта с кошками;
- запрет на употребление сырого мяса, фарша и морепродуктов;
- тщательная промывка зелени, фруктов и овощей;
- мытьё рук перед едой;
- работа на приусадебном участке только в перчатках.
Для беременных особенно важен скрининг антител к токсоплазме, позволяющий выявить активно протекающее заболевание или риск его возникновения, а также вовремя провести медикаментозную профилактику острого токсоплазмоза беременной и снизить риск врождённой инфекции на 60 %. При отсутствии антител класса G в первом триместре необходимо отслеживать антитела IgM и IgG не только в тертьем, но и во втором триместре беременности.
В очаге токсоплазмоза противоэпидемические мероприятия не проводятся, вакцина на разработана. [2] [3]
Читайте также:

