Трансформация клеток кишечной палочки
Обновлено: 24.04.2024
Эшерихии. Эшерихиозы. Свойства эшерихий. Кишечная палочка. Escherichia coli. Морфология кишечной палочки. Культуральные свойства кишечной палочки.
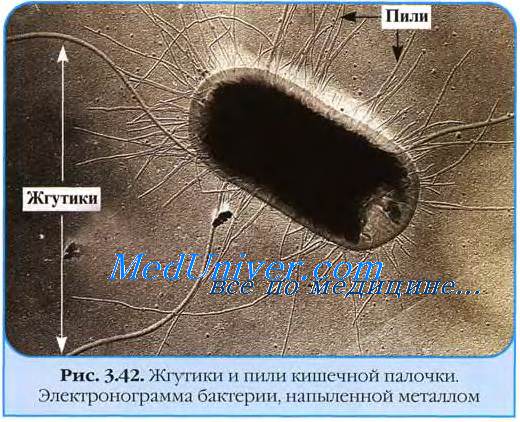
Своё название бактерии получили в честь немецкого педиатра Т. Эшериха, впервые выделившего Escherichia coli из содержимого кишечника детей. Род образуют подвижные (перитрихи) прямые палочковидные бактерии размером 1,1-1,5x2,0-6,0 мкм. В мазках они располагаются одиночно или парами. У большинства штаммов существуют капсулы или микрокапсулы.
Температурный оптимум для роста эшерихий 37 °С. Эшерихии ферментируют углеводы с образованием кислоты или кислоты и газа, оксидаза-отрицательны и каталаза-положительны.
Эшерихии входят в состав микрофлоры толстой кишки теплокровных, пресмыкающихся, рыб и насекомых. Эшерихии — основная аэробная микрофлора кишечника, вызывающая, однако, обширную группу заболеваний человека, известных как эшерихиозы.
Эшерихиозы характеризуются не только клиническим полиморфизмом, но и создают особую эпидемиологическую ситуацию. Основное медицинское значение имеет кишечная палочка (Escherichia coli). Кишечные палочки рассматривают как санитарно-показательные микроорганизмы (СПМ) при анализе воды и пищевых продуктов.

Кишечная палочка. Escherichia coli
В настоящее время среди прочих энтеробактерии кишечная палочка — основной возбудитель эшерихиозов у человека.
Морфология кишечной палочки. Культуральные свойства кишечной палочки
Кишечная палочка имеют типичную для энтеробактерий форму и представлены короткими подвижными палочками с закруглёнными концами.
• На плотных средах бактерии образуют плоские выпуклые мутные S-колонии с ровными или слегка волнистыми краями (3-5 мм в диаметре) либо сухие плоские R-колонии с неровными краями.
• В жидких средах растут диффузно, вызывая помутнение среды и образование осадка (реже формируют поверхностную плёнку или пристеночное кольцо).
• На средах Хисса кишечная палочка может образовывать газ. На селективно-дифференциальных средах колонии принимают цвет, соответствующий окраске среды. На агаре Эндо лактоза-положительные эшерихии образуют фукс и ново-красные колонии с металлическим блеском, лактоза-отрицательные — бледно-розовые или бесцветные с тёмным центром. На среде Левина бактерии формируют тёмно-синие колонии с металлическим блеском, а лактоза-отрицательные — бесцветные, на среде Плоскирева — соответственно красные с жёлтым оттенком или бесцветные. На КА могут давать полный гемолиз.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Причины и возбудители эшерихиозов. Механизмы развития эшерихиозов
Возбудители принадлежат к виду Е. coli, роду Escherichia, семейству Enterobacteriaceae. Это грамотрицательные подвижные (благодаря наличию жгутиков) и неподвижные палочки; хорошо ферментируют углеводы. Они устойчивы во внешней среде, переносят высушивание; месяцами сохраняются в испражнениях, воде и почве. Способны размножаться в готовых к употреблению пищевых продуктах, особенно в молоке и молочных изделиях (мороженое, сметана, творог и др ). Быстро погибают при кипячении и под действием дезинфицирующих средств. Морфологически и биохимически они имеют сходные свойства, но существенно различаются в этиологическом, иммунологическом и эпидемиологическом отношении и по способности вызвать клинически выраженные заболевания, протекающие с дизентерие-, сальмонеллезо- и холероподобными проявлениями.
К настоящему времени выделено около 170 антигенных вариантов Е. coli, из них- более 80 вызывают коли-инфекции.
Диарейные серовары (по определению ВОЗ) разделяют на 5 групп:
1. Энтеропатогенные кишечные палочки (ЭПКП) делятся на 15 серогрупп и 29 сероваров. Чаще других при диарейных заболевания у детей обнаруживают О 55, О 111, О 125 и др.; у взрослых они, как правило, заболеваний не вызывают.
2. Энтеротоксигенные кишечные палочки (ЭТКП) подразделяют на 17 серогрупп и 16 сероваров. Вызывают холероподобные заболевания у детей и взрослых вследствие способности вырабатывать экзотоксин, подобный холерогену.
3. Энтероинвазивные кишечные палочки (ЭИКП) объединены в 9 серогрупп и 13 сероваров. Чаще других при диареях обнаруживают О-124 и 0-151. Они вызывают дизентериеподобные заболевания у детей и взрослых.
4. Энтерогеморрагические кишечные палочки (ЭГКП) относят к серогруппам 0-26, 0-145, 0-157. Продуцируют цитотоксин, вызывают дизентериеподобные заболевания и урогемолитический синдром.
5. Энтероадгезивные кишечные палочки (ЭАКП) наименее изучены; отличаются способностью быстро прикрепляться к кишечному эпителию и вызывать заболевания у лиц с ослабленной сопротивляемостью инфекции.
Механизмы развития эшерихиозов
При попадании в кишечник эшерихии разрушаются, что приводит к высвобождению эндотоксина липополисахаридной природы, который входит в состав стенки грамотрицательных бактерий. Всасываясь из кишечника в кровь эндотоксин вызывает синдром общей инфекционной интоксикации, проявляющейся поражением нервной и сердечно-сосудистой системы; обуславливает тахикардию, гипотонию вплоть до коллапса. Кроме того, эндотоксин обладает энтеротропным действием, вызывая токсическое повреждение главным образом тонкой кишки с развитием диареи и эрозивного процесса в слизистой оболочке. Различия в патогенезе отдельных эшерихиозов зависят от биологических свойств возбудителей, обладающих неодинаковым набором патогенетических факторов, в зависимости от принадлежности к тому или иному классу эшерихий
Энтеротоксигенные эшерихий вырабатывают энтеротоксины и фактор колонизации, с помощью которого они прикрепляются к слизистой оболочке тонкой кишки и колонизируются на ней.
Механизм действия ЭИКП, неспособных продуцировать экзотоксин, сводится к внедрению в слизистую оболочку кишки, развитию воспалительной реакции в ней и образованию эрозий на ее поверхности. Поврежденная слизистая оболочка легко всасывает эндотоксины бактерий (наступает эндоинтоксикация). В испражнениях появляется слизь, кровь и полиморфно-ядерные лейкоциты. Заражающая доза ЭИКП составляет 5x105 микробных клеток.
Патогенез заболеваний, вызываемых ЭПКП, во многом остается еще недостаточно изученным, так как многие биологические свойства эшерихий пока неизвестны. В последние годы интенсивно изучаются кишечные палочки, продуцирующие цитотоксин SLT (Shigu-like-toxin), вызывающий повреждение мелких кровеносных сосудов эпителия кишечной стенки проксимальных отделов толстой кишки, что приводит к нарушению кровоснабжения стенки кишки, ишемии и некрозу, появлению крови в стуле. У некоторых больных в результате всасывания токсина в кровь развивается тяжелое осложнение - гемолитический уремический синдром, нередко приводящий к летальному исходу.Обладая способностью колонизировать эпителий тонкой кишки, кишечные палочки вызывают легкие, но длительно протекающие кишечные заболевания у взрослых и детей.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Один из наиболее распространенных способов получения клеток E.coli для последующей трансформации с очищенной ДНК – инкубация бактерий при низкой температуре в жидкой среде, содержащей катионы Ca. Данная методика была разработана японскими специалистами в области генной инженерии в 1996 году. Метод включает несколько последовательных этапов.
Выращивание колоний E.coli в агаризированной среде SOB
Мягкие и твердые стерильные одноразовые микробиологические петли из полистирола производства итальянской компании Promed выпускаются объемом 1 и 10 мкл
Для этого в стерильных условиях в пробирку с культурой E.coli вводится простерилизованная многоразовая или стерильная одноразовая бактериологическая петля, с помощью которой осуществляется забор материала, перенос его на селективную питательную среду и распределение по ее поверхности зигзагообразным движением.
Выращивать колонии в чашках Петри можно при 37°C или при 18°C. В первом случае материал для дальнейшей работы будет готов уже на следующее утро, однако уровень компетентности выращенных таким образом бактериальных клеток получится умеренным.
Для получения клеток с более высокой компетентностью материал рекомендуется инкубировать при t 18°C, однако нужно учитывать, что в таком температурном режиме нужной плотности колонии достигнут лишь через несколько суток.
Глубинное культивирование и охлаждение
После инкубирования 10-12 колоний диаметром от 2 до 3 мм отбираются в колбу емкостью 0,5-1л с 40 мл жидкой среды SOB. Колба помещается на качалку, установленную в термостат, где при температуре 37°C и интенсивном встряхивании (200-300 об/мин) осуществляется глубинное культивирование культуры в течение 2-2,5 часов до достижения оптической плотности 0,6.
После этого сосуд с материалом ставят в мелко-колотый лед, где и производятся все дальнейшие манипуляции.
Центрифугирование и ресуспензирование
Охлаждение после культивирования осуществляется в течение 30 минут, после чего из колбы отбирают 30 мл культуры и центрифугируют материал в пробирке емкостью 50 мл при температуре 4°C в течение 10 минут при скорости 3000 об/мин.
Затем супернатант сливают и центрифугируют бактериальные клетки в течение 20 секунд при аналогичных указанным выше скорости и температуре. После этого жидкую фракцию удаляют пипеткой, а осадок суспензируют в 10 мл буфера ТВ и оставляют на 10-15 минут в мелко-колотом льду (t - 0°C).
Диметилсульфоксид используется при выращивании компетентных клеток E.coli в качестве криопротектора
Вслед за этим материал вновь подвергается двукратному центрифугированию вышеописанными способами. Выпавшие в осадок клетки ресуспензируются в 2 мл буфера.
Затем к культуре добавляется диметилсульфоксид (криопротектор) до достижения концентрации 3,5%, и сосуд выдерживается при 0°C в течение 10-15 минут.
Вслед за этим культура вновь центрифугируется при 4°C и скорости 3000 об/мин в течение 10 минут, после чего супернатант сливается.
Разлив и хранение
Выбор оборудования и материалов
Встряхиватель KS 130 kontrol nol марки IKA может работать при температурах от 5 до 50 градусов Цельсия
Выбрать устройство для встряхивания не составляет проблемы – рынок современных лабораторных шейкеров и качалок представлен широким перечнем высокотехнологичных приборов, среди которых можно без труда подобрать аппарат с оптимальными характеристиками.
Для центрифугирования идеальным решением по сочетанию цены, функциональности и эксплуатационных характеристик станет выбор в пользу оборудования британской марки Centurion Scientific. Главное преимущество рефрижераторных моделей этой марки – использование уникальной запатентованной технологии принудительного охлаждения, обеспечивающей исключительную точность и стабильность температуры по всему объему центрифужной камеры.
Под этой маркой выпускаются лабораторные центрифуги со сменными роторами, работающие в различных диапазонах скоростей и предназначенные для решения разных задач.
Универсальная центрифуга PrO-Hospital HLR идеально справится с подготовкой E.coli для последующей трансформации и позволит успешно решать другие задачи
Если работу с материалом планируется вести по стандартным методикам, вполне достаточным может оказаться функционал охлаждаемых универсальных центрифуг для клинических исследований с 10 ячейками встроенной памяти. Эти приборы относятся к серии Pro-Hospital. Такие же модели, как, например, цитоцентрифуга Pro-CYTLCD или ее более простая модификация Pro-CYTLED, а также центрифуги для разделения крови серии Pro-PRP разработаны с целью подготовки образцов для гистологического анализа методом жидкостной цитологии и получения богатой тромбоцитами плазмы соответственно. Они совместимы с определенными типами роторов, оснащаются предустановленными программами центрифугирования в строго определенных режимах и работают при комнатных температурах. Поэтому при выборе оборудования для работы с клеточными культурами следует обращать внимание именно на аппараты линейки Pro-Hospital с подходящим функционалом – HLR или LLR.
Для нужд научно-исследовательских лабораторий великолепно приспособлены аппараты серии Pro-Research с сенсорной панелью управления, максимально гибкой настройкой и большим объемом встроенной памяти, позволяющей одномоментно хранить и быстро запускать до 108 методик с различными параметрами.
Крайне важно использовать высококачественные среды и реактивы – это на порядок повышает продуктивность и сводит к минимуму риск порчи биоматериала. Один из лидеров в этой нише рынка – французская компания Biochem, в перечень продукции которой входят стандартные растворы, готовые буферы и среды, а также реактивы для их приготовления.
1 Учреждение Российской академии наук Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН
Обзор посвящён использованию инактивированной бактериальной суспензии клеток бактерии Escherichia coli (БКС E. coli ) в качестве действующего компонента современных фармакологических препаратов. Освещена история вопроса, раскрываются механизмы действия этой группы препаратов через призму современных представлений об иммунитете и развитии воспалительных реакций. Приведён список целевых патологий и анализ опыта лечебного применения. Затронуты особенности биофармацевтического производства и приведены примеры положения некоторых лекарств в этом секторе фармрынка. Обосновывается перспективность разработки отечественных препаратов, имеющих в составе БКС E. coli. Работа может быть полезна для студентов и аспирантов биологических и медицинских специальностей, практикующих врачей и специалистов, занимающихся стратегическим планированием и выводом на российский рынок новых лекарственных препаратов.

1. Besredka A. Antivirus Therapy in Infectious Diseases // Proc R Soc Med. 1929. V. 12. № 12. Р. 1579-1598.
2. Everson M.P., McDuffie D.S., Lemak D.G., Koopman W.J., McGhee J.R., Beagley K.W. Dendritic cells from different tissues induce production of different T cell cytokine profiles // J Leukoc Biol. 1996. V. 59. № 4. P. 494-498.
3. Fesenko E.E., Novoselov V.I., Yanin V.A., Lipkin V.M., Shuvaeva T.M. Antioxidant pharmaceutical compound, method for producing polypeptide and method of cure // United States Patent №US8,003,345 B2. 2011.
4. Galli S.J., Maurer M., Lantz C.S. Mast cells as sentinels of innate immunity // Curr Opin Immunol. 1999. V. 11. P. 53-59.
6. Posterisan® Posterisan® forte: basic research and clinical efficacy / BCS Ser. Berlin: Dr Kade International, 2001. 87p.
7. Watts T.H., DeBenedette M.A. T-cell co-stimulatory molecules other than CD28 // Curr Opin Immunol. 1999. V. 11. P. 286-293.
Еще в начале ХХ века Безредка А. М. (французский микробиолог и иммунолог, ученик Мечникова) продемонстрировал, что поверхностно и местно применяемые инактивированные стафилококковые или стрептококковые фильтраты культур были значительно более эффективны в защите животных от последующего введения инфекции в летальной дозе, чем те же самые бактериальные суспензии культур, введенные парентерально (например, внутривенно). Из серии этих экспериментов становилось все более очевидным, что этот тип иммунитета представлялся в значительной степени независимым от формирования антител, т.к. защита животных происходила до истечения 24-часового периода после введения летальной дозы инактивированных нагреванием стафилококков. Кроме того, локальная обработка большей кожной поверхности (даже неповрежденных участков) фильтратом бактериальной культуры часто была достаточна для защиты организма подопытных животных от гибели. В то время результаты этих экспериментов были трудно объяснимы. Сегодня известно, что капсульные липополисахариды могут стимулировать устойчивые независимые Т-лимфоциты, но не длительный иммунитет. Липополисахариды и другие компоненты бактериальных клеток, очевидно, активируют врождённый иммунитет путем усиления фагоцитоза и убийства бактерий, что приводит в дальнейшем к стимуляции приобретённого иммунитета.
Механизм действия бактериальной культуральной суспензии
- Действие БКС E.coli увязывает врождённые и адаптивные пути ответа иммунной системы. Молекулярные компоненты БКС модифицируют различные популяции АПК (антиген-презентирующих клеток) и стимулируют Т-клетки. БКС является неспецифичным антигеном, но может оказывать влияние как на врожденный, так и на специфический иммунные ответы. Причина этого в том, что цитокины, продуцируемые макрофагами, кератиноцитами или дендритными клетками, принципиально антигеннеспецифичны, однако, они могут модифицировать экспрессию множества основных мембранных белков, играющих роль в клеточной коммуникации между АПК, с одной стороны, и Т-клетками, В-клетками или клетками-киллерами, с другой стороны.
- Иммуномодулирующая способность E. coli зависит не только от эндотоксинов, присутствующих в клеточных стенках бактерий. Ряд компонентов, таких как порины, липопротеины, фибриллярные протеины, липид А или липополисахариды, являются сильными индукторами генной экспрессии многих цитокинов в различных типах клеток, включая макрофаги и нейтрофилы - ключевые элементы первой линии антимикробной защиты.
- Дендритные клетки (функционально различные субпопуляции которых присутствуют в разных типах тканей) характеризуются способностью стимулировать Т-лимфоциты, следовательно, способны влиять на итог иммунного ответа, который особенно важен для процессов регенерации [2]. В частности, клетки Лангерганса, находящиеся в коже, представляют собой одни из наиболее специализированных типов клеток, презентирующих антиген отдельным функционально отличным субпопуляциям Т-лимфоцитов [2]. Различные субпопуляции Т-лимфоцитов вовлечены в иммунопатологический, а также иммуннорегуляторный циклы. Поэтому БКС E.coli опосредованно может оказывать влияние на воспалительные процессы, развивающиеся вследствие геморроя и хронического анально-кожного повреждения.
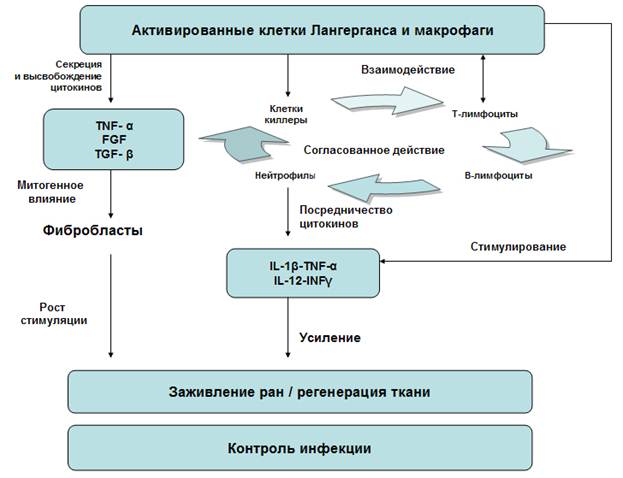
Рисунок. Схема действия бактериальной культуральной суспензии
В иммуномодулирующем действии препаратов на основе БКС условно можно выделить два основных пути.
Во-первых, бактериальные компоненты БКС могут стимулировать активность АПК и кератиноцитов кожи и за счёт этого повышать цитокиновую секрецию фагоцитов [5] (рис.). Кератиноциты - одни из первых клеток, отвечающие на повреждение тканей (рану) или инфекцию высвобождением медиаторов, участвующих в воспалении. Является общепризнанным, что цитокины, такие, как TNF-α или интерлeйкин-1b, определяют активированный статус T-клеток. В этот процесс вовлечены такие важные костимулирующиеся белки (часто это рецепторы клеток, отвечающие за их взаимодействие и правильное восприятие сигналов), как B7, B7-1 или антигены CD40 [7]. Существуют данные о том, что БКС усиливает эффекты Т-клеточной активации, хотя не является прямым индуктором антиген-специфической активации. Это подтверждается экспериментальными наблюдениями относительно слабого местного ответа антител на БКС, но достаточно серьезного воздействия на медиаторные каскады и локальную (местную) пролиферацию T-лимфоцитов. Целый ряд экспериментов на различных моделях: лимфоузлы кролика, смешанные культуры эпидермальных клеток Лангерганса и очищенных T-клеток (или периферических мононуклеарных клеток крови), подтверждают такой вывод.
Во-вторых, воспаление кожи вызвано накоплением иммунокомпетентных клеток и сопровождается сложными клеточными взаимодействиями между ними и различными медиаторами воспаления. Цитокины и хемокины регулируют связи между клеточными элементами иммунной системы, тогда как липидные медиаторы оказывают влияние непосредственно на секреторную и функциональную активность моноцитов, гранулоцитов, эозинофилов и базофилов, а также неиммунных клеток (тромбоциты, эндотелиальные клетки, тучные клетки, кератиноциты). Скоординированное взаимодействие цитокинов с иммунными клетками может оказывать на последние как стимулирующие, так и ингибирующие действие, которое в результате способно предотвратить повреждение ткани. Так, в процессе заживления раны тканевые макрофаги раны играют не только важную роль в элиминировании остатков повреждённых клеток путем фагоцитоза, но и контролируют уровень факторов роста и цитокинов (см. рис.). Сопутствующее фагоцитозу появление медиаторов (таких, как кислородные радикалы) вносит свой вклад в эффективное и успешное удаление болезнетворных микроорганизмов. Те же свободные радикалы могут воздействовать на регулирование сбалансированного иммунного ответа: чрезмерный синтез и высвобождение хемокинов, цитокинов или липидных медиаторов может вызвать необратимое повреждение ткани путем поддерживания длительной активации местных иммуноцитов и не иммунных клеток. БКС индуцирует синтез лейкотриенов (медиаторы воспаления), гистамина и факторов хемотаксиса (таких, как интерлeйкин-8, IL-8). Например, лейкотриены типа LTB4 быстро привлекают нейтрофилы к воспаленным тканям, стимулируют их миграцию в кожу, вызывают агрегацию тромбоцитов, мобилизуют клеточные запасы кальция, индуцируют выпуск супероксид-радикалов и стимулируют хемотаксис и адгезию эозинофилов при аллергических реакциях кожи. Известно, что воспалительные процессы усиливаются вследствие чрезмерного выпуска этого липидного медиатора тучными клетками, гранулоцитами или моноцитами [4]. IL-8 - самый мощный хемоаттрактант для нейтрофилов и может быть продуцирован эндотелиальными клетками, фибробластами, кератиноцитами и эозинофилами. Высвобождение IL-8 индуцируется при контакте клеток с липополисахаридами. Цитокины TNF-α и интерлeйкин-1b (IL-1b) также способствуют выпуску IL-8. IL-1b и TNF-α далее вызывают активацию эндотелиальных клеток, которая облегчает миграцию нейтрофилов. Понятно, что все эти события порождают воспаление в окружающих тканях, которое в свою очередь может заново активировать миграцию клеток в поврежденную кожу (рис.).
Несмотря на осторожное отношение некоторых специалистов к иммуномодуляторам, в своё время были проведены клинические исследования, доказывающие терапевтические эффекты препаратов на основе БКС E. coli [6] (таблица).
В конце нужно отметить, что поскольку активный компонент этой группы лекарств - суспензия культуры бактерий E. coli, препараты технологичны и выгодны при биотехнологическом производстве. Кроме этого существует возможность значительного улучшения свойств лекарств путём введения в их состав рекомбинантных белков. Фактически это является новым подходом, очевидный плюс которого заключается в отсутствии необходимости очистки препарата рекомбинантного белка перед введением в лекарственную композицию. Подразумевается, что БКС E. coli будет получаться из клеток штамма-продуцента целевого белка, обладающего лечебным действием. Синергизм доказанных иммуномодулирующих свойств БКС и лечебного действия целевого белка очевидно приведёт к увеличению терапевтического эффекта нового препарата. Любое повреждение ткани инициирует события, сопровождающиеся увеличением активных форм кислорода в районе раны, и их нейтрализация в клетке является одним из главных условий быстрого заживления.
Таблица. Результаты клинических исследований двойным слепым методом мазей Постеризан и Постеризан Форте по сравнению с плацебо мазью или активным контролем
Читайте также:

