Трансплацентарные инфекции что это
Обновлено: 24.04.2024
8.3. ПУТИ РАСПРОСТРАНЕНИЯ ИНФЕКЦИИ
В зарубежной и отечественной литературе описано пять основных пу-тей проникновения возбудителей инфекции в организм плода (Анкирская А.С., 1985; Радзинский В. Е, 1992; Кира Е.Ф., 1996; Левицкая С. К., 1991):
1) восходящий (через шейку матки и оболочки плодного яйца);
2) трансплацентарный, или гематогенный (через плацентарный барьер к плоду);
3) нисходящий (из воспалительно измененных придатков матки, аппен-дикса);
4) интранатальный (при прохождении плода через инфицированные ро-довые пути матери);
Антенатально инфекционный агент попадает к плоду гематогенно (трансплацентарно) или через инфицированные околоплодные воды. Чаще при антенатальном заражении возбудители поступают в организм плода ге-матогенно. Вначале они с кровью матери поступают в плаценту, где возмож-но размножение возбудителя и последующее развитие воспалительного про-цесса (плацентита). Преодолев маточно-плацентарный барьер, возбудитель проникает к плоду и может привести к развитию генерализованной инфекции с поражением печени, легких, почек, головного мозга и других органов (Ан-кирская А.С., 1989; Айламазян Э.К., 1995; Есаулова Н.Е., 1996; Сидельникова В.М., 1996; Сидорова И.С., 1999; Михайлов А.В., Лаврова Д.Б., Коляченко Е.С., 2003). Следует отметить, что распространение возбудителей может происходить и по вартонову студню пуповины, чему способствует внесосу-дистый ток жидкости от плаценты к плоду (Mindel A., 1995).
Околоплодные воды могут быть инфицированы восходящим (из влага-лища) и нисходящим (из маточных труб) путём, а также самим плодом, ин-фицированным гематогенно и выделяющим возбудителя с калом и мочой с последующим инфицированием околоплодных вод. При синдроме инфици-рования амниона может произойти преждевременный разрыв околоплодных оболочек с последующим развитием эндометрита, инфекционных осложне-ний новорожденного (Анкирская А.С., 1985). Учитывая ведущую роль трансплацентарного (гематогенного) инфицирования при антенатальной ВУИ, важно отметить, что состояние барьерной функции плаценты в значи-тельной мере определяет возможность развития инфекции и количество по-павшего к плоду инфекционного агента. Известно, что фетоплацентарная не-достаточность резко увеличивает риск развития генерализованной ВУИ при наличии хронического очага или остром заболевании у беременной.
Гематогенный путь передачи инфекции характерен для цитомегалови-русной, энтеровирусной инфекции, вируса простого герпеса, ветряной оспы, а также наблюдается при листериозе, микоплазмозе, некоторой бактериаль-ной инфекции и приводит к тяжёлым диссеминированным поражениям фе-топлацентарной системы, жизненно важных органов плода (мозга, печени, лёгких) (Девис П. А., 1987; Лозовская Л. С., 1995; Самохин П. А., 1987; Си-макова М. Г., 1995).
Восходящий путь инфицирования характерен для условно - патогенной микрофлоры, грибковой инфекции, а также наблюдается при хламидиозе, микоплазмозе, листериозе, других инфекциях. При восходящем пути инфи-цирования микроорганизмы проникают через плодные оболочки в около-плодные воды, где происходит размножение возбудителя. При этом плод оказывается в инфицированной среде. Заражение внутренних полостей плода происходит при заглатывании и аспирации инфицированных вод (Гуртовой Б. Л., Анкирская А. С., 1994; Цинзерлинг А. В., 1986).
Нисходящий путь инфицирования менее характерен для ВУИ, хотя его риск высок при персистенции возбудителей в эндометрии и маточных трубах (хламидии, микоплазмы, уреаплазмы) (Радзинский В. Е., 1996; Тареева Т. Г., 1994).
Интранатальный путь инфицирования (заражение плода во время родов путём аспирации или заглатывания содержимого родовых путей матери) наиболее характерен для бактериальной инфекции (стрептококк группы В, E.сoli, стафиллококк, Proteus, клебсиелла, анаэробная флора), но возможен и для вирусной (ВПГ, ЦМВ) инфекции, грибов рода Кандида. Причем передача инфекции возможна как при наличии симптомов поражения в области шейки матки и вульвы, так и при бессимптомном выделении возбудителя (Адаске-вич В. П., 1996; Барашнев Ю. И., 1994; Кудашев Н. И., 1991; Carmack M. A., 1993).
Таким образом, при наличии у беременной урогенитальной инфекции внутриутробное инфицирование плода и новорожденного может произойти любым из вышеперечисленных путей.
Диагностика TORCH-инфекции головного мозга по КТ, МРТ, УЗИ
а) Терминология:
1. Синонимы:
• TORCH(S), (S)TORCH, врожденные инфекции, внутриутробные инфекции
2. Определение:
• Врожденные инфекции, вызванные трансплацентарной передачей патогенов:
о Токсоплазмоз: Toxoplasma gondii
о Краснуха: вирус краснухи
о Цитомегаловирусная инфекция (ЦМВИ): наиболее распространенная TORCH-инфекция
о Герпес: вирус простого герпеса 2 (ВПГ-2)
о Прочее: вирус иммунодефицита человека (ВИЧ), лимфоцитарный хореоменингит (ЛХМ), сифилис
б) Визуализация:
1. Общие характеристики TORCH-инфекции головного мозга:
• Лучший диагностический критерий:
о Токсоплазмоз, ЦМВИ, ВИЧ и краснуха являются причиной кальцификации паренхимы (Са++)
о ЦМВИ является причиной возникновения перивентрикулярных кист, расщелин, шизэнцефали и дефектов миграции
о У новорожденных поражение мозговой ткани при ВПГ-инфекции имеет диффузный и мультифокальный характер, у взрослых поражаются лобная и височная доли
о Краснуха и ВПГ могут вызвать долевую деструкцию/энцефало-маляцию
о Сифилис вызывает базилярный менингит
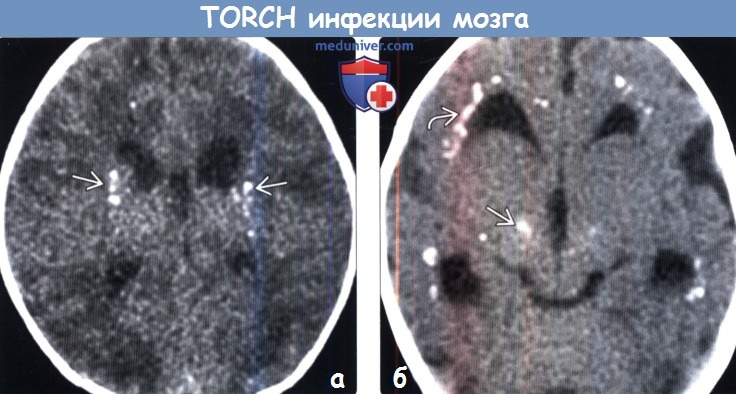
(а) Бесконтрастная КТ, аксиальный срез: у младенца с микроцефалией и вирусным лимфоцитарным хореоменингитом определяются рассеянные кальцификаты базальных ганглиев. Клинические и визуализационные признаки данного заболевания могут имитировать врожденную цитомегаловирусную инфекцию.
(б) Бесконтрастная КТ, аксиальный срез: у пациента с псевдо-TORCH инфекцией определяется перивентрикулярная кальцификация и отложение кальция в базальных ганглиях. Псевдо-TORCH состояния являются аутосомно-рецессивными нарушениями, проявляющихся минерализацией и прогрессирующей демиелинизацией.
2. КТ признаки TORCH-инфекции головного мозга:
• Бесконтрастная КТ:
о Цитомегаловирусная инфекция:
- 50% пациентов имеют паренхиматозные и/или перивентрикулярные Са++
- Очаговое понижение плотности белого вещества (БВ) ± кисты
- Миграционный дефекты, кортикальные расщелины, шизэнцефалия
- Расширение желудочков, потеря объема вещества головного мозга, гипоплазия мозжечка
о Токсоплазмоз:
- Паренхиматозные и перивентрикулярные кальцификаты обычно имеют менее распространенный и рассеянный характер, чем при ЦМВИ
о Вирус простого герпеса:
- Протяженные области пониженной плотности ± гиперденс-ные очаги кровоизлияний
о ВИЧ:
- Сочетание потери объема головного мозга, субкортикальных кальцификатов и кальцификатов в структуре базальных ганглиев
• КТ с контрастированием:
о Поражения с менингеальными воспалительными компонентами (сифилис, ВПГ) могут характеризоваться накоплением контраста
5. Рекомендации по визуализации:
• Лучший метод визуализации:
о Нейросонография для неонатального скрининга
о МРТ головного мозга для комплексной оценки аномалий
• Советы по протоколу исследования:
о Т2* GRE и/или бесконтрастная КТ для обнаружения перивентрикулярных Са++ или кровоизлияния
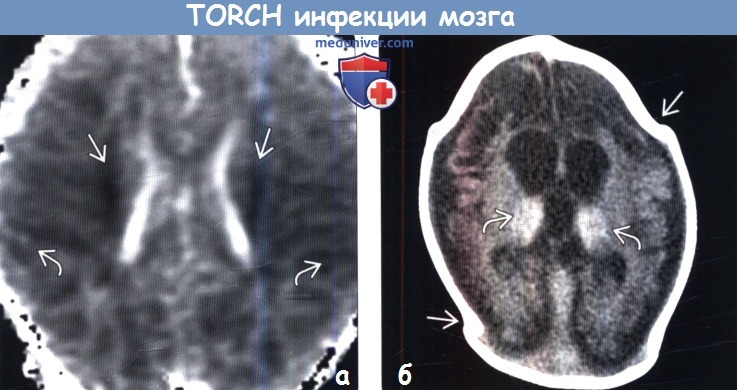
(а) Перивентрикулярные гиперэхогенные очаги соответствуют кальцификатам, выявляемым при бесконтрастной КТ у данного пациента с врожденной ЦМВИ. С помощью УЗИ также можно обнаружить кисты, расщелины и шизэнцефалию — признаки, связанные с врожденной ЦМВИ.
(б) МРТ, FLAIR, аксиальный срез: при врожденной ЦМВИ определяется перивентрикулярные герминолитиче-ские кисты и обширное повышение интенсивности белого вещества, вследствие глиоза. (а) MPT, Т2-ВИ, FSE, аксиальный срез: у ребенка с врожденной ЦМВИ определяется расширение сильвиевых цистерн, обусловленное перисильвиевой полимикрогирией. Сливные зоны повышения сигнала от перивентрикулярного белого вещества отражают глиоз и демиелинизацию.
(б) Бесконтрастная КТ, аксиальный срез: у пациента с токсоплазмозом определяются множественные рассеянные церебральные кальцификаты. Обратите внимание на расширение желудочков и потерю объема полушарий головного мозга. Инфекционное поражение вызвано простейшим Toxoplasma gondii.
в) Дифференциальная диагностика TORCH-инфекции головного мозга:
1. Туберозный склероз:
• Характерны субэпендимальные кальцификаты
• Периферические туберсы имитируют аномалии миграции
• Повреждения БВ могут имитировать глиоз при TORCH-инфекции
2. Врожденный лимфоцитарный хореоменингит:
• Вызывает некротизирующий эпендимит → обструкция водопровода; макроцефалия (в 43% случаев), микроцефалия (в 13% случаев)
• При бесконтрастной КТ может имитировать признаки ЦМВИ
3. Псевдо-TORCH синдромы:
• Синдромы Берейтсера-Реардона, Айкарди-Гутьерес (плеоцитоз в спинномозговой жидкости [СМЖ], ↑ α-интерферона в СМЖ):
о Прогрессирующая демиелинизация большого мозга и мозжечка
о Кальцификация базальных ганглиев, ± перивентрикулярные кальцификаты
г) Патология:
1. Общие характеристики TORCH-инфекции головного мозга:
• Этиология:
о Цитомегаловирус:
- Повсеместно распространенный ДНК вирус семейства Herpesviridae
- Наиболее частая причина внутриутробной инфекции
- У матери имеется первичное или повторное инфицирование во время беременности
о Герпетический энцефалит:
- ВПГ-2
- Активная генитальная инфекция, передающаяся во время родов; трансплацентарная передача встречается реже
о Краснуха:
- Семейство вирусов Togaviridae; очень редкая инфекция в США
- Высокий риск выкидыша и врожденных дефектов плода при заражении матери в первом триместре
о Токсоплазмоз:
- Кошки являются окончательными хозяевами для протозойных паразитов
- 50% случаев заражения инфекцией токсоплазмоза в США происходят при употреблении зараженного мяса
- Активная инфекция во время беременности → врожденная инфекция в 20-50% случаев
о ВИЧ:
- Передается через трансцервикальный путь
- 30% беременностей у ВИЧ(+) женщин приводит к передаче инфекции, если не были приняты превентивные меры
о Сифилис:
- Вызывается спирохетозной бактерией Treponema pallidum
2. Макроскопические и хирургические особенности:
• Микроцефалия, шизэнцефалия, полимикрогирия при ЦМВИ
• Воспаление/деструкция при токсоплазмозе, краснухе, ВПГ
3. Микроскопия:
• При токсоплазмозе возможно обнаружение инкапсулированных паразитов
• Ишемический некроз при краснухе
• Микроглиальные узелки и цитомегалия при ЦМВИ
(а) MPT, ИКД, аксиальный срез: у новорожденного с острой инфекцией, судорогами и герпетическим сепсисом (ВПГ 2 типа) определяется распространенное снижение диффузии (гипоинтен-сивный сигнал) в перивентрику-лярном и субкортикальном белом веществе, а также коре головного мозга.
(б) Бесконтрастная КТ, аксиальный срез: у младенца с врожденной краснухой и катарактой определяется атрофия полушарий головного мозга. Отмечается наложение костей черепа друг на друга, обусловленное потерей объема головного мозга. Обратите внимание на центральную кальцификацию базальных ганглиев.
д) Клиническая картина:
1. Проявления TORCH-инфекции головного мозга:
• Наиболее частые признаки/симптомы:
о ЦМВИ может проявляться при рождении (в 10% случаев) в виде микроцефалии, гепатоспленомегалии, петехиальной сыпи:
- В 55% случаев системных заболеваний имеет место повреждение центральной нервной системы (ЦНС)
о При рождении врожденный токсоплазмоз обычно имеет скрытый характер, проявляется в возрасте 2-3 месяцев:
- Лейкокория (хориоретинит)
о При заражении ребенка во время родов ВПГ-инфекция обычно проявляется на 3-15 день в виде судорог, вялости:
- При заражении ребенка внутриутробно (в 5% случаев) ВПГ обычно проявляется после рождения в виде гидроанэнцефалии и замедления роста
о ВИЧ обычно диагностируется на 6-12 месяцах жизни, когда проявляется задержка развития
о Краснуха проявляется в виде петехиальной сыпи, низкого веса при рождении и лейкокории (катаракты)
о Сифилис → задержка в развитии и повышенная возбудимость у новорожденных, боли в костях у младенцев
3. Течение и прогноз:
• Сроки инфекции во время беременности при токсоплазмозе, ЦМВИ коррелируют с тяжестью заболевания:
о Заражение на ранних сроках беременности характеризуется неблагоприятным прогнозом
• До 95% новорожденных с неврологическими симптомами ЦМВИ имеют большую тяжесть последствий со стороны неврологического развития
4. Лечение TORCH-инфекции головного мозга:
• Ганцикловир может быть полезен у ЦМВ-инфицированных младенцев
• При краснухе лечение отсутствует
• Антиретровирусная терапия во втором и третьем триместрах, а также во время родов может предотвратить передачу ВИЧ
• Пириметамин и сульфадиазин используются для неонатальнго лечения токсоплазмоза → более благоприятный исход по сравнению с нелечеными младенцами
• Лечение ацикловиром при ВПГ
• Лечение пенициллином при всех формах сифилиса
е) Диагностическая памятка:
1. Обратите внимание:
• Предполагайте TORCH-инфекции у новорожденных и младенцев с микроцефалией, аномалиями развития глаз и внутриутробной задержкой роста
2. Советы по интерпретации изображений:
• Следует предполагать врожденный ЦМВ-энцефалит при выявлении методами визуализации:
о Микроцефалии, полимикрогирии, перивентрикулярных кальцификатов и кист, кортикальных расщелин, поражения БВ и гипоплазии мозжечка
Врожденные инфекции у плода и новорожденного ребенка: виды, возбудители, клиника, диагностика
Передача врождённых и перинатальных инфекций плоду происходит через плаценту (внутриутробные инфекции), во время родов или при контакте с физиологическими жидкостями матери. Длительное разрушение плодных оболочек также способствует развитию внутриутробных заболеваний. Кроме того, заражение может произойти и после рождения (при контакте с матерью и другими людьми).
Врожденная краснуха
Первый признак врождённой краснухи — желтуха, как следствие развития гепатита. Часто возникает гемолиз и тромбоцитопеническая пурпура, а также слабовыраженные клинические проявления менингоэнцефалита. У некоторых новорождённых обнаруживают признаки метафизарной дисплазии. Инфицированные дети при рождении обычно имеют сниженную массу тела и отстают в физическом развитии.
В тяжёлых случаях болезнь обычно заканчивается летальным исходом. Наиболее грозные осложнения — незаращение артериального протока, катаракта, глухота, ретинопатия.
Тест на антитела к краснухе (IgM), которые можно обнаружить в крови детей до 3-го мес жизни, даёт положительный результат. При заболевании матери в I триместре вероятность развития патологии у ребёнка составляет 60%, поэтому некоторые женщины предпочитают прерывать беременность. В дальнейшем риск заметно снижается (2% после 20-й нед), в связи с чем выбор между рождением ребенка с вероятными нарушениями в развитии и прерыванием беременности необходимо делать крайне осторожно.
Цитомегаловирус у плода и новорожденного
Инфекция проявляется примерно в 1% случаев, при этом тяжёлая форма заболевания развивается только у 1% инфицированных. Наиболее высокий риск заражения плода отмечают на сроке гестации, соответствующем I триместру беременности. Симптомы заболевания у новорождённых — сниженная масса тела, гепатомегалия, спленомегалия, тромбоцитопения, продолжительная желтуха, повышенная возбудимость, судорожный синдром, аномальный мышечный тонус и двигательные расстройства.
Наиболее частые осложнения — микроцефалия, нейросенсорная глухота. Нередко обнаруживают кальцификацию головного мозга, гемиплегию (паралич мышц одной стороны тела), замедление психомоторных реакций, хориоретинит и миопатию. Диагностика основана на обнаружении антител к цитомегаловирусу (IgM) или определении экскреции вируса в течение первых двадцати дней жизни.
Возбудитель ЦМВ инфекции
Врожденная инфекция вируса простого герпеса
Первичная инфекция, вызванная вирусом простого герпеса, сопровождается виремией. При этом может произойти трансплацентарное заражение плода. При врождённом инфицировании дети рождаются с тяжёлыми отклонениями (пневмония, менингоэнцефалит, гепатоспленомегалия, цитопения), но лишь у некоторых из них присутствуют герпетические очаги на коже и слизистых оболочках. Лечение ацикловиром позволяет снизить смертность с 80—90% до 10—15%.
Терапию следует начинать до получения результатов лабораторного анализа. Первичная инфекция также возникает при заражении от матери, страдающей генитальным герпесом. При этом в первые дни жизни ребёнка возникают очаги на коже, конъюнктиве, слизистой оболочке рта и половых органов, а в 50% случаев наблюдают генерализованное течение инфекции. Лечение: внутривенное введение ацикловира.
Ветряная оспа плода
Инфицирование плода ветряной оспой возникает при заражении беременной в I—II триместре беременности, при этом вероятность передачи инфекции плоду составляет 3%. Заболевание характеризуется развитием рубцовой контрактуры в области лимбических структур головного мозга, микроцефалии или офтальмомикрии. Непривитые беременные в течение десяти дней после возможного заражения (контакта) должны пройти профилактический курс введения иммуноглобулина (содержащим антитела к вирусу ветряной оспы).
Ветряная оспа новорождённых возникает при заболевании матери в течение одной недели до родов. Смертность составляет 40%, поэтому в первые 48 ч жизни ребёнку необходимо ввести специфический иммуноглобулин. При ухудшении состояния следует незамедлительно начать лечение ацикловиром. Применение нормального иммуноглобулина человека не защищает новорождённого от заражения. В некоторых странах применяется вакцина.
Врожденный листериоз
Трансплацентарная передача Listeria monocytogenes происходит при заражении матери инфекцией, протекающей бессимптомно. Заболевание матери на ранних стадиях беременности обычно приводит к смерти плода, а на более поздних — к преждевременным родам. Инфекцию новорождённых обычно осложняет бактериемия, гепатоспленомегалия, менингоэнцефалит, тромбоцитопения и пневмония. При интранатальном заражении инфекция развивается в течение первых двух недель жизни ребенка и сопровождается менингитом и бактериемией.
Для выделения возбудителя на анализ отбирают кровь, спинномозговую жидкость, плацентарную ткань и послеродовую жидкость из матки. Инфицированную мать и ребёнка помещают в отдельную палату, так как они могут стать причиной вспышки заболевания в родильном отделении. Препарат выбора — ампициллин (иногда в комплексе с гентамицином); длительность лечения 2—6 нед.
Врожденный сифилис
Благодаря эффективным пренатальным исследованиям случаи врождённого сифилиса в настоящее время достаточно редки. У заражённых детей обнаруживают лихорадку, а также симптомы, свойственные вторичному сифилису, сыпь, кондиломы и трещины на слизистых оболочках. При развитии остеохондритов возникает выраженный болевой синдром. Очень часто отмечают постоянный насморк (сопение, гнусавость).
Для подтверждения диагноза применяют темнопольную микроскопию образцов поражённой кожи и слизистых оболочек. Специфические IgM или другие антитела персистируют в организме свыше 6 мес после перенесённой инфекции. Поздние симптомы (глухота, атрофия зрительного нерва, паретический нейросифилис) наблюдают в возрасте 12—20 лет. Нередко возникают бугристые образования на лобных костях, хронический большеберцовый периостит, перфорация передних зубов, деформация первых постоянных коренных зубов и высокий изгиб нёба. Препарат выбора — пенициллин.
Врожденный токсоплазмоз
Вероятность врождённого токсоплазмоза варьирует в разных регионах. Например, в Великобритании его регистрируют достаточно редко, а во Франции — часто. При заражении беременной трансплацентарную передачу инфекции плоду наблюдают в каждом третьем случае. Наиболее высок риск развития патологии плода (мертворождение, смерть после рождения, кальцификация головного мозга, церебральный паралич и эпилепсия) при заражении женщины в I и II триместре беременности.
Хориоретинит может возникать только спустя некоторое время после рождения и быть единственным симптомом болезни. Токсоплазмоз у матери подтверждают при обнаружении специфических антител (IgM) или сероконверсии. IgM также обнаруживают у инфицированных новорождённых. Применение спирамицина позволяет снизить риск трансплацентарного заражения, но не влияет на исход заболевания у новорождённых.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Трансплацентарная передача антител плоду. Переход антител через плаценту.
Трансплацентарная передача антител плоду зависит, прежде всего, от типа плаценты и играет большую роль у человека, приматов и грызунов, имеющих гемохориальную плаценту, у других видов млекопитающих механизм передачи антител зависит от других факторов.
Следует отметить, что у собак и кошек с эндотелиохориальной плацентой трансплацентарно передается только 5—10% всего количества иммуноглобулинов. Эпителиохориальная плацента лошадей и свиней и синдесмохориальная плацента жвачных вообще непроницаемы для иммуноглобулинов, то есть в этом случае передача антител с молозивом — единственный путь пассивной иммунизации.
Интересна взаимосвязь между структурой плаценты и иммуноглобулиновым составом молозива, а также молока. У животных, не обладающих трансплацентарной передачей иммуноглобулинов, в молозиве содержится большое количество антител IgG (80% всех колостральных иммуноглобулинов), в то время как концентрация IgA низкая (15%). Колостральный иммуноглобулин IgG при переходе в секрет молочной железы концентрируется из сыворотки крови.
Этот процесс начинается уже в постколостральной фазе и, очевидно, контролируется гормонами. Следует отметить, что 90% IgA и 70% IgM синтезируются в молочной железе локально плазматическими клетками. У этих видов животных (без трансплацентарной передачи) иммуноглобулины эффективно всасываются через кишечник в течение первых 2—36 ч жизни, и формируется (при достаточном потреблении молозива) пассивно приобретенный системный иммунитет против тех инфекций, в отношении которых матери были иммунны. Однако через несколько суток после родов концентрация иммуноглобулинов, прежде всего IgG, в секрете молочной железы резко снижается. Например, у свиней в этот период IgA становится основным иммуноглобулином молока. Поступающие с молозивом и молоком иммуноглобулины формируют у поросят пассивный системный и местный иммунитет.

Основным классом иммуноглобулина в сыворотке крови и молозиве свиноматок является IgG, доля которого составляет более 80% от суммы иммуноглобулинов всех классов. В молозиве концентрация IgG и IgA примерно в 2,5—4,5 раза выше, чем в сыворотке крови.
Через 3 суток после опороса концентрация IgG в молозиве снижается примерно в 30 раз. В молоке свиноматок доминирующим классом является IgA (53—57%), и его концентрация остается практически неизменной до конца лактационного периода. В первые 24-36 часов после рождения поросят иммуноглобулины молозива проникают через незрелые эпителиальные клетки в кишечные капилляры, а затем поступают в кровь. Наибольшее поступление антител в кровь поросят наблюдается при приеме молозива сразу после рождения. Содержащиеся в молозиве ингибиторы протеолитических ферментов предохраняют иммуноглобулины от расщепления. Созревая, эпителиальные клетки кишечника теряют способность пропускать иммуноглобулины в кровь.
С целью защиты потомства от инфицирования матерей вакцинируют за 4-6 недель до начала беременности или за 3-6 недель перед родами или началом яйцекладки. В первом случае защищают эмбрионы и плоды от внутриутробного инфицирования, во втором - защищают новорожденных антителами молозива или антителами желтка яиц птиц. Такая защита потомства млекопитающих и птиц в постнатальный период важна при инфекциях, возникающих в раннем возрасте, особенно в первые недели жизни, когда иммунизация новорожденных не является эффективной. Так как многие живые вакцины обладают абортогенным или тератогенным действием, беременных матерей рекомендуют прививать преимущественно инактивированными вакцинами.
Например, многие вакцины против инфекционного ринотрахеита КРС являются абортогенными, а вакцины против панлейкопении кошек, классической чумы свиней, диареи КРС, лихорадки долины Рифт и синего языка обладают тетратогенным действием. Эти нежелательные эффекты обычно наблюдают при первичной вакцинации неиммунных беременных животных.
Основным недостатком естественной пассивной иммунизации является интерференция колостральных антител с индукцией активного иммунитета. Оптимально молодых животных следует вакцинировать, когда исчезнут или почти исчезнут материнские антитела. Однако ожидание может привести к появлению восприимчивости к данной инфекции у некоторой части людей или животных, что особенно опасно при высокой инфицированности окружающей среды или выраженной активности членистоногих переносчиков. Имеется много путей, но нет полностью удовлетворительного решения проблемы, поэтому большинство вакцин применяют в первые 6 месяцев жизни с учетом времени снижения и исчезновения материнских антител.
Другая проблема заключается в том, что молодые животные реагируют на вакцинацию менее выраженным иммунным ответом. Иммуногенность многих вакцин повышается с увеличением возраста прививаемых животных до достижения периода иммунокомпетентности, который, например, у свиней равняется 70-80 дням.
Материнские антитела у млекопитающих и птиц подавляют иммунный ответ новорожденных на вакцинацию, особенно при использовании живых вакцин. На фоне пассивных антител репликация вакцинного вируса может быть значительно подавлена или вовсе не произойдет. Поэтому иммунизация живой вакциной на фоне материнских антител не даст желаемого эффекта. В таких случаях ее следует проводить после исчезновения или значительного ослабления материнского иммунитета. При использовании инактивированных вакцин материнские антитела не являются столь критическим фактором развития активного иммунитета.
Существующая коревая живая вакцина вызывает иммунитет у серонегативных детей, однако, в случае присутствия материнских антител, иммунитет может не развиваться. Трансплацентарный иммунитет у новорожденных более выражен, если матери перенесли корь, а не были вакцинированы. Подавление материнскими антителами иммуногенности живой вакцины против кори является серьезной проблемой в ряде стран Африки, где вакцинацию против кори необходимо начинать с 6-месячного возраста, т.е. на фоне материнских антител. Аналогичная ситуация имеет место при применении живых вакцин в промышленном животноводстве и особенно в птицеводстве. Наличие материнских антител существенным образом затрудняет специфическую профилактику классической чумы свиней.
Отрицательное влияние колостральных антител является менее выраженным при иммунизации живыми вакцинами на слизистые оболочки по сравнению с парентеральным введением. Имеются данные, что оральная вакцинация новорожденных способна индуцировать системный и местный иммунитет, несмотря на наличие материнских антител к вирусу.
Учитывая актуальность данного явления, было начато изучение возможности преодоления неблагоприятного действия материнских антител с использованием живых генноинженерных вакцин.
В одной из них в качестве вектора использовали вирус везикулярного стоматита, в геном которого был включен ген вируса кори, кодирующий гемагглютинин. У вакцинированных крыс на фоне введенных антител к вирусу кори наблюдали специфическую сероконверсию, чего не происходило при введении обычного вируса кори. Аналогичный результат получен при использовании рекомбинантного вируса осповакцины или оспы канареек, в геном которых были вставлены гены вируса чумы собак, кодирующие белки Н (гемагглютинин) и F (белок слияния). Хорьков, содержащих или не содержащих антитела к вирусу чумы собак, вакцинировали рекомбинантными вирусами или обычной вакциной против чумы собак. Наиболее высокие титры у хорьков с материнскими антителами наблюдали при комбинированной интраназальнои и парентеральной иммунизации рекомбинантным вирусом.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Внутриутробные инфекции – группа заболеваний плода и новорожденного, развивающихся вследствие заражения в дородовом периоде или в родах. Внутриутробные инфекции могут приводить к гибели плода, самопроизвольному аборту, задержке внутриутробного развития, преждевременным родам, формированию врожденных пороков, поражению внутренних органов и ЦНС. Методы диагностики внутриутробных инфекций включают микроскопические, культуральные, иммуноферментные, молекулярно-биологические исследования. Лечение внутриутробных инфекций проводится с использованием иммуноглобулинов, иммуномодуляторов, противовирусных, антибактериальных препаратов.

Общие сведения
Внутриутробные инфекции – патологические процессы и заболевания, обусловленные антенатальным и интранатальным инфицированием плода. Истинная распространенность внутриутробных инфекций не установлена, однако, согласно обобщенным данным, с врожденными инфекциями рождается не менее 10% новорожденных. Актуальность проблемы внутриутробных инфекций в педиатрии обусловлена высокими репродуктивными потерями, ранней неонатальной заболеваемостью, приводящей к инвалидизации и постнатальной гибели детей. Вопросы профилактики внутриутробных инфекций лежат в плоскости рассмотрения акушерства и гинекологии, неонатологии, педиатрии.

Причины внутриутробных инфекций
Внутриутробные инфекции развиваются в результате инфицирования плода в дородовом периоде или непосредственно во время родов. Обычно источником внутриутробной инфекции для ребенка выступает мать, т. е. имеет место вертикальный механизм передачи, который в антенатальном периоде реализуется трансплацентарным или восходящим (через инфицированные околоплодные воды) путями, а в интранатальном - аспирационным или контактным путями.
Реже происходит ятрогенное инфицирование плода в период беременности при проведении женщине инвазивной пренатальной диагностики (амниоцентеза, кордоцентеза, биопсии ворсин хориона), введении плоду препаратов крови через сосуды пуповины (плазмы, эритроцитарной массы, иммуноглобулинов) и т. д.
В антенатальном периоде инфицирование плода обычно связано с вирусными агентами (вирусами краснухи, герпеса, цитомегалии, гепатита В и С, Коксаки, ВИЧ) и внутриклеточными возбудителями (токсоплазмоза, микоплазмоза).
В интранатальном периоде чаще происходит микробная контаминация, характер и степень которой зависит от микробного пейзажа родовых путей матери. Среди бактериальных агентов наиболее распространены энтеробактерии, стрептококки группы В, гонококки, синегнойная палочки, протей, клебсиелла и др. Плацентарный барьер непроницаем для большинства бактерий и простейших, однако при повреждении плаценты и развитии фетоплацентарной недостаточности, может произойти антенатальное микробное инфицирование (например, возбудителем сифилиса). Кроме этого, не исключается и интранатальное вирусное заражение.
Факторами возникновения внутриутробных инфекций служат отягощенный акушерско-гинекологический анамнез матери (неспецифические кольпиты, эндоцервициты, ЗППП, сальпингофориты), неблагополучное течение беременности (угроза прерывания, гестозы, преждевременная отслойка плаценты) и инфекционная заболеваемость беременной. Риск развития манифестной формы внутриутробной инфекции существенно выше у недоношенных детей и в том случае, когда женщина инфицируется первично во время беременности.
Известно, что тяжесть проявлений инфекционного процесса у беременной и у плода может не совпадать. Бессимптомное или малосимптомное течение инфекции и у матери может вызвать тяжелые поражения плода, вплоть до его гибели. Это связано с повышенным тропизмом вирусных и микробных возбудителей к эмбриональным тканям, преимущественно ЦНС, сердца, органа зрения.
Классификация
Этиологическая структура внутриутробных инфекций предполагает их деление на:
- вирусные (вирусный гепатит, герпес, краснуха, ОРВИ, цитомегалия, эпидемический паротит, энтеровирусная инфекция)
- бактериальные (туберкулез, сифилис, листериоз, сепсис)
- паразитарные и грибковые (микоплазмоз, токсоплазмоз, хламидиоз, кандидоз и др.)
Для обозначения группы наиболее распространенных внутриутробных инфекций используется аббревиатура TORCH-синдром, объединяющий токсоплазмоз (toxoplasmosis), краснуху (rubella), цитомегалию (cytomegalovirus), герпес (herpes simplex). Буквой О (other) обозначаются другие инфекции, в числе которых - вирусные гепатиты, ВИЧ-инфекция, ветряная оспа, листериоз, микоплазмоз, сифилис, хламидиоз и др.).
Симптомы внутриутробных инфекций
Наличие внутриутробной инфекции у новорожденного может быть заподозрено уже во время родов. В пользу внутриутробного инфицирования может свидетельствовать излитие мутных околоплодных вод, загрязненных меконием и имеющих неприятный запах, состояние плаценты (полнокровие, микротробозы, микронекрозы). Дети с внутриутробной инфекцией часто рождаются в состоянии асфиксии, с пренатальной гипотрофией, увеличенной печенью, пороками развития или стигмами дисэмбриогенеза, микроцефалией, гидроцефалией. С первых дней жизни у них отмечается желтуха, элементы пиодермии, розеолезных или везикулезных высыпаний на коже, лихорадка, судорожный синдром, респиратрные и кардиоваскулярные расстройства.
Ранний неонатальный период при внутриутробных инфекциях нередко отягощается интерстициальной пневмонией, омфалитом, миокардитом или кардитом, анемией, кератоконъюнктивитом, хориоретинитом, геморрагическим синдромом и др. При инструментальном обследовании у новорожденных могут обнаруживаться врожденная катаракта, глаукома, врожденные пороки сердца, кисты и кальцификаты мозга.
В перинатальном периоде у ребенка отмечаются частые и обильные срыгивания, мышечная гипотония, синдром угнетения ЦНС, серый цвет кожных покровов. В поздние сроки при длительном инкубационном периоде внутриутробной инфекции возможно развитие поздних менингитов, энцефалитов, остеомиелита.
Рассмотрим проявления основных внутриутробных инфекций, составляющих TORCH-синдром.
Врождённый токсоплазмоз
Внутриутробное инфицирование одноклеточным протозойным паразитом Toxoplasma Gondii приводит к тяжелым поражениям плода – задержке развития, врожденным порокам развития мозга, глаз, сердца, скелета.
После рождения в остром периоде внутриутробная инфекция проявляется лихорадкой, желтухой, отечным синдромом, экзантемой, геморрагиями, диареей, судорогами, гепатоспленомегалией, миокардитом, нефритом, пневмонией. При подостром течении доминирую признаки менингита или энцефалита. При хронической персистенции развивается гидроцефалия с микроцефалией, иридоциклит, косоглазие, атрофия зрительных нервов. Иногда встречаются моносимптомные и латентные формы внутриутробной инфекции.
К числу поздних осложнений врожденного токсоплазмоза относятся олигофрения, эпилепсия, слепота.
Врождённая краснуха
Внутриутробная инфекция возникает из-за заболевания краснухой при беременности. Вероятность и последствия инфицирования плода зависят от гестационного срока: в первые 8 недель риск достигает 80%; последствиями внутриутробной инфекции могут служить самопроизвольное прерывание беременности, эмбрио- и фетопатии. Во II триместре риск внутриутробного инфицирования составляет 10-20%, в III – 3-8%.
Дети с внутриутробной инфекцией обычно рождаются недоношенными или с низкой массой тела. Для периода новорожденности характерна геморрагическая сыпь, длительная желтуха.
Классические проявления врожденной краснухи представлены триадой Грега: поражением глаз (микрофтальмией, катарактой, глаукомой, хориоретинитом), ВПС (открытым артериальным протоком, ДМПП, ДМЖП, стенозом легочной артерии), поражением слухового нерва (сенсоневральной глухотой). В случае развития внутриутробной инфекции во второй половине беременности у ребенка обычно имеется ретинопатия и глухота.
Кроме основных проявлений врожденной краснухи, у ребенка могут выявляться и другие аномалии: микроцефалия, гидроцефалия, расщелины нёба, гепатит, гепатоспленомегалия, пороки развития мочеполовой системы и скелета. В дальнейшем внутриутробная инфекция напоминает о себе отставанием ребенка в физическом развитии, ЗПР или умственной отсталостью.
Врождённая цитомегалия
Внутриутробное заражение цитомегаловирусной инфекцией может приводить к локальному или генерализованному поражению многих органов, иммунодефициту, гнойно-септическим осложнениям. Врожденные дефекты развития обычно включают микроцефалию, микрогирию, микрофтальмию, ретинопатию, катаракту, ВПС и др. Неонатальный период врожденной цитомегалии осложняется желтухой, геморрагическим синдромом, двусторонней пневмонией, интерстициальным нефритом, анемией.
К отдаленным последствиям внутриутробной инфекции относятся слепота, нейросенсорная глухота, энцефалопатия, цирроз печени, пневмосклероз.
Врождённая герпетическая инфекция
Внутриутробная герпес-инфекция может протекать в генерализованной (50%), неврологической (20%), слизисто-кожной форме (20%).
Генерализованная внутриутробная врожденная герпетическая инфекция протекает с выраженным токсикозом, респираторным дистресс-синдромом, гепатомегалией, желтухой, пневмонией, тромбоцитопенией, геморрагическим синдромом. Неврологическая форма врожденного герпеса клинически проявляется энцефалитом и менингоэнцефалитом. Внутриутробная герпес-инфекция с развитием кожного синдрома сопровождается появлением везикулярной сыпи на кожных покровах и слизистых оболочках, в т. ч. внутренних органов. При наслоении бактериальной инфекции развивается сепсис новорожденных.
Внутриутробная герпес-инфекция у ребенка может приводить к формированию пороков развития - микроцефалии, ретинопатии, гипоплазии конечностей (кортикальной карликовости). В числе поздних осложнений врожденного герпеса - энцефалопатия, глухота, слепота, задержка психомоторного развития.
Диагностика
В настоящее время актуальной задачей является пренатальная диагностика внутриутробных инфекций. С этой целью на ранних сроках беременности проводится микроскопия мазка, бактериологический посев из влагалища на флору, ПЦР-исследование соскоба, обследование на TORCH-комплекс. Беременным из группы высокого риска по развитию внутриутробной инфекции показана инвазивная пренатальная диагностика (аспирация ворсин хориона, амниоцентез с исследованием амниотической жидкости, кордоцентез с исследованием пуповинной крови).
Возможно выявление эхографических маркеров внутриутробных инфекций с помощью акушерского УЗИ. К косвенным эхографическим признакам внутриутробного инфицирования относятся маловодие или многоводие; наличие гиперэхогенной взвеси в околоплодных водах или амниотических тяжей; гипоплазия ворсин хориона, плацентит; преждевременное старение плаценты; отечный синдром плода (асцит, перикардит, плеврит), гепатоспленомегалия, кальцификаты и пороки развития внутренних органов и др. В процессе допплерографического исследования кровотока выявляются нарушения плодово-плацентарного кровотока. Кардиотокография обнаруживает признаки гипоксии плода.
После рождения ребенка с целью достоверной верификации этиологии внутриутробной инфекции используются микробиологические (вирусологические, бактериологические), молекулярно-биологические (ДНК-гибридизация, ПЦР), серологические (ИФА) методики обследования. Важное диагностическое значение имеет гистологическое исследование плаценты.
По показаниям новорожденные с внутриутробными инфекциями в первые сутки жизни должны быть осмотрены детским неврологом, детским кардиологом, детским офтальмологом и др. специалистами. Целесообразно провести ЭхоКГ, нейросонографию, офтальмоскопию, исследование слуха методом вызванной отоакустической эмиссии.
Лечение внутриутробных инфекций
Общие принципы лечения внутриутробных инфекций предполагают проведение иммунотерапии, противовирусной, антибактериальной и посиндромной терапии.
Иммунотерапия включает применение поливалентных и специфических иммуноглобулинов, иммуномодуляторов (интерферонов). Противовирусная терапия направленного действия осуществляется, главным образом, ацикловиром. Для противомикробной терапии бактериальных внутриутробных инфекций используются антибиотики широкого спектра действия (цефалоспорины, аминогликозиды, карбапенемы), при микоплазменной и хламидийной инфекциях – макролиды.
Посиндромная терапия внутриутробных инфекций направлена на купирование отдельных проявлений перинатального поражения ЦНС, геморрагического синдрома, гепатита, миокардита, пневмонии и т. д.
Прогноз и профилактика
При генерализованных формах внутриутробных инфекций летальность в неонатальном периоде достигает 80%. При локальных формах возникают серьезные поражения внутренних органов (кардиомиопатии, ХОБЛ, интерстициальный нефрит, хронический гепатит, цирроз и т. д.). Практически во всех случаях внутриутробные инфекции приводят к поражению ЦНС.
Профилактика внутриутробных инфекций заключается в проведении предгравидарной подготовки, лечении ЗППП до наступления беременности, исключении контактов беременной с инфекционными больными, коррекции программы ведения беременности у женщин групп риска. Женщины, ранее не болевшие краснухой и не получавшие прививки против краснухи, должны быть вакцинированы не позднее, чем за 3 месяца до предполагаемой беременности. В ряде случаев внутриутробные инфекции могут являться основанием для искусственного прерывания беременности.
Читайте также:

