Транзиторная инфекция впч это
Обновлено: 22.04.2024
- КЛЮЧЕВЫЕ СЛОВА: шейка матки, вирус папилломы человека, скрининг, предраковое поражение, дииндолилметан, Эпигаллат, Индинол Форто, Цервикон-ДИМ
Инфицирование вирусом папилломы человека (ВПЧ) высокого онкогенного риска запускает механизм трансформации клеток слизистой оболочки и приводит к развитию рака шейки матки (РШМ). Ежегодно в мире диагностируется около 570 000 новых случаев этого злокачественного новообразования. Рост заболеваемости за последние десять лет составил 7,8%, смертности – 13,1%. Примерно в 60% случаев РШМ выявляется у женщин старше 45 лет и в 20% – у женщин старше 65 лет.
Последние годы наблюдается тенденция к росту частоты выявления РШМ в молодой популяции (шесть-семь новых случаев) и пожилой популяции – 17 случаев на 100 тыс. женщин 1 . Пик заболеваемости цервикальным раком приходится на возраст 40–49 лет. Не случайно основной целью глобальной стратегии Всемирной организации здравоохранения (ВОЗ) на период 2020–2030 гг. по ликвидации РШМ стало снижение уровня смертности от данного заболевания. В перспективе порог заболеваемости должен составлять четыре случая рака шейки матки на 100 тыс. женщин в год. Перед мировым здравоохранением поставлены задачи, которые необходимо выполнить к 2030 г. 2 :
- 90% девочек должны быть вакцинированы против ВПЧ к 15 годам;
- 70% женщин должны проходить скрининг с помощью высокопроизводительного теста к 35 годам, а затем к 45 годам;
- 90% женщин с заболеваниями шейки матки (предраком и инвазивным раком) должны получать соответствующее лечение.
Эксперты ВОЗ рекомендуют комплексный подход к профилактике РШМ и борьбе с ним. При этом алгоритм действий предусматривает наблюдение за здоровьем женщины на протяжении всей жизни. Так, в целях первичной профилактики РШМ предусмотрено не только проведение вакцинации против ВПЧ, но и информирование детей 9–14 лет о пользе здорового образа жизни, половое воспитание с учетом возраста и культуры, пропаганда использования презервативов. В свою очередь вторичная профилактика – скрининг РШМ у женщин старше 30 лет позволяет выявлять предраковые поражения на стадии, на которой они легко поддаются лечению.
Течение ВПЧ-инфекции зависит от состояния иммунной системы и может быть транзиторным, латентным и персистирующим. Около 90% случаев инфицирования ВПЧ остаются незамеченными в течение двух лет, и лишь у 10% женщин отмечается персистенция инфекции. Для персистирующей ВПЧ-инфекции характерно выявление типоспецифической ДНК ВПЧ при повторном взятии образца через 6–12 месяцев. Риск развития предракового поражения шейки матки повышен именно у женщин с персистирующим ВПЧ.
У женщин в возрасте 30–35 лет опасность персистенции ВПЧ увеличивается в десять раз по сравнению с женщинами более молодого возраста. Наиболее высокий риск персистенции ВПЧ и цервикальной интраэпителиальной неоплазии (cervical intraepithelial neoplasia – CIN) наблюдается у женщин в возрасте старше 50 лет, имеющих сексуальные отношения с молодыми мужчинами 3 .
Транзиторная (эписомальная) форма ВПЧ нередко встречается у молодых женщин. Различают транзиторную форму со стойким отрицательным ответом – вирус исчезает через 12 месяцев и нестойким отрицательным ответом – через 12 месяцев вирус сохраняется в отсутствие поражения шейки матки.
Латентная форма носительства ВПЧ характеризуется персистенцией в течение двух и более лет без изменений шейки матки. Эта форма опасна непрогнозируемым риском трансформации в дисплазию шейки матки. Интегративная форма существования ВПЧ – интеграция клеточной ДНК, сопровождающаяся тяжелым поражением шейки матки.
Транзиторная форма с нестойким отрицательным ответом относится к малым формам поражения шейки. При ВПЧ-инфекции они отличаются длительной персистенцией при нормальных цитологических результатах. Малые формы поражения шейки матки могут реализоваться в появлении атипичных клеток – дисплазии низкой LSIL (low grade SIL) и высокой HSIL степени (hight grade SIL) к концу второго года наблюдения.
У многих молодых женщин возможна самоэлиминация ВПЧ в течение двух лет. Тем не менее в 10% случаев за тот же период может наблюдаться прогрессирование до диспластических изменений цервикального эпителия второй степени (CIN II) и более. Обнаружение ВПЧ в отсутствие клинических или субклинических проявлений инфекции ассоциируется с 250-кратным увеличением риска развития РШМ 4 . В связи с этим необходимо своевременно выявлять носительство онкогенных типов ВПЧ и начинать лечение до развития предраковых поражений шейки матки.
К факторам риска персистенции ВПЧ относят:
- тип и онкогенность вируса;
- раннее начало половой жизни;
- наличие более пяти партнеров;
- паритет (количество рожденных детей) и юный возраст при рождении первого ребенка;
- наличие других инфекций, передаваемых половым путем, бактериальный вагиноз, хронические воспалительные заболевания;
- игнорирование барьерной контрацепции;
- курение;
- альтернативные виды секса;
- частые внутриматочные вмешательства;
- вторичный иммунодефицит.
Может ли CIN, ассоциированная с ВПЧ, регрессировать самостоятельно? Установлено, что дисплазия слабо выраженной степени (CIN I) регрессирует в 57% случаев, в 32% – персистирует, но инвазивный рак развивается в 1% случаев. При CIN II регрессия наблюдается в 43% случаев, персистенция – в 35%. В 22% случаев патологический процесс прогрессирует, причем инвазивный рак формируется у 5% женщин. Даже у женщин с CIN III, которая считается абсолютным предраковым состоянием, в 32% случаев возможна регрессия. HSIL – CIN II и CIN III развивается, как правило, в течение трех лет с момента инфицирования у 27% женщин 5 .
Таким образом, можно выделить два ключевых момента, связанных с ВПЧ и воспалением, – исходное наличие воспалительного процесса в шейке матки и активацию воспалительного процесса на фоне дисплазии. Данные процессы взаимосвязаны: ВПЧ способствует воспалению, воспаление – прогрессированию ВПЧ. Возникает состояние, которое называется ВПЧ-ассоциированным цервицитом. ВПЧ-ассоциированный цервицит характеризуют упорное течение с низкой эффективностью стандартных методов лечения, высокая частота дисбиотических состояний влагалища. В 30% случаев заболевание сопровождается формированием острых кондилом. При ВПЧ-ассоциированном цервиците обнаруживается сочетанная ВПЧ-инфекция из двух-трех вирусов с доминированием ВПЧ 16-го типа, а также нетяжелые атипические изменения эпителия у 19% и умеренные у 4,5% женщин 7 .
В настоящее время хорошо известно, что в развитии неопластических процессов в тканях шейки матки участвуют метаболиты эстрогенов. ВПЧ негативно влияет на обмен эстрадиола в клетках эпителия шейки матки. В норме концентрация метаболита эстрогена 2-гидрокисэстрона (2-ОНЕ1) превышает концентрацию 16-гидроксиэстрона (16-ОНЕ1). При персистенции ВПЧ в цервикальном эпителии образуется аномально высокое количество 16-альфа-ОНЕ1, что усиливает клеточную пролиферацию. Накопление же 4-гидроксиэстрона (4-ОНЕ1) на фоне ВПЧ вызывает перерождение клеток-мишеней, приводя к развитию злокачественных новообразований 8 .
Сегодня активно изучается новая концепция развития РШМ – поражение стволовых клеток в области зоны трансформации, которое приводит к быстрому прогрессированию злокачественного процесса. ВПЧ поражает полипотентные стволовые клетки под цилиндрическим эпителием эктопии, в формирующейся зоне трансформации с ее верхней границей – переходной зоной, а также в расположенном выше канале и эндоцервикальных криптах. Поэтому при поражении ВПЧ стволовых клеток быстро формируется CIN II и III, и в течение одного года или двух лет развивается РШМ.
Для диагностики патологии шейки матки используют:
- цитологическое исследование;
- ВПЧ-тестирование;
- молекулярные маркеры;
- кольпоскопическое исследование.
Биопсия и выскабливание цервикального канала обязательны при наличии цитологических и кольпоскопических признаков атипичного эпителия.
В России рекомендовано проведение скрининга для выявления патологии шейки матки. Цитологическое исследование женщинам в возрасте 21–29 лет выполняется один раз в три года, цитологический скрининг и ВПЧ-тестирование в возрасте 30–65 лет – один раз в пять лет или только цитология – ежегодно после 40 лет.
Согласно рекомендациям Американского общества кольпоскопии и патологии шейки матки и 24 международных сообществ, женщинам с выявленным ВПЧ проводят цитологический скрининг с 21 года. Существует два подхода к наблюдению за пациентками с CIN: консервативное с цитологическим исследованием, обследованием на ВПЧ, выполнением кольпоскопии и биопсии шейки матки и проведение эксцизионных процедур или аблации переходной зоны. Как правило, консервативное наблюдение рекомендуется женщинам до 24 лет, даже при наличии CIN II 10 .
По мнению российских экспертов, у молодых женщин и/или планирующих беременность пациенток с морфологически подтвержденным диагнозом LSIL (признаки ВПЧ-инфекции, койлоцитоз, CIN I) также предпочтительна выжидательная тактика с динамическим наблюдением за состоянием шейки матки в течение 18–24 месяцев в виде цитологического контроля один раз в шесть месяцев и ВПЧ-тестирования один раз в 12 месяцев. Хирургическое лечение проводится в отсутствие регрессии через 18–24 месяца.
У женщин до 25 лет с диагнозом CIN II в биоптате при р16-негативном результате иммуногистохимического исследования допустимо динамическое наблюдение с использованием цитологического контроля, ВПЧ-тестирования и кольпоскопии один раз в шесть месяцев в течение двух лет.
Женщинам старше 40 лет с CIN I в биоптате эктоцервикса целесообразно проводить петлевую эксцизию зоны трансформации 11 .
Таким образом, консервативное лечение показано:
- женщинам с малыми формами поражений ВПЧ – латентной персистирующей инфекцией, которая не исчезает через 12 месяцев персистенции;
- молодым женщинам с выявленными клетками плоского эпителия с атипией неясного значения (ASCUS), CIN I, CIN II шейки матки при p16-негативном или слабоположительном результате;
- пациенткам с хроническим цервицитом бактериальным или ВПЧ-ассоциированным;
- после хирургического лечения CIN II и CIN III для профилактики рецидива.
На сегодняшний день наиболее эффективными в терапии ВПЧ-ассоциированных поражений шейки матки признаны лекарственные средства, регулирующие работу эпигенетических механизмов. К таким препаратам относят дииндолилметан (Цервикон-ДИМ), эпигаллокатехин-3-галлат (Эпигаллат), индолкарбинол (Индинол Форто). Целесообразно также добавление к диете биологически активной добавки (БАД) Промисан, содержащей индол-3-карбинол и эпигаллокатехин-3-галлат.
Указанные препараты обладают уникальными свойствами. Они воздействуют на основные звенья патогенеза диспластических процессов шейки. На фоне эпигенетической терапии препаратами на основе индол-3-карбинола, дииндолилметана, а также БАД, содержащей эпигаллокатехин-3-галлат, при цервиците, ассоциированном с ВПЧ, происходят избирательный апоптоз и элиминация вирус-инфицированных клеток, тормозится образование агрессивных метаболитов эстрадиола, вследствие чего блокируется переход вирус-инфицированных клеток в злокачественные. Кроме того, блокируется синтез вирусного онкобелка Е7, восстанавливается активность эндогенного интерферона и повышается чувствительность к экзогенному интерферону. Восстанавливаются функциональные возможности иммунной системы шейки матки и влагалища. Эпигенетическая терапия также способствует деметилированию генов пролиферации и противоопухолевой защиты, блокаде стволовых опухолевых клеток.
В многочисленных исследованиях доказана прямая противомикробная и противовирусная активность эпигаллокатехин-3-галлата (активного компонента БАД Эпигаллат) в отношении широкого спектра возбудителей, таких как Staphylococcus aureus, Chlamydia trachomatis, Mycoplasma, Escherichia coli, герпесвирусы, аденовирусы, энтеровирусы, вирусы гепатита и гриппа. Кроме того, в последних публикациях сказано, что эпигаллокатехин-3-галлат способствует подавлению пролиферации клеток рака шейки матки, блокированию ангиогенеза 12 .
При ВПЧ-ассоциированном цервиците и CIN рекомендовано использование эпигаллокатехин-3-галлата в качестве БАД в комбинации с препаратом дииндолилметана для интравагинального введения Цервикон-ДИМ.
Лекарственный препарат Цервикон-ДИМ на основе метаболита действующего вещества индол-3-карбинола – дииндолилметана разработан для безопасной и эффективной терапии диспластических заболеваний шейки матки. Цервикон-ДИМ стимулирует апоптоз и ускоряет элиминацию инфицированных ВПЧ и трансформированных клеток, нормализует метаболизм эстрадиола в ВПЧ-инфицированных клетках, усиливает неспецифический иммунный ответ на инфекцию. Цервикон-ДИМ непосредственно воздействует на патогенез CIN и препятствует опухолевой трансформации. Дииндолилметан относится к практически нетоксичным препаратам. При интравагинальном применении Цервикон-ДИМ демонстрирует высокую местную биодоступность, при этом он практически не попадает в системный кровоток. Показанием для применения препарата Цервикон-ДИМ является лечение дисплазии (CIN) шейки матки независимо от результатов выявления папилломавирусной инфекции методом полимеразной цепной реакции. Использование препарата Цервикон-ДИМ оправданно и в случае субклинического течения ВПЧ-инфекции для профилактики развития CIN шейки матки.
Цервикон-ДИМ применяют интравагинально по 100 мг два раза в сутки, длительность курса – 3–6 месяцев. Продолжительность курса лечения определяется динамикой клинико-лабораторных показателей.
Эффективность препарата Цервикон-ДИМ подтверждена в клинических исследованиях. Так, в многоцентровом рандомизированном плацебоконтролируемом двойном слепом исследовании на фоне применения дииндолилметана в виде интравагинальных суппозиториев в дозе 200 мг (100 мг два раза в сутки) у пациенток с CIN I–II в течение 180 дней наблюдалась полная регрессия CIN 13 .
Назначая эпигенетическую терапию женщинам с ВПЧ-инфекцией, врач должен учитывать такой важный момент, как наличие дисбиоза влагалища или бактериального вагиноза. Установлена тесная взаимосвязь между инфекцией ВПЧ и обогащением бактериями. В частности, бактерии рода Sneathia ассоциируются с новообразованиями шейки матки, бактерии рода Prevotella – со стойкой инфекцией ВПЧ 14 .
Дисбиоз и бактериальный вагиноз приводят к увеличению восприимчивости к инфекции ВПЧ шейки матки, вирусной адгезии, инвазии ВПЧ в геном клетки, прогрессированию CIN. Не случайно лечение бактериального вагиноза связывают с лучшим исходом поражений шейки матки 15 .
При бактериальном вагинозе, трихомонадном и кандидозном вагините, смешанных вагинальных инфекциях применяют препарат Нео-Пенотран Форте. Суппозитории препарата Нео-Пенотран Форте содержат метронидазол, характеризующийся антибактериальным и противотрихомонадным эффектами, и миконазол, оказывающий противогрибковое действие.
В исследовании микробиологические показатели излечения на фоне терапии препаратом Нео-Пенотран Форте были получены в 100% случаев для трихомониаза, в 96,2% – для бактериального вагиноза и 90% – для кандидоза. При смешанных инфекциях общий микробиологический показатель излечения достиг 92%.
Применение препарата Нео-Пенотран Форте, содержащего метронидазол и миконазол, считается клинически доказанным медицинским подходом к лечению вагинальных инфекций с точки зрения эффективности и скорости достижения результата.
Итак, терапевтическое действие препарата Цервикон-ДИМ при дисплазии шейки матки можно усилить предварительным лечением бактериального вагиноза, совместным применением БАД Эпигаллат и иммуномодуляторов.
В частности, лечение ВПЧ-ассоциированного цервицита с CIN I на первом этапе предполагает проведение антибактериальной терапии (амоксициллин/клавуланат и джозамицин) и назначение БАД Эпигаллат 270 мг три раза в день. При наличии бактериального вагиноза или кольпита показана терапия препаратами Нео-Пенотран или Гайномакс в сочетании с пробиотиками. На втором этапе лечения к БАД Эпигаллат добавляют интравагинальный препарат Цервикон-ДИМ по одной свече два раза в сутки в течение трех месяцев. При CIN II у молодых женщин терапию препаратом Цервикон-ДИМ целесообразно сочетать с Эпигаллатом и Полиоксидонием. Как известно, Полиоксидоний воздействует на все звенья иммунитета, в том числе эффективен при наличии ВПЧ-инфекции.
Таким образом, тактика ведения пациенток с поражением шейки матки, ассоциированным с ВПЧ, должна быть комплексной с применением средств эпигенетического действия.
Проникая в эпителиальные клетки ВПЧ не вызывают никакой болезни у 95-99 человек из 100 зараженных. Проблемы из-за этих вирусов возникают только у 1-5% инфицированных:
- у 1% зараженных доброкачественными типами ВПЧ возникают бородавки (они же кондиломы, они же папилломы половых органов);
- у 1-5% зараженных злокачественными типами ВПЧ развиваются предраковые и раковые изменения клеток шейки матки.
КАКИЕ ОБЛАСТИ ПОРАЖАЮТСЯ ВПЧ
Верхний слой тканей вульвы, влагалища, шейки матки, полового члена, ротовой полости и гортани, кожи ладоней и ступней покрыт эпителиальными клетками. Все эти области могут подвергаться атаками ВПЧ. Поскольку момент проникновения ВПЧ в эпителиальные клетки ничем себя не выдает, ни вы сами, ни методы современной медицины не могут сказать, когда произошло заражение- 3 дня, 3 месяца или 3 года тому назад.
КАК РАСПРОСТРАНЯЕТСЯ ВПЧ
Все злокачественные типы ВПЧ передаются половым путем. Поэтому рак шейки матки относится к венерическим заболеваниям. Доброкачественные типы, заселяющие половые органы, тоже передаются половым путем. Поскольку некоторые доброкачественные типы живут и в ротовой полости и на половых органах, то они могут передаваться при орогенитальном контакте. Доброкачественные типы ВПЧ могут передаваться от матери к ребенку в процессе родов. Один из 1000 зараженных детишек может потом иметь кондиломы гортани. Доброкачественные типы ВПЧ, вызывающие бородавки рук, ступней передаются только контактным путем. Вероятность заразиться от одного рукопожатия с человеком, на ладони которого есть бородавка, близка к нулю.
ПОСЛЕ ЗАРАЖЕНИЯ злокачественным типом ВПЧ события могут развиваться по-разному:
2.Длительная ВПЧ - инфекция, более 12-18 месяцев встречается у 2-10% женщин, в основном старше 30 лет. По каким-то причинам иммунная система не выгоняет ВПЧ из организма, и он надолго задерживается в клетках шейки матки. С течением времени ВПЧ изменяет клетку сначала в предраковую,а затем в раковую. Процесс это действительно длительный и в среднем от предраковых изменений в шейке матки до рака шейки матки проходит 10 лет. И все это время злокачественный тип ВПЧ должен сидеть в клетке.
НИКАКИЕ ТЕСТЫ, К СОЖАЛЕНИЮ, ПОКА НЕ МОГУТ ОПРЕДЕЛИТЬ, У КОГО, ИЗ ИМЕЮЩИХ СЕЙЧАС, ЗЛОКАЧЕСТВЕННЫЕ ТИПЫ ВПЧ В ШЕЙКЕ МАТКИ БУДЕТ ДЛИТЕЛЬНАЯ ИНФЕКЦИЯ С РАЗВИТИЕМ ПРЕДРАКА И РАКА, А У КОГО ТОЛЬКО ТРАНЗИТОРНАЯ И БЕЗ ПОСЛЕДСТВИЙ.
Основными факторами риска для длительной ВПЧ инфекции являются:
- непостоянство в сексуальных отношениях;
Длительная инфекция доброкачественными типами ВПЧ может приводить к появлению кондилом на половых органах (у 1 человека на 100 зараженных).
ИССЛЕДОВАНИЕ СТРОЕНИЯ КЛЕТОК ШЕЙКИ МАТКИ ОСУЩЕСТВЛЯЕТСЯ ПРИ ПОМОЩИ ЦИТОЛОГИЧЕСКОГО ОБСЛЕДОВАНИЯ ШЕЙКИ МАТКИ. Именно это нужно делать регулярно, 2 раза в год всем женщинам до и после 30 лет. Первый раз примерно через год после начала половой жизни.
МОЖНО ЛИ ОБНАРУЖИТЬ ВПЧ ДО НАЧАЛА ПОЯВЛЕНИЯ ИЗМЕНЕННЫХ КЛЕТОК?
Да, существует метод ПЦР (полимеразная цепная реакция), основанный на определении ДНК вируса. Для этого специальным зондом берут микроскопический соскоб клеток шейки матки. Процедура быстрая и абсолютно безболезненная.
ЧТО ПОМОГАЕТ ЗАЩИТИТЬ ОТ ВПЧ- ИНФЕКЦИИ?
ГАРДАСИЛ, как защитная вакцина от рака шейки матки, произвел настоящий фурор в современной медицине. Эта вакцина почти на 100% избавляет женщину от разновидностей ВПЧ и генитальных кондилом, а также предотвращает раковые заболевания половых органов. Это рекомбинантная квадривалентная вакцина, которая защищает от ВПЧ 6,11,16.18 типов. Гардасил -вакцина, показанная для применения у девочек и женщин в возрасте от 9 до 26 лет для профилактики рака шейки матки, влагалища, вульвы; предраковых или диспластичесиких поражений; генитальных бородавок и инфекций, вызванных вирусом ВПЧ 6,11,16,18 типов. Гардасил обеспечивает защиту еще от 6 родственных типов ВПЧ, которые обусловливают около 12% случаев рака шейки матки. Вакцинацию лучше проводить девочкам в период полового созревания, еще до начала ведения половой жизни, то есть еще до контакта с ВПЧ.
Гардасил показан к применению у мальчиков в возрасте от 9 до 17 лет для профилактики поражения наружных гениталий и инфекций, вызванных ВПЧ 6,11,16,18 типов.
Вакцина не предназначена для применения при лечении активных патологических процессов в области наружных гениталий; рака шейки матки, вульвы или влагалища. Эта вакцина не защищает от заболеваний, которые не вызваны ВПЧ.
Гардасил вводят внутримышечно в виде 3 отдельных доз по 0,5 мл, в соответствии со следующей схемой:
Первое введение: в произвольно выбранный день
Вторая доза: через 2 месяца после 1-й дозы
Третья доза: через 6 месяцев после первой дозы.
ЦЕРВАРИКС - вакцина рекомбинантная адсорбированная против ВПЧ 16,18 типов. Эффективность ЦЕРВАРИКСОМ в отношении ВПЧ 16, 18 и связанных с инфицированием последствий подтверждена клиническими исследованиями. Вакцина обеспечивает перекрестную защиту у 40,6% вакцинированных в отношении любых проявлений ВПЧ-инфекции, выявленных цитологически, вызванных другими онкогенными типами ВПЧ. Схема первичной иммунизации включает введение 3-х доз вакцины. Оптимальной схемой является 0-1-6 месяцев.
Поговорите с Вашим врачом! Узнайте, как уберечь Вашу дочь от рака шейки матки и других заболеваний, вызванных ВПЧ! Не отдавайте свое будущее на волю случая!
Начните делать все, что в ваших силах, прямо сейчас!
Врач акушер - гинеколог, заведующая отделением Е.А.Шабуневич
Контакты
Где мы находимся?
220077, г. Минск, ул. Ташкентская, 5
Телефон платных услуг: 8 (017) 345-21-05; касса 8 (017) 345-35-93
Телефон доверия : 8 (017) 340-94-73
Телефон приемной: 8 (017) 340-91-46
Факс: 8 (017) 340-91-46
Е-mail: Этот адрес электронной почты защищен от спам-ботов. У вас должен быть включен JavaScript для просмотра.
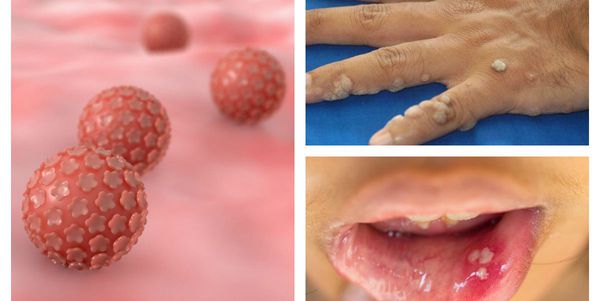
Папиллома (papilla – сосок (лат.) + oma – опухоль (греч)) – сосочковые разрастания на коже и слизистых оболочках.
Особого внимания заслуживают папилломы, вызванные вирусами с высоким онкогенным риском (ВПЧ 16,18, 45, 56 типов). Пациенты (женщины и мужчины), у которых выявлен хотя бы один из таких типов ВПЧ, нуждаются не только в лечении, но и в последующем динамическом наблюдении у врача.
Возбудитель – вирус папилломы человека. Существует около 100 типов вируса. Некоторые из них чаще вызывают поражение урогенитального тракта, другие поражают кожу.
Источник папилломавирусной инфекции – больной или вирусоноситель. Папиллома может находиться не только на коже и слизистых органов мочеполовой системы, вирус может циркулировать в моче, сперме и слюне. При наличии активного вируса в слюне передача его может осуществляться бытовым путем (при поцелуе).
Локализация: негенитальная (носоглотка, полость рта, придаточные пазухи носа, голосовые связки), органы мочевыводящей системы (уретра, мочеточники, мочевой пузырь, почечные лоханки), гениталии (у женщин: слизистые наружных гениталий, преддверие влагалища, промежность, перианальная область и шейка матки, реже – уретру, лобок, влагалище; у мужчин: головка полового члена, внутренний листок крайней плоти, венечная борозда, уздечка, ствол полового члена, мошонка, кожа паховой области, лобок, промежность, перианальная область) Наружное отверстие уретры у мужчин поражается в 20-24% случаев.
Генитальная папилломавирусная инфекция
Генитальная папилломавирусная инфекция – одна из наиболее частых инфекций, передаваемых половым путем. Чрезвычайная опасность и важная социальная значимость данной инфекции обусловлена ее ролью в развитии:
- практически всех случаев рака шейки матки,
- около 50% других раков аногенитальной области,
- нескольких разновидностей злокачественных новообразований верхних дыхательных путей и кожи.
Эпидемиологические исследования свидетельствуют о том, что папилломавирусные поражения шейки матки встречаются у 20-46% женщин, живущих половой жизнью. С такой же частотой удается выявить поражения нижнего отдела полового тракта у сексуально активных мужчин.
Важными эпидемиологическими особенностями инфекции являются наличие субклинических форм болезни и длительных инкубационный период (от нескольких месяцев до нескольких лет), что в значительной мере затрудняет ее диагностику и лечение.
В настоящее время доказано, что вирус папилломы человека является онкогенным и отличаются по степени онкогенности. Различают вирусы низкой (6,11,42,43,44), средней (31,33,35,51,52,58) и высокой степени (16,18, 45, 56) риска развития онкологического заболевания. У одного больного может быть несколько типов ВПЧ одновременно.
Репликация ДНК папилломавируса происходит только в клетках базального (глубокого) слоя кожи и слизистых оболочек, поэтому методы лечения, направленные на удаление поверхностного слоя эпидермиса, неэффективны и сопровождаются рецидивом заболевания. Инфицированные клетки базального слоя служат постоянным источником инфицирования вновь появляющихся эпителиальных клеток.
Причины папиллом
ДНК папилломавируса может быть функционально неактивной и активизироваться под влиянием:
- курения,
- гормональных нарушений,
- сопутствующих ИППП, и, прежде всего, генитального герпеса, возбудителем которого является ВПГ-2.
Инфицирование половых органов происходит при наличии микротравм в области гениталий (механическая травматизация, бактериальные микроповреждения и т.д.), при этом следует учитывать, что резервуаром могут служить уретра, семенная жидкость и секрет предстательной железы.
Инкубационный период при генитальных бородавках обычно варьирует от нескольких месяцев до нескольких лет, в большинстве случаев инфекция протекает субклинически. Прогрессия инфекции высокого онкогенного риска в кожную дисплазию и рак in situ обычно происходит в сроки от 5 до 30 лет и редко в сроки, не превышающие 1 года Папилломавирусная инфекция гениталий часто бывает многоочаговой и ассоциированной более чем с одним типом вируса папилломы человека, а также с другими возбудителями ИППП В большинстве случаев генитальная папилломавирусная инфекция остается нераспознанной. Генитальная инфекция имеет высокую контагиозность и приобретается во время нескольких первых половых контактов; заражение же при однократном половом контакте происходит примерно в 60% случаев. В 65-70% случаев папилломы (бородавки) выявляются у обоих половых партнеров.
Вероятность и частота развития генитальной инфекции во многом зависят от сексуального поведения человека. Риски повышаются при:
- раннем начале половой жизни,
- частой смене половых партнеров,
- гомосексуальной ориентации, как у мужчин (существенно повышена частота анального рака), так и у женщин.
При иммуносупрессии и сахарном диабете папилломы, как правило, бывают множественными и сливаются между собой. При генитальной папилломавирусной инфекции у беременной существует высокий риск инфицирования младенца внутриутробно или в родах. При этом папилломавирусная инфекция (ВПЧ 6, 11 и 16, 18 типов) может персистировать в течение целого ряда лет в клетках слизистой оболочки рта ребенка, и являться причиной ювенильного папилломатоза гортани. Ювенильный папилломатоз гортани может развиваться и при наличии у матери генитальных бородавок в анамнезе, а также при субклиническом течении у нее генитальной ВПЧ-инфекции. Дети могут быть носителями кожно-слизистых типов вируса даже при отсутствии на момент родов в половом тракте матери.
В этой связи следует помнить об учащении обнаружения вируса в половом тракте женщины в период беременности (молочница беременных), когда и происходит инфицирование плода.
Описаны случаи папилломатоза гортани, трахеи, бронхов у детей, рожденных путем кесарева сечения, свидетельствующие о возможности трансплацентарной передачи инфекции. Это указывает на нецелесообразность родоразрешения кесаревым сечением, единственная задача которого – предупреждение заражения новорожденного вирусом. Внеполовая передачи генитальных бородавок возможна также
- при купании детей в общей ванне с инфицированными вирусом взрослыми,
- при использовании инфицированных взрослыми полотенец,
- при половой передачи ВПЧ-инфекции детям.
Таким образом, в отличие от взрослых, заражение аногенитальными бородавками детей может происходить различными путями.
Клиническая манифестация генитальной инфекции сопровождается появлением генитальных бородавок (кондилом). Отсутствие клинических и гистологических признаков при выявлении ДНК вируса папилломы человека свидетельствует о латентной (бессимптомной) инфекции.
Лечение папиллом
от 2 500 руб
Однако важно не просто удалить, но и повысить устойчивость организма к вирусам. Состояние иммунитета напрямую сказывается на тяжести проявлений инфекции. Поэтому для общего лечения используются противовирусные препараты широкого спектра, иммуномодуляторы, различные интерфероны и стимуляторы выработки интерферонов.
В настоящее время нет ни одного противовирусного препарата для целенаправленного уничтожения ВПЧ. Поэтому обычно проводится комплексное лечение. Особое внимание обращается на папилломы, вызванные вирусами с высоким онкогенным потенциалом. Если человек заражен таким типом вируса, ему необходимо не только лечение, но и постоянное наблюдение у врача.
Поэтому при папилломавирусной инфекции рекомендуется проводить иммунологическое обследование. Если в анализах будет выявлено отклонение от нормы, требуется лечение для восстановления показателей иммунитета.
Осложняется ситуация и в том случае, когда у пациента помимо ВПЧ-инфекции находят хламидиоз, генитальный герпес, кандидоз. При сочетанных вирусно-бактериальных и/или вирусно-вирусных заболеваниях повышается вероятность развития осложнений ВПЧ-инфекции. Поэтому в таких случаях решающее значение для выздоровления пациента имеют индивидуально разработанные схемы терапии.
В настоящее время возможно не только лечение, но и профилактика инфекции. Для предупреждения заражения можно сделать вакцинацию. Ее проводят врачи нашего центра.
Вакцина вводится в плечо три раза в течение полугода. Наиболее целесообразным считается вакцинировать девочек, девушек и молодых женщин до 26 лет. Прививку делают либо до первого интимного контакта, либо в самом начале сексуальной жизни.
Особых ограничений для этой прививки нет. Необходимо соблюдать только общие правила, которые учитывают при любой вакцинации. Непосредственно перед прививкой проводится осмотр врача. У пациентки не должно быть серьезных хронических заболеваний и непереносимости компонентов вакцины. Опыт показывает, что прививка от папилломавируса обычно хорошо переносится и редко вызывает побочные эффекты.
Что такое папилломавирусная инфекция (ВПЧ)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Борисова Э. В., гинеколога со стажем в 35 лет.
Над статьей доктора Борисова Э. В. работали литературный редактор Юлия Липовская , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
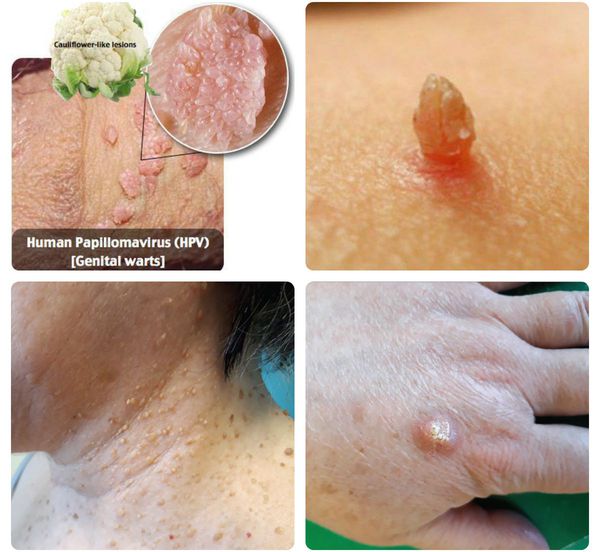
Папилломавирусная инфекция — это состояние, развивающееся при заражении какой-либо разновидностью вируса папилломы человека (ВПЧ). Возбудители данной группы могут существовать только в человеческом организме, поражая кожу и слизистые оболочки, приводя к появлению папиллом, бородавок, плоских и остроконечных кондилом. [1] [2] [4]
ВПЧ довольно широко распространён в человеческой популяции, особенно среди сексуально активных людей, а это свыше 80% всего населения. До недавнего времени вирусы этой группы считались относительно безобидными, вызывающими лишь косметические дефекты, но последние научные исследования показывают, что проблема гораздо серьёзнее. [9]
На сегодняшний день науке известно несколько сотен штаммов (типов) папилломавирусов . Около 40 из них преимущественно поражают аногенитальную область и передаются половым путём. Особую опасность представляют штаммы высокого онкогенного риска, так как они могут спровоцировать развитие онкологических заболеваний, в том числе рака шейки матки.
Чаще всего заражение происходит в молодом возрасте, как правило, с началом половой жизни, при этом возможно неоднократное инфицирование. Наиболее уязвимой группой в плане вероятности заражения ВПЧ и развития неблагоприятных последствий являются молодые женщины в возрасте 15-30 лет.
Помимо этого ВПЧ может перейти от инфицированной матери к ребёнку, например, при родах. Не исключается и контактно-бытовой способ передачи возбудителя, например, при соприкосновениях и даже при совместном использовании предметов личной гигиены.
К факторам риска, способствующим заражению ВПЧ, развитию хронической папилломавирусной инфекции и её переходу в предраковые состояния с потенциальным перерождением в злокачественную опухоль, относятся:
- иммунодефицит любого происхождения, в том числе вследствие ВИЧ-инфекции, лучевых поражений, применения иммунодепрессантов при трансплантации органов и тканей, лечения цитостатиками и других причин;
- подавленное состояние иммунитета во время беременности;
- раннее начало половой жизни;
- частая смена половых партнёров, незащищённый секс;
- инфицированность высокоонкогенными штаммами ВПЧ;
- заражение одновременно несколькими типами ВПЧ;
- наличие других инфекций, передающихся половым путём, например, герпесвирусной и цитомегаловирусной инфекции, вируса Эпштейна — Барр, гепатитов В и С, гонореи и трихомониаза;
- стресс, истощение, гиповитаминоз, гормональный дисбаланс;
- многократные роды и аборты;
- тяжёлые хронические заболевания, в том числе сахарный диабет;
- вредные привычки (курение, злоупотребление спиртным);
- низкий социальный статус, плохие условия жизни, неудовлетворительная интимная гигиена;
- пренебрежение регулярными профилактическими обследованиями (один из важнейших факторов риска);
- низкий уровень развития медицины в регионе проживания.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы папилломавирусной инфекции
Далеко не всегда человек догадывается о наличии в своём организме папилломавирусной инфекции, оставаясь при этом источником заражения для потенциальных партнёров. [1] [2] Дело в том, что заболевание может долгое время протекать бессимптомно: вирус скрыто существует в организме от нескольких месяцев до нескольких лет, никак себя не проявляя. Кроме того, уже имеющиеся проявления инфекции не всегда доступны для наружного обзора. Например, если папилломы, бородавки и кондиломы на открытых участках тела и поверхности гениталий ещё можно заметить самостоятельно, то патологические изменения, локализующиеся на шейке матки, сможет обнаружить только специалист в ходе осмотра с применением соответствующих инструментов.
И всё же существует несколько симптомов, которые прямо или косвенно могут указывать на наличие папилломавирусной инфекции и её неблагоприятных последствий. [3] К ним относятся:
- появление на коже и/или слизистых оболочках каких-либо разрастаний различных форм (на тонкой ножке или с широким основанием, нитевидной, округлой или плоской конфигурации, в форме цветной капусты или петушиного гребня) и размеров (от образований в несколько миллиметров до разрастаний, занимающих всю промежность);
- отёчность и воспалительная инфильтрация папилломатозных разрастаний (остроконечных кондилом), их ранимость и кровоточивость, что приводит к присоединению вторичной инфекции с появлением гнойного отделяемого с неприятным запахом;
- зуд, жжение, мокнутие в области промежности, появление обильных белей, даже при отсутствии видимых патологических образований;
- межменструальные кровянистые выделения, в том числе появляющиеся в результате полового контакта:
- дискомфорт во время полового акта.
Наиболее тревожными признаками заболевания являются:
- постоянные боли в области спины и таза;
- слабость;
- беспричинная потеря веса;
- опухание одной или обеих ног.
Патогенез папилломавирусной инфекции
Заражение папилломавирусной инфекцией происходит при попадании вирусных частиц на кожу или слизистую оболочку. [1] [2] Излюбленная локализация инфекции на теле женщины — промежность, большие и малые половые губы, вульва, влагалище и шейка матки, у мужчин — половой член. Может также произойти поражение слизистой полости рта, пищевода, мочевого пузыря, трахеи, конъюнктивы и других органов и тканей.
Заражению способствуют микротравмы и потёртости. Особенно благоприятные для инфицирования условия создаются при половом акте. В 60–80% случаев достаточно однократного сексуального контакта с больным папилломавирусной инфекцией или бессимптомным носителем ВПЧ. К развитию заболевания может привести попадание в организм буквально единичных вирусных частиц.
При наличии предрасполагающих факторов (микроповреждения, слабого иммунитета и других) возбудитель проникает в эпителиальную ткань до её базального слоя. Там он прикрепляется к оболочке незрелой клетки и внедряется сначала в её цитоплазму, а затем и в ядро, где повреждает генетический аппарат. После этого начинается деление клеток с изменённым геномом, что приводит к появлению в месте внедрения вируса генитальных кондилом (образований, которые постепенно разрастаются), а, например, на шейке матки — к развитию диспластических процессов различной степени тяжести (дисплазия шейки матки).
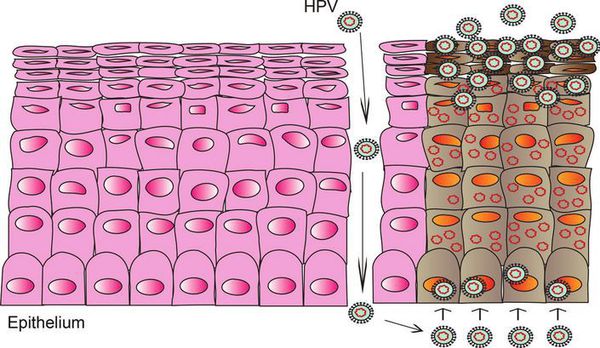
В случае ВПЧ высокого онкогенного риска определённые гены в вирусной ДНК кодируют синтез специфических белков-онкопротеинов (Е6 и Е7), которые подавляют противораковую защиту клеток. Под действием онкопротеинов нарушается стабильность генома клеток, стимулируется их размножение и снижается способность к дифференцировке — всё это со временем может привести к онкопатологии. [12]
Формирование новых полноценных вирусных частиц, способных инфицировать другого человека, происходит уже не в базальном, а в самых поверхностных слоях поражённого эпителия. Возбудитель может содержаться в слущивающихся отмирающих клетках, которые отделаются слизистой оболочкой. Таким образом они переходят к новому хозяину при тесном (сексуальном или бытовом) контакте.
Классификация и стадии развития папилломавирусной инфекции
По способности индуцировать развитие злокачественных новообразований ВПЧ подразделяют на четыре группы: [8]
- неонкогенные штаммы ВПЧ (типы 1-5);
- ВПЧ низкого онкогенного риска (типы 6, 11, 40, 42-44, 54, 61, 70, 72, 81);
- ВПЧ среднего онкогенного риска (типы 26, 31, 33, 35, 51-53, 58, 66);
- ВПЧ высокого онкогенного риска (типы 16, 18, 39, 45, 56, 59, 68, 73, 82).
Клинические формы папилломавирусной инфекции: [5]
- латентная — скрытая форма, не имеющая клинических и морфологических признаков, но обнаруживаемая иммунохимическими и молекулярно-биологическими методами;
- субклиническая — возникает у лиц с нормальным иммунитетом, определяется только специальными диагностическими методами (пробы с растворами-индикаторами, гистологические и цитологические исследования);
- манифестная — появляется у лиц с временным или стойким снижением иммунитета, в случае генитальной папилломавирусной инфекции характеризуется появлением кондилом.
Латентная инфекция может переходить в субклиническую и манифестную форму в случае возникновения предрасполагающих условий (факторов риска), но чаще всего она протекает бессимптомно, не манифестируя.
Клинические проявления папилломавирусной инфекции:
- кожные поражения: подошвенные, плоские и обычные (вульгарные) бородавки, бородавчатая эпидермодисплазия, бородавки Бютчера и небородавчатые поражения кожи;
- поражения слизистых оболочек гениталий: кондиломы, некондиломатозные поражения, карциномы;
- поражения слизистых вне гениталий: папилломатоз гортани, карциномы шеи, языка и другое.
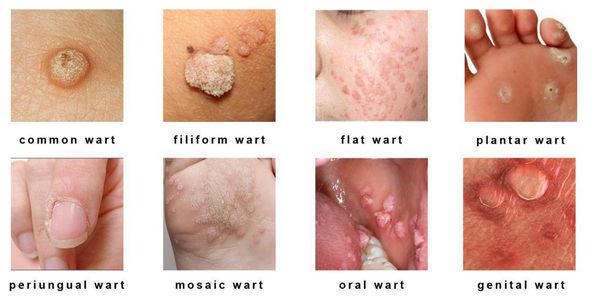
Разновидности поражений:
- экзофитные — видимые разрастания в виде папиллом и бородавок;
- эндофитные — образования, располагающиеся в толще ткани, которые не видны невооружённым глазом.
Осложнения папилломавирусной инфекции
Основными наиболее опасными осложнениями папилломавирусной инфекции являются злокачественные новообразования. Но возможны и другие серьёзные последствия:
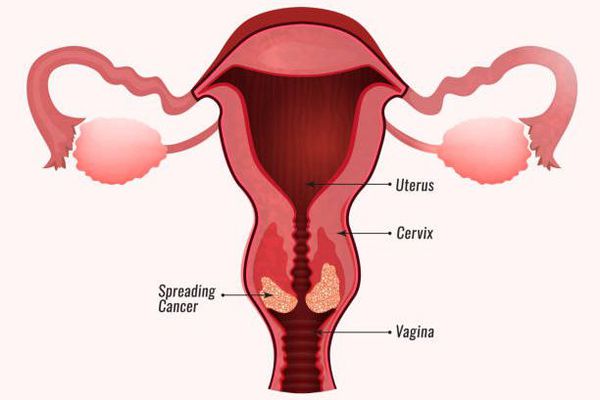
- Злокачественные новообразования заднего прохода, вульвы, полового члена и ротоглотки. Повышение риска их развития также связывают с высокоонкогенными штаммами ВПЧ. [6]
- Остроконечные кондиломы на гениталиях, папилломатоз верхних дыхательных путей (рецидивирующий респираторный папилломатоз, веррукозный ларингит). Причиной возникновения могут стать 6-й и 11-й типы вируса, несмотря на свой низкий онкогенный риск. В случае папилломатоза есть вероятность полной потери голоса, обструкции (перекрытия) гортани с развитием асфиксии. Это довольно редкое заболевание может возникать у детей, рождённых женщинами с папилломавирусной инфекцией. По разным данным, заражение может происходить как во время родов, так и внутриутробно. Как правило, респираторный папилломатоз начинает проявляться в детском и подростковом возрасте, он склонен к неоднократным рецидивам после удаления множественных папиллом, перекрывающих дыхательные пути.
- Гнойно-септические осложнения. Папилломатозные разрастания на слизистых оболочках очень ранимы, легко травмируются, и через участки мокнутия, расчёсов и потёртостей может проникать вторичная инфекция, которая в свою очередь и вызывает нагноение.
Диагностика папилломавирусной инфекции
Основные цели диагностических мероприятий: [3]
- ранняя диагностика папилломавирусной инфекции для динамического наблюдения и лечения;
- своевременное обнаружение и лечение предраковых изменений, что позволяет на 80% предотвратить развитие злокачественных новообразований;
- выявление онкологических новообразований на ранних стадиях, что в большинстве случаев даёт хороший прогноз эффективного излечения;
- решение вопроса о целесообразности вакцинации.
Для выявления папилломавирусной инфекции на сегодняшний день существует целый комплекс диагностических процедур:
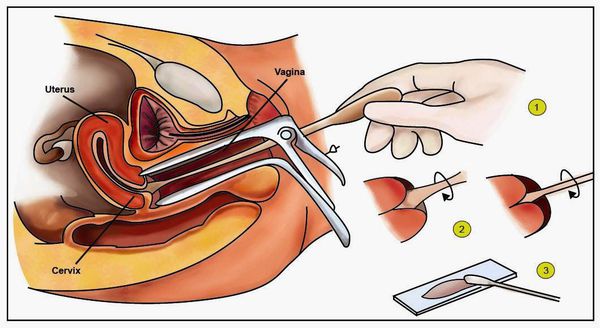
- Гинекологический осмотр в зеркалах — позволяет увидеть папилломатозные разрастания (аногенитальные кондиломы) и другие изменения.
- Классический тест Папаниколау (мазки с поверхности шейки матки и стенок влагалища для цитологического исследования) — обнаруживает ранние признаки дисплазии и злокачественного перерождения.
- Пробы с уксусной кислотой и раствором Люголя — выявляют участки поражения слизистой шейки матки.
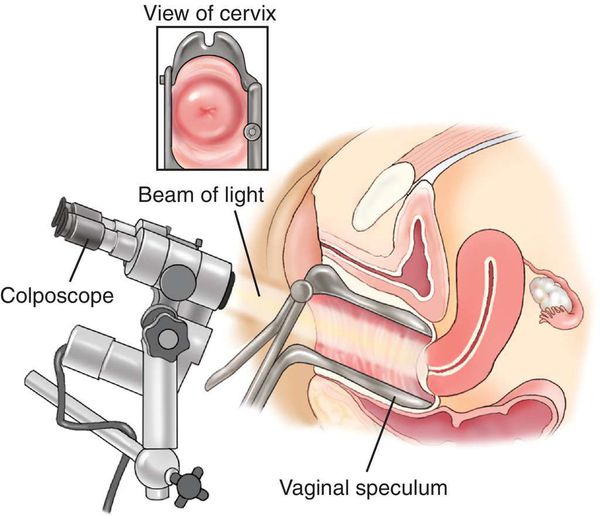
- Кольпоскопия, в том числе с биопсией подозрительных участков и их гистологическим исследованием, — определяет характер имеющегося новообразования.
- Иммунофлюоресцентный анализ (ИФА) обнаруживает в цервикальном соскобе онкопротеины (Е7 и Е6). Этот метод достаточно новый, с его помощью можно различить носительство ВПЧ и первые признаки злокачественного перерождения в клетках, [12] оценить агрессивность данного процесса, сделать предположения относительно прогноза заболевания.
- Полимеразная цепная реакция (ПЦР) находит вирусную ДНК в биологическом материале (соскоб со слизистой), определяет тип ВПЧ, степень его онкогенности, а также количество вирусных частиц, что косвенно позволяет судить о характере течения папилломавирусной инфекции у данного пациента, возможности спонтанного излечения или высокого риска прогрессирования. Обнаружение ВПЧ с помощью этого возможно даже при латентном течении болезни, когда цитологические и гистологические методы не эффективны.
Целесообразно дополнительное обследование пациента на наличие других инфекций, передающихся половым путём, так как папилломавирус в 90% случаев с ними сочетается, и это может осложнять течение заболевания.
Лечение папилломавирусной инфекции
Лечение папилломавирусной инфекции должно быть комплексным и включать следующие составляющие: [3] [5]
- деструкцию (удаление) видимых проявлений (аногенитальных кондилом и др.);
- иммуномодулирующую терапию;
- противовирусную терапию;
- лечение сопутствующих инфекций, передающихся половым путём.
Деструктивные методы делятся на две основные группы:
- химические — с применением трихлоруксусной кислоты, а также таких препаратов, как "Солкодерм", "Колломак", "Ферезол" и др.;
- физические — хирургическое удаление, электрокоагуляция, криодеструкция, радиоволновая и плазменная коагуляция, лазеротерапия.
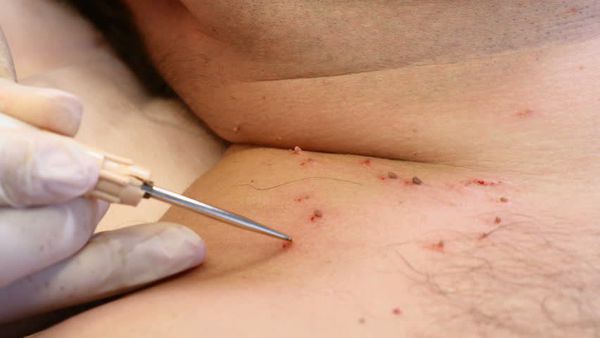
Лечение сопутствующих половых инфекций проводят до начала деструктивной терапии на фоне адекватной иммунокоррекции.
Удаление видимых проявлений папилломавирусной инфекции должно сочетаться с противовирусной терапией — как с общей, так и с применением препаратов местного действия после удаления кондилом.
Следует помнить, что успешно проведённое лечение не исключает развитие рецидивов в дальнейшем, особенно у пациентов с нарушениями иммунитета. Поэтому за ними устанавливается динамическое наблюдение в течение как минимум 1-2 лет.
Прогноз. Профилактика
В 90% случаев здоровая иммунная система человека справляется с папилломавирусной инфекцией самостоятельно за период от полугода до двух лет с момента инфицирования, после чего происходит полное выздоровление с исчезновением вируса из организма. При этом не формируется напряжённого пожизненного иммунитета, то есть человек может заразиться повторно.
В других случаях, при наличии предрасполагающих факторов, заболевание приобретает хроническую форму, склонную к длительному скрытому течению с периодическими рецидивами и возможным развитием тяжёлых осложнений.
От момента попадания вируса в организм до развития предраковых состояний и тем более возникновения рака может пройти достаточно много времени, иногда десятки лет. Поэтому регулярные профилактические обследования, своевременное выявление и лечение предраковых состояний — вполне реальный и эффективный способ избежать самого неблагоприятного варианта развития событий. [13] С этой целью Всемирная организация здравоохранения рекомендует всем женщинам старше 30 лет при первичном скрининге проходить не только “рутинное” цитологическое исследование, но и делать тест на наличие ВПЧ. [10]
Регулярное посещение гинеколога (при отсутствии каких-либо жалоб — раз в год) с проведением теста Папаниколау позволяет своевременно обнаружить начальные признаки дисплазии и предпринять все необходимые меры для предотвращения прогрессирования процесса и его перехода в онкологическое заболевание.
Использование методов барьерной контрацепции хоть и не полностью защищает от инфицирования, но несколько снижает его вероятность.
Главным методом первичной профилактики папилломавирусной инфекции считается вакцинация. [11] Современные вакцины разработаны с целью защиты от наиболее опасных, высокоонкогенных штаммов ВПЧ, ответственных за 70-80% случаев развития рака шейки матки. Стандартный курс, состоящий из трёх прививок, даёт вполне надёжную защиту.
Авторами было проведено плацебоконтролируемое исследование, в ходе которого была проанализирована эффективность терапии аллофероном у пациенток с персистирующей папилломавирусной инфекцией. Были выявлены выраженные нарушения локальных иммунных реакций, обусловленных дисбалансом продукции цитокинов при поражении вирусом папилломы человека (ВПЧ) шейки матки. На фоне терапии аллофероном улучшались вирусологические, кольпоскопические и цитологические показатели, препарат хорошо переносился. Это позволяет рекомендовать аллоферон в качестве противовирусного и иммуномодулирующего средства в составе комплексной терапии для лечения инфекции, вызванной онкогенными типами ВПЧ, и для монотерапии выявленных онкогенных типов ВПЧ при отсутствии каких-либо аномальных изменений шейки матки или генитальных кондилом.
- КЛЮЧЕВЫЕ СЛОВА: вирус папилломы человека, рак шейки матки, генитальные кондиломы, аллоферон
Авторами было проведено плацебоконтролируемое исследование, в ходе которого была проанализирована эффективность терапии аллофероном у пациенток с персистирующей папилломавирусной инфекцией. Были выявлены выраженные нарушения локальных иммунных реакций, обусловленных дисбалансом продукции цитокинов при поражении вирусом папилломы человека (ВПЧ) шейки матки. На фоне терапии аллофероном улучшались вирусологические, кольпоскопические и цитологические показатели, препарат хорошо переносился. Это позволяет рекомендовать аллоферон в качестве противовирусного и иммуномодулирующего средства в составе комплексной терапии для лечения инфекции, вызванной онкогенными типами ВПЧ, и для монотерапии выявленных онкогенных типов ВПЧ при отсутствии каких-либо аномальных изменений шейки матки или генитальных кондилом.
Рост инфицированности вирусом папилломы человека (ВПЧ) обусловливает актуальность проблемы ВПЧ-ассоциированных заболеваний гениталий [1, 2]. ВОЗ (1996), а также Европейская ассоциация по генитальным инфекциям и неоплазиям (European Research Organization on Genital Infection and Neoplasia, EUROGIN) (2003) подтвердили, что причиной возникновения рака шейки матки являются высокоонкогенные типы вируса папилломы человека. Папилломавирусная инфекция гениталий отличается высокой контагиозностью. По данным многочисленных эпидемиологических исследований, ДНК ВПЧ определяется у 3–10% здоровых женщин, а также в 50–80% случаев при различных клинических формах остроконечных кондилом, в 12–30% – при доброкачественных поражениях шейки матки, от 19 до 90% – при цервикальных интраэпителиальных неоплазиях, в 58–95% случаев – при внутриэпителиальных карциномах [3–5].
В зависимости от проявлений папилломавирусной инфекции на гениталиях выделяют следующие ее формы:
- клиническую (экзофитные кондиломы различной локализации: вульва, влагалище, промежность, половые губы, перианальная область у женщин, половой член у мужчин);
- субклиническую (изменения, выявляемые только при кольпоскопии, цитологическом и гистологическом исследованиях: кондиломатозный цервицит и вагинит, плоские кондиломы шейки матки, различные изменения многослойного плоского эпителия, инвертированные кондиломы с локализацией в криптах);
- латентную (обнаружение ДНК вируса при отсутствии клинических и морфологических проявлений).
Клинические и субклинические формы ВПЧ обнаруживают также у 40–60% мужчин – половых партнеров инфицированных женщин [6]. Кроме того, папилломавирусная инфекция является фактором риска развития цервикальной интраэпителиальной неоплазии (дисплазии слабой, умеренной или тяжелой степени) и инвазивной карциномы (плоскоклеточной или железистой) [7].
ВПЧ отличается высокой тропностью к пролиферирующим клеточным популяциям, инфицирует эпителиальные клетки базального слоя эпителия. Инвазия вируса происходит через микроповреждения тканей (механические, бактериальные и др.), когда глубина их достигает базального слоя эпителия. Вирусы инфицируют делящиеся незрелые клетки базально-клеточного слоя и переходных типов эпителия, где пролиферирующие клетки находятся близко к поверхности. Этим фактом, возможно, объясняется частота инфицирования шейки матки и нижней трети влагалища и вульвы [8].
В предотвращении клинической манифестации папилломавирусной инфекции важную роль играет иммунный ответ. ВПЧ эпителиотропен, поэтому особое значение имеет состояние факторов местной защиты слизистой гениталий.
Местная противоинфекционная защита обеспечивается комплексом лимфоидных структур, фагоцитирующих клеток, в том числе макрофагов стромальных тканей шейки матки, секреторных гуморальных и цитокиновых факторов. Цервикальные эпителиальные клетки, предположительно, являются основой для развития иммунного ответа на слизистой. В исследованиях in vivo и in vitro показано, что клетки цервикального эпителия секретируют цитокины, экспрессируют на своей поверхности Toll-like-рецепторы и осуществляют разграничение верхнего и базального слоев [10, 11]. Исследования клеточных линий показали различную иммунореактивность клеток цилиндрического и плоского эпителия [12]. Клетки цервико-вагинальной зоны не только продуцируют цитокины/хемокины, но и являются мишенью для воздействия цитокинов, вырабатываемых другими клетками. В противовирусной защите при ВПЧ-инфекции наиболее существенную роль играют клетки, которые находятся в прямом контакте с вирусом [9, 13]. Многочисленные исследования указывают на наличие тесной взаимосвязи между уровнем продукции цитокинов и клиническими характеристиками инфекционного процесса, но при этом отсутствует единое мнение о патогенетическом значении отдельных регуляторных пептидов на разных стадиях болезни [14, 15].
Несмотря на многочисленные исследования местного иммунитета в защите от ВПЧ, механизмы действия клеточных и цитокиновых компонентов иммунитета слизистых в отношении персистенции вируса изучены недостаточно. Персистенция ВПЧ высокого риска является ключевым событием в малигнизации клеток, что обусловливает необходимость изучения факторов, инициирующих этот процесс и, следовательно, способствующих реализации онкогенного потенциала ВПЧ.
Аллоферон в терапии ВПЧ-инфекции
Современный подход к терапии ВПЧ-инфекции основан на данных об особенностях взаимодействия вируса папилломы с организмом хозяина, зависит от формы ВПЧ-инфекции, возраста пациента, длительности персистенции вируса и предполагает местное (деструкция или эксцизия пораженных тканей) или системное лечение (противовирусные препараты и иммунотерапия), а чаще всего – комбинированную терапию [9, 16].
Материалы и методы
С целью поиска новых подходов к лечению папилломавирусной инфекции проведена оценка факторов цитокинового ответа при персистирующем течении инфекции и проанализировано влияние терапии Аллокином-альфа на показатели иммунитета у пациенток с ВПЧ.
- наличие репликации ВПЧ онкогенного типа (16, 18, 31, 33, 35, 39, 45, 52, 58, 59, 26, 51, 53, 56, 66, 68, 82-го) на слизистой цервикального канала, установленное методом полимеразной цепной реакции;
- хроническая ВПЧ-инфекция в течение 2 и более лет с момента установленного инфицирования.
В исследование не включались беременные и кормящие женщины; женщины детородного возраста, не получающие адекватной контрацепции; женщины, имеющие цитологически значимые отклонения, дисплазию шейки матки тяжелой степени, рак in situ. Критерием исключения также было наличие сопутствующих урогенитальных инфекций в активной фазе, требующих проведения соответствующей терапии, и острых состояний, способных существенно повлиять на результаты исследования.
Всего углубленное обследование с включением молекулярно-генетических, кольпоскопического, цитологического методов было проведено 60 пациенткам. 40 женщин составили основную группу, им была назначен препарат Аллокин-альфа, 20 женщин соответствующего возраста и с аналогичным диагнозом вошли в контрольную группу и получали плацебо.
Проведение осмотра шейки матки при помощи зеркал и расширенной кольпоскопии позволило выявить аномальные кольпоскопические картины (мозаика, пунктуация, ацетобелый эпителий, атипичные сосуды), эктопию и другие образования (кондиломы, лейкоплакия, кисты) шейки матки. У 92,5% (n = 37) женщин основной группы выявлялась аномальная кольпоскопическая картина шейки матки. В результате проведенного цитологического исследования у 37,5% (n = 15) женщин выявлены неопределенные полиморфные изменения мазка, что соответствовало 2-му классу мазка по системе Папаниколау. У 47,5% (n = 19) пациенток изменений в цитологическом составе мазка не обнаружено. У 10% (n = 4) женщин изменения морфологии клеточных элементов были обусловлены воспалением, кроме того, у 15% (n = 6) пациенток отмечена легкая степень дисплазии.
1. Bosh F.X., Burchell A.N., Schiffman M. et al. Epidemiology and natural history of human papillomavirus infections and type-specific implications in cervical neoplasia // Vaccine. 2008. Vol. 26. Suppl. 10. P. K1–K16.
Читайте также:

