Транзиторные инфекции у детей
Обновлено: 19.04.2024
Бактерии широко распространяются, новые госпитальные штаммы регулярно формируются из-за широкого применения антибиотиков и высокой резистентности протея к большинству этих препаратов. Протеи в отделениях для грудничков могут вызвать экзогенную нозокомиальную инфекцию.
Инфекцию распространяют больные люди разных возрастов и бактериовыделители без ярко выраженной симптоматики. Самое большое количество возбудителей протеоза выделяют с испражнениями больные с кишечной протейной инфекцией. В 1 г фекалий содержится до 10 7 —10 8 бактерий. Также большое количество возбудителя попадает во внешнюю среду при гнойно-воспалительных процессах: нагноении ожоговых поверхностей, операционных ран, отите, остеомиелите, флегмонах и т. д. То же касается и болезней мочевых путей, вызванных Proteus.
Данному заболеванию подвержены в том числе новорожденные, груднички и дети дошкольного возраста, лица, имеющие аномалии и поражения мочевых путей, а также ослабленные хирургическими вмешательствами и/или разными болезнями.
Пути передачи протейной инфекции:
- контактный
- пищевой (творог, рыба, мясо, фруктово-овощные смеси)
- медаппаратура, инструменты
- предметы ухода за больными взрослыми и детьми.
Заболевания протеозами фиксируют на протяжении всех пор года, в основном заболеваемость спорадическая (без эпидемических вспышек).
Что провоцирует / Причины Протейной инфекции у детей:
Существует пять видов рода протеев:
- P. mirabilis
- P. vulgaris
- P. retgeri
- P. morganii
- P. inconstans (providencia).
Разница между видами заключается в антигенной структуре. Протеи на данный момент считаются условно-патогенными микроорганизмами, возбудителями нозокомиапьных инфекций по типу пиелонефрита, острого гастроэнтерита, омфалита и т.д.
Патогенез (что происходит?) во время Протейной инфекции у детей:
Протеи вырабатывают уреазу – фермент, который расщепляет мочевину. Это грозит ощелачиванием мочи, нарушением целостности эпителия мочевых путей и снижением его резистентности. Таким образом возбудитель болезни колонизирует мочевые пути.
Протеи в тонком кишечнике приводят к развитию энтероколита, энтерита. Формирование того или иного симптома зависит от состояния макроорганизма, дозы и вирулентности штамма возбудителя. Почти сразу после заражения какая-то доза бактерий попадает в стенку кишки и в органы, где и сохраняется. Предположительно, там он и размножается несколько суток. Если есть соответствующие условия, появляются вторичные очаги, которые в условиях снижения резистентности организма ребенка могут приводить к локальным инфекционным процессам или вторичной бактериемии.
Таким образом, протеи при экзогенном заражении могут спровоцировать не только кишечную инфекцию, но и сделать кишечник источником потенциальной эндогенной инфекции различной локализации (месторасположения).
Симптомы Протейной инфекции у детей:

Среди основных симптомов протеозов:
- гнойно-воспалительные процессы на коже
- поражения мочевых путей
- гнойно-воспалительные процессы в костной ткани
- поражения ЖКТ
- поражения мозговых оболочек
- поражения уха
- поражения придаточных пазух
- поражения легких и т. д.
В детском организме поражается прежде всего желудочно-кишечный тракт, а также мочевая система. При кишечной инфекции заражение происходит во время контакта с заболевшим диереей человеком или во время употребления зараженной протеем еды. От 2-3 часов до 2 суток колеблется инкубационный период. Болезнь имеет острое начало, проявляются общеинфекционные симптомы, нарушается функция ЖКТ.
Стул больного водянистый, желто-зеленый, имеет очень неприятный запах. В стуле можно заметить непереваренные комочки пищи, может быть присемь слизи. Дефекация происходит 5-10 раз в сутки. В 1/3 случаев среди симптомов – метеоризм и боли в животе. В ½ случаев фиксируют увеличение печени, а в 1/3 случаев – селезенка.
У детей до 12-ти месяцев при заражении протейной инфекцией начинается кишечный токсикоз с эксикозом I—II степени. Фиксируют потерю массы тела, сухость слизистых оболочек и кожи, снижение эластичности кожи и тургора мягких тканей. Происходят нарушения сердечно-сосудистой системы: относительная тахикардия, приглушение тонов сердца, в некоторых случаях – систолический шум.
Патологические изменения легких проявляются такими симптомами:
- токсическая одышка
- развитие пневмонии.
В пик болезни фиксируют олигурию с умеренным количеством белка в моче. Под олигурией понимают уменьшение количества отделяемой почками мочи. Анализ крови показывает у ½ больных детей нейтрофилез, лейкоцитоз, палочкоядерный сдвиг, умеренно повышенную СОЭ.
Кишечная инфекция длится 5-10 дней. Самый длительный симптом – дисфункция кишечника с вторичными нарушениями пищеварения. Морфологические изменения в кишечнике представляют собой острый серозный энтерит. Гистологические методы исследования показывают отек стенок кишок, полнокровие, поверхностные дефекты. Лимфогистиоцитарные инфильтратыобнаруживаются обнаруживают в слизистой оболочке и подслизистом слое кишки. Дистрофические процессы наблюдаются в других внутренних органах. Есть вероятность развития пневмонии. Затяжной энтероколит может привести к возникновению глубоких множественных язв, диаметр которых от 0,2 до 0,5 мм. Язвы имеют приподнятые края. Редко они находятся в области единичных лимфатических фолликулов.
У детей с аномалией развития почек и органов мочевой системы может быть поражение мочевых путей. Частое поражение мочевых путей объясняется выработкой протеями фермента уреазы, которая способствует нарушению целостности эпителия мочевых путей и внедрению возбудителя в эти ткани. После попадания в мочевую систему возбудитель закрепляется в паренхиме почек, что приводит к развитию пиелонефрита.
Симптоматика протейных пиелонефритов:
- тупые боли в области поясницы
- повышенная утомляемость
- субфебрильная температура тела
- транзиторная гипертензия (не всегда).
Особенности протейной инфекции у новорожденных и детей до 12-ти месяцев. Нередкими являются вспышки протеозов в отделениях для новорожденных. Заражение может произойти через аппаратуру. Протейная инфекция может локазалироваться по-разному у новорожденных. Протейная диарея имеет острое начало, температура тела поднимается до уровня 37,5—38 ˚С. Проявляются такие симптомы как рвота и жидкий стул со слизью и зеленью, болезненность живота, вздутие, урчание по ходу расположения кишечника.
На протяжении 2-3 первых дней развивается дегидратация на фоне общеинфекционного токсикоза. Дети начинают плохо питаться (отталкивают грудь), наблюдается вялость, появляется токсическая одышка.
Есть вероятность инфекции пупочной ранки — омфалита в сочетании с инфекцией пупочных сосудов в виде септического артериита и флебита, захватывающего пупочную и портальную вены.
Протейная инфекция у новорожденных иногда развивается как острый гнойный менингит с септицемией. Болезнь имеет внезапное начало, температура тела поднимается до уровня 38 ˚С, малыш проявляет беспокойство, нарушается ритм дыхания, появляется цианоз. У младенцев наблюдается резкое ослабление сосательного рефлекса, возникновение спастических судорог в ручках и ножках, гемипарезы. Ребенок начинает пронзительно кричать. В крови отмечается лейкоцитоз более 10 9 , в спинномозговой жидкости — плеоцитоз с преобладанием нейтро-филов (до 70—90%). Если не случается летального исхода, происходит отставание в психомоторном развитии и судорожные припадки.
Диагностика Протейной инфекции у детей:
Для постановки диагноза нужны бактериологические исследования такого биологического материала как испражнения, рвотные массы, моча, кровь, отделяемое из воспалительных очагов на коже. Иногда исследуют на присутствие бактерий воду, пищевые продукты, смывы с предметов, которые использовал больной, с медаппаратуры, а также лекарственные растворы.
В диагностике важны показания серологических исследований. Антитела к аутоштамму протея начинают выявляться в РА с 5— 6-го дня болезни в титрах 1:200 и 1:400 с максимумом к 9—15-му дню от начала заболевания (1:400— 1:1600). Применяют также РСК и РПГА.
Болезни мочевых путей с с протейной бактериурией сопровождаются появлением антипротейных антител в титрах от 1:160 до 1:640. При пиелонефритах и септических состояниях диагностическое значение придается титрам антипротейных антител 1:320 и выше.
Лечение Протейной инфекции у детей:
Терапия кишечных инфекций базируется на тех же принципах, что и лечение других кишечных инфекций бактериальной природы. Для лечения легких форм используется колипротейный бактериофаг. Для лечения тяжелых форм протейной инфекции у детей применяют антибактериальные препараты, например, защищенные пенипиллины, гентамицин, цефалоспорины III поколения.
Нормализацию микрофлоры кишечника в периоде реконвалесценции проводят с помощью полибактерина, бифидумбактерина, линекса, бификола, энтерола и пр.
Если произошло поражение мочевыводящих путей и почечной паренхимы, необходимо восстановить нормальный пассаж мочи. Антибактериальную терапию в данных случаях проводят при бактериурии и признаках пиелонефрита. Уроштаммы протея устойчивы к пенициллину, эритромицину, полимиксину и сохраняют высокую чувствительность к препаратам налидиксовой кислоты.
Чтобы усилить эффективность противопротейных препаратов, их сочетают с другими. К примеру, фурадонин сочетается с эритромицином, невиграмон с левомниетином, ампициллин с геитамицином.
Вялотекущие процессы лечатся комплексной терапией, с включением иммуномодуляторов, к примеру, нуклеината натрия, метилурацила, а также вакцины из бактерий рода Proteus или аутовакцины. При тяжелых формах болезни врачи иногда прописывают колипротейную плазму и антипротейную иммунную сыворотку.
Прогноз
Неблагоприятным исходам грозят случаи генерализированных заболеваний у новорожденных недоношенных детей. Острые кишечные инфекции, вызванные протеями, оканчиваются в большинстве случаев выздоровлением ребенка. Течение протейной инфекции бывает упорным, с рецидивами. В последние годы часто формируется вялотекущий пиелонефрит, трудно поддающийся лечению.
Профилактика Протейной инфекции у детей:
Специфических профилактических мер протеозов пока что нет. Для предупреждения протеозов важно соблюдать санитарно-гигиенические правила. Большие трудности представляет борьба с нозокомиальной протейной инфекцией, особенно в палатах для новорожденных и в урологических стационарах. Для снижения риска инфицирования протеем в указанных медицинских учреждениях необходимо наряду с применением дезинфекции и антисептических средств orpaничивать инвазивные манипуляции до минимума.
К каким докторам следует обращаться если у Вас Протейная инфекция у детей:
Вас что-то беспокоит? Вы хотите узнать более детальную информацию о Протейной инфекции у детей, ее причинах, симптомах, методах лечения и профилактики, ходе течения болезни и соблюдении диеты после нее? Или же Вам необходим осмотр? Вы можете записаться на прием к доктору .
Транзиторные иммунодефициты. Механизм развития транзиторных иммунодефицитов. Иммунотерапия. Иммунопрофилактика. Иммунобиологические препараты.
Многие инфекционные заболевания сопровождаются дефектами иммунной реактивности. Подобные нарушения известны ещё со времён фон Пирке (начало XX века), однако в большинстве случаев они носят временный характер и исчезают после выздоровления.
Основополагающий механизм развития транзиторных иммунодефицитов — повреждение или инфицирование иммунокомпетентных клеток с последующим нарушением их функций. Особенно часто транзиторные иммунодефицита наблюдают на фоне вирусных инфекций, что обусловлено облигатным внутриклеточным паразитизмом возбудителей. Наиболее яркий пример — ВИЧ, избирательно инфицирущий Т-хелперы. В результате развивается прогрессирующее разрушение иммунной системы — синдром приобретённого иммунодефицита (СПИД).
Иммунотерапия. Иммунопрофилактика. Иммунобиологические препараты
Иммунотерапия — введение с лечебными целями иммунных препаратов (например, AT, ИФН, цитокинов и др.). Иммунопрофилактика — введение иммунных препаратов с целью предотвращения развития инфекционных заболеваний (вакцины, сыворотки). На протяжении столетий практическая медицина применяла эмпирические методы искусственной защиты от инфекционных болезней (например, от оспы). Научные основы иммунопрофилактики были заложены исследованиями Пастера, открывшего феномен аттенуации (ослабления) микробов и создавшего вакцины против сибирской язвы и бешенства.
Все средства, применяемые для воздействия на иммунную систему, известны как иммунобиологические препараты. К ним относят разнообразные по природе и происхождению вещества.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Что такое сальмонеллез? Причины возникновения, диагностику и методы лечения разберем в статье доктора Александрова Павла Андреевича, инфекциониста со стажем в 14 лет.
Над статьей доктора Александрова Павла Андреевича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов и шеф-редактор Лада Родчанина

Определение болезни. Причины заболевания
Сальмонеллёз — это острое инфекционное заболевание желудочно-кишечного тракта с возможностью дальнейшей генерализации процесса (распространением заболевания по всему организму). Причина развития сальмонеллёза — различные серотипы бактерий рода Salmonella. К клиническим характеристикам сальмонеллёза относят синдром общей инфекционной интоксикации, синдром поражения желудочно-кишечного тракта (гастрит, энтерит), синдром обезвоживания, гепатолиенальный синдром (увелечение печени и/или селезёнки) и иногда синдром экзантемы (высыпания).
Возбудитель
семейство — кишечные бактерии (Enterobacteriaceae)
род — Сальмонелла (Salmonella)
Существует 7 подвидов (более 2500 сероваров). Наиболее актуальные серовары: typhimurium, enteritidis, panama, london.
Представлены следующей антигенной структурой:
- О-антиген (соматический, термостабильный);
- H-антиген (жгутиковый, термолабильный);
- К-антиген (поверхностный, капсульный);
- Vi-антиген (антиген вирулентности — степень способности штамма вызвать заболевание; является компонентом О антигена);
- М-антиген (слизистый).
К факторам патогенности (механизмам приспособления бактерий) относятся:
- холероподобный энтротоксин — интенсивная секреция жидкости в просвет кишки;
- эндотоксин (липополисахарид) — общее проявление интоксикации;
- инвазия — заражение.
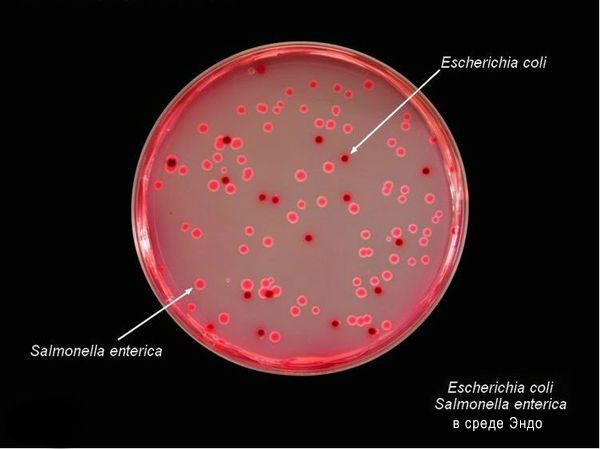
Тинкториальные свойства: разлагают глюкозу и маннит, образовывая кислоту и газ, продуцируют сероводород. Грамм-отрицательные палочки подвижны, спор и капсул не образуют. Растут на обычных питательных средах, образуя прозрачные колонии, на мясо-пептонном агаре с образованием колоний голубоватого цвета, на среде Эндо образуют прозрачные розовые колонии, на среде Плоскирева — бесцветные мутные, на висмут-сульфитном агаре — чёрные с металлическим блеском.
Высокоустойчивы во внешней среде (без агрессивных воздействий), активно размножаются в мясе и молоке (до 20 суток), в воде сохраняют жизнесособность до 5 мес., в почве — до 9 мес., в комнатной пыли — до 6 мес., в колбасе — до 1 мес., в яйцах — до 3 мес., в фекалиях сохраняются до 4 лет. При 56 °C погибают через 3 минуты, при кипячении мгновенно. Сальмонеллы, которые находятся в куске мяса массой 400 гр и толщиной до 9 см, погибают при его варке за 3,5 часа. Соление и копчение оставляет сальмонелл в живых. Воздействие кислот и хлорсодержащих дезинфицирующих средств вызывает их гибель. В последнее десятилетие появились штаммы сальмонелл, устойчивые ко многим антимикробным препаратам. [2] [5]
Эпидемиология
Зооантропоноз, распространённый повсеместно.
Источники инфекции: домашние животные (сами не болеют), птицы, человек (больной и носитель).
Резервуары инфекции и причина эпидемических вспышек сальмонеллеза: грызуны, дикие птицы, тараканы, улитки, лягушки, змеи.
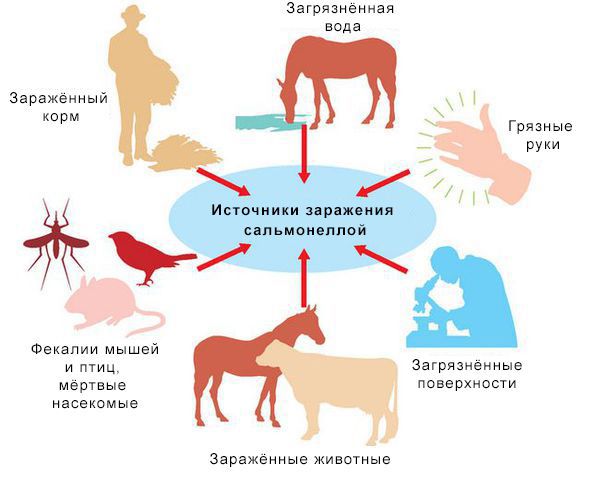
Механизм передачи: фекально-оральный (пути — алиментарный, т. е. через органы ЖКТ, водный, контактно-бытовой). В основном источниками заражения являются птицы, яйца и молочные продукты. Инфицирующая доза 10*5-10*8 микробных тел.
Факторы риска
- детский возраст до 5 лет;
- возраст до 12 месяцев, особенно высока вероятность заболеть без грудного вскармливания;
- иммунодефицит (в основном у младенцев и лиц старше 65 лет, а так же у пациентов с ВИЧ в стадии СПИДа, принимающих иммунодепрессивные препараты);
- регулярный приём препаратов, снижающих кислотность желудка;
- употребление сырого и недостаточно термически обработанного мяса, молочных продуктов и яиц;
- частый контакт с животными с несоблюдением правил гигиены;
- посещение стран с низким уровнем жизни.
В России в 2016 г. заболеваемость была – 26 на 100 тыс. населения, у детей в до 14 лет – 71 на 100 тыс. Для сравнения в США среднегодовая заболеваемость — 15 на 100 тыс. (1,35 миллиона заболеваний, 26 500 госпитализаций и 420 смертей ежегодно). Иммунитет строго типоспецифичен (возможно многократное инфицирование различными штаммами) и непродолжителен [2] [6] [9] [10] .
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы сальмонеллеза
Инкубационный период — от 6 часов (при алиментарном заражении) до 3 суток. При внутрибрюшном заражении (искусственно) — до 8 дней.
Начало заболевания острое (т. е. развитие основных синдромов происходит в первые сутки заболевания).
Иммунодефицит у детей подразделяется на первичный (врожденный) и вторичный, вызванный экзогенными влияниями, тяжелыми инфекциями, ятрогенными факторами. Симптомы патологии включают частые и затяжные инфекционные заболевания различной локализации, задержку физического и психического развития, аллергические и аутоиммунные расстройства. Для диагностики назначают общеклинические анализы, расширенную иммунограмму, серологические и генетические тесты. Лечение иммунодефицитов состоит из заместительной и антибактериальной терапии, хирургических методов (трансплантация костного мозга и тимуса).
МКБ-10

Общие сведения
Частота встречаемости иммунодефицитов в детском возрасте колеблется от 1:10000 до 1:100000. Вариативность данных обусловлена большим разнообразием клинических форм патологии и полиморфностью симптоматики. Легкие вторичные иммунодефициты обычно не диагностируются и не попадают в общую статистику. Лечение заболевания, особенно связанного с генетическим дефектом, представляет большие трудности. При тяжелых нарушениях иммунной системы нередки инвалидизации и летальные исходы.

Причины
Этиологическая структура первичных иммунодефицитов включает врожденные дефекты иммунной системы — как наследственные заболевания, так и пороки развития (эмбриопатии, фетопатии), возникшие под действием тератогенных факторов. Большинство случаев обусловлено генетическими аномалиями, передающимися аутосомно или сцепленными с половыми хромосомами. Причины вторичных форм более обширны и включают следующие категории:
- Недостаточность питания.Дефицит белка приводит к недостатку строительного материала для иммунных молекул, вследствие чего снижается активность гуморального звена защиты. При нехватке эссенциальных микроэлементов и витаминов нарушается функционирование Т-клеточной системы.
- Потеря иммуноглобулинов. В норме защитные молекулы постоянно циркулируют в крови, а при патологических процессах они усиленно выводятся из организма. Подобная ситуация наблюдается при нефротическом синдроме на фоне гломерулонефрита, массивных кровотечениях или лимфорее, обширных ожогах.
- Экзогенные вредные воздействия. Иммунитет ухудшается под влиянием физических факторов: ионизирующего излучения, высокой или низкой температуры, радиоактивных волн, что часто связано с местом проживания ребенка. Причиной иммунного расстройства также может послужить загрязнение окружающей среды пестицидами и промышленными выбросами.
- Инфекции. Иммунодефициты встречаются при заражении типичными детскими инфекциями (корью, краснухой, эпидемическим паротитом), могут быть результатом опасных хронических заболеваний — гепатита В, СПИДа, подострого склерозирующего энцефалита. Реже болезнь обусловлена бактериальной или протозойной инвазией.
- Злокачественные новообразования. Нарушения защитных сил организма возникают при любых лимфопролиферативных процессах, поскольку они затрагивают процесс образования и функционирования иммунокомпетентных клеток. Недостаточность гуморального звена преимущественно вызвана миеломной болезнью.
- Ятрогенные факторы. После спленэктомии страдает гуморальный иммунный ответ, поскольку селезенка является основным органом антителопродукции. Нарушения Т-клеточного звена зачастую отмечаются, когда проводится длительное лечение иммуносупрессорами, кортикостероидами, химиотерапевтическими препаратами.
Патогенез
Заболевание проявляется нарушениями в одном или нескольких звеньях иммунного ответа, в результате чего у ребенка повышается чувствительность к инфекциям. Если есть дефект иммуноглобулинов или комплемента, у детей в основном возникают рецидивирующие гнойные патологии, вызванные инкапсулированными бактериями. Дефицит клеточного звена иммунитета повышает частоту оппортунистических инфекций.
Классификация
В детской иммунологии все иммунодефициты разделяют на 2 категории согласно причине появления: первичные (ПИД), связанные с врожденными факторами, и вторичные (ВИД), вызванные внешним воздействием или соматическим заболеванием. Вторые, в свою очередь, делятся на индуцированные, приобретенные и спонтанные. Среди ПИД выделяют 5 основных разновидностей:
- В-клеточные иммунодефициты. Самая распространенная форма, составляющая до 50% от общего числа патологий. Она обусловлена недостаточной продукцией защитных антител, которые в норме синтезируются при активации В-лимфоцитов. В эту категорию входят болезнь Брутона, гипер-IgM синдром, делеция генов тяжелых цепей иммуноглобулинов.
- Т-клеточные иммунодефициты. Вызваны снижением количества или нарушением функциональной активности Т-лимфоцитов. К ним принадлежат синдром Ди Джорджи, первичный дефицит CD4-клеток, дефицит ИЛ-2.
- Комбинированные иммунодефициты. Тяжело протекающие процессы, которые сочетают в себе признаки двух предыдущих форм. Встречаются в 30% случаев. К комбинированным патологиям относят синдром Вискотта-Олдрича, синдром Луи-Бар (атаксия-телеангиоэктазия).
- Дефекты фагоцитоза. При этой форме иммунодефицитов нарушается переваривание инфекционных агентов, возникают проблемы с антигенпрезентацией и выработкой антител. Сюда относят разные формы наследственных нейтропений.
- Дефекты комплемента. Нехватка этого фактора делает невозможным уничтожение антигена после присоединения к нему антитела, поэтому наблюдается несостоятельность В-лимфоцитов. Такие состояния составляют не более 2% от иммунодефицитов у детей.
Симптомы иммунодефицита у детей
Основным признаком иммунодефицитов является инфекционный синдром, который встречается у 95-100% детей. Заболевание отличается затяжным и рецидивирующим течением, а стандартное лечение не дает результатов. При первичных иммунодефицитах, которые протекают более тяжело, часто сочетается несколько инфекций разной локализации, что ухудшает состояние ребенка. Типичными маркерами являются гнойные отиты (6-8 раз в год), синуситы (4 раза в год), пневмонии (1 раз в полгода).
У детей с первичными иммунодефицитами, как правило, возникает задержка роста и нервно-психического развития. Она наиболее характерна для дефицитов клеточного звена, которые сопровождаются хронической диареей, мальабсорбцией и мальдигестией. У 18% детей болезнь дополняется системными аллергическими реакциями, в 6% случаев — аутоиммунными поражениями тканей.
Клиническая картина иммунодефицитов отличается при нарушениях Т-клеточного или В-клеточного звеньев иммунитета. В первом случае симптомы проявляются сразу после рождения, у младенца выявляются кандидоз полости рта, гнойничковые высыпания на коже, затяжная диарея. Позже присоединяются рекуррентные вирусные и микотические инфекции, наблюдается гепатоспленомегалия и костные аномалии.
Для дефицита В-клеточного иммунитета характерно начало после 6-месячного возраста, когда из крови ребенка исчезают материнские антитела. Типичным симптомом являются затяжные респираторные инфекции, вызванные бактериальной флорой или микоплазмами. Если лечение отсутствует, начинаются менингоэнцефалиты, артриты, энтеровирусные гастроэнтериты.
Вторичный иммунодефицит протекает в легкой форме, если он не спровоцирован ВИЧ-инфекцией или онкологическими процессами. При ВИД повышается частота ОРВИ и кишечных инфекций, болезни хуже поддаются терапии, а выздоровление наступает медленнее. Больных относят к группе длительно и часто болеющих детей. При отсутствии медицинской помощи и коррекции иммунитета возможно отставание в физическом развитии, снижается успеваемость в школе.
Осложнения
При тяжелых первичных иммунодефицитах и отсутствии адекватной терапии смертность достигает 30-50% в первые годы жизни ребенка. Пациенты, которым удалось выжить, зачастую становятся инвалидами из-за последствий инфекционных болезней, неизлечимых злокачественных или аутоиммунных процессов. У большинства детей с ПИД определяются интеллектуальные нарушения разной степени выраженности.
Диагностика
При первом обследовании ребенка иммунолог-аллерголог собирает подробный анамнез о всех перенесенных заболеваниях и полученных прививках, факторах риска беременности и родов, материально-бытовых и экологических условиях проживания. Для обнаружения дефектов иммунного ответа и установления их причин назначают ряд инструментальных и лабораторных методов, основными из которых являются:
- Иммунограмма. Врач оценивает количество Т- и В-лимфоцитов и их соотношение, смотрит на уровни разных типов иммуноглобулинов. Полученные показатели сопоставляются с симптоматикой и данными общеклинических тестов. Для оценки тяжести и течения иммунодефицита выполняют несколько иммунограмм в динамике.
- Анализы крови. Гемограмма показывает признаки воспалительного процесса, по наличию лейкопении судят о недостаточном иммунном ответе. В биохимическом исследовании интересует значение острофазовых белков, протеинограммы. Ставится тест на ВИЧ, ИФА или РИФ на другие специфические инфекции.
- Расширенные тесты. Для выявления клеточного иммунодефицита проводится исследование на Т-рецепторные эксцизионные кольца, серологическое HLA-типирование. Чтобы оценить нарушения фагоцитоза, применяется проточная цитометрия, оценка хемотаксической активности нейтрофилов. Недостаточность системы комплемента определяется с помощью теста CH50.
- Пренатальная диагностика. Многие ПИД удается выявить во время беременности, если у родителей отягощена наследственность. Для пренатального скрининга осуществляют биопсию ворсин хориона, цитологию амниотической жидкости или анализ фетальной крови.
Лечение иммунодефицита у детей
Консервативная терапия
Лечебная схема подбирается с учетом формы патологии, причины и степени ее тяжести. Для большинства вторичных иммунодефицитов основу терапии составляет ликвидация факторов риска и устранение хронических вялотекущих инфекций. Это позволяет нормализовать работу иммунной системы. Лечение первичных иммунодефицитов у детей сложное и комплексное, оно включает 3 основных направления:
- Заместительная терапия. При дефиците гуморального звена рекомендуют длительное и постоянное введение гамма-глобулинов с антителами. Таким образом работа иммунной системы восстанавливается, пациенты доживают до зрелых лет и ведут активный образ жизни.
- Антибиотикотерапия. Лечение противомикробными препаратами применяется для ликвидации основного кинического проявления иммунодефицитов — бактериальных и грибковых инфекций. Чтобы минимизировать риски длительного употребления антибиотиков, показаны пробиотики, антимикотики.
- Иммуномодулирующее лечение. Использование иммуномодуляторов у детей, страдающих первичными иммунодефицитами, не так эффективно, как при вторичных нарушениях иммунитета, но в ряде случаев препараты усиливают эффективность заместительного лечения. Они активируют систему фагоцитоза, нормализуют функции Т-лимфоцитов.
Хирургическое лечение
При нарушении В-клеточной системы иммунитета перспективным методом терапии является пересадка костного мозга. Процедура ликвидирует врожденные аномалии, нормализует выработку и активность лимфоцитов, оказывает пожизненный лечебный эффект. Для коррекции патологии Т-лимфоцитов производят трансплантацию тимуса как основного источника иммунных клеток у детей.
Прогноз и профилактика
Прогноз при иммунодефицитах сомнительный, но раннее начало терапии позволяет скорректировать нарушения и улучшить качество жизни больных. Профилактика ПИД включает медико-генетическое консультирование пар с отягощенным семейным анамнезом, антенатальную охрану плода. Для предупреждения вторичных иммунодефицитов необходимо своевременное лечение инфекционных и соматических заболеваний, устранение негативного влияния неблагоприятных внешних факторов.
1. Первичные иммунодефициты. Актуальные проблемы диагностики и лечения/ Л.Н. Ончул// Здоровье ребенка. — 2015.
2. Введение в клиническую иммунологию и аллергологию. Первичные и вторичные иммунодефицитные состояния. Методические рекомендации/ Е.В. Нусинов. — 2012.
3. Первичные и вторичные иммунодефициты/ Л.М. Карзакова, О.М. Мучукова, Н.Л. Рассказова// В помощь практикующему врачу. — 2008.
Пограничные состояния новорожденных – различные транзиторные изменения со стороны кожных покровов, слизистых оболочек и внутренних органов, развивающиеся у ребенка в первые дни после рождения и отражающие физиологическую перестройку организма. К пограничным состояниям новорожденных относятся родовая опухоль, простая и токсическая эритема, шелушение кожи, милии, физиологическая мастопатия, физиологический вульвовагинит, физиологическая желтуха, физиологический дисбактериоз, физиологическая диспепсия, мочекислый инфаркт и др. Пограничные состояния новорожденных наблюдаются неонатологом и не требуют специального лечения.
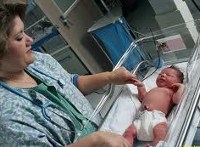
Общие сведения
Пограничные состояния новорожденных – физиологические реакции, отражающие естественную адаптацию организма новорожденного к внеутробному существованию в неонатальном периоде. В педиатрии пограничные состояния новорожденных расцениваются как переходные, транзиторные, которые сохраняются не дольше 3-х недель (у недоношенных младенцев – 4-х недель) и представляют для этого возраста физиологическую норму. В большинстве случаев пограничные состояния новорожденных самостоятельно исчезают к концу неонатального периода, однако, при нарушении адаптивных возможностей организма ребенка, дефектах ухода, неблагоприятных условиях окружающей среды физиологические процессы могут перерастать в патологические, требующие лечения.
Сразу после рождения ребенок попадает в совершенно иные условия существования, нежели те, что окружали его весь период внутриутробного развития. Организм крохи вынужден адаптироваться к значительно более низкой температурной среде; воспринимать зрительные, слуховые и тактильные раздражители; приспосабливаться к новому типу дыхания, питания и выделения и т. д., что ведет к развитию изменений в различных системах организма, т. е. пограничных состояний новорожденных.
Рассмотрим основные пограничные состояния новорожденных: их причины, проявления и патологические процессы, к которым они предрасполагают. О физиологической желтухе новорожденных подробнее можно прочесть здесь.

При неблагоприятных обстоятельствах может развиваться нарушение кардиореспираторной адаптации (кардиореспираторная депрессия) – угнетение жизненно-важных функций в первые минуты и часы жизни.
Физиологическая убыль массы тела
Изменения со стороны кожных покровов
К данной группе пограничных состояний новорожденных относятся простая эритема, токсическая эритема, милии, шелушение кожных покровов.
Под простой эритемой понимают диффузную гиперемию кожных покровов новорожденного, развивающуюся после удаления первородной смазки вследствие адаптации кожи к новым факторам окружающей среды (воздуху, свету и др.). Выраженная гиперемия сохраняется 2-3 дня и полностью исчезает к исходу 1-й недели. По мере исчезновения эритемы развивается мелкопластинчатое или крупнопластинчатое шелушение кожи, более выраженное на груди, животе, ладонях и стопах у детей, рожденных от переношенной беременности. Лечения данных пограничных состояний новорожденных не требуется; на участки обильного шелушения кожи после купания можно наносить стерильное растительное масло или специальную детскую косметику.
Примерно у трети новорожденных на 2-5-й сутки жизни развивается пограничное состояние, расцениваемое как токсическая эритема. При этом на коже появляются эритематозные пятна с пузырьками, содержащими прозрачную серозную жидкость с большим количеством эозинофилов. Излюбленная локализация элементов – кожа в области суставов, груди, ягодиц. Токсическая эритема обычно регрессирует через 2-3 дня, однако может возобновляться в течение первого месяца жизни. Поскольку в основе токсической эритемы лежит аллергическая реакцию на материнские белки, при выраженных проявлениях или затяжном течении педиатр может назначить ребенку обильное питье и прием антигистаминных препаратов.
Милии (милиа, белые угри) после рождения присутствуют у половины новорожденных. Они представляют собой мелкие пузырьки, содержащие молочно-белый или бело-желтоватый секрет. Милии образуются вследствие закупорки выводных протоков сальных желез; чаще располагаются в области носа и лба; исчезают без лечения в течение 1-2 недель.
Неудовлетворительный уход за кожными покровами новорожденного при данных пограничных состояниях может способствовать развитию инфекционных заболеваний кожи.
Гормональный (половой) криз
Эта группа пограничных состояний новорожденных включает физиологический мастит, десквамативный вульвовагинит у девочек, водянку оболочек яичек у мальчиков. Возникновение полового криза у 2/3 новорожденных связано с действием материнских эстрогенов, получаемых плодом в последние месяцы беременности.
Физиологический мастит (мастопатия) – пограничное состояние новорожденных, характеризующееся нагрубанием молочных желез, гиперемий кожи над ними и выделением молозивоподобного секрета. Данное состояние отмечается у большинства девочек и 50% мальчиков; сохраняется с 3-4-го дня до конца 2-3-й недели жизни. Лечение физиологического мастита не проводится; в случае выраженного набухания молочных желез может быть рекомендовано наложение на грудные железы стерильной повязки. Категорически воспрещается надавливание на молочные железы новорожденного из-за опасности развития инфекционного мастита.
Десквамативный вульвовагинит – пограничное состояние новорожденных девочек, сопровождающееся появлением слизистых или кровянистых выделений из половой щели. Выделения отмечаются у 60-70% девочек в первые три дня жизни и продолжаются 1-3 дня. В 5-7% случаев может развиваться метроррагия в объеме, не превышающем 1-2 мл, что связано с прекращением действия эстрогенов матери. Лечение сводится к проведению туалета наружных половых органов девочки.
У 5–10% мальчиков в период новорожденности развивается гидроцеле, которое проходит самостоятельно, без лечения.
Переходные изменения стула
Переходные изменения стула на первой неделе жизни возникают практически у всех новорожденных. К данной группе пограничных состояний новорожденных относятся транзиторный дисбактериоз кишечника и физиологическая диспепсия. После отхождения в первые 1-2 дня мекония (первородного кала), имеющего вид густой вязкой массы темно-зеленого цвета, стул у ребенка становится частым. Переходный стул имеет негомогенную консистенцию с примесью комочков и слизи, окраску с чередованием участков темно-зеленого и желто-зеленого цвета. При исследовании копрограммы обнаруживается большое количество лейкоцитов, слизи, жирных кислот. К концу первой недели стул приобретает гомогенную кашицеобразную консистенцию и более однородную желтую окраску. Одновременно с очищением кишечника происходит его заселение бифидо- и лактофлорой.
Отсутствие выделения мекония может свидетельствовать об атрезии прямой кишки или кишечной непроходимости у новорожденного, что требует немедленной консультации детского хирурга. При нарушении формирования микробного пейзажа кишечника развивается истинный дисбактериоз.
Изменения функции почек
К пограничным состояниям новорожденных, характеризующим адаптацию органов мочевыделительной системы к новым условиям, относят транзиторную олигурию, альбуминурию и мочекислый инфаркт новорожденного.
При транзиторной олигурии, свойственной всем здоровым новорожденным в первые 3 суток жизни, отмечается уменьшение выделения мочи. Причинами данного явления служат снижение поступления в организм жидкости и с особенности гемодинамики.
Отмечаемая альбуминурия (протеинурия) вызвана увеличением проницаемости фильтрационного барьера, капилляров и канальцев почек, усиленным гемолизом эритроцитов.
Патогенез мочекислого инфаркта связан с отложением солей мочевой кислоты в просвете почечных канальцев, что приводит к окрашиваю мочи в красноватый цвет и появлению на пеленках коричнево-красных разводов. При исследовании общего анализа мочи обнаруживаются зернистые и гиалиновые цилиндры, эпителий, лейкоциты. При мочекислом инфаркте необходимо следить за адекватным потреблением жидкости и выделением мочи новорожденным. Если данное пограничное состояние у новорожденного не исчезает самостоятельно, примерно с 10-го дня жизни изменения мочи расцениваются как патологические, требующие консультации детского уролога и проведения УЗИ почек ребенку.
Неблагоприятное протекание данных пограничных состояний новорожденных может послужить основой для последующего развития дисметаболической нефропатии, инфекций мочевыводящих путей, мочекаменной болезни.
Прочие пограничные состояния новорожденных
В числе других пограничных состояний новорожденных, прежде всего, следует рассмотреть транзиторные нарушения теплового обмена – гипотермию и гипертермию. Поскольку рождение ребенка знаменуется переходом в иную окружающую среду, температура которой на 12-15°C ниже внутриутробной, в первый час жизни у новорожденного отмечается транзиторная гипотермия (снижение температуры тела до 35,5-35,8°C и ниже). Через несколько часов температуры тела повышается и стабилизируется.
Кроме этого, к пограничным состояниям новорожденных относят открытый артериальный проток и открытое овальное окно, которые описаны в соответствующих обзорах.
Читайте также:

