Treatment of salmonella with antibiotics
Обновлено: 18.04.2024
Одними из крайне актуальных для летнего сезона возбудителей кишечных инфекций являются сальмонеллы.
Материалы предназначены исключительно для врачей и специалистов с высшим медицинским образованием. Статьи носят информационно-образовательный характер. Самолечение и самодиагностика крайне опасны для здоровья. Автор статей не дает медицинских консультаций: клинический фармаколог — это врач только и исключительно для врачей.
Автор: Трубачева Е.С., врач – клинический фармаколог
Одними из крайне актуальных для летнего сезона возбудителей кишечных инфекций являются сальмонеллы (Salmonella). В отличие от ранее обсуждаемой микрофлоры, сальмонеллы не входят в состав нормальной кишечной микрофлоры и являются фактически абсолютными патогенами, что существенно облегчает диагностику кишечных инфекций, но при этом сами сальмонеллы способны вызывать вспышки внутрибольничных инфекций в стационарах, что делает их карантинными микроорганизмами, за которыми эпидемиологическая служба следить просто обязана.
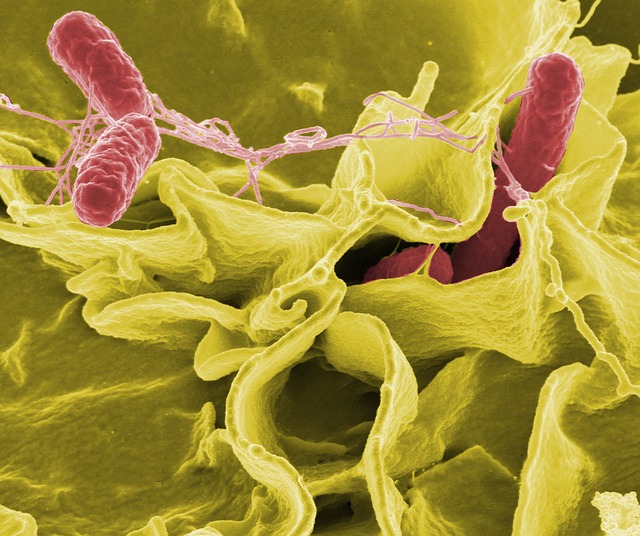
Микробиологические аспекты
- Сальмонеллы – это аэробные грамотрицательные палочки, являющиеся возбудителями энтероколитов или пищевых токсикоинфекций, а также генерализованных процессов с явлениями бактериемии и септицемии. S.typhi,S.paratyphiA и S.paratyphiB являются источником брюшного тифа и паратифа
- Сальмонеллы хорошо растут на стандартных питательных средах, что существенно облегчает микробиологическую диагностику
- Различают тифоидные и нетифоидные сальмонеллы
- Нетифоидные сальмонеллы вызывают пищевые токсикоинфекции, ранее передававшиеся при употреблении мяса домашней птица (в основном утки) и яиц, а ныне большим количеством не всегда предсказуемых способов от инфицированных животных. Основной механизм передачи – фекально-оральный
- Инфицирование S.typhi связано только и исключительно с фекальным заражением воды (так называемые водные вспышки) или продуктов питания больным человеком. Стоит иметь в виду, что существует здоровое носительство, характерное для 3-5% населения и чаще всего у детей первых лет жизни, поэтому может быть и контактно-бытовой путь заражения от подобного носителя.
Клинические аспекты
S.typhi, возбудитель брюшного тифа, колонизирует только и исключительно человека, особенно в бедных странах, что необходимо иметь в виду при сборе анамнеза, так как пациент мог заразится как употребляя небутилированную воду, так и контактным путем. Смертность от заболевания может достигать 15%. Характерно поражение лимфатической системы тонкого кишечника, которая сдерживает генерализованное распространение возбудителя, и в большинстве случаев все ограничивается на уровне язвенного поражения тонкого кишечника.
К серьезным осложнениям брюшного тифа относятся:
- кровотечение из изъязвленных участков кишечника,
- перитонит,
- остеомиелит,
- абсцесс мозга, эндокардит, менингит и абсцессы различных органов (в результате септических отсевов).
Нетифоидные сальмонеллы вызывают пищевые токсикоинфекции при употреблении в пищу зараженных продуктов питания, таких как колбасные изделия, масло, творог, молоко и яйца. Чаще всего выявляется в составе микст-инфекции, например, вместе с C.jejuni. Для клиники характерно развитии симптоматики острого энтероколита.
Помимо кишечных, существуют также и некишечные формы сальмонеллеза:
- Васкулиты
- Остеомиелиты
- Септические артриты
- Менингиты, особенно у новорожденных
- Реактивные артриты
Диагностические аспекты:
Так как сальмонеллез редко возникает в единичном случае, то в диагностике помогают эпидемиологические данные о наличии локальной вспышки.
Золотым стандартом диагностики является обнаружение возбудителя в крови, моче или фекальных массах в зависимости от срока с момента заболевания (особенно это актуально для больных брюшным тифом).
Для брюшного тифа будут характерны следующие признаки:
- инкубационный период от пяти дней до трех недель, во время которых диарея то начинается, то прекращается, возвращаясь с лихорадкой, болью в животе, запорами.
- высокие цифры лихорадки (39-40°С) на фоне недомогания, боли в животе, головной боли.
- диарея может быть, а может и не быть, так как не является типичным признаком заболевания.
- На 10-15-й день может появиться характерная розеолезная сыпь на туловище:
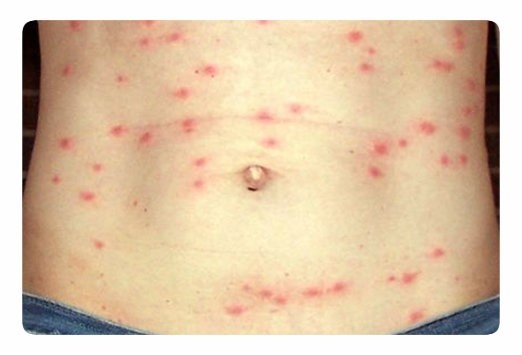
- наличие относительной брадикардии является классическим симптомом заболевания.
- возможно наличие гепато- и спленомегалии
- возможно наличие лейкопении
- прогрессирование инфекции часто ведет к развитию делирия
- переболевшие брюшным тифом остаются заразными еще в течение 5 недель. 10% – в течение 3 месяцев и 3-5% становятся хроническими многолетними носителями
Для пищевой токсикоинфекции будут характерны:
- Инкубационный период от 8 часов до 2-х суток
- Тошнота, рвота
- Диарея с кровью или без нее
- Спазмы в животе
- Отмечается связь с локальной вспышкой заболевания
Аспекты лекарственной терапии
Брюшной тиф:
Пищевые токсикоинфекции:
- Лечение будет зависеть от выявленного возбудителя (не забываем про дифференциальную диагностику, ПТИ может вызвать что угодно, а есть еще диареи путешественников и антибиотик-ассоциированные диареи)
- В случае выявления сальмонеллы и при неосложненном течении, никакого особого, кроме симптоматического, лечения не требуется
- При наличии факторов риска, таких как тяжелое течение, возраст старше 50 лет, наличие поражений сердечных клапанов либо протезирование оных, наличие тяжелого атеросклероза, рака, иммуносупрессии или уремии, можно использовать:
ципрофлоксацин 500 мг дважды в день 5-7 дней либо
цефтриаксон 2 г внутривенно те же 5-7 дней - У пациентов с иммуносупрессией используются те же препараты, но длительность применения увеличивается до двух недель
Профилактические аспекты
Часть из них мы уже упоминали:
- не пить воду непонятного происхождения вне привычного ареала обитания (то есть на любом выезде в отпуск)
- не есть еду непонятного происхождения и приготовленности, особенно это касается продуктов животного происхождения
- перед отпуском просматривать сводки Роспотребнадзора и Ростуризма на предмет эпидемической безопасности. Например, в 2018 году был массовый очаг брюшного тифа, вызванный высокоустойчивым штаммом, в Пакистане, в городе Хайдарабад
И пациентов, подозрительных на возможные сальмонеллезы и брюшной тиф, спрашивать об этом же.
Вакцинация от брюшного тифа крайне рекомендована всем путешественникам, выдвигающимся в бедные и развивающиеся страны, а также путешествующим по сельскохозяйственным районам. Прямо сейчас, когда автор пишет эти строки, в районах подтопления в Иркутской области завершен второй этап иммунизации населения от брюшного тифа и шигеллеза.
На этом небольшой, но крайне важный, особенно в постотпускной период, обзор сальмоннелезов мы и закончим.
Что такое сальмонеллез? Причины возникновения, диагностику и методы лечения разберем в статье доктора Александрова Павла Андреевича, инфекциониста со стажем в 14 лет.
Над статьей доктора Александрова Павла Андреевича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов и шеф-редактор Лада Родчанина

Определение болезни. Причины заболевания
Сальмонеллёз — это острое инфекционное заболевание желудочно-кишечного тракта с возможностью дальнейшей генерализации процесса (распространением заболевания по всему организму). Причина развития сальмонеллёза — различные серотипы бактерий рода Salmonella. К клиническим характеристикам сальмонеллёза относят синдром общей инфекционной интоксикации, синдром поражения желудочно-кишечного тракта (гастрит, энтерит), синдром обезвоживания, гепатолиенальный синдром (увелечение печени и/или селезёнки) и иногда синдром экзантемы (высыпания).
Возбудитель
семейство — кишечные бактерии (Enterobacteriaceae)
род — Сальмонелла (Salmonella)
Существует 7 подвидов (более 2500 сероваров). Наиболее актуальные серовары: typhimurium, enteritidis, panama, london.
Представлены следующей антигенной структурой:
- О-антиген (соматический, термостабильный);
- H-антиген (жгутиковый, термолабильный);
- К-антиген (поверхностный, капсульный);
- Vi-антиген (антиген вирулентности — степень способности штамма вызвать заболевание; является компонентом О антигена);
- М-антиген (слизистый).
К факторам патогенности (механизмам приспособления бактерий) относятся:
- холероподобный энтротоксин — интенсивная секреция жидкости в просвет кишки;
- эндотоксин (липополисахарид) — общее проявление интоксикации;
- инвазия — заражение.
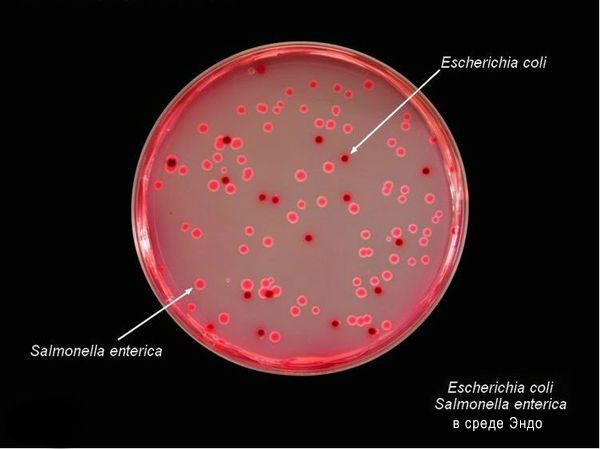
Тинкториальные свойства: разлагают глюкозу и маннит, образовывая кислоту и газ, продуцируют сероводород. Грамм-отрицательные палочки подвижны, спор и капсул не образуют. Растут на обычных питательных средах, образуя прозрачные колонии, на мясо-пептонном агаре с образованием колоний голубоватого цвета, на среде Эндо образуют прозрачные розовые колонии, на среде Плоскирева — бесцветные мутные, на висмут-сульфитном агаре — чёрные с металлическим блеском.
Высокоустойчивы во внешней среде (без агрессивных воздействий), активно размножаются в мясе и молоке (до 20 суток), в воде сохраняют жизнесособность до 5 мес., в почве — до 9 мес., в комнатной пыли — до 6 мес., в колбасе — до 1 мес., в яйцах — до 3 мес., в фекалиях сохраняются до 4 лет. При 56 °C погибают через 3 минуты, при кипячении мгновенно. Сальмонеллы, которые находятся в куске мяса массой 400 гр и толщиной до 9 см, погибают при его варке за 3,5 часа. Соление и копчение оставляет сальмонелл в живых. Воздействие кислот и хлорсодержащих дезинфицирующих средств вызывает их гибель. В последнее десятилетие появились штаммы сальмонелл, устойчивые ко многим антимикробным препаратам. [2] [5]
Эпидемиология
Зооантропоноз, распространённый повсеместно.
Источники инфекции: домашние животные (сами не болеют), птицы, человек (больной и носитель).
Резервуары инфекции и причина эпидемических вспышек сальмонеллеза: грызуны, дикие птицы, тараканы, улитки, лягушки, змеи.
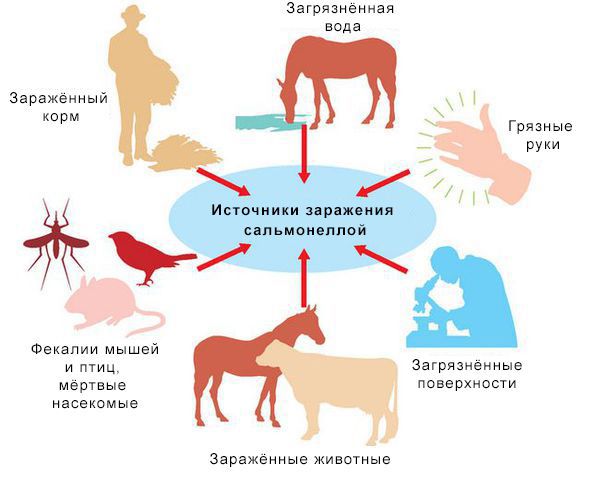
Механизм передачи: фекально-оральный (пути — алиментарный, т. е. через органы ЖКТ, водный, контактно-бытовой). В основном источниками заражения являются птицы, яйца и молочные продукты. Инфицирующая доза 10*5-10*8 микробных тел.
Факторы риска
- детский возраст до 5 лет;
- возраст до 12 месяцев, особенно высока вероятность заболеть без грудного вскармливания;
- иммунодефицит (в основном у младенцев и лиц старше 65 лет, а так же у пациентов с ВИЧ в стадии СПИДа, принимающих иммунодепрессивные препараты);
- регулярный приём препаратов, снижающих кислотность желудка;
- употребление сырого и недостаточно термически обработанного мяса, молочных продуктов и яиц;
- частый контакт с животными с несоблюдением правил гигиены;
- посещение стран с низким уровнем жизни.
В России в 2016 г. заболеваемость была – 26 на 100 тыс. населения, у детей в до 14 лет – 71 на 100 тыс. Для сравнения в США среднегодовая заболеваемость — 15 на 100 тыс. (1,35 миллиона заболеваний, 26 500 госпитализаций и 420 смертей ежегодно). Иммунитет строго типоспецифичен (возможно многократное инфицирование различными штаммами) и непродолжителен [2] [6] [9] [10] .
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы сальмонеллеза
Инкубационный период — от 6 часов (при алиментарном заражении) до 3 суток. При внутрибрюшном заражении (искусственно) — до 8 дней.
Начало заболевания острое (т. е. развитие основных синдромов происходит в первые сутки заболевания).
Salmonella gastroenteritis is usually a self-limiting disease. Fluid and electrolyte replacement may be indicated in severe cases. Because antibiotics do not appear to shorten the duration of symptoms and may actually prolong the duration of convalescent carriage, they are not routinely used to treat uncomplicated nontyphoidal Salmonella gastroenteritis. Current recommendations are that antibiotics be reserved for patients with severe disease or patients who are at a high risk for invasive disease.
Historically, recommended regimens for the treatment of typhoid fever included ampicillin, trimethoprim-sulfamethoxazole, or chloramphenicol. Emerging drug resistance over the past 20 years has limited the usefulness of these antibiotics. Presently, quinolone, macrolide, and third-generation cephalosporin antibiotics are preferred for empiric therapy pending sensitivities. Unfortunately, sensitivity to quinolones has been steadily declining, and these are no longer fool-proof agents for typhoid fever. A growing rate of resistance of nontyphoidal salmonella to nalidixic acid and ceftriaxone has been reported. [46]
Clinical data suggested reduced effectiveness of quinolone therapy in patients with nalidixic acid-resistant Salmonella strains. [47] A study of more than 1000 stored Salmonella isolates from Finland has confirmed earlier data that showed that resistance to nalidixic acid by means of disk diffusion is a sensitive and specific method of screening Salmonella isolates for reduced susceptibility to fluoroquinolones. [48]
Although uncommon in the United States, resistance to quinolone antibiotics among typhoidal and nontyphoidal salmonellae is increasingly common elsewhere. In one 22-year surveillance study in Spain, the prevalence of nalidixic acid resistance increased almost 80-fold to 38.5%.
In a review of US data from the National Antimicrobial Resistance Monitoring System, 58% of S typhimurium isolates isolated between 1997 and 1998 were resistant to at least one antibiotic, and 3 multidrug-resistant strains (resistant to ≥5 antibiotics) accounted for 74% of isolates.
The decline in prevalence of chloramphenicol resistance in many endemic areas has led to reconsideration of its use as an alternative to newer-generation fluoroquinolones or azithromycin.
There are widespread concerns about aplastic anemia with chloramphenicol and dysglycemia with gatifloxacin. In most developed settings, there are also cautions or specific constraints about the use of fluoroquinolones in children and pregnant or nursing mothers, because of potential cartilage toxicities; other adverse effects such as photosensitivity, electrocardiographic abnormalities, and tendinopathies largely affect elderly patients with concomitant problems such as renal impairment. [49]
Azithromycin is likely to be the preferred empirical treatment, often given together with ceftriaxone, in developed countries where chloramphenicol is usually reserved for life-threatening situations, for which no alternatives are available, and physicians are reluctant to use fluoroquinolones in children and lack easy access to gatifloxacin. [49]
In an endemic area such as Nepal, gatifloxacin is as effective as chloramphenicol in ambulatory young patients, and adherence to treatment is improved by the shorter duration and smaller number of tablets in the gatifloxacin regimen. [49]
Salmonella bacteremia is generally treated with a single bactericidal drug for 10-14 days. Given the resistance trends, life-threatening infections should be treated with both a third-generation cephalosporin and a fluoroquinolone until the susceptibilities of antimicrobial agents are known. [2]
If endocarditis or infectious arteritis is documented, urgent surgical treatment is usually necessary. Antimicrobial therapy for endovascular infections should be continued for a minimum of 6 weeks after successful surgery.
Years of therapy might be needed when surgery is not possible (eg, retained prosthetic devices, chronic bone and joint infections). [2]
For proven or possible CNS involvement, high-dose ceftriaxone would be the best choice for optimal penetration of the blood-brain barrier. [2]
Treatment of salmonella infection in pregnancy is controversial, and antibiotic therapy should be reserved for cases of invasive disease, using amoxicillin or cephalosporin. [50] Case reports describe of fetal loss in the setting of disseminated Salmonella infection. [51, 50]
Antibiotics, antidiarrheals, and glucocorticoids are used to treat symptoms and/or documented Salmonella infection.
Antibiotics
Class Summary
Nontyphoid Salmonella gastroenteritis is generally self-limited. In a systematic review, 12 trials showed no significant change in the overall length of the illness or the related symptoms in otherwise healthy children and adults treated with a course of antibiotics for nontyphoid Salmonella disease. Antibiotics tend to increase adverse effects, prolong Salmonella detection in stools, and do not shorten the duration of gastrointestinal symptoms. [50, 51]
The intracellular nature of nontyphoid Salmonella protects against extracellular antibiotics and promotes relapse; however, antibiotic treatment should be considered on a case-by-case basis to include patients with severe symptoms. [52] Antibiotics are currently indicated for infants aged up to 2 months, elderly patients, immunocompromised patients, those with a history of sickle cell disease or prosthetic grafts, patients who have extraintestinal findings, or patients with signs of sepsis. Treatment of at-risk patients should last 2-5 days or until the patient is afebrile. [3]
Salmonella infections are commonly treated with fluoroquinolones or third-generation cephalosporins, such as ciprofloxacin and ceftriaxone.
Enteric or typhoid fever is best treated with antibiotics for 5-7 days for uncomplicated cases and up to 10-14 days for a severe infection. [3] Bacteremia and focal infections may require antibiotics for up to 4-6 weeks depending on the site of infection and serotype of Salmonella. Specific surgical intervention is often necessary in conjunction with antibiotic management. Chronic Salmonella carriers require 1-3 months of oral antibiotics depending on the serotype, susceptibility, and antibiotic used.
Some evidence suggests that fluoroquinolones may be used in children with infections that are difficult to treat. When treating children and pregnant women, note that treatment with fluoroquinolones should be carefully weighed against the possibility of damaging developing cartilage. [53] Ampicillin and amoxicillin have been the classic treatment of choice in pregnancy patients and neonates. [22]
Salmonella antibiotic resistance is a global concern that includes multidrug resistant strains. [20] Overuse, misuse, inappropriate antibiotic prescribing practices, and patient poor compliance lead to a continued increase in multidrug-resistant typhoid fever. [24] Traditional first-line antibiotic medications include ampicillin, chloramphenicol, and trimethoprim-sulfamethoxazole.
Overall global Salmonella Typhi resistance to chloramphenicol, trimethoprim-sulfamethoxazole, and ampicillin is 25.9%, 37.9%, and 38.8%, respectively, per a recent global literature review. Additionally, 35% were found to be multidrug resistant (MDR), defined as resistance to all three medications while 64.7% were nalidixic acid (discontinued in the United States) resistant and 15.0% were ciprofloxacin resistant. Ceftriaxone and azithromycin were found to exhibit 1.3% and 4.5% resistance, respectively. Some regions such as Pakistan (2.6%) exhibit extensive drug resistance (XDR), which is defined as resistance to MDR plus fluoroquinolone and third-generation cephalosporin. [54] Despite the increase in ciprofloxacin resistance in typhoid and paratyphoid, it is still considered the drug of choice by many physicians. In the case of treatment failures, a third-generation cephalosporin and macrolide are good alternatives. [55]
The prevalence of resistance among nontyphoid Salmonella isolates was 3.4% for third-generation cephalosporins in 2004, [56] and the European Committee on Antimicrobial Susceptibility Testing (EUCAST) reported 6% ciprofloxacin resistance in 2015. Fluoroquinolone-resistant Salmonella is listed by the WHO as a priority pathogen for which new antibiotics are needed as of 2017. [57] Patients with antimicrobial-resistant nontyphoidal strains more commonly developed blood stream infections and were admitted to the hospital more often. [58] The reemergence of chloramphenicol-sensitive strains in prior resistant organisms points towards the concept of antibiotic recycling. [20]
In a systematic review, 38 trials showed a reduced clinical relapse rate using fluoroquinolones versus chloramphenicol. [59]
Outbreaks show that a connection may exist between antimicrobial drug treatment and the risk of disease from Salmonella. [59] A mouse model has shown enhanced ability of Salmonella to translocate the intestinal tract more easily in the presence of antibiotics. [12]
Subsequently, stool and blood cultures and sensitivities are important, as susceptibilities not only vary depending on region of the world but also locally. In developing countries such as India, ciprofloxacin continues to be the mainstay of treatment, even though the incidence of resistant strains is increasing. [22] Zinc and probiotic supplements have been shown to reduce the severity and duration of diarrhea. [59]
Ciprofloxacin (Cipro)
Fluoroquinolone with activity against pseudomonads, streptococci, MRSA, S epidermidis, and most gram-negative organisms but has no activity against anaerobes. Inhibits bacterial DNA synthesis and, consequently, growth. Is effective in treatment of long-term carriers of S typhi.
Chloramphenicol
Acts by inhibiting bacterial protein synthesis. Binds reversibly to the 50S subunit of bacterial 70S ribosome and prevents attachment of the amino acid-containing end of the aminoacyl-tran to acceptor site on ribosome. Active in vitro against a wide variety of bacteria, including gram-positive, gram-negative, aerobic, and anaerobic organisms. Well-absorbed from GI tract and metabolized in the liver, where it is inactivated by conjugation with glucuronic acid and then excreted by the kidneys. Oral form is not available in the United States.
Trimethoprim and sulfamethoxazole (Bactrim)
Inhibits bacterial growth by inhibiting synthesis of dihydrofolic acid.
Ceftriaxone (Rocephin)
Third-generation cephalosporin with broad-spectrum, gram-negative activity; lower efficacy against gram-positive organisms; higher efficacy against resistant organisms. Arrests bacterial growth by binding to one or more penicillin-binding proteins.
Azithromycin (Zithromax)
Acts by binding to 50S ribosomal subunit of susceptible microorganisms and blocks dissociation of peptidyl tRNA from ribosomes, causing RNA-dependent protein synthesis to arrest. Nucleic acid synthesis is not affected.
Concentrates in phagocytes and fibroblasts as demonstrated by in vitro incubation techniques. In vivo studies suggest that concentration in phagocytes may contribute to drug distribution to inflamed tissues.
Treats mild-to-moderate microbial infections.
Amoxicillin (Amoxil, Biomox, Polymox, and Wymox)
Interferes with synthesis of cell wall mucopeptides during active multiplication resulting in bactericidal activity against susceptible bacteria.
Ampicillin (Principen)
Broad-spectrum penicillin. Interferes with bacterial cell wall synthesis during active replication, causing bactericidal activity against susceptible organisms. Alternative to amoxicillin when unable to take medication orally.
Demonstrated effectiveness in treatment of gastroenteritis, invasive disease, and enteric fever.
Cefpodoxime (Vantin)
Inhibits bacterial cell wall synthesis by binding to one or more of the penicillin-binding proteins; bacteria eventually lyse because of ongoing activity of cell wall autolytic enzymes while cell wall assembly is arrested.
Bactericidal activity is against gram-positive and gram-negative bacteria.
Cefotaxime (Claforan)
Third-generation cephalosporin with broad gram-negative spectrum, lower efficacy against gram-positive organisms, and higher efficacy against resistant organisms. Arrests bacterial cell wall synthesis by binding to one or more of the penicillin-binding proteins, which in turn inhibits bacterial growth. Used for septicemia and treatment of gynecologic infections caused by susceptible organisms.
Third-generation cephalosporin with gram-negative spectrum. Lower efficacy against gram-positive organisms.
Cefixime (Suprax)
Third-generation oral cephalosporin with broad activity against gram-negative bacteria. By binding to one or more of the penicillin-binding proteins, it arrests bacterial cell wall synthesis and inhibits bacterial growth.
The goals or pharmacotherapy are to eradicate infection, to reduce morbidity, and to prevent complications.
Antibiotics
Class Summary
Empiric antimicrobial therapy must be comprehensive and should cover all likely pathogens in the context of the clinical setting.
Ciprofloxacin (Cipro)
Fluoroquinolone with good activity against Salmonella and most aerobic gram-negative organisms, although resistance is gradually increasing. Poor activity against anaerobes and most gram-positive organisms. Inhibits bacterial DNA topoisomerases.
Azithromycin (Zithromax)
A macrolide antibiotic with enhanced gram-negative activity and a long half-life
Ceftriaxone (Rocephin)
Arrests bacterial growth by binding to one or more penicillin-binding proteins. A third-generation cephalosporin with broad-spectrum activity, although not a preferred anti-staphylococcal agent. Its gram-negative activity is limited against many multiresistant nosocomial organisms.
Trimethoprim and sulfamethoxazole (Bactrim DS, Septra)
Inhibits bacterial growth by inhibiting synthesis of dihydrofolic acid. Antimicrobial activity of TMP-SMZ is broad and includes MRSA, most common UTI and diarrheal pathogens, toxoplasmosis, Isospora species, and Nocardia species, among many others.
Chloramphenicol (Chloromycetin)
Binds to 50S bacterial-ribosomal subunits and inhibits bacterial growth by inhibiting protein synthesis. Effective against gram-negative and gram-positive bacteria. PO formulation unavailable in the United States.
References
Kim AY, Goldberg MB, Rubin RH. Salmonella infections. Gorbach SL, Bartlett JG, Blacklow NR, eds. Infectious Diseases. 3rd ed. Lippincott Williams and Wilkins; 2004. 68.
Hohmann EL. Nontyphoidal salmonellosis. Clin Infect Dis. 2001 Jan 15. 32(2):263-9. [QxMD MEDLINE Link].
Su LH, Chiu CH. Salmonella: clinical importance and evolution of nomenclature. Chang Gung Med J. May-Jun 2007. 30 (3):210-9. [QxMD MEDLINE Link].
Grassl GA, Finlay BB. Pathogenesis of enteric Salmonella infections. Curr Opin Gastroenterol. 2008 Jan. 24(1):22-6. [QxMD MEDLINE Link].
Kurtz JR, Goggins JA, McLachlan JB. Salmonella infection: Interplay between the bacteria and host immune system. Immunol Lett. 2017 Oct. 190:42-50. [QxMD MEDLINE Link]. [Full Text].
Meltzer E, Schwartz E. Enteric fever: an Israeli perspective. Isr Med Assoc J. 2007 Oct. 9(10):736-41. [QxMD MEDLINE Link].
Centers for Disease Control and Prevention (CDC). Notes from the field: Human Salmonella infantis infections linked to dry dog food--United States and Canada, 2012. MMWR Morb Mortal Wkly Rep. 2012 Jun 15. 61(23):436. [QxMD MEDLINE Link].
Yeh Y, Purushothaman P, Gupta N, Ragnone M, Verma SC, de Mello AS. Bacteriophage application on red meats and poultry: Effects on Salmonella population in final ground products. Meat Sci. 2017 May. 127:30-34. [QxMD MEDLINE Link]. [Full Text].
Kore K, Asrade B, Demissie K, Aragaw K. Characterization of Salmonella isolated from apparently healthy slaughtered cattle and retail beef in Hawassa, southern Ethiopia. Prev Vet Med. 2017 Nov 1. 147:11-16. [QxMD MEDLINE Link]. [Full Text].
Crum-Cianflone NF. Salmonellosis and the gastrointestinal tract: more than just peanut butter. Curr Gastroenterol Rep. Aug 2008. 10 (4):424-31. [QxMD MEDLINE Link].
Centers for Disease Control and Prevention. From the Centers for Disease Control and Prevention. African pygmy hedgehog-associated salmonellosis--Washington, 1994. JAMA. 1995 Jul 26. 274(4):294. [QxMD MEDLINE Link].
Mermin J, Hutwagner L, Vugia D, et al. Reptiles, amphibians, and human Salmonella infection: a population-based, case-control study. Clin Infect Dis. 2004 Apr 15. 38 Suppl 3:S253-61. [QxMD MEDLINE Link].
Outbreaks of multidrug-resistant Salmonella typhimurium associated with veterinary facilities--Idaho, Minnesota, and Washington, 1999. MMWR Morb Mortal Wkly Rep. 2001 Aug 24. 50(33):701-4. [QxMD MEDLINE Link]. [Full Text].
Salmonellosis associated with chicks and ducklings--Michigan and Missouri, Spring 1999. MMWR Morb Mortal Wkly Rep. 2000 Apr 14. 49(14):297-9. [QxMD MEDLINE Link]. [Full Text].
Woodward DL, Khakhria R, Johnson WM. Human salmonellosis associated with exotic pets. J Clin Microbiol. 1997 Nov. 35(11):2786-90. [QxMD MEDLINE Link]. [Full Text].
Swanson SJ, Snider C, Braden CR, Boxrud D, Wunschmann A, Rudroff JA, et al. Multidrug resistant salmonella enterica serotype Typhimurium associated with pet rodents. N Engl J Med. January 4, 2007. 356:21-8. [QxMD MEDLINE Link]. [Full Text].
Centers for Disease Control and Prevention. Preliminary FoodNet data on the incidence of infection with pathogens transmitted commonly through food--10 states, 2007. MMWR Morb Mortal Wkly Rep. 2008 Apr 11. 57(14):366-70. [QxMD MEDLINE Link].
Voetsch AC, Van Gilder TJ, Angulo FJ, Farley MM, Shallow S, Marcus R, et al. FoodNet estimate of the burden of illness caused by nontyphoidal Salmonella infections in the United States. Clin Infect Dis. 2004 Apr 15. 38 Suppl 3:S127-34. [QxMD MEDLINE Link].
Cavallaro E, Date K, Medus C, Meyer S, Miller B, Kim C, et al. Salmonella typhimurium infections associated with peanut products. N Engl J Med. 2011 Aug 18. 365(7):601-10. [QxMD MEDLINE Link].
Linam WM, Gerber MA. Changing epidemiology and prevention of Salmonella infections. Pediatr Infect Dis J. 2007 Aug. 26(8):747-8. [QxMD MEDLINE Link].
Crump JA, Luby SP, Mintz ED. The global burden of typhoid fever. Bull World Health Organ. May 2004. 82 (5):346-53. [QxMD MEDLINE Link].
Bhan MK, Bahl R, Bhatnagar S. Typhoid and parattyphoid fever. Lancet. Aug 2005. 366:749-62. [QxMD MEDLINE Link]. [Full Text].
Hathout S el-D. Relation of schistosomiasis to typhoid fever. J Egypt Public Health Assoc. 45. 1970:145-56. [QxMD MEDLINE Link].
Akhaddar A, Hall W, Boucetta M. Subgaleal and brain abscesses due to Salmonella enteritidis following craniotomy for giant cell glioblastoma multiforme: A case report and literature review. Surg Neurol Int. 2019. 10:37. [QxMD MEDLINE Link].
Luciani L, Dubourg G, Graillon T, Honnorat E, Lepidi H, Drancourt M, et al. Salmonella enterica serovar Enteritidis brain abscess mimicking meningitis after surgery for glioblastoma multiforme: a case report and review of the literature. J Med Case Rep. 2016 Jul 7. 10:192. [QxMD MEDLINE Link].
Gardini G, Zanotti P, Pucci A, Tomasoni L, Caligaris S, Paro B, et al. Non-typhoidal Salmonella aortitis. Infection. 2019 Dec. 47 (6):1059-1063. [QxMD MEDLINE Link].
Ikejiri K, Suzuki K, Ito A, Yasuda K, Shindo A, Ishikura K, et al. Invasive Salmonella Enteritidis infection complicated by bacterial meningitis and vertebral osteomyelitis shortly after influenza A infection in an immunocompetent young adult. J Infect Chemother. 2019 Aug 21. pii: S1341-321X(19)30235-1. doi: 10.1016/j.jiac.2019.08.001. [Epub ahead of print]. [QxMD MEDLINE Link].
Fukushima K, Yanagisawa N, Sekiya N, Izumiya H. Bacteremia Caused by Salmonella Poona in a Healthy Adult in Tokyo, Japan. Intern Med. 2019 Sep 18. doi: 10.2169/internalmedicine[Epub ahead of print]:3161-19. [QxMD MEDLINE Link].
Bhutta ZA. Impact of age and drug resistance on mortality in typhoid fever. Arch Dis Child. 1996. 75:214-7. [QxMD MEDLINE Link]. [Full Text].
Ali G, Rashid S, Kamli MA, Shah PA, Allaqaband GQ. Spectrum of neuropsychiatric complications in 791 cases of typhoid fever. Trop Med Int Health. 1997. 2:314-318. [QxMD MEDLINE Link].
Zha L, Garrett S, Sun J. Salmonella Infection in Chronic Inflammation and Gastrointestinal Cancer. Diseases. 2019 Mar 10. 7 (1):28. [QxMD MEDLINE Link].
Gasem MH, Keuter M, Dolmans WM, Van DerVen-Jongekriig J, Djokomoeljanto R, Van Der Meer JW. Persistence of Salmonellae in blood and bone marrow randomized controlled trial comparing ciprofloxacin and chloramphenicol treatment against enteric fever. Antimicrob Agents Chemother. May 2003. 47:1727-31. [QxMD MEDLINE Link]. [Full Text].
Dekker JP, Frank KM. Salmonella, Shigella, and yersinia. Clin Lab Med. 2015 Jun. 35 (2):225-46. [QxMD MEDLINE Link].
Nakamura S, Iida M, Tominaga M, et al. Salmonella colitis: Assessment with double-contrast barium enema examination in seven patients. Radiology. Aug/1992. 184:537-540. [QxMD MEDLINE Link].
Balthazar EJ, Charles HW, Megibow AJ. Salmonella- and shigella-induced ileitis: CT findings in four patients. J Comput Assist Tomogr. May/1996. 20:375-378. [QxMD MEDLINE Link].
Puylaert JB, Van der Zant FM, Mutsaers JA. Infectious ileocecitis caused by Yersinia, Campylobacter, and Salmonella: clinical, radiological and US findings. Eur Radiol. 1997. 7(1):3-9. [QxMD MEDLINE Link].
Shirakava T, Acarya B, Kinoshita S, Kumagai S, Gotoh A, Kawabata M. Decreased susceptibility to fluoroquinolones and gyrA gene mutation in the Salmonella enterica serovar Typhi and Paratyphi A isolated in Kathmandu, Nepal, in 2003. Diagn Microbiol Infect Dis. Apr 2006. 54:299-303. [QxMD MEDLINE Link].
Ercis S, Erdem B, Hasçelik G, Gür D. Nalidixic acid resistance in Salmonella strains with decreased susceptibility to ciprofloxacin isolated from humans in Turkey. Jpn J Infect Dis. 2006 Apr. 59(2):117-9. [QxMD MEDLINE Link]. [Full Text].
Hakanen A, Kotilanien P, Jalava J, et al. Detection of decreased fluoroquinolone susceptibility in Sal.onella and validation of nalidixic acid screening test. J Clin Microbiol. 1999. 37:3572-77. [QxMD MEDLINE Link]. [Full Text].
Beeching NJ, Parry CM. Outpatient treatment of patients with enteric fever. Lancet Infect Dis. 2011 Jun. 11(6):419-21. [QxMD MEDLINE Link].
Coughlin LB, McGuigan J, Haddad NG, Mannion P. Salmonella sepsis and miscarriage. Clin Microbiol Infect. 2003 Aug. 9(8):866-8. [QxMD MEDLINE Link].
Gyang A, Saunders M. Salmonella Mississippi: a rare cause of second trimester miscarriage. Arch Gynecol Obstet. 2008 May. 277(5):437-8. [QxMD MEDLINE Link].
Oskoui R, Davis W, Gomez M. Salmonella aortitis: a report of successfully treated case with a comprehensive review of the literature. Arch Intern Med. Feb 1993. 153:517-25. [QxMD MEDLINE Link].
Nunes AP, Marques A, Marchado C, Meirelaes N, Sobrinho G, et al. Tiphymurium Salmonella Aortitis. Rev Port Cir Cardiotorac Vasc. Jul-Sept 2007. 14:167-71. [QxMD MEDLINE Link].
Fraser A, Goldberg E, Acosta CJ, Paul M, Leibovici L. Vaccines for preventing typhoid fever. Cochrane Database Syst Rev. Jul 2007. 3:CD001261. [QxMD MEDLINE Link].
Szu SC. Development of Vi conjugate - a new generation of typhoid vaccine. Expert Rev Vaccines. 2013 Nov. 12 (11):1273-86. [QxMD MEDLINE Link].
Chen PL, Lee CC, Li CY, et al. A simple scoring algorithm predicting vascular infections in adults with nontyphoid Salmonella bacteremia. Clin Infect Dis. 2012 Jul. 55(2):194-200. [QxMD MEDLINE Link].
Workman MR, Philpott-Howard J, Bragman S, Brito-Babapulle F, Bellingham AJ. Emergence of ciprofloxacin resistance during treatment of Salmonella osteomyelitis in three patients with sickle cell disease. J Infect. 1996 Jan. 32(1):27-32. [QxMD MEDLINE Link].
Berkley JA, Lowe BS, Mwangi I, Williams T, Bauni E, Mwarumba S, et al. Bacteremia among children admitted to a rural hospital in Kenya. N Engl J Med. 2005 Jan 6. 352(1):39-47. [QxMD MEDLINE Link].
Sinha A, Sazawal S, Kumar R, Sood S, Reddaiah VP, Singh B, et al. Typhoid fever in children aged less than 5 years. Lancet. 1999 Aug 28. 354(9180):734-7. [QxMD MEDLINE Link].
Crum-Cianflone NF. Salmonellosis and the gastrointestinal tract: more than just peanut butter. Curr Gastroenterol Rep. Aug 2008. 10 (4):424-31. [QxMD MEDLINE Link].
Miller SI, Pegues DA. Salmonella species, including Salmonella typhi. Mandell, et al, ed. Principles and Practices of Infectious Diseases. 5th ed. 2000. Vol 2: 2344-62.
Schroeder CM, Naugle AL, Schlosser WD, et al. Estimate of illnesses from Salmonella enteritidis in eggs, United States, 2000. Emerg Infect Dis. 2005 Jan. 11(1):113-5. [QxMD MEDLINE Link].
Freeman R, Dabrera G, Lane C, Adams N, Browning L, Fowler T, et al. Association between use of proton pump inhibitors and non-typhoidal salmonellosis identified following investigation into an outbreak of Salmonella Mikawasima in the UK, 2013. Epidemiol Infect. 2015 Oct 1. 1-8. [QxMD MEDLINE Link].
Williams S, Markey P, Harlock M, Binns P, Gaggin J, Patel M. Individual and household-level risk factors for sporadic salmonellosis in children. J Infect. 2015 Sep 28. [QxMD MEDLINE Link].
Rose spots on abdomen of a patient with typhoid fever due to the bacterium Salmonella typhi. Courtesy of CDC/Armed Forces Institute of Pathology, Charles N. Farmer.
Читайте также:

