Триада молчанова при дифтерийном миокардите
Обновлено: 19.04.2024
Проведено ультразвуковое и ангиографическое обследование 75 больных с диагнозами миокардита, подтвержденного данными патоморфологического исследования биоптатов, полученных с помощью прижизненной эндомиокардиальной биопсии.
Установлено, что ремоделирование миокарда является ключевым звеном в патогенезе развития недостаточности кровообращения при миокардите. Данный процесс характеризуется первоначальным поражением левого желудочка с последующим вовлечением правых отделов сердца. Признаки ремоделирования миокарда (изменение геометрии сердца, преобладание дилатации над гипертрофией миокарда) возникают на начальных стадиях миокардита и прогрессируют на стадии хронического воспаления.
Ключевые слова: миокардит, недостаточность кровообращения, ремоделирование миокарда.
Одним из осложнений многих заболеваний сердечно-сосудистой системы является сердечная недостаточность. Несмотря на снижение смертности от сердечно-сосудистых заболеваний (ССЗ) в развитых странах, в настоящее время отмечается стойкая тенденция к увеличению показателей смертности от недостаточности крообращения (НК).
Целью нашего исследования была оценка еще одного звена в патогенезе развития НК - ремоделирования сердца при миокардитах.
Материал и методы исследования
Было проведено исследование 75 больных с диагнозом острого и хронического миокардита (средний возраст 46+/-2 года). Диагноз был выставлен на основании данных анамнеза, клинических и инструментальных методов исследований. У всех больных было проведено ЭКГ в 12 отведениях на аппарате Cardimax FX - (Япония), тредмил тест - с помощью прибора фирмы Siemens (Германия), эхокардиография в секторальном режиме и М-эхо с цветной допплерографией (Aloka, Япония). Для анализа активности ренина и уровня альдостерона использовали радиоиммунный метод, коронарографию и рентгеноконрастную вентрикулографию выполняли на ангиографической установке Siemens (Германия), эндомиокардиальную биопсию из левого желудочка проводили в момент ангиографии. Патоморфологическое изучение биоптатов с использованием электроннооптической микроскопии и гистохимического анализа с моноклональными антителами проводилось в лаборатории патоморфологии г. Кишинева (Республика Молдова) и лаборатории экспериментальной кардиологии Bad-Nauheim (Германия).
Результаты исследования
Согласно классификации сердечной недостаточности (NYHA) больных разделили на 2 группы: 1 гр. - 39 пациентов (52%) II ф.к. и 2 гр. - 36 больных (48%) III ф.к. Как видно из данных, приведенных в таблице 1, прогрессирование НК характеризовалось увеличением размеров левого желудочка, снижением фракции выброса, степени укорочения, увеличением массы миокарда левого желудочка и конечного диастолического давления левого желудочка.
Таблица 1
Показатели центральной гемодинамики у больных миокардитом с НК (М+/-m)
| Показатели | II ф.к. (NYHA) | III ф.к. (NYHA) | Норма |
| ДДЛЖ (мм) | 62+/-1,4* | 69+/-1,4* | 48+/-5,0 |
| СДЛЖ (мм) | 46+/-1,3* | 54+/-1,3* | 35+/-4 |
| СУ (%) | 20+/-3,4* | 15+/-2,3* | 30+/-3 |
| ФВ (%) | 43+/-4,2* | 32+/-4,2* | 67+/-6 |
| УО(мл) | 94+/-8* | 142+/-9* | 70+/-8 |
| МО (л/мин) | 7,2+/-0,9 | 8,8+/-0,9* | 5,2+/-1 |
| КДДЛЖ (мм рт.ст.) | 18,4+/-4,6 | 22,7+/-5,2* | 12+/-4,4 |
| ИММ (г/м 2 ) | 157+/-21 | 223+/-25* | 109+/-20 |
ДДЛЖ - диастолический диаметр левого желудочка;
СДЛЖ -систолический диаметр левого желудочка;
СУ - степень укорочения;
ФВ - фракция выброса;
УО - ударный объем;
МО - минутный объем;
КДДЛЖ - конечное диастолическое давление левого желудочка;
ИММ - индекс массы миокарда.
Одновременно со снижением ФВ (с 43% до 32%) нами отмечено увеличение такого показателя, как ударный объем, тогда как минутный объем достоверно увеличивается только у больных с НК III ф.к. Это объясняется увеличением частоты сердечных сокращений в покое при прогрессировании сердечной недостаточности (76,7+/-15,4 и 84,6+/-16,2 уд/мин, соответственно). Выявлена прямая корреляция (r=0,86) показателей систолической функции ЛЖ - степени укорочения с фракцией выброса и обратная корреляция (r=0,78) с систолическим объeмом ЛЖ (р<0,05). Прогрессирование дилатации левого желудочка было прямо связано с величиной параметров конечно-диастолического миокардиального стресса, обусловленного, в первую очередь, КДД ЛЖ.
Изменение диастолического объема левого желудочка прямо коррелировало с уровнем КДД ЛЖ (r=0,88), (р<0,05).
Увеличение КДД ЛЖ сопровождалось прогрессированием НК, появлением типичной ее клинической картины и явными признаками застоя в малом круге кровообращения, изменениями структуры легочной ткани и нарушением газообмена.
Прогрессирование НК сопровождалось достоверным увеличением индекса массы миокарда и конечно-систолического миокардиального стресса (26+/-0,8 Ра и 22,8+/-0,6 Ра (р<0,05).
Одновременно с вышеуказанными нарушениями центральной гемодинамики у больных миокардитом отмечались изменения геометрии сердца. Согласно данным ЭхоКГ, преобладало диффузное поражение миокарда (67%), региональное нарушение сократимости отмечено только в 33% случаев. Форма левого желудочка имела тенденцию к трансформации в сферическую. При этом отмечалось ухудшение как систолических, так и диастолических показателей сферичности левого желудочка (табл. 2).
Коэффициент корреляции индексов сферичности и функционального класса сердечной недостаточности у больных с миокардитом составлял 0,75 (р<0,05).
Прогрессирование НК сопровождалось изменением другого параметра, характеризующего геометрию сердца - 2 H/D. Этот показатель отражает динамику изменения отношения толщины стенки левого желудочка (Н) к его диастолическому диаметру (D). Прирост функционального класса НК сопровождался уменьшением этого показателя. У больных с НК II ф.к. он был равен 0,35+/-0,02, у пациентов с НК III ф.к. - 0,31+/-0,02 (р<0,05). Коэфициент корреляции 2H/D с функциональным классом НК составлял 0,68 (р<0,05).
Таблица 2
Показатели сферичности левого желудочка в зависимости от функционального класса сердечной недостаточности
| Показатели | II ф.к. (NYHA) | III ф.к. (NYHA) |
| Диастолическая сферичность | 0,86+/-0,03 | 0,89+/-0.04 |
| Систолическая сферичность | 0,84+/-0,04 | 0,8+/-0,04 |
Таким образом, у больных миокардитом процесс ремоделирования миокарда протекает согласно общим закономерностям, характерным для пациентов с некоронарогенным поражением сердца. Неблагоприятный фактор преобладания скорости дилатации левого желудочка над процессами гипертрофии миокарда приводит к изменению конфигурации левого желудочка с преобладанием сферичной формы над эллипсоидной, что является одним из основных компонентов в развитии НК. При этом полученные данные демонстрируют, что у пациентов с НК III ф.к. изменения гемодинамических параметров, геометрии сердца были более выражены, чем у пациентов с НК II ф.к. По данным ЭхоКГ увеличение правых отделов сердца было отмечено у 78% больных миокардитом. Как правило, отмечалось одновременное увеличение правого предсердия (в среднем 44+/-0,8 мм) и правого желудочка (в среднем 28+/-1,2 мм). Коэффициент корреляции между параметрами изменения правых и левых отделов сердца составлял 0,87 (р<0,05). Таким образом, можно предположить, что повреждение миокарда при миокардите носит двухсторонний характер и приводит к право- и левосторонней НК.
Таблица 3
Показатели гемодинамики у больных с острым (ОМ) и хроническим миокардитом (ХМ) (М+/-m)
| Показатели | ОМ n=36 | ХМ n=39 |
| ЛП (мм) | 46+/-0,8 | 48+/-0,7* |
| ДДЛЖ (мм) | 61+/-1,4 | 65+/-1,6* |
| СДЛЖ (мм) | 49+/-1,0 | 55+/-1,2* |
| СУ (%) | 19+/-0,9 | 17+/-1,0 |
| ФВ (%) | 39,0+/-2,0 | 36+/-2,7* |
| ТМЖП (мм) | 11+/-0,2 | 11+/-0,2 |
| ТЗСЛЖ (мм) | 10+/-0,2 | 11+/-0,2 |
| ПЖ (мм) | 28+/-0,6 | 29+/-1,0 |
| ПП (мм) | 42+/-0,9 | 46+/-1,2* |
| ИММ (г/м 2 ) | 177+/-13 | 185+/-15 |
При разделении пациентов по длительности воспалительного процесса, нами отмечено более выраженное ухудшение показателей центральной гемодинамики у больных с хроническим миокардитом (табл. 3).
Изучение показателей ренин-ангиотензин-альдостероновой системы у исследуемых больных продемонстрировало, что при остром миокардите активность ренина была меньше, чем при хроническом (1,7+/-0,1 нг/мл/час и 2,0+/-0,1 нг/мл/час, р<0,05). Изменения уровня альдостерона имели такую же тенденцию (92+/-23 пг/мл и 126+/-29 пг/мл), однако отличия были статистически недостоверны (р>0,05).
Поражение мышцы сердца при миокардите происходит, чаще всего, вследствие токсического воздействия вирусного агента. При этом происходит не только гибель кардиомиоцитов [1], но и такие явления, как ускорение апоптоза [5], активизация фагоцитарной функции лейкоцитов, макрофагов с выделением цитотоксина TNFcc [3], являющегося одним из факторов с негативным инотропным эффектом и способностью стимулировать гипертрофию кардиомиоцитов. Одновременно, при миокардите в биоптатах обнаруживается повышенный уровень энзима конверсии ангиотензина и ангиотензина II, который обладает вазоконстриктивным эффектом и стимулирует развитие коллагена [8]. Микротромбоз, обнаруживаемый в капиллярном русле, приводит к диффузной ишемии миокарда. Весь этот комплекс изменений вызывает прогрессирующую дилатацию сердца, ведет к систолической и диастолической дисфункции, ухудшению насосной функции сердца. Появление и прогрессирование сердечной недостаточности при миокардите, как продемонстрировано и в нашем исследовании, сопровождается изменением конфигурации сердца, которая становится более сферичной. Ранее аналогичные данные были получены при изучении процессов ремоделирования сердца у больных с постинфарктным кардиосклерозом [9]. При этом, несмотря на прогрессирующее увеличение массы миокарда, процессы дилатации преобладают над процессами гипертрофии. Ремоделирование миокарда является бивентрикулярным процессом, паралельно вовлекающим левый и правый желудочки с едиными патофизиологическими механизмами.
Как видно из полученных данных, можно заключить, что, в основном, ремоделирование миокарда, а не сократительная дисфункция мышцы сердца, является ключевым фактором развития хронической сердечной недостаточности. При этом, первые признаки ремоделирования возникают на этапе первичного поражения миокарда. Другие звенья прогрессирующей сердечной недостаточности (активизация нейрогуморальной системы, вазоконстрикция) возникают уже при хронизации воспалительного процесса на стадии выраженного нарушения диастолической и систолической функции миокарда.
Заключение
1. Первичное повреждение миокарда приводит к нарушению сократительной функции миокарда с включением всех патофизиологических механизмов развития сердечной недостаточности.
2. Ремоделирование миокарда является ключевым звеном в патогенезе развития недостаточности кровообращения при миокардите и характеризуется поражением левого желудочка с последующем вовлечением в процесс правых отделов сердца.
3. Изменение формы сердца от эллипсоидной к более сферичной сопровождается преобладанием дилатации над гипертрофией миокарда. Признаки ремоделирования миокарда возникают уже на начальных этапах воспалительного процесса и усугубляются на хронической стадии миокардита.
ЛИТЕРАТУРА
1. Anversa P., Kajstura J., Olivetti G. Myocyte death in heart failure. // Current opinion in Cardiology, 1996, №11, p. 245-251.
2. Barry W.H. Mechanisms of immune mediated myocyte injury. // Circulation. -1994, -V.89.-N5., p.2421-2432.
3. Bristow M. Tumor Necrosis Factor - a and Cardiomyopathy. // Circulation. -1998, -v.97, p.l340-1341.
4. Freude B., Masters T.N., Kastins et al. Cardiomyocyte apoptosis in acute and chronic conditions. // Basic Res.Cardiol. -1998, v.93, p.85-89.
5. Friman G., Wesslen L., Fohiman S. et al. The epidemiology of infections myocarditis lymphacytic myocarditis and dilated cardiomyopathy. // Europ. Heart. J. -1995,- v.l6, suppl.O, p.36-42.
8. Sharpe N., Doghty R.N. Left ventricular remodelling and improved long-term outcomes in chronic heart failure. // Europ. Heart. J. -1998, -v.l9, (suppl.B), В 36-B 39.
Abstract
We have studied 75 patients with a verified pathologically (by means of endomyocardial biopsy) myocarditis with the usage of ultrasound and angiography.
We have found myocardial remodeling to be the key process in the development of heart failure in myocarditis. The process is characterized by the initial involvement of the left ventricle with the later influence upon the right heart. Remodeling patterns (altered heart geometry, dilation dominating over myocardial hypertrophy) are assessable on the early stages and an subject to further progress.
Key words: myocarditis, heart failure, myocardial remodeling.
Для цитирования: Сорокин Е.В., Карпов Ю.А. Миокардиты в клинической практике: современные представления о старой болезни. РМЖ. 2001;10:423.
Институт кардиологии им. А.Л. Мясникова РКНПК МЗ РФ, Москва
Д иагностика и лечение миокардитов по-прежнему остается одним из наиболее сложных разделов работы терапевтов и кардиологов. Трудности сохраняются, несмотря на то, что воспаление миокарда в качестве причины хронического сердечного заболевания известно еще со времен французского патолога Corvisart (1806 г.), указавшего, что постоянное воспаление сердца ведет к прогрессирующей сердечной недостаточности и смерти. Весьма либеральное использование клиницистами термина “миокардит” в начале XX века (в частности, Osler причислял к миокардитам гипертрофию левого желудочка, дилатацию сердца, коронарную болезнь сердца и аневризмы) дало повод для неоправданно произвольного отнесения к миокардитам многих невоспалительных заболеваний сердца.
Для лучшего понимания современных представлений о миокардитах эту главу кардиологии, по-видимому, можно разделить на 2 части – воспалительное поражение миокарда в рамках инфекционных и некоторых неинфекционных заболеваний и воспалительная кардиомиопатия, которая по недавно пересмотренной классификации кардиомиопатий (ВОЗ, 1995) определена, как “миокардит, ассоциированный с дисфункцией сердца”.
Миокардит, как воспалительное заболевание миокарда при инфекционных и аутоиммунных заболеваниях, чаще всего протекает без выраженных кардиальных симптомов, а нередко и бессимптомно, как правило, доброкачественно, и не требует активного специфического лечения. Однако в небольшом числе случаев миокардит может сопровождаться выраженными клиническими симптомами и приводить к самым тяжелым последствиям – сердечной недостаточности и смерти.
Механизмы поражения миокарда
Поражение миокарда встречается практически при любых инфекциях – вирусных, бактериальных, грибковых, риккетсиозных, паразитарных. Однако, клинически наиболее важными причинами инфекционного миокардита являются возбудители, указанные в таблице 1. Инфекционные агенты могут вызывать повреждение кардиомиоцитов одним или более из 4 механизмов:
1. Прямое миокардиоцитолитическое действие вследствие миокардиальной инвазии и репликации возбудителя.
2. Клеточное повреждение циркулирующими токсинами при системной инфекции.
3. Неспецифическое клеточное повреждение вследствие генерализованного воспаления.
4. Клеточное повреждение вследствие продукции специфическими клетками или гуморальной иммунной системой факторов в ответ на воздействующий агент или вызванный неоантигенами.
Последний механизм, запущенный антигеном, как инициирующим агентом, в дальнейшем поддерживается вновь вырабатываемыми аутоантигенами или антигенами миоцитов, которые гомологичны инициирующим антигенам. Это является основой для продолжающейся иммунной стимуляции повреждения. Вероятно, что описанный механизм является обычным вариантом повреждения миокарда, а его активность сохраняется долгое время после “инактивации” инициирующего агента. По-видимому, именно таким путем развиваются вирусные миокардиты.
Распространенность
Абсолютная частота миокардитов неизвестна, поэтому можно ориентироваться лишь на частоту их выявления при различных заболеваниях. Например, при дифтерии миокардит встречается в 20-30% случаев, летальность у таких больных достигает 60%. Весьма часто поражения миокарда различной степени тяжести встречаются при коллагенозах. Сообщалось о поражении сердца при системной красной волчанке – до 8% случаев, при ревматоидном артрите – 4-30% случаев (чаще у женщин). У ВИЧ-инфицированных лиц поражение миокарда встречается довольно часто – в 20-50% случаев, и бывает проявлением саркомы Капоши, сопутствующих грибковых и бактериальных инфекций.
Относительно редким вариантом заболевания является гигантоклеточный миокардит, который развивается преимущественно у людей молодого и среднего возраста, быстро прогрессирует и заканчивается, как правило, летально. Считают, что гигантоклеточный миокардит – аутоиммунное заболевание, вызванное нарушением функции Т-лимфоцитов. Сообщалось о случаях гигантоклеточного миокардита при тимоме, системной красной волчанке, тиреотоксикозе. Предполагалась его связь с туберкулезом, саркоидозом и сифилисом, однако эти гипотезы остаются неподтвержденными. Точная диагностика гигантоклеточного миокардита возможна только при морфологическом исследовании миокарда.
Клинические признаки
Диагноз миокардита в большинстве случаев основан на неспецифических клинических признаках. Спектр клинических проявлений при инфекционном миокардите варьирует от минимальных симптомов до острой и крайне тяжелой сердечной недостаточности на фоне миокардиального некроза.
Самые распространенные жалобы при миокардитах – лихорадка, слабость, утомляемость, одышка, сердцебиение, нарушения ритма сердца. Довольно часто встречаются дискомфорт и разнообразные боли в грудной клетке, которые, в отличие от стенокардии, редко провоцируются физической нагрузкой.
При физикальном исследовании обычно обнаруживают тахикардию, непропорциональную тяжести лихорадки, приглушенность I сердечного тона, систолический шум на верхушке сердца (диастолические шумы при миокардите встречаются редко) и артериальную гипотонию. В тяжелых случаях заметны обычные признаки сердечной недостаточности – периферические отеки, кардиомегалия, асцит, застойные хрипы в легких и т.д. Хотя при миокардите физикальный осмотр редко позволяет выявить специфические признаки, в отдельных случаях удается заподозрить определенную инфекцию (табл. 2). Например, при инфицировании вирусом Коксаки В нередко выявляют сопутствующие плевродинию (боль при раздражении плевры), лимфаденопатию, спленомегалию и орхит. В то же время детальное физикальное исследование может оказать существенную помощь в выявлении основного заболевания, в рамках которого развился миокардит (особенно коллагенозов и кожных проявлений аллергических реакций).
Инструментальные и лабораторные исследования
На ЭКГ, помимо тахикардии, весьма часто обнаруживают различные нарушения ритма и проводимости, а также неспецифические изменения сегмента ST и зубца Т. Различные изменения ЭКГ часто выявляются при миокардите и служат обычно для “подтверждения” диагноза. При ультразвуковом исследовании сердца иногда обнаруживают нарушение систолической и диастолической функции желудочков различной тяжести, а в редких случаях можно обнаружить и нарушение локальной сократимости. В целом, ценность эхокардиографии при подозрении на миокардит состоит, главным образом, в исключении других возможных причин ухудшения состояния больного.
На , помимо тахикардии, весьма часто обнаруживают различные нарушения ритма и проводимости, а также неспецифические изменения сегмента ST и зубца Т. Различные изменения ЭКГ часто выявляются при миокардите и служат обычно для “подтверждения” диагноза. При ультразвуковом исследовании сердца иногда обнаруживают нарушение систолической и диастолической функции желудочков различной тяжести, а в редких случаях можно обнаружить и нарушение локальной сократимости. В целом, ценность эхокардиографии при подозрении на миокардит состоит, главным образом, в исключении других возможных причин ухудшения состояния больного.
Выделить возбудитель миокардита (особенно вирусного) удается крайне редко. Предполагалось, что диагностически значимым будет повышение титра вирус-нейтрализующих антител в плазме в 4 и более раза, однако клиническая значимость этого метода пока не доказана. Кроме того, воспалительные и некротические изменения миокарда выявляют с помощью сцинтиграфии с Ga67 и антимиозиновых антител, меченных In111. Аналогичными возможностями обладает магнитно-резонансно-томографическое исследование сердца. Однако ценность данных методов для клинической практики также трудно считать доказанной.
Доказательством мионекроза может быть повышение в плазме активности креатинфосфокиназы и концентрации тропонина I. Чувствительность в диагностике миокардита недавно предложенного определения уровня сердечного тропонина I достигает 34%, специфичность – 89%, положительная диагностическая значимость – 82%.
Развитие методов катетеризации сердца и трансвенозной эндомиокардиальной биопсии сделали возможной прижизненную диагностику миокардита. Однако, несмотря на техническую простоту метода (в современных условиях биопсию миокарда можно повторять неоднократно), в интерпретации результатов имеется немало сложностей. Только в 1986 г. были согласованы рекомендации гистологической диагностики миокардита, получившие название “Далласские критерии” (табл. 3).
При миокардитах данные гистологического исследования миокарда обычно малоспецифичны, за исключением случаев гигантоклеточного миокардита, некоторых гранулематозных и паразитарных поражений сердца. Обычно удается выявить воспалительную инфильтрацию миокарда различными клетками. Считают, что при бактериальных миокардитах в составе инфильтрата преобладают полиморфноядерные нейтрофилы, при аутоимунных поражениях – эозинофилы, при вирусных – лимфоциты. Помимо инфильтрации, в ходе гистологического исследования иногда удается выявить признаки дистрофии и даже участки некроза кардиомиоцитов.
Диагноз и дифференциальный диагноз
Учитывая разнообразие возможных причин воспалительного поражения сердца, диагностика миокардитов – непростая задача. Способность заподозрить миокардит в определенной клинической ситуации может оказаться наиболее эффективным диагностическим инструментом врача. В диагностический поиск обязательно включают тщательный анализ анамнеза заболевания, уделяя особое внимание связи кардиальных симптомов с предшествующими эпизодами респираторных, вирусных и бактериальных инфекций и неясной лихорадки, всевозможным аллергическим реакциям, контактам с токсичными веществами, пищевыми отравлениями, высыпаниям на коже, облучением, поездками в другие страны. Поскольку многие медикаментозные препараты кардиотоксичны, следует уделить самое пристальное внимание расспросу о всех принимаемых лекарственных средствах, в том числе наркотических.
Дифференцируя хронический миокардит с дилатационной кардиомиопатией, следует учитывать наличие общих симптомов воспаления (лихорадка, лейкоцитоз, увеличение СОЭ) и появление симптомов воспаления и аутоиммунного поражения других органов (артралгии, миалгии, плеврит, нефрит). При дифференциальном диагнозе миокардита с ишемической кардиомиопатией и постинфарктным кардиосклерозом с выраженными клиническими проявлениями недостаточности кровообращения следует обращать внимание на характер болевого синдрома в грудной клетке, его связь с физической нагрузкой и реакцию на прием коронарных вазодила торов (нитраты, антагонисты кальция), сопутствующие симптомы воспаления (см. выше), наличие стенокардии и инфаркта миокарда в анамнезе. Выявление признаков рубцовых изменений на ЭКГ в этой ситуации может с равной вероятностью указывать как на перенесенный ранее инфаркт миокарда, так и на миокардит. Недавно было продемонстрировано, что выявление при ультразвуковом исследовании сонных артерий атеросклеротических бляшек либо толщины интимы-медии >1 мм указывает на атеросклероз коронарных артерий с 96% чувствительностью и 86% специфичностью. В сложных случаях проводят коронароангиографию и биопсию миокарда.
Окончательно диагноз миокардита может быть подтвержден только гистологически. Однако поскольку гистологические данные могут весьма значительно варьировать, существенное значение имеют позитивные результаты обнаруженного воспаления. В настоящее время имеет смысл обязательно проводить эндомиокардиальную биопсию лишь у больных с крайне неблагоприятным течением заболевания (чаще всего это гигантоклеточный миокардит), либо при неэффективности проводимой терапии. В то же время следует помнить, что клиническую значимость данных биопсии и в этих случаях не стоит абсолютизировать.
Особенности лечения
Острый миокардит, сопутствующий вирусным инфекциям, зачастую протекает малосимптомно, не диагностируется и имеет благоприятный прогноз даже при обычной неспецифической поддерживающей и общеукрепляющей терапии (постельный режим с постепенной активизацией, дезинтоксикационная и общеукрепляющая терапия, витамины, антигистаминные средства). После периода постельного режима физические нагрузки ограничивают до исчезновения клинических симптомов заболевания, нормализации размеров сердца и показателей его функции. Антибиотики, как правило, существенной роли в лечении миокардитов небактериального происхождения не играют, а при аллергических реакциях и аутоимунных нарушениях их применение бывает небезопасным.
Недостаточность кровообращения лечат по общеизвестным правилам (ингибиторы АПФ, диуретики, b-адреноблокаторы и антагонисты альдостерона по показаниям). Сердечные гликозиды при миокардитах следует назначать очень осторожно, поскольку в острой стадии заболевания их передозировка наступает быстрее, а побочные эффекты гораздо более выражены – даже при использовании небольших доз. В тех случаях, когда необходима профилактика тромбоэмболий, назначают прямые (лучше – низкомолекулярные гепарины) и непрямые антикоагулянты. Однако прежде следует убедиться в отсутствии сопутствующих инфекционного эндокардита и перикардита. При нарушениях ритма сердца показано применение антиаритмических препаратов.
Вопреки вполне обоснованным ожиданиям (механизмы развития болезни, экспериментальные данные и клинические наблюдения), убедительных доказательств благоприятного влияния на исход миокардитов противовирусных и нестероидных противовоспалительных средств, а также иммунодепрессантов не получено.
Считается, что кортикостероиды следует применять только при наличии активности воспалительного процесса и явной неэффективности мероприятий по лечению сердечной недостаточности, иногда вместе с иммунодепрессантами (азатиоприном и циклоспорином А). В то же время следует помнить, что имеющиеся данные об эффективности иммунодепрессантов при миокардитах малоубедительны, поскольку уменьшение морфологических признаков воспаления далеко не всегда сопровождается улучшением клинического состояния и прогностически важных показателей. В частности, американским исследователям не удалось продемонстрировать преимущества комбинации преднизолона с циклоспорином перед плацебо в ходе лечения миокардитов (исследование American Myocarditis Treatment Trial). Тем не менее в последнее время появляются данные о перспективности применения иммунодепрессантов при гигантоклеточном миокардите и поражении миокарда при СПИДе. Если медикаментозное лечение не позволяет предотвратить нарастание сердечной недостаточности, средством выбора остается трансплантация сердца.
В тех случаях, когда удается выявить причину миокардита, наряду с симптоматической и общеукрепляющей терапией назначают этиотропное лечение (таблица 4 и 5).
Надежды в лечении миокардитов связаны с разработкой новых средств с противовирусными и иммунодепрессантными свойствами. В настоящее время проводится сравнительное рандомизированное исследование лечения миокардита муромонабом-CD3, циклоспорином А и глюкокортикоидами. Кроме того, исследуется эффективность стимуляторов синтеза интерферона.
Течение вирусных миокардитов
Бессимптомные миокардиты обычно заканчиваются полным выздоровлением или трансформируются в кардиомиопатию, нередко после длительного латентного периода (рис. 1). Однако доказанность безусловного влияния перенесенного вирусного миокардита и наблюдающихся в дальнейшем иммунологических изменений на патогенез дилатационной (воспалительной) кардиомиопатии нельзя считать абсолютной.
Рис. 1. Течение вирусных миокардитов (схема)
Острые миокардиты, как правило, протекают благоприятно и заканчиваются полным выздоровлением даже без лечения, хотя известны случаи летальных исходов. Появление симптомов выраженной сердечной недостаточности при остром миокардите не обязательно указывает на неблагоприятный исход или означает переход в хроническую фазу. В большинстве таких случаев лабораторные, ультразвуковые и гистологические показатели нормализуются в течение месяца. Вместе с тем, исходом может быть прогрессирующая дилатация полостей сердца с развитием хронической сердечной недостаточности, что и определяет дальнейший прогноз выживаемости и трудоспособности.
Результаты нескольких небольших работ указывают, что через несколько лет после острого миокардита выраженные симптомы поражения сердца (в основном, сердечная недостаточность) имелись у 15% больных, что, впрочем, может быть даже завышено по сравнению с общей популяцией.
Амиокордин (торговое название)
1. Braunwald E., Editor. Heart Disease. Textbook of Cardiovascular Medicine. 5th edition. W.B.Saunders Company, 1998
2. Гуревич М.А. “Проблема некоронарогенных заболеваний миокарда в клинической практике” РМЖ, 1998, т,6, №24, С.1523-1531
5. Миокардит и дилатационная кардиомиопатия. Редакционная статья. “Клиническая фармакология и терапия”. 1999; 8 (4): 3-7
6. Smith S.C., Ladenson J.H., Mason J.W., et al “Elevations of cardiac troponin I associated with myocarditis” Circulation 1997; 95: 163-168
7. Cuffe M.S. “The heart and infectiuos disease”. In: Topol E. et al., Editors. “Cardiovascular Medicine”. Lippincott. 1998. P.932-946
8. Cooper L.T. Jr. “Giant cell myocarditis: diagnosis and treatment”. Herz 2000 May;25(3):291-298.
9. Hufnagel G., Pankuweit S., Richter A., et al “The European Study of Epidemiology and Treatment of Cardiac Inflammatory Diseases (ESETCID). First epidemiological results”. Herz 2000 May;25(3):279-285
10. Mason J.W, O’Connell J.B., Herskowitz A., et al “A clinical trial of immunosuppressive therapy of myocarditis The Myocarditis Treatment Trial investigators” New Eng J Med, 1995; 333: 269-275
11. Angelini A, Carzolari V, Colabrese F, et al “Myocarditis, mimicking acute myocardial infarction: role of endomyocardial biopsy in the differential diagnosis” Heart, 2000; 84:245-250
12. Arets HT, Billingham ME, Edwards WD, et al “Myocarditis: a histopathologic definition and classification” Am J Cardivasc Pathol, 1987; 1: 3-14
Что такое миокардиодистрофия? Причины возникновения, диагностику и методы лечения разберем в статье доктора Мадоян М. А., терапевта со стажем в 21 год.
Над статьей доктора Мадоян М. А. работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Миокардиодистрофия (МКД) — группа вторичных обратимых поражений мышечного слоя сердца (миокарда) невоспалительной и некоронарогенной природы, которые обусловлены нарушением обмена веществ в миокарде и проявляются нарушением его функций. [1] [3] [5]
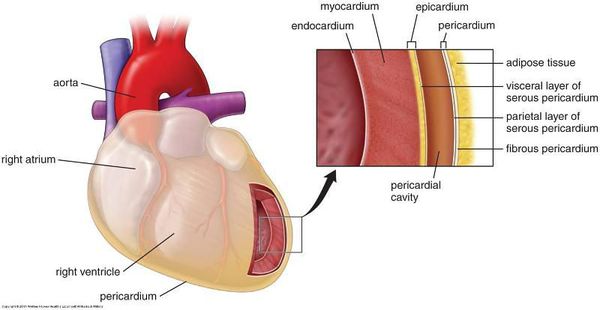
Общие признаки миокардиодистрофий:
- Нарушен обмен веществ в тканях сердца.
- Возникает вторично, то есть является следствием или осложнением других патологий.
- Первопричиной не может быть воспаление и поражение артерий сердца (они вызывают иные заболевания — миокардит, ишемическую болезнь сердца).
- Обратимость на начальных этапах (при устранении причин).
- Проявляются разнообразными неспецифическими нарушениями сердечной деятельности.
Заболевание поражает разные возрастные группы, но чаще встречается после 40 лет. [2] [3] [4] [6] [7]
К миокардиодистрофии могут приводить самые различные внутренние и внешние факторы, нарушающие обмен веществ и энергии в тканях сердца. [1] [3] [5] [6] [7]
Внутренние (эндогенные) факторы — патологические процессы в организме, осложнившиеся миокардиодистрофией. Эндогенные факторы можно разделить на две большие группы: сердечные и несердечные причины возникновения МКД.
К сердечным факторам относятся:
- пороки сердца;
- миокардиты;
- ишемическая болезнь сердца (далее — ИБС);
- изменения сердца вследствие гипертонической болезни;
- изменения сердца вследствие лёгочной гипертензии;
- болезни крови (анемии);
- болезни эндокринной системы и обмена веществ (сахарный диабет, ожирение, голодание, подагра, нарушение функций щитовидной железы, патологический климакс и другие) [2][6][7] ;
- болезни пищеварительной системы (тяжёлые поражения печени, поджелудочной железы или кишечника);
- болезни мышечной системы (миастения, миотония);
- эндогенные интоксикации (хроническая почечная недостаточность, хроническая печёночная недостаточность);
- инфекции (острые и хронические, бактериальные и вирусные).
Внешние (экзогенные) факторы — патологические воздействия на организм внешней среды и образа жизни:
- воздействие физических факторов (радиация, вибрация, экстремальные температуры) [7] ;
- воздействие химических факторов (хронические и острые отравления химическими элементами и соединениями, алкоголем, наркотиками, некоторыми лекарственными средствами);
- физическое и психоэмоциональное перенапряжение (хроническое и острое). [2][4]
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы миокардиодистрофии
Характеристика симптомов при миокардиодистрофии:
- неспецифичны — могут наблюдаться и при других заболеваниях;
- наслаиваются на симптомы заболевания (состояния), вызвавшего МКД;
- обратимы — могут полностью исчезнуть при своевременном устранении причины МКД;
- нарастают по мере развития МКД.
Виды симптомов при МКД:
- Боли в сердце. В отличие от болей при ИБС, не связаны с физической нагрузкой, не носят жгущий и давящий характер, отличаются большей длительностью, не купируются (не прерываются) нитратами. В отличие от болей при поражении плевры (оболочки лёгких), не связаны с актом дыхания и кашлем. В отличие от болей при поражении позвоночника, не связаны с движениями в корпусе. Но могут, как плевральные и позвоночные боли, купироваться обезболивающими и противовоспалительными средствами.
- Одышка — чувство нехватки воздуха. Как и при большинстве других заболеваний с одышкой, последняя обычно нарастает при нагрузке.
- Отёки. Как и при большинстве других заболеваний сердца, отёки чаще локализуются на нижних конечностях и нарастают к вечеру.
- Нарушения ритма сердца. Могут отмечаться приступы сердцебиений, неприятные чувства перебоев, остановки сердца, головокружения, редко — обмороки.
Патогенез миокардиодистрофии
В патогенезе миокардиодистрофии задействованы ткани сердца следующих видов:
- Мышечная ткань (сердечная мышца, миокард). Функция — нормально сокращаться (при этом из камер сердца кровь выбрасывается) и расслабляться (при этом камеры сердца заполняются следующей порцией крови).
- Нервная ткань (проводящая система сердца). Функция — генерировать нервные импульсы строго определённых характеристик (место возникновения, частота) и без задержек проводить их к миокарду. Именно нервный импульс заставляет сердечную мышцу сокращаться.
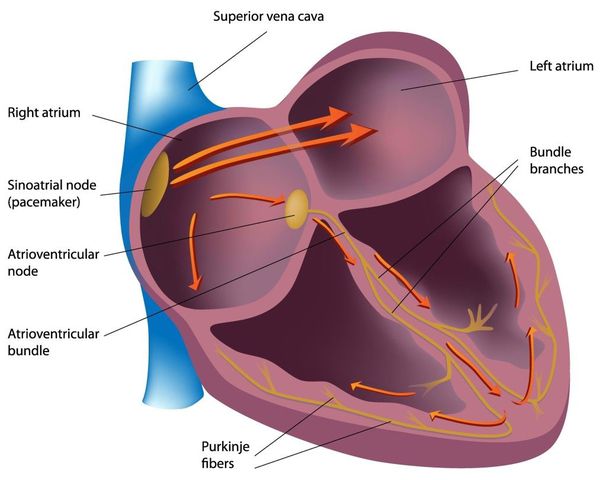
При нарушении обменных процессов (электролитного, белкового, энергетического) нарушаются и функции сердечных тканей [1] [2] [5] : мышечные клетки утрачивают способность к нормальным сокращениям, нервные — к генерированию и проведению нормальных импульсов.
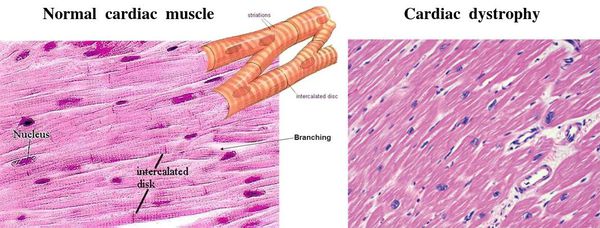
Причём поражается не сразу вся ткань сердца. Сначала возникают одиночные очаги дистрофии из нескольких клеток, а соседние неповреждённые клетки пытаются восполнить потерю и усиливают свою функцию. Затем количество и размер поражённых очагов увеличиваются, происходит их слияние, здоровые участки теряют способность компенсировать ухудшение работы, появляется расширение сердечных камер и выраженное нарушение функций сердца. [3]
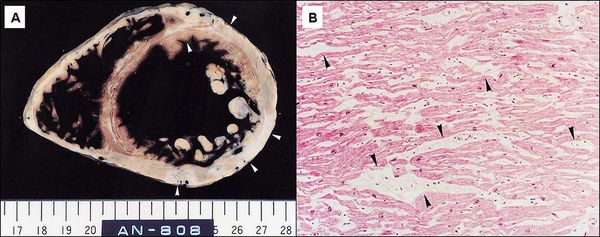
Далее при прекращении воздействия причинного фактора начинается медленное восстановление структуры и функции клеток. [7] При продолжающемся воздействии причинного фактора происходит гибель клеток и их замещение рубцовой (соединительной) тканью. Соединительная ткань не способна сокращаться и расслабляться, генерировать и проводить импульсы, заменяться здоровыми клетками. Процесс формирования соединительной ткани в сердце называется кардиосклероз, на этом этапе у болезни уже не может быть обратного развития. [3]
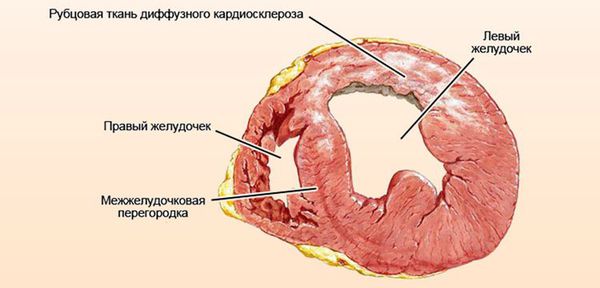
Классификация и стадии развития миокардиодистрофии
Миокардиодистрофии классифицируют по причинам возникновения, перечисленным выше, а также по скорости развития и стадиям заболевания. [1] [5]
По скорости развития миокардиодистрофий различают:
- острую форму (при массивном воздействии внешних и внутренних факторов: например, при тромбоэмболии лёгочной артерии, гипертоническом кризе, остром физическом перенапряжении);
- хроническую форму (при длительном воздействии умеренных по силе внешних и внутренних факторов: например, при хронической интоксикации, часто рецидивирующих острых инфекциях).
По стадиям миокардиодистрофий выделяют:
- I стадию — компенсации. Обратима. Формируются очаги дистрофии. Изменения на микроскопическом уровне. Симптомы отсутствуют или минимальны.
- II стадию — субкомпенсации. Обратима. Очаги дистрофии сливаются. Изменения на макроскопическом уровне, камеры сердца увеличиваются в размерах. Симптомы нарастают.
- III стадию — декомпенсации. Необратима. Некроз клеток с замещением их соединительной тканью — кардиосклероз. Прогрессирующее нарушение структуры сердца и нарастание симптомов.
Осложнения миокардиодистрофии
-
— утрата способности сердца обеспечивать организму требуемый кровоток. Проявляется нарастающими одышкой, сердцебиением, слабостью. [3] Симптомы сначала возникают при интенсивных нагрузках, затем при обычных, требуется всё больше времени для восстановления, появляются и усиливаются отёки. Затем одышка и сердцебиение появляются при любых движениях, потом и в покое, возникают приступы сердечной астмы, может развиться отёк лёгкого. Хорошо подобранное лечение способно надолго затормозить развитие событий по этому сценарию. Без лечения достаточно быстро наступает смерть от прогрессирующей сердечной недостаточности.
- Нарушения ритма и проводимости сердца — утрата способности проводящей системы сердца к генерации и проведению нормальных импульсов. Импульсы приобретают патологический характер (возникают не в тех местах, не с той частотой) или не могут достичь рабочего миокарда и вызвать его сокращение. Диапазон нарушений ритма и проводимости сердца чрезвычайно широк [2] : от незначительных (одиночная, редкая экстрасистолия (преждевременное сокращение сердца), некоторые виды блокад) до жизнеугрожающих (пароксизмальные нарушения ритма, мерцательная аритмия, тяжёлые блокады). Разными могут быть и проявления: от полного отсутствия симптомов до выраженных сердцебиений, болей в сердце, обмороков. Соответственно, предполагается разное лечение — от отсутствия необходимости специального лечения до экстренного хирургического.
Диагностика миокардиодистрофии
Задачи диагностического процесса:
- исключение других, более опасных и необратимых заболеваний сердца;
- выявление причин миокардиодистрофии;
- определение эффективности получаемого лечения.
В диагностике миокардиодистрофий большое значение имеет грамотный расспрос и внимательный осмотр пациента. Также проводят электрокардиографию, УЗИ сердца, рентгенологичесское исследование органов грудной клетки, лабораторные исследование крови и мочи. [3] Специфических изменений результатов данных исследований для миокардиодистрофий нет, но они позволяют выявить заболевания — причины миокардиодистрофий. ЭКГ и УЗИ сердца могут проводить повторно для оценки положительной динамики функций сердца на фоне проводимого лечения.
Лечение миокардиодистрофии
Задачи лечебного процесса:
- устранение причины миокардиодистрофии;
- восстановление (улучшение) обмена веществ в сердечных тканях;
- устранение (уменьшение) симптомов;
- профилактика и лечение осложнений.
Своевременность и полнота устранения причины миокардиодистрофии определяет эффективность терапии и её сроки. На этапе устранения причины лечебный процесс сильно разнится у больных с разными причинами заболевания: [1] [2] [5] [6] [7]
- женщин с патологическим климаксом лечат гинекологи при помощи гормональных препаратов;
- пациенты с хроническим тонзиллитом, осложнившимся миокардиодистрофией, нуждаются в оперативном удалении миндалин ЛОР-врачом;
- тиреотоксикоз, как причина миокардиодистрофии, лечится эндокринологом медикаментозно или удалением щитовидной железы или её части;
- анемия лечится гематологом или терапевтом, в зависимости от выраженности заболевания — стационарно или амбулаторно;
- для лечения алкогольной миокардиодистрофии необходимо исключить употребление алкоголя, поэтому здесь требуется помощь нарколога.
- голодание, будучи причиной МКД, может быть устранено при помощи психиатра, если у пациента анорексия, и посредством привлечения к проблеме социальных служб, если у пациента нет возможности обеспечить себе регулярное питание;
- тяжёлые психоэмоциональные реакции, вызвавшие миокардиодистрофию, лечатся психотерапевтом сеансами психотерапии или медикаментозно;
- физическое перенапряжение, вызвавшее миокардиодистрофию, должно быть срочно прекращено и не должно возобновляться, в таком случае вне спорта роль врача играет сам пациент, а в спорте — тренер под руководством врачей спортивной медицины. [2][4] И так далее.
Однако не всякую выявленную причину миокардиодистрофии можно устранить. Например, сами заболевания (длительные или хронические) и токсические препараты, применяемые для их лечения, лучевая терапия онкологических больных, некупируемые зависимости и другое.
Параллельно лечению основного заболевания, вызвавшего миокардиодистрофию (независимо от того, можно его устранить или нет), всех больных наблюдает кардиолог, по его назначению применяются виды лечения, направленные на улучшение обмена веществ в сердечных тканях, уменьшение симптомов и профилактику осложнений. [3]
Немедикаментозное лечение — нормализация образа жизни и питания, отказ от вредных привычек. Важно, чтобы пациент придерживался определённого режима дня, полноценно отдыхал и питался, обязательно имел регулярные, адекватные именно для него физические нагрузки, ежедневно находился на свежем воздухе. Также очень важно, чтобы в жизни пациента было увлекающее его дело. Немедикаментозное лечение — это зона ответственности пациента. Врач может порекомендовать, но реализовывать должен сам пациент.
Медикаментозное лечение:
- Улучшают обмен веществ в сердце препараты калия, витамины группы В, стимуляторы обменных процессов. Их обычно назначают курсами 3-4 раза в год.
- Уменьшают симптомы нарушений ритма препараты с антиаритмической активностью. Нарушения проводимости и ритма могут потребовать и хирургического лечения.
- Уменьшают симптомы хронической сердечной недостаточности и являются средством профилактики её развития такие препараты как ингибиторы ангиотензинпревращающего фермента, β-адреноблокаторы. [3]
Медикаментозное лечение — это зона ответственности врача. Ни в коем случае не надо пытаться лечиться самостоятельно. Каждый медикаментозный препарат (витамины и стимуляторы обменных процессов в том числе) может при определённых условиях нанести вред.
Прогноз. Профилактика
При I и II стадиях прогноз благоприятный. После устранения причинного фактора функции сердца могут полностью восстановиться. Длительность периода восстановления зависит от времени начала лечения (чем быстрее начата адекватная терапия, тем быстрее регрессируют патологические изменения) и от общего состояния организма (молодой возраст, отсутствие сопутствующих заболеваний способствуют быстрейшему восстановлению) и может составлять от года до многих лет. [7]
При III стадии прогноз зависит от выраженности изменений и наличия осложнений. Так как изменения в сердце уже необратимы, речь идёт не о восстановлении нормальных параметров сердца и хорошего самочувствия, а о замедлении прогрессирования хронической сердечной недостаточности и нарушений ритма. При III стадии необходимо пожизненное лечение, профессиональная деятельность ограничена либо невозможна, а при отсутствии лечения неблагоприятным становится и прогноз жизни.
Одной из сложных задач для врача-интерниста является верификация причины острого миоперикардита и тактики лечения подобных больных. В странах Европы и Запада в 86% указывается на идиопатический характер заболевания в случаях локального поражения пери- и миокарда (особенно при отсутствии клинических признаков первичного поражения других органов и систем) [1]. За последние 10-20 лет существенно выросла заболеваемость миокардитами и миоперикардитами, причем большинство авторов сходятся на концепции вирусной природы “идиопатических” миоперикардитов [2,3]. Вирусные миоперикардиты могут явиться причиной неожиданной смерти больных, развития сердечной недостаточности или аритмий [4].
Однако в 35% случаев не удается установить причину заболевания даже с использованием полимеразной цепной реакции (ПЦР) клеток перикардиальной жидкости и биоптата эпикарда по отношению к большинству из известных кардиотропных вирусов/бактерий, а также при иммуногистохимическом и иммуноцитохимическом исследовании эндомиокардиальных биоптатов [5].
Противоречивые результаты получены в большинстве последних исследований ПЦЗ. Значительная частота выявления энтеровирусного генома показана не только в сердцах больных дилатационной кардиомиопатией (ДКМП), но также при других заболеваниях сердца и у здоровых доноров. Проведено исследование эндомиокардиальных биоптатов у 82 и перикардиальной жидкости у 7 больных. Энтеровирусный геном был обнаружен в биоптатах 19% пациентов c ДКМП; у 18% — с миокардитами; у 22% — с другими болезнями сердца и у 57% пациентов — с перикардитами в перикардиальной жидкости [6].
Миоперикардиты вызываются различными вирусами, чаще вирусами Коксаки группы В и ЕCHO-вирусами, паравирусом B19, реже встречаются аденовирусы, возбудители инфекционного мононуклеоза, свинки, краснухи, полиомиелита, гепатита В [3, 6, 7, 8, 9].
Патоморфологически сухой перикардит характеризуется фибринозной реакцией перикарда, которая придает его поверхности ворсинчатый, лохматый вид. К этому присоединяется воспаление с выпотом [3], причем, по данным нашей клиники, в последние годы существенно возросла частота геморрагических перикардитов, иногда имеющих вирусную этиологию. Наличие геморрагического характера перикардиального выпота требует дифференциации с первичным (мезотелиома и др.) и вторичным (метастатическим) процессами. Подобная дифференциация осуществляется на основании динамики клинических данных (позитивных, в случае миоперикардита), цитологического анализа перикардиального пунктата, эволюции патологической симптоматики после назначения кортикостероидов и нестероидных противовоспалительных препаратов.
У больных острым миоперикардитом выявляется наличие цитокинов в перикардиальной жидкости, что может лежать в основе констрикции перикарда [10].
Таким образом, собственные данные и результаты исследований других авторов убедительно свидетельствуют, что миокардит не представляет собой ограниченное миокардом поражение. В патологический процесс в различной степени вовлекаются перикард, эпикард и эндокард. Иногда симптоматика поражения пери- и эндокарда бывает довольно обозначенной. Однако чаще она маскируется преимущественно патологией миокарда.
Из физикальных данных наиболее характерен шум трения перикарда, гарантирующий наличие перикардита, хотя его отсутствие не исключает наличия миоперикардита. Шум трения перикарда выслушивается у 1/3 — 1/2 больных. Шум быстропроходящий и меняющий интенсивность, иногда на протяжении часов-суток; может быть грубый, скрипучий или царапающий; обычная локализация — вдоль нижней части левого края грудины, а также между этой областью и верхушкой сердца. Классический перикардиальный шум имеет 3 компонента: во время систолы предсердий, систолы желудочков и во время диастолы. Иногда шум трения перикарда выслушивается даже при большом выпоте [3].
Приоритетными в диагностике миоперикардита являются динамические клинико-электрокардиографические данные. Остановимся на этом вопросе подробнее, так как именно ЭКГ-картина может оказаться решающей для постановки диагноза миоперикардита. Она напоминает таковую при остром фибринозном перикардите и характеризуется определённой стадийностью.
Первая стадия заключается в подъёме сегмента ST обычно в тех отведениях, где комплекс QRS направлен вверх; в тех отведениях, где он направлен вниз, отмечается снижение сегмента ST.
Подъём сегмента ST наступает во многих отведениях, что свидетельствует о распространённом, диффузном характере процесса. Показательным являются конкордантные смещения сегмента ST и зубца Т. Следует отметить, что во всех случаях подъема сегмента ST отчетливо выявляется зубец S, а кривая не носит монофазный характер. Ориентировочная продолжительность этой стадии от нескольких дней до одной-двух недель.
Во второй стадии наблюдается снижение сегмента ST к изолинии, уменьшается амплитуда зубца Т вплоть до его сглаженности. Сегмент ST переходит в зубец Т, формируя изоэлектрический интервал ST-T, а иногда отмечается негативность зубца Т. Эта стадия длится также от нескольких дней до нескольких недель.
Третья стадия характеризуется наличием отрицательного зубца Т симметричной и несколько тупой формы. Длительность этой стадии довольна вариабельна — от 1-2 недель до 1-2 месяцев.
Четвёртая стадия заключается в постепенной позитивизации зубца Т. Эта стадия обычно соответствует 2-3 месяцам.
Во всех стадиях отсутствуют изменения комплекса QRS.
Приведенная динамика носит довольно искусственный характер и может иметь самые различные вариации. В той же степени это касается обозначенной выше продолжительности отдельных стадий, которая может широко варьировать в сторону уменьшения или удлинения.
Патогенез описанных ЭКГ-изменений, как считают многие авторы, обусловлен, прежде всего, субэпикардиальным повреждением и сопутствующей ишемией соответствующих слоев миокарда.
По нашим данным, эхокардиография ни в одном случае миоперикардита, сопровождающегося подъемом сегмента ST, не позволяла диагностировать вовлечение перикарда. Однако не наблюдалось и существенного поражения миокарда, в том числе и локального гипокинеза, что позволяло проводить дифференциальную диагностику с инфарктом миокарда.
Лабораторные данные могут характеризоваться повышением СОЭ, лейкоцитoзом за счет лимфоцитоза, эозинофилией. Могут также отмечаться увеличение реакции торможения миграции лейкоцитозом, показателя повреждения нейтрофилов, теста дегрануляции базофилов, повышения уровня кардиальных изоферментов (ЛДГ, КФК). Однако чаще всего при развитии миоперикардита общепринятые лабораторные данные остаются нормальными [12].
Приводим электрокардиограмму больного А., 24 лет (рис. 1), заболевшего остро, через 1 неделю после перенесенной ОРВИ. Ночью пациент почувствовал интенсивные давящие боли за грудиной, к утру ставшими нестерпимыми и иррадиирующими в обе руки. Болевой синдром был купирован использованием наркотических аналгетиков. Госпитализирован в стационар. Дальнейшая ЭКГ-динамика представлена на рис. 2 и3. Лихорадки и изменений со стороны лабораторных анализов отмечено не было. При ЭхоКГ не было отмечено признаков перикардита; глобальная и сегментарная функции миокарда были сохранены. Пациенту проведена коронарография. Патологии со стороны коронарных артерий выявлено не было. Иммуносупрессивная терапия не проводилась. В дальнейшем отмечалась полная нормализация электрокардиограммы, болевой синдром не рецидивировал.
Клиническое течение миоперикардита чаще благоприятное, с вполне удовлетворительным эффектом от проводимой противовоспалительной терапии [13,14]. Однако возможно рецидивирование заболевания даже через много лет после первичного процесса [3, 4]. Механизм рецидивирования миоперикардита неясен [4].
Лечение миоперикардита включает в себя использование нестероидных противовоспалительных средств — индометацина 25-75 мг 4 раза в день, ибупрофена 400 мг 4 раза в день и аспирина (если перикардит считается идиопатическим или вирусным). Пациентам, не отвечающим на подобное лечение в течение 2-3 дней, необходимо назначение преднизолона в дозе 60 мг/сутки на 2-3 дня с последующим снижением дозы [3, 13]. Считается, что наличие вирусов в перикардиальной жидкости является противопоказанием к терапии глюкокортикостероидами.
Иммуносупрессорная терапия циклофосфаном, азатиоприном или колхицином является резервной для пациентов с миоперикардитом [6]. Незначительное число больных с хроническими формами заболевания резистентно как к нестероидным препаратам, так и к колхицину. Учитывая, что кортикостероидная терапия часто дает побочные эффекты, рядом авторов было предложено внутриперикардиальное введение триамсиналона. Уменьшение симптомов заболевания отмечалось в зависимости от дозировки препарата в 82 и 92% через 3 месяца и 1 год, соответственно. Однако, в зависимости от дозировки препарата, за время наблюдения у 13,1-29,6% отмечено развитие синдрома Кушинга [5].
Нами назначались дозы преднизолона от 1 до 1,5 мг/кг массы тела в день, терапия проводилась в течение 4-х недель, затем производилось медленное снижение дозы препарата в течение 3-х мес., в конце курса допускалось добавление аспирина по 1,6 г/день.
Весьма актуальна и дискуссионна проблема лечения диффузных миокардитов, протекающих без клинически определяемого поражения перикарда. В последние годы таким формам заболевания уделяется особое внимание. Начало этому положило сенсационное исследование, проведенное J.W.Mason и соавт. на 111 больных миокардитом, рандомизированных на 2 группы, получающих стандартную терапию и сочетание преднизолона и азатиоприна. Через 28 недель после начала лечения больные не различались по значениям фракции выброса, которые достоверно увеличивались. Группы также не различались по уровню смертности в течение первого года (20%) и 4,3 лет наблюдения (56%) [15].
Сходные данные были получены в результате проведенного в 1995 году исследования MTT (Myocarditis Treatment Trial) на 2305 больных с сердечной недостаточностью, из которых 2233-м была проведена эндомиокардиальная биопсия; 66 пациентам была проведена иммуносупрессивная терапия [16] .
Несколько другие результаты были получены B.Maisch и соавт.: при лечении больных двух рандомизированных групп, состоящих из 39 пациентов с миокардитом, авторы отметили существенное увеличение фракции выброса, снижение функционального класса сердечной недостаточности и уменьшение инфильтративных процессов в миокарде у больных, получающих преднизолон и азатиоприн в течение 3 месяцев. Различий в прогнозе заболевания отмечено не было [17].
К настоящему времени проведено 2 рандомизированных исследования на 126 больных и 4 когортных — на 118 больных, выявивших, что фракция выброса увеличивается, в среднем, на 10% через 6 месяцев без иммуносупрессивной терапии. Использование преднизолона, интерферона или гормонов щитовидной железы не увеличивает фракцию выброса и не улучшает прогноз заболевания [18]. Использование полимеразной цепной реакции у больных миокардитом без положительного эффекта иммуносупрессивной терапии позволило выявить энтеровирусы в миокарде, что, по мнению авторов, свидетельствовало о продолжающемся повреждении кардиомиоцитов [19].
Однако мнения по поводу использования интерферона и тимомодулина крайне противоречивы.
В настоящее время известны три типа интерферона: интерферон-альфа, вырабатываемый лейкоцитами, интерферон-бета, вырабатываемый фибробластами и интерферон-гамма, вырабатываемый лимфоцитами. Независимо от типа вируса, интерферон играет существенную роль в противовирусной защите, вызывая внутриклеточную блокаду цикла репликации вируса. U.Kuhl и соавт. выявили, что через 6 месяцев после начала лечения интерфероном-бета использование ПЦР не выявляло адено- и энтеровирусные геномы в миокарде, у больных уменьшались проявления сердечной недостаточности, достоверно увеличивалась фракция выброса левого желудочка и уменьшались его размеры [20].
Некоторыми авторами на фоне терапии интерфероном-альфа и тимомодулином отмечено достоверное увеличение фракции выброса, сохраняющееся в течение 2-лет наблюдения, улучшение функционального состояния больных и более быстрая нормализация ЭКГ [21]. Однако в это исследование, кроме больных миокардитом, были включены пациенты с дилатационной кардиомиопатией, что делает результаты менее репрезентативными.
При лечении миокардитов у детей получены более обнадеживающие результаты [16, 22].
В 1995 году начато исследование ESETCID (European Study of Epidemiology and Treatment of Cardiac Inflammatory Disease). Это — первое многоцентровое, плацебо-контролируемое рандомизированное исследование, проведенное отдельно от исследования MTT. Планируется, что больные с цитомегаловирусным миокардитом будут получать терапию гипериммуноглобулином, c энтеровирусным миокардитом – интерфероном- альфа, вирус-негативным миокардитом – иммуносупрессивную терапию. Первой конечной точкой исследования является увеличение фракции выброса более, чем на 5% [23].
В случае правильно установленного диагноза заболевания благоприятный ближайший и отдалённый прогноз более показателен для миоперикардита. В то же время, прогноз диффузного миокардита остается неблагоприятным, а показания к его рациональному лечению – недостаточно установленными.
Литература
1. Soler-Soler J., Permanyer-Miralda G., Sagrista-Sauleda J.A. Systematic diagnostic approach to primary acute pericardial disease // Cardiol.Clin.- 1990.- v.8.-N 4.- Р.609-620.
2. Гогин Е.Е. Новые возможности и задачи в дифференциальной диагностике перикардитов // Клин.медицина.- 1983.- N 11.- С.24-30.
3. Shabetai R. Acute pericarditis // Cardiol. Clin.- 1990.- v.8.- N 4.- Р.639-644.
4. Yoneda S., Ohte N., Samoto T., Kobayashi T., et al. Two cases of viral myocarditis and one case of viral pericarditis // Jap.Circul. J.- 1982.- v.46.- Р.1222-1226.
5. B.Maisch, A.D.Ristic, S.Pankuweit. Intrapericardial treatment of autoreactive pericardial effusion with triamcinolone // Eur. Heart J.- 2002.- Vol.23.- P.1503-1508.
6. Fujioka S., Koide H., Kitaura Y. et al. Molecular detection and differentiation of enteroviruses in endomyocardial biopsies and pericardial effusions from dilated cardiomyopathy and myocarditis // Am.Heart J.- 1996.- Vol.131.- P.760-765.
7. Гогин Е.Е. Перикардиты // Кардиология.- 1991.- N 2.- С.80-86.
8. Chia J.K.S., Jackson B. Myopericarditis due to parvovirus B19 in an adult // Clin.Infect.Dis.- 1996.- v.23.- Р.200-201.
9. Orth T., et al. Human parvovirus B19 infection associated with severe acute perimyocarditis in a 34-year-old man [letter] // Eur.Heart J.- 1997.- v.18. -N 3.-Р.524-525.
10. Schцnian U., Paul R., Gemsa D., Maisch B. Soluble interleukin-2 receptor, interleukin-6 and tumoral necrosis factor-alfa in inflammatory pericardial effusions. XVII Congr.of the Europ.Society of Card // Eur. Heart J.- 1995.- v.16. (abstr. suppl.). - ref. № 1711.
11. D.H.Spodick. Intrapericardial treatment of persistent autoreactive pericarditis/myopericarditis and pericardial effusion // Eur. Heart J.- 2002.- Vol.23.- P.1481-1482.
12. Бойцов С.А., Дерюгин М.В. Современные возможности диагностики неревматических миокардитов // Consilium Medicum.- 2002.- Vol.4.- P.117-124.
13. Marcolongo R., Russo R., Laveder F., Noventa F., Agostini C Immunosuppressive therapy prevents recurrent pericarditis // J.Am.Coll.Cardiol.- 1995.- v.26.- N 5.- Р.1276-1279.
14. Гуревич М.А., Мравян С.Р., Григорьева Н.М. Особенности клиники, диагностики и лечения миоперикардитов // Клин.медицина.- 1999.- № 7.- С.33-36.
15. Mason J.W., O’Connell J.B., Herskowitz N.E. et al. A clinical trial of immunosuppressive therapy for myocarditis // New Engl. J. Med.- 1995.- Vol.333.- P.269-275.
16. Hahn E.A., Hartz V.L., Moon T.E. et al. The Myocarditis Treatment Trial: Design, methods and patient enrolment // Eur. Heart J.- 1995.- Vol.16.- P.162-167.
17. Maisch B., Schonian U., Hengstenberg C. et al. Immunosuppressive treatment in autoreactive myocarditis – results from a controlled trial // Postgrad.Med.J.- 1994.- Vol.70 (suppl.1).- S29-34.
18. Grag A., Shiau J., Guyatt G. The ineffectiveness of immunosuppressive therapy in lymphocytic myocarditis // Ann. Intern.Med.- 1998.- Vol.129.- P.317-322.
19. Frustaci A., Pieroni M., Chimenti C. Immunosuppressive therapy in inflammatory cardiomyopathy // Eur. Heart J.- 2002.- Vol.4 (suppl.1).- P.169-173.
20. Kuhl U., Pauschinger M., Noutsias M. et al. Diagnosis and treatment of patients with virus induced inflammatory cardiomyopathy // Eur.Heart J.- 2002.- Vol.4 (suppl.1).- P.173-180.
21. Miric M., Vasiljevic J., Bojic M et al. Long-term follow up of patients with dilated heart muscle disease treated with human leucocytic interferon alpha or thymic hormones initial results // Heart.- 1996.- Vol.75.- P.596-601.
22. Camargo P.R., Snitcowsky R., da Luz P.L. et al. Favorable effects of immunosuppressive therapy in children with dilated cardiomyopathy and active myocarditis // Pediatric Cardiol.- 1995.- Vol.16.- P.61-8.
23. Schmaltz A.A., Demel K.P., Kallenberg R. et al. Immunosuppressive therapy of chronic myocarditis in children: Three cases and the design of a randomized prospective trial of therapy // Pediatric Cardiol.- 1998.- Vol.19.- P.235-239.
24. Maisch B., Hufnagel G., Schonian U., Hengstenberg. The European Study of Epidemiology and Treatment of Cardiac Inflammatory Disease (ESETCID) // Eur.Heart J.- 1995.- Vol.16 (suppl.0).- P.173-175.
Читайте также:

