Трихомониаз мальтофилия чувствительность к антибиотикам
Обновлено: 06.05.2024
Stenotrophomonas maltophilia and Burkholderia cepacia are gram-negative bacteria that acquire motility via multitrichous polar flagella.
Related terms:
Download as PDF
About this page
Stenotrophomonas maltophilia and Burkholderia cepacia Complex
John E. Bennett MD , in Mandell, Douglas, and Bennett's Principles and Practice of Infectious Diseases , 2020
Stenotrophomonas maltophilia
One theme that connects bothS. maltophilia and the BCC is their inherent resistance to a variety of antibiotics.S. maltophilia demonstrates inherent resistance to most β-lactams, aminoglycosides, and various disinfectants. 171 , 172 S. maltophilia also shows resistance to certain heavy metals such as silver. 173 S. maltophilia encodes a number of resistance genes including numerous resistance-nodulation-division efflux pumps 172 , 174 and the efflux pump MfsA. 175 In addition, resistance to quinolones administered for treatment of bacteremia has been described and was linked to a repressor for one of these efflux pumps, SmeDEF. 176 Other studies have shown that approximately 33% of clinical isolates have multidrug resistance to fluoroquinolones, tetracycline, erythromycin, and chloramphenicol through overexpression of SmeDEF. 177,178 Many resistance mechanisms beyond efflux have been found inS. maltophilia including β-lactamases, aminoglycoside-modifying enzymes, and reduced permeability of the outer membrane. 179 For many classes of antibiotics, resistance rates have been increasing over time. 180
Trimethoprim-sulfamethoxazole (TMP-SMZ) has been a mainstay of therapy forS. maltophilia, as it has historically had the greatest in vitro potency against clinical isolates. 179 , 181 , 182 The vast majority of isolates in early reports showed susceptibility to TMP-SMZ; however, drug resistance has increased worldwide, in part due to the incorporation of class 1 integrons carrying thesul1 gene. 179 , 183 The global spread of this mobile gene has been linked to increased use of TMP-SMZ in patients. 184,185 For systemic infections, treatment frequently involves combination therapy with TMP-SMZ as a backbone. Combination therapy has been suggested for non–catheter-related bacteremia, endovascular infections, bone and joint involvement, central nervous system infection, systemic infection in patients with severe neutropenia or immune defects, and multifocal lung disease. 60 , 135 , 186 Some combinations including TMP-SMZ and ticarcillin-clavulanic acid have shown in vitro activity. 187 In one pediatric study, combination of TMP-SMZ with ciprofloxacin or minocycline extended survival. 188
If resistance arises to TMP-SMZ or it cannot be tolerated, a number of other agents have been shown to have activity. The newer fluoroquinolones such as moxifloxacin demonstrate in vitro activity inS. maltophilia even in isolates that are resistant to TMP-SMZ. 189 However, resistance can develop after single-drug therapy, which can be prevented by using various drug combinations with ticarcillin-clavulanic acid or TMP-SMZ or both. 190 – 192 Although studies are limited, monotherapy with a fluoroquinolone compared with TMP-SMZ has shown similar treatment failure rates and development of resistance during therapy, although the numbers studied have been low. 193 , 194 In vitro, levofloxacin was shown to have decreased activity inS. maltophilia biofilms. 195 Other monotherapy studies included comparing TMP-SMZ with minocycline; although there were no significant differences in the treatment failure rate between the two groups, greater than 30% of the patients in both groups failed single-drug therapy. 58,196 There are no good data to support any unique therapeutic approaches for the treatment ofS. maltophilia in patients with CF. 197
Pseudomonas spp., Acinetobacter spp. and Miscellaneous Gram-Negative Bacilli
Stenotrophomonas maltophilia
Nature and Taxonomy
Stenotrophomonas maltophilia is a ubiquitous environmental bacterium that has also emerged as an important nosocomial pathogen contributing substantially to morbidity and mortality of immunocompromised patients, particularly in the ICU setting. 3
Epidemiology
S. maltophilia is a water-borne organism that can be readily isolated from soil, plants, water and raw milk. It can also be recovered from the hospital environment where it has been isolated from a variety of sources such as ventilatory equipment, nebulizers, endoscopes, prosthetic devices, as well as dialysis fluids and antiseptic solutions (see Table 181-6 ). There is a high incidence of infections due to S. maltophilia in immunocompromised patients such as those with solid malignancies, leukemia or lymphoma. 67 In addition, S. maltophilia is increasingly implicated in pulmonary infections in CF patients (see Table 181-1 ). Recent surveys report a point prevalence of 11% of CF patients with transient colonization with S. maltophilia, even though the importance of S. maltophilia in patients with CF remains to be determined. 3
Diagnostic Microbiology
S. maltophilia grows readily on most routinely used media and is characterized by the presence of a single or a small number of polar flagella (motile bacteria), frequently pigmented colonies (yellow or yellowish-orange) and a negative oxidase reaction, even though some isolates may be oxidase-positive. 3 S. maltophilia acidifies sugars (except for rhamnose and mannitol) and is generally proteolytic. Co-isolation of S. maltophilia with other NFGNB, such as A. baumannii, Burkholderia spp. and P. aeruginosa, from respiratory specimens can be challenging. Current automated biochemical panels usually identify S. maltophilia with high certainty as well as molecular methods or MALDI-TOF. 3
Pathogenicity and Pathogenesis
S. maltophilia produces proteolytic enzymes and other pathogenic extracellular enzymes such as DNAse, RNAse, elastase, lipase, hyaluronidase, mucinase and hemolysin, which may contribute to the severity of S. maltophilia infection. In addition, cytotoxic activity has been reported from clinical isolates. Other pathogenicity factors include LPS, flagella and a diffusible signal factor system which may play a role in adherence to and invasion of bronchial epithelial cells, biofilm formation, chronic colonization and antimicrobial resistance. Pathogenicity, including the role of S. maltophilia in the CF lung environment, has been recently reviewed in detail. 3
Clinical Manifestations
S. maltophilia has been implicated in respiratory tract infections, endocarditis, bacteremia, meningitis and UTI. In addition, severe cutaneous infections (ecthyma gangrenosum similar to that due to P. aeruginosa), cellulitis and abscesses (wounds resulting from agricultural machinery) have been reported. Several studies listing S. maltophilia among the top 15 pathogens with recovery rates around 3% from hospitalized patients with pneumonia have been summarized in a recent review. 3 In a series analyzing almost 13 000 patients hospitalized with pneumonia in the USA and Europe, S. maltophilia was the sixth (USA) and eighth (Europe) most common pathogen, accounting for 4.4% and 3.2% of isolates, respectively. Crude mortality in patients with S. maltophilia BSI ranges from 14% to 69%, and attributable mortality as high as 37.5% has been reported. 3,55
Management and Resistance
S. maltophilia displays intrinsic resistance to most classes of antimicrobial agents (see Table 181-8 ). Mechanisms of resistance include production of several β-lactamases, rendering it susceptible only to latamoxef and combinations of ticarcillin plus clavulanic acid or piperacillin plus tazobactam, as well as carbapenemase production conferring resistance to carbapenems. 3,68 Few strains are susceptible to gentamicin, neomycin and kanamycin, and susceptibility to doxycycline is reported in less than 50% of strains.
Currently, TMP–SMX remains the drug of choice for treatment of infections due to S. maltophilia, although in vitro studies and retrospective case series indicate that ticarcillin–clavulanic acid, minocycline, some of the new fluoroquinolones, colistin and tigecycline may be alternative agents in case of resistance or allergy. 68,69 Due to increasing rates of resistance, therapy should always be guided by susceptibility testing. Of note, susceptibility testing results may not correctly predict clinical treatment response. Severe infections may require combination therapy.
Pseudomonas and Related Bacteria
Patrick R. Murray PhD, F(AAM), F(IDSA) , in Medical Microbiology , 2021
Stenotrophomonas maltophilia
S. maltophilia was originally classified in the genusPseudomonas, moved to the genusXanthomonas, and then transferred to the genusStenotrophomonas. Despite the confusion created by these taxonomic changes, the clinical importance of this opportunistic pathogen is well known. It is responsible for infections in debilitated patients with impaired host defense mechanisms. Also, becauseS. maltophilia is resistant to most commonly used β-lactam and aminoglycoside antibiotics, patients receiving long-term antibiotic therapy with these drugs are particularly at risk for acquiring infections.
The most common nosocomial infections caused byS. maltophilia are bacteremia and pneumonia, with both associated with a high incidence of complications and death ( Clinical Case 27.3 ). Hospital infections with this organism have been traced to contaminated intravenous catheters, disinfectant solutions, mechanical ventilation equipment, and ice machines.
Antimicrobial therapy is complicated because the organism is resistant to many commonly used drugs. In contrast with most gram-negative rods,Stenotrophomonas is uniformlyresistant to carbapenems (e.g., imipenem, meropenem, ertapenem, doripenem) and typically susceptible toTMP-SMX, although increased resistance has been reported in some studies. Treatment is usually effective with TMP-SMX (if susceptible) or with ciprofloxacin combined with ticarcillin-clavulanate or ceftazidime.
Stenotrophomonas maltophilia and Burkholderia cepacia
Microbiology and Epidemiology
Stenotrophomonas maltophilia and Burkholderia cepacia are gram-negative bacteria that acquire motility via multitrichous polar flagella. They do not ferment glucose, and many clinical isolates tend to give a weak oxidase reaction.
Slow-growing morphotypes, known as small-colony variants of B. cepacia and S. maltophilia, may appear and exhibit a high degree of resistance to antibiotics and may go undetected in routine cultures.
These free-living organisms are present in most aquatic and humid environment, including hospital drinking water.
Burkholderia cenocepacia and Burkholderia multivorans are the prominent bacterial strains isolated from patients with cystic fibrosis. Patient-to-patient transmission is believed to contribute to colonization.
Community-acquired S. maltophilia pneumonia has emerged as a serious concern in patients with no known risk factors, such as critical unit stay; mechanical ventilation or prolonged treatment-induced neutropenia; recent carbapenem, higher-generation cephalosporin, or fluoroquinolone therapy; or extended hospital stays.
Clinical Manifestations
S. maltophilia may involve any organ. Lungs are frequent sites of infection. Pulmonary infection is often preceded by respiratory tract colonization. Lobular or lobar consolidation is common, whereas pleural effusions are seldom noted.
Most S. maltophilia bloodstream infections arise from infected indwelling intravascular devices. Non–catheter-related bacteremia is often seen in patients with prolonged neutropenia.
S. maltophilia wound infections in burn patients are being reported as the second most common gram-negative bacterial infections after those caused by Aeromonas hydrophila. Skin lesions in mostly neutropenic patients are difficult to distinguish from pyoderma gangrenosum, leukemia cutis, vasculitis, and disseminated Pseudomonas, Fusarium, Candida, and rapidly growing mycobacterial infections.
In patients with cystic fibrosis, after initial B. cepacia infection, 50% of patients with B. multivorans may develop chronic asymptomatic bacterial colonization whereas nearly all (94%) patients with B. cenocepacia retain bacterial presence after the initial infection episode.
Complications
Lack of acute inflammation may underwhelm initial clinical presentation of S. maltophilia pneumonia in the immunosuppressed patient. Patients may present with serious pulmonary hemorrhage at the time of diagnosis owing to high propensity for tissue necrosis and hemorrhage.
Non–catheter-related S. maltophilia bacteremia is a serious complication associated with high rate of treatment failure and death. Patients often have profound neutropenia lasting longer than 10 days; and in nearly 70% of patients hematogenous dissemination arises from lung or soft tissue infection. Indicators for poor outcome in cancer patients include neutropenia more than 10 days, bacteremic pneumonia, shock syndrome, severe thrombocytopenia, and delay in appropriate therapy.
B. cenocepacia is associated with prolonged respiratory tract colonization, and the risk for death with invasive disease is more than fivefold higher compared with infections due to the other eight B. cepacia complex genomovars.
B. cepacia complex infection in patients with cystic fibrosis with diminished forced expiratory volume in 1 second has steadily been associated with poor prognosis. Infection in critically ill patients, presence of septic shock, and advanced underlying conditions also herald higher mortality.
Diagnosis
Early diagnosis requires a high level of suspicion for S. maltophilia lung infection.
Up to 36% of Burkholderia species may be misidentified by automated systems as other nonfermentative bacteria, such as Achromobacter or Ralstonia.
Swift and accurate molecular methods using 16S or 23S ribosomal RNA gene sequencing may replace conventional methods.
Whole-cell matrix-assisted laser desorption/ionization time-of-flight mass spectrometry holds promise as a rapid, accurate identification method for B. cepacia and S. maltophilia.
Therapy
Monotherapy is not recommended, owing to high frequency of treatment failure and infection relapse.
Trimethoprim-sulfamethoxazole (TMP/SMX) has the most potent and reliable in vitro activity against clinical isolates of S. maltophilia; however, drug resistance has increased among 30% to 40% of disease-associated isolates worldwide.
The newer fluoroquinolones, such as moxifloxacin, show improved activity against S. maltophilia. However, resistance has developed after single-drug therapy, which can be prevented by drug combinations including ticarcillin-clavulanic acid and/or TMP/SMX.
Carbapenems, TMP/SMX, chloramphenicol, and tetracycline are active against most B. cepacia complex isolates. Treatment pending susceptibility testing will depend on experience of the institution.
Most active drugs against B. cepacia include minocycline (38%), meropenem (26%), and ceftazidime (23%). Ceftazidime, tobramycin, and ciprofloxacin retain antimicrobial activity against planktonic and biofilm-embedded organisms.
Prevention
Nosocomial outbreaks underscore the current practice of strict infection prevention measures with main emphasis on decreasing transmission on health care workers' hands and cohort segregation of infected or colonized hospitalized patients with multidrug-resistant bacteria.
Continued surveillance of hospital water supply remains critical in preventing iatrogenic and hospital-related acquisition of these free living, nearly ubiquitous bacteria.
Immunization: preclinical experiments using outer membrane protein immunogenic epitopes against B. multivorans and B. cenocepacia appear promising.
Immunotherapy: various strategies to boost innate local immune response against gram-negative bacteria are being investigated.
Инфекции вызванные Burkholderia cepacia, Burkholderia pseudomallei, Stenotrophomonas maltophilia, Acinetobacter
Burkholderia cepacia. Возбудитель хронических заболеваний лёгких у пациентов с муковисцидозом. Инфекция характеризуется нарушениями функции лёгких и молниеносной септицемией. В лечебных учреждениях происходит её передача от одного пациента с муковисцидозом к другому. Возбудитель обладает природной устойчивостью к большинству антибиотиков.
Антимикробную терапию назначают только после проведения тестов на чувствительность микроорганизма к антибактериальным препаратам (обычно применяют цефалоспорины широкого спектра действия, карбапенемы или уреидопенициллины).
Burkholderia pseudomallei. Сапрофит, обитающий в почве и водоёмах тропической зоны. Вызывает мелиоидоз (ложный сап), характеризующийся туберкулёзоподобными симптомами и развитием острой септицемии или множественных абсцессов. Септицемия часто приводит к летальному исходу. Диагностические мероприятия включают бактериологическое исследование крови и тканей больного. Для лечения используют цефтазидим.
Другой вид рода Burkholderia — Burkholderia mallei — вызывает похожую инфекцию у лошадей (сап), которая может перейти к человеку.
Возбудитель инфекции - бактерия Burkholderia cepacia
Stenotrophomonas maltophilia — грамотрицательная палочка, обитающая в почве и воде. Охотно колонизирует влажные поверхности и благодаря природной устойчивости к большинству антибиотиков представляет серьёзную угрозу для пациентов, помещённых в отделение интенсивной терапии, и для лиц со сниженным иммунитетом. Инфекция распространяется через предметы общего пользования и медицинские принадлежности (например, ингаляторы, катетеры идр.). Возбудитель вызывает септицемию и пневмонию.
Большинство штаммов устойчивы к действию аминогликозидов и карбапенемов, однако чувствительны к ко-тримоксазолу, тетрациклинам и иногда к цефалоспоринам широкого спектра действия.
Acinetobacter — мелкие грамотрицательные коккобациллы, обитающие в окружающей среде и обладающие природной устойчивостью к большинству антибиотиков. Обычно инфекция возникает у пациентов, находящихся на стационарном лечении (особенно в отделении интенсивной терапии). Возбудитель колонизирует различные предметы в местах с высокой влажностью (например, увлажнители воздуха) и вызывает вспышки мультирезистентных инфекций. При генерализированном течении развивается пневмония, септицемия, менингит и инфекции мочевыводящих путей.
В группу риска входят пациенты, принимающие антибиотики, с множеством установленных катетеров, после интубации трахеи. Антибактериальное лечение назначают после проведения тестов на чувствительность к антибиотикам.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Жгутиконосцы. Трихомоноз. Возбудитель трихомоноза.
Особенность жгутиконосцев микроорганизмов — наличие одного или нескольких жгутиков. Принципиальное отличие жгутиков простейших от жгутиков бактерий — наличие в цитоплазме у основания жгутика особого органоида-кинетопласта, вырабатывающего энергию для его движения. У некоторых видов движение обеспечивает ундулирующая мембрана — тонкая перепонка, образованная продольным соединением одного из жгутиков с телом простейшего. Жгутиковые включают большое количество представителей, паразитирующих в организме человека, однако патогенными признано лишь четыре вида.
Возбудитель трихомоноза
Трихомоноз (трихомониаз)— венерическое заболевание, проявляющееся комплексным воспалительным поражением различных участков мочеполовой системы. Возбудитель — Trichomonas vaginalis, впервые его выделил А. Доннё (1837). Трихомонады выделяют из влагалища и мочеиспускательного канала женщин, мочеиспускательного канала и предстательной железы мужчин (человек — единственный природный хозяин).
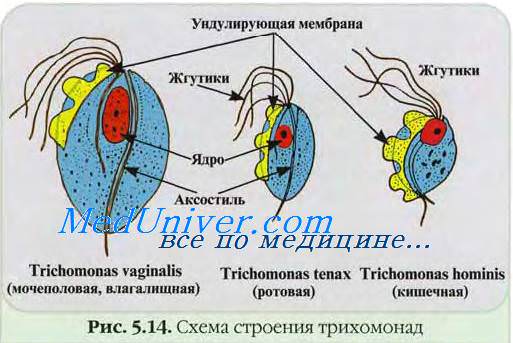
В организме человека также обитают трихомонады-комменсалы. В полости рта — Т. tenax (71 elongata), выделяемая из зубных камней и кариозных дефектов зубов; в толстом кишечнике — Т. hominis, выделяемая при диспептических расстройствах. Трихомоноз распространён повсеместно. До 25% женщин, ведущих активную половую жизнь, инфицированы трихомонада-ми. Риск заражения коррелирует с частотой половых контактов. Частота трихомоноза у мужчин и женщин одинакова.
Морфология и культуральные свойства возбудителя трихомоноза
Возбудитель трихомоноза имеет грушевидное тело 14-30 мкм длиной, вытянутое ядро, смещённое в передний ко-нец, и вакуолизировэнную цитоплазму (рис. 37-3). На переднем конце расположены четыре жгутика и ундулирующая мембрана, доходящая только до середины тела. Сквозь всё тело проходит осевая нить — аксостиль, выступающая на заднем конце в виде шипика. Т. vaginalis можно культивировать на питательных средах, на клеточных культуpax и куриных эмбрионах. Наиболее пригодная среда для культивирования — печёночная среда с цистеином, пептоном и мальтозой. Трихомонады предпочитают анаэробные условия, рН 5,5-6,0, температуру культивирования 35-37 "С.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Что такое трихомониаз? Причины возникновения, диагностику и методы лечения разберем в статье доктора Агапова Сергея Анатольевича, венеролога со стажем в 39 лет.
Над статьей доктора Агапова Сергея Анатольевича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов
Определение болезни. Причины заболевания
Урогенитальный трихомониаз — это передающаяся половым путём инфекция мочеполовой системы, вызванная влагалищной трихомонадой (Trichomonas vaginalis).
Насколько распространён трихомониаз
Что такое трихомониаз, трихомонады и их виды
Причиной заболевания является инфицирование мочеполовых органов влагалищной трихомонадой — одноклеточным жгутиковым простейшим организмом изменчивой формы, который в естественных условиях может существовать и размножаться только в организме человека. Помимо вагинальной трихомонады у человека могут паразитировать ещё два вида — кишечная трихомонада (Pentatrichomonas hominis) и ротовая (Trichomonas tenax), однако их роль в возникновении заболеваний мочеполовой системы не установлена.
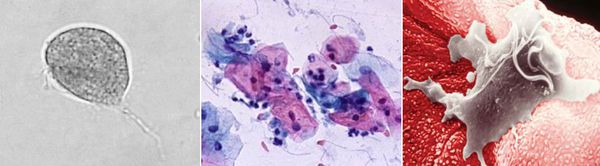
Трихомонада, так как не образует цист и других устойчивых форм, быстро погибает во внешней среде вследствие высыхания, легко разрушается при кипячении, воздействии антисептиков и этилового спирта. Однако может сохранять некоторое время жизнеспособность во влажной среде. Исследованиями установлено, что трихомонады могут выживать до 45 минут на сидениях унитазов, нижнем белье и в воде ванны. [3]
Как можно заразиться трихомониазом
Пути передачи инфекции:
Факторами риска являются:
- случайные половые связи;
- половой контакт, незащищённый барьерной контрацепцией (презервативом);
- злоупотребление алкоголем и наркомания; [7]
- атрофия шейки матки — вследствие снижения защитных свойств из-за уменьшения эстрогенов в тканях; [8]
- наличие других половых инфекций, таких как ВИЧ-инфекция, бактериальный вагиноз, вульвовагинальный кандидоз, генитальный герпес, хламидиоз. [9]
Защищает ли презерватив от трихомониаза
Использование презервативов снижает вероятность заражения. Однако микроорганизмы могут попасть на области, не закрытые ими, поэтому презервативы не могут полностью защитить от трихомониаза [52] .
Передаётся ли трихомониаз во время орального секса
Микроорганизмы способны поражать различные части тела, например, руки или рот. Оральный секс с инфицированным партнёром может привести к заражению трихомониазом ротовой полости [52] .
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы трихомониаза
Чаще трихомониаз диагностируется у женщин, чем у мужчин. У 10-30 % женщин и у 45-50 % мужчин отмечается асимптомное течение заболевания . [10]
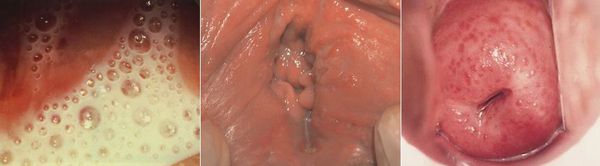
Симптомы трихомониаза у женщин
У женщин трихомонады преимущественно поражают влагалище, откуда они могут проникать в уретру, бартолиновы железы, мочевой пузырь и канал шейки матки. В редких случаях трихомонады паразитируют в полости матки, маточных трубах, почечных лоханках и прямой кишке. [11]
Основными симптомами трихомониаза у женщин являются:
Редкими проявлениями трихомониаза у женщин являются:
- макулярный кольпит (клубничный цервикс) — кровоизлияния в слизистую влагалища и шейку матки, напоминающее ягоду клубники; [12]
- эрозивно-язвенные поражения вульвы и преддверия влагалища. [13]
Симптомы трихомониаза у мужчин
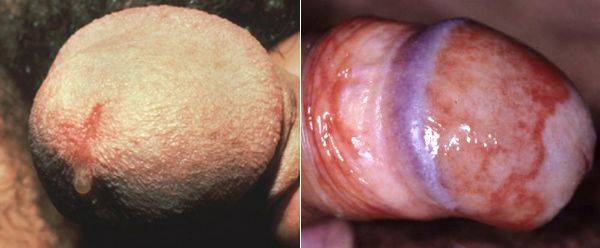
У мужчин трихомонады поражают слизистую оболочку мочеиспускательного канала, нередко проникая в уретральные железы и лакуны. Ввиду неблагоприятных условий для существования в мужской уретре трихомонад, заболевание часто носит транзиторный (временный) характер. Этим же объясняется и большой процент асимптомных форм трихомониаза у мужчин. [14]
Основными симптомами трихомониаза у мужчин являются:
Редким проявлением трихомониаза у мужчин является баланопостит (воспаление головки и крайней плоти полового члена). Описаны его эрозивно-язвенные формы. [15]
Патогенез трихомониаза
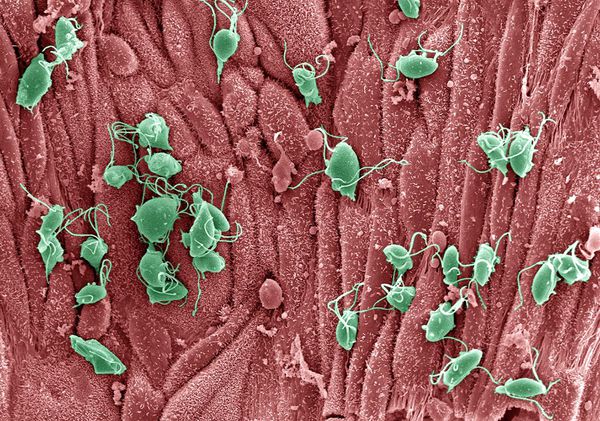
Проникая в урогенитальный тракт человека, трихомонады прикрепляются к эпителиальным клеткам, что приводит к повреждению и воспалительной реакции клеток эпителия. В этой реакции важное значение имеет адгезин — белок, продуцируемый паразитом. [16]
Трихомонады выделяют многочисленные протеолитические ферменты, которые участвуют в цитотоксичности, гемолизе (разрушении эритроцитов и выделении гемоглобина) и уклонении от иммунных реакций. Ферменты находятся во влагалищных выделениях инфицированных женщин вместе с антителами, которые их распознают. Важную роль играет фермент муциназа, который значительно облегчает проникновение трихомонад в слизистые оболочки. [17]
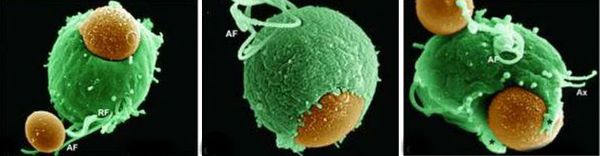
Трихомонадная инфекция вызывает клеточный, гуморальный и секреторный иммунные ответы. Однако эти реакции не способны защитить пациентов от реинфекции, поэтому повторное инфицирование встречается часто. Антитела и компоненты комплемента, присутствующие в сыворотке крови и секрете половых желез у некоторых больных, могут воздействовать на паразита путём стимуляции нейтрофилов, которые способствуют уничтожению трихомонад через классическую систему комплемента. Также антитела могут блокировать адгезию (прилипание) паразита к поверхности слизистой оболочки. [21]
Классификация и стадии развития трихомониаза
По Международной классификации болезней 10-го пересмотра трихомониаз разделяют на:
A59.0 Урогенитальный трихомониаз;
- Бели (вагинальные выделения), вызванные Trichomonas vaginalis; (N51.0), вызванный Trichomonas vaginalis;
A59.8 Трихомониаз других локализаций;
A59.9 Трихомониаз неуточнённый.
Стадии заболевания
После скрытого (инкубационного) периода, продолжающегося от 4 до 28 дней с момента заражения, приблизительно у 40-50% мужчин появляются признаки уретрита в виде слизистых выделений из уретры, а у 70-90% женщин — признаки вульвовагинита, характеризующегося зудом, жжением и наличием обильных мутных выделений из влагалища. [10] В остальных случаях болезнь протекает первоначально бессимптомно. В дальнейшем, если вовремя не получено лечение, развитие заболевания происходит по следующим сценариям:
- Длительное бессимптомное носительство, при котором нет никаких субъективных и объективных симптомов.
- Длительное рецидивирующее течение, при котором симптомы заболевания могут временно возобновляться и самопроизвольно исчезать.
- Ранее развитие осложнений может возникать как при течении заболевания с клиническими симптомами, так и при бессимптомном течении.
- Позднее развитие осложнений возникает при длительно текущем бессимптомном или хроническом рецидивирующем процессе.
Осложнения трихомониаза
В отличии от других половых инфекций – хламидийной и гонококковой — осложнения при трихомониазе встречаются гораздо реже.
Осложнения у мужчин
Эпидидимит — воспаление придатка яичка, очень редкое осложнение трихомонадной инфекции. Чаще всего это хронический процесс, хотя встречаются описания острых форм. [22]
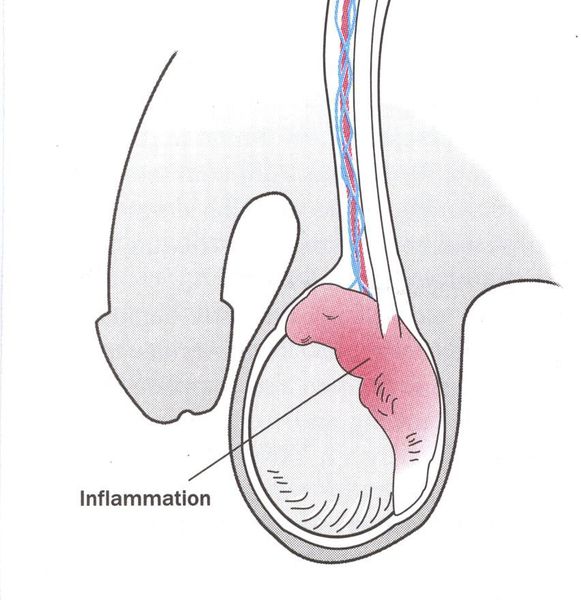
Редким осложнением трихомониаза является простатит. Сообщается о нескольких случаях хронического простатита, вызванного трихомонадной инфекцией. [23]
Нарушение фертильности. Проведенные исследования показывают негативное воздействие трихомонад на сперматозоиды мужчин в виде снижения их подвижности. [24]
Сообщается также о случае трихомонадного двухстороннего конъюнктивита. [31]
Осложнения у женщин
Воспалительные заболевания малого таза, вызванные вагинальной трихомонадной инфекцией, являющиеся причиной трубного бесплодия и синдрома хронической абдоминальной боли, описаны, в основном, у ВИЧ-позитивных женщин. [25]
Проведённые исследования указывают на повышенный риск преждевременных родов, рождения ребёнка с низким весом у инфицированных влагалищной трихомонадой женщин. [26]
Также трихомонадная инфекция в 2-3 раза увеличивает риск заражения ВИЧ. [32]
Очень редким осложнением трихомониаза является цистит. В медицинской литературе описано всего несколько случаев. [33]
Прочие осложнения
Сообщалось о паранефральном абсцессе [27] , абсцессе головного мозга [28] у новорождённого, абсцессе срединного шва полового члена [29] у мужчины, вызванных вагинальной трихомонадой.
Описаны случаи неонатальной трихомонадной пневмонии у новорождённых, успешно вылеченных метронидазолом. [30]
Диагностика трихомониаза
Для диагностики трихомониаза применяются микроскопические, цитологические, бактериологические, молекулярные лабораторные тесты и инструментальные методы обследования.
Показаниями для диагностики трихомониаза являются [2] :
- наличие признаков воспалительного процесса мочеполовых органов;
- беременность (при постановке на учёт по поводу беременности, при сроке беременности 27-30 недель и 36-40 недель, при поступлении на роды без документов о результатах обследования на половые инфекции);
- предстоящие оперативные вмешательства на половых органах и органах малого таза;
- бесплодие и выкидыши в анамнезе;
- половые контакты с больными половыми инфекциями;
- сексуальное насилие.
Микроскопическое исследование
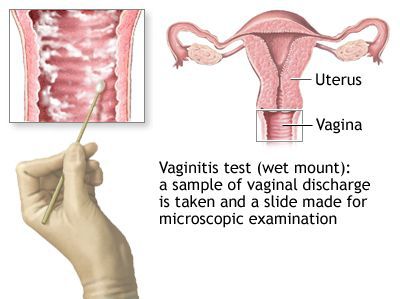
Микроскопия окрашенного препарата (окраска по Романовскому, Папаниколау) не рекомендуется из-за субъективизма при интерпретации результатов исследования. [2]
Культуральное исследование
Молекулярно-биологические методы
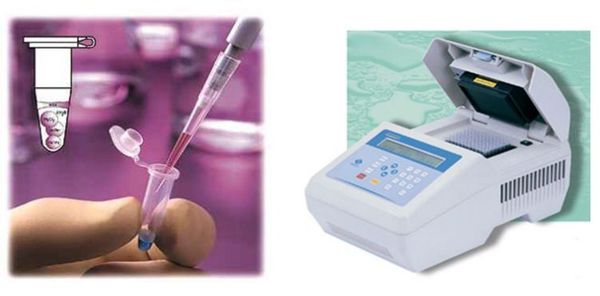
Материалом для исследования методом ПЦР при диагностике трихомониаза являются:
- у женщин: выделения из уретры, канала шейки матки, влагалища, первая порция мочи);
- у мужчин: выделения или соскоб из уретры, первая порция мочи, секрет предстательной железы, в редких случаях — сперма. [2]
Требования для получения достоверных результатов исследования:
- Забор материала должен осуществляться не ранее чем через месяц после полученного лечения.
- При отсутствии или скудных выделениях из уретры забор материала должен проводиться через 2-3 часа после последнего мочеиспускания, а при наличии обильных выделений — через 10-15 минут после мочеиспускания.
- Во время менструации забор материала для исследования проводить запрещается.
- Должны быть соблюдены сроки и условия доставки образцов в лабораторию.
Серологическое исследование
Метод иммуноферментного анализа (ИФА) для обнаружения антител классов IgA, IgM и IgG к антигенам T. vaginalis применять не допустимо. [2]
Применение биологических (парентеральное введение пирогенала, гоновакцины), химических (внутриуретральное введение растворов серебра) и алиментарных провокаций (приём алкоголя и острой пищи) с целью повышения выявляемости трихомонад при проведении лабораторных тестов нецелесообразно, так как эффективность этого метода не доказана. [2]
Лечение трихомониаза
Многочисленными исследованиями и клиническими испытаниями было установлено, что наиболее эффективными препаратами для лечения трихомониаза являются препараты группы 5-нитроимидазолов, а среди них — метронидазол, тинидазол и орнидазол.
Современными отечественными и зарубежными руководствами предложены следующие схемы лечения этими препаратами.
Метронидазол (Трихопол, Метрогил, Флагил) — эффективность его применения составляет 90-95%.
Для неосложнённых форм заболевания: 500 мг перорально 2 раза в сутки в течение 7 дней [36] или 2,0 г перорально однократно. [37]
Для осложнённых форм: 500 мг перорально 3 раза в сутки в течение 7 дней или 2,0 г внутрь 1 раз в сутки в течение 5 дней. [38]
Для беременных: 2,0 г однократно (лечение проводится не ранее II триместра беременности). [39]
Для детей: 10 мг на кг массы тела перорально 3 раза в сутки в течение 5 дней. [40]
Тинидазол (Фазижин, Тиниба) — эффективность применения составляет 86-100%.
Для неосложнённых форм заболевания: 500 мг перорально 2 раза в сутки в течение 5 дней или 2,0 г перорально однократно. [35]
Для осложнённых форм: 2,0 г перорально 1 раз в сутки в течение 3 дней. [37]
Орнидазол (Тиберал, Гайро, Дазолик) — эффективность применения составляет 90-100%.
Для неосложнённых форм заболевания: 500 мг перорально 2 раза в сутки в течение 5 дней [41] или 1,5 г перорально однократно. [42]
Для осложнённых форм: 500 мг перорально 2 раза в сутки в течение 10 дней. [38]
Для детей: 25 мг на кг массы тела перорально 1 раз в сутки в течение 5 дней. [39]
Другие препараты из группы 5-нитроимидазолов — менее распространены и изучены, чем вышеизложенные препараты, однако применяются в клинической практике:
- Тенонитрозол (Атрикан) — 250 мг перорально 2 раза в день в течение 4 дней; [43]
- Ниморазол (Наксоджин) — схемы применения при неосложнённом трихомониазе: 2,0 г перорально однократно или 1,0 г перорально через каждые 12 часов – три приёма, или 250 мг перорально 2 раза в день в течение 6 дней. [44]
- Секнидазол (Тагера) — 2,0 г перорально однократно (эффективность 97%). [45]
Причины неудач в лечении
В 5 % случаев трихомонады устойчивы (резистентны) к перечисленным препаратам [46] . Центры по контролю за заболеваемостью (США) в таких случаях рекомендуют увеличить дозировку и длительность применения медикаментов [47] : Метронидазол — 2,0 г перорально однократно в сутки в течении 7 дней или Тинидазол 2,0 г перорально однократно в сутки в течении 7 дней.
Дисульфирам-подобная реакция на препараты
Нитроимидазолы блокируют и снижают выработку фермента алкоголь-дегидрогеназы, что приводит к повышению уровня и накапливанию токсического ацетальдегида в крови. При приёме алкоголя в любых концентрациях во время лечения препаратами, входящими в группу нитроимидазолов, через 10-20 минут возникает реакция в виде тошноты, рвоты, головной боли, затруднения дыхания, судорог. Длительность её составляет несколько часов. Реакция наблюдается при приёме метронидазола, тинидазола [48] и орнидазола [49] .
Помимо исключения алкоголя, рекомендаций по изменению привычек или особенностям питания при лечении трихомониаза нет.
Установление излеченности трихомонадной инфекции
Проводится через две недели после окончания лечения микроскопией и культуральным посевом и через 4 недели методом ПЦР. При отрицательных результатах лабораторных тестов пациенты дальнейшему наблюдению не подлежат. [2]
Можно ли заниматься сексом при трихомониазе
Заниматься сексом можно через 7-10 дней после завершения лечения трихомониаза. Примерно каждый пятый выздоровевший заражается вновь в течение трёх месяцев после окончания лечения. Чтобы избежать повторного заражения, лечение должны пройти все сексуальные партнеры. Если симптомы возникли снова, нужно пройти повторное обследование [52] .
Прогноз. Профилактика
Прогноз при раннем выявлении и вовремя начатом лечении благоприятный. При неосложнённых формах трихомонадной инфекции после однократного курса выздоровление составляет 95-100%. Лица с осложнёнными формами и метронидазол-устойчивыми формами заболевания после проведённого лечения должны находиться под динамическим наблюдением.
Половые партнёры больных трихомониазом должны быть пролечены независимо от результатов их обследования на наличие трихомонад.
Самой эффективной мерой профилактики является использование презервативов при случайных половых контактах.
Ввиду бессимптомного течения инфекции лицам, имеющим несколько половых партнёров в год или случайные половые связи, рекомендовано ежегодное обследование на наличие трихомонад.
В настоящее время вакцины, предотвращающей заражение трихомониазом, не создано. В 80-е годы прошлого века была создана коммерческая вакцина Солкотриховак, состоящая из лиофилизата Lactobacillus acidophilus, которая по утверждению фирмы-производителя оказывает положительный эффект при рецидивирующем трихомониазе и бактериальном вагинозе. [50] Однако последующими исследованиями предположение о том, что защитный механизм действия вакцины связан на антигенном сходстве применяемых штаммов лактобацилл и вагинальной трихомонады, было отвергнуто. [51]
Читайте также:

