Тромбоцитопения при инфекционном мононуклеозе
Обновлено: 24.04.2024
Рассматриваемое заболевание — одно из наиболее часто встречающихся иммуноопосредованных гематологических заболеваний в детском возрасте, зачастую оно является причиной развития жизнеугрожающих состояний. В приведенных разборах клинических случаев специалисты Морозовской ДГКБ (Москва) обращают особое внимание на отслеживание развития патогенетических механизмов, обусловленных вирусной инфекцией — ведущей причиной возникновения тромбоцитопенической пурпуры у детей.
Рассматриваемое заболевание — одно из наиболее часто встречающихся иммуноопосредованных гематологических заболеваний в детском возрасте, зачастую оно является причиной развития жизнеугрожающих состояний. В приведенных разборах клинических случаев специалисты Морозовской ДГКБ (Москва) обращают особое внимание на отслеживание развития патогенетических механизмов, обусловленных вирусной инфекцией — ведущей причиной возникновения тромбоцитопенической пурпуры у детей.
Тромбоцитопеническая пурпура (ТПП) — заболевание, характеризующееся генерализованным геморрагическим синдромом, обусловленным изолированной тромболитической тромбоцитопенией (менее 150 000/мкл, однако в реальной практике чаще встречаются случаи менее 50 000/мкл), при отсутствии иных отклонений при подсчете форменных элементов в мазке крови. При этом данный диагноз может быть поставлен только после исключения у пациента других заболеваний или факторов, способных вызвать тромбоцитопению (системная красная волчанка, лейкозы, миелодисплазии, агаммаглобулинемия, врожденные и наследственные тромбоцитопении).
Иммуноопосредованное заболевание
Данное заболевание является одним из наиболее часто встречающихся иммуноопосредованных гематологических заболеваний в детском возрасте, зачастую являясь причиной развития жизнеугрожающих состояний за счет высокого риска развития профузных кровотечений и внутричерепных кровоизлияний.
Ведущей причиной возникновения тромбоцитопенической пурпуры у детей является вирусная инфекция, запускающая следующие патогенетические механизмы: продукцию антиидиотипических антител к антивирусным антителам; усиление экспрессии молекул главного комплекса гистосовместимости (HLA I и II класса), сходных с определенными участками вирусных геномов; нарушения иммунного ответа хозяина; изменения эндогенных антигенов; инфицирование и разрушение клеток костного мозга путем прямого клеточного уничтожения.
Особая роль вирусов семейства Herpes (HSV-I/II, CMV, EBV, HHV-6) при развитии ТПП обусловлена повсеместным распространением с неуклонным ростом заболеваемости (ВОЗ), а также их широким тканевым тропизмом, позволяющим в полной мере реализовывать вышеуказанные механизмы. Как правило, данные процессы запускаются в момент первичного инфицирования, проявляющегося клиникой инфекционного мононуклеоза.
Далее мы приведем наши собственные клинические наблюдения о развитии ТПП у детей с инфекционным мононуклеозом.
Клинический случай 1
Девочка С., 15 лет, до настоящего заболевания росла и развивалась по возрасту; наследственный анамнез не отягощен; вакцинирована согласно Национальному календарю профилактических прививок, сильных реакций на вакцинацию не отмечалось.
Состояние при поступлении тяжелое. Не лихорадит. Кожные покровы бледные, на ногах петехиальная сыпь, расположена симметрично. Слизистая ротоглотки бледная, отмечаются геморрагические кровоизлияния на верхнем небе, губах, язык.

Пациентка жаловалась на боль в горле, заложенность носа, сильную потливость, слабость, тяжесть в правом подреберье, высокую температуру, сыпь на груди, увеличенные лимфоузлы на шее.
Анамнез
Пациентка заболела 4 дня назад, когда отметила днём резкий подъём температуры до 39 °C, затем присоединилась слабость, головная боль, небольшое першение в горле. Девушка расценила состояние как начало обычного ОРВИ. Стала принимать ибупрофен, температура снижалась на пару часов и повышалась снова.
На следующий день боль в горле усилилась появились налёты, температура была 38,5 °C. Пациентка вызвала врача на дом. После осмотра поставлен диагноз "лакунарная ангина", взят мазок на BL (возбудителя дифтерии). Назначено лечение:
- полоскание зева раствором фурацилина; ; ;
- ибупрофен.
На фоне данного лечения состояние не улучшалось, нарастали симптомы интоксикации, на приёме терапевт направил пациентку на общий анализ крови с пометкой "cito" (т. е. срочно) и на приём к инфекционисту.
Девушка учится на 3 курсе Рязанского государственного радиотехнического университета, вредные привычки отрицает, живёт в нормальных условиях с родителями и младшей сестрой.
Обследование
При физикальном осмотре: кожные покровы влажные, с мелкоточечной сыпью на груди. По ходу грудино-ключично-сосцевидной мышцы пальпируются два увеличенных лимфоузла диаметром 4 х 4 см, лимфоузлы мягкие, неспаянные с кожей, болезненные. При осмотре зева: миндалины отёчные, гиперемированные, рыхлые, увеличены, виден белый налёт в лакунах.
Дыхание в лёгких везикулярное (хрипов нет), частота дыхательных движений 22 в минуту. Тоны сердца ясные, ритм правильный, частота сердечных сокращений 96 ударов в минуту, артериальное давление 110/70 мм рт. ст. Живот мягкий, безболезненный. Печень + 2 см из под края рёберной дуги, край мягкий эластичный. Стул и диурез (объём мочи) в норме.
В анализе крови моноцитоз (увеличение числа моноцитов в крови) и лимфоцитоз (увеличение числа лимфоцитов в крови):
- лейкоциты — 18,9 x 10^9/л;
- СОЭ — 30 мм/ч;
- эритроциты — 3,9 х 10^12/л;
- гемоглобин — 128 г/л.
Инфекционистом пациентка была направлена на анализы: биохимический анализ крови (АЛТ, АСТ, билирубин общий, прямой, непрямой, глюкоза, холестерин, щелочная фосфатаза), ВИЧ, RW (сифилис), гепатиты В и С, антитела к вирусу Эпштейна — Барр (ВЭБ).
- гепатиты В и С, ВИЧ, RW — отрицательно;
- обнаружены антитела IgM (иммуноглобулин М) к вирусу Эпштейна — Барр.
- АЛТ — 425 ЕД/л;
- АСТ — 308 ЕД/л;
- билирубин общий — 26 мкмоль/л;
- непрямой — 6 мкмоль/л;
- прямой — 20 мкмоль/л;
- щелочная фосфатаза — 280 Ед/л;
- глюкоза — 5,4 ммоль/л;
- холестерин 4,2 — ммоль/л.
Диагноз
Лечение
- Полупостельный режим.
- Обильное питьё.
- Диета № 5 (рекомендована для людей с заболеваниями печени и желчного пузыря). — по 2 таблетке 3 раза в день в течение 10 дней. 500 мг — по 1 таблетке 2 раза в день в течение 10 дней 400 мг — по 1 таблетке 2 раза в день в течение 10 дней. — по 1 таблетке 4 раза в день рассасывать.
- Ибупрофен 400 мг — при температуре выше 38,5 °C.
- Полоскание зева раствором фурацилина.
На фоне лечения улучшилось общее самочувствие, нормализовалась температура тела, исчезли воспалительные изменения в горле, уменьшились лимфоузлы. Общий анализ крови практически нормализовался, оставались повышены моноциты, биохимический анализ крови нормализовался в течение двух месяцев.
Лечение длилось 21 день, закончилось выздоровлением. Далее пациентка в течение года находилась на диспансерном наблюдении.
Заключение
Данный клинический случай показывает типичное течение инфекционного мононуклеоза, вызванного ВЭБ. Этим заболеванием часто болеют молодые люди — студенты, которые постоянно контактируют с большим количеством людей, часто испытывают стресс и не имеют строгого режима дня и питания.
Эпштейна-Барр вирусная инфекция (ЭБВИ) относится к наиболее распространенным инфекционным заболеваниям человека. Антитела (Ат) к вирусу Эпштейна-Барр (ВЭБ) обнаруживают у 60% детей первых двух лет жизни и у 80–100% взрослых [3, 13]. Заболеваемость острой формой ЭБВИ (ОЭБВИ) в различных регионах мира колеблется от 40 до 80 случаев на 100 тыс. населения [2]. Хроническая форма ЭБВИ (ХЭБВИ) развивается у 15–25% лиц после ОЭБВИ [1, 5, 15]. Установлена роль ВЭБ в развитии злокачественных новообразований, аутоиммунных заболеваний и синдрома хронической усталости [3, 5, 14, 15]. Все это свидетельствует об актуальности проблемы ЭБВИ.
ВЭБ, открытый в 1964 г. M. Epstein и Y. Barr, относится к γ-герпес-вирусам [3]. ВЭБ имеет в своем составе 3 антигена: капсидный (VCA), ранний (EA) и ядерный (EBNA). Своеобразие патологического процесса при ЭБВИ определяется способностью ВЭБ к трансформации В-лимфоцитов, пожизненной персистенции в организме человека, индукции вторичного иммунодефицитного состояния (ИДС), аутоиммунных реакций, злокачественных опухолей [1, 3, 5, 12].
Источник заражения ВЭБ — больные манифестными и бессимптомными формами. 70–90% лиц, перенесших ОЭБВИ, выделяют вирус в последующие 1–18 мес. Пути передачи ВЭБ: воздушно-капельный, контактно-бытовой, парентеральный, половой, вертикальный. ОЭБВИ характеризуется эпидемическими подъемами 1 раз в 6–7 лет, чаще регистрируется в возрасте от 1 до 5 лет, в организованных коллективах [4, 7, 9].
Иммунный статус 109 больных ОЭБВИ в возрасте от 5 до 14 лет в нашей работе выявил признаки активации Т-клеточного звена иммунной системы — повышение количества Т-лимфоцитов (CD3), цитотоксических Т-лимфоцитов (CD8), клеток с маркерами поздней активации (HLA-DR); поликлональную активацию В-лимфоцитов — увеличение количества CD20-клеток, иммуноглобулинов (Ig) IgA, IgM, IgG, циркулирующих иммунных комплексов (ЦИК). Обнаружены признаки угнетения иммунной системы: нормальное содержание Т-хелперов (CD4), снижение иммунорегуляторного индекса CD4/CD8, количества естественных киллерных клеток NK (CD16), повышение готовности иммунокомпетентных клеток к апоптозу (CD95). Наблюдалась активация кислородзависимого метаболизма нейтрофилов и редукция его адаптационных возможностей.
У трети обследованных детей (33,9%) ОЭБВИ протекала в форме микст-инфекции с цитомегаловирусами (ЦМВ), вирусами простого герпеса 1 и 2 типов (ВПГ-1, ВПГ-2). При бактериологическом исследовании мазков из ротоглотки у 41,3% пациентов выделены Streptococcus (S.) viridans, у 11,9% — Candida albicans, у 8,2% — Staphilococcus (Staph.) epidermidis, у 6,4% — S. pyogenes, у 2,7% — Klebsiella (Kl.) pneumoniae, у 41,3% — ассоциация бактерий. У 43,1% пациентов — серологические маркеры активной формы хламидийной инфекции, у 30,3% — микоплазмоза.
Возможны следующие исходы ОЭБВИ: латентная инфекция, ХЭБВИ, ИДС, онкологические, аутоиммунные заболевания, синдром хронической усталости [5, 8, 10, 11]. Переход в ХЭБВИ связан с комплексом неблагоприятных факторов в анте-, интра- и постнатальном периодах, нарушением нейроиммунноэндокринной регуляции, генетической предрасположенностью.
Проведенное нами обследование 60 детей в возрасте от 5 до 14 лет с ХЭБВИ показало, что в этой группе у 86,7% матерей имел место отягощенный акушерский анамнез; у 83,3% детей обнаружены перинатальная и постнатальная патология ЦНС, ЛОР-органов и др.
Нарушения иммунного статуса приводили к активации условно-патогенной микрофлоры, вирусных и грибковых инфекций. В микробном спектре слизистой ротоглотки пациентов с ХЭБВИ выделены S. Viridans (30%), Candida albicans (28,3%), Staph. Epidermidis (25%), S. Pyogenes (20%), Kl. Pneumoniae (8,4%), ассоциация бактерий (41,7%); у 28,3% — серологические маркеры активной формы хламидиоза, у 26,7% — микоплазмоза. У 90% пациентов заболевание протекало в форме микст-инфекции с участием герпес-вирусов: ВЭБ + ЦМВ, ВЭБ + ВПГ-1, ВПГ-2.
Классификация. Общепринятая классификация заболевания отсутствует; рекомендуем использовать разработанную нами рабочую классификацию ЭБВИ.
- По периоду возникновения: врожденная, приобретенная.
- По форме: типичная (инфекционный мононуклеоз), атипичная: стертая, бессимптомная, висцеральная.
- По тяжести: легкая, среднетяжелая, тяжелая.
- По течению: острая, затяжная, хроническая.
- По фазе: активная, неактивная.
- Осложнения: гепатит, разрыв селезенки, менингоэнцефалит, полирадикулонейропатия, миокардит, синусит, отит, гемолитическая анемия, тромбоцитопения, нейтропения, панкреатит и др.
- Микст-инфекция.
Примеры оформления диагноза:
- Осн.: Приобретенная ЭБВИ, типичная тяжелая форма (инфекционный мононуклеоз), острое течение, активная фаза. Осл.: Острый гепатит.
- Осн.: Приобретенная ЭБВИ, висцеральная форма (менингоэнцефалит, гепатит, нефрит), тяжелое хроническое течение, активная фаза. Осл.: острая печеночно-почечная недостаточность. Сопp.: Респираторный хламидиоз (ринофарингит, бронхит, пневмония).
Клиническая картина острой ЭБВИ впервые была описана Н. Ф. Филатовым (1885) и Е. Пфейфером (1889). Инкубационный период длится от 4-х дней до 7 нед. Полный симптомокомплекс формируется к 4–10-му дням болезни [4, 7].
Нами обследованы 109 детей с ОЭБВИ. У большинства пациентов заболевание начинается остро, с повышения температуры тела и появления симптомов интоксикации; реже отмечается постепенное начало: несколько дней наблюдается недомогание, слабость, вялость, снижение аппетита. Температура тела субфебрильная или нормальная. Ко 2–4-му дням болезни температура достигает 39–40 °С; лихорадка и симптомы интоксикации могут сохраняться в течение 2–3 и более недель.
Тонзиллит — наиболее частый и ранний симптом ОЭБВИ, сопровождается увеличением миндалин до II-III степени. Лакунарный рисунок подчеркнут за счет инфильтрации ткани миндалин или сглажен из-за лимфостаза. На миндалинах — налеты желтовато-белого или грязно-серого цвета в виде островков, полосок. Они исходят из лакун, имеют шероховатую поверхность (напоминают кружево), легко снимаются без кровоточивости, растираются, не тонут в воде. Характерно несоответствие размера налета и степени увеличения регионарных ЛУ. При фибринозно-некротическом характере налетов в случае их распространения за пределы миндалин необходим дифференциальный диагноз с дифтерией. Налеты на миндалинах исчезают, как правило, через 5–10 дней.
Гепатомегалия может быть обнаружена с первых дней болезни, однако чаще выявляется на второй неделе. Нормализация размеров печени происходит в течение полугода. У 15–20% больных в качестве осложнения развивается гепатит.
Спленомегалия относится к поздним симптомам, встречается у большинства больных. Нормализация размеров селезенки происходит в течение 1–3 нед.
Экзантема при ОЭБВИ появляется на 3–14-й дни болезни, имеет полиморфный характер — пятнистая, папулезная, пятнисто-папулезная, розеолезная, мелкоточечная, геморрагическая. Определенной локализации нет. Сыпь наблюдается в течение 4–10 дней, иногда оставляет пигментацию. У детей, получавших ампициллин или амоксициллин, сыпь появляется чаще (90–100%).
Гематологические изменения включают лейкоцитоз (10–30 х 10 9 /л), нейтропению с палочкоядерным сдвигом влево, увеличение количества лимфоцитов, моноцитов, атипичных мононуклеаров до 50–80%, повышение СОЭ до 20–30 мм/час. Характерный гематологический признак — атипичные мононуклеары в количестве 10–50%: они появляются к концу первой недели заболевания, сохраняются в течение 1–3 нед.
Хроническая ЭБВИ является исходом ОЭБВИ или развивается как первично-хроническая форма [2, 5, 8, 10, 11, 15]. Нами обследовано 60 детей с ХЭБВИ, клиника которой включала хронический мононуклеозоподобный синдром и полиорганную патологию. У всех пациентов обнаружены лимфопролиферативный синдром (генерализованная лимфаденопатия, гипертрофия небных и глоточной миндалин, увеличение печени и селезенки) и признаки хронической интоксикации (длительный субфебрилитет, слабость, снижение аппетита и др.). Вследствие развития ИДС наблюдались острые инфекции респираторного тракта и ЛОР-органов с обострениями до 6–11 раз в год: ринофарингиты (28,3%), фаринготонзиллиты (91,7%), аденоидиты (56,7%), отиты (11,7%), синуситы (20%), ларинготрахеиты (18,3%), бронхиты (38,3%), пневмонии (25%). Обращала внимание высокая частота полиорганной патологии, обусловленная длительной репликацией ВЭБ, вторичным ИДС, аутоиммунными реакциями (патология ЦНС; хронический гастрит, дискинезия желчевыводящих путей; кардиальный синдром, артралгии).
В последние годы описана врожденная ЭБВИ. Установлено, что риск ее при первичной ЭБВИ во время беременности составляет 67%, при реактивации — 22%. Клиника врожденной ЭБВИ сходна с ЦМВИ.
Установлена роль ВЭБ в развитии онкологических заболеваний и паранеопластических процессов — лимфомы Беркетта, назофарингеальной карциномы, лимфогранулематоза, опухолей желудка, кишечника, слюнных желез, матки, лейкоплакии языка и слизистой ротовой полости, а также ряда аутоиммунных заболеваний — системной красной волчанки, ревматоидного артрита, синдрома Шегрена, лимфоидного интерстициального пневмонита, хронического гепатита, увеита и др. [3, 5, 14, 15]. ВЭБ, наряду с вирусами герпеса человека 6 и 7 типов, является этиологическим фактором синдрома хронической усталости и наиболее частой причиной (15%) развития длительной лихорадки неясного генеза.
Диагностика ЭБВИ основана на учете групп риска, ведущих клинических синдромов и данных лабораторного исследования [8–11]. К группам риска у матери относят отягощенный анамнез, маркеры герпес-вирусных инфекций и др., у ребенка — перинатальное поражение ЦНС, аллергический фенотип, ИДС, маркеры герпес-вирусных инфекций и др. Ведущими клиническими синдромами ЭБВИ являются мононуклеозоподобный, общеинфекционный синдромы, экзантема, синдром полиорганной патологии.
В обязательный стандарт диагностики ЭБВИ входят клинический анализ крови, общий анализ мочи, биохимическое исследование крови, бактериологическое исследование слизи ротоглотки и носа, серологические маркеры ВЭБ, других герпес-вирусов, хламидий, микоплазм, УЗИ органов брюшной полости, консультация ЛОР-врача, по показаниям — рентгенография придаточных пазух носа, органов грудной клетки, ЭКГ. Дополнительный стандарт диагностики (в специализированном лечебно-профилактическом учреждении): маркеры ВЭБ, других герпес-вирусов, хламидий, микоплазм методом полимеразной цепной реакции (ПЦР), иммунограмма второго уровня, консультация иммунолога, по показаниям — коагулограмма, морфологическая картина стернальной пункции, консультация гематолога, онколога.
Методом иммуноферментного анализа (ИФА) определяют Ат к антигенам ВЭБ, что позволяет осуществить лабораторную диагностику ЭБВИ и определить период инфекционного процесса.
Ат класса IgM к VCA появляются одновременно с клиникой ОЭБВИ, сохраняются в течение 2–3 мес, повторно синтезируются при реактивации ВЭБ. Длительная персистенция высоких титров этих Ат характерна для ХЭБВИ, ВЭБ-индуцированных опухолей, аутоиммунных заболеваний, ИДС.
Ат класса IgG к EA достигают высокого титра на 3–4-й нед ОЭБВИ, исчезают через 2–6 мес. Они появляются при реактивации, отсутствуют при атипичной форме ЭБВИ. Высокие титры Ат данного класса выявляют при ХЭБВИ, ВЭБ-индуцированных онкологических и аутоиммунных заболеваниях, ИДС.
Ат класса IgG к EBNA появляются через 1–6 мес после первичной инфекции. Затем их титр уменьшается и сохраняется в течение всей жизни. При реактивации ЭБВИ происходит повторное увеличение их титра.
Большое значение имеет исследование авидности Ат класса IgG (прочности связывания антигена с Ат). При первичной инфекции сначала синтезируются Ат с низкой авидностью (индекс авидности (ИА) менее 30%). Для поздней стадии первичной инфекции характерны Ат со средней авидностью (ИА — 30–49%). Высокоавидные Ат (ИА — более 50%) образуются через 1–7 мес после инфицирования ВЭБ.
Серологическими маркерами активной фазы ЭБВИ являются Ат IgM к VCA и Ат IgG к EA, низкая и средняя авидность Ат IgG к маркерам неактивной фазы, Ат IgG к EBNA.
Материалом для ПЦР служат кровь, ликвор, слюна, мазки со слизистой ротоглотки, биоптаты органов и др. Чувствительность ПЦР при ЭБВИ (70–75%) ниже, чем при других герпесвирусных инфекциях (95–100%). Это связано с появлением ВЭБ в биологических жидкостях лишь при иммуноопосредованном лизисе инфицированных В-лимфоцитов.
На основании опыта лечения 169 детей с ЭБВИ нами разработан стандарт лечения этого заболевания.
Базисная терапия: охранительный режим; лечебное питание; противовирусные препараты: вироцидные препараты — инозин пранобекс (Изопринозин), аномальные нуклеозиды (Валтрекс, Ацикловир), Арбидол; препараты ИФН — рекомбинантный ИФН α-2β (Виферон), Кипферон, Реаферон-ЕС-Липинт, интерфероны для в/м введения (Реаферон-EC, Реальдирон, Интрон А, Роферон А и др.); индукторы ИФН — Амиксин, сверхмалые дозы антител к γ-ИФН (Анаферон), Циклоферон, Неовир. По показаниям: локальные антибактериальные препараты (Биопарокс, Лизобакт, Стопангин и др.); системные антибактериальные препараты (цефалоспорины, макролиды, карбапенемы); иммуноглобулины для внутривенного введения (Иммуновенин, Габриглобин, Интраглобин, Пентаглобин и др.); витаминно-минеральные комплексы — Мульти-табс, Вибовит, Санасол, Киндер Биовиталь гель и др.
Интенсификация базисной терапии по показаниям:
Симптоматическая терапия.
При лихорадке — жаропонижающие препараты (парацетамол, ибупрофен и др.); при затруднении носового дыхания — назальные препараты (Изофра, Полидекса, Називин, Виброцил, Адрианол и др.); при сухом кашле — противокашлевые препараты (Глаувент, Либексин), при влажном кашле — отхаркивающие и муколитические препараты (АмброГЕКСАЛ, бромгексин, ацетилцистеин и др.).
Эффективность этиотропной терапии ОЭБВИ оценена в двух группах больных. Пациенты 1-й группы (52 человека) получали инозин пранобекс (Изопринозин) в сочетании с рекомбинантным ИФН α-2β (Вифероном), больные 2-й группы (57 детей) — монотерапию рекомбинантным ИФН α-2β (Вифероном). Клинико-серологические показатели до начала лечения и через 3 мес терапии представлены в табл. 1. У пациентов обеих групп в динамике отмечалось достоверное уменьшение таких симптомов, как генерализованная лимфаденопатия, тонзиллит, аденоидит, гепатомегалия и спленомегалия. Вместе с тем на фоне комбинированной терапии, положительная динамика клинических показателей была более значительной; острые респираторные инфекции (ОРИ) лишь у 19,2% больных 1-й группы и у 40,3% больных 2-й группы (p < 0,05). На фоне комбинированной терапии наблюдалось более быстрое исчезновение серологических маркеров репликации.
Эффективность этиотропной терапии исследована у 60 больных ХЭБВИ. Пациенты 1-й группы (30 детей) получали инозина пранобекс (Изопринозин) и рекомбинантный ИФН α-2β (Виферон), 2-я группа (30 человек) — монотерапию рекомбинантным ИФН α-2β (Вифероном). Независимо от схемы лечения через 3 мес после начала терапии отмечалось достоверное уменьшение частоты генерализованной лимфаденопатии, гипертрофии небных и глоточной миндалин, спленомегалии, интоксикационного, инфекционного и вегето-висцерального синдромов (табл. 2). Комбинация инозина пранобекса (Изопринозина) с рекомбинантным ИФН α-2β (Вифероном) способствовало более существенной динамике клинических показателей. Количество эпизодов ОРИ снизилось с 6–11 (7,9 ± 1,1) до 4–6 (5,2 ± 1,2) в год на фоне монотерапии рекомбинантным ИФН α-2β (Вифероном), и до 2–4 (2,5 ± 1,4) в год на фоне комбинированной терапии (p < 0,05). В обеих группах уменьшалась частота репликации ВЭБ, однако при сочетанном применении противовирусных препаратов этот эффект был более выраженным.
Побочных эффектов при использовании инозина пранобекса (Изопринозина) и рекомбинантного ИФН α-2β (Виферона) не было.
Результаты проведенного исследования свидетельствуют о потенцировании эффектов при комбинации инозина пранобекса (Изопринозина) с рекомбинантным ИФН a-2b (Вифероном) у больных ЭБВИ.
Потенцирование противовирусных, иммуномодулирующих и цитопротекторных эффектов этих препаратов приводит к более существенной, чем при монотерапии, положительной динамике проявлений клинических симптомов ЭБВИ, к исчезновению серологических маркеров активности инфекционного процесса. Следует отметить высокую эффективность и безопасность комбинированной терапии с использованием инозина пранобекса (Изопринозина) и рекомбинантного ИФН α-2β (Виферона).
Реабилитация. Ребенок наблюдается участковым врачом и инфекционистом, снимается с учета через 6–12 мес после исчезновения клинико-лабораторных показателей активности инфекционного процесса. Кратность осмотров — 1 раз в месяц. По показаниям рекомендуют консультацию ЛОР-врача, иммунолога, гематолога, онколога и др. Лабораторные и инструментальные исследования пациентов включают: клинический анализ крови 1 раз в месяц в течение 3 мес, затем 1 раз в 3 месяца, по показаниям — чаще; серологические маркеры ВЭБ методом ИФА один раз в три месяца, по показаниям — чаще; ПЦР крови, мазков из ротоглотки 1 раз в 3 месяца, по показаниям — чаще; иммунограмма — 1 раз в 3–6 мес; биохимическое и инструментальное исследования — по показаниям.
Реабилитационная терапия включает: охранительный режим, лечебное питание, противовирусные препараты по пролонгированным схемам. Под контролем иммунограммы осуществляют иммунокоррекцию. По показаниям назначают локальные антибактериальные препараты, курсы витаминно-минеральных комплексов, про- и пребиотиков, препаратов метаболической реабилитации, энтеросорбентов, антигистаминные препараты, гепато-, нейро- и ангиопротекторы, кардиотропные препараты, ферменты, гомеопатические средства, немедикаментозные методы лечения.
Таким образом, ЭБВИ характеризуется широким распространением, длительным течением с периодической реактивацией инфекционного процесса у части пациентов, возможностью развития осложнений и неблагоприятных исходов (онкозаболеваний, аутоиммунной патологии). Важную роль при ЭБВИ играет формирование вторичного ИДС. Ведущими клиническими синдромами ЭБВИ являются острый и хронический мононуклеозоподобный синдромы, интоксикационный, инфекционный, церебральный, гастроинтестинальный, кардиальный и артралгический синдромы. Диагностика ЭБВИ основана на анализе групп риска, выделении ведущих клинических синдромов и лабораторном исследовании. Лечение ЭБВИ является комплексным и включает этиотропные средства (виростатические препараты, интерферон и его индукторы), препараты патогенетической, иммуномодулирующей, симптоматической терапии. Сочетанное пролонгированное использование инозина пранобекс (Изопринозина) и рекомбинантного ИФН α-2β (Виферона), потенцирующих свои иммунокорригирующие и цитопротекторные эффекты, существенно повышает эффективность лечения. Больные ЭБВИ нуждаются в длительной реабилитации с обязательным контролем клинико-лабораторных показателей активности инфекционного процесса.
По вопросам литературы обращайтесь в редакцию.
Э. Н. Симованьян, доктор медицинских наук, профессор
В. Б. Денисенко, кандидат медицинских наук
Л. Ф. Бовтало, кандидат медицинских наук
А. В. Григорян
Ростовский ГМУ, Ростов-на-Дону
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Инфекционный мононуклеоз: причины появления, симптомы, диагностика и способы лечения.
Определение
Инфекционный мононуклеоз – заболевание вирусной природы, при котором развивается лихорадка, увеличиваются печень и селезенка, лимфатические узлы, поражаются гортань, глотка. В крови регистрируются свойственные только этой патологии изменения (появление атипичных мононуклеаров, лимфоцитоз). В ряде случаев инфекционный мононуклеоз имеет хроническое течение, при некоторых состояниях клиническая картина стерта, что существенно затрудняет диагностику и постановку верного диагноза.
Причины появления инфекционного мононуклеоза
Заболевание вызывают вирусы семейства герпесвирусов, самым частым возбудителем считается вирус Эпштейна–Барр (ВЭБ, или вирус герпеса человека 4-го типа). Большинство людей переносят его в стертой клинической форме в детстве и юношестве, что подтверждается анализами крови на содержание иммуноглобулинов, которые вырабатываются в ответ на попадание вирусов в организм человека: по статистике у 9 из 10 взрослых положительные анализы крови на ДНК этого вируса.
Пути передачи вируса, вызывающего инфекционный мононуклеоз:
- Воздушно-капельный.
- Контактно-бытовой (в том числе половой).
- Парентеральный – во время переливания крови, пересадки органов и тканей в течение 6 предшествующих заболеванию месяцев.
К предрасполагающим факторам развития болезни относятся такие состояния, как снижение иммунитета, длительно текущие заболевания или обострение хронических патологий, неблагоприятная психоэмоциональная и экологическая обстановка.
Классификация заболевания
Единой общепринятой классификации инфекционного мононуклеоза нет. Для удобства формулировки диагноза используются следующие разделения патологии на группы:
По возбудителю:
- Вирус Эпштейна–Барр (ВЭБ).
- Цитомегаловирус.
- Вирус герпеса 6-го и 7-го типов (HV6, HV7).
- Аденовирус.
- Вирус иммунодефицита.
- Toxoplasma gondii (токсоплазма).
- Типичный – свойственная мононуклеозу клиническая картина и патогномоничные (характерные только для этого заболевания) изменения в анализах крови.
- Атипичный – стертая клиника, бессимптомное течение.
- Острый инфекционный мононуклеоз – проявления заболевания регистрируются в течение не более 3 месяцев.
- Затяжное течение (3–6 месяцев).
- Рецидивирующее течение – симптомы патологии возникают вновь через 1 месяц и менее после перенесенного заболевания.
- Хроническое – симптомы беспокоят более 6 месяцев.
Симптомы инфекционного мононуклеоза
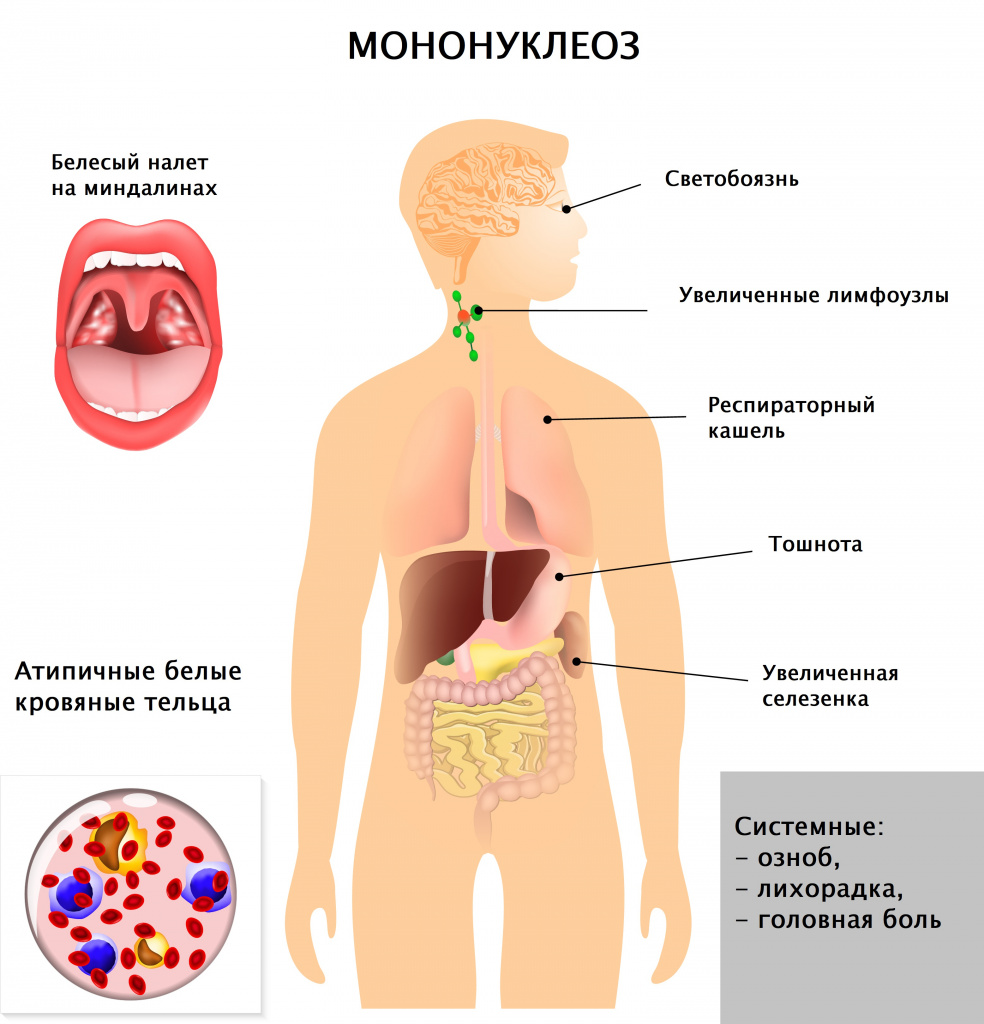
Диагностика инфекционного мононуклеоза
Врач в первую очередь собирает анамнез и проводит визуальный осмотр пациента. При осмотре обращают на себя внимание увеличенные группы лимфатических узлов (в тяжелых случаях не только шейной группы, но даже внутренние лимфатические узлы), гиперемия (краснота) зева, увеличение селезенки и печени, которое врач выявляет при пальпации и перкуссии живота.
Синонимы: Общий анализ крови, ОАК. Full blood count, FBC, Complete blood count (CBC) with differential white blood cell count (CBC with diff), Hemogram. Краткое описание исследования Клинический анализ крови: общий анализ, лейкоформула, СОЭ См. также: Общий анализ – см. тест № 5, Лейкоцит.
Читайте также:

