Туберкулез это аутоиммунное заболевание
Обновлено: 24.04.2024
Проведено изучение основных эпидемиологических показателей по туберкулезу у детей и подростков в России за последнее двадцатилетие, дана характеристика работы в группах риска по заболеванию и проанализирована ее эффективность. Подведен итог внедрения мето
Characteristics of tuberculosis in children in the XXI century, achievements and prospects in the field of prevention and diagnostics
Main epidemiologic indices of tuberculosis in children and teenagers in Russia during the latest twenty years were studied, work in the risk groups of the disease was described, and its efficiency was analysed. Implementation of method of tuberculosis diagnostic in children, using innovative technologies was summarized.
Туберкулез — это широко распространенное в мире инфекционное заболевание. По данным ВОЗ, около трети населения земного шара инфицировано M. tuberculosis. Большая часть инфицированных людей переносят латентные формы туберкулеза. Активация латентной инфекции происходит в условиях иммунодефицитного состояния (стресс, голодание, длительная глюкокортикоидная терапия, ВИЧ-инфекция и др.). В свою очередь, возбудитель инфекции — микобактерия туберкулеза — способствует дальнейшему углублению иммунодефицитного состояния [1]. Все это приводит к сохранению проблемы туберкулеза, несмотря на все проводимые мероприятия в борьбе с данной инфекцией. Около 1 млн заболевших — дети в возрасте до 15 лет, или 11% от всех новых случаев заболевания. В разных странах на долю детей приходится от 3% до 25% общего числа заболевших туберкулезом [15].
Целью настоящей работы было определить особенности туберкулеза у детей в России в настоящее время, наметить новые подходы к профилактике и раннему выявлению туберкулеза.
В настоящее время активно используются во фтизиатрии новые научно-технические достижения для ранней диагностики заболевания: компьютерная томография, магнитно-резонансная томография, иммунологические тесты in vivo и in vitro, ускоренные методы бактериологического подтверждения туберкулеза. Это способствует улучшению работы по раннему выявлению заболевания. Однако необходимо преодоление объективных трудностей, связанных с правильной интерпретацией получаемых данных, что напрямую влияет на показатели заболеваемости туберкулезом детей.
Одним из наиболее сложных вопросов, которые нам необходимо было решить, — это выяснить истинную эпидемическую ситуацию по туберкулезу в стране и определить факторы, на нее влияющие. Для этого проведен анализ эпидемиологических показателей по туберкулезу (источники: формы Федерального статистического наблюдения № 8 и № 33, формы № 1 и № 4) в период с 1990 по 2015 гг. в целом по Российской Федерации.
Регистрируемая заболеваемость туберкулезом детей 0–14 лет за данный период имела значительные колебания: на первом этапе отмечен рост более чем вдвое к 2002 г. (с 9,4 до 19,1 на 100 тыс. детского населения). В последующие пять лет показатель заболеваемости практически перестал меняться, отмечались лишь небольшие колебания в пределах 16,2–16,4 на 100 тыс. в пределах 95% доверительного интервала. К 2008 г. заболеваемость снизилась до 15,3 на 100 тыс. детского населения. Последующие два года вновь отмечено стабильное увеличение показателя регистрируемой заболеваемости детей туберкулезом с 14,6 в 2009 г. до 16,6 на 100 тыс. детей в 2012 г. (3688 впервые выявленных детей 0–14 лет). Лишь в последующие годы отмечена четкая тенденция к уменьшению числа выявленных детей с локальными формами туберкулеза.
Таким образом, изучение официальных государственных статистических показателей по туберкулезу у детей за последние два десятилетия показало, что если на первом этапе увеличение числа больных детей можно было объяснить только ухудшением экономических условий в стране, то в последующем на фоне снижения показателей заболеваемости взрослого населения продолжающееся увеличение числа как выявленных больных детей с активным процессом, так и с туберкулезом в фазе обратного развития (с посттуберкулезными петрификатами) не может характеризовать эпидемиологическую ситуацию в стране, а больше свидетельствует о дефектах работы при скрининговых обследованиях детского населения на туберкулез.
В России последние 60 лет существует единая схема выявления туберкулеза у детей путем скринингового обследования всего детского населения методом туберкулинодиагностики с последующим обследованием у фтизиатра только лиц с положительными результатами на 2 ТЕ стандартного туберкулина как группы риска по заболеванию. Данные дети наблюдаются у фтизиатра в течение года и получают специфическую химиопрофилактику. На этапах внедрения этой схемы в сочетании с появлением противотуберкулезных препаратов, широко развитой системой изоляции и длительного лечения взрослых больных туберкулезом наблюдалось ежегодное снижение показателей заболеваемости туберкулезом в стране. В последующем, при появлении новых факторов риска, способствующих распространению туберкулеза в стране (появление ВИЧ, туберкулеза с множественной лекарственной устойчивостью, увеличение числа лиц с аутоиммунными и аллергическими заболеваниями и др.), данная схема скрининга детского населения на туберкулез не позволяла своевременно и качественно проводить противотуберкулезную работу.
Из всего вышеизложенного следует, что туберкулез у детей и подростков в современных условиях остается серьезной проблемой. Сохраняющиеся высокие показатели заболеваемости, особенно в группах риска по туберкулезу, требуют как пересмотра существующих принципов формирования групп риска, так и серьезной коррекции всей системы противотуберкулезной помощи детям и подросткам.
Развитие генной инженерии, иммунологии, аллергологии, молекулярной биологии в конце прошлого века позволило расшифровать механизм пробы Манту. Было установлено, что туберкулин представляет собой суммарный экстракт антигенов M. tuberculosis, это определяет низкий уровень специфичности пробы. Обнаружить антигены, присущие только M. tuberculosis, удалось после завершения исследования по первичной структуре ее генома [20]. После того как рядом исследований в области молекулярной биологии у микобактерий были установлены гены, делегированные у микобактерий вакцинного штамма M. bovis (BCG), область RD1, и специфичные в отношении микобактерий туберкулеза, были получены соответствующие белки, в частности, ESAT-6 и CFP-10. При использовании рекомбинантных антигенов ESAT-6 и CFP-10, специфично присутствующих в M. tuberculosis, но отсутствующих у M. bovis (BCG) и у большинства непатогенных микобактерий, были созданы тесты для диагностики туберкулезной инфекции. За последние 7 лет в практику противотуберкулезной службы внедрены тесты QuantiFERON (QFT), T-SPOT.TB, основанные на применении Т-клеток, их продукции интерферона-γg (IGRA — Interferon-Gamma Release Assays) [16–19].
В 2008 г. в НИИ молекулярной медицины ММА им. И. М. Сеченова был разработан новый препарат для аллергодиагностики туберкулеза — аллерген туберкулезный рекомбинантный [11–14]. Представляет собой рекомбинантный белок, продуцируемый генетически модифицированной культурой Escherichia coli BL 21 (DE3)/CFP-ESAT. Содержит два связанных между собой антигена — CFP-10 и ESAT-6, присутствующих в вирулентных штаммах M. tuberculosis и M. bovis. Эти антигены отсутствуют в штаммах M. bovis (BCG), включая российский, из которого готовятся вакцины туберкулезные — БЦЖ и БЦЖ-М. Тест внедрен в работу противотуберкулезной службы с 2009 г. [6, 7]. Оценка эффективности применения аллергена туберкулезного рекомбинантного в разных клинических ситуациях позволила обосновать возможность замены традиционной туберкулинодиагностики на диагностику аллергеном туберкулезным рекомбинантным при массовом скрининге детей и подростков на туберкулезную инфекцию [2–5, 8, 12, 14].
С целью изучения результатов внедрения пробы с аллергеном туберкулезным рекомбинантным как метода обследования на наличие туберкулезного процесса в группах риска нами проведено широкомасштабное ретроспективное сплошное наблюдение в 65 территориях РФ с 2010 по 2012 гг. (n = 2 262 194). Возраст пациентов составил от 0 до 17 лет. Больных активным туберкулезом (I группы диспансерного учета (ГДУ)) был 7 631 человек, пациентов с впервые выявленными остаточными посттуберкулезными изменениями (III А ГДУ) 2573 человек, пациентов VI ГДУ — 595 129 человек. Пациентов групп риска на участке педиатра обследовано в 26 территориях РФ 154 418 человек. В эту группу вошли дети с хроническими неспецифическими заболеваниями (сахарный диабет, воспалительные заболевания органов дыхания, мочевыводящей системы и др.). Изучены результаты пробы с аллергеном туберкулезным рекомбинантным и частота выявления туберкулеза с использованием этого метода. Положительные реакции составили от 10,8% до 14,1%. За этот период времени выявление больных туберкулезом детей при помощи пробы с аллергеном туберкулезным рекомбинантным составило 0,2%. Выявление туберкулеза из числа лиц с положительными реакциями на пробы с аллергеном туберкулезным рекомбинантным составило в 2010 г. 2,1%, в 2011 г. — 1,3%, в 2012 г. — 1,6% (табл. 1).
Таким образом, нами доказано, что внедрение нового инновационного метода обследования детей с целью идентификации туберкулезной инфекции и выявления локальных форм туберкулеза дает возможность формирования на участке фтизиатра групп наиболее высокого риска заболевания туберкулезом и обеспечивает проведение эффективного профилактического лечения среди лиц, наблюдающихся у фтизиатра в группах риска. Полученные результаты дали нам основание необходимости дальнейшего внедрения пробы с аллергеном туберкулезным рекомбинантным в России как скринингового метода обследования на туберкулез всего детского населения старше 8 лет взамен общепринятой туберкулинодиагностики, что может позволить сократить ненужные расходы на обследование населения, значительно повысить качество диагностики туберкулезной инфекции и улучшить ситуацию по заболеваемости туберкулезом в целом.
Длительность применения скрининга с аллергеном туберкулезным рекомбинантным в условиях общей лечебной сети в г. Ставрополе составляла четыре года, что позволило в заключение нашего исследования провести оценку отдаленных результатов применения аллергена туберкулезного рекомбинантного для скрининга туберкулезной инфекции по случаям пропуска локальных форм туберкулеза. По нашим данным, при переходе на новую схему иммунодиагностики туберкулеза у школьников старше 8 лет, уменьшается общее количество детей, состоящих на диспансерном учете у фтизиатра, с 4,6% всего детско-подросткового населения до 3%. Практически в три раза уменьшилось число детей в возрасте с 8 до 17 лет, взятых под наблюдение фтизиатра по результатам массового осмотра. Если при работе по традиционной методике шестая группа состояла в основном из VI А ГДУ (впервые инфицированные микобактерией туберкулеза), то при диагностике с аллергеном туберкулезным рекомбинантным в поле зрения фтизиатра попадают в 94,2% случаев давно инфицированные дети и подростки. Фактически мы имеем дело с новой группой риска заболевания туберкулезом.
Оценка результатов применения аллергена туберкулезного рекомбинантного для скрининга туберкулезной инфекции в г. Ставрополе в динамике на протяжении четырех лет показана в табл. 2. Число детей в возрасте 8–17 лет, положительно реагирующих на указанную пробу при проведении массовых обследований, оставалось стабильным (колебания от 0,85% до 1,0% статистически не значимы). Число детей в возрасте 8–17 лет, взятых под диспансерное наблюдение в группу риска развития туберкулеза по результатам массовых обследований с применением пробы аллергеном туберкулезным рекомбинантным, также стабильно.
Состав школьников год от года меняется. За время нашего исследования каждый год четверть детей принимали участие в скрининговом обследовании впервые по достижении школьного возраста. Заболевание туберкулезом выявлялось лишь у школьников, принимающих участие в скрининге с аллергеном туберкулезным рекомбинантным впервые. Всем школьникам с положительным результатом скрининга было проведено контролируемое превентивное лечение. При этом отмечена отчетливая тенденция к уменьшению доли выявленной специфической патологии при применении новой методики скрининга на протяжении нескольких лет с 13,6% до 6,7%, р = 0,0216. Случаев пропуска локальных форм туберкулеза при оценке отдаленных результатов применения аллергена туберкулезного рекомбинантного для скрининга туберкулезной инфекции по достижению ими подросткового возраста при флюорографическом обследовании выявлено не было.
Резюмируя вышеизложенное, можно заключить, что продолжающийся рост показателей по туберкулезу у детей в России в последние годы с последующим снижением к 2015 г. произошел благодаря внедрению новых методик диагностики в детском возрасте в регионах страны. Переход на скрининг с аллергеном туберкулезным рекомбинантным всего детского населения старше 8 лет позволяет улучшить качество ранней диагностики туберкулеза, способствует более полноценному излечению различных проявлений туберкулезной инфекции у детей и подростков и повышению эффективности противотуберкулезной помощи детям и подросткам в целом.
Острой проблемой в стране становится заболеваемость детей туберкулезом и ВИЧ-инфекцией. Уровень распространения как туберкулеза, так и ВИЧ-инфекции среди детей 0–14 лет является отражением напряженности эпидемиологической ситуации по данным заболеваниям. В этом плане очень важны мероприятия по выявлению детей, больных как туберкулезом, так и ВИЧ-инфекцией, находящихся в контакте.
Ежегодно, согласно форме № 61, в РФ регистрируется от 720 до 800 впервые выявленных детей 0–14 лет, больных ВИЧ-инфекцией. Показатель регистрируемой заболеваемости ВИЧ-инфекцией среди детей в возрасте 0–14 лет составлял в 2012 г. 3,5 (95% ДИ 3,2 –3,7) на 100 тыс. детского населения (в 17,8 раза меньше, чем у лиц, старше 14 лет — 62,0 на 100 тыс.). При этом нужно отметить значительное превышение (в семь раз) значения показателя для детей 0–7 лет по сравнению с возрастом 8–14 лет: 5,6 (95% ДИ 5,2–6,0) и 0,8 (95% ДИ 0,6–1,0) соответственно.
Какую роль играет очаг туберкулезной инфекции в развитии туберкулеза у детей, больных ВИЧ-инфекцией, мы попытались установить на примере 166 детей с сочетанной инфекцией в возрасте от 0 до 14 лет, вошедших в наше собственное исследование. В табл. 3 и 4 представлена частота и характер установленных контактов у детей с туберкулезом и ВИЧ-инфекцией. Контакт с больным туберкулезом установлен более чем у 70% детей с сочетанной патологией.
В подавляющем большинстве (90,8%) случаев заболевшие туберкулезом дети с ВИЧ-инфекцией были из родственного (постоянного) контакта, из них в 79% случаев туберкулезом были больны родители. Причем источником заражения чаще являлись матери, нежели отцы: 36% против 16% (p < 0,05). Этот факт можно объяснить наличием ВИЧ-инфекции преимущественно у матерей больных туберкулезом детей, а ВИЧ-инфекция, как известно, является мощным фактором риска развития заболевания у лиц, инфицированных микобактерией.
Таким образом, как оказалось, общая беда для всех детей, заболевших туберкулезом (без ВИЧ-инфекции, с ВИЧ-инфекцией), — не только контакт с больными туберкулезом, но и дефекты диспансерного наблюдения за детьми в очагах инфекции.
Заключение
Проведенный анализ эпидемической ситуации в стране показал, что туберкулез у детей в настоящее время приобрел отличия по сравнению с предыдущими годами. Наблюдается четкая тенденция преобладания малых его форм без поражения легочной ткани и со склонностью к самопроизвольному излечению. На этом фоне появились новые группы риска по заболеванию и проблемы с лечением детей из очагов, особенно с множественной лекарственной устойчивостью микобактерии и ВИЧ- инфекцией, при сохраняющихся высоких показателях заболеваемости детей из очагов туберкулезной инфекции.
Опыт использования современных инновационных диагностических методик раннего выявления туберкулеза и отбора групп риска для проведения превентивного лечения и углубленного обследования в России показал высокую эффективность и необходимость широкого внедрения. Приоритетом должна стать первичная вакцинопрофилактика в раннем детском возрасте и активное выявление туберкулезного процесса с использованием инновационных диагностических методов у детей школьного и подросткового возраста. Скрининг с использованием аллергена рекомбинантного для детского населения старше 8 лет позволяет уже на этапе общей лечебной сети целенаправленно выделить группы наиболее высокого риска заболевания туберкулезом.
По результатам данного широкомасштабного исследования в России в настоящее время пересмотрены подходы к раннему выявлению туберкулеза у детей и профилактическому лечению детей из групп высокого риска заболевания туберкулезом, согласно которым для лечения отобраны только наиболее угрожаемые пациенты. Изданы Национальные клинические рекомендации по диагностике и лечению латентной туберкулезной инфекции в России и приказ Минздрава РФ № 951 [11].
Все вышеизложенное обосновывает необходимость пересмотра общепринятых противотуберкулезных мероприятий как в общей педиатрической службе, так и у фтизиатров.
Литература
В. А. Аксенова 1 , доктор медицинских наук, профессор
Н. И. Клевно, кандидат медицинских наук
Н. Н. Моисеева
ГБОУ ВПО Первый МГМУ им. И. М. Сеченова МЗ РФ, Москва
Туберкулез легких – это инфекционная патология, вызываемая бациллой Коха, характеризующаяся различными в клинико-морфологическом отношении вариантами поражения легочной ткани. Многообразие форм туберкулеза легких обусловливает вариабельность симптоматики. Наиболее типичны для туберкулеза легких респираторные нарушения (кашель, кровохарканье, одышка) и симптомы интоксикации (длительный субфебрилитет, потливость, слабость). Для подтверждения диагноза используются лучевые, лабораторные исследования, туберкулинодиагностика. Химиотерапия туберкулеза легких проводится специальными туберкулостатическими препаратами; при деструктивных формах показано хирургическое лечение.
МКБ-10

Общие сведения
На сегодняшний день туберкулез легких представляет не только медико-биологическую, но и серьезную социально-экономическую проблему. По данным ВОЗ, туберкулезом инфицирован каждый третий житель планеты, смертность от инфекции превышает 3 млн. человек в год. Легочный туберкулез является самой частой формой туберкулезной инфекции. Удельный вес туберкулеза других локализаций (суставов, костей и позвоночника, гениталий, кишечника, серозных оболочек, ЦНС, глаз, кожи) в структуре заболеваемости значительно ниже.

Причины
Характеристика возбудителя
Отличительной чертой МБТ является их высокая устойчивость к внешним воздействиям (высоким и низким температурам, влажности, воздействию кислот, щелочей, дезинфектантов). Наименьшую стойкость возбудители туберкулеза легких демонстрируют к солнечному свету. Для человека опасность представляют туберкулезные бактерии человеческого и бычьего типа; случаи инфицирования птичьим типом микобактерий крайне редки.
Пути заражения
Основной путь заражения при первичном туберкулезе легких – аэрогенный: от больного открытой формой человека микобактерии распространяются с частичками слизи, выделяемыми в окружающую среду при разговоре, чихании, кашле; могут высыхать и разноситься с пылью на значительные расстояния. В дыхательные пути здорового человека инфекция чаще попадает воздушно-капельным или пылевым путем.
Меньшую роль в инфицировании играют алиментарный (при употреблении зараженных продуктов), контактный (при использовании общих предметов гигиены и посуды) и трансплацентарный (внутриутробный) пути. Причиной вторичного туберкулеза легких выступает повторная активация ранее перенесенной инфекции либо повторное заражение.
Факторы риска
Однако попадание МБТ в организм не всегда приводит к заболеванию. Факторами, на фоне которых туберкулез легких развивается особенно часто, считаются:
- неблагоприятные социально-бытовые условия
- курение и другие химические зависимости
- недостаточное питание
- иммуносупрессия (ВИЧ-инфекция, прием глюкокортикоидов, состояние после трансплантации органов)
- онкологические заболевания и др.
В группе риска по развитию туберкулеза легких находятся мигранты, заключенные, лица, страдающие наркотической и алкогольной зависимостью. Также имеет значение вирулентность инфекции и длительность контакта с больным человеком.
Патогенез
При снижении местных и общих факторов защиты микобактерии беспрепятственно проникают в бронхиолы, а затем в альвеолы, вызывая специфическое воспаление в виде отдельных или множественных туберкулезных бугорков или очагов творожистого некроза. В этот период появляется положительная реакция на туберкулин - вираж туберкулиновой пробы. Клинические проявления туберкулеза легких на этой стадии часто остаются нераспознанными. Небольшие очажки могут самостоятельно рассасываться, рубцеваться или обызвествляться, однако МБТ в них длительно сохраняются.
Классификация
Первичный туберкулез легких - это впервые развившаяся инфильтрация легочной ткани у лиц, не имеющих специфического иммунитета. Диагностируется преимущественно в детском и подростковом возрасте; реже возникает у лиц старшего и пожилого возраста, которые в прошлом перенесли первичную инфекцию, закончившуюся полным излечением. Первичный туберкулез легких может принимать форму:
- первичного туберкулезного комплекса (ПТК)
- туберкулеза внутригрудных лимфоузлов (ВГЛУ)
- хронически текущего туберкулеза.
Вторичный туберкулез легких развивается при повторном контакте с МБТ или в результате реактивации инфекции в первичном очаге. Основные вторичные клинические формы представлены:
Отдельно различают кониотуберкулез (туберкулез, развивающийся на фоне пневмокониозов), туберкулез верхних дыхательных путей, трахеи, бронхов; туберкулезный плеврит. При выделении больным МБТ в окружающую среду с мокротой говорят об открытой форме (ВК+) туберкулеза легких; при отсутствии бацилловыделения – о закрытой форме (ВК–). Также возможно периодическое бацилловыделение (ВК±).
Течение туберкулеза легких характеризуется последовательной сменной фаз развития:
- 1) инфильтративной
- 2) распада и обсеменения
- 3) рассасывания очага
- 4) уплотнения и обызвествления.
Симптомы туберкулеза легких
Первичный туберкулезный комплекс
Первичный туберкулезный комплекс сочетает в себе признаки специфического воспаления в легком и регионарный бронхоаденит. Может протекать бессимптомно или под маской простудных заболеваний, поэтому выявлению первичного туберкулеза легких способствуют массовые скрининги детей (проба Манту) и взрослых (профилактическая флюорография).
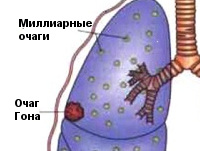
Чаще возникает подостро: больного беспокоит сухой кашель, субфебрилитет, утомляемость, потливость. При острой манифестации клиника напоминает неспецифическую пневмонию (высокая лихорадка, кашель, боль в груди, одышка). В результате лечения происходит рассасывание или обызвествление ПТК (очаг Гона). В неблагоприятных случаях может осложняться казеозной пневмонией, образованием каверн, туберкулезным плевритом, милиарным туберкулезом, диссеминацией микобактерий с поражением почек, костей, мозговых оболочек.
Туберкулез внутригрудных лимфоузлов
Признаки туберкулезной интоксикации включают отсутствие аппетита, снижение массы тела, утомляемость, бледность кожи, темные круги под глазами. На венозный застой в грудной полости может указывать расширение венозной сети на коже грудной клетки. Данная форма нередко осложняется туберкулезом бронхов, сегментарными или долевыми ателектазами легких, хронической пневмонией, экссудативным плевритом. При прорыве казеозных масс из лимфоузлов через стенку бронхов могут формироваться легочные очаги туберкулеза.
Очаговый туберкулез легких
Клиническая картина очагового туберкулеза малосимптомна. Кашель отсутствует или возникает редко, иногда сопровождается выделением скудной мокроты, болями в боку. В редких случаях отмечается кровохарканье. Чаще больные обращают внимание на симптомы интоксикации: непостоянный субфебрилитет, недомогание, апатию, пониженную работоспособность. В зависимости от давности туберкулезного процесса различают свежий и хронический очаговый туберкулез легких.
Течение очагового туберкулеза легких относительно доброкачественное. У больных с нарушенной иммунной реактивностью заболевание может прогрессировать в деструктивные формы туберкулеза легких.
Инфильтративный туберкулез легких
Клиническая картина инфильтративного туберкулеза легких зависит от величины инфильтрата и может варьировать от нерезко выраженных симптомов до острого лихорадочного состояния, напоминающего грипп или пневмонию. В последнем случае отмечается выраженная высокая температура тела, ознобы, ночная потливость, общая слабость. Со стороны органов дыхания беспокоит кашель с мокротой и прожилками крови.
В воспалительный процесс при инфильтративной форме туберкулеза легких часто вовлекается плевра, что обусловливает появление болей в боку, плеврального выпота, отставание пораженной половины грудной клетки при дыхании. Осложнениями инфильтративного туберкулеза легких могут стать казеозная пневмония, ателектаз легкого, легочное кровотечение и др.
Диссеминированный туберкулез легких
Может манифестировать в острой (милиарной), подострой и хронической форме. Тифоидная форма милиарного туберкулеза легких отличается преобладанием интоксикационного синдрома над бронхолегочной симптоматикой. Начинается остро, с нарастания температуры до 39-40 °С, головной боли, диспепсических расстройств, резкой слабости, тахикардии. При усилении токсикоза может возникать нарушение сознания, бред.
При легочной форме милиарного туберкулеза легких с самого начала более выражены дыхательные нарушения, включающие сухой кашель, одышку, цианоз. В тяжелых случаях развивается острая сердечно-легочная недостаточность. Менингеальной форме соответствуют симптомы поражения мозговых оболочек.
Подострое течение диссеминированного туберкулеза легких сопровождается умеренной слабостью, понижением работоспособности, ухудшением аппетита, похуданием. Эпизодически возникают подъемы температуры. Кашель продуктивный, не сильно беспокоит больного. Иногда первым признаком заболевания становится легочное кровотечение.
Хронический диссеминированный туберкулез легких при отсутствии обострения бессимптомен. Во время вспышки процесса клиническая картина близка к подострой форме. Диссеминированный туберкулеза легких опасен развитием внелегочного туберкулеза, спонтанного пневмоторакса, тяжелых легочных кровотечений, амилоидоза внутренних органов.
Кавернозный и фиброзно-кавернозный туберкулез легких
Характер течения кавернозного туберкулезного процесса волнообразный. В фазу распада нарастают интоксикационные симптомы, гипертермия, усиливается кашель и увеличивается количество мокроты, возникает кровохарканье. Часто присоединяется туберкулез бронхов и неспецифический бронхит.
Фиброзно-кавернозный туберкулез легких отличается формированием каверн с выраженным фиброзным слоем и фиброзными изменениями легочной ткани вокруг каверны. Протекает длительно, с периодическими обострениями общеинфекционной симптоматики. При частых вспышках развивается дыхательная недостаточность II-III степени.
Осложнениями, связанными с деструкцией легочной ткани, являются профузное легочное кровотечение, бронхоплевральный свищ, гнойный плеврит. Прогрессирование кавернозного туберкулеза легких сопровождается эндокринными расстройствами, кахексией, амилоидозом почек, туберкулезным менингитом, сердечно-легочной недостаточностью – в этом случае прогноз становится неблагоприятным.
Цирротический туберкулез легких
Является исходом различных форм туберкулеза легких при неполной инволюции специфического процесса и развитии на его месте фиброзно-склеротических изменений. При пневмоциррозе бронхи деформированы, легкое резко уменьшено в размерах, плевра утолщена и нередко обызвествлена.
Изменения, происходящие при цирротическом туберкулезе легких, обусловливают ведущие симптомы: выраженную одышку, тянущую боль в груди, кашель с гнойной мокротой, кровохарканье. При обострении присоединятся признаки туберкулезной интоксикации и бацилловыделение. Характерным внешним признаком пневмоцирроза служит уплощение грудной клетки на стороне поражения, сужение и втянутость межреберных промежутков. При прогрессирующем течении постепенно развивается легочное сердце. Цирротические изменения в легких необратимы.
Туберкулома легкого
Представляет собой инкапсулированный казеозный очаг, сформировавшийся в исходе инфильтративного, очагового или диссеминированного процесса. При стабильном течении симптомы не возникают, образование выявляется при рентгенографии легких случайно. В случае прогрессирующей туберкуломы легкого нарастает интоксикация, появляется субфебрилитет, боль в груди, кашель с отделением мокроты, возможно кровохарканье. При распаде очага туберкулома может трансформироваться в кавернозный или фиброзно-кавернозный туберкулез легких. Реже отмечается регрессирующее течение туберкуломы.
Диагностика
Диагноз той или иной формы туберкулеза легких выставляется врачом-фтизиатром на основании совокупности клинических, лучевых, лабораторных и иммунологических данных. Для распознавания вторичного туберкулеза большое значение имеет подробный сбор анамнеза. Для подтверждения диагноза проводится:
- Лучевая диагностика.Рентгенография легких является обязательным диагностической процедурой, позволяющей выявить характер изменений в легочной ткани (инфильтративный, очаговый, кавернозный, диссеминированный и т. д.), определить локализацию и распространенность патологического процесса. Выявление кальцинированных очагов указывает на ранее перенесенный туберкулезный процесс и требует уточнения данных с помощью КТ или МРТ легких.
- Анализы. Обнаружение МБТ достигается неоднократным исследованием мокроты (в т. ч. с помощью ПЦР), промывных вод бронхов, плеврального экссудата. Но сам по себе факт отсутствия бацилловыделения не является основанием для исключения туберкулеза легких. Современные иммунологические тесты позволяют выявить туберкулезную инфекцию почти со 100%-ной вероятностью. К ним относятся QuantiFERON и Т-спот. ТБ.
- Туберкулинодиагностика. К методам туберкулинодиагностики относятся диаскин-тест, пробы Пирке и Манту, однако сами по себе данные методы могут давать ложные результаты. Иногда для подтверждения туберкулеза легких приходится прибегать к пробному лечению противотуберкулезными препаратами с оценкой динамики рентгенологической картины.
По результатам проведенной диагностики туберкулез легких дифференцируют с пневмонией, саркоидозом легких, периферическим раком легкого, доброкачественными и метастатическими опухолями, пневмомикозами, кистами легких, абсцессом, силикозом, аномалиями развития легких и сосудов. Дополнительные методы диагностического поиска могут включать бронхоскопию, плевральную пункцию, биопсию легкого.

Лечение туберкулеза легких
Во фтизиатрической практике сформировался комплексный подход к лечению туберкулеза легких, включающий медикаментозную терапию, при необходимости - хирургическое вмешательство и реабилитационные мероприятия. Лечение проводится поэтапно: сначала в тубстационаре, затем в санаториях и, наконец, амбулаторно. Режимные моменты требуют организации лечебного питания, физического и эмоционального покоя.
- Противотуберкулезная терапия. Ведущая роль отводится специфической химиотерапии с помощью препаратов с противотуберкулезной активностью. Для терапии различных форм туберкулеза легких разработаны и применяются 3-х, 4-х и 5-тикомпонентные схемы (в зависимости от количества используемых препаратов). К туберкулостатикам первой линии (обязательным) относятся изониазид и его производные, пиразинамид, стрептомицин, рифампицин, этамбутол; средствами второго ряда (дополнительными) служат аминогликозиды, фторхинолоны, циклосерин, этионамид и др. Способы введения препаратов различны: перорально, внутримышечно, внутривенно, эндобронхиально, внутриплеврально, ингаляторно. Курсы противотуберкулезной терапии проводят длительно (в среднем 1 год и дольше).
- Патогенетическая терапия. При туберкулезе легких включает прием противовоспалительных средств, витаминов, гепатопротекторов, инфузионную терапию и пр. В случае лекарственной резистентности, непереносимости противотуберкулезных средств, при легочных кровотечениях используется коллапсотерапия.
- Хирургическое лечение. При соответствующих показаниях (деструктивных формах туберкулеза легких, эмпиеме, циррозе и ряде др.) применяются различные оперативные вмешательства: кавернотомию, торакопластику, плеврэктомию, резекцию легких.
Профилактика
Профилактика туберкулеза легких является важнейшей социальной проблемой и приоритетной государственной задачей. Первым шагом на этом пути является обязательная вакцинация новорожденных, детей и подростков. При массовых обследованиях в дошкольных и школьных учреждениях используется постановка внутрикожных туберкулиновых проб Манту. Скрининг взрослого населения осуществляется путем проведения профилактической флюорографии.
Рассмотрены вопросы поражения легких при системной красной волчанке, ревматоидном артрите, системной склеродермии, полимиозите/дерматомиозите, синдроме Шегрена, смешанном заболевании соединительной ткани, гранулематозе Вегенера, синдроме Черджа–Стросса, с
Aspects of lungs lesion with exanthematous lupus erythematosus, rheumatoid arthritis, Addison’s keloid, polymyositis/dermatomyositis, Sj?gren’s sicca syndrome, mixed connective tissue disease, necrotizing respiratory granulomatosis, Churg–Strauss syndrome, Goodpasture’s syndrome and Bechterew’s disease have been analysed.
В основе поражения легких (ПЛ) при системных аутоиммунных заболеваниях (САЗ) лежат расстройства механизмов иммунорегуляции и гиперреактивность организма. Макрофаги и лимфоциты являются ключевыми клетками, участвующими в инициации и сохранении иммунного ответа в легких. Альвеолярные макрофаги — резиденты легочной ткани — поглощают чужеродные агенты, проникшие через слизистые поверхности легких и бронхов. Кроме того, эти клетки служат в качестве антигенпредставляющих клеток для Т-лимфоцитов. Относительно небольшое число лимфоцитов присутствуют в нормальной паренхиме легких. Однако после стимуляции соответствующим антигеном окружающей лимфоидной ткани лимфоциты мигрируют в легкие и принимают участие в воспалительной реакции.
Проведение специальных исследований, включавших компьютерную томографию высокого разрешения (КТВР) и биопсию легкого, выявило, что при САЗ встречаются различные гистологические формы поражения интерстиция легких (табл.).
Системная красная волчанка
Системная красная волчанка (СКВ) — системное аутоиммунное заболевание неизвестной этиологии, характеризующееся гиперпродукцией органоспецифических аутоантител к различным компонентам клеточного ядра с развитием иммуновоспалительного повреждения тканей и внутренних органов.
Ревматоидный артрит
Ревматоидный артрит (РА) — системное аутоиммунное заболевание соединительной ткани с преимущественным поражением суставов по типу хронического прогрессирующего эрозивно-деструктивного полиартрита и внесуставными проявлениями.
ПЛ при РА было впервые описано в 1948 г., когда Эллман и Болл установили диффузный фиброз легких у трех пациентов. Легочные проявления при РА включают поражение плевры, образование ревматоидных узелков в легких, ИПЛ, легочный васкулит, альвеолярные кровоизлияния, бронхообструктивные изменения. Почти у половины больных РА при вскрытии выявляется плеврит. Экссудативный плеврит может быть односторонним или двусторонним и сохраняться в течение многих месяцев. Наличие плеврального выпота вызывает нарушение легочной функции. Как правило, плевральная жидкость бывает экссудативной с низким содержанием глюкозы и низким уровнем комплемента. Чаще у пациентов с РА встречается сухой плеврит и является находкой при рентгенологическом исследовании.
Ревматоидные узелки (РУ), как единичные, так и множественные, могут быть обнаружены в легочной паренхиме больных РА. РУ легких у пациентов с РА были впервые описаны Каплан в 1953 г. РУ могут появиться до, во время или после начала РА. ИПЛ характеризуется хроническим воспалением стенок альвеол и скоплением больших мононуклеарных клеток в альвеолах. Довольно часто у больных РА встречается сочетание ИПЛ и подкожных ревматоидных узелков. Прогноз для пациентов с РА с ИПЛ неблагоприятен. Легочный васкулит является одним из редких легочных проявлений РА. Альвеолярные кровоизлияния, не часто встречающиеся у больных РА, приводят к кровохарканью и анемии. У пациентов с РА отмечается высокая частота поражения бронхов. ПЛ может быть результатом токсического воздействия препаратов, используемых в терапии РА. Для того чтобы обеспечить оптимальный эффект от лечения, врач всегда должен учитывать возможную легочную патологию при оценке состояния пациентов с РА [1–3].
Системная склеродермия
Системная склеродермия (ССД) — диффузное заболевание соединительной ткани с прогрессирующим фиброзом, распространенными вазоспастическими нарушениями и характерными изменениями кожи, опорно-двигательного аппарата и внутренних органов. Среди висцеральных проявлений ССД ПЛ занимает важное место.
Плеврит при ССД наблюдается реже, чем при РА и СКВ. В то же время у больных ССД значительно выше частота ИПЛ, при этом морфологическое исследование показывает выраженный фиброз интерстициальной ткани и утолщение межальвеолярных перегородок. Исследование функции внешнего дыхания (ФВД) демонстрирует снижение диффузионной способности легких (ДСЛ) даже при отсутствии каких-либо клинических симптомов и рентгенологических изменений.
У пациентов с ССД выявляется рестриктивный тип нарушения вентиляции легких. У большинства больных ССД с ЛФ наблюдается гистологическая картина обычной интерстициальной пневмонии (ОИП), однако во многих случаях встречается гистопатологический тип неспецифической интерстициальной пневмонии (НИП).
Развитие ЛФ инициируется микрососудистыми изменениями, которые приводят к повреждению эндотелиальных клеток и поражению альвеолярного эпителия. Это приводит к активации каскада свертывания (рис.).
Экспрессия аутоантител является предиктором поражения внутренних органов, в частности ПЛ. Наличие антител к Scl-70 (антисклеродермальные антитела с молекулярной массой 70 кДа, антитела к топоизомеразе I) в значительной степени является фактором риска развития ИПЛ, в то время как антицентромерные антитела (АЦА) говорят о низкой вероятности развития рентгенологических признаков ЛФ.
У пациентов с ССД встречается легочная гипертензия (ЛГ). ЛГ может быть изолированной, возникшей вследствие поражения сосудов, или вторичной — при поражении паренхимы легких или левых отделов сердца. ЛГ развивается у 5–7% больных, чаще на поздних стадиях лимитированной формы ССД. Предиктор ЛГ — изолированное уменьшение ДСЛ. Более редко встречаются аспирационная пневмония, причиной которой является дисфункция пищевода, а также спонтанный пневмоторакс, лекарственный пневмонит [1–3, 6–8].
Полимиозит/дерматомиозит
Полимиозит/дерматомиозит (ПМ/ДМ) — группа хронических диффузных заболеваний поперечнополосатой мускулатуры, основным проявлением которых выступает мышечная слабость.
Около 40% пациентов с ПМ/ДМ имеют патологию легочной системы. Одной из причин этого является поражение мышц. Поражение межреберных мышц и высокое стояние диафрагмы приводят к уменьшению экскурсии грудной клетки и появлению вентиляционных нарушений по рестриктивному типу. В отличие от других САЗ, ПЛ при ПМ/ДМ не затрагивает в первую очередь дыхательные пути или плевру. Наиболее распространенной патологией является аспирационная пневмония, которая возникает по причине слабости мышц глотки и верхней трети пищевода.
Болезнь Шегрена
Болезнь Шегрена (БШ) — системное аутоиммунное заболевание неизвестной этиологии, характеризуется поражением секретирующих эпителиальных желез, с вовлечением преимущественно слюнных и слезных желез (ксеростомия, ксерофтальмия).
Поражение экзокринных желез верхних дыхательных путей часто приводит к сухости носовых ходов и бронхов. Наиболее распространенным проявлением ПЛ, связанным с БШ, является лимфоцитарный пневмонит, поражающий нижние доли. У пациентов с БШ может развиться плеврит (с или без выпота), ИПЛ с очагами лимфоидной инфильтрации. При развитии неходжкинских лимфом метастатические поражения легких встречаются часто, реже наблюдают формирование MALT-ткани (mucosal-associated lymphoid tissue) с развитием первичной MALT-лимфомы [1–3, 12, 13].
Смешанное заболевание соединительной ткани
Смешанное заболевание соединительной ткани (синдром Шарпа) (CЗСТ) — аутоиммунное заболевание, характеризующееся наличием отдельных признаков СКВ, ССД, РА, ПМ/ДМ в сочетании с высоким титром антител к экстрагируемому ядерному антигену — U1-RNP.
ИПЛ и ЛГ довольно часто встречаются у больных с СЗСТ, при этом нередко имеют субклиническое течение. Обследование пациентов с СЗСТ показало повышение уровня иммунных комплексов (ИК) и увеличение потребления комплемента. ИК-опосредованное повреждение альвеолярно-капиллярной мембраны и легочной ткани может играть важную роль в патогенезе ИПЛ при СЗСТ. При исследовании показателей функции внешнего дыхания больные с СЗСТ демонстрируют снижение диффузионной способности легких (ДСЛ) и рестриктивный тип нарушения вентиляции. Прогноз ИПЛ у пациентов с СЗСТ более благоприятный, чем при РА и ССД. ЛГ является основной причиной смерти больных с СЗСТ [1–3, 14, 15].
Гранулематоз Вегенера
Гранулематоз Вегенера (ГВ) — системный некротический васкулит мелких вен и артерий с образованием гранулем в сосудистых стенках и окружающих тканях дыхательных путей, почек и других органов.
ПЛ развивается у большинства пациентов с ГВ. Клинические проявления ПЛ при ГВ разнообразны, начиная от бессимптомных узелков в легких и кончая фульминантным альвеолярным кровотечением. ГВ может сопровождаться образованием опухолевидных инфильтратов с неровными краями, которые могут распадаться и образовывать полости. Плеврит, легочное кровотечение и увеличение лимфатических узлов средостения встречаются редко. Поражение трахеальных или бронхиальных стенок обычно проявляется гранулематозным утолщением слизистой оболочки или подслизистого слоя, при этом возникает обструктивный тип нарушения вентиляции легких. Частое осложнение — коллапс бронхов и постобструктивная пневмония. Инфильтраты, которые могут увеличиваться и уменьшаться, первоначально часто неправильно диагностируются как пневмония. Примерно в 20% случаев развивается прогрессирующая легочная недостаточность, связанная с ЛФ, пневмонией или пневмонитом, индуцированным циклофосфамидом. ДСЛ, как правило, уменьшена, но при развитии диффузных альвеолярных геморрагий наблюдают ее рост. Описаны случаи развития бронхоплевральных свищей [1–3].
Синдром Чарджа–Стросса
Синдром Чарджа–Строса (СЧС) — эозинофильное, гранулематозное воспаление респираторного тракта и некротизирующий васкулит, поражающий мелкие и средние сосуды, часто сочетающийся с астмой и эозинофилией.
Легкие — это наиболее поражаемый орган при данном синдроме; более 90% пациентов с синдромом СЧС в анамнезе имеют астму. При рентгенологическом исследовании легких выявляются очаги консолидации, распределяющиеся по периферии, которые часто бывают преходящими. Могут появляться узелки, при распаде не образующие полости. Другие менее распространенные проявления ПЛ включают утолщение междольковой перегородки и утолщение бронхиальной стенки. Плевральные выпоты образуются редко.
Существуют три фазы развития СЧС: продромальная фаза, которая характеризуется наличием аллергических заболеваний (как правило, астма или аллергический ринит), может продолжаться от нескольких месяцев до многих лет; эозинофилия/фаза инфильтрации тканей, в которой может наблюдаться удивительно высокая периферическая эозинофилия, а также инфильтрация эозинофилами тканей легких, желудочно-кишечного тракта и других органов; васкулитная фаза, в которой некротический васкулит поражает широкий спектр органов — сердце, легкие, периферические нервы и кожу. Диагноз приходится верифицировать с другими васкулитами, в первую очередь ГВ [1–3].
Синдром Гудпасчера
Синдром Гудпасчера (СГ) (геморрагический легочно-почечный синдром) — прогрессирующее аутоиммунное заболевание легких и почек, характеризующееся образованием антител к базальным мембранам капилляров клубочков почек и альвеол и проявляющееся сочетанием легочных и почечных геморрагий.
Патоморфологически в легких наблюдается картина венулитов, артериолитов, капилляритов с выраженными явлениями деструкции и пролиферации; поражение капилляров наблюдается преимущественно в межальвеолярных перегородках, развивается альвеолит с геморрагическим экссудатом в альвеолах.
В большинстве случаев ПЛ и почек происходит одновременно. Клинические проявления ПЛ включают в себя кашель, одышку и кровохарканье, которое может появляться на несколько месяцев раньше признаков поражения почек. В развитии альвеолита при СГ огромное значение имеет активация альвеолярных макрофагов. В активированном состоянии они выделяют около 40 цитокинов. Цитокины I группы (хемотаксины, лейкотриены, интерлейкин-8) усиливают поступление полиморфноядерных лейкоцитов в легкие. Цитокины II группы (факторы роста — тромбоцитарный, макрофагальный) способствуют перемещению в легкие фибробластов. Альвеолярные макрофаги продуцируют также активные формы кислорода, протеазы, повреждающие легочную ткань.
Исследование жидкости бронхоальвеолярного лаважа (ЖБАЛ) не является диагностическим при СГ, но может использоваться для подтверждения наличия диффузной альвеолярной геморрагии у пациентов с гломерулонефритом и легочными инфильтратами, но без кровохарканья. ЖБАЛ, которая остается геморрагической после многократных промываний, позволяет подтвердить диффузный геморрагический синдром, особенно при сопутствующем снижении гематокрита.
Гистологическое и иммунологическое исследование биоптатов легочной ткани при СГ характеризуется признаками геморрагического альвеолита, гемосидероза и интерстициального фиброза, а также линейных отложений иммуноглобулина G (IgG) и С3-компонента комплемента на базальных мембранах легочных альвеол.
Рентгено-компьютерное исследование легких при СГ демонстрирует наличие легочных инфильтратов в прикорневой области с распространением на нижние и средние отделы легких. Исследование легочных тестов выявляет рестриктивный тип нарушения вентиляции легких (снижение жизненной емкости легких — ЖЕЛ), но по мере прогрессирования заболевания присоединяются обструктивные изменения (снижение объема форсированного выдоха за 1 сек — ОФВ1, индекса Тиффно) [1–3].
Болезнь Бехтерева (анкилозирующий спондилит)
Болезнь Бехтерева (ББ, анкилозирующий спондилит, АС) — хроническое системное заболевание, характеризующееся воспалительным поражением суставов позвоночника, околопозвоночных тканей и крестцово-подвздошных сочленений с анкилозированием межпозвоночных суставов и развитием кальцификации спинальных связок.
ПЛ у больных АС встречается в 50–85% случаев и обусловлено анкилозирующим процессом в грудном отделе позвоночника, снижением дыхательной экскурсий грудной клетки, утомлением и слабостью дыхательных мышц. У больных АС чаще всего развивается эмфизема легких, затем ИПЛ, хроническая обструктивная болезнь легких (ХОБЛ), апикальный фиброз, бронхоэктазия и поражение плевры. Апикальный пневмофиброз, который встречается нечасто (3–4%), требует проведения дифференциальной диагностики с туберкулезными изменениями. Фиброз верхней доли легкого обычно протекает бессимптомно, но может вызывать кашель, отделение мокроты и одышку.
При АС чаще встречается рестриктивный тип нарушения вентиляции легких. У больных АС с хронической обструктивной болезнью легких (ХОБЛ) исследование ФВД демонстрирует обструктивные вентиляционные изменения [1, 16, 17].
Заключение
Таким образом, при САЗ могут наблюдаться различные типы легочной патологии. Развитие ПЛ обусловлено особенностями патофизиологических характеристик основного заболевания. Основные легочные проявления САЗ включают заболевания плевры, ИПЛ, поражение бронхиального дерева. При РА и СКВ чаще, чем при других САЗ, встречается поражение плевры. ИПЛ в настоящее время все больше признается как самое частое и серьезное проявление САЗ. ПЛ у больных с САЗ оказывает существенное негативное воздействие на качество жизни (КЖ): у больных снижаются показатели КЖ, характеризующие физический, психоэмоциональный статус и социальную активность.
ПЛ при САЗ имеет большое значение в формировании облика заболевания, при этом во многом определяет его тяжесть и прогноз. Наряду с базисной терапией САЗ, ПЛ необходимо рассматривать как важную мишень для терапевтического воздействия.
Литература
- Ревматология, национальное руководство. Под ред. Е. Л. Насонова, В. А. Насоновой. М.: ГЭОТАР-Медиа, 2008.
- Castelino F. V., Varga J. Interstitial lung disease in connective tissue diseases: evolving concepts of pathogenesis and management // Arthritis Research & Therapy. 2010; 12: 213.
- Bouros D., Pneumatikos I., Tzouvelekis A. Pleural involvement in systemic autoimmune disorders // Respiration. 2008; 75: 361–371.
- Kriegel M. A., Van Beek C., Mostaghimi A. et al. Sterile empyematous pleural effusion in a patient with systemic lupus erythematosus: a diagnostic challenge // Lupus. 2009; 18: 581–585.
- Pego-Reigosa J. M., Medeiros D. A., Osenberg D. A. Respiratory manifestations of systemic lupus erythematosus: old and new concepts // Best Pract Res Clin Rheumatol. 2009; 23: 460–480.
- Varda J., Abraham D. Systemic sclerosis: a prototypic multisystem fibrotic disorder // J Clin Invest. 2007; 117: 557–567.
- Yanaba K., Hasegawa M., Takehara K. et al. Comparative study of serum surfactant protein-D and KL-6 concentrations in patients with systemic sclerosis as markers for monitoring the activity of pulmonary fibrosis // J Rheumatol. 2004; 31: 1112–1120.
- McNearney T. A., Revelle J. D., Fischbach M. et al. Pulmonary involvement in systemic sclerosis: associations with genetic, serologic, sociodemographic, and behavioral factors // Arthritis Rheum. 2007; 57: 318–326.
- Tillie-Leblond I., Wislez M., Valeyre D. et al. Interstitial lung disease and anti-Jo-1 antibodies: difference between acute and gradual onset // Thorax. 2008; 63: 53–59.
- Chen I. J., Jan Wu Y. J., Lin C. W. et al. Interstitial lung disease in polymyositis and dermatomyositis // Clin Rheumatol. 2009; 28: 639–646.
- Fujisawa T., Suda T., Nakamura Y. et al. Differences in clinical features and prognosis of interstitial lung diseases between polymyositis and dermatomyositis // J Rheumatol. 2005; 32: 58–64.
- Ito I., Nagai S., Kitaichi M. et al. Pulmonary manifestations of primary Sjögren’s syndrome: a clinical, radiologic, and pathologic study // Am J Respir Crit Care Med. 2005; 171: 632–638.
- Parambil J. G., Myers J. L., Lindell R. M. et al. Interstitial lung disease in primary Sjögren’s syndrome // Chest. 2006; 130: 1489–1495.
- Bodolay E., Szekanecz Z., Devenyi K. et al. Evaluation of interstitial lung disease in mixed connective tissue disease (MCTD) // Rheumatol. 2005; 44: 656–661.
- Kinder B. W., Shariat C., Collard H. R. et al. Undifferentiated connective tissue disease-associated interstitial lung disease: changes in lung function // Lung 2010; 188: 143–149
- Quismorio F. P. Jr. Pulmonary involvement in ankylosing spondylitis // Curr Opin Pulm Med. 2006; 12: 342–345.
- Lee C. C., Lee S. H., Chang I. J. et al. Spontaneous pneumothorax associated with ankylosis spondylitis // Rheumatol. 2005; 44: 1538–1541.
Д. В. Бестаев 1 , кандидат медицинских наук
Е. Л. Насонов, доктор медицинских наук, профессор, академик РАН
Читайте также:

