Туберкулез органов дыхания эффективность лечения
Обновлено: 19.04.2024
В чем особенность течения туберкулеза на современном этапе? Почему в схеме комплексной терапии туберкулеза необходимо использовать иммуномодуляторы? Tуберкулез — это специфическое инфекционное заболевание, развивающееся в ответ на попадание в орган
В чем особенность течения туберкулеза на современном этапе?
Почему в схеме комплексной терапии туберкулеза необходимо использовать иммуномодуляторы?
Tуберкулез — это специфическое инфекционное заболевание, развивающееся в ответ на попадание в организм микобактерий туберкулеза (МБТ). Туберкулез может поражать все органы и системы организма человека, но наиболее часто — органы дыхания. В настоящее время туберкулез признан ВОЗ глобальной проблемой, наносящей колоссальный экономический и биологический ущерб. В России эпидемиологическая ситуация по туберкулезу характеризуется наличием у большинства больных обширных, запущенных форм туберкулеза, с деструкцией и бацилловыделением, эффективность лечения при этом снижена. В сложившихся неблагоприятных условиях основными противотуберкулезными мероприятиями следует считать выявление и лечение больных туберкулезом.
Различные авторы указывают на многообразие факторов, имеющих существенное значение в развитии туберкулезного воспаления. Среди них большая роль принадлежит иммунологическим процессам, в связи с чем туберкулез может быть признан классическим примером иммунного воспаления. Состояние иммунной системы организма является также одной из причин замедленной регрессии специфических изменений и сохранения морфологической активности туберкулезного процесса [9, 16]. Необходимо признать, что традиционная химиотерапия, даже проводимая правильно, вызывает в основном бактериостатический эффект и не в состоянии полностью устранить многообразие морфологических и функциональных изменений туберкулезного характера. Химиотерапия не стимулирует защитные силы организма и не может во всех случаях обусловить полное выздоровление. У большинства больных туберкулезом легких в процессе эффективного лечения достигается нормализация основных показателей иммунитета, но у части больных развивается вторичное иммунодефицитное состояние [10]. Клинически туберкулез у лиц с иммунодефицитом плохо поддается лечению.
Нарушение иммунорегуляции может корректироваться с помощью иммунотерапии. В связи с этим особое значение в современной комплексной терапии туберкулеза имеет использование иммунотропных препаратов с целью стимуляции защитных сил организма и нормализации измененного иммунологического статуса больных туберкулезом [7, 18]. Клинический опыт свидетельствует о благоприятном влиянии на лечение туберкулеза таких препаратов, как спленин, левамизол, диуцифон, препараты тимуса, туберкулин, вакцина БЦЖ. Включение в комплексную терапию больных туберкулезом иммуномодуляторов способствует ускорению нормализации показателей иммунитета и более быстрой регрессии туберкулезного процесса [1, 16]. Актуальной задачей является поиск новых отечественных иммунокорригирующих препаратов и изучение механизмов их действия [2, 4, 5, 6]. В работах Р. В. Петрова, Р. М. Хаитова и соавторов обоснован новый подход к поиску иммунокорректоров с избирательным воздействием на конкретное звено иммунитета, в основе которого заложен принцип создания иммуногенов путем структурного объединения антигена (АГ) и полимера-иммуностимулятора [17]. В качестве иммуностимуляторов предложено использовать водорастворимые полиэлектролиты. Экспериментально доказано, что иммунный ответ на комплексы АГ, конъюгированных с водорастворимыми полиэлектролитами, гораздо выше ответа на сами АГ. В Институте иммунологии МЗ РФ А. В. Некрасовым впервые в нашей стране создан принципиально новый синтетический высокомолекулярный иммуностимулятор — полиоксидоний (ПО; рег. № 96/302/9, патент РФ № 2073031) [14, 15].
ПО, обладающий в большом диапазоне доз широким спектром фармакологического действия и высокой иммуностимулирующей активностью, оказывает выраженное иммуностимулирующее действие на гуморальный иммунный ответ, усиливает кооперацию Т- и В-лимфоцитов. Установлено его преимущественное влияние на фагоцитарное звено иммунитета. ПО активирует функцию макрофагов и лимфоцитов. При этом препарат обладает неспецифическим защитным действием от широкого спектра патогенов, основанным не на прямом угнетении микроорганизмов, а на стимуляции иммунитета. Кроме того, в экспериментах была показана стимулирующая способность клеток ретикулоэндотелиальной системы захватывать и удалять из циркулирующей крови чужеродные микрочастицы [14, 15]. Известно, что ПО, стимулируя иммунные реакции, не нарушает естественных механизмов их торможения, не истощает резервных возможностей кроветворной системы [14, 15]. Показано, что введение ПО приводит к значительному повышению интенсивности антителообразования в ответ на чужеродные АГ различной природы [14, 17].
Установлено также, что токсичность ряда лекарственных препаратов снижается при совместном их введении в организм с ПО.
Отсутствие побочных эффектов и токсичности, четко показанное в эксперименте, указывает на возможность применения ПО в качестве лечебного и профилактического средства при различных заболеваниях, в том числе при хронических заболеваниях легких. ПО может применяться как иммуностимулятор широкого спектра действия, детоксикант, иммуностимулирующий и пролонгирующий носитель для АГ в структуре конъюгированных вакцин нового поколения. В настоящее время на основе ПО созданы гриппозная, бруцеллезная, брюшнотифозная вакцины и ряд аллерговакцин, разрабатываются и другие вакцины, в том числе форсифицированные.
Препарат обладает пролонгированным эффектом. Однократно введенный, он действует в течение одной-двух недель. Клинические испытания препарата на здоровых добровольцах показали хорошую переносимость ПО, отсутствие каких-либо побочных явлений или аллергических реакций [6].
В клинике ПО применялся у хирургических больных с послеоперационными инфекционными осложнениями, с трофическими нарушениями нижних конечностей при сахарном диабете, с острыми и хроническими инфекционно-воспалительными урогенитальными заболеваниями, с аллергией и бронхиальной астмой, с онкологическими заболеваниями [8, 11, 12, 13]. Проведено исследование клинической эффективности и переносимости ПО при лечении пациентов с хроническим бронхитом и хроническим рецидивирующим фурункулезом — заболеваниями, представляющими собой вторичные иммунодефициты с поражением различных звеньев иммунной системы [6].
В литературе имеются лишь единичные сведения об исследованиях эффективности использования ПО в клинике фтизиатрии [3].
Целью настоящей работы явилось исследование клинической эффективности ПО в комплесной иммунохимиотерапии больных туберкулезом органов дыхания.
Курс иммунотерапии ПО проводился по схеме: 6 мг в сутки внутримышечно два раза в неделю; 27 пациентам было сделано 10 инъекций, двум больным — 4 и 6 инъекций ПО соответственно.
Больным проводилось комплексное клинико-лабораторное, рентгенологическое, инструментальное и иммунологическое обследование. Эффективность ПО у больных туберкулезом легких оценивали в процессе комплексной иммунохимиотерапии, сразу после проведения курса лечения ПО и через месяц после его окончания. Пациенты контрольной группы обследовались в те же сроки. Схемы специфической химиотерапии у пациентов основной и контрольной группы были идентичными.
Анализ влияния иммунотерапии ПО на ликвидацию симптомов интоксикации у больных туберкулезом легких представлен на рис. 2. Необходимо отметить, что улучшение общего самочувствия, уменьшение или исчезновение жалоб со стороны органов дыхания отмечалось больными после первых инъекций ПО.
Наряду с оценкой дезинтоксикационного эффекта ПО поводилось изучение влияния препарата на состояние специфического процесса в легочной ткани у больных туберкулезом. Динамика рассасывания инфильтративных изменений в легочной ткани у больных основной и контрольной групп представлена на рис. 3. Анализ данных, представленных на рис. 3, позволяет сделать вывод о выраженном положительном влиянии ПО на процесс рассасывания специфического воспаления в легочной ткани у больных туберкулезом.
Важными являются результаты исследования прекращения бактериовыделения у пациентов через месяц после окончания курса иммунотерапии ПО. Анализ этих данных представлен на рис. 4.
Результаты изучения другого важного критерия эффективности лечения больных туберкулезом — инволюции полостей распада под влиянием иммунотерапии ПО — представлены на рис. 5. Проанализировав эти данные, можно сделать вывод о положительном влиянии ПО на процесс заживления деструкции легочной ткани у больных туберкулезом.
Ниже мы приводим клиническое наблюдение, подтверждающее сделанные нами выводы.
Больному начали проводить курс противотуберкулезной химиотерапии четырьмя препаратами (изониазид + рифампицин + стрептомицин + пиразинамид). Учитывая данные клинико-лабораторного исследования, свидетельствующие о наличии у больного резко выраженного интоксикационного синдрома, было решено начать лечение ПО. Курс иммунотерапии составил 10 инъекций ПО два раза в неделю по 0,006 г в течение 5 недель. На фоне проводимого лечения у больного уже в первые две недели отмечалось улучшение самочувствия, значительное уменьшение симптомов интоксикации. При рентгенологическом исследовании в динамике отмечалось значительное рассасывание инфильтративных изменений и уменьшение размеров деструкции в верхней доле правого легкого. Через месяц после окончания курса иммунотерапии ПО полость распада четко не определялась.
Заключение: у больного с впервые выявленным инфильтративным туберкулезом верхней доли правого легкого в фазе распада и обсеменения МБТ(+) назначение иммунотерапии ПО позволило добиться полной ликвидации симптомов интоксикации, нормализации гемограммы, прекращения бактериовыделения, значительного рассасывания воспалительной инфильтрации и закрытия деструкции легочной ткани к третьему месяцу химиотерапии.
Поскольку иммунотерапия ПО проводилась в разные сроки от начала антибактериального лечения, представлялось целесообразным оценить ее эффективность при раннем (в течение первых одного-двух месяцев) назначении ПО совместно с антибактериальными препаратами (I подгруппа) и в более поздние сроки (II подгруппа). Первая подгруппа в основном была сформирована из больных инфильтративной формой туберкулеза легких (73,1%), тогда как во II подгруппе преобладали больные фиброзно-кавернозной формой туберкулеза легких (47,4%).
Мы изучали дезинтоксикационный эффект ПО у больных туберкулезом легких в различные сроки от начала антибактериального лечения, а также динамику рассасывания инфильтрата, прекращения бактериовыделения и инволюции деструктивных изменений в легочной ткани. Анализ полученных данных показал эффективность использования ПО с дезинтоксикационной целью на различных этапах антибактериального лечения больных туберкулезом легких. Симптомы интоксикации через месяц после окончания курса ПО ликвидированы у больных I и II подгрупп в 78,6 и 72,7% случаев соответственно. Значительное рассасывание специфических воспалительных изменений в легких у больных после курса ПО чаще отмечалось в I (68,7%), чем во II (30,8%) подгруппе. Абациллирование достигнуто через месяц после окончания курса ПО в I подгруппе у всех больных, а во II подгруппе — у 54,5% больных. Закрытие деструкции легочной ткани через месяц после курса иммунотерапии ПО у больных чаще происходило в I, чем во II подгруппе (46,7 и 18,2% соответственно).
Таким образом, анализ клинической эффективности ПО у больных туберкулезом легких показал преимущества комплексной иммунохимиотерапии, проводимой пациентам с наличием интоксикации, бактериовыделения, инфильтративными изменениями и деструкцией легочной ткани в первые один-два месяца от начала антибактериальной терапии.
Для цитирования: Мишин В.Ю., Степанян И.Э. Контролируемая химиотерапия туберкулеза органов дыхания в современных условиях. Проблема лекарственной устойчивости. РМЖ. 2000;12:496.
Центральный НИИ туберкулеза РАМН,
кафедра туберкулеза Московского государственного медико-стоматологического университета
Этиотропная химиотерапия играет приоритетную роль среди методов лечения туберкулеза, к которым относятся также лечебно-охранительный режим, рациональное питание, патогенетическая терапия, коллапсотерапия, оперативное и санаторно-курортное лечение. Лечебный эффект противотуберкулезных препаратов основан на их бактериостатическом или бактерицидном действии в отношении микобактерий туберкулеза (МБТ), которое приводит к уменьшению бактериальной популяции в организме больного.
Группа препаратов, применяемых для лечения туберкулеза, весьма немногочисленна и включает разнородные химические соединения – антибиотики и химиотерапевтические средства.
Основными противотуберкулезными средствами на сегодня являются изониазид, рифампицин, стрептомицин, пиразинамид, этамбутол, тиоацетазон. Первые два из перечисленных препаратов обладают бактерицидным действием и способны быстро убивать большое количество активно размножающихся МБТ [1].
Противотуберкулезные препараты “второго ряда” – канамицин, амикацин, капреомицин; этионамид (протионамид); офлоксацин, ципрофлоксацин; циклосерин (теризидон); ПАСК – назначают в случаях, когда по каким-либо причинам невозможно использовать основные средства [2].
Полвека назад, вскоре после появления первых противотуберкулезных препаратов, продолжительность лечения была сравнительно небольшой (1– 3 мес), химиотерапия оказывала фантастический эффект, что позволило необоснованно считать проблему лечения туберкулеза решенной. Однако опыт, накопленный фтизиатрией в последующие десятилетия, показал, что после того, как интенсивное размножение бактериальной популяции подавлено в результате химиотерапии, продолжается персистирование части микобактерий, которые сохраняются, главным образом, внутриклеточно (внутри фагоцитов). Подавить жизнедеятельность этой части МБТ очень трудно, так как большинство химиопрепаратов не действуют на внутриклеточно расположенные микобактерии. Оказалось также, что при монотерапии (лечение одним противотуберкулезным препаратом), нерегулярном приеме лекарств быстро формируется лекарственная устойчивость МБТ.
Таким образом, было обосновано одновременное назначение больным нескольких противотуберкулезных средств, созданы новые химиопрепараты, продолжительность лечения постепенно увеличивалась и достигла 12–18 мес, что не всегда было оправдано. Было установлено, что низкая эффективность лечения туберкулеза в большей степени обусловлена нерегулярным приемом препаратов, чем недостаточной длительностью его. В течение последнего десятилетия по рекомендации ВОЗ во многих странах внедрили методику контролируемой краткосрочной химиотерапии (ДОТС), которая оказалась эффективной и позволила сократить длительность лечения до 6–9 мес за счет использования рациональных режимов химиотерапии.
Режимы химиотерапии
Понятие “режим химиотерапии” включает определенную комбинацию химиопрепаратов, их дозировку, способ использования в виде однократной суточной дозы или разделенной на 2–3 приема, путь введения (внутрь, внутривенно, в виде аэрозолей, эндобронхиальных вливаний, ректально) и ритм приема (ежедневно или прерывисто).
Интенсивность и длительность химиотерапии больного туберкулезом определяется наличием или отсутствием бактериовыделения, тяжестью и распространенностью легочного процесса, сведениями о предшествующем лечении. Учет указанных факторов позволяет отнести каждый случай заболевания к определенной категории (табл. 1).
Курс противотуберкулезной химиотерапии состоит из двух фаз. Назначение первой фазы – интенсивной – подавить размножение бактериальной популяции, добиться ее количественного уменьшения. Главной задачей второй фазы является предупреждение размножения оставшихся микобактерий.
В первой фазе химиотерапии впервые выявленным бациллярным больным назначают 4 основных противотуберкулезных препарата. Интенсивную химиотерапию проводят 2 мес, а при сохранении бактериовыделения по данным микроскопии мазка – 3 мес. Во второй фазе химиотерапии у впервые выявленных больных используют 2 препарата в течение 4 мес ежедневно или через день.
Впервые выявленным больным, лечившимся нерегулярно или прервавшим лечение, а также больным с рецидивом туберкулеза, в интенсивной фазе рекомендуется назначение 5 химиопрепаратов в течение 2 мес, затем в течение еще 1 месяца применяют 4 химиопрепарата (отменяется стрептомицин). Вторую фазу химиотерапии у этой категории больных рекомендуется проводить 3 противотуберкулезными препаратами в течение последующих 5 мес ежедневно или через день.
Больным, у которых при первоначальном исследовании мокроты не были выявлены МБТ, интенсивную фазу химиотерапии проводят тремя основными противотуберкулезными препаратами, после чего переходят на прием двух препаратов в течение 4 мес (см. табл. 1).
Больные хроническими формами туберкулеза легких должны лечиться по индивидуальным схемам химиотерапии с учетом устойчивости микобактерий к химиопрепаратам (табл. 2).
Эффективность проводимой химиотерапии оценивают по динамике клинических проявлений, бактериовыделения, рентгенологически выявляемых изменений в легких (уменьшению инфильтративных изменений в легких и закрытию каверн).
Обеспечение регулярного приема больным назначенных химиопрепаратов является важной задачей в течение всего периода лечения. В стационаре прием назначенных химиопрепаратов осуществляется под контролем медицинского персонала с точным учетом принятых медикаментов. В амбулаторных условиях прием химиопрепаратов осуществляется под контролем медицинского персонала в противотуберкулезных диспансерах либо на дому у больного. Контроль облегчается при применении всей суточной дозы в один прием, при интермиттирующем лечении.
Удобство контролируемой химиотерапии обеспечивается также применением комбинированных таблетированных форм, содержащих 2–4 основных химиопрепарата. Майрин содержит этамбутол, изониазид и рифампицин, в майрин П дополнительно включен пиразинамид. Рифакомб плюс, рифатер и трикокс включают изониазид, пиразинамид и рифампицин; рифинаг и тибитекс - изониазид и рифампицин. Их применение значительно облегчает контроль за химиотерапией, особенно в амбулаторных условиях. Нерегулярный прием химиопрепаратов может привести к развитию лекарственной устойчивости МБТ и прогрессированию процесса.
Часть больных в процессе лечения нуждается в изменении режима химиотерапии вследствие возникновения неустранимых побочных реакций на препараты, либо обнаружения лекарственной устойчивости, либо отсутствия эффекта от проводимой терапии, что чаще всего выражается продолжающимся бактериовыделением и сохранением каверны в легком. Режим химиотерапии целесообразно менять не позже, чем через 2–3 мес после начала лечения, поскольку к концу 3-го месяца уже имеются результаты количественного исследования мокроты методом микроскопии до начала лечения и в процессе химиотерапии; результаты посева мокроты, сделанного до начала лечения, с данными о чувствительности МБТ к химиопрепаратам; динамика рентгенологических изменений в легких. Своевременная коррекция химиотерапии значительно повышает ее эффективность, способствует более быстрому заживлению деструктивных изменений в легких. Индивидуализация лечебной тактики осуществляется на основании информации, полученной на протяжении всего периода химиотерапии.
Причины неэффективности лечения
Положительных результатов лечения удается достичь не у всех больных. Среди важнейших причин неэффективности лечения больных туберкулезом можно назвать побочное действие противотуберкулезных препаратов; заметное увеличение частоты остропрогрессирующих форм туберкулеза, протекающих на фоне выраженного иммунодефицита с развитием необратимых изменений в легких; сопутствующие туберкулезу заболевания; плохое обеспечение противотуберкулезными химиопрепаратами, отсутствие контроля за приемом лекарств, недисциплинированность больных и др. Однако наиболее важной причиной недостаточной эффективности химиотерапии остается лекарственная резистентность МБТ.
Лекарственная резистентность МБТ
Больные туберкулезом, выделяющие лекарственно-устойчивые штаммы МБТ, длительное время остаются бактериовыделителями и могут заражать окружающих лекарственно-резистентными возбудителями. Чем больше число больных, выделяющих лекарственно-устойчивые МБТ, тем выше риск распространения инфекции среди здоровых лиц и появления новых случаев заболевания туберкулезом с первичной лекарственной устойчивостью.
По определению экспертов ВОЗ [2], лекарственно-устойчивый туберкулез – это случай туберкулеза легких с выделением МБТ, устойчивых к одному и более противотуберкулезным препаратам. В последние годы в связи с ухудшением эпидемической ситуации существенно увеличилось число больных, выделяющих МБТ, устойчивые к основным противотуберкулезным препаратам. По данным ЦНИИ туберкулеза РАМН, у 50% впервые выявленных и ранее не леченных противотуберкулезными препаратами больных в мокроте определялись лекарственно-устойчивые МБТ, из них у 27,7% имелась устойчивость к 2 основным противотуберкулезным препаратам – изониазиду и рифампицину. При хроническом фиброзно-кавернозном туберкулезе частота выявления лекарственно-уcтойчивых МБТ возрастает до 95,5% [3].
Феномен лекарственной устойчивости МБТ имеет важное клиническое значение. Существует тесная взаимосвязь количественных изменений микобактериальной популяции и изменения ряда биологических свойств МБТ, одним из которых является лекарственная устойчивость. В активно размножающейся бактериальной популяции всегда имеется некоторое количество лекарственно-устойчивых мутантов, которые практического значения не имеют, но по мере сокращения бактериальной популяции под влиянием химиотерапии изменяется соотношение между количеством лекарственно-чувствительных и устойчивых МБТ [4]. В этих условиях происходит размножение главным образом устойчивых МБТ, эта часть бактериальной популяции увеличивается. В клинической практике необходимо исследовать лекарственную чувствительность МБТ и результаты этого исследования сопоставлять с динамикой туберкулезного процесса в легких [3].
Методы обнаружения лекарственной устойчивости МБТ
Повышение эффективности лечения туберкулеза, вызванного лекарственно-устойчивыми МБТ, возможно за счет использования ускоренных методов обнаружения лекарственной устойчивости МБТ, что позволяет своевременно изменять режим химиотерапии, отменив препараты, к которым выявлена устойчивость МБТ, и назначить противотуберкулезные средства, к которым чувствительность сохранена.
Исследование лекарственной устойчивости МБТ непрямым методом осуществляют после получения культуры МБТ, выделенных от больного, что требует от 30 до 45 сут. Коррекция химиотерапии в таком случае носит отсроченный характер и проводится, как правило, уже на конечном этапе интенсивной фазы химиотерапии.
Лекарственную устойчивость МБТ в настоящее время определяют методом абсолютных концентраций, который основан на добавлении в плотную питательную среду Левенштейна–Йенсена стандартных концентраций противотуберкулезных препаратов, которые принято называть предельными. Для изониазида она составляет 1 мкг/мл, рифампицина – 40 мкг/мл, стрептомицина – 10 мкг/мл, этамбутола – 2 мкг/мл, канамицина – 30 мкг/мл, амикацина – 8 мкг/мл, протионамида (этионамида) – 30 мкг/мл, офлоксацина (таривида) – 5 мкг/мл, циклосерина – 30 мкг/мл и пиразинамида – 100 мкг/мл. Определение лекарственной устойчивости МБТ к пиразинамиду проводят на специально приготовленной яичной среде с рН 5,5–5,6. Культура МБТ считается устойчивой, если в пробирке выросло более 20 колоний.
В последнее время для ускоренного определения лекарственной устойчивости применялся радиометрический метод с использованием автоматической системы BACTEC – 460 TB (Becton Dickinson Diagnostic Systems, Sparks, MD), который позволяет выявлять лекарственную устойчивость МБТ на жидкой среде Middlebrook 7H10 через 8–10 дней.
Другая не менее важная задача – правильное лечение впервые выявленных больных туберкулезом легких с использованием комбинации из 4–5 основных противотуберкулезных препаратов до получения данных лекарственной устойчивости МБТ [1]. В этих случаях существенно повышается вероятность того, что даже при наличии первичной лекарственной устойчивости МБТ бактериостатическое действие окажут 2 или 3 химиопрепарата, к которым чувствительность сохранена. Именно несоблюдение фтизиатрами научно обоснованных комбинированных режимов химиотерапии при лечении впервые выявленных больных и назначение им в большинстве случаев только 3 химиопрепаратов является грубой врачебной ошибкой, что, в конечном счете, ведет к формированию вторичной лекарственной устойчивости МБТ.
Наличие у больного туберкулезом легких лекарственно-резистентных МБТ существенно снижает эффективность лечения, приводит к появлению хронических и неизлечимых форм, а в ряде случаев и к летальным исходам. Особенно тяжело протекают поражения легких, вызванные полирезистентными МБТ, которые устойчивы как минимум к изониазиду и рифампицину, т.е. к основным и самым активным противотуберкулезным препаратам [4]. Множественная лекарственная устойчивость МБТ является на сегодня наиболее тяжелой формой бактериальной устойчивости, а специфические поражения легких, вызванные такими микобактериями, называются полирезистентным туберкулезом легких [2]. Лекарственная устойчивость МБТ имеет не только клиническое и эпидемиологическое, но и экономическое значение, так как лечение таких больных обходится намного дороже, чем больных с МБТ, чувствительными к основным химиопрепаратам. Разработка лечения лекарственно-резистентного туберкулеза легких является одним из приоритетных направлений современной фтизиатрии.
Возможные режимы химиотерапии при выявлении лекарственной устойчивости МБТ больных с впервые выявленным деструктивным туберкулезом легких представлены в табл. 2.
Для проведения эффективной химиотерапии больных хроническими формами туберкулеза легких с множественной лекарственной устойчивостью МБТ используют комбинации резервных противотуберкулезных препаратов, включающие пиразинамид и этамбутол, к которым медленно и довольно редко формируется вторичная лекарственная устойчивость [4]. В табл. 2 представлены схемы химиотерапии для больных с множественной лекарственной устойчивостью МБТ, ранее длительно получавших противотуберкулезную терапию.
Все резервные препараты обладают довольно низкой бактериостатической активностью, поэтому общая длительность химиотерапии у больных с хроническим фиброзно-кавернозным туберкулезом легких и множественной лекарственной устойчивостью МБТ должна составлять не менее 21 мес.
При отсутствии эффекта от проводимой химиотерапии резервными противотуберкулезными препаратами возможно применение хирургических методов лечения, наложение лечебного искусственного пневмоторакса или пневмоперитонеума. Оперировать следует после максимально возможного сокращения микобактериальной популяции, что определяется с помощью микроскопии или культурального исследования мокроты. После операции следует продолжать применять тот же режим химиотерапии минимум 18–20 мес. Лечебный искусственный пневмоторакс должен продолжаться у больных полирезистентным туберкулезом легких не менее 12 мес.
Повышение эффективности лечения больных с лекарственно-устойчивым туберкулезом легких в значительной степени зависит от своевременной коррекции химиотерапии и применения противотуберкулезных препаратов, к которым сохранена чувствительность. Для лечения больных лекарственно-устойчивым и, особенно, полирезистентным туберкулезом легких необходимо использовать резервные препараты: протионамид (этионамид), амикацин (канамицин), офлоксацин. Эти препараты в отличие от основных (изониазид, рифампицин, пиразинамид, этамбутол, стрептомицин) намного более дорогостоящие, менее эффективные и имеют много побочных эффектов. Они должны быть доступны только для специализированных противотуберкулезных учреждений.
Эффективное лечение больных туберкулезом достигается за счет подавления микобактериальной популяции путем применения современных режимов контролируемой химиотерапии основными противотуберкулезными препаратами: изониазидом, рифампицином, пиразинамидом, стрептомицином, этамбутолом. Важнейшими факторами, снижающими эффективность химиотерапии, следует признать резистентность МБТ к противотуберкулезным препаратам, характер специфического процесса и побочные реакции на химиопрепараты.
Повышение эффективности лечения больных с лекарственно-устойчивым туберкулезом легких в значительной степени зависит от своевременной коррекции химиотерапии и применения противотуберкулезных препаратов, к которым сохранена чувствительность. Для лечения больных лекарственно-устойчивым и, особенно, полирезистентным туберкулезом легких необходимо использовать резервные препараты: протионамид (этионамид), амикацин (канамицин), офлоксацин.
1. Лечение туберкулеза: рекомендации для национальных программ.- ВОЗ - Женева, 1998. - Пер. с англ. 77.
2. Рекомендации по лечению резистентных форм туберкулеза. - ВОЗ. - Женева, 1998. - Пер. с англ. 47.
3. Чуканов В.И. Основные принципы лечения больных туберкулезом легких. //Русс. мед. журн. 1998; 17: 1138–42.
Туберкулез легких – это инфекционная патология, вызываемая бациллой Коха, характеризующаяся различными в клинико-морфологическом отношении вариантами поражения легочной ткани. Многообразие форм туберкулеза легких обусловливает вариабельность симптоматики. Наиболее типичны для туберкулеза легких респираторные нарушения (кашель, кровохарканье, одышка) и симптомы интоксикации (длительный субфебрилитет, потливость, слабость). Для подтверждения диагноза используются лучевые, лабораторные исследования, туберкулинодиагностика. Химиотерапия туберкулеза легких проводится специальными туберкулостатическими препаратами; при деструктивных формах показано хирургическое лечение.
МКБ-10

Общие сведения
На сегодняшний день туберкулез легких представляет не только медико-биологическую, но и серьезную социально-экономическую проблему. По данным ВОЗ, туберкулезом инфицирован каждый третий житель планеты, смертность от инфекции превышает 3 млн. человек в год. Легочный туберкулез является самой частой формой туберкулезной инфекции. Удельный вес туберкулеза других локализаций (суставов, костей и позвоночника, гениталий, кишечника, серозных оболочек, ЦНС, глаз, кожи) в структуре заболеваемости значительно ниже.

Причины
Характеристика возбудителя
Отличительной чертой МБТ является их высокая устойчивость к внешним воздействиям (высоким и низким температурам, влажности, воздействию кислот, щелочей, дезинфектантов). Наименьшую стойкость возбудители туберкулеза легких демонстрируют к солнечному свету. Для человека опасность представляют туберкулезные бактерии человеческого и бычьего типа; случаи инфицирования птичьим типом микобактерий крайне редки.
Пути заражения
Основной путь заражения при первичном туберкулезе легких – аэрогенный: от больного открытой формой человека микобактерии распространяются с частичками слизи, выделяемыми в окружающую среду при разговоре, чихании, кашле; могут высыхать и разноситься с пылью на значительные расстояния. В дыхательные пути здорового человека инфекция чаще попадает воздушно-капельным или пылевым путем.
Меньшую роль в инфицировании играют алиментарный (при употреблении зараженных продуктов), контактный (при использовании общих предметов гигиены и посуды) и трансплацентарный (внутриутробный) пути. Причиной вторичного туберкулеза легких выступает повторная активация ранее перенесенной инфекции либо повторное заражение.
Факторы риска
Однако попадание МБТ в организм не всегда приводит к заболеванию. Факторами, на фоне которых туберкулез легких развивается особенно часто, считаются:
- неблагоприятные социально-бытовые условия
- курение и другие химические зависимости
- недостаточное питание
- иммуносупрессия (ВИЧ-инфекция, прием глюкокортикоидов, состояние после трансплантации органов)
- онкологические заболевания и др.
В группе риска по развитию туберкулеза легких находятся мигранты, заключенные, лица, страдающие наркотической и алкогольной зависимостью. Также имеет значение вирулентность инфекции и длительность контакта с больным человеком.
Патогенез
При снижении местных и общих факторов защиты микобактерии беспрепятственно проникают в бронхиолы, а затем в альвеолы, вызывая специфическое воспаление в виде отдельных или множественных туберкулезных бугорков или очагов творожистого некроза. В этот период появляется положительная реакция на туберкулин - вираж туберкулиновой пробы. Клинические проявления туберкулеза легких на этой стадии часто остаются нераспознанными. Небольшие очажки могут самостоятельно рассасываться, рубцеваться или обызвествляться, однако МБТ в них длительно сохраняются.
Классификация
Первичный туберкулез легких - это впервые развившаяся инфильтрация легочной ткани у лиц, не имеющих специфического иммунитета. Диагностируется преимущественно в детском и подростковом возрасте; реже возникает у лиц старшего и пожилого возраста, которые в прошлом перенесли первичную инфекцию, закончившуюся полным излечением. Первичный туберкулез легких может принимать форму:
- первичного туберкулезного комплекса (ПТК)
- туберкулеза внутригрудных лимфоузлов (ВГЛУ)
- хронически текущего туберкулеза.
Вторичный туберкулез легких развивается при повторном контакте с МБТ или в результате реактивации инфекции в первичном очаге. Основные вторичные клинические формы представлены:
Отдельно различают кониотуберкулез (туберкулез, развивающийся на фоне пневмокониозов), туберкулез верхних дыхательных путей, трахеи, бронхов; туберкулезный плеврит. При выделении больным МБТ в окружающую среду с мокротой говорят об открытой форме (ВК+) туберкулеза легких; при отсутствии бацилловыделения – о закрытой форме (ВК–). Также возможно периодическое бацилловыделение (ВК±).
Течение туберкулеза легких характеризуется последовательной сменной фаз развития:
- 1) инфильтративной
- 2) распада и обсеменения
- 3) рассасывания очага
- 4) уплотнения и обызвествления.
Симптомы туберкулеза легких
Первичный туберкулезный комплекс
Первичный туберкулезный комплекс сочетает в себе признаки специфического воспаления в легком и регионарный бронхоаденит. Может протекать бессимптомно или под маской простудных заболеваний, поэтому выявлению первичного туберкулеза легких способствуют массовые скрининги детей (проба Манту) и взрослых (профилактическая флюорография).
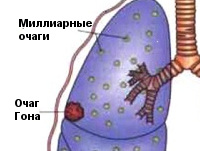
Чаще возникает подостро: больного беспокоит сухой кашель, субфебрилитет, утомляемость, потливость. При острой манифестации клиника напоминает неспецифическую пневмонию (высокая лихорадка, кашель, боль в груди, одышка). В результате лечения происходит рассасывание или обызвествление ПТК (очаг Гона). В неблагоприятных случаях может осложняться казеозной пневмонией, образованием каверн, туберкулезным плевритом, милиарным туберкулезом, диссеминацией микобактерий с поражением почек, костей, мозговых оболочек.
Туберкулез внутригрудных лимфоузлов
Признаки туберкулезной интоксикации включают отсутствие аппетита, снижение массы тела, утомляемость, бледность кожи, темные круги под глазами. На венозный застой в грудной полости может указывать расширение венозной сети на коже грудной клетки. Данная форма нередко осложняется туберкулезом бронхов, сегментарными или долевыми ателектазами легких, хронической пневмонией, экссудативным плевритом. При прорыве казеозных масс из лимфоузлов через стенку бронхов могут формироваться легочные очаги туберкулеза.
Очаговый туберкулез легких
Клиническая картина очагового туберкулеза малосимптомна. Кашель отсутствует или возникает редко, иногда сопровождается выделением скудной мокроты, болями в боку. В редких случаях отмечается кровохарканье. Чаще больные обращают внимание на симптомы интоксикации: непостоянный субфебрилитет, недомогание, апатию, пониженную работоспособность. В зависимости от давности туберкулезного процесса различают свежий и хронический очаговый туберкулез легких.
Течение очагового туберкулеза легких относительно доброкачественное. У больных с нарушенной иммунной реактивностью заболевание может прогрессировать в деструктивные формы туберкулеза легких.
Инфильтративный туберкулез легких
Клиническая картина инфильтративного туберкулеза легких зависит от величины инфильтрата и может варьировать от нерезко выраженных симптомов до острого лихорадочного состояния, напоминающего грипп или пневмонию. В последнем случае отмечается выраженная высокая температура тела, ознобы, ночная потливость, общая слабость. Со стороны органов дыхания беспокоит кашель с мокротой и прожилками крови.
В воспалительный процесс при инфильтративной форме туберкулеза легких часто вовлекается плевра, что обусловливает появление болей в боку, плеврального выпота, отставание пораженной половины грудной клетки при дыхании. Осложнениями инфильтративного туберкулеза легких могут стать казеозная пневмония, ателектаз легкого, легочное кровотечение и др.
Диссеминированный туберкулез легких
Может манифестировать в острой (милиарной), подострой и хронической форме. Тифоидная форма милиарного туберкулеза легких отличается преобладанием интоксикационного синдрома над бронхолегочной симптоматикой. Начинается остро, с нарастания температуры до 39-40 °С, головной боли, диспепсических расстройств, резкой слабости, тахикардии. При усилении токсикоза может возникать нарушение сознания, бред.
При легочной форме милиарного туберкулеза легких с самого начала более выражены дыхательные нарушения, включающие сухой кашель, одышку, цианоз. В тяжелых случаях развивается острая сердечно-легочная недостаточность. Менингеальной форме соответствуют симптомы поражения мозговых оболочек.
Подострое течение диссеминированного туберкулеза легких сопровождается умеренной слабостью, понижением работоспособности, ухудшением аппетита, похуданием. Эпизодически возникают подъемы температуры. Кашель продуктивный, не сильно беспокоит больного. Иногда первым признаком заболевания становится легочное кровотечение.
Хронический диссеминированный туберкулез легких при отсутствии обострения бессимптомен. Во время вспышки процесса клиническая картина близка к подострой форме. Диссеминированный туберкулеза легких опасен развитием внелегочного туберкулеза, спонтанного пневмоторакса, тяжелых легочных кровотечений, амилоидоза внутренних органов.
Кавернозный и фиброзно-кавернозный туберкулез легких
Характер течения кавернозного туберкулезного процесса волнообразный. В фазу распада нарастают интоксикационные симптомы, гипертермия, усиливается кашель и увеличивается количество мокроты, возникает кровохарканье. Часто присоединяется туберкулез бронхов и неспецифический бронхит.
Фиброзно-кавернозный туберкулез легких отличается формированием каверн с выраженным фиброзным слоем и фиброзными изменениями легочной ткани вокруг каверны. Протекает длительно, с периодическими обострениями общеинфекционной симптоматики. При частых вспышках развивается дыхательная недостаточность II-III степени.
Осложнениями, связанными с деструкцией легочной ткани, являются профузное легочное кровотечение, бронхоплевральный свищ, гнойный плеврит. Прогрессирование кавернозного туберкулеза легких сопровождается эндокринными расстройствами, кахексией, амилоидозом почек, туберкулезным менингитом, сердечно-легочной недостаточностью – в этом случае прогноз становится неблагоприятным.
Цирротический туберкулез легких
Является исходом различных форм туберкулеза легких при неполной инволюции специфического процесса и развитии на его месте фиброзно-склеротических изменений. При пневмоциррозе бронхи деформированы, легкое резко уменьшено в размерах, плевра утолщена и нередко обызвествлена.
Изменения, происходящие при цирротическом туберкулезе легких, обусловливают ведущие симптомы: выраженную одышку, тянущую боль в груди, кашель с гнойной мокротой, кровохарканье. При обострении присоединятся признаки туберкулезной интоксикации и бацилловыделение. Характерным внешним признаком пневмоцирроза служит уплощение грудной клетки на стороне поражения, сужение и втянутость межреберных промежутков. При прогрессирующем течении постепенно развивается легочное сердце. Цирротические изменения в легких необратимы.
Туберкулома легкого
Представляет собой инкапсулированный казеозный очаг, сформировавшийся в исходе инфильтративного, очагового или диссеминированного процесса. При стабильном течении симптомы не возникают, образование выявляется при рентгенографии легких случайно. В случае прогрессирующей туберкуломы легкого нарастает интоксикация, появляется субфебрилитет, боль в груди, кашель с отделением мокроты, возможно кровохарканье. При распаде очага туберкулома может трансформироваться в кавернозный или фиброзно-кавернозный туберкулез легких. Реже отмечается регрессирующее течение туберкуломы.
Диагностика
Диагноз той или иной формы туберкулеза легких выставляется врачом-фтизиатром на основании совокупности клинических, лучевых, лабораторных и иммунологических данных. Для распознавания вторичного туберкулеза большое значение имеет подробный сбор анамнеза. Для подтверждения диагноза проводится:
- Лучевая диагностика.Рентгенография легких является обязательным диагностической процедурой, позволяющей выявить характер изменений в легочной ткани (инфильтративный, очаговый, кавернозный, диссеминированный и т. д.), определить локализацию и распространенность патологического процесса. Выявление кальцинированных очагов указывает на ранее перенесенный туберкулезный процесс и требует уточнения данных с помощью КТ или МРТ легких.
- Анализы. Обнаружение МБТ достигается неоднократным исследованием мокроты (в т. ч. с помощью ПЦР), промывных вод бронхов, плеврального экссудата. Но сам по себе факт отсутствия бацилловыделения не является основанием для исключения туберкулеза легких. Современные иммунологические тесты позволяют выявить туберкулезную инфекцию почти со 100%-ной вероятностью. К ним относятся QuantiFERON и Т-спот. ТБ.
- Туберкулинодиагностика. К методам туберкулинодиагностики относятся диаскин-тест, пробы Пирке и Манту, однако сами по себе данные методы могут давать ложные результаты. Иногда для подтверждения туберкулеза легких приходится прибегать к пробному лечению противотуберкулезными препаратами с оценкой динамики рентгенологической картины.
По результатам проведенной диагностики туберкулез легких дифференцируют с пневмонией, саркоидозом легких, периферическим раком легкого, доброкачественными и метастатическими опухолями, пневмомикозами, кистами легких, абсцессом, силикозом, аномалиями развития легких и сосудов. Дополнительные методы диагностического поиска могут включать бронхоскопию, плевральную пункцию, биопсию легкого.

Лечение туберкулеза легких
Во фтизиатрической практике сформировался комплексный подход к лечению туберкулеза легких, включающий медикаментозную терапию, при необходимости - хирургическое вмешательство и реабилитационные мероприятия. Лечение проводится поэтапно: сначала в тубстационаре, затем в санаториях и, наконец, амбулаторно. Режимные моменты требуют организации лечебного питания, физического и эмоционального покоя.
- Противотуберкулезная терапия. Ведущая роль отводится специфической химиотерапии с помощью препаратов с противотуберкулезной активностью. Для терапии различных форм туберкулеза легких разработаны и применяются 3-х, 4-х и 5-тикомпонентные схемы (в зависимости от количества используемых препаратов). К туберкулостатикам первой линии (обязательным) относятся изониазид и его производные, пиразинамид, стрептомицин, рифампицин, этамбутол; средствами второго ряда (дополнительными) служат аминогликозиды, фторхинолоны, циклосерин, этионамид и др. Способы введения препаратов различны: перорально, внутримышечно, внутривенно, эндобронхиально, внутриплеврально, ингаляторно. Курсы противотуберкулезной терапии проводят длительно (в среднем 1 год и дольше).
- Патогенетическая терапия. При туберкулезе легких включает прием противовоспалительных средств, витаминов, гепатопротекторов, инфузионную терапию и пр. В случае лекарственной резистентности, непереносимости противотуберкулезных средств, при легочных кровотечениях используется коллапсотерапия.
- Хирургическое лечение. При соответствующих показаниях (деструктивных формах туберкулеза легких, эмпиеме, циррозе и ряде др.) применяются различные оперативные вмешательства: кавернотомию, торакопластику, плеврэктомию, резекцию легких.
Профилактика
Профилактика туберкулеза легких является важнейшей социальной проблемой и приоритетной государственной задачей. Первым шагом на этом пути является обязательная вакцинация новорожденных, детей и подростков. При массовых обследованиях в дошкольных и школьных учреждениях используется постановка внутрикожных туберкулиновых проб Манту. Скрининг взрослого населения осуществляется путем проведения профилактической флюорографии.
Ключевые слова: лечение туберкулеза легких, множественная лекарственная устойчивость, широкая лекарственная устойчивость, безопасность лекарственной помощи.
Clinical effectiveness of new drugs in the treatment of pulmonary tuberculosis with multi-drug-resistant and extensively-drug-resistant pathogen
Kildyusheva E.I. 1 , Egorov E.A. 1 , Skornyakov S.N. 1 , Medvinsky I.D. 1 , Zaletaeva G.E. 1 , Podgaeva V.A. 2 , Lugovkina T.K. 2 , Okhtyarkina V.V. 2 , Kravchenko M.A. 1 , Fadina O.V. 1 , Schipunov S.V. 1 , Guschin A.C. 3
Key words: treatment of pulmonary tuberculosis, multiple drug resistance, extensively- drug resistance, drug safety.
For citation: Kildyusheva E.I., Egorov E.A., Skornyakov S.N. et al. Clinical effectiveness of new drugs in the treatment of pulmonary tuberculosis with multi-drug-resistant and extensively-drug-resistant pathogen // RMJ. 2017. № 18. P. 1288–1295.
В статье представлена клиническая результативность новых лекарственных препаратов в схемах лечения туберкулеза с множественной и широкой лекарственной устойчивостью возбудителя
Прозрачность исследования. Авторы не получали грантов, вознаграждений или спонсорской помощи при подготовке данной статьи. Авторы несут полную ответственность за предоставление окончательной версии рукописи в печать.
Декларация о финансовых и других взаимоотношениях. Все авторы принимали участие в разработке концепции, дизайна работы и написании
рукописи. Окончательная версия рукописи одобрена всеми авторами.
Актуальность
На фоне стабилизации заболеваемости туберкулезом в России в последнее десятилетие происходит изменение структуры лекарственной чувствительности микобактерии туберкулеза (МБТ). На первый план вышла проблема лекарственно-устойчивого туберкулеза, особенно с множественной лекарственной устойчивостью (МЛУ) и широкой лекарственной устойчивостью (ШЛУ) возбудителя. Так, в 2013 г. в Российской Федерации среди впервые выявленных бациллярных больных туберкулезом органов дыхания доля пациентов, выделяющих МБТ с МЛУ к противотуберкулезным препаратам (ПТП), составила 17,3%, а среди всех больных туберкулезом различной локализации с бактериовыделением – 40,0% [1]. В 2015 г. отмечено увеличение доли впервые выявленных больных с МЛУ-туберкулезом до 23,0%, а среди всех больных туберкулезом с бактериовыделением – до 47,5%. В Уральском Федеральном округе эти цифры составили 24,1 и 50,2% соответственно [2]. Доля пациентов с выделением МБТ с ШЛУ возбудителя среди всех случаев бактериовыделения в России составляет в настоящее время более 10% [1].
Лечение больных туберкулезом с МЛУ/ШЛУ возбудителя проводится в России в соответствии с Федеральными клиническими рекомендациями по диагностике и лечению туберкулеза органов дыхания с множественной и широкой лекарственной устойчивостью возбудителя, утвержденными приказом Минздрава России от 29.12.2014 № 951 [3, 4].
При лечении этой категории больных у врача существенно ограничены возможности формирования эффективных режимов химиотерапии. Это связано не только с плохой переносимостью противотуберкулезных препаратов, наличием сопутствующей патологии, но и с лекарственной устойчивостью к имеющимся в распоряжении клинической практики ПТП [5, 6]. В связи с этим изучение клинической результативности и эффективности новых лекарственных препаратов для лечения туберкулеза имеет большое практическое значение [7].
Цель исследования: оценка клинической результативности и безопасности включения в схемы противотуберкулезной химиотерапии новых комбинаций ПТП при лечении легочного туберкулеза с МЛУ/ШЛУ возбудителя.
Материал и методы
Результаты исследования
Изопаск
Перхлозон ®
Бедаквилин
Полностью 24-недельный курс завершили 110 (98,2%) человек основной группы и 107 (97,2%) – контрольной группы (t=0,3448, p>0,05). Причиной прекращения терапии у 2–х пациентов основной группы послужили НЯ III степени. Отмечалось удлинение интервала QT до 520 мс к 2-му месяцу терапии, связанное с приемом Бедаквилина, расцененное как серьезная угроза жизни, Бедаквилин был отменен. Через 2 нед. после отмены препарата интервал QT нормализовался. У 3-х пациентов группы сравнения причиной прекращения терапии явилось нарушение протокола.
Другие НЯ I и II степени выраженности (слабой и умеренной степени по CTCAE) были отмечены у 64 (57,4%) пациентов основной группы и у 69 (62,7%) – контрольной группы (p>0,05). Среди НЯ преобладали гастроинтестинальные – 44,4%, нейротоксические – 23,8%, гепатотоксические – 19,0%, артралгические – 7,9%, аллергические – 4,8%. Все они были слабой или умеренной степени выраженности по CTCAE и не связаны с исследуемым препаратом.
Бактериовыделение, подтвержденное методом посева, прекратилось в основной группе у 59,8%, в контрольной – у 36,6% пациентов (t=1,9733, p<0,05), закрытие полости деструкции отмечено соответственно у 23,9% и 15,4% (t=1,1184, p>0,05), прогрессирование процесса – у 15,2% и 28,2% (t=1,9883, p <0,05).
Хиксозид
Выводы :
Какие возможны варианты туберкулеза легких по отношению к лекарственному лечению? Какова роль фторхинолонов в лечении туберкулеза легких?
Какие возможны варианты туберкулеза легких по отношению к лекарственному лечению?
Какова роль фторхинолонов в лечении туберкулеза легких?
Таблица. Стандартные концентрации ПТП, используемые для выявления лекарственной устойчивости МБТ
Первый этап характеризуется проведением интенсивной насыщенной химиотерапии четырьмя-пятью ПТП в течение 2-3 месяцев, что ведет к подавлению размножающейся микобактериальной популяции, уменьшению ее количества и предотвращению развития лекарственной резистентности. На первом этапе используется комбинация препаратов, состоящая из изониазида, рифампицина, пиразинамида, стрептомицина и/или этамбутола.
Второй этап — менее интенсивной химиотерапии — проводится, как правило, двумя-тремя ПТП. Цель второго этапа — воздействие на оставшуюся бактериальную популяцию, в большинстве своем находящуюся внутриклеточно в виде персистирующих форм микобактерий. Здесь главной задачей является предупреждение размножения оставшихся микобактерий, а также стимуляция репаративных процессов в легких с помощью различных патогенетических средств и методов лечения.
Такой методический подход к лечению ЛЧТЛ позволяет к концу первого этапа комбинированной химиотерапии под непосредственным медицинским наблюдением абациллировать 100%, а к завершению всего курса лечения — закрыть каверны в легких у более чем 80% больных с впервые выявленным и рецидивным туберкулезом легких [5].
Намного сложнее вопрос о проведении этиотропного лечения второго варианта, к которому мы относим ЛУТЛ, вызванный лекарственно резистентными (ЛР) МБТ к одному и более ПТП и/или их сочетанию. Особенно тяжело протекает ЛУТЛ у больных с множественной ЛР МБТ к изониазиду и рифампицину, то есть к основным и самым эффективным ПТП. Поэтому поиск новых концептуальных путей повышения эффективности лечения ЛУТЛ и разработка современной методологии специфического воздействия на ЛР МБТ является одним из важнейших и приоритетных направлений современной фтизиатрии.
Развитие ЛР у МБТ к ПТП — одна из главных причин недостаточно эффективной этиотропной химиотерапии. Больные туберкулезом, выделяющие ЛР-штаммы МБТ, длительное время остаются бактериовыделителями и могут заражать окружающих ЛР-возбудителем. Чем больше число больных, выделяющих ЛР МБТ, тем выше риск распространения инфекции среди здоровых лиц и появления новых случаев заболевания туберкулезом с первичной резистентностью не только к основным, но и к резервным ПТП.
Феномен ЛР МБТ имеет важное клиническое значение. Существует тесная взаимосвязь количественных изменений микобактериальной популяции и изменения ряда биологических свойств МБТ, одним из которых является ЛР. В активно размножающейся бактериальной популяции всегда имеется небольшое количество ЛР-мутантов, которые практического значения не имеют, но по мере уменьшения бактериальной популяции под влиянием химиотерапии изменяется соотношение между количеством ЛР и устойчивых МБТ [5]. В этих условиях происходит размножение главным образом устойчивых МБТ, эта часть бактериальной популяции увеличивается. Следовательно, в клинической практике необходимо исследовать ЛР МБТ и результаты этого исследования сопоставлять с динамикой туберкулезного процесса в легких [5].
По определению экспертов ВОЗ [3], ЛУТЛ — это случай туберкулеза легких с выделением МБТ, резистентных к одному и более ПТП. По данным Центрального НИИ туберкулеза РАМН, у каждого второго впервые выявленного и ранее не леченного противотуберкулезными препаратами больного в мокроте выявлялись ЛР к ПТП МБТ, при этом у 27,7% из них наблюдалась устойчивость к двум основным противотуберкулезным препаратам — изониазиду и рифампицину. При хроническом фиброзно-кавернозном туберкулезе частота вторичной ЛР МБТ возрастает до 95,5%.
По нашему мнению, и это составляет основу нашей концепции, для повышения эффективности лечения туберкулеза, вызванного ЛР МБТ, необходимо в первую очередь использовать ускоренные методы выявления ЛР МБТ, что позволяет своевременно изменять режим химиотерапии.
Исследование лекарственной устойчивости МБТ в настоящее время возможно по прямому и непрямому методам.
Непрямой метод определения лекарственной чувствительности МБТ требует от 30 до 60, а иногда до 90 суток, ввиду того что вначале производится посев мокроты на твердые питательные среды и только после получения культуры МБТ производят ее пересев уже на среды с добавлением ПТП. При этом коррекция химиотерапии носит отсроченный характер, как правило, уже на конечном этапе интенсивной фазы химиотерапии.
В последнее время для ускоренного определения лекарственной устойчивости нами применялся радиометрический метод с использованием автоматической системы ВАСТЕС-460 ТВ (Becton Dickinson Diagnostic Systems, Sparks, MD), которая позволяет выявлять лекарственную резистентность МБТ на жидкой среде Middlebrook 7H10 через 6-8 дней.
Не менее важно правильное лечение впервые выявленных больных туберкулезом легких и применение современных режимов химиотерапии с использованием в начале лечения комбинации из четырех-пяти основных противотуберкулезных препаратов до получения результатов лекарственной устойчивости МБТ [2]. В этих случаях существенно повышается вероятность того, что даже при наличии первичной ЛР МБТ бактериостатическое действие окажут два или три химиопрепарата, к которым чувствительность сохранена. Именно несоблюдение фтизиатрами научно обоснованных комбинированных режимов химиотерапии при лечении впервые выявленных и рецидивных больных и назначение ими только трех ПТП является грубой врачебной ошибкой, что в конечном счете ведет к формированию наиболее трудно поддающейся лечению вторичной ЛР МБТ.
Наличие у больного туберкулезом легких ЛР МБТ существенно снижает эффективность лечения, приводит к появлению хронических и неизлечимых форм, а в ряде случаев и летальных исходов. Особенно тяжело протекают специфические поражения легких у больных с полирезистентными МБТ, которые обладают множественной ЛР, как минимум к изониазиду и рифампицину, т. е. к основным и самым активным противотуберкулезным препаратам. ЛР МБТ имеет не только чисто клиническое и эпидемиологическое, но и экономическое значение, так как лечение таких больных резервными ПТП обходится намного дороже, чем больных с чувствительными МБТ к основным химиопрепаратам.
В этих условиях расширение списка резервных ПТП, воздействующих на ЛР МБТ, является актуальным и крайне важным для повышения эффективности лечения больных с ЛУТЛ. Кроме того, присоединение к ЛУТЛ неспецифической бронхолегочной инфекции существенным образом утяжеляет течение специфического процесса в легких, требуя назначения дополнительных антибиотиков широкого спектра. В этом плане применение антибиотиков, воздействующих как на МБТ, так и на неспецифическую патогенную бронхолегочную микрофлору, является научнообоснованным и целесообразным.
В этом плане хорошо себя зарекомендовал в России такой препарат из группы фторхинолонов, как офлоксацин (таривид) [3]. Мы же свой выбор остановили на ломефлоксацине, как препарате, который еще не столь широко применяется при лечении туберкулеза и у которого, судя по имеющимся данным, практически не выявляются побочные эффекты и крайне редко формируется ЛР возбудителей инфекционных заболеваний [2].
Ломефлоксацин (максаквин) — антибактериальный препарат из группы фторхинолонов. Как и все представители производных оксихинолонкарбоновой кислоты, максаквин обладает высокой активностью против грамположительных (включая метициллин-устойчивые штаммы Staphylococcus aureus и Staphylococcus epidermidis) и грамотрицательных (включая Pseudomonas) микроорганизмов, в том числе по отношению к различным типам Micobacterium tuberculosis).
Механизм действия максаквина заключается в ингибировании хромосомной и плазмидной ДНК-гиразы, фермента, ответственного за стабильность пространственной структуры микробной ДНК. Вызывая деспирилизацию ДНК микробной клетки, максаквин ведет к гибели последней.
Максаквин обладает иным механизмом действия, нежели другие антибактериальные средства, поэтому к нему не существует перекрестной устойчивости с другими антибиотиками и химиотерапевтическими препаратами [2].
Основной целью настоящего исследования явилось изучение клинической и микробиологической эффективности максаквина при комплексном лечении больных деструктивным ЛУТЛ, выделяющих ЛР МБТ к изониазиду, рифампицину и другим ПТП, а также при сочетании туберкулеза с неспецифической бронхолегочной инфекцией.
Под наблюдением находилось 50 больных деструктивным ЛУТЛ, выделяющих с мокротой ЛР МБТ к изониазиду, рифампицину и ряду других ПТП. Эти люди в возрасте от 20 до 60 лет составили основную группу.
В контрольную группу вошли также 50 больных деструктивным ЛУТЛ легких в той же возрастной группе, выделяющие ЛР МБТ к изониазиду, рифампицину и другим ПТП. Эти пациенты лечились только протионамидом, амикацином, пиразинамидом и этамбутолом.
У 47 больных основной группы и 49 контрольной в мокроте микробиологическими методами были выявлены различные возбудители неспецифической бронхолегочной инфекции.
Среди больных основной группы диссеминированный туберкулез был установлен у 5 человек, инфильтративный — у 12, казеозная пневмония — у 7, кавернозный — у 7 и фиброзно-кавернозный туберкулез — у 17 человек. Большинство больных (45 пациентов) имели распространенный туберкулез легких с поражением более двух долей, у 34 больных был двусторонний процесс. У всех больных основной группы в мокроте были обнаружены МБТ, как методом микроскопии по Цилю — Нильсену, так и методом посева на питательные среды. При этом у них МБТ были устойчивы как минимум к изониазиду и рифампицину. Необходимо отметить, что все пациенты уже ранее неоднократно и неэффективно лечились основными ПТП, и специфический процесс у них приобрел рецидивирующий и хронический характер.
В клинической картине преобладали симптомы интоксикации с высокой температурой тела, потливостью, адинамией, изменениями в крови воспалительного характера, лимфопенией, увеличенной СОЭ до 40-50 мм в час. Следует отметить наличие грудных проявлений болезни — кашель с выделением мокроты, подчас значительного количества, слизисто-гнойной, а у половины больных — гнойной, с неприятным запахом. В легких выслушивались обильные катаральные явления по типу мелко-, средне-, а подчас и крупнопузырчатых влажных хрипов.
У большинства больных преобладали клинические проявления, которые скорее укладывались в картину неспецифического бронхолегочного поражения (бронхита, острой пневмонии, абсцедирования) с частыми и практически не стихающими обострениями.
Основным возбудителем неспецифической инфекции был Streptococcus hemoliticus — у 15,3% и Staphilococcus aureus — у 15% больных. Среди грамотрицательной микрофлоры преобладал Enterobacter cloacae в 7,6% случаев. Следует отметить высокую частоту ассоциации возбудителей неспецифической бронхолегочной инфекции.
МБТ были обнаружены у всех 50 больных. У 42 человек определялось обильное бактериовыделение. У всех пациентов выделенные штаммы МБТ были устойчивы к изониазиду и рифампицину. При этом у 31 больного лекарственная устойчивость МБТ к изониазиду и рифампицину сочеталась с другими ПТП.
Определение минимальной ингибирующей концентрации (МИК) максаквина проводили на лабораторных штаммах H37Rv и Academia, а также клинических штаммах (изолятах), выделенных от 30 больных, из которых 12 изолятов были чувствительны ко всем основным химиопрепаратам и 8 обладали резистентностью к изониазиду, рифампицину и стрептомицину. В опытах in vitro подавление роста лабораторных штаммов МБТ наблюдалось в зоне 57,6±0,04 до 61,8±0,02 мкн/мл, что почти в семь раз больше, чем показатели, характерные для остальных ПТП .
Таким образом, в ходе микробиологических исследований было установлено выраженное бактериологическое действие максаквина на МБТ, при этом более выраженный эффект наблюдался при его воздействии на лекарственно чувствительные штаммы и изоляты. Однако при повышенных концентрациях максаквина эффект также заметен при воздействии на полирезистентные МБТ, устойчивые к основным ППТ.
Лечение максаквином проводилось у всех 50 больных основной группы в разработанной нами комбинации с другими резервными препаратами: протионамидом, амикацином, пиразинамидом и этамбутолом.
Максаквин назначали в дозе 800 мг в сутки перорально однократно в утренние часы сразу вместе с другими противотуберкулезными препаратами для создания максимальной суммарной бактериостатической концентрации в крови и очагах поражения. Доза максаквина выбрана с учетом микробиологических исследований и соответствовала МИК, при которой отмечалось существенное подавление роста МБТ. Терапевтический эффект определяли через месяц — для оценки воздействия его на неспецифическую патогенную бронхолегочную микрофлору и через два месяца — для оценки воздействия на полирезистентные МБТ. Длительность курса лечения резервными химиопрепаратами в сочетании с максаквином составляла два месяца.
Через месяц комплексного лечения было отмечено значительное улучшение состояния больных основной группы, что проявлялось в уменьшении количества мокроты, кашля и катаральных явлений в легких, снижении температуры тела, при этом более чем у двух третей больных — до нормальных цифр.
У всех больных к этому сроку в мокроте перестал определяться рост вторичной патогенной бронхолегочной микрофлоры. К тому же у 34 больных значительно уменьшилась массивность выделения микобактерий туберкулеза. Практически у всех больных нормализовались анализы крови.
Следует отметить, что у 28 пациентов рентгенологически через месяц лечения максаквином в сочетании с протионамидом, амикацином, пиразинамидом и этамбутолом отмечалось частичное рассасывание специфических инфильтративных изменений в легких, а также существенное уменьшение перикавитарной воспалительной реакции. Это позволило применить на данном этапе искусственный пневмоторакс, который является обязательным методом в лечении ЛУТЛ и составляет вторую и не менее важную часть нашей концепции повышения эффективности лечения больных деструктивным туберкулезом легких, выделяющих полилекарственнорезистентные МБТ.
При анализе эффективности специфического действия комбинации резервных противотуберкулезных препаратов в сочетании с максаквином на полирезистентные МБТ при лечении 50 больных основной группы мы делали основной акцент на показатель прекращения бактериовыделения, как по микроскопии мокроты по Цилю — Нильсену, так и по посеву на питательные среды через два месяца после химиотерапии.
Анализ частоты прекращения бактериовыделения у больных основной и контрольной группы через два месяца лечения показал, что у пациентов, получавших максаквин в сочетании с протионамидом, амикацином, пиразинамидом и этамбутолом, прекращение бактериовыделения было достигнуто в 56% случаях. В контрольной группе больных, не получавших максаквина, — только в 30% случаев.
Следует отметить, что у остальных больных основной группы за этот период времени существенно уменьшилась массивность выделения МБТ.
Инволюция локальных изменений в легких у 50 больных контрольной группы также шла более замедленными темпами, и только у 25 больных к концу второго месяца удалось достичь частичного рассасывания перикавитарной инфильтрации и применить к ним искусственный пневмоторакс. К 39 из 50 пациентов основной группы был применен искусственный пневмоторакс в течение 1,5-2 месяцев, и 17 из них удалось достигнуть закрытия каверн в легких. 11 оставшихся больных, имеющих противопоказания к проведению искусственного пневмоторакса, в этот период были подготовлены к плановому оперативному вмешательству.
При определении лекарственной устойчивости МБТ к максаквину через два месяца лечения у больных основной группы только в 4% случаев была получена вторичная лекарственная устойчивость, сформировавшаяся в процессе двухмесячной химиотерапии, что в конечном итоге потребовало его отмены и замены на другой химиопрепарат, к которому МБТ сохранили свою чувствительность.
К концу второго месяца у 4% больных отмечались явления непереносимости максаквина — в виде диспепсических явлений и диареи, связанной с дисбактериозом, аллергических кожных проявлений и эозинофилии до 32%, что привело к полной отмене препарата. Во всех остальных случаях при двухмесячном ежедневном применении максаквина в суточной дозе 800 мг побочных явлений не отмечалось.
Проведенная после окончания курса лечения максаквином комбинированная химиотерапия резервными препаратами и динамическое наблюдение за этими же больными показали, что достигнутый ко второму месяцу положительный результат в абациллировании мокроты оказал положительное влияние и на конечный результат излечения больных с ЛУТЛ.
Таким образом, применение максаквина в дозе 800 мг в сутки в сочетании с протионамидом, амикацином, пиразинамидом и этамбутолом у больных деструктивным ЛУТЛ с сопутствующей неспецифической бронхолегочной инфекцией показало его достаточную эффективность как антибиотика широкого спектра, воздействующего на грамотрицательную и грамположительную микрофлору, и препарата, действующего на туберкулезное воспаление.
Максаквин с полной уверенностью может быть отнесен к группе резервных ПТП. Он эффективно действует не только на МБТ, чувствительные ко всем ПТП, но и на ЛУ МБТ к изониазиду и рифампицину, что и обусловливает целесообразность его назначения таким больным. Тем не менее максаквин не следует рассматривать как основной препарат в схемах лечения больных с впервые выявленным туберкулезом легких, он должен оставаться в резерве и применяться только при ЛУТЛ и сопутствующей неспецифической бронхолегочной инфекции.
Для изониазида это составляет 1 мкг/мл, для рифампицина — 40 мкг/мл, стрептомицина — 10 мкг/мл, этамбутола — 2 мкг/мл, канамицина — 30 мкг/мл, амикацина — 8 мкг/мл, протионамида (этионамида) — 30 мкг/мл, офлоксацина (таривида) — 5 мкг/мл, циклосерина — 30 мкг/мл и для пиразинамида — 100 мкг/мл.
Литература
1. Лечение туберкулеза. Рекомендации для национальных программ. ВОЗ. 1998. 77 с.
2. Мишин. В. Ю., Степанян И. Э. Фторхинолоны в лечении туберкулеза органов дыхания // Русский медицинский журнал. 1999. № 5. С. 234-236.
3. Рекомендации по лечению резистентных форм туберкулеза. ВОЗ. 1998. 47 с.
4. Хоменко А. Г., Мишин В. Ю., Чуканов В. И. и др. Эффективность применения офлоксацина в комплексном лечении больных туберкулезом легких, осложненным неспецифической бронхолегочной инфекцией // Новые лекарственные препараты. 1995. Вып. 11. С. 13-20.
5. Хоменко А. Г. Современная химиотерапия туберкулеза // Клиническая фармакология и терапия. 1998. № 4. С. 16-20.
Читайте также:

