Туберкулезные палочки культивируют на глицериновом агаре
Обновлено: 23.04.2024
Свойства туберкулезной палочки и передача возбудителя. Инфекционность туберкулеза.
В какой мере эти особенности возбудителя отражаются на частоте заражения и заболевания туберкулезом, а также на характере его течения? Отдельные авторы утверждают, что снижение инфицированности и заболеваемости туберкулезом и особенности его течения в последнее время отчасти обусловлены понижением вирулентности и малой патогенностью изониазидоустоичивых и каталазоотрицательных микобактерии, которыми заражаются теперь некоторые взрослые и дети при контакте с больными, лечившимися без достаточного эффекта препаратами ГИНК. Эта гипотеза основывается, с одной стороны, на результатах экспериментальных исследований, установивших слабую патогенность таких штаммов микробов для некоторых видов лабораторных животных, а с другой — па отдельных клинических наблюдениях о якобы меньшей зараженности и заболеваемости лиц, соприкасающихся с больными, в мокроте которых находят тубазидоустойчивые микобактерии туберкулеза (А. Ш. Шерман, 1962).
Однако такая точка зрения не имеет достаточных обоснований. Установлено, например, что микобактерии туберкулеза, даже высокоустойчивые к препаратам ГИНК, характеризующиеся отрицательной каталазной и пероксидазной активностью, а также слабопатогенные и маловирулентные для морских свинок, вызывают генерализованный туберкулез у белых мышей, золотистых хомяков и патогенны для человека.
Gerbeaux и соавт. (1962) обнаружили в спинномозговой жидкости у нескольких детей, больных туберкулезным менингитом, микобактерии, устойчивые к изониазиду и вместе с тем обладавшие различной степенью вирулентности при испытании на морских свинках. У части привитых животных они вызывали генерализованный туберкулез, у других — слабо выраженные специфические изменения; у третьей группы морских свинок не только отсутствовали морфологические признаки процесса, но оставались отрицательными туберкулиновые пробы, а из внутренних органов не удавалось высеять возбудителя.
Аналогичные данные получили Ж. К. Кантарбаева и соавт. (1963) при изучении первично устойчивых к фтивазиду микобактерий, выделенных из мокроты больных фиброзно-кавернозным, инфильтративным и дис-семинированным туберкулезом легких. У 80% привитых этими микробами морских свинок развились ограниченные специфические изменения во внутренних органах, а у остальных образовался генерализованный туберкулез.
Вместе с тем наблюдения показали, что формы туберкулеза легких у больных, выделяющих первично устойчивые микобактерий, не отличаются от таковых у лиц, в мокроте которых были обнаружены лекарственночувствительные микробы (Canetti е. а., 1967).
На материале нашей клиники и диспансера № 13 мы в свою очередь смогли убедиться, что характер и частота различных форм туберкулеза легких среди 54 детей и взрослых, в мокроте которых были обнаружены микобактерий, первично устойчивые к основным туберкулостатическим препаратам, были такими же, как и среди больных, выделявших с мокротой чувствительные штаммы микобактерий.
В то же время хорошо известно, что течение различных форм туберкулеза при наличии лекарственнорезистентных микобактерий нередко оказывается неблагоприятным из-за недостаточной эффективности в этих случаях химиотерапии. Следует, наконец, указать, что некоторые данные о меньшей инфицированности и заболеваемости лиц, состоящих в контакте с больными, выделяющими микобактерий, устойчивые к изониазиду, не подтверждаются большинством авторов и, в частности, наблюдениями Н. Ю. Маргулис, Т. И. Виноградовой и др. (1971), Н. М. Рудого (1969, 1975).
Клиническое значение лекарственной зависимости микробов недостаточно выяснено вследствие ограниченности наблюдений. Кроме того, лекарственная зависимость — нестойкий признак, так как быстро теряется при пересевах таких штаммов. Тем не менее, по некоторым данным, применение препаратов, к которым развилась лекарственная зависимость, неблагоприятно отражается на течении болезни и состоянии организма больного. Таким образом, следует признать, что как лекарственная устойчивость, так и лекарственная зависимость микобактерий отрицательно отражаются на течении туберкулеза.
Известную роль в клинических проявлениях туберкулеза играет заражение микобактериями различного типа. Как известно, патогенными для человека являются главным образом микобактерий млекопитающих, т. е. человеческий, бычий и в меньшей степени птичий типы. Наибольшее этиологическое значение из них имеет первый тип возбудителя. По сводным данным Gervois (1966), на протяжении 1954—1966 гг. в различных странах он был обнаружен в среднем у 96,6% взрослых и детей, больных туберкулезом органов дыхания, и у 85% — при других локализациях процесса. По обобщенным материалам отечественных авторов за 1934— 1968 гг., микобактерий бычьего типа были выделены у 6,4% больных туберкулезом легких и у 14,8% — при кожном и костно-суставном процессах. При всех формах заболевания этот вид возбудителя у детей и подростков встречается чаще, чем у взрослых.
Таким образом, при заражении микобактериями бычьего типа чаще, чем при инфицировании человеческим типом возбудителя, развиваются различные внелегочные формы процесса: волчанка, периферический лимфаденит, костно-суставной и мочеполовой туберкулез, менингит. Тем самым структура клинических форм туберкулеза в какой-то мере зависит от эпидемической ситуации, т. е. от степени распространенности туберкулеза среди рогатого скота и других видов домашних животных и от условий контакта с ними человека.
Вот почему раньше, когда инфицированность домашних животных была высокой, у больных туберкулезом, особенно у детей, в мокроте и другом материале сравнительно часто обнаруживали микобактерии бычьего типа. С тех пор как во многих странах, особенно за последние 15— 20 лет, инфицированный и больной туберкулезом рогатый скот был забит, этот тип возбудителя стали реже находить у больных людей, в особенности у детей и подростков. Об этом свидетельствуют, например, данные, накопленные в ФРГ, где на протяжении 1952—1962 гг. был забит рогатый скот, больной туберкулезом, и осталось лишь 0,3% инфицированных животных. В результате этого мероприятия, указывает Meissner (1974), резко уменьшилась частота обнаружения микобактерии бычьего типа у больных туберкулезом легких, внутригрудных и наружных лимфатических узлов, а у детей, кроме того, — кожи, костей и суставов.
Однако и теперь, даже в тех странах и районах, где проводится энергичная борьба против туберкулеза у рогатого скота, встречаются больные, которые выделяют микобактерии бычьего типа. Такое явление наблюдается чаще среди сельских жителей. Так, в Саксонии этот тип возбудителя был обнаружен в среднем у 5,2% всех бацилловыделителей. Но среди проживавших в сельских местностях его находили у 17,2%, между тем как среди больных в небольших городах — у 1,4%, а в крупных городских центрах — всего у 0,2%. Надо полагать, что выделение больными в этих случаях микобактерии бычьего типа было обусловлено обострением туберкулезного процесса, который возник в свое время в результате заражения от больных животных.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Диагностика туберкулеза. Принципы микробиологической диагностики туберкулеза. Выделение возбудителя туберкулеза.
Для диагностики туберкулёза применяют бактериоскопические, бактериологические, биологические, серологические и аллергологические методы, входящие в обязательный диагностический минимум. Материалом для исследований служат мокрота, отделяемое свищей, моча, СМЖ, испражнения.
Микроскопия возбудителя туберкулеза в патологическом материале. В мазках, окрашенных по Цилю-Нильсену, обнаруживают кислотоустойчивые палочки возбудителя туберкулеза.
Нередко материал содержит мало бактерий туберкулеза и для повышения вероятности их обнаружения используют методы обогащения: центрифугирование и флотацию. В первом случае исследуемый материал обрабатывают смесью растворов NaCl и NaOH, центрифугируют и микроскопируют осадок. Второй метод включает обработку материала смесью NaOH, дистиллированной воды и ксилола (или бензола). Образец энергично встряхивают; образующаяся пена всплывает и захватывает микобактерии. Пену отсасывают и готовят мазки.
Наиболее результативна люминесцентная микросколия возбудителя туберкулеза. Материал обрабатывают аурамин-родамином и бактерии окрашиваются в бело-жёлтый цвет. Для выявления L-форм применяют AT, меченные флюорохромами.
Выделение возбудителя туберкулеза
Достоинство метода — возможность получения чистой культуры туберкулеза, позволяющая её идентифицировать, оценить вирулентные свойства и определить чувствительность к ЛС. Материал засевают, тщательно втирая, на твёрдые питательные среды.
Для повышения эффективности выделения возбудителя туберкулеза и уничтожения контаминирующей микрофлоры применяют методы обогащения или обрабатывают материал 6-12% серной кислотой. Основной недостаток бактериологического метода — длительность получения результата (от 2 до 12 нед). В связи с этим разработаны ускоренные микрометоды выделения возбудителя туберкулеза.
Один из распространённых методов выделения возбудителя туберкулеза, метод Прайса, заключается в следующем. Материал помещают на предметное стекло, обрабатывают серной кислотой, отмывают физиологическим раствором и вносят в питательную среду, дополненную цитратной лизированной кровью.
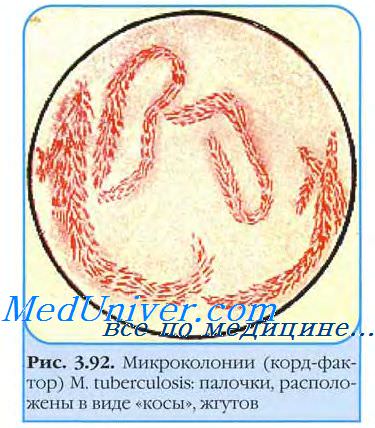
Стекло вынимают через 3-4 сут и окрашивают но Цилю-Нильсену. При микроскопии обнаруживают микроколонии микобактерии возбудителя туберкулеза. Вирулентные бактерии образуют змеевидные (рис. 22-2), а невирулентные — аморфные микроколонии. Культуры L-форм выделяют посевом в столбик полужидкой среды и инкубируют при 37 °С 1-2 мес.
Рост проявляется в виде облачка помутнения с мелкими вкраплениями. Вирулентность выделенной культуры возбудителя туберкулеза определяют заражением лабораторных животных и по наличию корд-фактора. Последний легко идентифицируют по способности микобактерии связывать нейтральный красный и нильский голубой и удерживать их после добавления щелочи. Вирулентные штаммы возбудителя туберкулеза удерживают красители, авирулентные — нет.
Морфология туберкулёза человека. Палочка Коха. Тинкториальные свойства туберкулеза. Культуральные свойства возбудителя туберкулеза.
М. tuberculosis (палочка Коха) — тонкая, прямая или слегка изогнутая палочка, размером 1-10*0,2-0,6 мкм, со слегка закруглёнными концами (рис. 22-1). В молодых культурах палочки более длинные, а в старых склонны к ветвлению.
Бактерии туберкулёза способны образовывать L-формы, сохраняющие способность к инфицированию, а также фильтрующиеся формы, патогенетическая роль которых остаётся плохо изученной. Капсул не имеют, но образуют микрокапсулу.
Методом Циля-Нильсена окрашиваются в ярко-красный цвет. Содержат кислотонеустойчивые гранулы (зёрна Муха), располагающиеся в цитоплазме.
Культуральные свойства возбудителя туберкулеза
Туберкулёзные палочки могут расти как в аэробных, так и факультативно анаэробных условиях. Повышенное содержание СО2 (5-10%) способствует более быстрому росту. Оптимальная температура 37-38 °С; рН 7,0-7,2. Нуждаются в присутствии белков, глицерина, факторов роста (биотин, никотиновая кислота, рибофлавин и др.), ионов (Mg2+ K+, Na+ Fe2+) и др.
Для выращивания бактерий туберкулеза наиболее часто применяются глицериновые, картофельные с жёлчью, яичные, полусинтетические и синтетические среды. Наиболее оптимальна среда Лёвенштайна-Йёнсена.
На средах туберкулёзные палочки обычно образуют R-колонии; под влиянием антибактериальных препаратов бактерии могут диссоциировать с образованием мягких и влажных S-колоний.
В жидких средах палочки туберкулеза образуют сухую морщинистую пленку (на 7-10-е сутки), поднимающуюся на края пробирки; среда остаётся прозрачной. В жидких средах выявляют корд-фактор — важный дифференциальный признак вирулентности. Наличие корд-фактора обусловливает сближение бактериальных клеток в микроколониях и их рост в виде серпантинообразных кос.
На плотных средах рост палочек туберкулеза отмечают на 14-40-е сутки в виде сухого морщинистого налёта желто-, вато-кремового цвета. Зрелые колонии напоминают цветную капусту, крошковатые, плохо смачиваются водой и имеют приятный запах. Культуры плохо снимаются со среды, а при прокаливании трещат. Отличительная особенность М. tuberculosis— способность к синтезу значительного количества никотиновой кислоты (ниацина); ниациновый тест — важный метод дифференцировки микобактерий.
Цель исследования: выделение возбудителя для постановки диагноза. Выявление бактерионосителей дифтерии по эпидемиологическим показателям. Выявление экзотоксина у выделенной культуры.
Материал для исследования:
1. Отделяемое слизистой оболочки зева
2. Отделяемое слизистой оболочки носа
3. Отделяемое слизистой оболочки глаза
5. Отделяемое слизистой оболочки влагалища
6. Отделяемое раны
Материал для исследования зависит от локализации процесса
Способы сбора материала:
1. Слизь из зева – собирают тампоном на границе пораженного участка и здоровой слизистой оболочки
2. Слизь из носа – слизь обеих ноздрей можно брать одним тампоном
3. Слизь из глаза – собирают тампоном
4. Гной из уха собирают тампоном, смоченным в изотоническом растворе натрия хлорида
5. Отделяемое слизистой оболочки влагалища – собирают тампоном
6. Отделяемое раны – то же
При любой локализации процесса обязательно исследуют слизистую зева и носа. Материал собирают ватным тампоном, для чего используют металлическую проволоку, желательно алюминиевую, на один конец которой плотно накручивают вату, затем тампон монтируют в корковую пробку, помещают в пробирку и стерилизуют в печи астера при температуре 160 о С 1 тампон в течение часа или в автоклаве при температуре 112 о С.
Основные методы исследования:
Представители семейства микобактерий имеют вид тонких, иногда ветвистых палочек, чем напоминают гриб. Медленный рост на питательных средах также сближает их с грибами. Эти особенности объясняют название семейства, рода – Mycobacterium.
Микобактерии кислотно-щелоче- и спиртоустойчивы, что обусловливается наличием в оболочках их клеток жировосковых веществ.
Род микобактерий включает патогенных и непатогенных представителей. Патогенными для человека являются возбудители туберкулеза и возбудитель лепры.
Туберкулез широко распространен среди животных, птиц, грызунов.
Существуют несколько видов туберкулезных палочек:
5. Встречаются микобактерии, вызывающие заболевания у холоднокровных. К ним относится особая группа атипичных микобактерий.
В настоящее время атипичные микобактерии приобретают особое значение. Их делят по ряду признаков на 4 группы: I, II, III, IV (по Раньону). Они отличаются от микобактерий туберкулеза меньшей требовательностью к питательным средам. между собой они различаются по отношению к питательным средам, скорости роста, по способности образовывать пигмент, а также по каталазной и пероксидазной активности. Вызывают заболевания у человека представтели групп I и III.
Морфология. Возбудители туберкулеза были открыты Р. Кохом в 1882г. это тонкие палочки величиной 1,5-4х0,3- 0,5 мкм. Они очень полиморфны: встречаются прямые, изогнутые, колбовидные. Как результат изменчивости бактерий, имеются кослотоподатливые формы и очень мелкие, так называемые зерна Муха. Разнообразие форм нередко зависит от состава среды, воздействия на них антибиотиков и химиотерапевтических средств. Бактерии туберкулеза неподвижны, не имеют спор и капсул. Грамположительны, однако они плохо воспринимают анилиновые краски. Хорошо окрашиваются в красный цвет по методу Циля-Нильсена, где используются концентрированные краски и протравливание.

Микобактерии туберкулеза встречаются в R- и S-форме. Более вирулентной является R-форма. На плотных питательных средах возбудители туберкулеза образуют сухие морщинистые колонии кремового цвета с чуть приподнятым центром и изрезанными краями. В жидких питательных средах микобактерии туберкулеза вырастают на 10-15 день в виде пленки, которая постепенно утолщаяется, становится грубой, морщинистой, ломкой и в силу тяжести иногда падает на дно. Бульон под пленкой остается прозрачным.
Ферментативные свойства. Возбудители туберкулеза биохимически мало активны. У них обнаружен протеолитический фермент, который в определенных условиях расщепляет белок. Они расщепляют также некоторые углеводы, образуют уреазу. Но свойства эти непостоянны. Поэтому изучение ферментов не имеет диагностического значения.
Туберкулин обладает свойствами аллергена. Он не оказывает токсического действия на здоровый организм. Его действие проявляется только в зараженном организме.поэтому введение туберкулина используют с диагностической целью, в постановках аллергических проб (Пирке или Манту. Проба Манту - в/к вводят 0,5 Мл очищенного туберкулина. Учет через 72 часа. Положительная реакция – покраснение и припухлость 5-10 мм (имеется иммунитет)). Для этой цели туберкулин готовят из бычьего типа микобактерий туберкулеза.
Вирулентные штаммы возбудителей туберкулеза содержат особый липид корд-фактор, который способствует склеиванию микобактерий и росту их в виде кос и тяжей.
Антигенная структура. Микобактерии туберкулеза содержат антиген, в который входят белковые, липоидные и полисахаридные факторы. Этот антиген вызывает в организме выработку антител. Однако эти антитела обнаруживаются в малых концентрациях, поэтому практически с целью диагностики мало используется.
Устойчивость к факторам окружающей среды. Микобактреии туберкулеза самые устойчивые из неспороносных форм бактерий. Температуру 100 о С они переносят в течение 5 мин. УФ-лучи вызывают их гибель только через несколько часов.
В высохшей мокроте они живут до 10 мес. При низких температурах микобактерии туберкулеза длительно сохраняются.
Дезинфицирующие растворы губят их только через сутки. Наиболее чувствительны к хлорамину и хлорной извести.
Восприимчивость животных. К микобактериям туберкулеза человек очень чувствителен, животные и птица малочувствительны. Их экспериментальных животных к нему высокочувствительны морские свинки, у которых инфекция протекает генерализовано и заканчивается обычно гибелью животного.
К M.bovis чувствительны крупный и мелкий домашний скот и домашние животные (человек мало чувствителен, но дети могут заражаться при использовании молока больных животных).
Их экспериментальных животных наиболее чувствительны кролики, у которых инфекция протекает генерализовано. M.avium вызывает заболевание у птиц: кур, голубей, фазанов и т.д. Однако могут болеть и некоторые животные.
Их экспериментальных животных чувствительны кролики. Инфекция протекает у них остро.
Мышиный вид патогенен главным образом для полевок. У кроликов и морских свинок заболевание протекает в хронической форме.
Источники инфекции. Человек. Реже животные.
Пути передачи. Наиболее частые пути передачи – воздушно-капельный и воздушно-пылевой; реже пищевой. Возможно внутриутробное инфицирование через плаценту.
Заболевания у человека и патогенез. Заболевание туберкулезом характеризуется многообразием клинических форм. Различают легочную (наиболее часто встречающуюся) и внелегочные формы: туберкулез желудка и кишечника, почек, мозговых оболочек, костей и других органов.
При закрытом процессе палочки туберкулеза не выделяются с мокротой, мочой и др.
Таким образом, даже при доброкачественном течении процесса организм не освобождается от возбудителей туберкулеза. Считают, что 80% людей инфицированы туберкулезными бактериями. Однако клинически они здоровы. Когда организм попадает в неблагоприятные условия, защитные функции его снижаются, бугорок подвергается некрозу, бактерии высвобождаются и вовлекают в процесс новые участки, наступает обострение, образуются каверны – открытый процесс. Иногда может быть генерализация процесса, которая приводит организм к гибели. Чаще туберкулез протекает в хронической форме (закрытый процесс). Большое значение при обострении имеют условия труда и быта.
Иммунитет. Человек обладает определенной резистентностью, т.е. при заражении не всегда возникает заболевание, а образуется инфекционный (нестерильный) иммунитет, который обусловливается комплексом защитных факторов: гуморальных, клеточных, а также резистентностью органов и тканей.
Профилактика. Ранняя диагностика, изоляция и т.д.
Для специфической профилактики используется живая вакцина БЦЖ, полученная французскими учеными Кальметтом и Гереном. Эту вакцину вводят новорожденным однократно, внутрикожно в наружную поверхность плеча. Ревакцинацию проводят в 7, 11 лет.
Лечение. Антибактериальные препараты: стрептомицин, рифампицин, ПАСК, фтивазин и др.

Обзор
Автор
Редакторы

Спонсором приза зрительских симпатий выступил медико-генетический центр Genotek.
Тем не менее диагностика — это еще не диагноз, и результат любого теста не является истиной в последней инстанции. Диагноз же по-прежнему ставят, исходя из нескольких составляющих:
- клинической картины;
- наличия контакта с туберкулезным больным;
- рентгенографии легких, флюорографии или компьютерной томографии;
- результатов диагностических тестов.
Однако большинство этих методов диагностируют туберкулез постфактум — только скрининговые тесты помогают выделить лиц с высоким риском развития заболевания или с только зарождающимся процессом. И уже более 100 лет основным методом массовой диагностики туберкулеза является туберкулиновая проба Манту 2 ТЕ (содержащая 2 туберкулиновые единицы). Тест спорный, со множеством ложноположительных результатов, но именно его используют во всем мире и отказываться пока не собираются.
Проба Манту
В мире используют 3 вида туберкулина (рис. 1): датский препарат PPD (purified protein derivative) RT 23, американский PPD-S и российский — PPD-L. Различаются они видами микобактерий, из которых были получены: при производстве датского и американского препаратов используют только M. tuberculosis, а при производстве российского — смесь из M. tuberculosis и M. bovis (микобактерии, вызывающей туберкулез у крупного рогатого скота; на основе этого штамма была разработана вакцина БЦЖ). Различие в составах туберкулина обусловливает разные границы положительного результата: 15 мм для детей, привитых БЦЖ, и не более 10 мм для непривитых детей до 5 лет у датского препарата, не более 10 мм у американского и 5 мм у российского [4].

Рисунок 1. Препараты туберкулина
Диагностику с помощью пробы Манту проводят следующим образом: небольшое количество туберкулина вводят под кожу чуть выше запястья и через 72 часа оценивают реакцию, которую считают положительной, если в месте введения появляется припухлость (папула) более 5 мм в диаметре. В зависимости от ее размера, различают степень реакции от отрицательной (0–1 мм) до резковыраженной, или гиперергической (17 мм и более у детей и подростков, 21 мм и более у взрослых) [5]. И тут начинаются трудности, потому что у привитых БЦЖ реакция Манту положительна [6]! Мало того, чем больше поствакцинальный рубец, тем выше чувствительность к туберкулину [7]. Поэтому у привитых БЦЖ оценивают не только диаметр папулы, но и размер поствакцинального рубчика (табл. 1).
| Срок, прошедший с момента вакцинации БЦЖ | Размер рубчика после БЦЖ | Привитый иммунитет (мм) | Неясная причина | Подозрение на инфицирование |
|---|---|---|---|---|
| 1 год | 6–10 мм | 5–15 мм | 16 мм | Более 17 мм |
| 2–5 мм | 5–11 мм | 12–15 мм | Более 16 мм | |
| 0 мм | 2–4 мм | 5–11 мм | Более 12 мм | |
| 2 года | Вне зависимости от размера | Уменьшение размера папулы или прежний ее размер | Увеличение размера на 2–5 мм от предыдущего положительного результата | Реакция изменяется на положительную или папула увеличивается более чем на 5 мм |
| 3–5 лет | Вне зависимости от размера | 5–8 мм либо уменьшение размера папулы | Увеличение размера на 2–5 мм за последний год или отсутствие тенденции к уменьшению | Изменение на положительную (5 мм) реакцию или увеличение папулы на 6 мм; 12 мм при впервые поставленной пробе; изменение предыдущего размера на 2–4 мм или размер в 12 мм |
| 6–7 лет | Вне зависимости от размера | 0–4 мм | 5 мм | 6 мм и более |
| 7–9 лет | Если в 7 лет ребенку была сделана ревакцинация БЦЖ, реакция Манту вновь становится положительной и нормы повторяются | 0–4 мм | 5 мм | 6 мм и более |
| Взрослые | Отрицательная реакция, покраснение любого диаметра; папула до 4 мм | Более 5 мм |
Безусловно, метод оценки результата довольно субъективный. Но главное, папулу надо еще правильно измерить, зафиксировав только размер выпуклой части и игнорируя покраснение вокруг нее (рис. 2).

Рисунок 2. Правильная и неправильная оценки диаметра папулы
Еще одна трудность с диагностическими возможностями пробы Манту связана с тем, что они зависят от нижней границы положительного результата: чем ниже граница, тем больше будет наблюдаться ложноположительных реакций. К примеру, в России пороговым значением является папула в 5 мм. Это приводит к гипердиагностике — большому количеству зафиксированных реакций, но в итоге к низкому проценту реально выявленных случаев инфицирования [4].
В общем, не удивительно, что в последнее время информативность туберкулиновой пробы постоянно ставится под сомнение. Мало того, она может вызывать не связанные с туберкулезом аллергические реакции, поэтому все больше здоровых, но склонных к аллергии детей вынуждены идти в тубдиспансер в надежде выяснить причину положительной реакции. И наконец, на результат пробы может влиять множество факторов: недавно перенесенные инфекции, хронические заболевания, прием медикаментов, изменение гормонального фона или иммунитет к нетуберкулезным микобактериям [7].
Если говорить о достоинствах пробы Манту, то кроме низкой себестоимости, ими будут возможность выявления туберкулеза на ранних стадиях развития (за исключением лиц с иммуносупрессией и маленьких детей до двух лет [7]) и более высокая диагностическая ценность у непривитых БЦЖ по сравнению с привитыми (от 50% и ниже против 65,4% [6], [9]).
Мифы о пробе Манту

Рисунок 3. Антигены ESAT-6 и CFP-10
Что нужно знать о кожных пробах?
Анализы крови на туберкулез: плюсы и минусы
- в ранние сроки инфицирования;
- при иммунодефицитных состояниях;
- при неправильном заборе крови или ее транспортировке;
- из-за ошибок во время расшифровки результатов.
Добавлю, что тесты IGRA требуют наличия качественного оборудования, специальных реактивов и квалифицированного персонала, поэтому себестоимость у них довольно высока.
Кроме того, по сравнению с кожными тестами существенным недостатком этих анализов является определение in vitro только образования гамма-интерферона или активности Т-клеток. Поэтому в странах с высокой заболеваемостью (а Россия, несомненно, в их числе с показателем более 50 больных на 100 000 населения [13]) у IGRA-анализов нет никаких дополнительных преимуществ [12]. Тем более что их способность диагностировать туберкулезный процесс колеблется в районе 42–90% для разных возрастных групп, к тому же они не маркируют латентное носительство [12]. Другими словами, для жителей нашей страны анализы крови на туберкулез в общем-то напрасная трата денег, хотя в странах с низкой заболеваемостью (США, Канада, Западная Европа) они более информативны и рекомендованы к замене туберкулиновых проб для привитых БЦЖ [14].
В мире живет более полумиллиарда латентных носителей M. tuberculosis. Причем, далеко не каждый из них в итоге заболевает, потому что размножение микобактерии сдерживает иммунная система. Например, из 100 инфицированных палочкой Коха детей, лишь у одного развивается активная форма туберкулеза, поэтому диагностические тесты направлены не только на выявление латентных носителей, но и на оценку риска развития заболевания [15].
Анализы крови vs кожные тесты: сравнение эффективности
При оценке эффективности тестов для диагностики туберкулеза чаще всего учитывают два параметра: чувствительность (sensitivity) и специфичность (specificity). Под чувствительностью понимают способность метода выявлять лиц с заболеванием или носителей с высоким риском развития туберкулеза. Под специфичностью — способность теста правильно идентифицировать людей, у которых нет туберкулеза (то есть этот параметр характеризует риск появления ошибочных ложноположительных результатов) [12].
Какой тест все-таки выбрать?
Как говорится, при всем богатстве выбора альтернатив немного. К сожалению, при выборе теста многие руководствуются не его диагностическими характеристиками, а безвредностью для здоровья, потому что фенол в составе кожных проб пугает многих. И существует даже движение против пробы Манту, группа поддержки которого периодически предлагает заменить ее анализами крови IGRA. Но, как было отмечено выше, у подобных страхов нет никаких оснований. В придачу, являясь продуктом жизнедеятельности организма, фенол не накапливается, а выводится вместе с мочой. Поэтому главными критериями все-таки являются чувствительность и специфичность тестов.
Читайте также:

