Учебный модуль по лаб диагностике дифтерии
Обновлено: 25.04.2024
Выявление дифтерийной палочки. Принципы микробиологической диагностики дифтерии. Диагностика дифтерии. Культивирование дифтерии. Определение токсигенности дифтерийной палочки.
С целью раннего выявления дифтерии и определения носителей дифтерийной палочки необходимы выделение и идентификация возбудителя, а также определение его способности к токсинообразованию. Материалом для исследования служат дифтеритические плёнки, слизь из носоглотки или отделяемое из подозрительных поражений кожных покровов.
Забор материала на дифтерию проводят двумя стерильными тампонами: один используют для посева, с другого делают мазки и окрашивают их по Граму и Найссеру. Взятый материал следует доставлять в лабораторию не позднее чем через 3 ч.
Бактериоскопия дифтерийной палочки
Окраска по Граму не является специфичной, так как дифтерийные палочки сравнительно плохо воспринимают красители, но позволяет косвенно идентифицировать непатогенные коринебактерии, располагающиеся в виде палисада (параллельно) или в виде китайских иероглифов. Окраска по Найссеру позволяет выявить характерные зёрна Бабеша-Эрнста и отличить дифтерийную палочку от ложнодифтерийной палочки С. pseudodiphtheriticum (С. hofmannii), часто обитающей в носоглотке.

Культивирование дифтерийной палочки
Бактерии дифтерии выделяют посевом на элективные среды с теллуритом (например, Клауберга II или Маклёода), ложнодифтерийная палочка (палочка Хофманна) теллур не восстанавливает (см. рис. 8 на вклейке). Для выделения чистой культуры дифтерии часть подозрительной колонии засевают на скошенный агар (или среду Ру), вторую часть — на твёрдую питательную среду для определения токсигенности и (не обжигая петли) проводят определение цистиназной активности (проба Пизу). При положительном результате наблюдают образование коричневого облачка вокруг линии укола. Чистую культуру идентифицируют на средах Хйсса, пользуясь укороченным пёстрым рядом (глюкоза, мальтоза, сахароза, мочевина), что позволяет отличить С. diphtheriae от непатоген пых коринебактерии (рис. 14-3).
Определение токсигенности дифтерийной палочки
Определение токсигенности дифтерийной палочки in vivo. Проводят подкожным или внутрикожным заражением 0,5-1,0 мл бактериальной культуры морских свинок массой 250 г. За 24 ч до заражения одно животное иммунизируют дифтерийным антитоксином. При положительном результате неиммунизированные животные погибают в течение 3-5 сут.
Фаготипирование дифтерийной палочки
Для дифференциальной диагностики возбудителей используют набор из 9 кори нефагов. С его помощью можно типировать большинство токсигенных и нетоксигенных штаммов биовара gravis.
Рабочие листы и материалы для учителей и воспитателей
Более 300 дидактических материалов для школьного и домашнего обучения
- Онлайн
формат - Диплом
гособразца - Помощь в трудоустройстве
Государственное автономное образовательное учреждение
среднего профессионального образования Республики Крым
Цикловая методическая комиссия лабораторных дисциплин
МЕТОДИЧЕСКАЯ РАЗРАБОТКА
открытого практического занятия № 38
по теме: Проведение микробиологической диагностики дифтерии
МДК.04.01 Теория и практика лабораторных микробиологических и иммунологических исследований
Специальность: 31.02.03 Лабораторная диагностика
Вид занятия: практическое
Количество часов: 4
г. Евпатория, 2017г .
Автор: Гончарова А.И. – преподаватель колледжа, I квалификационная категория
Рассмотрено и одобрено
на заседании ЦМК
Государственное автономное образовательное учреждение
среднего профессионального образования Республики Крым
План занятия (практическое) № 38
Тема занятия: Проведение микробиологической диагностики дифтерии
МДК.04.01. Теория и практика лабораторных микробиологических и иммунологических исследований
Специальность: 31.02.03. Лабораторная диагностика
МДК : Теория и практика лабораторных микробиологических и иммунологических исследований
Методическая цель занятия:
Демонстрация инновационных педагогических технологий с целью реализации индивидуального дифференцированного подхода в процессе выполнения студентами практических методик исследования.
Образовательные:
Рассмотреть морфологические, культуральные, биохимические и серологические свойства коринебактерий
Изучить микробиологическую диагностику дифтерии
Рассмотреть определение токсигенности культуры коринебактерий
Развивающие:
Развивать навыки самообразования, творческие способности студентов
Продолжить развитие учебно-интеллектуальных умений выделять главное и существенное
устанавливать причинно-следственные связи
Воспитательные:
воспитывать уважение к людям, науки, их достижениям
продолжить формирования умения работать в коллективе, принимать совместные решения
продолжить формирования здорового образа жизни
Междисциплинарные связи:
Физико-химические методы исследования и техника лабораторных работ
Анатомия и физиология человека
Проведение лабораторных санитарно-гигиенических исследований
Проведение лабораторных биохимических исследований
Основы латинского языка с медицинской терминологией
Внутридисциплинарные связи:
Проведение микробиологического исследования
Место проведения: кабинет 407
Тип занятия: практическое
Количество часов: 4 академических
Обеспечение занятия: методическая разработка.
Интернет- ресурсы:
Студент должен уметь:
- принимать, регистрировать, отбирать клинический материал, пробы объектов внешней среды и пищевых продуктов;
- готовить исследуемый материал, питательные среды, реактивы и оборудование для проведения микроскопических, микробиологических и серологических исследований;
- проводить микробиологические исследования клинического материала, проб объектов внешней среды и пищевых продуктов;
- оценивать результат проведенных исследований;
- вести учетно-отчетную документацию;
- проводить утилизацию отработанного материала, дезинфекцию и стерилизацию, используемой в лаборатории посуды, инструментария, средств защиты рабочего места и аппаратуры;
Студент должен знать:
- задачи, структуру, оборудование, правила работы и техники безопасности в микробиологической лаборатории .
– общие характеристики микроорганизмов, имеющие значение для лабораторной диагностики
- требования к организации работы с микроорганизмами III – IV групп патогенности
- механизм иммунологических реакций
Студент должен обладать:
Общие компетенции
ОК 2. Организовывать собственную деятельность, выбирать типовые методы и способы выполнения профессиональных задач, оценивать их эффективность и качество.
ОК 3. Принимать решения в стандартных и нестандартных ситуациях и нести за них ответственность.
ОК 4. Осуществлять поиск и использование информации, необходимой для эффективного выполнения возложенных на него профессиональных задач, а также для своего профессионального и личностного развития.
ОК 5. Использовать информационно-коммуникационные технологии в профессиональной деятельности.
ОК 6. Работать в коллективе и команде, эффективно общаться с коллегами, руководством, пациентами.
ОК 9. Ориентироваться в условиях смены технологий в профессиональной деятельности.
ОК 12. Оказывать первую медицинскую помощь при неотложных состояниях.
ОК 13. Организовывать рабочее место с соблюдением требований охраны труда, производственной санитарии, инфекционной и противопожарной безопасности.
Профессиональные компетенции
ПК 4.1. Готовить рабочее место и аппаратуру для проведения лабораторных микробиологических исследований.
ПК 4.2. Проводить лабораторные микробиологические и иммунологические исследования биологических материалов, проб объектов внешней среды и пищевых продуктов; участвовать в контроле качества.
ПК 4.3. Регистрировать результаты проведенных исследований
ПК 4.4. Проводить утилизацию отработанного материала, дезинфекцию и стерилизацию использованной лабораторной посуды, инструментария, средств защиты.
Структура занятия:
Организационный момент 2 мин.
Мотивация (цели) занятия 3 мин.
Оценка знаний студентов (проверка исходного уровня знаний) 30 мин.
Практическая часть 120 мин.
Итоговый контроль 15 мин.
Задание на дом 2 мин.
Подведение итогов занятия, оценка работы студентов 8 мин.
Ход занятия
Организационный момент
Мотивация (цели) занятия :
Изучение микробиологической диагностики дифтерии является обязательным разделом профессионального модуля в связи с распространенностью данной инфекции.
Мотивация: ОК.2-ОК.9; ПК.4.1-4.4;
3.Оценка знаний студентов (проверка исходного уровня знаний) :
а) проверка знаний :
Тестовый контроль (приложение №1)
б) проверка внеаудиторной самостоятельной работы
задание на сайте eliademy
в) подведение итогов контроля:
Оценивание, замечания по работе.
4. Практическая часть:
а) подготовка студентов к самостоятельной работе ( проведение инструктажа по выполнению заданий):
б) самостоятельная работа студентов:
Взять мазок со слизистой оболочки носа и смыв с кожи
Приготовить среду для коринебактерий, провести посев
Приготовить мазки, окрасить по Граму и Нейсеру
Сделать выводы
в) подведение итогов самостоятельной работы
Оформление в рабочей тетради выводов о проделанной работе
Итоговый контроль
Решение ситуационных задач (см.приложение №2)
Проверка преподавателем работ студентов
Задание на дом
Подведение итогов занятия, оценка работы студентов
Преподаватель оценивает работу студентов, корректирует ошибки, отвечает на вопросы студентов
Преподаватель Гончарова А.И.
Цель : Выявление грам-положительных и грам-отрицательных микроорганизмов
Оснащение: Набор красителей для окраски, подговленные препараты
4. Промыть водой
Для удаления спирта
5. Нанести на препарат фуксин Пфейффера на 1-2 мин.
Грам- бактерии не содержат магниевую соль РНК и не способны удержать краситель (генциановый фиолетовый). Под воздействием спирта они обесцвечиваются и окрашиваются в красный цвет фуксином Пфейффера
Реакция двойной встречной иммунодиффузии по Оухтерлони (реакция преципитации в геле)
Принцип метода: В агаровом геле формируют лунки, в которые вносят антигены А и Б и сыворотку, содержащую соответствующие антитела (Ат).
Антитела и антигены диффундируют в агар и образуют линии преципитации .
Учет результатов:
Возможны три варианта реакции:
а – если антигены идентичны, образуются идентичные линии преципитации;
б – если антигены частично идентичны, образуется одна оторванная от общей линия преципитации (это связано с тем, что одно антитело не реагирует с антигеном и продвигается дальше);
в – если антигены не идентичны, линии преципитации перекрещиваются.
Препараты для специфической профилактики и
терапии дифтерии, коклюша
коклюшно-дифтерийно- столбнячная вакцина (АКДС)
коклюшных палочек, дифтерийного и
Применяется с целью
коклюша, дифтерии и
столбняка у детей.
дифтерийно- столбнячный анатоксин (АДС)
Смесь дифтерийного и столбнячного
Для создания активного антитоксического иммунитета против дифтерии и столбняка детей, переболевших коклюшем.
дифтерийно- столбнячный анатоксин с уменьшенным содержанием антигенов (АДС- М)
Смесь дифтерийного и столбнячного
ревакцинации детей и взрослых против дифтерии и столбняка
Анатоксин дифтерийный (АД)
С целью создания активного антитоксического иммунитета у
детей и взрослых
экзотоксина дифтерийных палочек
Для лечения экстренной профилактики

1) Как проверить наличие иммунитета к дифтерии у контактных школьников?
2) Как установить источник инфекции?
3) Какие препараты применяют для специфической профилактики дифтерии?
Ответ к задаче №52:
1) Поставить РПГА с эритроцитарным диагностикумом. Титр антител при наличии иммунитета должен быть не менее 1:20.
2) Выявить бактерионосителей токсигенных штаммов бактериологическим методом с последующим определением эпидмаркеров (серовары, биовары, фаговары, корициновары).
3) Для специфической профилактики применить вакцины АКДС, АДС-М, АД.
Задача №53 . Больной поступил в стационар с предположительным диагнозом дифтерии зева.
1) Какой материал подлежит исследованию?
2) Какие экспресс-методы диагностики необходимо применить для решения вопроса о диагнозе?
3) Какой метод специфической терапии применить при подтверждении диагноза?
Ответ к задаче №53:
1) Слизь из зева, пленки фибрина.
2) Провести РПГА с антительным эритроцитарным антитоксическим диагностикумом или ИФА для обнаружения в фильтрате материала дифтерийного экзотоксина.
3) Для нейтрализации токсина немедленно назначить противодифтерийную антитоксическую сыворотку.
Задача №55 .У больного ребенка в мазке из зева были обнаружены бактерии, напоминающие дифтерийные палочки.
2) Какие необходимо провести дополнительные исследования для проверки диагноза?
3) Какие препараты следует назначить для лечения больного?
Ответ к задаче №55:
1) Нельзя, т.к. микроскопический метод является ориентировочным. Ребенок мог быть носителем нетоксигенного штамма дифтерийной палочки.
2) Необходимо провести бактериологическое исследование. У выделенной чистой культуры обязательно определить наличие токсина. Для этого можно использовать реакцию преципитации в агаре.
3) Для лечения необходимо экстренно назначить антитоксическую противодифтерийную сыворотку с целью нейтрализации токсина.
Краткое описание документа:
Изучение микробиологической диагностики дифтерии является обязательным разделом профессионального модуля в связи с распространенностью данной инфекции.
Указанная структура занятия содержит все элементы образовательного процесса, включая контроль уровня знаний, отработку и закрепление полученных навыков, использование активных методов обучения.
Контроль уровня знаний представлен разноплановыми приёмами: фронтальный опрос по самостоятельной работе, тестовый контроль уровня знаний, отработка практических навыков.
С целью формирования профессиональных и общих компетенций в занятии используется моделирование производственных ситуаций, воспроизведение которых направлено не только на закрепление полученных знаний и навыков, но и позволяет студентам более осмысленно осуществлять реализацию этапов микробиологического исследования в конкретной ситуации, максимально приближенной к реальной.
Применение метода, несомненно, вызывает познавательный интерес и развитие логического и клинического мышления.
В процессе проведения практического занятия преподаватель использует электронные образовательные ресурсы: модули (информационный, практический, контролирующий), презентации на тему занятия, что, безусловно, является положительным моментом.
Оценка работы студентов проводится на всех этапах занятия, что обеспечивает её объективность.
3.1.2. ЭПИДЕМИОЛОГИЯ. ПРОФИЛАКТИКА ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ. ИНФЕКЦИИ ДЫХАТЕЛЬНЫХ ПУТЕЙ
Серологические методы диагностики и мониторинга дифтерийной инфекции
1. Разработаны ФБУН "НИИ эпидемиологии и микробиологии имени Пастера" (Г.Я.Ценева, Л.А.Краева); ФБУЗ "Центр гигиены и эпидемиологии в Вологодской области" (Б.В.Лимин, Е.А.Алексеева); ГБОУ ДПО РМАПО Минздрава России (О.А.Бургасова); Федеральной службой по надзору в сфере защиты прав потребителей и благополучия человека (А.А.Мельникова).
2. Утверждены руководителем Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Главным государственным санитарным врачом Российской Федерации А.Ю.Поповой 3 ноября 2015 г.
3. Введены впервые.
I. Область применения
1.1. В методических рекомендациях (далее - MP) представлена рациональная и эффективная тактика использования серологических методов диагностики и мониторинга иммунитета к дифтерийной инфекции.
1.2. В настоящих MP описаны используемые в последние годы международные и отечественные методы определения противодифтерийных антител, а также предложен наиболее надежный и перспективный метод иммуноферментного анализа (далее - ИФА) для определения суммарных и высокоавидных антител, его стандартное применение, в том числе предложены надежные критерии оценки защитных уровней, необходимые для выявления среди детей и взрослых групп повышенного риска и оценки напряженности индивидуального и коллективного иммунитета к дифтерийной инфекции.
1.3. Настоящие MP предназначены для врачей-эпидемиологов и микробиологов и носят рекомендательный характер.
II. Введение
2.1. Несмотря на высокие показатели привитости населения от дифтерии в разных регионах России периодически регистрируются случаи заболевания дифтерией или носительства Corynebacterium diphtheria, особенно среди лиц в закрытых коллективах [3, 4, 8].
2.2. В настоящее время, спустя 15 лет после прошедшей эпидемии дифтерии, повсеместно отмечается снижение внимания клиницистов к этой инфекции. Профилактические и диагностические обследования проводятся, но не в полном объеме [12].
2.3. Как известно, защищенность от дифтерии в нашей стране определяется с помощью реакции прямой гемагглютинации (РПГА) [13]. Однако результат реакции, выражаемый в титрах, не позволяет точно определить количество антитоксических антител (АТ-АТ), а, значит, и оценить состояние иммунитета против дифтерии. Разработка и повсеместное внедрение в практику оценочной шкалы защищенности от дифтерии на основании определения количества АТ-АТ позволили контролировать качество вакцинации [14]. Однако информация о количестве вырабатываемых противодифтерийных антител не всегда дает достоверный ответ на вопрос о степени защищенности от дифтерии. Это было продемонстрировано во время последней эпидемии дифтерии в России и после нее, когда у заболевших (до 40% случаев) находили в крови АТ-АТ защитных уровней [9, 10]. Проведенными исследованиями установлена определяющая роль высокоавидных АТ-АТ в защите от дифтерии, которые могут быть определены наряду с количеством суммарных АТ-АТ в иммуноферментном анализе [2, 5, 6, 16]. При этом была показана динамика формирования и утраты АТ-АТ, равно как и показателя их авидности, изучены особенности специфического иммунитета к дифтерии среди различных групп населения [1, 7, 11, 15]. Тем не менее, отсутствие программ и схем исследования при диагностике дифтерии и изучении напряженности иммунитета у населения, содержащих новые аргументированные данные, не позволяют полноценно и качественно проводить бактериологический и иммунологический контроль в отношении защищенности к дифтерии на местах.
0,01 МЕ/мл - минимальная степень защиты,
0,01-0,09 МЕ/мл - некоторая степень защиты,
0,1-0,9 МЕ/мл - защитный уровень антител,
1,0 и > МЕ/мл - стойкая длительная невосприимчивость к дифтерии.
III. Общие положения
3.2. Список оборудования и материалов, необходимых для проведения исследования, представлен в прилож.1.
IV. Группы населения, подлежащие обследованию
4.1. Серологический контроль состояния иммунитета у детей и подростков
4.1.1. Серологический контроль иммунитета в различных группах позволяет представить иммунологическую структуру населения и выявить группы повышенного риска, определить состояние вакцинального иммунитета как в ранние, так и в отдаленные сроки после вакцинации.
4.1.2. Серологический контроль состояния и длительности сохранения вакцинального иммунитета необходимо осуществлять систематически методом выборочного серологического обследования (мониторинга) различных групп населения в городах и сельских районах каждой области, края.
4.1.3. Обследованию подлежат привитые против дифтерии дети и подростки от 3 до 18 лет каждой возрастной группы (3 года, 4 года, 5 лет и т.д., особое внимание следует обратить на детей 9-13 лет).
4.1.4. Серологический контроль следует проводить, начиная с групп детей 3 лет не ранее, чем через 6 месяцев после последней прививки. К этому возрасту должен быть закончен первичный вакцинальный комплекс против дифтерии, включающий вакцинацию и первичную ревакцинацию (V и RV).
4.1.5. В случае отсутствия материально-технических возможностей обследования каждой возрастной группы детей и подростков можно отобрать возрастные группы, подлежащие очередной ревакцинации (4- 5 лет, 9-10 лет, 14-15 лет).
4.1.6. При получении неудовлетворительных иммунологических показателей в этих группах контроль за иммунитетом следует провести в каждой возрастной группе.
4.2. Серологический контроль состояния иммунитета у взрослых
4.2.1. Наиболее подвержены заболеванию дифтерией следующие группы "риска": лица старше 50 лет; рабочие промышленных предприятий, особенно занятые на вредном производстве; лица, страдающие туберкулезом, а также гепатитом С, СПИД, наркоманией и алкоголизмом.
4.2.2. Особое внимание должно уделяться лицам в закрытых коллективах.
V. Описание методов определения антител
5.1. Реакция пассивной гемагглютинации (РПГА)
Для определения уровней сывороточных АТ-АТ в крови здоровых людей в нашей стране используют реакцию пассивной гемагглютинации (РПГА), которая рекомендована методическими указаниями МУК 4.2.3065-13 "Лабораторная диагностика дифтерийной инфекции", утвержденными Главным государственным санитарным врачом Российской Федерации 14 июля 2013 г. Эта реакция имеет свои преимущества, состоящие в простоте постановки, быстроте получения результатов и экономичности.
Для постановки реакции используется диагностикум дифтерийный эритроцитарный антигенный. Поскольку срок годности эритроцитарных диагностикумов составляет 1 год, необходимо перед каждым проведением серологического исследования сывороток проверять активность препарата. Проверка проводится с контрольным антитоксином, приложенным к комплекту, либо используется национальный препарат дифтерийного антитоксина, очищенного ферментолизом и специфической сорбцией, диагностический сухой. Допускается исследование контрольной сыворотки (лабораторный образец) с известным титром дифтерийных антител. Если диагностикум выявляет в сыворотке антитела в концентрации на 2-3 разведения ниже, чем они в ней содержатся, то такой препарат не пригоден для дальнейшего исследования.


Дифтерия — это токсикоинфекция, возбудитель которой бактерия (Corynebacterium diphtheriae), продуцирующая токсин, поражающий ткани на месте инфицирования. Токсин вызывает проблемы с дыханием, вызывая воспаления слизистой оболочки носа и горла, поражает сердце, нервную систему и почки.
Заболеваемость
За 2018 г. на территории Российской Федерации было зафиксировано 3 случая заболевания дифтерией легкой формы, а также выявлены 3 случая бактерионосительства.
Возбудитель

Возбудитель дифтерии - коринебактерия дифтерии (Corynebacterium diphtheriae), продуцирующая дифтерийный токсин.
Бактерии способны длительно сохраняться в окружающей среде (в пыли - 5 недель, на одежде и других предметах - до 15 суток, в воде и молоке от 6 до 20 суток, в сухой дифтерийной пелёнке до 7 недель).
Источник инфекции
Заболевший любой формой дифтерии и носитель токсигенных C. diphtheriae.
Пути передачи
Воздушно-капельный (при чихании, кашле, в разговоре), воздушно-пылевой (через загрязнённые коринебактериями поверхности).
Группы риска

Наиболее тяжело дифтерия протекает у детей младшего возраста, а также у взрослых старше 30 лет.
Инкубационный период
С момента заражения до появления первых симптомов обычно проходит от нескольких часов до 7-10 суток, чаще 2-5 суток.
Период заразности
Носители бактерии могут быть источниками инфекции более 1 месяца (носители представляют основную опасность для окружающих).
Клиника
Дифтерия характеризуется следующими симптомами:
- интоксикация (лихорадка, утомляемость, общая слабость),
- боль в горле при глотании,
- отечность миндалин с характерным налетом (поражённая ткань образует серые пленки),
- осиплость голоса, сухой кашель, затруднённое дыхание,
- выделения из носа,
Чем опасно заболевание
При попадании токсина в кровоток, возникают осложнения, опасные для жизни -поражение сердца, почек и нервной системы (риск паралича дыхательной мускулатуры). Летальные исходы чаще наблюдаются среди детей.
Диагностика
Диагноз дифтерии устанавливается на основании клинических данных, эпидемиологического анамнеза и результатов лабораторного исследования.
Лечение
Заболевшие дифтерией или носители подлежат обязательной госпитализации.
Лечение заключается во введении антитоксической противодифтерийной сыворотки, а также антибактериального препарата. В ряде случаев прибегают к использованию глюкокортикоидов.
Профилактика

Основная мера профилактики - вакцинация, проводимая в соответствии с Национальным календарем профилактических прививок.
Схема вакцинации
В состав вакцины входит дифтерийный анатоксин, вводимый вместе со столбнячным анатоксином (АДС, АДС-м) или в виде комплексной вакцины.
Вакцинация проводится по схеме 3 - 4,5 - 6 месяцев. Первая ревакцинация проводится в 18 месяцев, вторая - в 6-7 лет, третья - в 14 лет. И далее каждые 10 лет. Начиная со второй, ревакцинация проводится анатоксинами с уменьшенным содержанием антигенов.
Вакцинация против дифтерии по эпидемическим показаниям проводится контактным лицам из очагов заболевания, не болевшим, не привитым и не имеющим сведений о профилактических прививках против дифтерии.
Противопоказания к вакцинации
- прогрессирующие заболевания нервной системы,
- афебрильные судороги в анамнезе.
Реакция на введение вакцины
В некоторых случаях в первые дни после вакцинации возможно кратковременное повышение температуры, а также боли, покраснение в месте инъекции.
Неспецифическая профилактика
Неспецифическая профилактика заключается в раннем выявлении и изоляции заболевшего, исключении контактов с заболевшими, а также в соблюдении правил личной гигиены.
Дифтерийный круп. Диагностика дифтерии
Дифтерийный круп - клинический синдром, проявляющийся хриплым и сиплым голосом, лающим грубым кашлем, затрудненным стенотическим дыханием, возникает при локализации дифтеритического воспаления в дыхательных путях, а именно: в гортани (локализованный круп); в гортани, трахее, бронхах (распространенный круп) по типу нисходящего ларинготрахеобронхита. Начало болезни в этих случаях не столь бурное и при отсутствии специфического лечения катаральный период (через 1-2-3 суток) постепенно переходит во вторую стенотическую стадию крупа, проявляющуюся стенозом дыхательных путей.
Стенотический период продолжается от нескольких часов до 2-3 суток; без введения противодифтерийной сыворотки заканчивается летальным исходом при явлениях асфиксии (синюшность лица и кожных покровов, дыхательная недостаточность, кома).
Течение дифтерии при других локализациях более легкое, но они также требуют введения противодифтерийной сыворотки. Возникновение дифтерии у привитых возможно, но она отличается более легким течением и редкими осложнениями.
Осложнения дифтерии. 1. Миокардит. Нарушается сердечный ритм, падает АД, тахикардия. На ЭКГ - снижение вольтажа зубцов, смещение ST-интервала, отрицательный зубец Т, AV-блокада. На высоте интоксикации возможно развитие нефротического синдрома, а при нисходящем крупе - поражение легких в виде острой пневмонии.
2. Периферические параличи: ранние (на 2-й неделе болезни) и поздние (на 4-5-й неделе). В раннем периоде поражаются черепные нервы (паралич мягкого неба, аккомодации, иногда наружная офтальмоплегия); поздние параличи характеризуются развитием полирадикулоневрита. Течение параличей длительное, но исход в большинстве случаев благоприятный: через 1-3 мес нарушенные функции восстанавливаются.
Диагноз дифтерии устанавливается клинически, так как нельзя допускать промедления с введением противодифтерийной сыворотки.
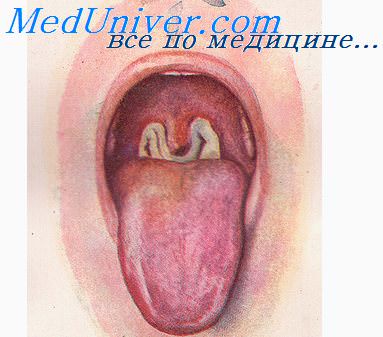
Из лабораторных методов наибольшее значение имеет бактериологическое исследование. Возможно определение антимикробных антител методами РПГА, РИГА: результат считается положительным при нарастании титра антител в динамике заболевания. Дифтерийный токсин в крови можно определить ПЦР.
Для определения наличия и напряженности антитоксического иммунитета при дифтерии применяют внутрикожную реакцию Шика (при наличии иммунитета она отрицательная) и определяют титр антитоксина в сыворотке крови обследуемого.
Главным методом лечения является введение антитоксической противодифтерийной сыворотки (ПДС), которая нейтрализует дифтерийный токсин, циркулирующий в крови. На токсин, связанный с тканями и вызвавший их повреждение, ПДС не оказывает нейтрализующего действия, что подчеркивает необходимость возможно раннего назначения серотерапии. Лечебная эффективность сыворотки столь высока, что при локализованной и распространенной формах дифтерии других средств не требуется.
При токсических формах и дифтерийном крупе кроме ПДС необходимы патогенетическая терапия и правильный уход за больным, а также индивидуальная тактика ведения больного на основе тщательного клинического наблюдения за течением болезни на фоне применяемого лечения, которое может подвергаться этапной коррекции.
За последние годы лечение дифтерии ПДС подверглось серьезному клиническому анализу. Обоснована нецелесообразность введения больших доз ПДС и многократности ее введения (Н.Д. Ющук с соавт. и др.). Сделан еще раз акцент на необходимости раннего введения ПДС в адекватных форме болезни дозах и сокращения продолжительности серотерапии, сведения ее в большинстве случаев к однократному введению сыворотки.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Читайте также:

