Уланова в и мазуров в и инфекционный эндокардит
Обновлено: 22.04.2024
Цель исследования — выявление особенностей клинического течения и морфогенеза инфекционного эндокардита (ИЭ) у ВИЧ-инфицированных инъекционных наркоманов с сопутствующим гепатитом С в сопоставлении с клиникоморфологической картиной эндокардита у лиц без наркотической зависимости.
Установлено, что возбудителем ИЭ у ВИЧ-инфицированных больных являлся золотистый стафилококк (71,8%), а у лиц без наркотической зависимости в этологии заболевания преобладала условно-патогенная флора. У ВИЧинфицированных наркозависимых больных было выявлено поражение трехстворчатого клапана (82,7%), а у лиц без наркотической зависимости изолированное поражение аортального клапана (40%) и сочетанные поражения митрального и аортального клапанов (36,4%).
Осложнения гнойно-экссудативного характера у наркозависимых больных ИЭ встречаются реже, чем у пациентов без наркотической зависимости в связи с иммуносупрессией, имеющейся у ВИЧ-инфицированых лиц.
Ключевые слова
Об авторах
Уланова Вероника Ивановна — д-р мед. наук, доцент кафедры терапии и ревматологии им. Э.Э. Эйхвальда
Список литературы
1. Tyurin V.P., Dubinina S.V. Infectious endocarditis in elderly and senile persons. Klinicheskaya meditsina. 2003;4:53–6. (in Russian) [Тюрин В.П., Дубинина С.В. Инфекционный эндокардит у лиц пожилого и старческого возраста. Клиническая медицина. 2003;4:53‒6.]
2. Tazina S.Ya., Gurevich M.A. Modern infectious endocarditis. Klinicheskaya meditsina. 1999;12:19–23. (in Russian) [Тазина С.Я., Гуревич М.А. Современный инфекционный эндокардит. Клиническая медицина. 1999;12:19‒23.]
4. Hoen B., Alla F., Selton-Suty C. et al. Changing profile of infective endocarditis. Results of 1-year survey in France. JAMA. 2002;288:75‒81.
5. Lopez J., Sevilla T., Vilacosta I., Garcia H., Sarria C., Pozo E. et al. Clinical significance of congestive heart failure in prosthetic valve endocarditis. A multicenter study with 257 patients. Rev. Esp. Cardiol. (Engl Ed). 2013;66:384–390.
6. Ho H.H., Siu C.W., Yiu K.H. et al. Prosthetic valve endocarditic in a multicenter registry of Chinese patients. Asian Cardiovasc. Thorac. Ann. 2010;18:430–4.
7. Keeshin S.W., Feinberg J. Endocarditis as a marker for new epidemics of injection drug use. Am. J. Med. Sci. 2016;352(6):609–14.
8. Athan E., Chu V.H., Tattevin P. et al. Clinical characteristics and outcome of infective endocarditis involving implantable cardiac devices. JAMA. 2012;307:1727–35.
9. Rundstrom H., Kennergren C., Andersson R. et al. Pace maker endocarditis during 18 years in Goteborg. Scand. J. Infect. Dis. 2004;36:674–9.
10. Baddour L.M., Cha Y.M., Wilson W.R. Clinical practice. Infections of cardiovascular implantable electronic devices. N. Engl. J. Med. 2012;367:842–9.
11. Corti V.E., Palmieri O.J., Villafane M.F. et al. Evaluation of 61 episodes of infective endocarditis in intravenous drug abusers and human immunodeficiency tipe-1 virus infection. Rev. Argent. Microbiol. 2004;36(2):85‒7.
12. Moss R., Munt B. Injecting drug use and right-sided endocarditis. Heart. 2003;89:577‒81.
13. Yanagawa B., Bahji A., Lamba W., Tan D.H., Cheema A., Syed I. et al. Endocarditis in the setting of IDU: multidisciplinary management. Curr. Opin. Cardiol. 2018;33(2):140–7.
14. Stein M.D., Maksad J., Clarke J. Hepatitis C disease among injection drug users: knowledge, perceived risk, and willingness to receive treatment. Drug. Alcohol. Depend. 2001;61:211‒5.
15. Mathew J., Addai T., Anand A. et al. Clinical features, site of involvement, bacteriologic findings and outcome of infection endocarditis in intravenous drug users. Heart. 2008;155:1641‒8.
16. Miro J.M., Moreno A., Mestres C.A. Infective endocarditis in intravenous drug abusers. Curr. Infect. Dis. Rep. 2003;5(4):307‒16.
17. Yanagawa B., Bahji A., Lamba W., Tan D.H., Cheema A., Syed I. et al. Endocarditis in the setting of IDU: multidisciplinary management. Curr. Opin. Cardiol. 2018;33(2):140‒7.
18. Reyes M. P., Reyes K.S. Gram-negative endocarditis. Curr. Infect. Dis. Rep. 2008;10:267‒74.
19. Kugler K.C., Biedenbach D.J., Jones R.N. Determination of the antimicrobial activity of 29 clinically important compounds tested against fastidious HACEK group organisms. Diag. Microbiol. Infect. Dis. 1999;34:73‒6.
20. Davis G.L., Rodrigue J.R. Treatment of chronic hepatitis C in active drug users. N. Engl. J. Med. 2001;3:215‒7.
21. Zhang C., Yang R., Xia X et al. High prevalence of HIV-1 and hepatitis C virus coinfection among injection drug users in southeast region of Yunnan, China. J. Acquir. Defic. Syndr. 2002;29 (2):191‒6.
22. Prendergast B.D. HIV and cardiovascular medicine. Heart. 2003;89: 793‒800.
23. Losa J.E., Miro J.M., Del Rio A. et al. Infective endocarditis not related to intravenous drug abuse in HIV-1-infected patients: report of eight cases and review of the literature. Clin. Microbiol. Infect. 2003;6(1):45‒54.
24. Chang F. Y. Staphylococcus aureus bacteremia and endocarditis. J. Microbiol. Immunol. Infect. 2000;33(2):63‒8.
25. D’Amati G., DiGiola R.T., Gallo P. Pathological findings in HIV heart disease. Ann. NY. Acad. Sci. 2001;946:23‒45.
26. Garcia-Cabrera E., Fernandez-Hidalgo N., Almirante B., Ivanova-Georgieva R., Noureddine M., Plata A. et al. Neurological complications of infective endocarditis: risk factors, outcome, and impact of cardiac surgery: a multicenter observational study. Circulation. 2013;127:2272–84.
27. Snygg-Martin U., Gustafsson L., Rosengren L., Alsio A., Ackerholm P. Andersson R. et al. Cerebrovascular complications in patients with left-sided infective endocarditis are common: a prospective study using magnetic resonance imaging and neurochemical brain damage markers. Clin. Infect. Dis. 2008;47:23–30.
28. Duval X., Iung B., Klein I., Brochet E., Thabut G., Arnoult F. et al. Effect of early cerebral magnetic resonance imaging on clinical decisions in infective endocarditis: a prospective study. Ann. Intern. Med. 2010;152:497–504.
29. Vasudev R., Shan P., Bikkina M., Shamoon F. Infective endocarditis in HIV. Int. J. Cardiol. 2016;;214:216‒17.
30. Baddour L.M., Wilson W.R., Bayer A.S., Fowler V.G., Tleyjeh I.M., Rybak M.J. et al. Infective Endocarditis in adults: diagnosis, antimicrobial therapy, and management of complications: a scientific statement for healthcare professionals from the american heart association. Circulation. 2015;13;132(15):1435‒86.
Цель исследования — выявление особенностей клинического течения и морфогенеза инфекционного эндокардита (ИЭ) у ВИЧ-инфицированных инъекционных наркоманов с сопутствующим гепатитом С в сопоставлении с клиникоморфологической картиной эндокардита у лиц без наркотической зависимости.
Установлено, что возбудителем ИЭ у ВИЧ-инфицированных больных являлся золотистый стафилококк (71,8%), а у лиц без наркотической зависимости в этологии заболевания преобладала условно-патогенная флора. У ВИЧинфицированных наркозависимых больных было выявлено поражение трехстворчатого клапана (82,7%), а у лиц без наркотической зависимости изолированное поражение аортального клапана (40%) и сочетанные поражения митрального и аортального клапанов (36,4%).
Осложнения гнойно-экссудативного характера у наркозависимых больных ИЭ встречаются реже, чем у пациентов без наркотической зависимости в связи с иммуносупрессией, имеющейся у ВИЧ-инфицированых лиц.
Ключевые слова
Об авторах
Уланова Вероника Ивановна — д-р мед. наук, доцент кафедры терапии и ревматологии им. Э.Э. Эйхвальда
Список литературы
1. Tyurin V.P., Dubinina S.V. Infectious endocarditis in elderly and senile persons. Klinicheskaya meditsina. 2003;4:53–6. (in Russian) [Тюрин В.П., Дубинина С.В. Инфекционный эндокардит у лиц пожилого и старческого возраста. Клиническая медицина. 2003;4:53‒6.]
2. Tazina S.Ya., Gurevich M.A. Modern infectious endocarditis. Klinicheskaya meditsina. 1999;12:19–23. (in Russian) [Тазина С.Я., Гуревич М.А. Современный инфекционный эндокардит. Клиническая медицина. 1999;12:19‒23.]
4. Hoen B., Alla F., Selton-Suty C. et al. Changing profile of infective endocarditis. Results of 1-year survey in France. JAMA. 2002;288:75‒81.
5. Lopez J., Sevilla T., Vilacosta I., Garcia H., Sarria C., Pozo E. et al. Clinical significance of congestive heart failure in prosthetic valve endocarditis. A multicenter study with 257 patients. Rev. Esp. Cardiol. (Engl Ed). 2013;66:384–390.
6. Ho H.H., Siu C.W., Yiu K.H. et al. Prosthetic valve endocarditic in a multicenter registry of Chinese patients. Asian Cardiovasc. Thorac. Ann. 2010;18:430–4.
7. Keeshin S.W., Feinberg J. Endocarditis as a marker for new epidemics of injection drug use. Am. J. Med. Sci. 2016;352(6):609–14.
8. Athan E., Chu V.H., Tattevin P. et al. Clinical characteristics and outcome of infective endocarditis involving implantable cardiac devices. JAMA. 2012;307:1727–35.
9. Rundstrom H., Kennergren C., Andersson R. et al. Pace maker endocarditis during 18 years in Goteborg. Scand. J. Infect. Dis. 2004;36:674–9.
10. Baddour L.M., Cha Y.M., Wilson W.R. Clinical practice. Infections of cardiovascular implantable electronic devices. N. Engl. J. Med. 2012;367:842–9.
11. Corti V.E., Palmieri O.J., Villafane M.F. et al. Evaluation of 61 episodes of infective endocarditis in intravenous drug abusers and human immunodeficiency tipe-1 virus infection. Rev. Argent. Microbiol. 2004;36(2):85‒7.
12. Moss R., Munt B. Injecting drug use and right-sided endocarditis. Heart. 2003;89:577‒81.
13. Yanagawa B., Bahji A., Lamba W., Tan D.H., Cheema A., Syed I. et al. Endocarditis in the setting of IDU: multidisciplinary management. Curr. Opin. Cardiol. 2018;33(2):140–7.
14. Stein M.D., Maksad J., Clarke J. Hepatitis C disease among injection drug users: knowledge, perceived risk, and willingness to receive treatment. Drug. Alcohol. Depend. 2001;61:211‒5.
15. Mathew J., Addai T., Anand A. et al. Clinical features, site of involvement, bacteriologic findings and outcome of infection endocarditis in intravenous drug users. Heart. 2008;155:1641‒8.
16. Miro J.M., Moreno A., Mestres C.A. Infective endocarditis in intravenous drug abusers. Curr. Infect. Dis. Rep. 2003;5(4):307‒16.
17. Yanagawa B., Bahji A., Lamba W., Tan D.H., Cheema A., Syed I. et al. Endocarditis in the setting of IDU: multidisciplinary management. Curr. Opin. Cardiol. 2018;33(2):140‒7.
18. Reyes M. P., Reyes K.S. Gram-negative endocarditis. Curr. Infect. Dis. Rep. 2008;10:267‒74.
19. Kugler K.C., Biedenbach D.J., Jones R.N. Determination of the antimicrobial activity of 29 clinically important compounds tested against fastidious HACEK group organisms. Diag. Microbiol. Infect. Dis. 1999;34:73‒6.
20. Davis G.L., Rodrigue J.R. Treatment of chronic hepatitis C in active drug users. N. Engl. J. Med. 2001;3:215‒7.
21. Zhang C., Yang R., Xia X et al. High prevalence of HIV-1 and hepatitis C virus coinfection among injection drug users in southeast region of Yunnan, China. J. Acquir. Defic. Syndr. 2002;29 (2):191‒6.
22. Prendergast B.D. HIV and cardiovascular medicine. Heart. 2003;89: 793‒800.
23. Losa J.E., Miro J.M., Del Rio A. et al. Infective endocarditis not related to intravenous drug abuse in HIV-1-infected patients: report of eight cases and review of the literature. Clin. Microbiol. Infect. 2003;6(1):45‒54.
24. Chang F. Y. Staphylococcus aureus bacteremia and endocarditis. J. Microbiol. Immunol. Infect. 2000;33(2):63‒8.
25. D’Amati G., DiGiola R.T., Gallo P. Pathological findings in HIV heart disease. Ann. NY. Acad. Sci. 2001;946:23‒45.
26. Garcia-Cabrera E., Fernandez-Hidalgo N., Almirante B., Ivanova-Georgieva R., Noureddine M., Plata A. et al. Neurological complications of infective endocarditis: risk factors, outcome, and impact of cardiac surgery: a multicenter observational study. Circulation. 2013;127:2272–84.
27. Snygg-Martin U., Gustafsson L., Rosengren L., Alsio A., Ackerholm P. Andersson R. et al. Cerebrovascular complications in patients with left-sided infective endocarditis are common: a prospective study using magnetic resonance imaging and neurochemical brain damage markers. Clin. Infect. Dis. 2008;47:23–30.
28. Duval X., Iung B., Klein I., Brochet E., Thabut G., Arnoult F. et al. Effect of early cerebral magnetic resonance imaging on clinical decisions in infective endocarditis: a prospective study. Ann. Intern. Med. 2010;152:497–504.
29. Vasudev R., Shan P., Bikkina M., Shamoon F. Infective endocarditis in HIV. Int. J. Cardiol. 2016;;214:216‒17.
30. Baddour L.M., Wilson W.R., Bayer A.S., Fowler V.G., Tleyjeh I.M., Rybak M.J. et al. Infective Endocarditis in adults: diagnosis, antimicrobial therapy, and management of complications: a scientific statement for healthcare professionals from the american heart association. Circulation. 2015;13;132(15):1435‒86.
Инфекционный эндокардит (ИЭ) относится к числу тяжелых заболеваний с высоким уровнем летальности. В отсутствии лечения смертность при ИЭ составляет 100%. В последние годы отмечается значительный рост числа больных эндокардитом в нашей стране и за рубеж
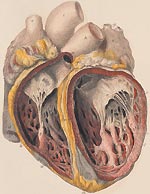
Инфекционный эндокардит (ИЭ) относится к числу тяжелых заболеваний с высоким уровнем летальности. В отсутствии лечения смертность при ИЭ составляет 100%. В последние годы отмечается значительный рост числа больных эндокардитом в нашей стране и за рубежом. По данным различных авторов, сегодня выросла заболеваемость в пожилом и старческом возрасте, а также среди лиц в возрасте до 30 лет, использующих внутривенное введение наркотиков [1, 2].
Известно, что ИЭ представляет собой заболевание инфекционной природы с первичной локализацией возбудителя на клапанах сердца, пристеночном эндокарде, протекающее с проявлениями системной инфекции, сосудистыми осложнениями и иммунной реакцией [3, 4, 5].
В данной работе обобщен опыт диагностики и ведения больных ИЭ на базе общетерапевтического отделения Александровской больницы Санкт-Петербурга за период 1998–2003 гг. Диагностика заболевания осуществлялась в соответствии с критериями Duke [8]. Диагноз ИЭ оценивался как достоверный при наличии двух главных критериев, а именно:
- при выделении типичного для ИЭ возбудителя при посевах крови больного;
- при определении эхокардиографических признаков поражения эндокарда - подвижные вегетации на клапанах сердца, абсцессов в области протеза клапана; образования внутрисердечных фистул и др., в сочетании с тремя или/и пятью вспомогательными критериями, к которым относились сосудистые осложнения (эмболии крупных артерий, септические инфаркты легких, внутричерепные кровоизлияния и др.), иммунологические феномены (гломерулонефрит, узелки Ослера, геморрагический васкулит и др.), а также фебрильная лихорадка, гепато-спленомегалия и другие проявления системной инфекции.
Нами было проведено обследование 105 больных ИЭ, из них у 80 человек в возрасте от 18 до 30 лет (первая группа) основным фактором риска заболевания являлась инъекционная наркомания.
Во второй группе больных (25 чел.) основными предрасполагающими факторами развития ИЭ были врожденные и приобретенные пороки сердца, а также протезированные клапаны.
У лиц старшей возрастной группы дополнительным фактором риска являлись дегенеративно-дистрофические изменения клапанов сердца.
Взаимосвязь характера поражения клапанов сердца и факторов риска ИЭ представлена в таблице 1.
По данным эхокардиографического исследования, у 100% больных первой группы были выявлены подвижные вегетации на створках трикуспидального клапана (ТК), что сопровождалось формированием его недостаточности I—III степени.
Во второй группе больных ИЭ отмечалось поражение левых камер сердца с образованием вегетаций на створках аортального и митрального клапанов. Изолированное поражение митрального клапана наблюдалось у двух человек с ревматическим пороком сердца (митральный стеноз), у одной больной с врожденным дефектом межжелудочковой перегородки и в единственном случае обструктивной формы гипертрофической кардиомиопатии.
Среди лиц пожилого и старческого возраста у девяти человек (36%) определялось изолированное поражение аортального клапана в отсутствии признаков аортального стеноза. Наряду с этим, у пяти больных (20%) в возрасте от 72 до 87 лет ИЭ развился на фоне аортального порока атеросклеротического генеза, причем у всех пятерых было выявлено сочетанное поражение аортального и митрального клапанов. Дегенеративно-дистрофические изменения других клапанов сердца определялись у 100% больных старшей возрастной группы.
Образование вегетаций на створках аортального клапана наблюдалось у двух больных с третичной формой сифилиса на фоне имеющегося аортального порока, связанного со специфическим процессом в аорте.
В двух случаях мы наблюдали развитие эндокардита протезированных клапанов.
При сопоставлении результатов посевов крови в двух группах больных определялись существенные различия как в частоте выделения микробной флоры, так и в видовом составе возбудителей эндокардита. По нашим данным, возбудителем ИЭ у больных-наркоманов в 71,3% наблюдений (57 чел.) являлся золотистый стафилококк, тогда как во второй группе, наряду с кокковой флорой, чаще обнаруживались грамотрицательные микроорганизмы (28%). Отрицательные результаты посевов крови значительно реже наблюдались в первой, чем во второй, группе больных ИЭ: 18,7% и 56% — соответственно. Данные относительно этиологической структуры ИЭ в обследуемых группах больных представлены в таблице 2.
Клиническая характеристика и особенности течения ИЭ
Клиническое течение и характер осложнений инфекционного эндокардита во многом зависят от локализации клапанных вегетаций — в правых или левых камерах сердца, а также степени вирулентности возбудителя заболевания.
Течение ИЭ у больных-наркоманов отличалось особой тяжестью и полисиндромностью. Причиной госпитализации у большинства больных были острые осложнения основного заболевания. Значительная часть больных поступала в реанимационное отделение стационара с клиническими симптомами одно- или двухсторонней многофокусной пневмонии, причиной которой являлась септическая тромбоэмболия ветвей легочной артерии (72% больных). Течение пневмонии сопровождалось тяжелой дыхательной недостаточностью, нередко с развитием респираторного дистресс-синдрома (РДСВ) и очагами деструкции в легких (12%). Проявления вторичной нефропатии, которые обнаруживались у 100% больных в первой группе, иногда ошибочно трактовались как обострение хронического гломеруло- или пиелонефрита, мочекаменной болезни, что служило поводом для госпитализации этих больных в урологическое и нефрологическое отделения.
Во второй группе больных основной причиной госпитализации была длительная фебрильная лихорадка в сочетании с анемией и гепатолиенальным синдромом. Наряду с этим, у пяти человек (20%) поводом для госпитализации послужила прогрессирующая сердечная недостаточность.
Основные клинические синдромы, наблюдаемые у больных ИЭ первой и второй групп, представлены в таблице 3.
По нашим наблюдениям, характерной особенностью клинического течения ИЭ у больных-наркоманов являлась высокая частота септической ТЭЛА с формированием множественных очагов инфильтрации в легких. У многих больных легочные тромбоэмболии носили рецидивирующий характер (31,3% больных) и нередко осложнялись развитием деструктивных очагов в легких.
Образование вегетаций у 100% больных первой группы сопровождалось недостаточностью трехстворчатого клапана I—III степени с формированием потоков регургитации. Вместе с тем, у большинства пациентов не определялось тяжелых нарушений центральной гемодинамики, связанных с дисфункцией ТК. В данной группе больных характерной клинической особенностью был обратимый характер нарушений гемодинамики на фоне проводимой терапии. Острая сердечная недостаточность с дилятацией полостей сердца и снижением фракции выброса до 40% и ниже наблюдалась у 28 больных (35,3%) в связи с присоединением острого миокардита или на фоне сочетанного поражения клапанов сердца.
Вторичная нефропатия являлась одним из самых распространенных синдромов в первой группе больных ИЭ. Острая почечная недостаточность наблюдалась у 16 больных, причем у 10 из них она носила обратимый характер и была связана с острым ДВС-синдромом, а также с острой сердечной недостаточностью с отеками. Инфекционно-токсическая нефропатия регистрировалась в 73,8% наблюдений и сопровождалась мочевым синдромом — гематурией, протеинурией, лейкоцитурией — при достаточном уровне клубочковой фильтрации.
Характерной особенностью ИЭ во второй группе было подострое течение заболевания с длительным периодом лихорадки на догоспитальном этапе, причем в пожилом и старческом возрасте лихорадка носила субфебрильный характер с редкими подъемами температуры до фебрильных цифр.
Большинство больных подострым инфекционным эндокардитом (ПИЭ) поступали в стационар в стадии развернутой клинической картины заболевания с клиническими признаками тромбоэмболии сосудов большого круга кровообращения. В данной группе больных наиболее распространенными следует признать такие осложнения, как церебральные эмболии с развитием ишемических и геморрагических инсультов, эмболии почечных сосудов с болевым синдромом и гематурией, а также формирование острых очаговых изменений в миокарде, связанных с эмболией коронарных сосудов или прикрытием устьев коронарных артерий вегетациями [9].
Септические тромбоэмболии церебральных сосудов нередко сопровождались развитием гнойного менингоэнцефалита с летальным исходом. Вместе с тем, при посевах крови у 56% больных второй группы не получено роста микробной флоры. Обращает на себя внимание тот факт, что септицемия у больных с положительными результатами посевов крови в 28% наблюдений была обусловлена грамотрицательной микрофлорой. В этой категории больных источником бактериемии являлись очаги хронической инфекции в мочеполовой системе, а у двух больных (по данным аутопсии) был выявлен двухсторонний апостематозный нефрит.
У значительного числа больных ПИЭ (62%) определялись признаки острой недостаточности кровообращения с застойными хрипами в легких, легочной гипертензией, увеличением полостей сердца и периферическими отеками.
В этой группе больных чаще, чем в первой, наблюдалась преренальная азотемия и ОПН, связанные с развитием острой недостаточности кровообращения.
Острый диффузный миокардит, типичными проявлениями которого были различные нарушения ритма, диагностирован у 27% больных второй группы.
Анемия со снижением уровня гемоглобина до 80 г/л и менее выявлена у 100% больных второй группы. Значительное увеличение СОЭ (более 45 мм/ч) наблюдалось у 85,8% больных подострым ИЭ.
Кожные изменения в виде геморрагических высыпаний, пурпуры Шенлейн-Геноха, а также другие проявления иммунного воспаления в обеих группах больных встречались нечасто — 6,3 и 4% в первой и второй группах, соответственно.
Лечение больных ИЭ
Консервативная терапия больных ИЭ проводилось с использованием антибиотиков широкого спектра действия в сочетании со средствами дезинтоксикационной, антикоагулянтной и метаболической терапии. В составе антибактериальной терапии больные получали цефалоспорины III-IV поколений в комбинации с аминогликозидами и метронидазолом. Из группы цефалоспоринов назначались: цефтриаксон (лонгацеф) 2 г в сутки внутривенно (в/в), или цефотаксим (тальцеф) 2 г в сутки в/в, или цефепим (максипим) 2 г в сутки в/в в сочетании с аминогликозидами (амикацин в суточной дозе 1,5 г в/в) и метронидазолом по 1,5-2 г в сутки в/в. В случае, если такая терапия оказывалась неэффективной или существовали противопоказания к вышеперечисленным препаратам, применялись антибиотики группы линкозаминов: клиндамицин 1,2 г в сутки в/в или линкомицин 3 г в сутки в/в в сочетании со фторхинолонами (ципрофлоксацин 400 мг в сутки в/в). В условиях отделения реанимации в течение пяти–семи дней проводилась терапия имипинемом (тиенамом) в дозе 2—4 г в сутки в/в или рифампицином в суточной дозе 0,45—0,6 г в/в. Средняя продолжительность курса антибиотикотерапии в обследуемой группе больных составила 28 + 3,5 дней.
Дезинтоксикационная терапия включала в себя внутривенные инфузии реополиглюкина, гемодеза, поляризующих смесей в сочетании с петлевыми диуретиками. Объем вводимой жидкости составлял в среднем 2-2,5 л в сутки. В течение всего периода инфузионной терапии осуществлялся контроль за функциональным состоянием почек, электролитным составом крови, суточным диурезом. В условиях отделения реанимации у всех больных осуществлялся мониторинг ЦВД. Инфузионная терапия проводилась в течение всего острого периода заболевания до купирования проявлений интоксикационного синдрома. Средняя продолжительность курса составила 22 + 4,5 дня.
Развитие легочной эмболии, особенно в сочетании с признаками острого ДВС-синдрома в стадии гиперкоагуляции, служило основанием для назначения антикоагулянтной терапии. Начальная доза гепарина составляла 10 тыс. ЕД внутривенно, струйно, за-тем — по 1000 ЕД в час внутривенно, капельно с переходом на подкожное введение до 30 тыс. ЕД в сутки. Введение гепарина осуществлялось под контролем показателей коагулограммы и времени свертывания крови. Одновременно проводились внутривенные трансфузии свежезамороженной плазмы по 300 мл в сутки с добавлением 2500–5000 ЕД гепарина. Анемия тяжелой степени (Нb менее 80 г/л, Ht ≤25) корригировалась переливаниями эритроцитарной массы (пять–семь доз). При наличии гипопротеинемии использовалось введение растворов аминокислот, альбумина или нативной плазмы. Выявление клинических и рентгенологических признаков отека легких на фоне рецидивирующего течения септической ТЭЛА служило показанием для назначения кортикостероидов (преднизолон от 120 до 200 мг в сутки внутривенно капельно). Терапия антикоагулянтами прямого действия в сочетании с трансфузиями криоплазмы проводилась до стойкого улучшения показателей гемостаза. Критериями нормокоагуляции являлись уровень фибриногена в плазме 3-4 г/л, отсутствие тромбоцитопении, нормализация ВСК, АЧТВ, тромбинового времени, а также отрицательные паракоагуляционные тесты. По нашим данным, купирование проявлений острого ДВС-синдрома на стадии гиперкоагуляции у 75% больных отмечалось на седьмой–десятый день от начала комплексной терапии.
У части больных формировалась резистентность к проводимой антибактериальной терапии, которая характеризовалась нарастанием интоксикации, фебрильной лихорадкой, прогрессирующей анемией, а также высевами из крови возбудителя ИЭ – золотистого стафилококка — в 65% наблюдений. При рентгенологическом обследовании данной категории больных с большой частотой определялись очаги деструкции легочной ткани, а у трех больных гнойный выпот в плевральной полости.
Длительное применение антибиотиков широкого спектра действия у 70,3% больных (38 чел.) сопровождалось развитием побочных эффектов антибактериальной терапии. Кандидоз полости рта глотки, пищевода, а также кишечный дисбактериоз III-IV стадии был выявлен у 36 больных (66,7%). Применение антибиотиков с гепатотоксическими свойствами (цефалоспорины, линкозамины, метронидазол) у двух больных (3,7%) с хроническим гепатитом С и В приводило к прогрессированию печеночной недостаточности, которая сопровождалась высокой ферментемией (АЛТ 1500 ЕД, АСТ 1000 ЕД) и желтухой.
Развитие застойной сердечной недостаточности с появлением акроцианоза, влажных хрипов в базальных отделах легких, периферических отеков в сочетании с кардиомегалией и падением фракции выброса до 50—45% наблюдалось у пяти больных (9,3%) на фоне массивной инфузионной терапии.
Длительная антикоагулянтная терапия в 20,4% (11 чел.) наблюдений сопровождалась повышением толерантности плазмы к гепарину, что клинически выражалось в развитии периферических флеботромбозов, в то время как гепарининдуцированной тромбоцитопении в обследуемой группе больных мы не наблюдали.
Положительные результаты консервативной терапии были получены у 70,2% больных (56 чел.) с поражением ТК и лишь у 32% пациентов (6 чел.) из второй группы. Исходом ИЭ в обеих группах больных являлось формирование недостаточности клапанов сердца.
Госпитальная летальность при ИЭ у наркозависимых лиц составила 29,4% (24 чел.), тогда как у больных с поражением левых камер сердца (вторая группа) уровень смертности составил 68% (19 чел.).
По данным аутопсии, основными причинами смерти больных ИЭ были:
- септикопиемия с формированием гнойных очагов в печени, почках селезенке, головном мозге с развитием полиорганной недостаточности (46,2%);
- сердечная недостаточность на фоне полипозно-язвенного эндокардита с разрушением клапанов сердца, а также острый миокардит с дилятацией полостей сердца (39,4%);
- вторичная нефропатия с развитием почечной недостаточности, отеком легких, отеком головного мозга (14,4%).
Таким образом, характерные особенности ИЭ у лиц с наркотической зависимостью — это острое течение заболевания с поражением правых камер сердца и рецидивами септической ТЭЛА. Возбудителем ИЭ у инъекционных наркоманов в 71,3% является высоковирулентный золотистый стафилококк. Формирование недостаточности трехстворчатого клапана I—III степени стало самым распределенным осложнением ИЭ у наркоманов. При этом у большинства больных не наблюдается тяжелых нарушений центральной гемодинамики, приводящих к развитию острой недостаточности кровообращения.
Подострый ИЭ у больных с предрасполагающими заболеваниями сердца, а также у лиц пожилого и старческого возраста протекает с преимущественным поражением левых камер сердца, причем в старшей возрастной группе преобладает моноклапанное поражение. Наличие сопутствующей патологии у лиц старше 60 лет маскирует течение основного заболевания, чем и обусловлены поздняя диагностика и высокая смертность больных. Для затяжного течения ИЭ характерна низкая высеваемость возбудителя, по сравнению с острыми формами заболевания. Развитие тромбоэмболий сосудов большого круга кровообращения является характерной клинической особенностью подострого ИЭ.
Положительный эффект от проводимой консервативной терапии наблюдается у большинства больных ИЭ с поражением ТК, тогда как при подостром эндокардите левых камер сердца консервативная терапия является малоэффективной у большинства больных.
Госпитальная летальность в обеих группах больных обусловлена диссеминацией возбудителя с формированием гнойных очагов и полиорганной недостаточностью, а также развитием острой недостаточности кровообращения и вторичной нефропатии.
Литература
- Буткевич О. М., Виноградова Т. Л. Инфекционный эндокардит. - М., 1997.
- Симоненко В. Б., Колесников С. А. Инфекционный эндокардит: современное течение, диагностика, принципы лечения и профилактики. - Клин. мед., 1999. - 3. - С. 44-49.
- Тазина С. Я., Гуревич М. А. Современный инфекционный эндокардит. - Клин. мед.,1999. - 12. - С. 19-23.
- Bansal R. C. Infective endocarditis. Med Clin North America 1995; 79 (5): 1205-1239.
- Bayer A. S., Bolger A. F., Taubert K. A. et al. Diagnosis and management of infective endocarditis and its complications. Circulation 1998; 98: 2936-2948.
- McKinsey D. S., Ratts T. E., Bisno A. I. Underlying cardiac lesions in adults with infective endocarditis. The changing spectrum. Amer J Med 1987; 82: 681-688.
- Lamas C. C. Eykyn S. J. Suggested modifications to the Duke criteria for the clinical diagnosis of native valve and prosthetic valve endocarditis: analysis of 118 pathologically proven cases. Clin Infect Dis 1997; 25: 713-719.
- Durack D. T., Lukes A. S., Bright D. K. et al. New criteria for diagnosis of Infective Endocarditis Utilization of Specific Echocardiographic Finding. Amer J Med 1994; 96: 200-209.
- Тюрин В. П., Дубинина С. В. Инфекционный эндокардит у лиц пожилого и старческого возраста. - Клин. мед., 2000. - 4. - С. 53-56.
В. И. Уланова
В. И. Мазуров, доктор медицинских наук, профессор
Медицинская академия последипломного образования, Санкт-Петербург
Цель . Выявить особенности клинических проявлений инфекционного эндокардита у инъекционных наркоманов.
Заключение . Знания особенностей современного клинического течения инфекционного эндокардита у инъекционных наркоманов позволяют улучшить подходы к диагностике эндокардита в более ранние сроки его возникновения и тем самым делает более перспективным лечение этих больных.
Ключевые слова
Об авторах
Красноярский государственный медицинский университет им. профессора В. Ф. Войно-Ясенецкого Минздрава России
Россия
Демко Ирина Владимировна — профессор, доктор медицинских наук, заведующий кафедрой внутренних болезней № 2 с курсом ПО.
Конфликт интересов: Не заявлен
Красноярский государственный медицинский университет им. профессора В. Ф. Войно-Ясенецкого Минздрава России
Россия
Пелиновская Лилия Ивановна — кандидат медицинских наук, ассистент кафедры внутренних болезней № 2 с курсом ПО.
Конфликт интересов: Не заявлен
Красноярский государственный медицинский университет им. профессора В. Ф. Войно-Ясенецкого Минздрава России
Россия
Манхаева Марина Вячеславовна — клинический ординатор кафедры внутренних болезней № 2 с курсом ПО.
Конфликт интересов: Не заявлен
Красноярский государственный медицинский университет им. профессора В. Ф. Войно-Ясенецкого Минздрава России
Россия
Ищенко Ольга Петровна — кандидат медицинских наук, ассистент кафедры внутренних болезней № 2 с курсом ПО.
Конфликт интересов: Не заявлен
Красноярский государственный медицинский университет им. профессора В. Ф. Войно-Ясенецкого Минздрава России
Россия
Мосина Валентина Анатольевна — кандидат медицинских наук, ассистент кафедры внутренних болезней № 2 с курсом ПО.
Конфликт интересов: Не заявлен
Красноярский государственный медицинский университет им. профессора В. Ф. Войно-Ясенецкого Минздрава России
Россия
Крапошина Ангелина Юрьевна — кандидат медицинских наук, доцент кафедры внутренних болезней № 2 с курсом ПО.
Конфликт интересов: Не заявлен
Иваницкая Элеонора Эдуардовна — врач кардиолог кардиологического отделения № 1.
Конфликт интересов: Не заявлен
Список литературы
1. Tazevell B, Ross F, Nayab A. Invective endocarditis in heroin addict. Am. J. Cardiol. 2007;55:444-51.
3. Филипенко П. С., Драгоман Е. А. Инфекционный эндокардит у инъекционных наркоманов. Часть 1. Особенности этиологии, патогенеза и течения. Клиническая медицина. 2010;1:9-14.
4. De Rosa FG, Cicalini S, Canta F, et al. Infective endocarditis in intravenous drug users from Italy: the increasing importance in HIV-infected patients. J. Infect. 2007;35 (3):154-60.
5. Рекомендации ESC по ведению больных с инфекционным эндокардитом. Российский кардиологический журнал. 2016; (5):65—116. doi:10.15829/1560-4071-2016-5-65-116.
6. Тюрин В. П. Инфекционные эндокардиты. 2-е изд., доп. и переработанное.М.: Гэотар-Медиа; 2012.
7. Муратов Р. Н., Скопин И. И., Шамсиев Г. А. Тактика хирургического лечения активного инфекционного эндокардита трикуспидального клапана. Анналы хирургии. 2005;1:35-9.
8. Уланова В. И., Мазуров В. И., Цинзерлинг В.А. Клинико-морфологические особенности инфекционного эндокардита у ВИЧ-инфицированных инъекционных наркоманов. Клиническая медицина. 2011;3:70-4.
9. Гуревич М. А. Некоторые особенности современного инфекционного эндокардита. Российский кардиологический журнал. 2009;6:87-92. doi:10.15829/1560-4071-2009-6-87-92.
10. Столбова М. В., Лискова Ю. В., Артемова Н. Э., и др. Особенности инфекционного эндокардита у “солевых” наркоманов. Архив внутренней медицины. 2017;4:267-70.
11. Lapenna E, De Bonis M, Verzini A, et al. The clover technique for the treatment of complex tricuspid valve insufficiency: midterm clinical and cuspid valve insufficiency: midterm clinical and ehocardiographic results in 66 patients. Eur. J. Cardiothorack Surgery. 2010;37:1297-303.
12. Galai N, Vlahov D, Bareta JC. Prognostic factors for survival differ according to CD4+ cell count among HIV-infection drug users: pre-HAART and HAART ears. J. I nfect. 2005;38:74-81.
13. Приходько В. П. Особенности хирургического лечения инфекционного эндокардита у наркоманов. X Всероссийский съезд сердечно-сосудистой хирургии: тезисы докладов. 2004:48.
14. Котова E. О., Писарюк А. С., Гетия Т. С., и др. Современный инфекционный эндокардит: острое почечное повреждение как проявление кардиоренального синдрома. Клиническая фармакология и терапия. 2015;24 (2):47-53.
15. Мишнаевский А. Л. Инфекционный эндокардит трикуспидального клапана. Клиническая медицина. 2001;2:21-4.
Инфекционный эндокардит (ИЭ) относится к числу тяжелых заболеваний с высоким уровнем летальности. В отсутствии лечения смертность при ИЭ составляет 100%. В последние годы отмечается значительный рост числа больных эндокардитом в нашей стране и за рубеж

Инфекционный эндокардит (ИЭ) относится к числу тяжелых заболеваний с высоким уровнем летальности. В отсутствии лечения смертность при ИЭ составляет 100%. В последние годы отмечается значительный рост числа больных эндокардитом в нашей стране и за рубежом. По данным различных авторов, сегодня выросла заболеваемость в пожилом и старческом возрасте, а также среди лиц в возрасте до 30 лет, использующих внутривенное введение наркотиков [1, 2].
Известно, что ИЭ представляет собой заболевание инфекционной природы с первичной локализацией возбудителя на клапанах сердца, пристеночном эндокарде, протекающее с проявлениями системной инфекции, сосудистыми осложнениями и иммунной реакцией [3, 4, 5].
В данной работе обобщен опыт диагностики и ведения больных ИЭ на базе общетерапевтического отделения Александровской больницы Санкт-Петербурга за период 1998–2003 гг. Диагностика заболевания осуществлялась в соответствии с критериями Duke [8]. Диагноз ИЭ оценивался как достоверный при наличии двух главных критериев, а именно:
- при выделении типичного для ИЭ возбудителя при посевах крови больного;
- при определении эхокардиографических признаков поражения эндокарда - подвижные вегетации на клапанах сердца, абсцессов в области протеза клапана; образования внутрисердечных фистул и др., в сочетании с тремя или/и пятью вспомогательными критериями, к которым относились сосудистые осложнения (эмболии крупных артерий, септические инфаркты легких, внутричерепные кровоизлияния и др.), иммунологические феномены (гломерулонефрит, узелки Ослера, геморрагический васкулит и др.), а также фебрильная лихорадка, гепато-спленомегалия и другие проявления системной инфекции.
Нами было проведено обследование 105 больных ИЭ, из них у 80 человек в возрасте от 18 до 30 лет (первая группа) основным фактором риска заболевания являлась инъекционная наркомания.
Во второй группе больных (25 чел.) основными предрасполагающими факторами развития ИЭ были врожденные и приобретенные пороки сердца, а также протезированные клапаны.
У лиц старшей возрастной группы дополнительным фактором риска являлись дегенеративно-дистрофические изменения клапанов сердца.
Взаимосвязь характера поражения клапанов сердца и факторов риска ИЭ представлена в таблице 1.
По данным эхокардиографического исследования, у 100% больных первой группы были выявлены подвижные вегетации на створках трикуспидального клапана (ТК), что сопровождалось формированием его недостаточности I—III степени.
Во второй группе больных ИЭ отмечалось поражение левых камер сердца с образованием вегетаций на створках аортального и митрального клапанов. Изолированное поражение митрального клапана наблюдалось у двух человек с ревматическим пороком сердца (митральный стеноз), у одной больной с врожденным дефектом межжелудочковой перегородки и в единственном случае обструктивной формы гипертрофической кардиомиопатии.
Среди лиц пожилого и старческого возраста у девяти человек (36%) определялось изолированное поражение аортального клапана в отсутствии признаков аортального стеноза. Наряду с этим, у пяти больных (20%) в возрасте от 72 до 87 лет ИЭ развился на фоне аортального порока атеросклеротического генеза, причем у всех пятерых было выявлено сочетанное поражение аортального и митрального клапанов. Дегенеративно-дистрофические изменения других клапанов сердца определялись у 100% больных старшей возрастной группы.
Образование вегетаций на створках аортального клапана наблюдалось у двух больных с третичной формой сифилиса на фоне имеющегося аортального порока, связанного со специфическим процессом в аорте.
В двух случаях мы наблюдали развитие эндокардита протезированных клапанов.
При сопоставлении результатов посевов крови в двух группах больных определялись существенные различия как в частоте выделения микробной флоры, так и в видовом составе возбудителей эндокардита. По нашим данным, возбудителем ИЭ у больных-наркоманов в 71,3% наблюдений (57 чел.) являлся золотистый стафилококк, тогда как во второй группе, наряду с кокковой флорой, чаще обнаруживались грамотрицательные микроорганизмы (28%). Отрицательные результаты посевов крови значительно реже наблюдались в первой, чем во второй, группе больных ИЭ: 18,7% и 56% — соответственно. Данные относительно этиологической структуры ИЭ в обследуемых группах больных представлены в таблице 2.
Клиническая характеристика и особенности течения ИЭ
Клиническое течение и характер осложнений инфекционного эндокардита во многом зависят от локализации клапанных вегетаций — в правых или левых камерах сердца, а также степени вирулентности возбудителя заболевания.
Течение ИЭ у больных-наркоманов отличалось особой тяжестью и полисиндромностью. Причиной госпитализации у большинства больных были острые осложнения основного заболевания. Значительная часть больных поступала в реанимационное отделение стационара с клиническими симптомами одно- или двухсторонней многофокусной пневмонии, причиной которой являлась септическая тромбоэмболия ветвей легочной артерии (72% больных). Течение пневмонии сопровождалось тяжелой дыхательной недостаточностью, нередко с развитием респираторного дистресс-синдрома (РДСВ) и очагами деструкции в легких (12%). Проявления вторичной нефропатии, которые обнаруживались у 100% больных в первой группе, иногда ошибочно трактовались как обострение хронического гломеруло- или пиелонефрита, мочекаменной болезни, что служило поводом для госпитализации этих больных в урологическое и нефрологическое отделения.
Во второй группе больных основной причиной госпитализации была длительная фебрильная лихорадка в сочетании с анемией и гепатолиенальным синдромом. Наряду с этим, у пяти человек (20%) поводом для госпитализации послужила прогрессирующая сердечная недостаточность.
Основные клинические синдромы, наблюдаемые у больных ИЭ первой и второй групп, представлены в таблице 3.
По нашим наблюдениям, характерной особенностью клинического течения ИЭ у больных-наркоманов являлась высокая частота септической ТЭЛА с формированием множественных очагов инфильтрации в легких. У многих больных легочные тромбоэмболии носили рецидивирующий характер (31,3% больных) и нередко осложнялись развитием деструктивных очагов в легких.
Образование вегетаций у 100% больных первой группы сопровождалось недостаточностью трехстворчатого клапана I—III степени с формированием потоков регургитации. Вместе с тем, у большинства пациентов не определялось тяжелых нарушений центральной гемодинамики, связанных с дисфункцией ТК. В данной группе больных характерной клинической особенностью был обратимый характер нарушений гемодинамики на фоне проводимой терапии. Острая сердечная недостаточность с дилятацией полостей сердца и снижением фракции выброса до 40% и ниже наблюдалась у 28 больных (35,3%) в связи с присоединением острого миокардита или на фоне сочетанного поражения клапанов сердца.
Вторичная нефропатия являлась одним из самых распространенных синдромов в первой группе больных ИЭ. Острая почечная недостаточность наблюдалась у 16 больных, причем у 10 из них она носила обратимый характер и была связана с острым ДВС-синдромом, а также с острой сердечной недостаточностью с отеками. Инфекционно-токсическая нефропатия регистрировалась в 73,8% наблюдений и сопровождалась мочевым синдромом — гематурией, протеинурией, лейкоцитурией — при достаточном уровне клубочковой фильтрации.
Характерной особенностью ИЭ во второй группе было подострое течение заболевания с длительным периодом лихорадки на догоспитальном этапе, причем в пожилом и старческом возрасте лихорадка носила субфебрильный характер с редкими подъемами температуры до фебрильных цифр.
Большинство больных подострым инфекционным эндокардитом (ПИЭ) поступали в стационар в стадии развернутой клинической картины заболевания с клиническими признаками тромбоэмболии сосудов большого круга кровообращения. В данной группе больных наиболее распространенными следует признать такие осложнения, как церебральные эмболии с развитием ишемических и геморрагических инсультов, эмболии почечных сосудов с болевым синдромом и гематурией, а также формирование острых очаговых изменений в миокарде, связанных с эмболией коронарных сосудов или прикрытием устьев коронарных артерий вегетациями [9].
Септические тромбоэмболии церебральных сосудов нередко сопровождались развитием гнойного менингоэнцефалита с летальным исходом. Вместе с тем, при посевах крови у 56% больных второй группы не получено роста микробной флоры. Обращает на себя внимание тот факт, что септицемия у больных с положительными результатами посевов крови в 28% наблюдений была обусловлена грамотрицательной микрофлорой. В этой категории больных источником бактериемии являлись очаги хронической инфекции в мочеполовой системе, а у двух больных (по данным аутопсии) был выявлен двухсторонний апостематозный нефрит.
У значительного числа больных ПИЭ (62%) определялись признаки острой недостаточности кровообращения с застойными хрипами в легких, легочной гипертензией, увеличением полостей сердца и периферическими отеками.
В этой группе больных чаще, чем в первой, наблюдалась преренальная азотемия и ОПН, связанные с развитием острой недостаточности кровообращения.
Острый диффузный миокардит, типичными проявлениями которого были различные нарушения ритма, диагностирован у 27% больных второй группы.
Анемия со снижением уровня гемоглобина до 80 г/л и менее выявлена у 100% больных второй группы. Значительное увеличение СОЭ (более 45 мм/ч) наблюдалось у 85,8% больных подострым ИЭ.
Кожные изменения в виде геморрагических высыпаний, пурпуры Шенлейн-Геноха, а также другие проявления иммунного воспаления в обеих группах больных встречались нечасто — 6,3 и 4% в первой и второй группах, соответственно.
Лечение больных ИЭ
Консервативная терапия больных ИЭ проводилось с использованием антибиотиков широкого спектра действия в сочетании со средствами дезинтоксикационной, антикоагулянтной и метаболической терапии. В составе антибактериальной терапии больные получали цефалоспорины III-IV поколений в комбинации с аминогликозидами и метронидазолом. Из группы цефалоспоринов назначались: цефтриаксон (лонгацеф) 2 г в сутки внутривенно (в/в), или цефотаксим (тальцеф) 2 г в сутки в/в, или цефепим (максипим) 2 г в сутки в/в в сочетании с аминогликозидами (амикацин в суточной дозе 1,5 г в/в) и метронидазолом по 1,5-2 г в сутки в/в. В случае, если такая терапия оказывалась неэффективной или существовали противопоказания к вышеперечисленным препаратам, применялись антибиотики группы линкозаминов: клиндамицин 1,2 г в сутки в/в или линкомицин 3 г в сутки в/в в сочетании со фторхинолонами (ципрофлоксацин 400 мг в сутки в/в). В условиях отделения реанимации в течение пяти–семи дней проводилась терапия имипинемом (тиенамом) в дозе 2—4 г в сутки в/в или рифампицином в суточной дозе 0,45—0,6 г в/в. Средняя продолжительность курса антибиотикотерапии в обследуемой группе больных составила 28 + 3,5 дней.
Дезинтоксикационная терапия включала в себя внутривенные инфузии реополиглюкина, гемодеза, поляризующих смесей в сочетании с петлевыми диуретиками. Объем вводимой жидкости составлял в среднем 2-2,5 л в сутки. В течение всего периода инфузионной терапии осуществлялся контроль за функциональным состоянием почек, электролитным составом крови, суточным диурезом. В условиях отделения реанимации у всех больных осуществлялся мониторинг ЦВД. Инфузионная терапия проводилась в течение всего острого периода заболевания до купирования проявлений интоксикационного синдрома. Средняя продолжительность курса составила 22 + 4,5 дня.
Развитие легочной эмболии, особенно в сочетании с признаками острого ДВС-синдрома в стадии гиперкоагуляции, служило основанием для назначения антикоагулянтной терапии. Начальная доза гепарина составляла 10 тыс. ЕД внутривенно, струйно, за-тем — по 1000 ЕД в час внутривенно, капельно с переходом на подкожное введение до 30 тыс. ЕД в сутки. Введение гепарина осуществлялось под контролем показателей коагулограммы и времени свертывания крови. Одновременно проводились внутривенные трансфузии свежезамороженной плазмы по 300 мл в сутки с добавлением 2500–5000 ЕД гепарина. Анемия тяжелой степени (Нb менее 80 г/л, Ht ≤25) корригировалась переливаниями эритроцитарной массы (пять–семь доз). При наличии гипопротеинемии использовалось введение растворов аминокислот, альбумина или нативной плазмы. Выявление клинических и рентгенологических признаков отека легких на фоне рецидивирующего течения септической ТЭЛА служило показанием для назначения кортикостероидов (преднизолон от 120 до 200 мг в сутки внутривенно капельно). Терапия антикоагулянтами прямого действия в сочетании с трансфузиями криоплазмы проводилась до стойкого улучшения показателей гемостаза. Критериями нормокоагуляции являлись уровень фибриногена в плазме 3-4 г/л, отсутствие тромбоцитопении, нормализация ВСК, АЧТВ, тромбинового времени, а также отрицательные паракоагуляционные тесты. По нашим данным, купирование проявлений острого ДВС-синдрома на стадии гиперкоагуляции у 75% больных отмечалось на седьмой–десятый день от начала комплексной терапии.
У части больных формировалась резистентность к проводимой антибактериальной терапии, которая характеризовалась нарастанием интоксикации, фебрильной лихорадкой, прогрессирующей анемией, а также высевами из крови возбудителя ИЭ – золотистого стафилококка — в 65% наблюдений. При рентгенологическом обследовании данной категории больных с большой частотой определялись очаги деструкции легочной ткани, а у трех больных гнойный выпот в плевральной полости.
Длительное применение антибиотиков широкого спектра действия у 70,3% больных (38 чел.) сопровождалось развитием побочных эффектов антибактериальной терапии. Кандидоз полости рта глотки, пищевода, а также кишечный дисбактериоз III-IV стадии был выявлен у 36 больных (66,7%). Применение антибиотиков с гепатотоксическими свойствами (цефалоспорины, линкозамины, метронидазол) у двух больных (3,7%) с хроническим гепатитом С и В приводило к прогрессированию печеночной недостаточности, которая сопровождалась высокой ферментемией (АЛТ 1500 ЕД, АСТ 1000 ЕД) и желтухой.
Развитие застойной сердечной недостаточности с появлением акроцианоза, влажных хрипов в базальных отделах легких, периферических отеков в сочетании с кардиомегалией и падением фракции выброса до 50—45% наблюдалось у пяти больных (9,3%) на фоне массивной инфузионной терапии.
Длительная антикоагулянтная терапия в 20,4% (11 чел.) наблюдений сопровождалась повышением толерантности плазмы к гепарину, что клинически выражалось в развитии периферических флеботромбозов, в то время как гепарининдуцированной тромбоцитопении в обследуемой группе больных мы не наблюдали.
Положительные результаты консервативной терапии были получены у 70,2% больных (56 чел.) с поражением ТК и лишь у 32% пациентов (6 чел.) из второй группы. Исходом ИЭ в обеих группах больных являлось формирование недостаточности клапанов сердца.
Госпитальная летальность при ИЭ у наркозависимых лиц составила 29,4% (24 чел.), тогда как у больных с поражением левых камер сердца (вторая группа) уровень смертности составил 68% (19 чел.).
По данным аутопсии, основными причинами смерти больных ИЭ были:
- септикопиемия с формированием гнойных очагов в печени, почках селезенке, головном мозге с развитием полиорганной недостаточности (46,2%);
- сердечная недостаточность на фоне полипозно-язвенного эндокардита с разрушением клапанов сердца, а также острый миокардит с дилятацией полостей сердца (39,4%);
- вторичная нефропатия с развитием почечной недостаточности, отеком легких, отеком головного мозга (14,4%).
Таким образом, характерные особенности ИЭ у лиц с наркотической зависимостью — это острое течение заболевания с поражением правых камер сердца и рецидивами септической ТЭЛА. Возбудителем ИЭ у инъекционных наркоманов в 71,3% является высоковирулентный золотистый стафилококк. Формирование недостаточности трехстворчатого клапана I—III степени стало самым распределенным осложнением ИЭ у наркоманов. При этом у большинства больных не наблюдается тяжелых нарушений центральной гемодинамики, приводящих к развитию острой недостаточности кровообращения.
Подострый ИЭ у больных с предрасполагающими заболеваниями сердца, а также у лиц пожилого и старческого возраста протекает с преимущественным поражением левых камер сердца, причем в старшей возрастной группе преобладает моноклапанное поражение. Наличие сопутствующей патологии у лиц старше 60 лет маскирует течение основного заболевания, чем и обусловлены поздняя диагностика и высокая смертность больных. Для затяжного течения ИЭ характерна низкая высеваемость возбудителя, по сравнению с острыми формами заболевания. Развитие тромбоэмболий сосудов большого круга кровообращения является характерной клинической особенностью подострого ИЭ.
Положительный эффект от проводимой консервативной терапии наблюдается у большинства больных ИЭ с поражением ТК, тогда как при подостром эндокардите левых камер сердца консервативная терапия является малоэффективной у большинства больных.
Госпитальная летальность в обеих группах больных обусловлена диссеминацией возбудителя с формированием гнойных очагов и полиорганной недостаточностью, а также развитием острой недостаточности кровообращения и вторичной нефропатии.
Литература
- Буткевич О. М., Виноградова Т. Л. Инфекционный эндокардит. - М., 1997.
- Симоненко В. Б., Колесников С. А. Инфекционный эндокардит: современное течение, диагностика, принципы лечения и профилактики. - Клин. мед., 1999. - 3. - С. 44-49.
- Тазина С. Я., Гуревич М. А. Современный инфекционный эндокардит. - Клин. мед.,1999. - 12. - С. 19-23.
- Bansal R. C. Infective endocarditis. Med Clin North America 1995; 79 (5): 1205-1239.
- Bayer A. S., Bolger A. F., Taubert K. A. et al. Diagnosis and management of infective endocarditis and its complications. Circulation 1998; 98: 2936-2948.
- McKinsey D. S., Ratts T. E., Bisno A. I. Underlying cardiac lesions in adults with infective endocarditis. The changing spectrum. Amer J Med 1987; 82: 681-688.
- Lamas C. C. Eykyn S. J. Suggested modifications to the Duke criteria for the clinical diagnosis of native valve and prosthetic valve endocarditis: analysis of 118 pathologically proven cases. Clin Infect Dis 1997; 25: 713-719.
- Durack D. T., Lukes A. S., Bright D. K. et al. New criteria for diagnosis of Infective Endocarditis Utilization of Specific Echocardiographic Finding. Amer J Med 1994; 96: 200-209.
- Тюрин В. П., Дубинина С. В. Инфекционный эндокардит у лиц пожилого и старческого возраста. - Клин. мед., 2000. - 4. - С. 53-56.
В. И. Уланова
В. И. Мазуров, доктор медицинских наук, профессор
Медицинская академия последипломного образования, Санкт-Петербург
Читайте также:

