Уреаплазма цистит молочница
Обновлено: 18.04.2024
Активное вещество: доксициклин в виде доксициклина моногидрата 100,0 мг.
Вспомогательные вещества: целлюлоза микрокристаллическая, сахарин, гипролоза (низкозамещённая), гипромеллоза, кремния диоксид коллоидный (безводный), магния стеарат, лактозы моногидрат.
Описание
Фармакотерапевтическая группа
Фармакологические свойства
ФармакодинамикаМеханизм действия
Доксициклин ингибирует синтез бактериальных протеинов путём связывания с 30S субъединицей рибосомы. Доксициклин проявляет бактериостатическую активность в отношении против широкого спектра грамположительных и грамотрицательных организмов.
Механизм резистентности
Резистентность, как правило, зависит от плазмид или транспозонов. Первичный механизм представляет собой повышенный отток (эффлюкс) тетрациклина из бактериальной клетки.
Может присутствовать значительная местная разница в процентном содержании устойчивых штаммов с природной резистентностью.
Было установлено, что некоторые штаммы Streptococcus pyogenes, Streptococcus pneumoniae и Enterococcus faecalis устойчивы к тетрациклинам. Поэтому тетрациклины не должны использоваться для лечения стрептококковых инфекций, если не будет получено подтверждение чувствительности микроорганизма. Для лечения инфекций верхних дыхательных путей, вызванных бета-гемолитическими стрептококками группы А (а также для профилактики острого ревматизма), предназначены другие препараты.
Перекрёстная резистентность
Перекрёстная резистентность в группе тетрациклинов является нормой.
Тесты на чувствительность
Используя стандартизированные методы для определения значения минимальной ингибирующей концентрации (МИК), для доксициклина со стороны EUCAST установлены следующие критерии:
Staphylococcus spp.: S ≤ 1 мг/л, R > 2 мг/л
Streptococcus групп A, B, C, G: S ≤ 1 мг/л, R > 2 мг/л
Streptococcus pneumoniae: S ≤ 1 мг/л, R > 2 мг/л
Haemophilus influenzae: S ≤ 1 мг/л, R > 2 мг/л
Moraxella catarrhalis: S ≤ 1 мг/л, R > 2 мг/л
Возникновение резистентности может варьировать как географически, так и в течение времени для выбранных микроорганизмов. Локальная информация о приобретённой резистентности желательна, особенно при лечении серьёзных инфекций. Если локальная распространённость резистентности настолько высока, что использование доксициклина для лечения некоторых инфекций вызывает сомнения, то в данном случае могут потребоваться консультации экспертов.
| Микроорганизмы, как правило, чувствительные к доксициклину: |
| Грамположительные аэробные микроорганизмы: |
| - Bacillus cereus |
| - Bacillus anthracis |
| - Staphylococcus aureus |
| |
| Грамотрицательные аэробные микроорганизмы: |
| - Brucella spp. |
| - Haemophilus influenzae |
| - Moraxella catharrhalis |
| - Vibrio cholerae |
| - Yersinia pestis |
| |
| Прочие: |
| - Borrelia burgdorferi |
| - Bartonella spp. |
| - Burkholderia pseudomallei |
| - Chlamydia trachomatis |
| - Chlamydophila pneumoniae |
| - Chlamydophila psittaci |
| - Coxiella burnettii |
| - Francisella tularensis |
| - Leptospira spp. |
| - Mycoplasma pneumoniae |
| - Rickettsia spp. |
| - Treponema pallidum |
| - Ureaplasma urealyticum |
| |
| Микроорганизмы, которые могут приобретать устойчивость: |
| Грамположительные аэробные микроорганизмы: |
| - Enterococcus spp. |
| - Streptococcus pneumoniae |
| Грамотрицательные аэробные микроорганизмы: |
| - Escherichia coli |
| - Klebsiella spp. |
| - Pasteurella multocida |
| |
| Анаэробные бактерии: |
| Propionibacterium acnes |
| Микроорганизмы, резистентные в силу своей природы |
| Грамотрицательные аэробные микроорганизмы: |
| - Acinetobacter spp. |
| - Proteus mirabilis |
| - Proteus vulgaris |
| - Pseudomonas spp. |
| - Serratia spp. |
Результаты исследования, во время которого резус-макакам вводили ингаляционную форму сибирской язвы (вызванной Bacillus anthracis), показали выживание 9/10 животных, которые получали доксициклин дважды в сутки в течении 30 дней, начиная с 1 дня воздействия патогена. Все 9 резус-макак, получавших доксициклин в сочетании с человеческой противосибиреязвенной вакциной в 1 и 15 день, выжили в эксперименте.
Недостаточно клинических данных об эффективности доксициклина при лечении сибирской язвы у человека. Лечащий врач должен руководствоваться действующими национальными и/или международными консенсусными документами в отношении лечения сибирской язвы.
Недостаточно клинических данных об эффективности доксициклина при лечении чумы (вызванной Yersinia pestis) и туляремии (вызванной Francisella tularensis) у людей. Лечащий врач должен руководствоваться действующими национальными и/или международными консенсусными документами в отношении лечения чумы и туляремии.
Доксициклин может назначаться (для приема перорально) для профилактики малярии. Лечащий врач должен руководствоваться действующими национальными и/или международными консенсусными документами в отношении химиопрофилактики против малярии.
Фармакокинетика
Всасывание
При приёме внутрь доксициклин характеризуется практически полной абсорбцией. Приём пищи либо молока незначительно влияет на абсорбцию доксициклина.
Уровень доксициклина в плазме крови 1,5-3 мг/л достигается при приёме стандартной дозы 200 мг в первый день терапии и 100 мг в сутки в последующие дни.
Средний уровень доксициклина в плазме крови 2,6-3,0 мг/л достигается через 2 ч и снижается примерно до 1,5 мг/л через 24 ч.
Распределение
Доксциклин связывается с белками примерно на 90%.
Объем распределения 1,6 л/кг. Доксициклин хорошо проникает в ткани, но плохо проходит через гематоэнцефалический барьер. Концентрация доксициклина в спинномозговой жидкости увеличивается при воспалении спинномозговой оболочки.
Доксициклин накапливается в дентине и костной ткани (в том числе у плода). Доксициклин проникает через плацентарный барьер и экскретируется в грудное молоко.
Концентрация в крови плода примерно в 0,3 раза превышает концентрацию в крови матери. Концентрация в амниотической жидкости примерно в 0,3 раза выше концентрации в крови матери. Концентрация в грудном молоке достигает 30-40% от сывороточной концентрации.
Метаболизм
Первичные пути метаболизма доксициклина не установлены, однако индукторы ферментов сокращают период полувыведения доксициклина.
Выведение
Период полувыведения доксициклина составляет около 20 часов. Более 40% абсорбированного доксициклина выводится почками посредством клубочковой фильтрации. Препарат также выводится через кишечник в виде неактивных форм (хелатов).
Несмотря на то, что печенью выводится очень небольшой процент дозы препарата, концентрации в желчи обычно в 5-10 раз превышают плазменные концентрации.
Фармакокинетика в особых клинических случаях
Пациенты с печёночной недостаточностью
Особые даные о фармакокинетике препарата у пациентов с печёночной недостаточностью отсутствуют.
Пациенты с почечной недостаточностью
Выведение доксициклина почками составляет около 40%/72 часов у лиц с нормальной функцией почек. При тяжелой почечной недостаточности (клиренс креатинина менее 10 мл/мин) данный показатель может быть снижен до 1-5%/72 часа. Исследования показали отсутствие существенной разницы в периоде плазменного полувыведения доксициклина у пациентов с нормальной функцией почек и тяжелой почечной недостаточностью, так как сниженное выведение почками компенсируется повышенным выведением через кишечник.
Гемодиализ не влияет на концентрацию доксициклина в плазме крови.
Доклинические данные по безопасности
Нежелательные эффекты, наблюдаемые после многократных доз у животных, включали гиперпигментацию щитовидной железы и дегенерацию канальцевого аппарата в почках. Данные эффекты наблюдались при воздействии в дозе приблизительно на уровне терапевтической дозы для человека. Клиническая значимость таких результатов неизвестна.
Доксициклин не проявляет мутагенной активности; убедительные доказательства кластогенной активности отсутствуют. Исследования канцерогенности у крыс показали наличие доброкачественных опухолей в ткани молочных желез (фиброаденома), матки (полипы) и щитовидной железы (аденома С-клеток) у самок.
У крыс доза доксициклина на уровне 50 мг/кг/сутки приводила к снижению линейной скорости сперматозоидов без негативного эффекта на фертильность самцов или самок, или морфологию спермы. Дозы, превышающие 50 мг/кг/сутки, отрицательно влияли на фертильность и репродуктивную функцию крыс. Исследования токсичности в перинатальный и постнатальный периоды у крыс не показали каких-либо существенных отрицательных воздействий в терапевтических дозах. Доксициклин проникает через плаценту, и данные литературы показывают, что тетрациклины могут проявлять токсический эффект на развивающийся плод (изменение цвета зубов и замедление роста плода).
Показания к применению
Противопоказания
Способ применения и дозы
Следует помнить, что обычная доза и частота приёма доксициклина отличается от дозы и частоты приёма большинства других тетрациклинов. Превышение рекомендуемой дозы может привести к увеличению частоты побочных эффектов.
Педиатрические пациенты
Детям старше 8 лет с массой тела менее 50 кг препарат применяется в средней суточной дозе 4 мг/кг в один приём в первый день лечения, в последующие дни – по 2 мг/кг в сутки в 1 приём. B случае тяжёлой инфекции препарат назначают в дозе 4 мг/кг в сутки на протяжении всего курса лечения. Для достижения точной дозы препарат может применяться в форме суспензии. Не следует ломать таблетки для уменьшения дозы.
Взрослым и детям с массой тела 50 кг и более назначают 200 мг в 1-2 приема в первый день лечения, далее по 100 мг ежедневно. В случаях тяжёлых инфекций препарат назначают в дозе 200 мг ежедневно в течение всего лечения.
Продолжительность лечения
Доксициклин следует принимать в течение, по крайней мере, 24-48 ч после исчезновения симптомов инфекции и лихорадки.
Продолжительность лечения инфекции, вызванной бета-гемолитическим стрептококком (S. pyogenes), должна составлять не менее 10 дней.
Особенности дозирования при некоторых заболеваниях.
Неосложнённые уретрит, вызванный Chlamidia trachomatis, эндоцервикальные и ректальные инфекции у взрослых, негонококковый уретрит, вызванный Ureaplasma urealyticum: 200 мг в сутки в течение 7 дней.
Первичный и вторичный сифилис: по 200 мг в сутки в течение, как минимум, 14 дней.
Венерическая гранулёма: по 200 мг в сутки в течение 21 дня.
Болезнь Лайма: 200 мг ежедневно в течение 10-21 дней (на ранней стадии заболевания); до 1 месяца в случае возникновения более поздних симптомов заболевания.
Сибирская язва (ингаляционная форма; после экспозиции):
Взрослые: 100 мг доксициклина внутрь два раза в сутки в течении 60 дней.
Дети: с массой тела менее 45 кг-2,2 мг/кг массы тела внутрь два раза в сутки в течении 60 дней. Дети с массой тела 45 кг и более должны получать дозу взрослых
Сибирская язва (кожная форма):
Взрослые: 100 мг доксициклина внутрь два раза в сутки в течении 60 дней.
Сибирская язва (желудочно-кишечная форма):
Взрослые: начальная доза 100 мг доксациклина внутрь два раза в сутки, как часть комбинированной терапии в течении 60 дней.
Лечение малярии, вызванной хлорохинрезистентным Plasmodium falciparum:
Взрослые: 200 мг/сут в течение, по крайней мере, 7 дней.
Дети старше 8 лет: 2,2 мг/кг массы тела внутрь два раза в сутки в течении, как минимум, 7 дней (не более 200 мг/сут).
Учитывая потенциальную тяжесть инфекции, одновременно с доксициклином следует применять быстродействующий шизонтоцидный препарат, например, хинин, рекомендуемые дозы которого, отличаются в разных регионах.
Профилактика:
Дети старше 12 лет и взрослые: 100 мг в сутки. Начинать приём следует за 1-2 дня до отправления в регионы с высокой распространённостью малярии. Применять на протяжении всего пребывания в регионе и продолжать прием в течение 4 недель после посещения эндемичного района.
Противомалярийные средства рекомендуется применять в соответствии с национальными
и международными рекомендациями (ВОЗ) по лечению и профилактике малярии.
Доксициклин следует применять с осторожностью у пациентов с нарушением функции печени или у пациентов, применяющих потенциально гепатотоксические лекарственные препараты.
Применение у пациентов с нарушением функции почек.
В исследовании не было продемонстрировано значимых различий в периоде полувыведения доксициклина из плазмы крови (примерно 20 часов) у пациентов с нормальной функцией почек и у пациентов с нарушением функции почек тяжелой степени. Таким образом, у пациентов с нарушением функции почек коррекции дозы не требуется.
Пациенты пожилого возраста: дозы как для взрослых.
При пропуске очередного приёма препарата следует принять пропущенную дозу. Прием следующей дозы необходимо произвести через установленное время от последнего приема. Не удваивать дозу для компенсации пропущенного приёма.
Способ применения
Таблетки следует принимать, запивая достаточным количеством воды. Таблетки также можно растворить в небольшом количестве воды (около 20 мл) с получением суспензии. Предпочтительно принимать во время еды. Таблетки следует принимать в положении сидя или стоя для снижения риска развития эзофагита и язвы пищевода. Препарат не следует принимать непосредственно перед сном.
Побочное действие
Побочные эффекты перечислены ниже в соответствии с системами MedDRA/классами систем органов и частотой встречаемости. Частота встречаемости определялась следующим образом: очень часто (≥1/10), часто (≥1/100,
Передозировка
Взаимодействия с другими лекарственными средствами
Абсорбция доксициклина может подавляться образованием биологически неактивных хелатных комплексов с ионами металлов, которые содержатся в антацидах, солях железа и солях висмута. Следует избегать одновременного применения с антацидами, содержащими алюминий, кальций либо магний, препаратами железа либо висмута (имеются в виду формы для перорального применения). Активированный уголь и ионообменные препараты (колестирамин) могут снижать всасывание доксициклина. Следовательно, такие лекарственные средства следует принимать через 2-3 часа после приёма доксициклина.
Квинаприл может снижать абсорбцию доксициклина ввиду высокого содержания магния в таблетках квинаприла.
Лекарственные средства, повышающие рН желудка, могут иметь отрицательное влияние на абсорбцию тетрациклинов, которые лучше растворяются в кислотной среде, чем в щелочной.
Ввиду того, что доксициклин может приводить к удлинению протромбинового времени, он стимулирует активность антикоагулянтов в составе комбинированной терапии. Может потребоваться снижение дозы антикоагулянта.
Ввиду того, что бактериостатические лекарственные средства могут влиять на бактерицидную активность бета-лактамных антибиотиков, таких как пенициллины, следует избегать одновременного применения доксициклина с бета-лактамными антибиотиками.
Индукторы микросомальных ферментов печени, такие как рифампицин, барбитураты, карбамазепин, дифенилгидантоин, примидон, фенитоин и постоянный приём алкогольных напитков могут повышать метаболизм доксициклина в печени и, тем самым, сокращать период полувыведения. Это может приводить к появлению субтерапевтических концентраций доксициклина. Следует рассмотреть возможность повышения суточной дозы доксициклина.
Сообщалось о летальных случаях в результате развития почечной токсичности при одновременном применении тетрациклинов и метоксифлурана.
Доксициклин может увеличивать концентрацию циклоспорина в плазме крови; следует проводить тщательный мониторинг при одновременном применении.
Показано, что доксициклин усиливает гипогликемический эффект производных сульфонилмочевины. При сочетанном применении данных лекарственных средств требуется пристальный контроль уровней сахара в крови. При необходимости требуется снижение дозы производных сульфонилмочевины.
При применении доксициклина незадолго до начала, в процессе либо после курса ретиноидов (например, ацитретина, изотретиноина) существует риск развития обратимой внутричерепной гипертензии в результате взаимного усиления действия препаратов. Поэтому рекомендуется избегать совместного применения доксициклина и ретиноидов.
Тетрациклины могут влиять на показатель глюкозы в моче.
Влияние на результаты лабораторных анализов: возможно ложное повышение концентраций катехоламинов в моче в результате влияния на результаты теста с флуоресцеином.
Меры предосторожности
Применение при беременности и в период грудного вскармливания
Влияние на способность управлять транспортными средствами и работать с механизмами
Упаковка
Таблетки диспергируемые 100 мг. По 10 таблеток в блистере из ПВХ/алюминиевой фольги. По 1 блистеру вместе с инструкцией по применению в картонную пачку.
103.by разговаривает о причинах возникновения цистита после секса, о лечении воспаления мочевого пузыря и об опасности самолечения с акушер-гинекологом.

Причины возникновения
Воспаление в мочевом пузыре, или цистит, может возникнуть при восходящем пути инфицирования (заражение инфекциями, передающимися половым путем, нарушение правил гигиены, микротравматизм), а также исходящем пути (заболевание почек, мочекаменная болезнь).
Чаще всего циститы возникают при инфицировании на фоне сниженного иммунитета при частой смене половых партнеров.
Нестандартные способы инфицирования
Иногда цистит возникает при смене способов сексуального удовлетворения. Например, если был анальный, а затем вагинальный секс или оральный без соблюдения правил гигиены. Микробная флора из полости рта может попадать в мочеполовой тракт — происходит заражение.

Инфекции, которые ждут своего времени
Наиболее часто возникает цистит при заражении инфекциями, передающимися половым путем (грамм+; грамм -; Е.coli; мико- и уреаплазмы).
В некотором количестве эта микробная флора есть у всех. При определенных условиях (стрессовая ситуация в организме, снижение иммунитета, микротравма) количество микроорганизмов повышается и инфекция активизируется.
Запущенная форма инфекции приводит к хроническому циститу. ИППП обязательно нужно лечить. Схема лечения включает антибактериальную терапию, фитотерапию, витаминотерапию, препараты коррекции иммунитета, а также физиотерапию.

Цистит лечит, как правило, уролог. Однако чаще всего пациенты обращаются именно к гинекологу. При подозрении на цистит проводится обследование с забором мазков на микрофлору, ПЦР на ИППП, сдается анализ мочи. При тяжелых формах цистита, которые не поддаются лечению, выполняется цистоскопия с целью исключения органических поражений.
Важный момент при лечении цистита — коррекция иммунитета. Как правило, многие заболевания возникают на фоне стресса: толчком может послужить психоэмоциональный стресс, переохлаждение или гипертермическое воздействие, первый половой контакт или частая смена половых партнеров.
Самолечение чревато тем, что острый цистит может перерасти в хронический. А при частом воспалении стенка мочевого пузыря повреждается и на месте более глубокого поражения могут образовываться язвы, полипы, возможна малигнизация — формирование злокачественных образований.

На самом деле, такой болезни не существует. Ни в одном международном руководстве, ни в одном англоязычном научном журнале встретить ее невозможно. Там что, не знают про уреаплазмы? Знают, и давно и тщательно все изучили.
И вот что получается:
Уреаплазмы – нормальный компонент флоры влагалища женщины.
Во влагалище здоровой женщины обитает более миллиона бактерий, которые относятся к тремстам разным видам. Уреаплазмы – одни из них. Они обнаруживаются примерно у 50% здоровых женщин.
Уреаплазмы – это не инфекции, передаваемые половым путем! Они совершенно спокойно обнаруживаются у девственниц и у бабушек, у монахинь и учительниц, и даже у гинекологов и дерматовенерологов.
Уреаплазмы, как и другие компоненты микрофлоры, иногда все же могут приводить к развитию воспаления, но это воспаление чаще всего затрагивает органы мочевой системы: уретра (чаще у мужчин), мочевой пузырь (цистит), почки. Обращаю внимание, что в этой ситуации уреаплазмы ведут себя в точности так же, как, например, кишечная палочка: кишечная палочка может вызывать и цистит, и пиелонефрит, и даже сепсис, но она живет в каждом здоровом организме. Значит ли это, что мы должны лечить всех поголовно от кишечной палочки? Конечно, нет! Та же история и с уреаплазмами.
Очень распространенное заблуждение: уреаплазмы приводят к бесплодию, выкидышам, преждевременным родам, внутриутробным инфекциям и т.д. Это очень большое преувеличение. Ни в одни международные руководства по бесплодию, выкидышам, преждевременным родам, и т.д. не входит обследование на наличие уреаплазм и (тем более!) лечение.
Уреаплазмы никак не влияют на течение и исход беременности. Но поскольку уреаплазмы есть у многих женщин, то очень легко списать все проблемы на то, что почти всегда обнаруживается. К сожалению, так и происходит.
Так или иначе, если есть необходимость выявить уреаплазмы (хотя мне такую необходимость представить сложно), нужно сдавать мазок (исследование методом ПЦР или посев (он же культуральный метод, он же микробиологическое исследование)). Если у Вас выявили уреаплазмы и собираются лечить, а симптомов заболевания у вас нет, задумайтесь и проконсультируйтесь с еще одним специалистом. Если Вам предлагают сдать кровь на антитела к уреаплазмам, бегите быстрее из этой клиники.
Что такое уреаплазмоз? Причины возникновения, диагностику и методы лечения разберем в статье доктора Ковалык Владимира Павловича, уролога со стажем в 27 лет.
Над статьей доктора Ковалык Владимира Павловича работали литературный редактор Елена Бережная , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Уреаплазмоз — группа воспалительных и дисбиотических заболеваний, ассоциированных с уреаплазмами (Ureaplasma species). С 1995 г. различают два вида уреаплазм: Ureaplasma urealyticum и Ureaplasma parvum. Геном U.urealyticum значительно больше U.parvum. В настоящее время невозможно утверждать, что какой-либо из видов является явным патогеном или наоборот — сапрофитом.
Уреаплазмы — условно-патогенные микроорганизмы, которые часто обнаруживаются на слизистых оболочках мочеполовых органов, верхних дыхательных путей и в рото-носоглотке.
В 2021 году профессиональные российские сообщества перестали разрабатывать официальные клинические рекомендации по ведению больных с Ureaplasma spp. и Mycoplasma hominis. Согласно позиции Международного союза по борьбе с инфекциями, передаваемыми половым путём, активное выявление этих микроорганизмов и лечение приносит больше вреда, чем пользы, так как из-за него устойчивость к антибиотикам развивается у действительно опасных инфекций. Поэтому антибиотики при выявлении этих бактерий нужно применять только при наличии симптомов.
Впервые уреаплазмы были выделены в США от темнокожего больного негонококковым уретритом в 1954 г. [1]
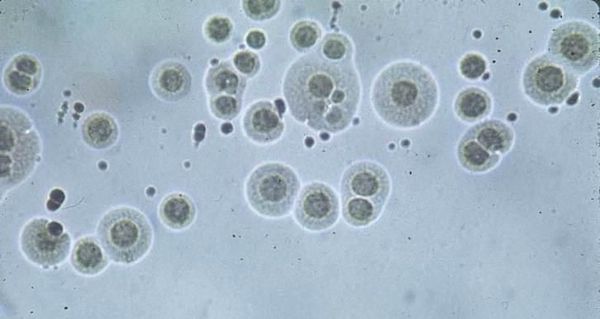
Первое попадание уреаплазм в мужскую уретру, как правило, вызывает уретрит — воспаление мочеиспускательного канала. Имеются данные о том, что у женщин уреаплазмы ассоциированы с острыми воспалительными заболеваниями органов малого таза (ВЗОМТ), а также с бактериальным вагинозом. Доказана роль уреаплазм в возникновении бронхолегочных заболеваний у новорожденных (бронхит, пневмония) и послеродового хорионамнионита. [2]
Роль уреаплазм в патологии человека до конца не установлена. Продолжается изучение патогенетической связи этих микроорганизмов с широким спектром заболеваний из разных сфер:
- заболевания мочеполовых органов у мужчин: бесплодие, простатит, везикулит, эпидидимоорхит; [3]
- урогенитальная патология у женщин: ВЗОМТ, бесплодие, воспаление бульбовагинальной железы;
- патология новорождённых. Существуют данные о том, что наличие уреаплазм приводит к низкому весу новорождённого и снижению балла по шкале Апгар;
- патология рожениц: преждевременные роды, преждевременный разрыв околоплодного пузыря, привычный выкидыш, замершая беременность и т. д.; , цистит. Уреаплазмы выявляли в удалённых из почек конкрементах в биоптатах мочевого пузыря, а эксперименты по инфицированию мышей приводили к появлению у них уратных камней в почках.
Уреаплазмы зачастую входят в состав нормальной микрофлоры уретры и влагалища. Частота выявления уреаплазм составляет в среднем 40% в мочеполовых органах у женщин и 5-15% у мужчин. При этом U.parvum обнаруживается значительно чаще, чем U.urealyticum (38% против 9%). [4]
Как передаётся уреаплазма
Уреаплазмы распространяются посредством сексуальных контактов. Чем больше сексуальных партнёров в течение жизни, тем чаще колонизация уреаплазмами влагалища или уретры. Уреаплазмы передаются новорождённым при прохождении через родовой канал. При этом происходит колонизация слизистой вульвы и влагалища у девочек и носоглотки у обоих полов. Частота выявления уреаплазм у новорожденных может достигать 30% и выше, снижаясь до нескольких процентов к первому году жизни. [5]
В последующем рост частоты колонизации уреаплазмами начинается с момента начала половой жизни (в 14-18 лет).
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы уреаплазмоза
Симптоматика различается в зависимости от возникшего заболевания.
Уреаплазмоз у мужчин
У мужчин может возникать уретрит, который проявляется скудными выделениями и жжением в мочеиспускательном канале, учащенным мочеиспусканием. Без лечения уретрит склонен к саморазрешению: симптомы затихают, пациент успокаивается. Перенесённый уретрит увеличивает вероятность возникновения в будущем воспаления предстательной железы — простатита. Кроме того, осложнениями уретрита могут быть эпидидимоорхит — воспаление яичка и его придатка, везикулит — семенного пузырька и, редко, куперит — бульбоуретральной железы.
Уреаплозмоз у женщин
У женщин под влиянием уреаплазм может развиваться сальпингоофорит, эндометрит и вагиноз.
Острый сальпингоофорит, эндометрит могут проявляться тянущими болями внизу живота, лихорадкой, слабостью и выделениями из вагины. Воспалительные заболевания тазовых органов у женщин — закономерное следствие бактериального вагиноза, наблюдаемого при выявлении уреаплазм. Симптомы заболевания могут быстро усугубляться, нередко требуется госпитализация в гинекологический стационар.
Помимо воспалительных заболеваний уреаплазмы, помимо многих других микроорганизмов, ассоциированы с бактериальным вагинозом.
Бактериальный вагиноз, как правило, сопровождается выделениями с неприятным запахом, который к тому же усиливается во время близости.
Заболевание предрасполагает к акушерско-гинекологическим осложнениям: преждевременным родам, рождению с низким весом.
Автор статьи разделяет взгляды мировых экспертов в области урогенитальной патологии (Jenny Marazzo, Jorma Paavonen, Sharon Hillier, Gilbert Donders) на отсутствие связи уреаплазм с возникновением цервицита и вагинита. [6] [7] [8]
Здесь необходимо заметить, что российский гайдлайн призывает проводить лечение цервицита и вагинита, базируясь на этиологической роли уреаплазм при этих заболеваниях, что, конечно же, является ошибкой. [17]
Уреаплазмоз у детей
У девочек в большинстве случаев уреаплазмы не вызывают каких-либо заболеваний, наблюдается здоровое носительство. Изредка развивается воспаление вульвыи/или влагалища. У новорождённых девочек и мальчиков повышен риск развития бронхолёгочной дисплазии.
Патогенез уреаплазмоза
Уреаплазмы — условно-патогенные микроорганизмы, т. е. их болезнетворные свойства реализуются только при особых условиях: высокая концентрация на слизистой, иммуносупрессия и другие.
Уреаплазмы прикрепляются к поверхности слизистой оболочки с помощью цитоадгезиновых протеинов. Кроме уретрального эпителия уреаплазмы способны прикрепляться к эритроцитам и сперматозоидам.
Одним из основных факторов патогенности являются ферменты фосфолипаза А и С, под влиянием которых в организме вырабатывается простагландин — фактор, запускающий сокращения непроизвольных мышц, следовательно, возможны преждевременные роды. Воспалительная реакция сопровождается выработкой провоспалительных цитокинов — IL 6, 8, 10.
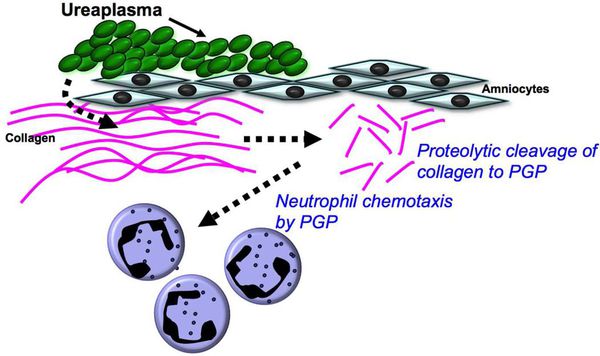
Уреаплазмы обладают IgA-протеазной активностью, разрушая местный защитный фактор слизистой оболочки иммуноглобулин А. [9]
Воспалительный процесс в мочеиспускательном канале развивается при большой концентрации уреаплазм. Так показано, что 10 3 КОЕ/мл и выше ассоциировано с выявлением 12 и более лейкоцитов на мл в уретральном содержимом. [10]
Особые факторы патогенеза реализуются при возникновении бактериального вагиноза. При этом ослабевают факторы местного иммунитета слизистой, благодаря чему такие пациентки более подвержены инфицированию инфекциями, передаваемыми половым путём (в т. ч. ВИЧ). Кислотность вагинального содержимого (рН в норме 3,5-4,5) снижается до нейтральной среды (рН 6,5-7 и выше). Таким образом, ослабевает естественный защитный барьер против болезнетворных микроорганизмов.
Классификация и стадии развития уреаплазмоза
По длительности протекания различают острый и хронический уретрит. Острый уретрит — до 2 месяцев, хронический — более 2 месяцев. В последнем случае различают рецидивирующий и персистирующий уретрит.
Хроническим рецидивирующим уретритом считается заболевание, при котором лейкоциты в уретре к концу лечения пришли в норму, а через 3 месяца — вновь наблюдался их подъём свыше 5 в поле зрения (при увеличении х1000). Хронический персистирующий уретрит — когда повышенное содержание лейкоцитов наблюдалось к концу лечения и через 3 месяца. [11]
ВЗОМТ подразумевает вовлечение в процесс маточных труб, яичника и их связок. Воспаление придатков может быть одно- и двухсторонним, острым или хроническим. Основные симптомы: боль внизу живота, в пояснице, выделения из половых органов, температура 38˚С и выше. [12]
Осложнения уреаплазмоза
У мужчин осложнениями уретрита являются баланопостит — воспаление головки и крайней плоти полового члена. Также возможны простатит, реже — эпидидимоорхит и шеечный цистит. При этом уреаплазмы не рассматриваются в качестве самостоятельного агента, вызывающего воспаление предстательной железы. Вероятно, эта цепь осложнений возникает посредством заднего уретрита и реализуется с помощью уретропростатического рефлюкса, т. е. заброса содержимого задней уретры в ацинусы простаты и семявыносящие протоки. [13]
У женщин ВЗОМТ может осложняться тубоовариальным абсцессом, изредка возникают перитонит и сепсис. В отдалённые сроки возможны серьёзные осложнения, имеющие социальные последствия: хроническая тазовая боль, внематочная беременность и бесплодие.
Маловероятно, что только лишь наличие уреаплазм в биоценозе влагалища приведёт к таким осложнениям. Свой патогенный потенциал эти микроорганизмы реализуют совместно с другими микроорганизмами, приводящими к дисбиотическим изменениям — бактериальному вагинозу. [14]
Диагностика уреаплазмоза
Показанием для назначения исследований для выявления уреаплазм являются клинические и/или лабораторные признаки воспалительного процесса: уретрит, ВЗОМТ. Не следует проводить рутинные исследования всем пациентам, в т.ч. без признаков какого-либо заболевания.
Для выявления уреаплазм используются только прямые методы выявления: бактериологический и молекулярно-генетический. Определение антител: IgG, IgA, IgM неинформативно. Материалом для исследования могут служить отделяемое мочеполовых органов, моча, вагинальный секрет и др.
Прямая иммунофлюоресценция (ПИФ) и иммунофлюоресцентный анализ (ИФА) менее информативны при уреаплазмозе, чем молекулярно-генетические и бактериологические исследования. Их применяют только при отсутствии последних.
Бактериальный вагиноз верифицируют с помощью критериев Амсела:
При наличии любых 3-х из 4-х критериев диагноз является установленным. Тем не менее, ввиду трудоёмкости выполнения, невозможности измерения рН оценка критериев Амсела затруднена.
Лечение уреаплазмоза
Лечение уреаплазмоза показано только в тех случаях, когда в результате обследования выявлена очевидная связь уреаплазм с воспалительным процессом. В случае здорового носительства уреаплазм лечение не показано. Порочной является практика назначения терапии всем лицам, у которых выявлены уреаплазмы.
Лечение показано донорам спермы и при бесплодии, когда других его причин не выявлено.
Недавние бактериологические исследования показали высокую активность в отношении уреаплазм Доксициклина, Джозамицина и ряда других антимикробных препаратов.
Схема лечения уреаплазмоза
Согласно клиническим рекомендациям Российского общества дерматовенерологов при неосложнённом заболевании — уретрит — проводят 10-дневные курсы лечения уреаплазмоза:
- Доксициклин моногидрат 100 мг по 1 таб. 2 раза в день;
- или Джозамицин 500 мг по 1 таб. 3 раза в день.
При персистенции воспалительного процесса курс лечения уреаплазмоза может быть продлён до 14 дней. [17]
При выявлении бактериального вагиноза назначают вагинальные препараты:
- Метронидазол вагинальный гель0,75% на ночь 5 г в течение 5 дней;
- или Клиндамицин крем 2% на ночь в течение 7 дней. [18]
Особенности лечения уреаплазмоза при беременности
При беременности по назначению врача можно применять препараты из группы макролидов и азалидов (Джозамицин, Азитромицин).
Прогноз. Профилактика
Ограничение числа сексуальных партнёров, применение барьерных методов контрацепции уменьшают колонизацию уреаплазм. В тех случаях, когда уже имеется носительство уреаплазм, необходимо профилактическое обследование и консультация у профильных специалистов перед:
Что такое вагинальный кандидоз (молочница)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Соснина А. С., гинеколога со стажем в 15 лет.
Над статьей доктора Соснина А. С. работали литературный редактор Вера Васина , научный редактор Сергей Федосов и шеф-редактор Лада Родчанина

Определение болезни. Причины заболевания
Вагинальный кандидоз (кандидозный вагинит) — поражение слизистой оболочки влагалища дрожжеподобными грибами рода Candida. В быту эту болезнь называют молочницей .
Краткое содержание статьи — в видео:
Candida — это условно-патогенные микроорганизмы, факультативные анаэробы (организмы, способные жить как в присутствии кислорода, так и без него). Они обладают тропизмом — направлением роста на клетки богатые гликогеном, в частности клетки слизистой оболочки влагалища. Самый распространённый вид возбудителя, который встречается в 70—90 % случаев, — Candida albicans.
В последние годы растёт заболеваемость кандидозом, вызванным другими представителями рода Candida. Наиболее часто выявляются:
- С. glabrata (15 %);
- C. dubliniensis (6 %);
- C. tropicalis (3—5 %);
- C. parapsilosis (3 %);
- C. krucei (1—3 %).
Распространение новых видов микроорганизмов связано в первую очередь с бесконтрольным самолечением пациенток, приводящем к возрастающей устойчивости грибов к препаратам [3] [4] .
Частота кандидозного вагинита среди инфекционных заболеваний влагалища и вульвы составляет 30—45 %. Патология занимает второе место среди всех инфекционных заболеваний влагалища и является крайне распространённым поводом для обращения женщин за медицинской помощью. По данным J. S. Bingham (1999):
- к 25 годам около 50 % женщин репродуктивного возраста сталкивались с хотя бы одним диагностированным врачом эпизодом вагинального кандидоза;
- к началу периода менопаузы — около 75 % [17] .
Кандидозный вагинит редко наблюдается в постменопаузе, за исключением тех пациенток, которые получают гормональную заместительную терапию.
Предрасполагающими факторами заболевания являются:
- Механические — ношение синтетического белья, первый половой контакт, травматическое повреждение тканей влагалища, длительное применение внутриматочной спирали.
- Физиологические — беременность, менструация.
- Эндокринные — гипотиреоз, сахарный диабет.
- Иммунодефицитные состояния.
- Ятрогенные (приём антибиотиков, кортикостероидов, иммуносупрессоров, лучевая терапия, химиотерапия, онкологические заболевания, оральные контрацептивы).
- Прочие (авитаминоз, аллергические заболевания, хронические патологии гениталий и желудочно-кишечного тракта).
Заболевание, как правило, не передаётся половым путём, но установлено, что оно связано с характером половых контактов: анально-вагинальным и орогенитальным. Также не исключается вероятность развития кандидозного баланопостита у половых партнёров пациенток с вагинальным кандидозом.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы вагинального кандидоза
Основные симптомы при вагинальном кандидозе:
- жжение и зуд в области влагалища и вульвы;
- творожистые выделения из влагалища;
- расстройства мочеиспускания;
- боль при половом акте.
Зуд может усиливаться после водных процедур, полового акта, ночью во время сна и в период менструации [1] .
В целом симптомы вагинального кандидоза нарастают перед менструацией. При беременности проявление болезни также усугубляется, это связано со снижением иммунитета у беременных женщин.
Объективные признаки вагинального кандидоза:
- отёк и гипермия слизистой оболочки влагалища и наружных половых органов;
- белые или зеленовато-белые наложения на стенках влагалища;
- покраснение слизистой влагалища.
При осложнённом кандидозе на коже наружных половых органов появляются везикулы — пузырьки, возвышающиеся над уровнем кожи или слизистой и заполненные прозрачным или мутным содержимым, которые могут вскрываться и образовывать эрозии. При вагинальном кандидозе также могут наблюдаться трещины слизистой вульвы, задней спайки и перианальной области [2] .
Патогенез вагинального кандидоза
Грибы рода Candida относятся к условно-патогенной микрофлоре, которая присутствует как в окружающей среде, так и на поверхности кожных покровов и слизистых оболочках здорового человека (в полости рта, кишечнике, влагалище). При снижении защитных сил организма возможно повышение адгезивных свойств (способности прилипать) грибов с прикреплением их к клеткам эпителия влагалища, колонизацией слизистой оболочки и развитием воспалительной реакции [7] .
Вагинальный кандидоз зачастую затрагивает только поверхностные слои эпителия влагалища без проникновения возбудителя в более глубокие слои слизистой оболочки. Однако в редких случаях эпителиальный барьер преодолевается и происходит инвазия в подлежащую ткань с последующей гематогенной диссеминацией (распространением возбудителя инфекции из первичного очага заболевания по всему органу или организму посредством кровотока) [8] [9] .
Основные этапы патогенеза:
- Адгезия (прилипание) грибов на слизистой и колонизация.
- Инвазия (проникновение) в эпителий.
- Преодоление эпителиального барьера.
- Проникновение в соединительную ткань.
- Преодоление защитных механизмов ткани.
- Попадание в сосуды.
- Гематогенная диссеминация.
При вагинальном кандидозе воспаление происходит в верхних слоях эпителия влагалища. Причина состоит в том, что поддерживается динамическое равновесие между грибом, который не может проникнуть в более глубокие слои, и организмом, который сдерживает его распространение. Соответственно инфекция может долго развиваться в одном месте, проявляясь творожистыми выделениями из влагалища. Обострение заболевания происходит при сдвиге равновесия между развитием грибов и защитными силами организма.
Классификация и стадии развития вагинального кандидоза
Согласно национальным клиническим рекомендациям [18] , выделяют две формы вагинального кандидоза:
- острую — до трёх обострений в год;
- хроническую (рецидивирующую) — не менее четырёх обострений в год.
По классификации, предложенной D.A. Eschenbach, вагинальный кандидоз подразделяют на два типа:
У женщин различают три формы заболевания:
- вагинит (воспаление влагалища); (воспаление влагалища и вульвы); (воспаление шейки матки).
У мужчин выделяют:
- баланит (воспаление головки полового члена);
- баланопостит (воспаление крайней плоти и головки полового члена); (воспаление мочеиспускательного канала).
Для острой формы вагинального кандидоза характерны выраженные симптомы: обильные выделения из влагалища, жжение и зуд во влагалище и наружных половых органах. На фоне таких симптомов нередко снижается трудоспособность пациентки и развиваются неврозы. Острая форма вагинального кандидоза встречается наиболее часто и формируется в результате увеличения количества грибов рода Candida во влагалище на фоне снижения иммунитета пациентки.
Рецидивирующий вагинальный кандидоз — встречается у 10—15 % женщин репродуктивного возраста и проявляется четырьмя и более обострениями за год [11] .
Неосложнённая форма заболевания предполагает впервые выявленный или возникающий менее четырёх раз в год вагинальный кандидоз с умеренными проявлениями вагинита у пациенток без сопутствующих факторов риска (сахарный диабет, приём глюкокортикоидов, цитостатиков и др.).
При осложнённом вагинальном кандидозе наблюдаются яркие объективные симптомы: покраснение, отёк, образование язв, трещин слизистых оболочек и кожи перианальной области. Также характерны рецидивы четыре и более раз в год. Заболевание часто возникает на фоне сахарного диабета, ВИЧ-инфекции, терапии глюкокортикоидами и цитостатиками. Возбудителем заболевания в данном случае являются как C. albicans, так и другие грибы рода Candida.
Осложнения вагинального кандидоза
К осложнениям вагинального кандидоза у женщин относятся:
- стеноз влагалища;
- воспалительные патологии органов малого таза — сальпингит, оофорит и другие;
- заболевания мочевыделительной системы — цистит, уретрит[2] .
Стеноз влагалища развивается при воспалении стенок влагалища. При этом просвет влагалища сужается, а стенки влагалища становятся плохо растяжимы. Пациентки испытывают боль при половом акте.
Сальпингит — инфекционно-воспалительное заболевание фаллопиевой (маточной) трубы. Возникает при переходе инфекции восходящим путем из влагалища, не исключен также и гематогенный путь передачи. Сальпингит чаще всего протекает в сочетании с оофоритом — воспалением яичника. Поражение может быть как односторонним, так и двусторонним. Пациентки испытывают боль в области придатков, внизу живота слева или справа, повышается температура тела, возникает общее недомогание, слабость, а иногда и тошнота со рвотой. При несвоевременном лечении данного осложнения высок риск бесплодия, наступления внематочной беременности, возникновения спаечного процесса, приводящего к оперативному вмешательству, инфицированию органов брюшины и малого таза. Сальпингит особенно опасен в случаях, когда с кандидозом сочетаются другие инфекции [1] .
Уретрит — воспаление слизистой мочеиспускательного канала. Проявляется болезненным мочеиспусканием, чувством жжения в области уретры, выделением с мочой крови или гноя, дискомфортом при соприкосновении с бельём, слипанием краёв уретры, покраснением области вокруг мочеиспускательного канала.
Цистит — воспаление мочевого пузыря. Патология возникает при попадании возбудителя восходящим путём через уретру в мочевой пузырь. Симптомы цистита схожи с симптомами уретрита, однако есть некоторые отличия: частые позывы к мочеиспусканию при небольшом количестве мочи, чувство неполного опорожнения мочевого пузыря, боль, резь в конце мочеиспускания, помутнение мочи, повышение температуры тела, боли внизу живота.
На фоне вагинального кандидоза возрастает частота осложнений при беременности, а также увеличивается риск инфицирования плода.
Кандидоз плода может вызвать его внутриутробную гибель или приводить к преждевременным родам. После родов у женщин возможно развитие кандидозного эндометрита — воспалительного процесса в тканях, выстилающих внутреннюю полость матки.
Диагностика вагинального кандидоза
Диагностика вагинального кандидоза основывается на характерных жалобах пациентки, данных анамнеза, клинических проявлениях, выявленных при гинекологическом осмотре. В зеркалах видна гиперемия, отёк слизистой, белые налёты на стенках влагалища.
Независимо от этих признаков, подтверждение диагноза должно основываться на лабораторных данных:
- Микроскопия мазков вагинального отделяемого — позволяет выявить споры и мицелий гриба.
- Культуральный метод — посев влагалищного содержимого на искусственные питательные среды. Метод определяет количество, видовую принадлежность, чувствительность к противогрибковым препаратам, а также характер и степень заселения другими микроорганизмами. Культуральный метод дополняет микроскопию.
- Серологическая диагностика (РСК). Определяет антитела против антигенов грибов рода Candida. Такая диагностика имеет значение при генерализации процесса.
- Молекулярно-биологические методы. Направлены на обнаружение специфических фрагментов ДНК Candida spp. Применяют метод полимеразной цепной реакции (ПЦР).
- Иммунофлюоресцентная диагностика (Candida Sure Test) проводится в случае рецидивирующего течения вагинального кандидоза [15] .
К дополнительным методам диагностики относятся: изучение микробиоценоза кишечника, обследование на инфекции, передаваемые половым путём, внутривенный тест на толерантность к глюкозе [16] .
Дифференциальную диагностику проводят со следующими заболеваниями:
- генитальным герпесом; ;
- аэробным вагинитом;
- кожными заболеваниями (экземой, красным плоским лишаём, склеродермией, болезнью Бехчета и др.).
Лечение вагинального кандидоза
Показаниями к назначению терапии вагинального кандидоза являются жалобы пациентки, клинические проявления и лабораторное подтверждение наличия грибов рода Candida. Лечение не требуется при обнаружении грибов без каких-либо клинических проявлений (кандидозоносительство). Это правило обусловлено тем, что грибы рода Candida могут содержаться в небольшом количестве во влагалище и являются частью нормальной микрофлоры, если их количество не превышает пороговое значение 10 4 .
Механизм действия противогрибковых препаратов — нарушение синтеза эргостерола (вещества в составе клеточных мембран грибов), что приводит к образованию дефектов в мембране микроорганизма. В зависимости от дозы антимикотики проявляют фунгистатическое (замедление роста) или фунгицидное (полное уничтожение) действие [15] .
Существуют различные группы препаратов для лечения вагинального кандидоза:
- антибиотики (пимафуцин, амфотерицин В, нистатин, леворин);
- имидазолы (клотримазол, сертаконазол, кетоконазол, гино-певарил, миконазол);
- триазолы (итраконазол, флуконазол);
- комбинированные препараты ("Тержинан", "Полижинакс", "Пимафукорт", "Клион Д", "Макмирор комплекс");
- препараты разных групп (флуцитозин, гризеофульвин, дафнеджин, нитрофунгин, йодат поливинилпирролидон).
Лечение подбирается гинекологом индивидуально для каждой пациентки, учитывая клиническую картину, форму заболевания и степень выраженности симптомов. Но важно отметить, что при лечении молочницы при беременности флуконазол противопоказан, так как он может негативно повлиять на развитие плода [19] [20] .
При лечении острых форм вагинального кандидоза назначают местное лечение. Препарат не всасывается в системный кровоток, а действует в области влагалища и слизистой. Примеры схем лечения:
-
150 мг в виде вагинальных свечей один раз в сутки в течение трёх дней; один аппликатор крема на ночь вагинально в течение трёх дней; одна свеча на ночь один раз в сутки в течение восьми дней; одна таблетка на ночь в течение 10 дней.
При хроническом кандидозе наряду с местным лечением применяют системные антимикотики:
-
150 мг один раз внутрь; 200 мг внутрь два раза с интервалом 12 часов в течение одного дня или 200 мг в сутки в течение трёх дней.
При рецидивирующей форме заболевания (более четырёх эпизодов в год) применяют схему:
-
150 мг внутрь три раза с интервалом 72 часа в 1,4 и 7 день лечения.
Для купирования рецидивов препарат применяют в дозировке 150 мг один раз в неделю в течение шести месяцев.
В последние годы всё больше исследуется способность C. albicans формировать биоплёнки — вещества на поверхности колонии микроорганизмов, которые служат барьером для проникновения лекарственных средств и обеспечивают выживание. Основным полисахаридом, определяющим развитие резистентности к антибиотикам, является глюкан. Его рассматривают как одну из причин формирования резистентности к антимикотическим препаратам. Этим объясняется отсутствие эффекта при лечении у некоторых больных. Таким пациенткам можно порекомендовать препарат фентиконазол 600 мг в сутки с интервалом в три дня. Лекарство отличается от других способностью преодолевать биоплёнки, тем самым повышая эффективность лечения при резистентности к другим препаратам.
Прогноз. Профилактика
При своевременном обращении пациентки к врачу, лабораторном обследовании и отсутствии самолечения прогноз благоприятный. Самолечение опасно из-за риска рецидива заболевания, его хронизации и возникновения резистентности к препарату, неверно выбранному пациенткой или при неадекватной дозе.
Чтобы повысить эффективность терапии пациентки должны следовать схеме лечения, индивидуально назначенной гинекологом. Во время лечения и диспансерного наблюдения необходимо соблюдать половой покой или применять барьерные методы контрацепции. Повторно обратиться к врачу для контроля анализов следует через 7-10 дней [12] .
Читайте также:

