Устойчивость антибиотиков к инфекционным заболеваниям
Обновлено: 17.04.2024
Причины устойчивости к антибиотикам. Механизмы
Устойчивость к действию антибиотиков отмечают в случае, когда ранее восприимчивые микроорганизмы теряют свою чувствительность к антибактериальному препарату при использовании клинически безопасной дозы. Это происходит в результате генетических изменений, часто возникающих в быстро делящихся клетках с гаплоидным набором хромосом.
Факторы определяющие устойчивость бактерий к антибиотикам
Трансформация бактерий и утойчивость к антибиотикам. Трансформация — процесс захвата бактериями свободной цепи ДНК и встраивания её в собственный геном.
Например, Streptococcus pneumoniae способен захватывать у близкородственных видов часть генов, кодирующих пенициллинсвязывающие белки (обладают меньшим сродством к лекарственному препарату). При продукции изменёнными генами этих белков чувствительность к действию пенициллина заметно снижается, т.е. бактерии продолжают синтезировать пептидогликан, сохраняя структуру клеточной стенки, даже в присутствии препарата.
Устойчивость к действию бензилпенициллина у Neisseria gonorrhoeae развивается по такому же механизму.
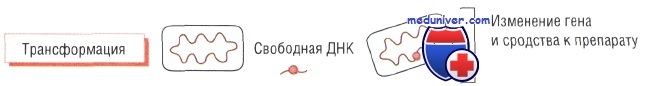
Конъюгация бактерий и утойчивость к антибиотику
Плазмиды — кольцевые структуры ДНК, расположенные в цитоплазме бактерий. Их может быть достаточно много. Именно поэтому при делении клеток одни и те же плазмиды обнаруживают у всех дочерних микроорганизмов. Плазмиды содержат информацию о различных генах бактерии, в том числе о генах, кодирующих метаболические ферменты, и факторах, определяющих вирулентность и устойчивость к действию антибиотиков.
Конъюгация — процесс передачи плазмид от одной бактерии к другой. В этом случае гены, кодирующие устойчивость, быстро распространяются среди бактерий, находящихся в одной среде обитания (например, в кишечнике). Комбинированное воздействие отдельных антибиотиков (например, в госпитальных условиях) приводит к появлению мультирезистентных штаммов.
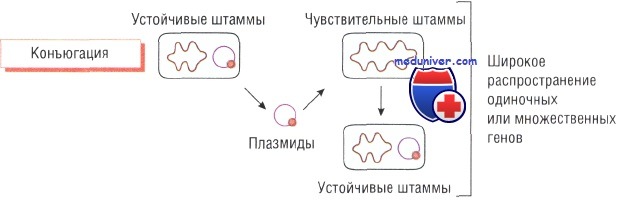
Транспозоны и интегроны бактерий и утойчивость к антибиотику
Транспозоны и интегроны — подвижные гены, способные кодировать транспозицию (внутрихромосомную транслокацию). Они могут перемещаться как между хромосомами и плазмидами, так и между бактериями и содержат большое количество генетической информации (например, антибиотикорезистентность).
Считают, что в основе развития устойчивости к метициллину у Staphylococcus aureus и к тетрациклину у Neisseria gonorrhoeae лежит передача именно этих генетических структур. Интегроны играют важную роль в передаче мультирезистентности у грамположительных микроорганизмов. Кроме того, передачу генов резистентности могут осуществлять бактериофаги.
Механизмы возникновения утойчивости к антибиотикам
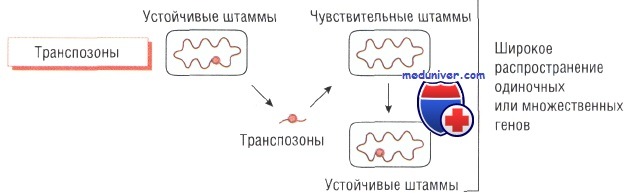
Изменение структуры антибактериального препарата. Ферментативная инактивация. Наиболее распространённый механизм развития устойчивости к действию антибиотика — спонтанное продуцирование фермента, разрушающего препарат.
Большинство штаммов Staphylococcus aureus продуцирует экстрацеллюлярный фермент бета-лактамазу, которая инактивирует пенициллины, разрушая бета-лактамное кольцо в их структуре. Ферменты, разрушающие пенициллины и цефало-спорины, синтезируют многие микроорганизмы, в том числе Escherichia coli, Haemophilus influenzae и некоторые представители рода Pseudomonas.
Гены, кодирующие эти ферменты, обычно расположены в подвижных генетических элементах (транспозонах) и могут передаваться как между бактериями одного вида, так и между видами. Распространение различных видов бета-лактамаз расширенного спектра (например, CTXm или АтрС) среди представителей семейства энтеробактерий приводит к возникновению устойчивости к эффектам пенициллинов и цефалоспоринов широкого спектра действия и возникновению внутрибольничных инфекций. Кроме того, эти микроорганизмы могут вызывать опасные внебольничные заболевания.
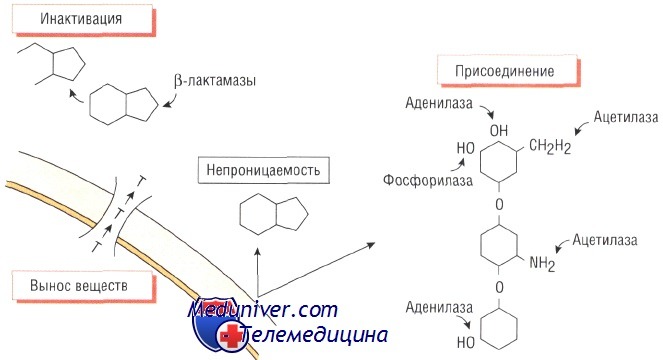
Ферментативное присоединение. Бактерии могут вырабатывать ферменты, способные угнетать активность антибиотиков путём присоединения к последним различных химических групп. Например, устойчивость к действию аминогликозидов возникает в результате присоединения ацетилового, аминового или аденозинового радикала к молекуле препарата.
Влияние такой модификации на эффективность лекарственных средств группы аминогликозидов различно. Так, амикацин наименее восприимчив к этому способу инактивации. Присутствие ферментов, обусловливающих устойчивость к действию аминогликозидов, характерно как для грамположительных (Staphylococcus aureus), так и для грамотрицательных (микроорганизмы рода Pseudomonas) возбудителей.
Непроницаемость клеточной стенки и утойчивость к антибиотику
Устойчивость некоторых бактерий к действию антимикробных средств связана с непроницаемостью их клеточной стенки для молекул препарата. Например, клеточная стенка грамо-трицательных микроорганизмов (особенно рода Pseudomonas) непроницаема для некоторых бета-лактамов.
В то же время аминогликозиды проникают внутрь бактерии посредством кислородозависимой транспортной системы (а потому анаэробы к ним невосприимчивы), в связи с этим анаэробы обладают небольшой чувствительностью к аминогликозидам.
Механизмы выведения веществ из бактериальной клетки и утойчивость к антибиотику
Некоторые бактерии, например Е. coli, становятся невосприимчивыми к действию тетрациклинов, когда приобретают внутримембранный белок, активно выводящий антибиотик из клетки. Устойчивость стрептококков к действию макролидов обусловлена подобным механизмом.
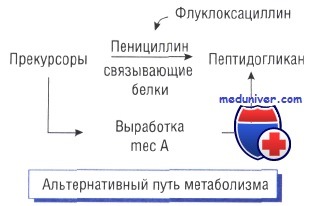
Альтернативные пути метаболизма и утойчивость к антибиотикам
Один из наиболее распространённых механизмов возникновения устойчивости к действию антибактериальных препаратов — развитие альтернативных путей метаболизма, помогающих обходить метаболический блок, вызываемый антибиотиком. Так, Staphylococcus aureus становится невосприимчивым к метициллину или флуклоксациллину, когда у него появляется ген тесА, кодирующий альтернативный пенициллинсвязывающий белок (РВР2), не чувствительный к метициллину.
Несмотря на то что состав бактериальной клеточной стенки изменяется, микроорганизм сохраняет способность к делению. Снижение восприимчивости к бензилпенициллину у Streptococcus pneumoniae также вызвано наличием пенициллинсвязывающих белков.
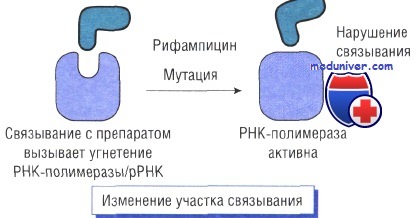
Изменение участка связывания антибиотика
В основе механизма действия рифампицина лежит угнетение бета-субъединицы РНК-полимеразы. Устойчивость возникает при изменении гена РНК-полимеразы в результате точечных мутаций, инсерции или делеции.
При этом новая РНК-полимераза невосприимчива к рифампицину.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Антибиотики используются для профилактики и лечения бактериальных инфекционных заболеваний. Устойчивость к антибиотикам развивается в случае изменения бактерий в ответ на применение этих препаратов.
Устойчивость к антибиотикам развивается у бактерий, а не людей или животных. Эти бактерии могут заражать людей и животных, и вызванные ими инфекции лечить труднее, чем инфекции от бактерий, не имеющих такой устойчивости.
Следствием устойчивости к антибиотикам являются рост медицинских расходов, более продолжительные госпитализации и рост смертности.
Необходимо срочно изменить порядок назначения и использования антибиотиков во всем мире. Даже в случае разработки новых препаратов серьезная угроза устойчивости к антибиотикам будет сохраняться, если поведение не изменится. Изменение поведения должно также включать меры по сокращению распространения инфекций с помощью вакцинации, мытья рук, более безопасного секса и надлежащей гигиены питания.
Масштабы проблемы
Устойчивость к антибиотикам возрастает до угрожающе высоких уровней во всем мире. Новые механизмы устойчивости появляются и распространяются повсюду, угрожая нашей способности лечить распространенные инфекционные заболевания. Все больше инфекций – например пневмонию, туберкулез, заражение крови, гонорея, заболевания пищевого происхождения – становится труднее, а иногда и невозможно лечить из-за снижения эффективности антибиотиков.
Там, где антибиотики для лечения людей или животных можно приобрести без рецепта, возникновение и распространение устойчивости усугубляются. Аналогичным образом, в тех странах, где нет стандартных лечебных рекомендаций, антибиотики часто назначаются врачами и ветеринарами избыточно и используются населением сверх меры.
В отсутствие неотложных мер на нас начнет надвигаться пост-антибиотическая эра, когда распространенные инфекции и незначительные травмы вновь могут стать смертельными.
Профилактика и борьба
Устойчивость к антибиотикам набирает темпы из-за их неправильного и чрезмерного использования, а также слабой профилактики инфекций и борьбы с ними. Меры к ослаблению последствий устойчивости и ограничению её распространения можно принимать на всех уровнях общества.
Население
Для предотвращения распространения устойчивости к антибиотикам и борьбы с ним индивидуумы могут:
Лица, формирующие политику
Для предотвращения распространения устойчивости к антибиотикам и борьбы с ним лица, формулирующие политику, могут:
- обеспечить принятие действенного национальный плана действий против устойчивости к антибиотикам;
- улучшать эпиднадзор за устойчивыми к антибиотикам инфекциями;
- усиливать меры политики, программы и осуществление мер профилактики инфекций и борьбы с ними;
- регулировать и поощрять надлежащее использование качественных препаратов и обращение с ними;
- предоставлять информацию о последствиях устойчивости к антибиотикам.
Медработники
Для предотвращения распространения устойчивости к антибиотикам и борьбы с ним медработники могут:
- предотвращать инфекции, обеспечивая чистоту своих рук, инструментов и окружающей среды;
- назначать и отпускать антибиотики только в случаях, когда в них есть необходимость, в соответствии с действующими лечебными инструкциями.
- информировать группы по эпиднадзору об инфекциях с устойчивостью к антибиотикам;
- беседуйте с пациентами о том, как правильно принимать антибиотики, об устойчивости к антибиотикам и об опасности их неправильного использования;
- говорите пациентам, как предотвращать инфекции (например, делая прививки, моя руки, практикуя более безопаснй секс и закрывая нос и рот при чихании).
Индустрия здравоохранения
Для предотвращения распространения устойчивости к антибиотикам и борьбы с ним индустрия здравоохранения может:
- инвестировать средства в научные исследования и разработку новых антибиотиков, вакцин, средств диагностики и других инструментов.
Сельскохозяйственный сектор
Для предотвращения распространения устойчивости к антибиотикам и борьбы с ним сельскохозяйственный сектор может:
- вводить антибиотики в организм животных лишь под ветеринарным надзором;
- не использовать антибиотики для стимулирования роста или профилактики болезней у здоровых животных.
- вакцинировать животных с целью сокращения потребности в антибиотиках и использовать альтернативы антибиотикам, когда они существуют;
- продвигать и применять надлежащую практику на всех этапах производства и переработки пищевых продуктов животного и растительного происхождения;
- повышать биобезопасность на фермах и предотвращать инфекции, улучшая гигиену и благополучие животных.
Недавние изменения
Хотя в настоящее время ведется разработка некоторых антибиотиков, ни один из них, как ожидается, не будет эффективен против наиболее опасных форм бактерий с устойчивостью к антибиотикам.
С учетом легкости и частоты поездок, совершаемых сегодня людьми, устойчивость к антибиотикам является глобальной проблемой, которая требует усилий всех стран и многих секторов.
Последствия
В тех случаях, когда инфекции не поддаются более лечению антибиотиками первой линии, надлежит использовать более дорогие препараты. Из-за большей продолжительности болезней и лечения, часто в больницах, возрастают медицинские расходы, а также экономическое бремя, которое ложится на семьи и общество.
Устойчивость к антибиотикам ставит под угрозу достижения современной медицины. В отсутствие эффективных антибиотиков для профилактики и лечения инфекций значительно возрастает риск трансплантации органов, химиотерапии и хирургических операций, например кесарева сечения.
Ответные меры ВОЗ
Решение проблемы устойчивости к антибиотикам является для ВОЗ важным приоритетом. В мае 2015 г. Всемирная ассамблея здравоохранения утвердила Глобальный план действий по устойчивости к противомикробным препаратам, включающий и устойчивость к антибиотикам. Глобальный план действий направлен на обеспечение профилактики и лечения инфекционных болезней с помощью безопасных и эффективных лекарств.
Глобальным планом действий по устойчивости к противомикробным препаратам поставлены 5 стратегических задач:
- повысить информированность и понимание устойчивости к противомикробным препаратам;
- усилить эпиднадзор и научные исследования;
- сократить число случаев заражения;
- оптимизировать использование противомикробных препаратов;
- обеспечить устойчивые инвестиции на цели противодействия устойчивости к противомикробным препаратам.
Собравшиеся на сессии Генеральной Ассамблеи Организации Объединенных Наций в Нью-Йорке в сентябре 2016 г. главы государств приняли обязательство развернуть широкую и координированную деятельность по борьбе с глубинными причинами устойчивости к антибиотикам в ряде секторов, особенно в области охраны здоровья человека и животных, а также сельского хозяйства. Государства-члены подтвердили свою решимость разработать национальные планы действий по борьбе с этим явлением, взяв за основу глобальный план действий. ВОЗ оказывает государствам-членам поддержку по подготовке их национальных планов действий по решению проблемы устойчивости к противомикробным препаратам.
ВОЗ реализует несколько инициатив, направленных на решение проблемы устойчивости к противомикробным препаратам:
Всемирная неделя правильного использования антибиотиков
Глобальная система по надзору за устойчивостью к противомикробным препаратам (GLASS)
Данная система, функционирование которой обеспечивает ВОЗ, базируется на стандартизированном подходе к сбору, анализу и обмену данными, касающимися устойчивости к противомикробным препаратам, в глобальном масштабе. Эти данные используются для принятия решений на местном, национальном и региональном уровнях.
Глобальное партнерство по научным исследованиям и разработке антибиотиков (GARDP)
Эта совместная инициатива ВОЗ и Инициативы по лекарственным средствам против забытых болезней стимулирует исследования и разработки на основе государственно-частных партнерств. К 2023 г. Партнерство планирует разработать и вывести на рынок до четырех новых лекарственных средств за счет совершенствования существующих антибиотиков и ускоренного создания новых антибиотиков.
Межучрежденческая координационная группа по устойчивости к противомикробным препаратам (IACG)
Генеральный секретарь Организации Объединенных Наций учредил Группу для повышения согласованности действий международных организаций и обеспечения эффективности глобальных усилий по устранению этой угрозы безопасности здоровья. Группой совместно руководят заместитель Генерального секретаря ООН и Генеральный директор ВОЗ, в нее входят высокопоставленные представители соответствующих учреждений ООН и других международных организаций, а также эксперты из различных секторов.
Противомикробные препараты, включающие в себя антибиотики, противовирусные, противогрибковые и противопаразитические средства, представляют собой лекарственные средства, применяемые для профилактики и лечения инфекций у людей, животных и растений.
Что такое устойчивость к противомикробным препаратам?
Устойчивость к противомикробным препаратам (УПП) возникает в результате постепенной мутации бактерий, вирусов, грибков и паразитов и утраты ими восприимчивости к лекарственным препаратам, затрудняя лечение инфекций и повышая риск распространения, тяжелого течения и летального исхода болезней.
Лекарственная устойчивость приводит к утрате эффективности антибиотиков и других противомикробных препаратов и постепенно осложняет или делает невозможным лечение инфекций.
Почему устойчивость к противомикробным препаратам вызывает обеспокоенность во всем мире?
Портфель клинических разработок новых противомикробных препаратов крайне мал. В 2019 г. ВОЗ выявила 32 антибиотика, которые находятся на этапе клинической разработки и предназначены для лечения болезнетворных возбудителей, включенных в список приоритетных патогенов ВОЗ, из которых только шесть антибиотиков отнесены в категории инновационных. Кроме того, серьезной проблемой остается недостаточная доступность качественных противомикробных препаратов. Нехватку антибиотиков испытывают страны всех уровней развития, и особенно учреждения систем здравоохранения стран.
По мере распространения лекарственной устойчивости во всем мире эффективность антибиотиков неуклонно снижается, и это приводит к появлению трудноизлечимых инфекций и смерти людей. Существует острая потребность в новых противомикробных препаратах, например для лечения карбапенем-резистентных грамотрицательных бактериальных инфекций, внесенных ВОЗ в список приоритетных патогенов. Вместе с тем без изменения нынешней практики использования антибиотиков человеком новые антибиотики, как и нынешние, будут утрачивать свою эффективность.
УПП наносит значительный урон экономике и системам здравоохранения стран, поскольку уменьшает производительность пациентов и ухаживающих за ними лиц в связи с удлинением сроков госпитализации и потребностью в более дорогостоящих и интенсивных видах терапии.
Без эффективных инструментов профилактики и надлежащего лечения лекарственно устойчивых инфекций и расширения доступа к существующим и новым качественным противомикробным препаратам число людей, не излечивающихся или умирающих от инфекций, будет расти. Более рискованными станут такие медицинские вмешательства, как хирургические операции, в том числе кесарево сечение или эндопротезирование тазобедренного сустава, химиотерапия онкологических заболеваний и трансплантация органов.
Какие факторы ускоряют формирование и распространение устойчивости к противомикробным препаратам?
Устойчивость к противомикробным препаратам развивается со временем естественным образом, обычно в результате генетических мутаций. Устойчивые к противомикробным препаратам микроорганизмы присутствуют у людей и животных, в продуктах питания, растениях и окружающей среде (в воде, почве и воздухе). Они могут передаваться от человека к человеку или между людьми и животными, в том числе с пищей животного происхождения. Основными причинами возникновения устойчивости к противомикробным препаратам являются неправильное и чрезмерное применение противомикробных препаратов; отсутствие доступа людей, а также животных к чистой воде, средствам санитарии и гигиены; неудовлетворительная профилактика инфекций и инфекционный контроль в медицинских учреждениях и на сельскохозяйственных предприятиях; ограниченный доступ к качественным и приемлемым по цене лекарственным препаратам, вакцинам и средствам диагностики; низкий уровень осведомленности и знаний; и отсутствие контроля за соблюдением законодательства.
Текущая ситуация
Лекарственная устойчивость бактерий
Во всем мире наблюдаются высокие показатели устойчивости к антибиотикам, используемым для лечения таких распространенных бактериальных инфекций, как инфекции мочевыводящих путей, сепсис, инфекции, передаваемые половым путем, и некоторые формы диареи, что свидетельствует об истощении нашего арсенала эффективных антибиотиков. Так, в странах, представляющих данные в Глобальную систему эпиднадзора за устойчивостью к противомикробным препаратам (GLASS), частота случаев устойчивости к антибиотику ципрофлоксацину, обычно применяемому для лечения инфекций мочевыводящих путей, варьируется в диапазоне от 8,4% до 92,9% для Escherichia coli и от 4,1% до 79,4% для Klebsiella pneumoniae.
Klebsiella pneumoniae – распространенная кишечная бактерия, которая может вызывать опасные для жизни инфекционные поражения. В настоящее время во всех регионах мира распространилась устойчивость K. pneumoniae к препаратам последнего резерва (антибиотикам класса карбапенемов). K. pneumoniae является одной из ведущих причин таких внутрибольничных инфекций, как пневмония, инфекции кровотока и инфекции у новорожденных и пациентов отделений интенсивной терапии. В некоторых странах из-за формирования устойчивости карбапенемы не подходят для лечения более половины пациентов, инфицированных K. pneumoniae.
Широкое распространение получила устойчивость E. coli к противомикробной активности фторхинолонов, используемых для лечения инфекций мочевыводящих путей.
В ряде стран различных регионов мира данная терапия перестала быть эффективной в более чем половине случаев.
Колистин остается единственным препаратом последнего резерва, подходящим для лечения опасных для жизни инфекций, вызываемых карбапенем-устойчивыми энтеробактериями (т.е. E.coli, Klebsiella и т.д.). В ряде стран и регионов уже выявлены колистин-резистентные бактерии, вызывающие инфекции, против которых в настоящее время не имеется эффективных антибиотиков.
Бактерии Staphlylococcus aureus присутствуют в микрофлоре кожных покровов человека, а также нередко вызывают распространение инфекций в быту и медицинских учреждениях. По оценкам, вероятность смерти больного, инфицированного метициллин-резистентной Staphylococcus aureus, на 64% выше, чем пациента с восприимчивой к препарату инфекцией.
Широко распространенная лекарственная устойчивость значительно различающихся между собой штаммов N. gonorrhoeae сводит на нет усилия по профилактике и лечению гонореи. Быстро развивается устойчивость инфекций к сульфаниламидам, пенициллинам, тетрациклинам, макролидам, фторхинолонам и цефалоспоринам первых поколений. В настоящее время единственным вариантом эмпирической монотерапии гонореи является применение инъекционного цефалоспорина широкого спектра действия цефтриаксона.
Лекарственная устойчивость mycobacterium tuberculosis
Устойчивые к антибиотикам штаммы mycobacterium tuberculosis (палочки Коха) угрожают достижениям в борьбе с глобальной эпидемией туберкулеза. По оценкам ВОЗ, в 2018 г. в мире произошло около полумиллиона новых случаев заболевания туберкулезом с устойчивостью к рифампицину (РУ-ТБ); в подавляющем большинстве случае они представляли собой туберкулез с множественной лекарственной устойчивостью (МЛУ-ТБ) – форму туберкулеза, характеризующуюся невосприимчивостью к двум наиболее мощным противотуберкулезным препаратам. При этом только треть из около полумиллиона пациентов, заболевших МЛУ/РУ-ТБ в 2018 г., была выявлена и включена в отчетность. По сравнению с нерезистентным туберкулезом для лечения МЛУ-ТБ требуются более продолжительные, менее эффективные и гораздо более дорогостоящие схемы лечения. Успешное излечение от МЛУ/РУ-ТБ наступает у менее 60% больных.
В 2018 г. доля случаев МЛУ-ТБ/РУ-ТБ оценивалась на уровне 3,4% среди ранее не болевших пациентов и на уровне 18% среди уже получавших лечение; таким образом, формирование устойчивости к новым противотуберкулезным препаратам последнего резерва, предназначенным для лечения лекарственно устойчивых форм туберкулеза, является крайне опасным явлением.
Лекарственная устойчивость вирусов
Устойчивость к противовирусным препаратам, формирующаяся в результате непрерывной репликации вирусов под длительным воздействием лекарственных средств и отбора резистентных штаммов, представляет собой растущую угрозу для пациентов с ослабленным иммунитетом. В настоящее время проблема устойчивости затрагивает большинство противовирусных препаратов, включая антиретровирусные (АРВ).
Формирование лекарственно устойчивой ВИЧ-инфекции (ЛУ-ВИЧ) может привести к частичной и полной утрате эффективности всех препаратов АРВ, в том числе относящихся к новым классам. Инфицирование ЛУ-ВИЧ может происходит как у пациентов, уже получающих антиретровирусную терапию, так и у заражающихся ВИЧ впервые. В большинстве стран Африки, Азии и Латинской Америки, в которых ведется мониторинг ситуации, доля случаев ЛУ-ВИЧ с дотерапевтической резистентностью к ненуклеозидным ингибиторам обратной транскриптазы (ННИОТ) на этапе до начала лечения среди взрослых, которым назначается терапия первой линии, превышает 10%. Тревожно высокой является распространенность дотерапевтической резистентности среди младенцев. В странах Африки к югу от Сахары носителями устойчивого к ННИОТ вируса являются более 50% младенцев с недавно диагностированной ВИЧ-инфекцией. С учетом данных обстоятельств в последнем варианте руководящих принципов ВОЗ по АРВ-терапии содержится рекомендация о применении в качестве предпочтительной терапии первой линии у взрослых и детей нового препарата долутегравир. Назначение данного препарата является особенно актуально для предотвращения негативных последствий устойчивости к ННИОТ.
Рост показателей устойчивости порождает и значимые экономические последствия, поскольку препараты второй и третьей линии являются гораздо более дорогостоящими по сравнению с препаратами первой линии. В рамках программы ВОЗ по борьбе с лекарственной устойчивостью ВИЧ-инфекции ведется мониторинг тенденций передачи инфекции и формирования ее устойчивости к более старым и новым препаратам против ВИЧ во всем мире.
Лекарственная устойчивость малярийных паразитов
Появление лекарственно устойчивых малярийных паразитов представляет собой одну из самых серьезных угроз для борьбы с малярией и приводит к увеличению заболеваемости малярией и смертности от нее. Рекомендуемым методом лечения первой линии при неосложненной малярии, вызванной P. falciparum, является артемизинин-комбинированная терапия (АКТ), применяемая в большинстве эндемичных по малярии стран. АКТ – комбинация компонента артемизинина и дополнительного лекарственного компонента. В рамках исследований, проведенных в 2001–2019 гг. в таких регионах ВОЗ, как Регион стран Западной части Тихого океана и Регион Юго-Восточной Азии, частичная устойчивость к артемизинину и устойчивость к ряду дополнительных лекарственных компонентов АКТ была подтверждена в Камбодже, Лаосской Народно-Демократической Республике, Мьянме, Таиланде и Вьетнаме. Это усложняет подбор эффективных лекарственных средств и требует пристального мониторинга процесса лечения.
В некоторых странах Региона Восточного Средиземноморья ВОЗ устойчивость P. falciparum к сульфадоксину-пириметамину сделала неэффективной терапию артезунатом в сочетании с сульфадоксином-пириметамином и потребовала перехода к другому варианту ACT.
В отношении стран Африки недавно были опубликованы данные, свидетельствующие о появлении мутаций, вызывающих частичную устойчивость паразита к артемизинину, в Руанде. На сегодняшний день апробированные варианты АКТ сохраняют высокую эффективность. Однако дальнейшее распространение устойчивости к артемизинину и дополнительным лекарственным компонентам АКТ может создать серьезную проблему для здоровья населения и поставить под угрозу важнейшие достижения в борьбе с малярией.
Лекарственная устойчивость грибков
Это приводит к появлению новых случаев заражения трудноизлечимыми грибковыми инфекциями, терапевтическим неудачам, затягиванию госпитализаций и к переходу на гораздо более дорогостоящие схемы лечения. ВОЗ проводит всеобъемлющий обзор грибковых инфекций в мире и намерена опубликовать перечень приоритетных для общественного здравоохранения патогенных грибков с анализом ситуации в области разработки новых противогрибковых препаратов.
Необходимость согласованных действий
Насущной задачей является активизация инновационной деятельности и наращивание капиталовложений в таких областях, как оперативные исследования, поиск и разработка новых противомикробных препаратов, вакцин и средств диагностики, особенно предназначенных для борьбы с наиболее серьезными грамотрицательными бактериями, в частности карбапенем-резистентными энтеробактериями и Acinetobacter baumannii. Значительному сокращению недостатка финансирования в этой области может способствовать создание Многостороннего партнерского целевого фонда по борьбе с устойчивостью к противомикробным препаратам (МПЦФ УПП), Глобального партнерства по научным исследованиям и разработкам антибиотиков, Фонда действий в отношении УПП и других фондов и инициатив. Правительства ряда стран, включая Швецию, Германию, США и Соединенное Королевство, апробируют модели возмещения затрат компаний-производителей новых препаратов. Для выработки долгосрочных решений круг этих инициатив должен быть расширен.
Глобальный план действий (ГПД) по борьбе с устойчивостью к противомикробным препаратам
Страны мира взяли на себя обязательство осуществлять рамочные принципы, изложенные в Глобальном плане действий (ГПД) по борьбе с УПП[1], принятом на сессии Всемирной ассамблеи здравоохранения в 2015 г., а также разработать и осуществлять многосекторальные планы действия на национальном уровне. ГПД был впоследствии одобрен руководящими органами Продовольственной и сельскохозяйственной организации Объединенных Наций (ФАО) и Всемирной организации охраны здоровья животных (МЭБ). Для обеспечения неуклонного улучшения ситуации во всем мире страны необходимо обеспечить финансированием и осуществлять национальные планы действий в целом ряде секторов. До одобрения ГПД в 2015 г. глобальные усилия по противодействию УПП осуществлялись, в частности, в рамках Глобальной стратегии ВОЗ по сдерживанию устойчивости к противомикробным препаратам, которая была разработана 2001 г. и описывает комплекс мероприятий, направленных на замедление процесса формирования и распространения УПП.
Трехсторонний совместный секретариат по проблеме устойчивости к противомикробным препаратам
Всемирная неделя правильного использования противомикробных препаратов
Глобальная система по надзору за устойчивостью к противомикробным препаратам (GLASS)
Глобальная система эпиднадзора за устойчивостью к противомикробным препаратам была создана ВОЗ в 2015 г. в целях непрерывного сбора недостающих данных, необходимых для стратегического планирования на всех уровнях. GLASS призвана систематически накапливать данные эпиднадзора за лекарственно устойчивыми инфекциями у человека, информацию о применении противомикробных препаратов и о лекарственно устойчивых инфекциях в продовольственных системах и окружающей среде. GLASS обеспечивает стандартизированный подход к сбору, анализу, интерпретации и распространению данных по странам, территориям и районам и позволяет отслеживать состояние существующих и новых национальных систем эпиднадзора, уделяя особое внимание качеству и репрезентативности собираемых данных. В некоторых регионах ВОЗ созданы сети эпиднадзора, обеспечивающие оказание технической поддержки странам и упрощающие присоединение к GLASS.
Глобальные исследования и выбор приоритетов в области борьбы с УПП
В 2017 г. ВОЗ разработала список приоритетных патогенов, призванный служить ориентиром для проведения научных исследований и разработки новых противомикробных препаратов. Он будет обновлен в 2022 г. Для оценки прогресса в разработке препаратов против приоритетных патогенов из списка ВОЗ Организация ежегодно анализирует антибактериальные препараты, находящиеся на стадии доклинической оценки и клинических испытаний. На сегодняшний день исследованиями и разработками по-прежнему не охвачен целый ряд направлений, в частности по разработке препаратов против грамотрицательных карбапенем-резистентных бактерий.
Глобальное партнерство по научным исследованиям и разработкам антибиотиков (GARDP)
Данное совместное начинание ВОЗ и Инициативы по лекарственным средствам против забытых болезней направлено на стимулирование исследований и разработок на основе государственно-частных партнерств. К 2025 г. Партнерство должно разработать и внедрить пять новых лекарственных препаратов, эффективных в отношении наиболее опасных с точки зрения ВОЗ лекарственно устойчивых бактерий.
Устойчивость к антимикробным препаратам создает угрозу для проведения эффективной профилактики и лечения постоянно возрастающего числа инфекций. Все более необходимым становится рациональное использование имеющихся антимикробных препаратов с учетом спектра их активности и профиля антибиотикорезистентности основных возбудителей. В связи с этим чрезвычайно актуально проведение научных и общественных мероприятий, направленных на обсуждение целого ряда вопросов, касающихся распространенности бактериальных инфекций, трудностей микробиологической диагностики, текущей ситуации с антибиотикорезистентностью и перспектив использования разных классов антимикробных препаратов при лечении инфекций различной локализации.
Вместе с тем, в настоящее время во всем мире наблюдается совершенно объективный процесс глобальный рост антибиотикорезистентности микроорганизмов к АМП. Проблема резистентности во многом обусловлена широким и часто нерациональным использованием данных препаратов. Инфекции, вызванные резистентными штаммами микроорганизмов, характеризуются более тяжелым течением, чаще требуют госпитализации больного, увеличивают продолжительность пребывания его в стационаре, предполагают применение комбинированной АМТ с использованием резервных препаратов. Все это приводит к увеличению затрат на лечение, ухудшает прогноз для здоровья и жизни пациентов, а также создает условия для возникновения эпидемий. По данным Центра по контролю и профилактике заболеваний, в США ежегодно не менее 2 миллонов человек инфицируются бактериями, устойчивыми к антибиотикам, из которых примерно 23 тысячи умирают вследствие этих инфекций [2,3].
Несмотря на значительный прогресс в медицине, интенсивность разработки новых АМП за последние 30 лет значительно снизилась. Американское общество по борьбе с инфекционными болезнями в 2004 году сообщило, что за период 1998–2002 гг. количество одобренных Управлением по контролю за пищевыми продуктами и лекарственными средствами (FDA) новых антибиотиков уменьшилось на 56% по сравнению с периодом 1983–1987 г.
Во втором квартале 2014 года Всемирная организация здравоохранения опубликовала отчет об антибиотикорезистентности в мире. Это один из первых детальных докладов за последние 30 лет, касающийся столь актуальной глобальной проблемы. В нем проанализированы данные из 114 стран, в том числе России, на основании которых сделан вывод о том, что резистентность к антибиотикам на сегодняшний день отмечается уже во всех странах независимо от уровня их благосостояния и экономического развития. Российская Федерация в 2014 году со своей стороны стала инициатором подписания документа, в котором закреплено, что оценка ситуации с антибиотикорезистентностью в стране является национальным приоритетом. Сложившаяся ситуация имеет большое социально-экономическое значениеи рассматривается как угроза национальной безопасности. При неэффективности стартовой терапии клиницисты вынуждены использовать альтернативные АМП, которые часто характеризуются более высокой стоимостью и худшим профилем безопасности.
Все более необходимым становится рациональное использование имеющихся АМП с учетом спектра их активности и профиля антибиотикорезистентности основных возбудителей. В связи с этим чрезвычайно актуально проведение научных и общественных мероприятий, направленных на обсуждение целого ряда вопросов, касающихся распространенности бактериальных инфекций, трудностей микробиологической диагностики, текущей ситуации с антибиотикорезистентностью и перспектив использования разных классов АМП при лечении инфекций различной локализации [3,4].
Проблема антибиотикорезистентности
Значение проблемы антибиотикорезистентности подтверждается многими исследованиями. Согласно данным, опубликованным в 2014 году, при сохраняющихся темпах роста антибиотикорезистентности суммарные потери общемирового ВВП к 2050 году составят более 100 триллионов долларов, а количество случаев преждевременной смерти людей в два раза превысит численность населения России [5].
Монорезистентные организмы становятся полирезистентными, а затем и панрезистентными. Появилось понятие так называемых “проблемных” микроорганизмов, среди которых особенно часто, особенно в условиях стационара, где широко применяются АМП и дезинфектанты, встречаются штаммы, резистентные к тем или иным (ко всем известным) АМП. К таким микроорганизмам относятся Staphylococcus spp., Enterococcus spp., Pseudomonas aeruginosa, Acinetobacter spp., ряд штаммов бактерий семейства Enterobacteriaceae.
Одной из наиболее важных причин сложившейся ситуации является доступность АМП населению во многих странах мира и высокая частота самолечения, которое очень часто является неадекватным. Так, по данным Европейского центра по профилактике и контролю заболеваний, около 40% европейцев уверены в том, что антибиотики эффективны при простуде и гриппе.
Свой вклад в усугубление проблемы, к сожалению, вносят и врачи. Недостаточная осведомленность клиницистов относительно правил рациональной АМТ, а иногда и неспособность устоять перед настойчивыми просьбами пациентов и их родителей приводят к неоправданному или неадекватному назначению АМП. Отсутствие просветительской работы с пациентами, в частности о необходимости завершения полного курса АМТ, становится причиной досрочного прекращения лечения. Все это способствует формированию и распространению устойчивых штаммов микроорганизмов.
Одной из основных проблем получения достоверных данных в бактериологических лабораториях России является недостаточно хорошее оснащение. Использование нестандартизированных сред и дисков с антибиотиками приводит к получению ложных результатов. В связи с этим значительное количество данных о чувствительности различных микроорганизмов к АМП не может быть использовано для проведения рациональной эмпирической АМТ. Следует также с осторожностью относиться к публикациям в отечественных и зарубежных источниках, в которых отсутствует информация о методах определения чувствительности и критериях интерпретации результатов. Необходимо помнить о том, что данные, полученные в зарубежных странах, могут существенно отличаться от российских, поэтому их нельзя использовать для выбора АМП.
Ситуацию также усугубляет недостаточный контроль за использованием АМП в ветеринарии и сельском хозяйстве. Применение антибиотиков в животноводстве в качестве добавки в корм для скота в малых дозах для стимулирования роста является общепринятой практикой во многих промышленно развитых странах и, как известно, приводит к повышению уровня резистентности микроорганизмов. Сельскохозяйственные животные могут служить резервуаром антибиотикорезистентных бактерий Salmonella spp., Campylobacter spp., Escherichia coli, Clostridium difficile, Staphylococcus aureus (MRSA), Enterococcus faecium (VRE) [7,8].
В настоящее время учитывая потенциальное развитие антибиотикорезистентности, АМП теряют коммерческую привлекательность, что находит подтверждение в отрицательной динамике появления новых системных антибиотиков (рис. 1).
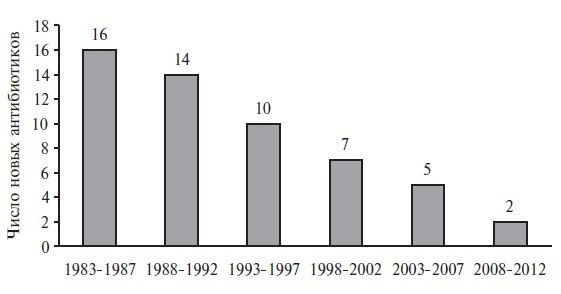
Рис. 1. Динамика появления новых системных антибиотиков
Сдерживание распространения антибиотикорезистентности
Антибиотики на сегодняшний день являются одной из самых часто применяющихся групп лекарственных средств. По данным Ассоциации международных фармацевтических производителей и ГК Ремедиум в 2014 году системные антибиотики в России занимали 4-е место в структуре амбулаторных и 2-е место в структуре госпитальных продаж готовых лекарственных средств.
Системные антибиотики в России, как и в большинстве развитых стран мира, относятся к лекарственным препаратам рецептурного отпуска, однако это требование далеко не всегда соблюдается. Недавнее исследование в рамках проводимой информационной кампании “Антибиотик надежное оружие, если цель бактериальная инфекция” показало, что 57% провизоров и фармацевтов аптечных учреждений Смоленска согласились продать антибиотик пациенту с симптомами острой респираторной инфекции без назначения врача. Более 60% опрошенных жителей Смоленска сообщили, что принимают антибиотики без назначения врача; у 38% опрошенных есть антибиотики в домашней аптечке. Таким образом, возможность свободного доступа стимулирует широкое использование антибиотиков населением для самолечения, что означает высокую вероятность их избыточного применения, ошибок при выборе препарата, дозы, длительности лечения.
В последние годы резко возросла поддержка со стороны органов исполнительной и законодательной власти, а также Министерства здравоохранения Российской Федерации исследований, направленных на сдерживание антибиотикорезистентности. Так, например, Межрегиональная ассоциация по клинической микробиологии и антимикробной химиотерапии (МАКМАХ) и Федеральный научно-методический центр мониторинга резистентности к антимикробным препаратам активно занимаются разработкой страте гических направлений по данной проблеме.
На международный уровень обсуждение данной проблемы вышло на рубеже веков. В 2001 году ВОЗ опубликовала Глобальную стратегию по сдерживанию устойчивости к противомикробным препаратам, а в 2016 году вопрос борьбы с растущей угрозой антибиотикорезистентности был вынесен на повестку дня Генеральной Ассамблеи ООН.
Еще одним знаменательным событием 2016 года стало подписание ведущими международными фармацевтическими, диагностическими и биотехнологическими компаниями совместной декларации о принятии всеобъемлющих мер против инфекций, устойчивых к лекарственной терапии. Декларация была оглашена на Всемирном экономическом форуме в г. Давосе и подписана на сегодняшний день почти 100 фармацевтическими компаниями. Представители индустрии призывают правительства всех стран мира выйти за рамки заявлений о намерениях и в сотрудничестве с компаниями принять конкретные меры для поддержки инвестиций в разработку антибиотиков, средств диагностики, вакцин и других продуктов, имеющих жизненно важное значение для предотвращения и лечения лекарственно устойчивых инфекций. Одновременно с этим в Декларации устанавливаются обязательства подписавших сторон по дальнейшим действиям в области проблем лекарственной устойчивости. Компании обязуются уменьшить воздействие производства АМП на окружающую среду; содействовать надлежащему применению новых и существующих АМП, в том числе за счет поддержки рекомендаций по применению АМП; продолжать и расширять научноисследовательские разработки по созданию новых АМП; поддерживать инициативы, направленные на обеспечение доступа к АМП во всех частях света при любых уровнях доходов.
Заключение
Современная медицина немыслима без АМТ. Антибиотики во много раз сократили смертность от инфекционных заболеваний, смягчили тяжесть их течения, уменьшили количество постинфекционных осложнений. Однако, несмотря на появление в арсенале врачей значительного перечня лекарственных препаратов, активных в отношении практически всех патогенных микроорганизмов, существует значительное количество проблем и нерешенных вопросов в области АМТ [1].
В течение последних десятилетий АМТ инфекционных заболеваний существенно осложняется резистентностью возбудителей к АМП. Постоянный рост резистентности к АМП отмечен среди возбудителей как нозокомиальных, так и внебольничных инфекций. Возникновение резистентности и распространение ее среди микроорганизмов является естественным процессом, возникшим в ответ на широкое использование АМП в клинической практике, однако имеет большое социально-экономическое значение и в развитых странах рассматривается как угроза национальной безопасности. Инфекции, вызванные резистентными штаммами микроорганизмов, отличаются более тяжелым течением, чаще требуют госпитализации и увеличивают продолжительность пребывания в стационаре, ухудшают прогноз для пациентов.
Специалисты в области АМТ выделяют несколько уровней резистентности к АМП глобальный, региональный и локальный. Прежде всего, необходимо учитывать глобальные тенденции в развитии резистентности. Примерами микроорганизмов, у которых во всем мире стремительно распространяется резистентность к АМП, являются Staphylococcus spp., Enterococcus spp, Streptococcus pneumoniae, Neisseria gonorrhoeae, Pseudomonas aeruginosa, Acinetobacter spp., бактерии семейства Enterobacteriaceae и другие. При этом следует помнить, что резистентность не является тотальной. Так, например, Streptococcus pyogenes сохраняет чувствительность к пенициллину.
При планировании политики АМТ внебольничных инфекций следует более рационально опираться на локальные (региональные) данные, полученные в конкретной стране или регионе страны. В Российской Федерации существуют значительные территориальные вариации частоты резистентности возбудителей вне больничных инфекций к АМП. Вот почему необходимы постоянный мониторинг резистентности и информирование врачей различных специальностей. Наряду с региональными данными по резистентности к АМП внебольничных возбудителей в каждом ЛПУ необходимо иметь данные по резистентности нозокомиальных возбудителей, особенно в отделениях с интенсивным использованием АМП: ОРИТ, отделения хирургической инфекции, травматологии и ортопедии [4].
Хотя от адекватных назначений врачей и отказа пациентов от самолечения во многом зависит успех борьбы с проблемой антибиотикорезистентности, этих шагов, к сожалению, недостаточно. Очень многие решения должны быть приняты на национальном уровне, например, запрет на безрецептурный отпуск антибиотиков, усиление законодательства в отношении предотвращения производства и продажи фальсифицированных АМП, снижение применения антибактериальных средств в продовольственном животноводстве. Следует также отметить, что современные тенденции развития фармацевтической промышленности таковы, что гарантий появления новых групп АМП нет [11,12].
Без сомнения, эра АМП сыграла существенную роль в жизни современного общества. Однако только трезвый подход как к проблеме лечения АМП и ее принципам, так и к роли антибиотикотерапии в современном обществе способен обеспечить правильное планирование выпуска АМП и прогнозирование их эффективности в будущем.
Выбор антибиотика при инфекциях. Рекомендации, критерии
Основные принципы антибактериальной терапии — избирательная токсичность в отношении патогенного микроорганизма и относительная безопасность для организма человека. Для их выполнения большое значение имеет использование в качестве мишеней для лекарственных препаратов тех компонентов бактериальной клетки, которые отсутствуют у человека.
Примером такого компонента может быть клеточная стенка, воздействие на которую оказывает слабое влияние на макроорганизм и в то же время губительно для бактерии. Правильно подобранная антибиотикотерапия всегда эффективна и достаточно безопасна.
Несмотря на то, что почти все антибиотики обладают рядом побочных эффектов, серьёзные нарушения возникают достаточно редко. Кроме того, препараты этой группы имеют достаточно высокий терапевтический индекс, а потому побочные эффекты манифестируют только при назначении доз, намного превышающих терапевтическую. Важное исключение — аминогликозиды, наблюдение за концентрацией которых в сыворотке крови имеет первостепенное значение.
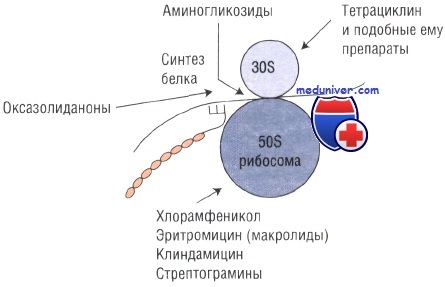
Выбор антибиотика
Выбор антибиотика зависит от локализации очага инфекции, чувствительности микроорганизмов, тяжести заболевания и аллергического анамнеза, вероятности возникновения побочных эффектов, стоимость препарата рассматривают в последнюю очередь. Рациональный выбор терапии зависит от знания локализации возбудителя и профиля его чувствительности к антибиотикам.
Локализация очага инфекции. Способность проникать в ткани (костную, суставную) или спинномозговую жидкость у всех антибактериальных препаратов различна. При абсцессах, а также в тканях с низким кровотоком достаточно трудно достичь высокого уровня антимикробной активности. Кроме того, эффект некоторых антибиотиков (например, аминогликозидов) снижается при низких значениях рН. В связи с этим абсцесс, возникающий внутри костной ткани или в спинномозговом канале, очень тяжело поддаётся лечению.
Чувствительность микроорганизмов. Streptococcus pyogenes высокочувствителен к действию бензилпенициллина, но другие бактерии, например, рода Acinetobacter и Pseudomonas. не восприимчивы к действию большинства антибиотиков, а потому подобрать эффективный препарат бывает достаточно сложно.
Вероятность возникновения аллергических реакций или побочных эффектов. Многие пациенты имеют в анамнезе наличие аллергических реакций к одному или более антибиотикам (наиболее чаще к пенициллину). В таких случаях обычно назначают альтернативное лечение. Возникновение аллергии — основное противопоказание не только к применению препарата, вызвавшего её, но и к назначению других родственных лекарств этой группы.
Противопоказание к использованию аминогликозидов — нарушение функции почек. Применение препаратов цефалоспоринового ряда ограничивается возрастом пациента, так как эти лекарственные средства повышают риск развития суперинфекции (например, в случае С. difficile).

Методы введения антибиотиков в организм при инфекциях
В настоящее время наиболее распространён приём препаратов внутрь (как при амбулаторном, так и при стационарном лечении). Кроме того, антибиотики можно применять местно (при кожных инфекциях), ректально (метронидазол для профилактики осложнений после хирургических операций) или вагинально (в виде пессариев). При тяжёлых инфекционных заболеваниях (септицемия и др.) для обеспечения терапевтического эффекта рекомендовано внутривенное введение антибактериальных препаратов.
Этот метод также показан пациентам, которые не могут принимать лекарства внутрь (например, при повторной рвоте). В педиатрии следует также учитывать вкусовые свойства антибиотиков. Кроме того, для многих пациентов большую роль играет кратность приёма и сложность режима лечения.
Многие пациенты имеют в анамнезе наличие аллергических реакций к одному или более антибиотикам (наиболее чаще к пенициллину).
Контроль антибактериальной терапии инфекции
Для контроля достижения и поддержания терапевтической дозы препарата, а также для снижения риска возникновения токсического эффекта при лечении антибиотиками необходимо наблюдение за состоянием пациентов. Это особенно важно в случаях, когда терапевтическая и токсическая дозы антибиотика отличаются незначительно. Перед внутривенным введением ванкомицина и аминогликозидов, а также по истечении часа после их введения необходимо измерять концентрацию препаратов в сыворотке крови.
Для обеспечения терапевтического эффекта и снижения риска интоксикации полученные результаты анализов должны соответствовать установленным нормам. Например, если концентрация высока, то дозу необходимо уменьшить. Кроме того, понизить уровень препарата в крови помогает снижение частоты его приёма. При приёме пролонгированных форм (когда для обеспечения терапевтического эффекта достаточно однократного приёма в сутки) анализы интерпретируют при помощи нормограммм и сравнивают результаты с общепринятыми нормами.
При лечении инфекций, вызванных частично устойчивыми микроорганизмами, также необходимо измерять концентрацию препаратов в сыворотке крови. Если рост бактерий ингибирует высокая концентрация антибиотика, то важно поддерживать её в сыворотке на постоянном уровне. Если инфекция возникает в труднодоступных местах (например, менингит, вызванный штаммами Pseudomonas), то содержание препарата можно измерить в спинномозговой жидкости.
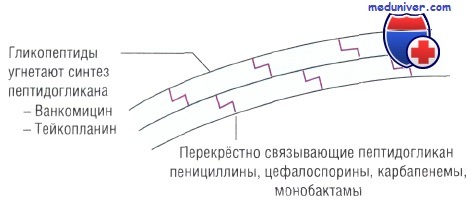
Побочные эффекты антибиотиков
Наиболее распространённый побочный эффект при приёме антибиотиков — незначительные желудочно-кишечные расстройства. В исключительных случаях наблюдают тяжёлые аллергические реакции, приводящие к анафилактическому шоку или сывороточной болезни.
Желудочно-кишечный тракт при антибактериальной терапии. Антибактериальные препараты (особенно бета-лактамы) нарушают баланс нормальной микрофлоры кишечника, вызывая активный рост условно-патогенных микроорганизмов, таких, как род Candida. Таким образом, антибактериальная терапия может привести к острой диарее или более серьёзному осложнению — пневдомембранозному колиту.
Кожа при антибактериальной терапии. Кожные реакции могут быть различны: от лёгкой крапивницы или пятнисто-папулёзной эритематозной сыпи до мультиформной эритемы и крайне опасного синдрома Стивенса— Джонсона. В большинстве своём они не носят угрожающего характера и исчезают при отмене препарата.
Система кроветворения при антибактериальной терапии. У пациентов, принимающих хлорамфеникол или ингибиторы фолиевой кислоты, наблюдают дозозависимое угнетение функции костного мозга. При тяжёлых осложнениях вследствие лечения хлорамфениколом возникает апластическая анемия. Высокие дозы р-лактамных препаратов вызывают гранулоцитопению. Иногда при приёме антибиотиков развивается гемолитическая анемия. Большинство антибактериальных препаратов вызывают обратимую тромбоцитопению или угнетение функции костного мозга.
Мочевыводящая система при антибактериальной терапии. Нефротоксичность аминогликозидов обусловлена их способностью повреждать клетки проксимальных извитых канальцев почек. В группу риска входят пожилые пациенты, лица с заболеваниями почек, а также пациенты, принимающие помимо аминогликозидов другие нефротоксичные препараты (например, антибиотики тетрациклинового ряда).
Печень при антибактериальной терапии. Изониазид и рифампицин могут быть причиной развития гепатита, особенно если у пациентов ещё до приёма этих препаратов были заболевания печени. Другие препараты, связанные с развитием гепатита, — тетрациклины, эритромицин, пиразинамид, этионамид и реже ампициллин или фторхинолоны. Кроме того, при приёме тетрациклинов или высоких доз фузидовой кислоты возникает холестатическая желтуха.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Читайте также:

