Устойчивость кишечной палочки к антибиотикам
Обновлено: 16.04.2024
Изучение этиологической структуры возбудителей инфекций мочевых путей и их чувствительности к антибиотикам необходимо для обеспечения адекватной антибактериальной терапии. Целью исследования было изучение чувствительности к антимикробным препаратам штаммов Escherichia coli, выделенных от пациентов с мочекаменной болезнью. Материалом исследования были 500 историй болезней пациентов с обострением мочекаменной болезни, госпитализированных в скоропомощные стационары г. Воронежа за период 2017-2019 гг. Всем пациентам проводилось общеклиническое обследование с бактериологическим исследованием мочи. Критерием включения пациентов в исследование был положительный результат бактериологического посева мочи в период госпитализации с выделением Escherichia coli. Проведенное исследование показало, что у пациентов с мочекаменной болезнью и с признаками инфекции мочевых путей кишечная палочка была обнаружена в 42,4% случаях. Всего 29,7% штаммов кишечной палочки были чувствительны ко всем исследованным антибиотикам, 70,3% штаммов имели различные фенотипические варианты резистентности: 15,6% - были устойчивы к одной группе антимикробных препаратов, 25,5% - к двум группам, и 29,2% имели множественную антибиотикорезистентность. В структуре штаммов E. coli с монорезистентностью чаще имела место устойчивость к ампициллину и цефтриаксону; с полирезистентностью – к комбинации аминогликозидов с цефалоспоринами. Среди выделенных изолятов E. coli с фенотипом множественной лекарственной устойчивости преобладающее большинство штаммов (53,3%) имело резистентность к комбинации аминогликозидов, пенициллинов, фторхинолонов и цефалоспоринов, второе место заняла комбинация пенициллинов, фторхинолонов и цефалоспоринов.

1. Палагин И.С., Сухорукова М.В., Дехнич А.В., Эйдельштейн М.В., Шевелев А.Н., Гринев А.В., Перепанова Т.С., Козлов Р.С., Коган М.И. Современное состояние антибиотикорезистентности возбудителей внебольничных инфекций мочевых путей в России: результаты исследования "ДАРМИС" (2010–2011) // КМАХ. 2012. №4. С. 280-302.
5. Ny S., Edquist P., Dumpis U., Gröndahl-Yli-Hannuksela K., Hermes J., Kling A-M., Klingeberg A., Kozlov R., Källman O., Lis D., Pomorska-Wesołowska M., Saule M., Wisell K., Vuopio J., Palagin I. Antibiotic resistance of Escherichia coli from outpatient urinary tract infection in women in six European countries including Russia. Journal of Global Antimicrobial Resistance. 2018. Vol.17. P. 25-34. DOI: 10.1016/j.jgar.2018.11.004.
7. Lutgring J.D., Limbago B.M. The Problem of Carbapenemase-Producing-Carbapenem-Resistant-Enterobacteriaceae Detection. Journal of Clinical Microbiology. 2016. Vol. 54. No. 3. P. 529-34. DOI: 10.1128/JCM.02771-15.
10. Мамчик Н.П., Батищева Г.А., Габбасова Н.В., Гончарова Н.Ю., Миляева Н.И., Хаперсков А.В. Структура и резистентность ведущих уропатогенов внебольничных инфекций мочевых путей в г. Воронеже за период 2013-2014 гг. // Медицинский альманах. 2017. № 4 (49). С. 63-65.
11. Барканова О.Н., Векильян М.А., Реброва Е.В., Шепелева Ю.Б. Уровень антибиотикорезистентности возбудителей калькулезного пиелонефрита в отделении урологического профиля города Волгограда в 2013 г // Вестник Волгоградского государственного университета. 2016. №4. С.13-16.
Риск формирования резистентных возбудителей значительно возрастает в условиях латентного течения инфекционного процесса, сопровождающегося нарушением оттока мочи у пациентов при мочекаменной болезни (МКБ). В свою очередь, инфекция мочевыводящих путей может играть основополагающую роль в камнеобразовании [8]. По мнению ряда авторов, отрицательные бактериологические анализы мочи у пациентов с нефролитиазом не являются гарантией отсутствия инфекции в мочевыводящих путях, а при необходимости инвазивных вмешательств (диагностических или лечебных) назначение антибактериальных препаратов должно быть обязательным (так называемая пери- или предоперационная профилактика) [9]. Проведенное недавнее исследование показало, что десятая часть ведущих уропатогенов внебольничных ИМП, в т.ч. Escherichia coli, выделенных от пациентов Воронежской области, представлена полирезистентными штаммами, что ограничивает использование для эмпирической терапии при инфекциях мочевых путей не только защищенных пенициллинов, но и антибиотиков из группы цефалоспоринов и фторхинолонов [10]. Постоянное обнаружение E. coli в качестве ведущего возбудителя инфекций мочевыводящих путей определяет необходимость контроля ее резистентности у пациентов с мочекаменной болезнью, имеющих признаки инфекции.
Целью исследования было изучение чувствительности к антимикробным препаратам штаммов Escherichia coli, выделенных от пациентов с обострением мочекаменной болезни.
Материалы и методы исследования
Выделение флоры проводили на агар стандартными бактериологическими методами. Чувствительность выделенных культур к антибиотикам изучалась диско-диффузионным методом с применением стандартных дисков на среде Мюллера-Хинтона с интерпретацией результатов согласно МУК 4.2.1890-04. Критерием включения пациентов в исследование был положительный результат бактериологического посева мочи в период госпитализации с выделением Escherichia coli. Клинически значимым уровнем бактериурии считали 10 6 -10 8 КОЕ/мл.
Статистический анализ производился с использованием программ Biostat (версия 4.3) и Microsoft Excel. Соответствие полученного распределения нормальному распределению определялось по критерию Колмогорова-Смирнова. Количественные признаки описаны с указанием медианы и значений нижнего и верхнего квартилей. Качественные признаки представлены абсолютной величиной и процентной долей в структуре всей совокупности. Для анализа различий в двух группах использовали непараметрический критерий Манна-Уитни. При проверке статистических гипотез принимался 5%-ный уровень значимости.
Результаты исследования и их обсуждение
У 29,7% штаммов кишечной палочки наблюдалась чувствительность ко всем исследованным антибиотикам, 15,6% - были резистентны к одной группе антимикробных препаратов, 25,5% - к двум группам, и 29,2% имели множественную резистентность. Достоверно реже в структуре штаммов E. coli встречались изоляты с монорезистентностью, р=0,008.
На основании результатов бактериологических исследований все пациенты с МКБ и положительными результатами бактериологических исследований были разделены на четыре группы наблюдения. Первую группу составили 63 человека (29,7%), у которых выделена E. coli, чувствительная ко всем антибактериальным препаратам. Во вторую группу вошли 33 (15,6%) пациента, у которых в посеве мочи обнаружена E. coli, резистентная к одному антимикробному препарату. Третью группу составили 54 (25,5%) пациента, у которых была обнаружена E. coli, резистентная к двум антибактериальным препаратам. Четвертую группу составили 62 пациента (29,2%), у которых E. coli была резистентна к трем и более антибактериальным препаратам, то есть имеющая фенотип множественной резистентности. Характеристика выделенных групп представлена в таблице 1.
Этой статьей мы начинаем рассмотрение представителей микробиологического мира, с которыми чаще всего встречаем в ежедневной клинической практике, и темой сегодняшнего разговора будет кишечная палочка, она же Escherichia coli (E.coli).
Материалы предназначены исключительно для врачей и специалистов с высшим медицинским образованием. Статьи носят информационно-образовательный характер. Самолечение и самодиагностика крайне опасны для здоровья. Автор статей не дает медицинских консультаций: клинический фармаколог — это врач только и исключительно для врачей.
Автор: Трубачева Е.С.,
врач – клинический фармаколог
Этой статьей мы начинаем рассмотрение представителей микробиологического мира, с которыми чаще всего встречаем в ежедневной клинической практике, и темой сегодняшнего разговора будет кишечная палочка, она же Escherichia coli (E.coli).
Микробиологические аспекты
E.coli относится к типичным представителям семейства Enterobacteriaceae, являясь грамотрицательной бактерией, факультативным анаэробом в составе нормальной кишечной микрофлоры человека. Но тут же становится патогеном, выбравшись из среды нормального обитания, хотя отдельные штаммы являются патогенными и для желудочно-кишечного тракта. То есть кишечная палочка относится к кишечным комменсалам, кишечным патогенам и внекишечным патогенам, каждый из которых мы кратко разберем.
К штаммам E.coli, действующим как кишечные патогены и встречающимся чаще других, относятся:
- Штамм серотипа O157:H7 (STEC O157) или так называемый энтерогеморрагический штамм E.coli, который является причиной 90% случаев геморрагических колитов и 10% случаев гемолитико-уремического синдрома. Встречается достаточно часто, а если вы работаете в стационарах плановой помощи, то это один из обязательных анализов для принятия решения о госпитализации, так что так или иначе он на слуху. Проблема инфицирования этим возбудителем связана с употреблением плохо термически обработанной пищи и передачи штамма контактным путем от человека к человеку, проще говоря, через руки.
- Второй крайне опасный высоко-патогенный штамм кишечной палочки – O104:H4, вызвавший в Германии 2011 году эпидемию с высоким уровнем смертности среди пациентов с пищевыми токсико-инфекциями вследствие развития гемолитико-уремического синдрома. Если помните, это была очень громкая история с перекрытиями границ для испанских огурцов, потом вообще для всей плодоовощной продукции из Европы в Россию, пока искали хотя бы источник, не говоря уж о виновнике тех событий. Окончательно виновными тогда были обозначены листья салата, в поливе которых использовалась вода с признаками фекального заражения, а затем речь пошла уже о пророщенных семенах, которые так же полили фекально-зараженной водичкой. Так вышли на конкретный штамм E.coli – O104:H4, который, подвергшись санации антибиотиком, выплескивает эндотоксин, вызывающий гемолиз и острую почечную недостаточность. В итоге – массовая летальность пациентов, получавших антибиотики.
Затем тот же штамм обнаружился при вспышке ПТИ в Финляндии, но к тому времени пациентов с диареями до появления микробиологических результатов перестали лечить бактерицидными антибиотиками и ситуация была купирована в зародыше.
И третий громкий (для нашей страны) случай – это массовое заболевание питерских школьников в Грузии, где так же был выявлен этот штамм (пресс-релиз Роспотребнадзора по данному случаю лежит здесь).
Когда кишечная палочка выступает внекишечным патогенном? Почти всегда, когда обнаруживается вне места своего нормального обитания.
- Заболевания мочевыводящий путей. Здесь E.coli является абсолютным лидером и играет ведущую роль в развитии:
- Острых циститов
- Пиелонефритов
- Абсцессов почек и
- Простатитов
Этот факт объясняется близким анатомическим расположением двух систем и огрехами в личной гигиене, что позволяет на этапе эмпирической терапии вышеперечисленных заболеваний сразу же назначать препараты, активные в отношении кишечной палочки.
- Заболевания желудочно-кишечного тракта:
- Диарея путешественников
- Интраабдоминальные абсцессы и перитониты, чаще всего носящие вторичный характер (прободение кишки в результате первичного заболевания, либо при дефектах оперативного вмешательства)
- Инфекции центральной нервной системы у очень ослабленных пациентов, результатом чего будет развитие менингитов. Встречается в основном у лиц старческого возраста и новорожденных. Кроме того, в случае внутрибольничного заражения менингит может развиться в результате плохой обработки рук медицинского персонала перед оперативным вмешательством или перевязками.
- Инфекции кровотока, а именно сепсис, как продолжение развития заболеваний мочевыводящих путей, ЖКТ и билиарного тракта вследствие метастазирования очага инфекции. Лечению поддается крайне тяжело, особенно если задействованы внутрибольничные штаммы, летальность чрезвычайно высокая.
- Инфекции кожи и мягких тканейкак следствие раневых инфекций после вмешательств на органах брюшной полости.
- Внутрибольничные пневмонии, вызванные устойчивыми штаммами кишечной палочки, целиком связаны с дефектами ухода за пациентом и фактором чистоты, точнее ее отсутствия, рук медицинского персонала или ухаживающих родственников. Факт внутрибольничного заражения доказывается элементарно, что будет наглядно продемонстрировано в следующем разделе.
- Послеродовые (и не только) эндометриты. Вынуждены упомянуть и эту патологию, так как инфицирование кишечной палочкой встречается все чаще и чаще, а большой настороженности нет. Как результат, можно очень сильно промахнуться с антибактериальной терапией и, как следствие, прийти к экстирпации органа в виду неэффективности антибиотикотерапии. Натолкнуть на мысль может более позднее, чем обычно, поступление и более агрессивное, чем обычно течение. Дополнительный осмотр прианальной области так же может натолкнуть на вероятность развития именно такого инфицирования.
(часть вторая) Практические вопросы диагностики и лечения.
Когда мы можем заподозрить, что перед нами пациент с инфекцией, вызванной кишечной палочкой?
- Пациенты с диареей, приехавшие из отпуска и все-таки смогшие прийти на прием (диарея путешественников или энтеротоксигенные штаммы E.coli).
- Пациенты со всеми заболеваниями мочевыделительной системы, в том числе беременные, но строго с наличием симптоматики (не надо лечить бессимптомную бактериурию, иначе вырастите резистентные штаммы и создадите проблему и себе, и женщине, и роддому в последующем).
- В стационарах – нозокомиальные пневмонии, послеоперационные менингиты, перитониты, сепсисы и т. д., носящие вторичный характер.
Подтвердить или полностью исключить кишечную палочку из возбудителей может только микробиологическое исследование. Конечно, в современных условиях микробиология уже становится практически эксклюзивом, но мы пришли учиться, а учится надо на правильных примерах, поэтому далее будет рассмотрен ряд антибиотикограмм, выполненных автоматизированными системами тестирования. Вдруг вам повезет, и в вашем лечебном учреждении все уже есть или в ближайшее время будет, а вы уже умеете с этим всем работать?
Если вы читаете данный цикл по порядку, то в базовом разделе по микробиологии был выложен ряд антибиотикограмм некоего микроорганизма в контексте нарастания антибиотикорезистентности, и это была наша сегодняшняя героиня – кишечная палочка.
- Начнем с дикого и крайне симпатичного штамма E.coli, который живет в кишечнике и обеспечивает синтез витамина К. С ним сталкиваются доктора амбулаторной службы у пациентов с инфекциями мочевыводящих путей или в случае госпитализации у пациентов, которые не получали антибиотики около года. И именно такую чувствительность мы имеем в виду, когда назначаем эмпирическую антибиотикотерапию
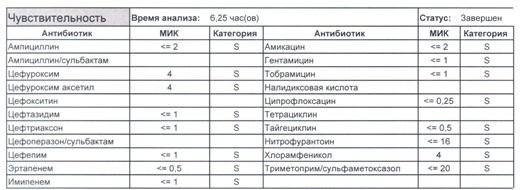
- Как видите, зверь чувствителен абсолютно ко всему, и это как раз тот случай, когда можно свободно пользоваться табличными материалами справочников или клинических рекомендаций, так как механизмы резистентности полностью отсутствуют.
- Если в ваши руки попал пациент, которого в течение последнего полугодия лечили антибиотиками пенициллинового ряда, то антибиотикограмма может выглядеть следующим образом.
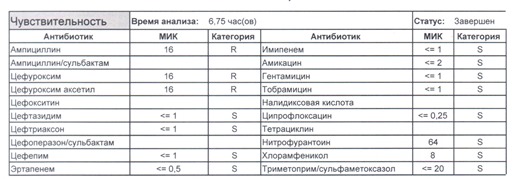
Если такая кишечная палочка окажется внекишечным патогенном, и перед вами будет беременная и ИМП (самый частый случай), то нам необходимо преодолеть резистентность к пенициллинам, то есть подавить деятельность пенициллиназ. Соответственно высокую эффективность продемонстрируют препараты с ингибиторами бета-лактамаз, чаще всего амоксициллина/клавуланат, как наиболее безопасный и эффективный. Единственное, пациентку необходимо предупредить, что в результате стимуляции рецепторов кишечника может развиться антибиотик-ассоциированная диарея.
- Отдельно хотелось бы обратить внимание на следующий штамм E.coli, как типичного обладателя бета-лактамаз расширенного спектра. И эти БЛРС чаще всего вырабатываются в результате неуемного использования цефалоспоринов третьего поколения и совершенно конкретного его представителя – цефтриаксона.
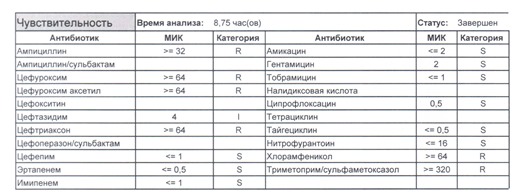
В каких ситуациях мы можем увидеть (или подумать) о таком звере:
- Пациент сам рассказывает, что получал цефтриаксон в промежутке полугодия
- Пациент был переведен из другого стационара (хотя там можно будет и следующую картинку обнаружить)
- Пациент ничего не получал, и вообще в больнице не лежал, но возбудитель попал с рук медицинского персонала, вызвав внутрибольничную инфекцию
- И самый простой случай – посев был взят в момент проведения терапии цефтриаксоном
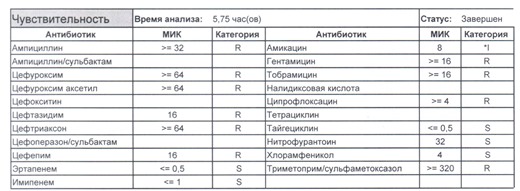
Подобный пациент не придет к вам своими ногами, его не увидит амбулаторная служба, это абсолютно стационарные больные, и если их привезут, то только из другого лечебного учреждения. Чаще всего это пациенты палат интенсивной терапии или реанимации, и такой возбудитель носит на 100% нозокомиальный характер.
Когда можем его обнаружить:
- вторичные перитониты,
- нозокомиальные пневмонии,
- пиелонефриты,
- послеоперационные менингиты,
- сепсис и т. п.
- Для эрадикации такого возбудителя нужен не просто отдельный обученный специалист и имеющая весь набор препаратов резерва аптека, но и напряженная работа эпидемиологической службы, так как подобный пациент должен быть изолирован в отдельную палату, а лучше изолятор (не подумайте, что бред – при правильной организации такие вещи вполне реальны) с проведением карантинных мероприятий, так как основная проблема появления подобного рода возбудителей в том, что они очень быстро разбегаются по всему корпусу (или стационару, если корпуса не изолированы) и обсеменяют все и вся, нанося вред другим ослабленным тяжелой болезнью пациентам и заселяя кишечники всего медицинского персонала.
- И еще одно крайне мерзкое свойство таких возбудителей – они умеют осуществлять горизонтальный перенос механизмов резистентности с другой флорой семейства Enterobacteriaceae, и даже если вы избавились от E.coli, неприятным сюрпризом может стать ее подруга клебсиелла, наносящая еще больший вред и по сути добивающая больного. Избавится полностью от этих возбудителей невозможно, для этого надо избавится от медицинского персонала как основных носителей, но контролировать можно – мероприятия подробно расписаны в действующих СанПиН 2.1.3.2630-10. Так что в случае выявления подобного возбудителя речь пойдет не только о лечении того пациента, у которого он обнаружен, но и проведения мероприятий по недопущению инфицирования всех остальных пациентов (а это, напомню, почти всегда ПИТ или ОРИТ), находящихся рядом.
- И в заключение необходимо упомянуть о панрезистентной E.coli, вооруженной полным спектром механизмов резистентности. В антибиотикограмме будут тотальные R, а МПК возбудителей пробьют все возможные потолки. К счастью для автора, она с таким зверем пока не сталкивалась, что связано с наличием работающей системы эпиднадзора, поэтому картинки не будет, хотя ее несложно представить. Такие пациенты, если кишечная палочка окажется патогеном, а не колонизатором (мало ли с чьих рук, например, в рану упала), к сожалению, почти не выживают, так как изначально являются крайне тяжелыми соматически, а кишечная палочка обычно подводит черту к их существования на бренной земле.
- Не допускать развития такой, не побоюсь этого слова, зверюги в ваших стационарах, а если появилась – гонять эпидемиологическую службу, чтобы избавляла руки и поверхности от такого рода заражения, что возможно только при условии наличия достаточного количества расходных материалов, перчаток и дезинфицирующих средств.
А теперь подведем небольшой итог нашего непростого разговора:
- Кишечная палочка – возбудитель очень серьезный и не следует его недооценивать. В ее типах также необходимо четко ориентироваться.
- В первую очередь о ней мы думаем при лечении инфекций мочевыводящих путей, особенно у беременных.
- Если перед нами пациент с признаками кишечной инфекции, то подход к терапии антибиотиками должен быть сугубо индивидуальным, и если состояние позволяет, то до получения микробиологии – вообще без антибиотиков. Если не позволяет – это должны быть бактериостатики.
- Мы никогда не лечим только анализ, и даже микробиологическое заключение, мы всегда лечим пациента со всем комплексом его симптомов и синдромов. Но микробиология помогает решить как дифференциально-диагностические задачи, что и позволяет отделить безусловный патоген от мирно живущего комменсала.
- Микробиологическая диагностика носит ключевое значение как для подтверждения самого возбудителя, так и для выбора необходимого антибиотика
- В случае выявления резистентных и панрезистентных возбудителей, помимо лечения самого пациента должна в полной мере задействоваться эпидемиологическая служба лечебного учреждения
Темой сегодняшнего разговора будут одни из наиболее распространенных микроорганизмов из семейства Enterobacteriaceae – энтерококки, которые являются грамположительными кокками и факультативными анаэробами.
Материалы предназначены исключительно для врачей и специалистов с высшим медицинским образованием. Статьи носят информационно-образовательный характер. Самолечение и самодиагностика крайне опасны для здоровья. Автор статей не дает медицинских консультаций: клинический фармаколог — это врач только и исключительно для врачей.
Автор: Трубачева Е.С., врач – клинический фармаколог
Темой сегодняшнего разговора будут одни из наиболее распространенных микроорганизмов из семейства Enterobacteriaceae – энтерококки, которые являются грамположительными кокками и факультативными анаэробами.
Микробиологические аспекты
Энтерококки входят в состав нормальной микрофлоры кишечника, обитают в основном в тонкой кишке и при этом, обнаруживаясь за пределами своей естественной среды обитания, являются возбудителями множества социально-значимых заболеваний. Наибольшее клиническое значение имеют E.faecalis и E.faecium.
Отличительным свойством энтерококков является их способность к образованию биопленок. О биопленках достаточно подробно мы рассуждали в статье, посвященной синегнойной палочке. И специфика течения многих заболеваний, вызванных энтерококками, объясняется именно пленкообразованием.
Клинические аспекты
Наиболее частым возбудителем внебольничных инфекций является E.faecalis – сюда относятся инфекции мочевыводящих путей и инфекционные эндокардиты у внутривенных наркозависимых пациентов.
E.faecium наиболее часто выявляется при нозокомиальных инфекциях – здесь преобладают так же инфекции мочевыводящих путей, но связанные с проведением инструментальных методов исследования, а также всевозможные виды бактеремий, связанных с медицинскими вмешательствами.
Когда мы можем думать о состояниях, вызванных энтерококками?
- Менингиты, как следствие черепно-мозговых травм, нейрохирургических вмешательств и при наличии антомических дефектов центральной нервной системы
- Перитониты любой этиологии
- Пельвиоперитониты (в составе микст-флоры)
- У пациентов с диабетической стопой
- У пациентов с инфекциями мочевыводящих путей, особенно в случаях их катетеризации
- Уросепсис
- У внутривенных наркозависимых – наравне с зеленящими стрептококками – энтерококки являются одними из наиболее частых возбудителей, а потому эмпирическая антибактериальная терапия должна перекрывать оба эти возбудителя
- Холангиты и инфекции билиарного тракта
- Катетер-ассоциированные инфекции (наряду с эпидермальными стафилококками)
Существуют следующие факторы риска инфицирования энтерококками:
Как мы можем заметить, основную роль в развитии заболеваний, вызванных энтерококками, играет человеческий, точнее ятрогенный фактор. Энтерококки, как и вся остальная кишечная микрофлора, по воздуху летать не умеют, да и ножками не ходят, а потому главное в их нераспространении – чистота наших рук и соблюдение санитарно-противоэпидемических правил, написанных, как и большинство подобных документов (например, как ПДД), кровью, причем кровью пациентов.
Аспекты лечения
Их можно разделить на лекарственные и нелекарственные.
Аспекты медикаментозного лечения
Здесь автор отступит от правила и не отправит изучать вопрос по книжкам и таблицам, а попытается расписать антибактериальную терапию более подробно. Это связано и со спецификой самого возбудителя, и со спецификой контингента, имеющего заболевания, им вызванные.
Как уже упоминалось ранее, наряду с зеленящим стрептококком, а вообще намного чаще, энтерококк является основным возбудителем инфекционного эндокардита у лиц с внутривенной наркотической зависимостью. Проще говоря, если перед вами наркозависимый, и у него эндокардит трикуспидального клапана, то первое, о чем вы должны подумать, – это энтерококк, и эмпирическую терапию назначать с учетом этого знания. Конечно, могут быть варианты в виде того же зеленящего стрептококка или даже золотистого стафилококка, но эти возбудители более присущи пациентам с несанированной ротовой полостью и на митральном клапане (зеленящий) или после кардиохирургического вмешательства (золотистый стафилококк). Также на стафилококковый, а не энтерококковый характер поражения будет намекать снимок органов грудной клетки в прямой проекции, подозрительно напоминающий решето (один раз увидев стафилококковую метастатическую пневмонию ее уже ни с чем не перепутаешь).
Чем будем лечить?
Как ни странно это прозвучит в современных условиях, но препаратами выбора будут представители аминопенициллинового ряда – ампициллин (дешевле) или амоксициллин (в разы дороже) в обязательной комбинации с аминогликозидом –гентамицином (этот дешевле) или амикацином. Поэтому если вы работаете в стационаре скорой помощи и у вас попадаются пациенты данной категории – ампициллин для инъекций крайне рекомендуется иметь на полках аптеки в достаточных количествах. Это до сих пор дешево, сердито и очень эффективно в случаях терапии энтерококковых инфекций почти любой этиологии, и главное правильно рассчитать дозу, так как аминопенициллины относятся к так называемым время-зависимым препаратам (читаем первую и вторую часть здесь).
Повторимся еще раз – аминопенициллины в данном случае должны использоваться только в комбинации с аминогликозидами ввиду их синергетического действия в отношении энтерококков и ввиду вероятности микст-инфекции у подобной категории пациентов.
Вопрос по эмпирическому использованию ванкомицина остается дискуссионным – если в случае E.faecalis его можно назначать на уровне эмпирической терапии, когда у пациента имеется документированная аллергия на пенициллины (если конечно вам покрасили мазок по Граму или ваш стационар настолько крут, что имеет свой масс-спектрометр), то в случае E.faecium даже начинать не стоит — сразу зовите специально обученного человека, пусть он думает, что дальше делать.
Как уже было выше упомянуто, цефалоспорины назначать не стоит — энтерококки к ним природно устойчивы. А для того чтобы рука потянулась к карбопенемам, вам надо иметь доказанную мульти-резистентность возбудителя.
В случае развития резистентности к ампициллину используется его защищенная форма в виде ампициллина/сульбактама в комбинации с гентамицином. Дозировки рассчитываются по ампициллину.
Если совсем не повезло и лаборатория дала мультирезистентного фекального энтерококка, то используется комбинация ванкомицин (15 мг/кг/сут) в комбинации с гентамицином (8 мг/кг/сут) под жесточайшим контролем функции почек. Кроме того, в случае мультирезистентного возбудителя может быть использована комбинация имипенема с ампициллином, если, конечно, сможете обосновать ее для страховой компании – автор обосновывала, необходимый эффект получала, пациент не только выживал, но и выздоравливал. Только призывать к такого рода схемам, описанным, в основном, в американской литературе, автор ни в коем случае не будет, особенно в нынешние неспокойные времена. Сейчас наши основные документы по назначению любого вида терапии располагаются здесь.
В случае обнаружения резистентного E.faecium препаратом выбора становится линезолид и, не побоюсь этого слова, молитва, так как срок лечения не менее 8 недель, а кто нам столько препарата выдаст, да и прогноз при применении бактериостатика как-то не очень.
- Катетер-ассоциированные инфекции: помимо удаления катетера и обязательного исследования оного в микробиологической лаборатории, установки нового катетера в новом месте, также используется ампициллин в комбинации с гентамицином (в тех же дозировках, что описаны выше) либо ванкомицин (15 мг/кг/сут), если пациент демонстрирует аллергическую реакцию на оные, либо линезолид 600 мг каждые 12 часов, либо даптомицин 6 мг/кг/сут (если сможете его добыть).
- Инфекции мочевыводящих путей– здесь предпочтение стоит отдать пероральному амоксициллину в комбинации с клавулановой кислотой дважды в день. Вызвана сия рекомендации тем, что это чаще всего эта инфекция, присущая амбулаторному этапу, будет вызвана дикой и непуганой флорой, и заодно прикроетесь от вероятной кишечной палочки как второго возбудителя. Если ситуация развилась в стационаре – смотрим пункт первый и лечим по той же схеме.
- Отдельного упоминания требует лечение ванкомицин-резистентных энтерококков, так как видят их уже практически все доктора хирургического и реанимационного профиля. Арсенал наш в этом случае крайне беден – это, по сути, только линезолид да даптомицин. Линезодид является бактериостатиком, дающим высокие риски миелосупресии и тромбоцитопении через 2 недели от начала применения, которое должно составлять не менее 8 недель, но это, по сути, единственный шанс для пациента с энтероккоковым менингитом, устойчивым к ванкомицину, так как даптомицин, который надо найти, и как-то убедить его купить (стоит он просто безбожных денег), в мозговые оболочки не проникает в виду размера самой молекулы. Можно также упомянуть о тигециклине (100 мг нагрузочная и далее по 50 мг каждые 12 часов), но он тоже стоит как самолет. Поэтому самым лучшим вариантом лечения ванкомицин-устойчивых энтерококковых инфекций является их недопущение в принципе, то есть СанПин, СанПин и еще раз СанПин. А уж если такой пациент все-таки приключился, то необходима немедленная изоляция оного в отдельную палату, а еще лучше в изолятор, чтобы от него не переинфицировать всех вокруг, если вдруг кто-то про обработку рук забудет.
На этом краткий обзор энтерококковых инфекций закончим, и из кишечной микрофлоры у нас останется только королева внтурибольничных инфекций – ее величество Klebsiella, о которой мы поговорим в одной из следующих публикаций.

Студент медицинского факультета УЛГУ. Интересы: современные медицинские технологии, открытия в области медицины, перспективы развития медицины в России и за рубежом.
- Запись опубликована: 08.10.2019
- Reading time: 1 минут чтения
Ученые выяснили, как кишечные палочки защищаются от антибиотиков. Результаты не радуют.
Бактерии начинают и выигрывают
Многие больные страдают от повторяющихся инфекций мочевыводящих путей, несмотря на антибиотикотерапию. Дело в том, что возбудители научились защищаться от антибиотиков.

Кишечные палочки, вызывающие инфекции мочевыводящих путей в 61% случаев, обладают способностью проникать в мочевыделительную систему из кишечника. Во время антибиотикотерапии они меняют свои свойства, становясь шаровидными и неправильными L-формами без клеточных стенок.
Антибиотики пенициллин, амоксициллин, фосфомицин и другие убивают бактерии, блокируя клеточные стенки во время деления клетки. На измененные формы препараты не действуют.
В течение шести месяцев исследователи исследовали 360 образцов мочи больных, страдающих от повторных инфекций мочевыводящих путей. В моче 46% пациентов были обнаружены кишечные палочки сферической неправильной формы без клеточных стенок.
На момент трансформации кишечные палочки теряют активность, и симптомы инфекции исчезают. Больные считают, что выздоровели, но через некоторое время снова обретают клеточную стенку и палочкообразную форму. Симптомы инфекции возникают снова.
От временной потери клеточной стенки микробы только выигрывают. Таким образом, кишечные палочки избегают атаки иммунных клеток, которые теряют способность их распознавать.
Ученым придется изобретать новые лекарства
Поэтому назначение антибиотиков должно сопровождаться посевами мочи на чувствительность. Только так можно подобрать препарат, оказывающий максимальное лечебное действие.
Пока еще больным удается подобрать антибиотики, уничтожающие микроорганизмы, но такая возможность может скоро кануть в Лету.
Читайте также:

