Узи при цитомегаловирусной инфекции
Обновлено: 24.04.2024
УЗИ, МРТ при цитомегаловирусной инфекции у плода
а) Сокращения:
• Цитомегаловирус (ЦМВ)
б) Лучевая диагностика:
1. Общие сведения:
• Если подтверждено инфицирование матери, инфицирование плода предполагают при наличии следующих изменений:
о Прогрессирующая ЗРП
о Микроцефалия
о Гепато- или спленомегалия:
- Вследствие экстрамедуллярного гемопоэза
- Анемия вследствие угнетения кроветворения или гемолиза
о Кальцинаты (внутренних органов или головного мозга)
о Водянка плода
2. УЗИ при цитомегаловирусной инфекции у плода:
• Головной мозг:
о Вентрикуломегалия (от умеренной до тяжелой - 45% новорожденных с врожденной инфекцией):
- Изменение перивентрикулярной эхогенности
- Интравентрикулярные адгезии
о Кальцинаты (часто без акустических теней):
- Гиперэхогенные очаги в мозговом веществе могут локализоваться перивентрикулярно, в коре головного мозга и в базальных ганглиях
о Кисты вещества головного мозга:
- Перивентрикулярные, передневисочные, затылочные, лобно-теменные
- У детей кисты в передневисочной области и сопутствующие изменения белого вещества с большой долей вероятности свидетельствуют
о ЦМВ-инфекции:
Аналогичные изменения могут отмечаться у плода
о Микроцефалия (до 27% плодов с врожденной инфекцией)
о Кортикальная дисплазия
о Изменения мозжечка и большой цистерны (у 67% новорожденных с врожденной инфекцией объем мозжечка уменьшен)
о Признаки лентикулостриарной васкулопатии:
- Одно- или двусторонние изогнутые гиперэхогенные полосы в базальных ганглиях, таламусе
• Гепатоспленомегалия
• Кардиомиопатия, неиммунная водянка плода
• ЗРП
3. МРТ при цитомегаловирусной инфекции у плода:
• Кортикальная дисплазия (определяется у 10% детей с врожденной ЦМВ):
о Лиссэнцефалия, пахигирия
о Полимикрогирия (фокальная или диффузная)
4. Рекомендации по лучевой диагностике:
• Советы по проведению исследования:
о При головном предлежании плода для получения изображений головного мозга с наибольшим разрешением используют ТВУЗИ
о Для уточнения изменений головного мозга (например, кортикальной дисплазии, мозжечковой гипоплазии) используют МРТ:
- МРТ имеет более высокую чувствительность в отношении диагностики нарушений со стороны головного мозга по сравнению с УЗИ (92 и 38% соответственно), а также для прогнозирования клинически проявляющейся инфекции (83 и 33% соответственно)
- В случае высокого риска инфицирования у плода УЗИ и МРТ дополняют друг друга и не являются взаимоисключающими методами
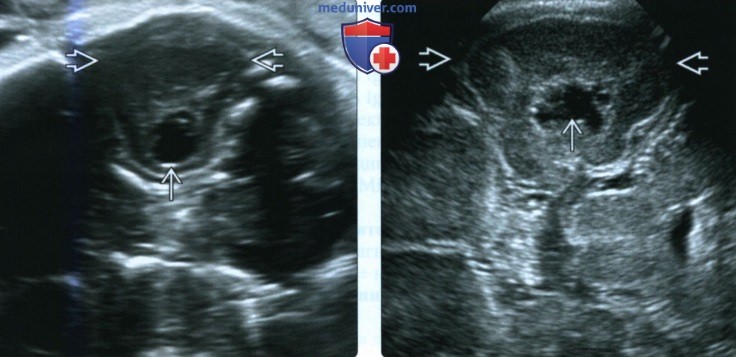
(Слева) УЗИ головного мозга плода в III триместре. Диагностирована ЦМВ-инфекция. В правой височной доле визуализируются вновь образованные кисты неправильной формы.
(Справа) Тот же случай. Ультразвуковой срез через сосцевидный отросток у новорожденного подтверждает наличие паренхиматозных кист в височной доле. ЦМВ-инфекция провоцирует воспаление и высвобождение нейротоксических факторов, вызывающих фокальный некроз вещества головного мозга. Кисты передней части височной доли в сочетании с поражением белого вещества - характерные признаки ЦМВ-инфекции.
в) Дифференциальная диагностика цитомегаловирусной инфекции у плода:
1. Другие врожденные инфекции:
• Парвовирусная инфекция:
о Характерное проявление у плода - асцит
о Водянка плода вследствие анемии
• Токсоплазмоз:
о Внутричерепные кальцинаты
о Печеночные кальцинаты и гепатоспленомегалия
• Ветряная оспа:
о Кальциноз (печень, сердце, почки), поражения кожи
• Простой герпес:
о Гиперэхогенный кишечник, вентрикуломегалия
• Сифилис:
о Гепатоспленомегалия, расширение петель кишечника, искривление трубчатых костей, патология эпифизов
• ВИЧ:
о ЗРП, при тяжелой форме - внутриутробная смерть
• Краснуха:
о Дефекты сердца, микроцефалия, микрофтальм, ЗРП
2. Другие причины неиммунной водянки плода:
• Анеуплоидия, анемия, тахиаритмия
3. Другие причины гиперэхогенного кишечника:
• Анеуплоидия, патология пищеварительного тракта, включая кишечную непроходимость, муковисцидоз
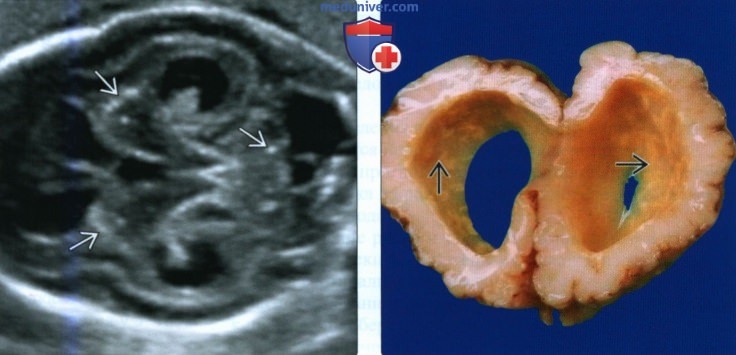
(Слева) УЗИ головного мозга плода в 25 нед. Диагностирована ЦМВ-инфекция. Определяются вентрикуломегалия и несколько кальцинатов в перивентрикулярном пространстве и в толще вещества головного мозга При УЗИ в 22 нед. данные кальцинаты не определялись.
(Справа) Похожий случай. Макропрепарат. Гидроцефалия и многочисленные желтоватые субэпендимальные кальцинаты.
г) Патологоанатомические особенности:
1. Общие сведения:
• ЦМВ является ДНК-содержащим вирусом семейства герпесвирусов:
о Подобно другим герпесвирусам ЦМВ может вызывать латентную форму инфекции и ее реактивацию
о Вирус обладает нейротропизмом, реплицируется в эпендиме, герминальном матриксе и эндотелии капилляров
2. Гистологические особенности:
• Иммуногистохимическое окрашивание ЦМВ-специфическими антителами выявляет крупные многоядерные клетки с внутрицитоплазматическими и внутриядерными включениями
• В инфицированных ЦМВ органах и костном мозге практически всегда присутствует воспалительная инфильтрация; тяжесть воспалительного ответа коррелирует со степенью повреждения
д) Клинические особенности:
1. Клиническая картина:
• Проявления у плода и новорожденного:
о Самопроизвольный аборт, преждевременные роды, мерт-ворождение
о Микроцефалия, вентрикуломегалия, внутримозговые кальцинаты
о ЗРП, водянка плода
о Гепатоспленомегалия, кальциноз внутренних органов
о Тромбоцитопения, анемия о Хориоретинит, тугоухость
о Задержка умственного развития, судороги
• Клинические проявления у взрослых, как правило, отсутствуют:
о Может быть диагностирована только при обнаружении изменений у плода с помощью УЗИ
о Возможны недомогание, лихорадка, лимфаденопатия, гепатоспленомегалия
2. Демографические особенности:
• Эпидемиология:
о Человек является единственным известным хозяином вируса:
- Горизонтальный путь передачи при непосредственном контакте: контакт с биологическими субстанциями, мочой, кровью или при трансплантации органов
- Вертикальный путь передачи: трансплацентарная передача инфекции плоду:
Инфицирование матери на ранних сроках беременности повышает риск осложнений у плода, инфицирование на поздних сроках повышает риск передачи вируса
о Самая частая врожденная инфекция во всем мире:
- Заболеваемость врожденной ЦМВ-инфекцией составляет ~1% живых новорожденных (в мире - 0,3-2,4%)
о Врожденная ЦМВ-инфекция является наиболее частой причиной умственных нарушений, нейросенсорной тугоухости и поражения органа зрения инфекционной природы
о Частота первичного инфицирования при беременности достигает 2,2%:
- Частота вертикальной (трансплацентарной) передачи -40%:
Частота передачи при первичном инфицировании в III триместре - 75-80%
о Частота вторичного инфицирования во время беременности (т.е. реактивация присутствующей в организме инфекции) — 5%:
- Частота вертикальной передачи - 5-10%
- Клинические проявления у инфицированных новорожденных обычно отсутствуют, однако у них повышен риск умеренных нарушений зрения, слуха и умственного развития
о Установлено, что в США ежегодно у 8000 новорожденных обнаруживается неврологический дефицит, обусловленный ЦМВ-инфекцией
3. Естественное течение и прогноз:
• Первичное инфицирование во время беременности:
о Выявление нарушений у плода связано с неблагоприятным неврологическим исходом у ребенка
о Острая симптоматика при рождении отмечается у 5-15% детей с врожденной инфекцией:
- Смертность в течение 2 лет достигает 30%
- Неврологические осложнения - до 80% (нейросенсорная тугоухость, нарушения зрения, умственное расстройство):
- Нейросенсорная тугоухость присутствует у 10—15% детей с клиническими проявлениями при рождении:
Прогрессирующая - в 50% случаев, флуктуирующая - в 20%
о У 85-95% новорожденных с врожденной инфекцией клинические проявления на момент рождения отсутствуют:
- Даже при отсутствии ультразвуковых признаков у плода неврологические осложнения отмечаются у 30% детей в течение 1-го года жизни
- У 10-15% детей с изначальным отсутствием симптомов к школьному возрасту развиваются неврологические нарушения, нарушения слуха или зрения
• Точная диагностика врожденной ЦМВ-инфекции имеет принципиальное значение, поскольку антивирусная терапия эффективно снижает поражение органа слуха у детей с клиническими проявлениями
4. Лечение цитомегаловирусной инфекции у плода:
• Диагностика первичной ЦМВ-инфекции у матери:
о Интерпретация результатов первого серологического анализа на ЦМВ часто затруднена:
- IgM могут определяться до 1 года после перенесенной острой инфекции
- IgM могут появляться в случае реактивации инфекции
о При подозрении на инфекцию у матери проводят исследование на специфические антитела IgM, IgG к ЦМВ и авидность IgG:
- Авидность IgG низкая в случае острой инфекции
- Авидность IgG высокая в случае рецидива или реактивации инфекции
о Появление специфических IgG к ЦМВ у ранее серонегативной женщины или обнаружение специфических IgM-антител к ЦМВ в сочетании с низкой авидностью IgG к ЦМВ
• Диагностика вторичной ЦМВ-инфекции у матери:
о В основе диагностики - значительное нарастание титра антител IgG ± наличие IgM и высокая авидность IgG
• Диагностика инфекции у плода с помощью амниоцен-теза:
о Пренатальная диагностика ЦМВ-инфекции у плода должна основываться на результатах амниоцентеза:
- Накопление диагностической концентрации вируса в околоплодных водах занимает 5-7 нед.
- Проведение кордоцентеза до 20 нед. беременности технически затруднено
о Если при УЗИ у плода заподозрена ЦМВ-инфекция, беременной предлагают амниоцентез, даже если серологическое исследование не подтверждает недавнюю сероконверсию:
- Для определения последовательности вирусного генома используется полимеразная цепная реакция
- Значимым прогностическим фактором является вирусная нагрузка в крови матери, амниотической жидкости и крови плода
о Соотношение риска и пользы от амниоцентеза при вторичной инфекции у матери отличается из-за меньшего риска вертикальной передачи (5-10%)
• Диагностированное инфицирование является показанием к прерыванию беременности
• Исследуется лечение специфическим иммуноглобулином
• После подтверждения ЦМВ-инфекции у плода для выявления нарушений и прогнозирования поражения плода каждые 2—4 недели выполняют УЗИ:
о Отсутствие нарушений при УЗИ не является гарантией благоприятного исхода
• Вакцинация против ЦМВ является предметом исследований
е) Особенности диагностики:
1. Признаки, учитываемые при интерпретации изображений:
• Кальцинаты головного мозга или базальных ганглиев имеют низкую плотность или расположены точечно
• Отсутствие кальцинатов не исключает врожденную ЦМВ-инфекцию
2. Информация, отражаемая в заключении:
• Многие изолированные изменения головного мозга являются неспецифическими, однако при наличии двух патологических находок или более необходимо провести обследование на ЦМВ
ж) Список использованной литературы:
1. Hadar Е et al: Antenatal risk factors for symptomatic congenital CMV disease following primary maternal CMV infection. J Perinat Med. ePub, 2015
2. Hui L et al: Perinatal outcome after maternal primary cytomegalovirus infection in the first trimester: a practical update and counseling aid. Prenat Diagn. 35(1): 1—7, 2015
3. McCormick AL et al: The immunological underpinnings of vaccinations to prevent cytomegalovirus disease. Cell Mol Immunol. 12(2): 170-9, 2015
4. Naing ZW et al: Congenital cytomegalovirus infection in pregnancy: a review of prevalence, clinical features, diagnosis and prevention. Aust N Z J Obstet Gynaecol. 56(1):9—18, 2015
Редактор: Искандер Милевски. Дата обновления публикации: 23.11.2021
Диагностика врожденной цитомегаловирусной инфекции головного мозга по КТ, МРТ, УЗИ
а) Терминология:
1. Сокращения:
• Врожденная цитомегаловирусная инфекция (ЦМВИ)
2. Определение:
• Врожденная инфекция, вызванная трансплацентарной передачей ЦМВ, представителя семейства герпесвирусов:
о Наиболее частый источник внутриутробной инфекции в США
б) Визуализация:
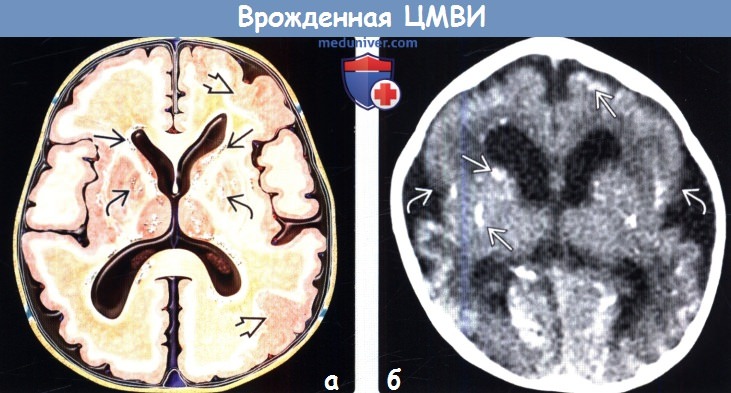
(а) На рисунке аксиального среза изображены многочисленные перивентрикулярные кальцификаты и отложения кальция в базальных ганглиях. Обратите внимание на участки кортикальной дисплазии (полимикрогирия). Расширение желудочков отражает потерю объема смежного белого вещества (БВ). Желтоватые зоны измененного БВ отражают зоны отека, демиелини-зации и/или глиоза.
(б) Бесконтрастная КТ, аксиальный срез: определяются распространенные перивентрикулярные и паренхиматозные кальцификаты. Обратите внимание на открытые сильвиевы щели и упрощенную архитектонику коры в пери-сил ьвиевых отделах. При МРТ была подтверждена полимикрогирия.
2. КТ признаки врожденной цитомегаловирусной инфекции (ЦМВИ):
• Бесконтрастная КТ:
о Внутричерепные кальцификаты (в 40-70% случаев): перивентрикулярные (субэпендимальные) (герминолитические)
о Потеря объема БВ, гиподенсные зоны в БВ, ± перивентрикулярные кисты, вентрикуломегалия
о Аномалии развития коры, извилин
о Гипоплазия мозжечка
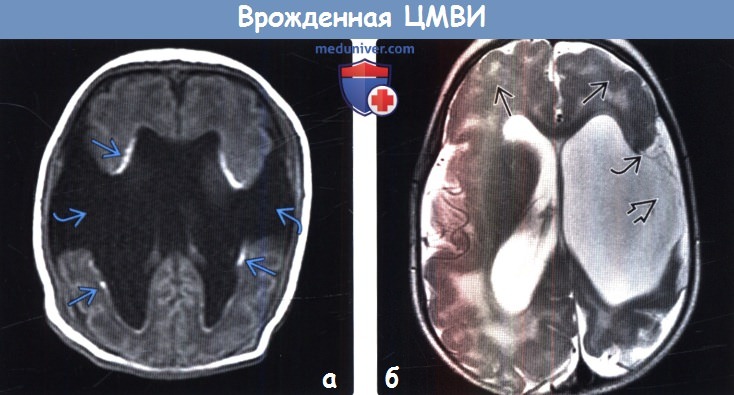
(а) МРТ, Т1 -ВИ: у младенца с врожденной ЦМВИ обнаруживается двусторонняя открытая шизэнцефалия. Обратите внимание на перивентрикулярное повышение интенсивности сигнала, что обусловлено кальцификацией.
(б) МРТ, Т2-ВИ, аксиальный срез: определяется открытая шизэнцефалия левого полушария головного мозга. Расщелина выстлана полимикрогирической корой. Обратите внимание на протяженную двустороннюю полимикрогирию лобных долей. Центральные зоны повышения сигнала от БВ отражают зоны демиелинизации или глиоза.
5. Рекомендации по визуализации:
• Лучший метод визуализации:
о УЗИ для пренатального или неонатального скрининга
о В проведении бесконтрастной КТ необходимость бывает редко
о МРТ головного мозга для комплексной оценки изменений
• Советы по протоколу исследования
о Неонатальная высокоразрешающая нейросонография:
о Бесконтрастная КТ или МРТ с использованием Т2* GRE для обнаружения слабо выраженных кальцификатов или кровоизлияний
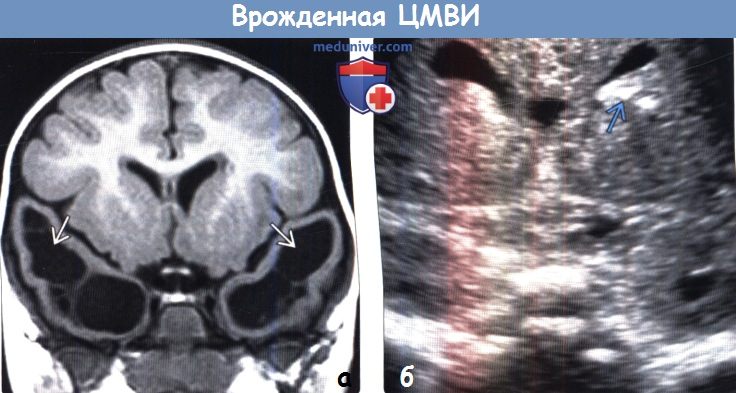
(а) МРТ, Т1-ВИ, корональный срез: у младенца с микроцералией определяются множественные перивентрикулярные полостные герминолитические кисты. Обнаружение этих кист при УЗИ, КТ или МРТ должно побуждать к рассмотрению возможности наличия врожденной ЦМВИ.
(б) Нейросонография, корональный срез: у младенца с врожденной ЦМВИ определяются перивентрикулярные гиперэхогенные очаги, соответствующие кальцификатам.
в) Дифференциальная диагностика врожденной цитомегаловирусной инфекции (ЦМВИ):
1. Врожденный лимфоцитарный хореоменингит:
• Ареновирус, переносимый грызунами: переносится дикими домовыми мышами и хомяками
• Некротизирующий эпендимит приводит к обструкции сильвиева водопровода (макроцефалия в 43% случаев, микроцефалия в 13% случаев)
• При бесконтрастной КТ может очень похоже имитировать ЦМВИ
2. Токсоплазмоз:
• Вызывается протозойными паразитами:
о факторы риска матери включают:
- Контакт с экскрементами кошек во время беременности
- Употребление в пищу сырого или неприготовленного мяса
• В 1/10 случаев частота схожа с ЦМВИ, макрокрания > микрокрания, дисплазия коры встречается реже, церебральные кальцификаты имеют стохастический характер
3. Псевдо-TORCH синдромы:
• Синдромы Берейтсера-Реардона, Айкарди-Гутьерес (плеоцитоз, ↑ α-интерферона в СМЖ)
о Аутосомно-рецессивный характер, прогрессирующая демиели-низация и дегенерация большого мозга и мозжечка
о Кальцификация базальных ганглиев и ствола мозга, перивентрикулярные кальцификаты встречаются менее часто
• Мутации гена OCLN, кодирующего окклюдин:
о Аутосомно-рецессивная микроцефалия
о Полимикрогирия с лентовидными участками субкортикальной кальцификации
г) Патология:
1. Общие характеристики врожденной цитомегаловирусной инфекции (ЦМВИ):
• Этиология:
о ЦМВИ - Повсеместно распространенный ДНК-содержащий вирус семейства герпесвирусов
о Нейротропный вирус, который реплицируется в эпендиме, герминальном матриксе, эндотелии капилляров
о Хроническая ишемия вследствие плацентита приводит к вторичной недостаточности перфузии
• Наиболее частая причина внутриутробной инфекции
• Механизмы инфекции:
о Внутриутробная инфекция:
- Первичное инфицирование матери во время беременности или повторная активация латентной инфекции у матери
о Неонатальная инфекция:
- Инфицирование при родах, передача вируса через грудное молоко или при переливании крови
3. Макроскопические и хирургические особенности:
• Микроцефалия
• Инфекция на ранних сроках гестации:
о Некроз герминальных зон, уменьшение количества глии и нейронов, потеря объема БВ
4. Микроскопия:
• Отличительный признак ЦМВИ: цитомегалия с вирусным поражением ядер и наличие цитоплазматических включений
• Фрагментарный и фокальный некроз клеток (в частности, клеток герминального матрикса)
• Воспаление сосудов и тромбоз, сосудистая и субэпендимальная дистрофическая кальцификация
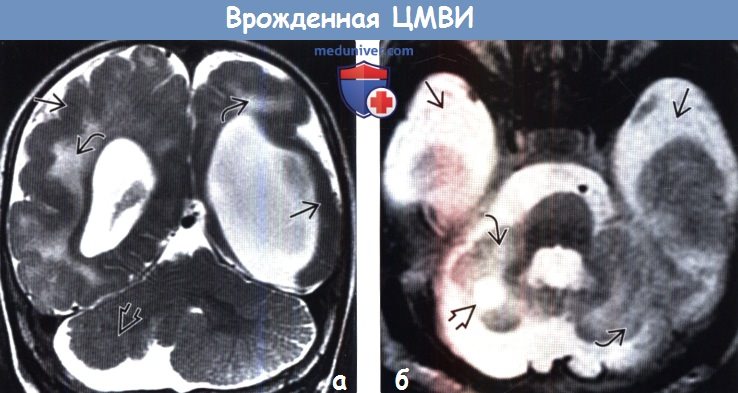
(а) МРТ, Т2-ВИ, корональный срез: определяется вентрикуломегалия, вызванная потерей объема центрального. Повышение сигнала от БВ отражает отек, глиоз или демиелинизацию. Кроме того, визуализируется полимикрогирия. Также обратите внимание на гипоплазию правого полушария мозжечка.
(б) МРТ, Т2-ВИ, аксиальный срез: у новорожденного определяется гипоплазия мозжечка и фокальное кистозное поражение мозжечка. Расширение субарахноидального пространства средней черепной ямки свидетельствует об атрофии височных долей.
д) Клиническая картина:
1. Проявления врожденной цитомегаловирусной инфекции (ЦМВИ):
• Наиболее частые признаки/симптомы:
о Клинические симптомы у большинства инфицированных новорожденных отсутствуют
о У 10% пациентов имеются системные признаки заболевания:
- Гепатоспленомегалия, петехии, хориоретинит, желтуха, задержка внутриутробного развития
о У 55% пациентов с системным заболеванием имеет место поражение ЦНС:
- Микроцефалия, судороги, гипотония или гипертония, ней-росенсорная тугоухость (НСТ)
• Клинический профиль:
о Более высокий риск вертикальной передачи вируса у женщин с серонегативной пробой
• Методы диагностики:
о Однослойная культура клеток для выявления ЦМВ (анализ мочи)
о Поздняя диагностика цитомегаловирусной ДНК методом ПЦР с использованием неонатальной карты Гатри
о Повышение в СМЖ уровня 3-2 микроглобулина, микроцефалия, нейровизуализационные признаки определяют исход
2. Демография:
• Эпидемиология:
о Поражает 1% всех новорожденных (10% из которых имеют признаки и симптомы поражения ЦНС или системного заболевания)
о 40% матерей, заразившихся инфекцией во время беременности, передают вирус плоду
3. Течение и прогноз:
• Три прогностические группы:
о Новорожденные с неврологическими проявлениями (микроцефалия, перивентрикулярное отложение Са++):
- До 95% детей имеют значительные нарушения со стороны неврологического развития
о У новорожденных только с системными проявлениями (гепатоспленомегалия, петехии, желтуха) прогноз более благоприятный, но клиническая картина при этом остается тяжелой
о Инфицированные новорожденные, не имеющие ни неврологических, ни системных проявлений, имеют наиболее благоприятный прогноз, но по-прежнему подвержены риску задержки развития, формирования моторного дефицита и НСТ
о Общая смертность - 5%
4. Лечение врожденной цитомегаловирусной инфекции (ЦМВИ):
• Терапия ганцикловиром инфицированных новорожденных может быть полезна
е) Диагностическая памятка:
1. Обратите внимание:
• Предполагайте врожденную ЦМВИ у отстающих в развитии младенцев с микроцефалией, НСТ
2. Советы по интерпретации изображений:
• Врожденный ЦМВ-энцефалит следует подозревать у ребенка при обнаружении методом МРТ следующих изменений:
о Микроцефалия, аномалии миграции, перивентрикулярные кисты, поражение БВ и гипоплазия мозжечка
• В случае, когда при бесконтрастной КТ обнаруживаются классические признаки ЦМВ-энцефалита, но результаты исследования на предмет (S)TORCH-инфекции отрицательные, следует предполагать:
о Лимфоцитарный хореоменингит (ЛХМ) и псевдо-TORCH синдромы

Профессиональные диагностические инструменты. Оценка эластичности тканей, расширенные возможности 3D/4D/5D сканирования, классификатор BI-RADS, опции для экспертных кардиологических исследований.
Введение
В настоящее время отмечается большой рост внутриутробной герпетической инфекции и увеличение числа инфицированных новорожденных. Среди инфекций герпетической этиологии наибольшую распространенность имеет цитомегаловирусная инфекция (ЦМВИ) и герпес-вирусная инфекция, вызываемая вирусами простого герпеса (ВПГ) I и II типов. У новорожденных 80% герпес-вирусной инфекции вызываются ВПГ II типа. Исходом даже бессимптомно протекающей во время беременности инфекции могут быть тяжелые последствия у плода: врожденные уродства, поражение различных органов и систем, наиболее серьезным из которых является повреждение головного мозга.
Клинические проявления в неонатальном периоде отмечаются лишь у 10% анте- или интранатально инфицированных детей, у остальных же внутриутробное инфицирование в периоде новорожденности протекает бессимптомно. Летальность у детей с генерализованной герпес-вирусной и цитомегаловирусной инфекцией при отсутствии химиотерапии составляет 90%; у 50% выживших отмечаются тяжелые психоневрологические исходы 3.
Быстрая и надежная расшифровка этиологии заболевания у новорожденного приобретает особую актуальность в связи с появляющейся в последние годы возможностью проведения этиотропной терапии.
Основным методом диагностики этих заболеваний является иммунологический метод. Но он далеко не всем доступен из-за дороговизны, трудоемкости, значительного времени, необходимого для постановки окончательного диагноза. Кроме того, этот метод не дает возможности установить вовлечение в патологический процесс головного мозга, что крайне важно для выбора лечебных мероприятий. Поэтому в настоящее время основным диагностическим методом на первом этапе помимо клинических методов является эхоэнцефалография, позволяющая оценить степень вовлечения головного мозга и других внутренних органов в инфекционный процесс.
На основании данных эхографии головного мозга и клинической картины заболевания у новорожденных можно начинать проводить лечение детей "по подозрению". В дальнейшем эти дети составят группу для комплексного иммунологического обследования, в результате которого диагноз будет уточнен.
Как свидетельствуют литературные данные, наиболее часто у детей с внутриутробной герпес-цитомегаловирусной инфекцией при эхоэнцефалографии выявляют кисты сосудистых сплетений боковых желудочков и (или) субэпендимальные кисты [4]. Показано, что при изолированных кистах сосудистых сплетений (без анализа причин их возникновения) прогноз психоневрологического развития детей в целом благоприятный [5]. При субэпендимальных кистах инфекционного происхождения прогноз неопределенный : от нормального развития до выраженного церебрального дефицита 8. В связи с этим цель настоящего исследования состояла в оценке психоневрологического статуса детей, имевших кисты сосудистых сплетений и (или) субэпендимальные кисты, с внутриутробной герпес-цитомегаловирусной инфекцией, подтвержденной данными комплексного иммунологического исследования.
Материалы и методы
Из многочисленной группы новорожденных (396 новорожденных с субэпендимальными кистами и 261 с кистами сосудистых сплетений) нами впоследствии (после завершения периода наблюдения) были отобраны 16 детей с подтвержденной иммунологическими методами герпес-цитомегаловирусной инфекцией, которые были подвергнуты динамической эхоэнцефалографии и клиническому обследованию в течение 2-12 мес. Показаниями для проведения иммунологического исследования на первом этапе являлись структурные изменения головного мозга, выявленные при эхографии, косвенно свидетельствующие о наличии внутриутробной инфекции.
Иммунологическая диагностика состояла в выявлении специфического антигена иммуноферментным и иммунофлюоресцентным методами, фрагментов ДНК вируса методом полимеразной цепной реакции, определении специфических антител в биологических средах. Материалом для исследования у детей служили кровь, моча и ликвор, у матерей - кровь. Обследование матерей проводили для повышения достоверности диагноза у их детей.
Всем детям проводили динамическую эхоэнцефалографию с первой недели до 2-9 мес. жизни. Эхографию головного мозга осуществляли с помощью различных ультразвуковых приборов, часть исследований выполнена на аппарате SA-8800 "GAIA" ("Medison", Южная Корея). Всего выполнено 59 эхографических исследований головного мозга.
Результаты и обсуждение
В клинической картине у 3 детей отмечался синдром угнетения функций ЦНС, который выражался в снижении церебральной и двигательной активности, мышечного тонуса и угнетении физиологических рефлексов новорожденных; у этих же детей выявлено вовлечение в патологический процесс органов дыхания с развитием пневмонии. У 2 новорожденных отмечена затянувшаяся желтуха с гепатоспленомегалией, у 2 - отечный синдром. У 4-го ребенка неврологическая симптоматика отсутствовала, у него были выявлены изменения со стороны внутренних органов в виде гепатоспленомегалии и затянувшейся желтухи.
При эхоэнцефалографии у детей I группы выявлено от 1 до 3 изолированных кистозных структур (не сочетающихся с другими структурными изменениями) диаметром от 0,2-0,5 см (рис. 1, 2), расположенных в верхушке или теле сосудистого сплетения левого бокового желудочка. У 3-х из этих детей исходные данные вентрикулометрии соответствовали нормальным значениям. У 1-го ребенка отмечено незначительное (до 0,6 см) расширение межполушарной щели и субарахноидальных пространств по конвекситальной поверхности мозга и умеренное симметричное увеличение ширины лобных рогов (преимущественно) и высоты тел боковых желудочков (до 0,7 см).
Рис. 1. Эхоэнцефалограмма ребенка Р. со смешанной герпес-цитомегаловирусной инфекцией, 7-е сут. жизни. Стрелками обозначена киста в верхушке сосудистого сплетения левого бокового желудочка.


Рис. 2. Эхоэнцефалограмма ребенка Д. с цитомегаловирусной инфекцией, 2-е сут. жизни. Стрелками обозначены кисты в теле сосудистого сплетения левого бокового желудочка.


В конце периода наблюдения, который составлял от 2 до 7 мес., у 2 детей кисты сосудистых сплетений имели прежние размеры и число; у них данные вентрикулометрии, как при первом УЗИ, соответствовали возрастной норме. У одного ребенка киста сосудистых сплетений уменьшилась в размерах с 0,5 до 0,1 см; у него отмечено дальнейшее симметричное расширение боковых желудочков (ширина их лобных рогов и высота тел увеличилась с 0,7 до 0,9 см) и межполушарной щели и субарахноидальных пространств по конвекситальной поверхности мозга от 0,6 до 0,9 см. У одного ребенка этой группы при эхоэнцефалографии, проведенной в 7 мес. жизни, киста сосудистых сплетений не выявлялась, однако у него произошло симметричное увеличение ширины лобных рогов (преимущественно) и высоты тел боковых желудочков до 1 см и расширение субарахноидальных пространств по конвекситальной поверхности мозга до 0,7 см. При катамнестическом наблюдении только у этого ребенка выявлена незначительная задержка психомоторного развития, у 3 других детей I группы признаки церебрального дефицита не отмечены.
Всем детям этой группы проводилась иммунотерапия цитотектом и пентаглобином ("Biotest", Германия); в том числе 2 детям - иммунохимиотерапия (противоцитомегаловирусный иммуноглобулин - цитотект и виролекс). При анализе полученных данных какой-либо связи клинических проявлений заболевания, данных комплексного иммунологического обследования с локализацией кисты сосудистых сплетений, их числом, размерами и динамикой не выявлено.
По данным комплексного иммунологического обследования, у 6 детей была установлена смешанная герпес-цитомегаловирусная, у 3 - цитомегаловирусная и у 3 - герпес-вирусная инфекция. В клинической картине у этой группы больных выявлено полиморфное поражение с преобладанием признаков нарушений функций нервной системы у всех детей: преимущественно синдромом угнетения - у 9, гипервозбудимости - у 3. Вовлечение в патологический процесс органов дыхания отмечено у 5 новорожденных, затянувшаяся желтуха с гипербилирубинемией - у 9, гепатомегалия - у 2, отечный синдром - у 3 детей.
У детей этой группы при первом эхоэнцефалографическом исследовании были выявлены субэпендимально расположенные кистозные структуры на уровне таламо-каудальной вырезки (ТКВ) и (или) кпереди от нее диаметром от 0,3 до 1,1 см. У части новорожденных субэпендимальные кисты были представлены единой полостью с однородным или неоднородным содержимым, у других детей эти структуры напоминали соты, т. е. состояли из множества жидкостных включений, окруженных эхопозитивным ободком (рис. 3). Эти структурные особенности субэпендимальных кист, по-видимому, обусловлены разными стадиями резорбции. У 10 детей субэпендимальные кисты располагались в симметричных участках обоих полушарий, у 2 новорожденных - только в левом полушарии. У 3 детей, помимо субэпендимальных кист, расположенных в таламо-каудальной вырезке и (или) кпереди от нее, дополнительно выявлены субэпендимальные щелевидные кистозные структуры на уровне средних или передних отделов лобных рогов (см. рис. 3).
Рис. 3. Эхоэнцефалограмма ребенка Б. со смешанной герпес-цитомегаловирусной инфекцией, 5-е сут. жизни.

а) Правое полушарие. Стрелками обозначены субэпендимальные кисты, имеющие вид сот, расположенные в таламокаудальной вырезке и кпереди от нее.

б) Левое полушарие. Стрелками обозначены субэпендимальные кисты, имеющие вид сот, расположенные в таламокаудальной вырезке и кпереди от нее.

в) Правое полушарие. Стрелками обозначены субэпендимальные щелевидные кистозные структуры на уровне передних и средних отделов лобных рогов боковых желудочков.

г) Левое полушарие. Стрелками обозначены субэпендимальные щелевидные кистозные структуры на уровне передних и средних отделов лобных рогов боковых желудочков.
У всех новорожденных этой группы исходные данные вентрикулометрии соответствовали нормальным значениям. В конце периода наблюдения, составляющего от 2 до 9 мес., размеры желудочковой системы у 9 детей оставались на нормальных значениях, у 3 детей отмечалось умеренное (до 0,9 см), симметричное увеличение ширины лобных рогов (преимущественно) и высоты тел боковых желудочков. Кроме того, у 1 ребенка выявлено расширение межполушарной щели и субарахноидальных пространств по конвекситальной поверхности мозга до 0,7 см. В течение периода наблюдения субэпендимальные кисты уменьшались в размерах у 11 детей (полностью резорбировались в конце периода наблюдения у 10 из них) и только у 1 ребенка односторонняя субэпендимальная киста увеличилась к 2 мес. жизни с 0,5 до 1 см.
Всем новорожденным II группы, как и детям I группы, проводилась иммунотерапия различными иммуноглобулинами (цитотект, пентаглобин), 3 детям - иммунохимиотерапия (цитотект, виролекс). Положительный терапевтический эффект отмечался у всех детей этой группы.
Эффективность лечения оценивалась по срокам выхода из тяжелого состояния, ликвидации или уменьшению явлений инфекционного токсикоза, нарастанию массы тела, данным динамической эхоэнцефалографии и лабораторным показателям. При катамнестическом наблюдении психоэмоциональное и моторное развитие у 6 детей II группы соответствовало возрастной норме. У других 6 детей этой группы в течение первого полугодия отмечено выраженное в различной степени отставание психомоторного развития (3-е из них имели вентрикуломегалию). К концу первого года жизни признаки церебрального дефицита у них отсутствовали.
Как и в I группе детей, мы не выявили отчетливой связи между числом, локализацией, динамикой субэпендимальных кист и данными комплексного иммунологического обследования, а также клиническими проявлениями заболевания как в раннем неонатальном периоде, так и в конце периода наблюдения.
Как известно, субэпендимальные кисты, возникающие при инфекции, являются результатом поражения субэпендимально расположенного герминативного матрикса инфекционным агентом. В начале процесса в зоне повреждения герминативного матрикса возникает участок некроза, который по мере его резорбции в течение 3-4 нед. трансформируется в кистозную полость [9]. Полная резорбция кисты, как показали наши исследования, происходит к концу 2-4 мес. жизни ребенка (чем больше кистозная полость, тем дольше идет процесс ее резорбции). Так как во всех приводимых нами наблюдениях уже при первом эхографическом исследовании головного мозга были выявлены субэпендимальные кисты, мы можем утверждать, что повреждение герминативного матрикса произошло в период внутриутробного развития.
Из 396 новорожденных с субэпендимальными кистами только один ребенок имел гестационный возраст 30 нед., подавляющее число новорожденных (88,9%) были доношенными. Зная время, необходимое на формирование субэпендимальной кисты в зоне некроза, можно предположить, что в подавляющем большинстве случаев повреждение матрикса произошло в конце II - начале III триместра беременности. При повреждении герминативного матрикса на стадии активной пролиферации его клеток (до 20 нед. гестации), обеспечивающей формирование серого вещества и глии [6], можно ожидать возникновения пороков развития головного мозга, обусловленных нарушением миграции, или внутриутробной гибели плода. Поскольку как первое, так и второе встречаются довольно редко, кроме того, учитывая, что субэпендимальные кисты в основном выявлены у доношенных детей, мы полагаем, что до 20 нед. гестации герминативный матрикс обладает определенной резистентностью к действию инфекционного агента.
Структурные же изменения головного мозга у новорожденных в виде субэпендимальных кист, по-видимому, являются исходом повреждения герминативного матрикса, находящегося в процессе регрессии (после завершения своей основной функции). Опровергнуть или подтвердить это предположение могут данные скринингового ультразвукового исследования головного мозга плода, проведенного в начале II триместра беременности, высококвалифицированным специалистом с использованием трансвагинального датчика.
Схожесть клинической картины заболевания у новорожденных I и II групп, этиологии процесса, установленной иммунологическим методом, а также высокий терапевтический эффект при использовании одних и тех же лекарственных препаратов свидетельствуют о том, что не кисты сосудистых сплетений и субэпендимальные кисты являются определяющими в клинической картине заболевания, а, по-видимому, сходные патоморфологические изменения, возникающие в головном мозге под влиянием инфекции, не обнаруживаемые при эхоэнцефалографии. Кисты сосудистых сплетений и субэпендимальные кисты - лишь маркеры этих патологических процессов. В то же время, выявление при эхографии головного мозга кист сосудистых сплетений и (или) субэпендимальных кист при клинической картине, характерной для внутриутробных вирусных инфекций, дает основание для проведения иммунохимиотерапии еще до получения результатов иммунологического исследования, что ведет к снижению тяжелых церебральных расстройств у детей раннего возраста.
Литература
- Кудашов Н.И., Озерова О.Е., Орловская И.В. Неврологические проявления при герпесвирусной инфекции у новорожденных // Педиатрия . - 1997. - N5. -С.42-45.
- Whitley R.T. Neonatal herpes Simplex infections // J. Med.Virol. - 1993. - V.1.- Suppl.- P.13-21.
- MurguiapdepSierra T., Florido J.,Minox T., Arriola M et al. Neonatal herpetic encephalitis . Current concepts concerning a case.// Rev. Invest. Clin. - 1996. - V.48. - N 1. - P. 35-41.
- Озерова О.Е., Кудашов Н.И., Орловская И.В. Особенности эхоэнцефалограммы у новорожденных с герпетической инфекцией // Ультразвуковая диагностика в акушерстве, гинекологии и педиатрии. - 1993. - N2. - С. 55-70.
- Озерова О.Е., Казьмин А.М., Дайхина Л.В., Кудашов Н.И., Орловская И.В. Клиническое значение кист сосудистых сплетений желудочков головного мозга у новорожденных // Акушерство и гинекология - 1993. - N 1. - вС. 31-33.
- Mito T., Ando Y.,Takeshita K.,Takada K., Takashima S. Ultrasonographical and morphological examination of subependimal cysts lesions in maturely born infants //Neuropediatrics. - 1989. - V.20. - N 4. - P. 211-214.
- Zorzi C., Angonese I. Subependimal pseudocysts in the neonate // Eur. J. Pediatr. - 1989. - V.148. - P. 462-464.
- Yamashita Y., Outani Y., Kawano Y., Horikawa M et al. Clinical analyses and short-term prognoses of neonates with subependimal cysts // Pediatr. Neurol. - 1990. - V.6. - N6. - P. 375378.
- Озерова О.Е., Казьмин А.М., Дайхина Л. В. Субэпендимальные кровоизлияния у новорожденных: эхографическая характеристика и психоневрологические исходы // Акушерство и гинекология. - 1991. - N3. - С. 40-43.

УЗИ сканер HS60
Профессиональные диагностические инструменты. Оценка эластичности тканей, расширенные возможности 3D/4D/5D сканирования, классификатор BI-RADS, опции для экспертных кардиологических исследований.
Цитомегалия – это инфекционное заболевание вирусного генеза, передающееся половым, трансплацентарным, бытовым, гемотрансфузионным путем. Симптоматически протекает в форме упорной простуды. Отмечается слабость, недомогание, головные и суставные боли, насморк, увеличение и воспаление слюнных желез, обильное слюноотделение. Часто протекает бессимптомно. Опасна цитомегалия беременных: она может вызывать самопроизвольный выкидыш, врожденные пороки развития, внутриутробную гибель плода, врожденную цитомегалию. Диагностика осуществляется лабораторными методами (ИФА, ПЦР). Лечение включает противовирусную и симптоматическую терапию.
МКБ-10
Общие сведения
Другие названия цитомегалии, встречающиеся в медицинских источниках, - цитомегаловирусная инфекция (ЦМВ), инклюзионная цитомегалия, вирусная болезнь слюнных желез, болезнь с включениями. Цитомегалия является широко распространенной инфекцией, и многие люди, являясь носителями цитомегаловируса, даже не подозревают об этом. Наличие антител к цитомегаловирусу выявляется у 10—15% населения в подростковом возрасте и у 50% взрослых людей. По некоторым источникам, носительство цитомегаловируса определяется у 80% женщин детородного периода. В первую очередь это относится к бессимптомному и малосимптомному течению цитомегаловирусной инфекции.

Причины
- воздушно-капельным: при чихании, кашле, разговоре, поцелуях и т.д.;
- половым путем: при сексуальных контактах через сперму, влагалищную и шеечную слизь;
- гемотрансфузионным: при переливании крови, лейкоцитарной массы, иногда - при пересадке органов и тканей;
- трансплацентарным: во время беременности от матери плоду.
Нередко цитомегаловирус находится в организме многие годы и может ни разу не проявить себя и не нанести вреда человеку. Проявление скрытой инфекции происходит, как правило, при ослаблении иммунитета. Угрожающую по своим последствиям опасность цитомегаловирус представляет у лиц со сниженным иммунитетом (ВИЧ-инфицированных, перенесших трансплантацию костного мозга или внутренних органов, принимающих иммунодепрессанты), при врожденной форме цитомегалии, у беременных.
Патогенез
Попадая в кровь, цитомегаловирус вызывает выраженную иммунную реакцию, проявляющуюся в выработке защитных белковых антител – иммуноглобулинов М и G (IgM и IgG) и противовирусной клеточной реакцией - образованием лимфоцитов CD 4 и CD 8. Угнетение клеточного иммунитета при ВИЧ-инфекции приводит к активному развитию цитомегаловируса и вызываемой им инфекции.
Даже при бессимптомном течении инфекции носитель цитомегаловируса является потенциально заразным для неинфицированных лиц. Исключение составляет внутриутробный путь передачи цитомегаловируса от беременной женщины плоду, который происходит в основном при активном течении процесса, и лишь в 5% случаев вызывает врожденную цитомегалию, в остальных же носит бессимптомный характер.
Симптомы цитомегалии
Врожденная цитомегалия
В 95% случаев внутриутробное инфицирование плода цитомегаловирусом не вызывает развития заболевания, а протекает бессимптомно. Врожденная цитомегаловирусная инфекция развивается у новорожденных, матери которых перенесли первичную цитомегалию. Врожденная цитомегалия может проявляться у новорожденных в различных формах:
- петехиальная сыпь – мелкие кожные кровоизлияния - встречается у 60-80% новорожденных;
- недоношенность и задержка внутриутробного развития плода - встречается у 30% новорожденных;
- желтуха;
- хориоретинит – острый воспалительный процесс в сетчатке глаза, часто вызывающий снижение и полную потерю зрения.
Летальность при внутриутробном инфицировании цитомегаловирусом достигает 20-30%. Из выживших детей большая часть имеет отставание в умственном развитии или инвалидность по слуху и зрению.
Приобретенная цитомегалия у новорожденных
При инфицировании цитомегаловирусом в процессе родов (при прохождении плода по родовым путям) или в послеродовом периоде (при бытовом контакте с инфицированной матерью или грудном вскармливании) в большинстве случаев развивается бессимптомное течение цитомегаловирусной инфекции. Однако у недоношенных младенцев цитомегаловирус может вызывать затяжную пневмонию, к которой часто присоединяется сопутствующая бактериальная инфекция. Часто при поражении цитомегаловирусом у детей отмечается замедление в физическом развитии, увеличение лимфоузлов, гепатит, сыпь.
Мононуклеозоподобный синдром
У лиц, вышедших из периода новорожденности и имеющих нормальный иммунитет, цитомегаловирус может вызывать развитие мононуклеозоподобного синдрома. Течение мононуклеазоподобного синдрома по клинике не отличается от инфекционного мононуклеоза, вызываемого другой разновидностью герпесвируса – вирусом Эбштейна-Барр. Течение мононуклеозоподобного синдрома напоминает упорную простудную инфекцию. При этом отмечается:
- длительная (до 1 месяца и более) лихорадка с высокой температурой тела и ознобами;
- ломота в суставах и мышцах, головная боль;
- выраженные слабость, недомогание, утомляемость;
- боли в горле;
- увеличение лимфоузлов и слюнных желез;
- кожные высыпания, напоминающие сыпь при краснухе (обычно встречается при лечении ампициллином).
В отдельных случаях мононуклеозоподобный синдром сопровождается развитием гепатита – желтухой и повышением в крови печеночных ферментов. Еще реже (до 6% случаев) осложнением мононуклеозоподобного синдрома служит пневмония. Однако у лиц с нормальной иммунной реактивностью она протекает без клинических проявлений, выявляясь лишь при проведении рентгенографии легких.
Длительность течения мононуклеозоподобного синдрома составляет от 9 до 60 дней. Затем обычно наступает полное выздоровление, хотя на протяжении нескольких месяцев могут сохраняться остаточные явления в виде недомогания, слабости, увеличенных лимфоузлов. В редких случаях активизация цитомегаловируса вызывает рецидивы инфекции с лихорадкой, потливостью, приливами и недомоганием.
Цитомегаловирусная инфекция у лиц с ослабленным иммунитетом
Ослабление иммунитета наблюдается у лиц, страдающих синдромом врожденного и приобретенного (СПИД) иммунодефицита, а также у пациентов, перенесших пересадку внутренних органов и тканей: сердца, легкого, почки, печени, костного мозга. После пересадки органов пациенты вынуждены постоянно принимать иммунодепрессанты, ведущие к выраженному подавлению иммунных реакций, что вызывает активность цитомегаловируса в организме.
У пациентов, перенесших трансплантацию органов, цитомегаловирус вызывает поражение донорских тканей и органов (гепатит – при пересадке печени, пневмонию при пересадке легкого и т. д.). После трансплантации костного мозга у 15-20% пациентов цитомегаловирус может привести к развитию пневмонии с высокой летальностью (84-88%). Наибольшую опасность представляет ситуация, когда инфицированный цитомегаловирусом донорский материал пересажен неинфицированному реципиенту.
Цитомегаловирус поражает практически всех ВИЧ-инфицированных. В начале заболевания отмечаются недомогание, суставные и мышечные боли, лихорадка, ночная потливость. В дальнейшем к этим признакам могут присоединяться поражения цитомегаловирусом легких (пневмония), печени (гепатит), мозга (энцефалит), сетчатки глаза (ретинит), язвенные поражения и желудочно-кишечные кровотечения.
У мужчин цитомегаловирусом могут поражаться яички, простата, у женщин – шейка матки, внутренний слой матки, влагалище, яичники. Осложнениями цитомегаловирусной инфекции у ВИЧ-инфицированных могут стать внутренние кровотечения из пораженных органов, потеря зрения. Множественное поражение органов цитомегаловирусом может привести к их дисфункции и гибели пациента.
Диагностика
С целью диагностики цитомегаловирусной инфекции проводится лабораторное обследование. Постановка диагноза цитомегаловирусной инфекции основана на выделении цитомегаловируса в клиническом материале или при четырехкратном повышении титра антител.
- ИФА-диагностика. Включает определение в крови специфических антител к цитомегаловирусу - иммуноглобулинов М и G. Наличие иммуноглобулинов М может свидетельствовать о первичном заражении цитомегаловирусом либо о реактивации хронической ЦМВИ. Определение высоких титров IgМ у беременных может угрожать инфицированию плода. Повышение IgМ выявляется в крови спустя 4-7 недель после заражения цитомегаловирусом и наблюдается на протяжении 16-20 недель. Повышение иммуноглобулинов G развивается в период затухания активности цитомегаловирусной инфекции. Их наличие в крови говорит о присутствии цитомегаловируса в организме, но не отражает активности инфекционного процесса.
- ПЦР-диагностика. Для определения ДНК цитомегаловируса в клетках крови и слизистых (в материалах соскобов из уретры и цервикального канала, в мокроте, слюне и т. д.) используется метод ПЦР-диагностики (полимеразной цепной реакции). Особенно информативно проведение количественной ПЦР, дающей представление об активности цитомегаловируса и вызываемого им инфекционного процесса.
В зависимости от того, какой орган поражен цитомегаловирусной инфекцией, пациент нуждается в консультации гинеколога, андролога, гастроэнтеролога или других специалистов. Дополнительно по показаниям проводится УЗИ органов брюшной полости, кольпоскопия, гастроскопия, МРТ головного мозга и другие обследования.
Лечение цитомегаловирусной инфекции
Неосложненные формы мононуклеазоподобного синдрома не требует специфической терапии. Обычно проводятся мероприятия, идентичные лечению обычного простудного заболевания. Для снятия симптомов интоксикации, вызываемой цитомегаловирусом, рекомендуется пить достаточное количество жидкости.
Лечение цитомегаловирусной инфекции у лиц, входящих в группу риска, проводится противовирусным препаратом ганцикловиром. В случаях тяжелого течения цитомегалии ганцикловир вводится внутривенно, т. к. таблетированные формы препарата обладают лишь профилактическим эффектом в отношении цитомегаловируса. Поскольку ганцикловир обладает выраженными побочными эффектами (вызывает угнетение кроветворения - анемию, нейтропению, тромбоцитопению, кожные реакции, желудочно-кишечные расстройства, повышение температуры и ознобы и др.), его применение ограничено у беременных, детей и у людей, страдающих почечной недостаточностью (только по жизненным показаниям), он не используется у пациентов без нарушения иммунитета.
Для лечения цитомегаловируса у ВИЧ-инфицированных наиболее эффективен препарат фоскарнет, также обладающий рядом побочных эффектов. Фоскарнет может вызывать нарушение электролитного обмена (снижение в плазме крови магния и калия), изъязвление половых органов, нарушение мочеиспускания, тошноту, поражение почек. Данные побочные реакции требуют осторожного применения и своевременной корректировки дозы препарата.
Прогноз
Особую опасность цитомегаловирус представляет при беременности, так как может провоцировать выкидыш, мертворождение или вызывать тяжелые врожденные уродства у ребенка. Поэтому цитомегаловирус, наряду с герпесом, токсоплазмозом и краснухой, относится к числу тех инфекций, обследоваться на которые женщины должны профилактически, еще на этапе планирования беременности.
Профилактика
Особенно остро вопрос профилактики цитомегаловирусной инфекции стоит у лиц, входящих в группу риска. Наиболее подвержены инфицированию цитомегаловирусом и развитию заболевания ВИЧ-инфицированные (особенно больные СПИДом), пациенты после трансплантации органов и лица с иммунодефицитом иного генеза.
Неспецифические методы профилактики (например, соблюдение личной гигиены) неэффективны в отношении цитомегаловируса, так как заражение им возможно даже воздушно-капельным путем. Специфическая профилактика цитомегаловирусной инфекции проводится ганцикловиром, ацикловиром, фоскарнетом среди пациентов, входящих в группы риска. Также для исключения возможности инфицирования цитомегаловирусом реципиентов при пересадке органов и тканей необходим тщательный подбор доноров и контроль донорского материала на наличие цитомегаловирусной инфекции.
Читайте также:

