В наибольшей степени поражаются вич
Обновлено: 25.04.2024
Коварство ВИЧ и последствий инфицирования им – это не более чем беспечность самих людей. Да, действительно, ВИЧ-инфекция является серьезным заболеванием. На сегодняшний день против нее нет вакцины и она неизлечима полностью. Но при своевременной диагностике и последующей ВААРТ (высокоактивная антиретровирусная терапия), продолжительность жизни ВИЧ-положительных пациентов ничем не отличается от среднестатистических показателей. Принимаемые на протяжении всей жизни препараты, тормозят развитие ВИЧ-инфекции и люди доживают до глубокой старости – 70 – 80 лет. Соблюдая рекомендации специалистов, они ведут обычный образ жизни – работают, вступают в брак, путешествуют и даже имеют здоровых детей. Главное – вовремя распознать первые признаки заболевания и обратиться за помощью.
Первые признаки ВИЧ-инфекции
Самолечение – плохая привычка. При недомогании мы сами себе ставим диагноз, назначаем лекарства, тем самым игнорируя симптомы на ранних сроках ВИЧ-инфекции. А в это время вирус уже активно атакует клетки нашей иммунной системы и разрушает ее. На прогрессирование процесса указывают следующие признаки.
- Увеличение лимфатических узлов – на шее, в паху, в области подмышек.
- Кандидоз (молочница), в том числе и в полости рта.
- Ночная потливость.
- Длительная диарея.
- Беспричинная тошнота и рвота.
- Резкое снижение массы тела.
- Лихорадка.
- Кожные высыпания.
Очень часто первые симптомы ВИЧ-инфекции напоминают ОРВИ и грипп. Пациента лихорадит, он испытывает мышечные и головные боли. У него ломит суставы, воспаляется слизистая рта и глотки. Но в скором времени все неприятные симптомы самостоятельно проходят и наступает следующая стадия ВИЧ-инфекции, когда заболевание ничем себя не выдает.
Стадии ВИЧ-инфекции
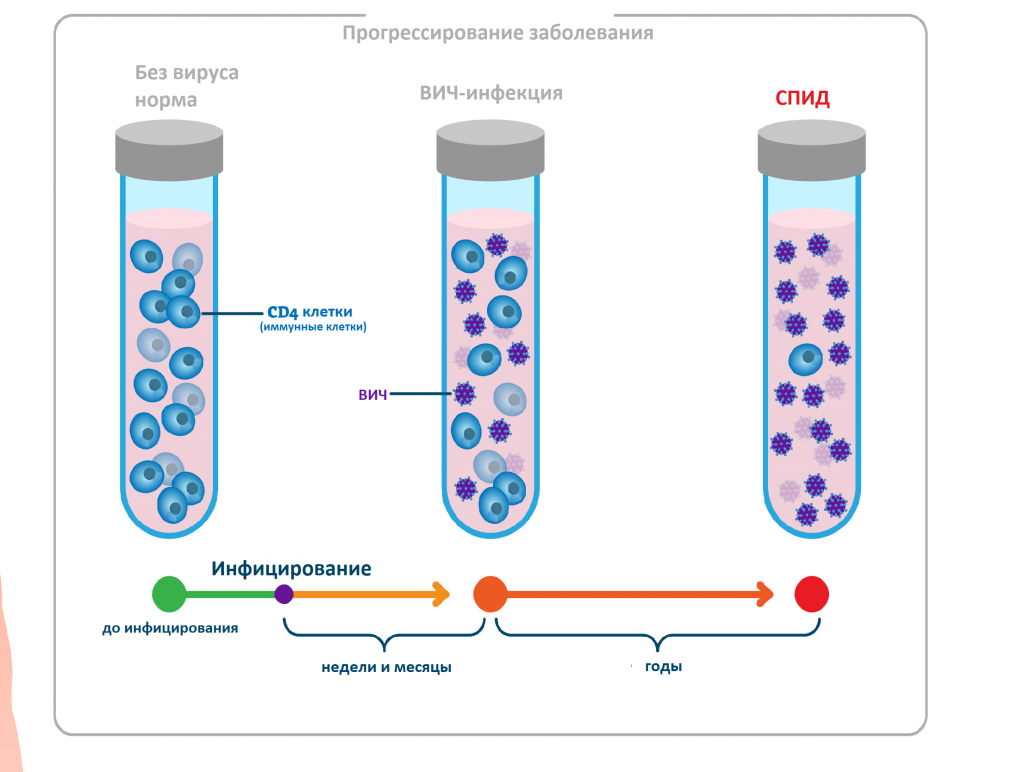
ВИЧ – это вирус иммунодефицита человека. Проникая в организм, он поражает клетки иммунной системы, что вызывает развитие ВИЧ-инфекции – медленно прогрессирующее заболевание. Без адекватного лечения оно переходит в СПИД – синдром приобретенного иммунного дефицита. Четкое разграничение этих понятий, помогает понять, что происходит с организмом человека на каждой из стадий заболевания.
Развитие заболевания: от инфицирования до СПИД
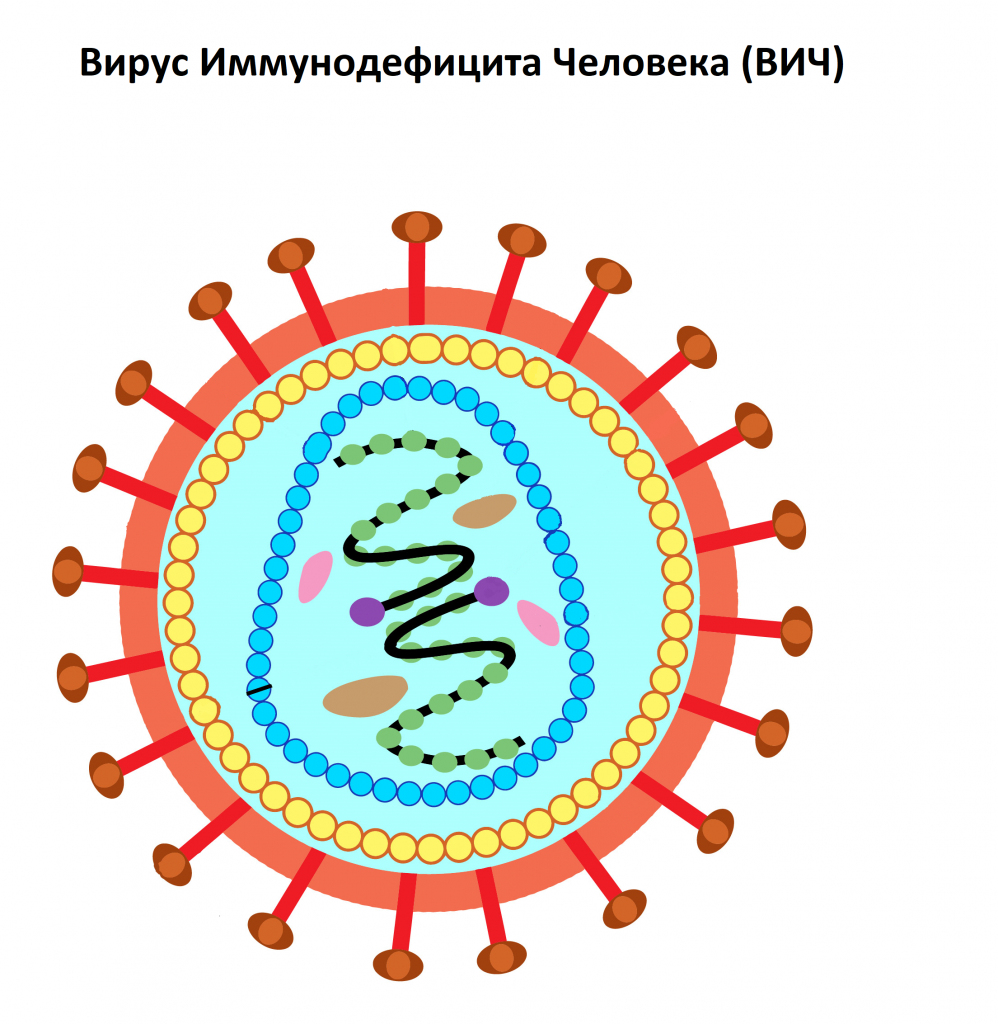
Вирус иммунодефицита человека относят к семейству ретровирусов. По своей сути это вирион – частица, состоящая из оболочки и белково-нуклеинового комплекса. Вне клетки-хозяина она не проявляет никаких признаков биологической активности. Но как только вирион ВИЧ присоединяется к живой клетке иммунитета (Т-лимфоциту), он сливается с ней и передает ей свою генетическую информацию. Инфицированная таким образом клетка иммунитета не способна выполнять свои функции и является благоприятной средой для репликации вирионов – ВИЧ начинает создавать собственные копии. Новые вирусные частицы отпочковываются, попадают в кровяное русло и находят для себя новую клетку-хозяина. Старая клетка-носитель вируса погибает, а под прицел попадают новые Т-лимфоциты. И так до бесконечности! Пока иммунная система не будет полностью разрушена. За это время организм человека проходит все стадии развития заболевания.
- ВИЧ попадает в организм – инфицирование вирусом.
- Вирионы начинают атаковать Т-лимфоциты – инкубационный период.
- Количество реплицируемых вирионов резко возрастает – острая фаза.
- Скорость размножения ВИЧ уравновешена иммунным ответом организма – латентная стадия, на которой симптомы отсутствуют.
- Количество репликаций растет, а количество здоровых Т-лимфоцитов неуклонно снижается – иммунная система не выполняет своих функций и развивается СПИД.
Таким образом, инфицирование и ВИЧ-инфекция не смертельны для человека. Проведение антиретровирусной терапии (ВААРТ) позволяет подавлять активность вируса, сдерживая прогрессирование заболевание. По сути, пациент постоянно пребывает в латентной стадии и ведет привычный образ жизни.
Сколько живут с ВИЧ?
В данном случае все зависит от трех важных факторов – сроки постановки диагноза, проводимое лечение и общее состояние здоровья пациента. В статистике ВИЧ-инфекции и СПИД приводятся следующие цифры.
- Своевременная постановка диагноза и последующая ВААРТ – продолжительность жизни составляет 20-50 лет.
- Выявление ВИЧ-инфекции на поздних стадиях и последующая ВААРТ – 10-40 лет.
- Не выявленная инфекция без лечения – 9-11 лет.
- СПИД без лечения – 6-9 месяцев.
Не менее важным фактором, влияющим на продолжительность жизни ВИЧ-инфицированных пациентов, является общее состояние здоровья и иммунитета. Естественно, люди с крепким иммунитетом, которые не имеют хронических заболеваний и врожденных патологий, будут жить дольше. В то время как, ослабленный организм хуже противостоит вирусу. Поэтому помимо ВААРТ, всем ВИЧ-положительным пациентам рекомендован здоровый образ жизни и правильное питание. Они должны беречь себя от инфекционных и простудных заболеваний. Укреплять иммунитет, заботиться о своем организме и проходить регулярное обследование.
Как проверить свой организм на наличие ВИЧ?
Для этого необходимо узнать свой ВИЧ-статус. Для его определения проводятся косвенные и прямые тесты, позволяющие обнаружить антитела к ВИЧ и собственно сам вирус. Для проведения тестов необходимо сдать кровь на анализ ВИЧ. Сделать это можно анонимно!
Через сколько можно проводить тест, если был риск заражения?
Сдать кровь на анализ можно спустя 2-3 недели после факта возможного заражения. Однако необходимо учесть, что в силу индивидуальных особенностей иммунной системы того или иного человека, результат теста может быть недостоверным, поскольку количество антител к ВИЧ еще будет слишком мало для точной диагностики заболевания.
Через сколько проявляется в крови точно ВИЧ-инфекция?
Для получения достоверного результата теста, необходимо чтобы прошло не менее 3 месяцев с момента инфицирования. В редких случаях появление характерных к ВИЧ антител занимает больше времени – 4-6 месяцев.
Если через 3 месяца результат отрицательный, обязательно ли делать повторный тест?
Если был получен отрицательный результат, но вы уверены в факте инфицирования, то тест лучше повторить через 6 месяцев.
Что делать, если тест на ВИЧ дал положительный результат?
- Во-первых, не паниковать.
- Во-вторых, обратиться за помощью к специалистам.
- В-третьих, проходить ВААРТ.
- В-четвертых, беречь иммунитет и соблюдать все рекомендации лечащего врача.
Важно понимать! Обнаружение ВИЧ-инфекции – это не конец жизни. Это ее принципиально новый этап, на котором необходимо пересмотреть свой привычный образ жизни и приложить все усилия к тому, чтобы сдерживать прогрессирование заболевания.
19503 04 Сентября
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
ВИЧ: причины появления, симптомы, диагностика и способы лечения.
Определение
ВИЧ (вирус иммунодефицита человека) – инфекционное хроническое заболевание, передающееся контактным путем, медленно прогрессирующее и характеризующееся поражением иммунной системы с развитием синдрома приобретенного иммунодефицита (СПИДа). СПИД – это финальная стадия ВИЧ-инфекции, когда из-за ослабленной иммунной системы человек становится беззащитным перед любыми инфекциями и некоторыми видами рака. Опасность представляют так называемые оппортунистические инфекции – заболевания, вызываемые условно-патогенной или непатогенной флорой: вирусами, бактериями, грибами, которые у здоровых людей не приводят к серьезным последствиям или протекают легко и излечиваются самостоятельно. При СПИДе они наслаиваются друг на друга, имеют затяжное течение, плохо поддаются терапии и могут стать причиной летального исхода.
Причины появления ВИЧ
Источником инфекции является человек, инфицированный ВИЧ, на любых стадиях заболевания. Вирус передается через кровь, сперму, секрет влагалища, грудное молоко.
Половой путь (незащищенный секс с инфицированным партнером) – доминирующий фактор распространения ВИЧ-инфекции.
Передача ВИЧ от матери ребенку может произойти на любом сроке беременности (через плаценту), во время родов (при прохождении через родовые пути) и грудного вскармливания (при наличии язвочек, трещин на сосках матери и во рту ребенка).
Высокий риск инфицирования существует при внутривенном введении наркотических веществ нестерильными шприцами, при переливании ВИЧ-инфицированной крови и ее препаратов, использовании медицинского и немедицинского инструментария, загрязненного биологическими жидкостями человека, инфицированного ВИЧ. Кроме того, опасность могут представлять органы и ткани доноров, используемые для трансплантации.

Попадая в кровоток, вирус проникает в Т-лимфоциты хелперы, или CD-4 клетки (рановидность лейкоцитов), которые помогают организму бороться с инфекциями. Т-хелперы имеют на поверхности так называемые CD4-рецепторы. ВИЧ связывается с этими рецепторами, проникает в клетку, размножается в ней и в конечном счете уничтожает ее. Со временем вирусная нагрузка увеличивается, а количество Т-хелперов снижается.
При отсутствии лечения через несколько лет из-за значительного снижения числа Т-хелперов появляются связанные со СПИДом состояния и симптомы.
Классификация заболевания
- Стадия инкубации - от момента заражения до появления реакции организма в виде клинических проявлений острой инфекции и/или выработки антител (специфических белков, продуцируемых в ответ на проникновение антигена, в данном случае – вируса).
- Стадия первичных проявлений клинических симптомов:
В дальнейшем продолжается активное размножение вируса и разрушение Т-лимфоцитов, развивается стадия вторичных изменений, для которой характерно прогрессирующее снижение веса, общая слабость, стойкое повышение температуры, озноб, выраженная потливость. Клинические проявления оппортунистических заболеваний обусловливают клиническую картину этой стадии: пациентов беспокоят кашель и одышка, тошнота, рвота, боли в животе, тяжелая диарея, кожные высыпания, сильные головные боли, снижение памяти и внимания и др.
Диагностика ВИЧ
Лабораторные методы исследования:
Скрининг (обследование здоровых людей) на ВИЧ должен быть проведен любому человеку, который считает, что может быть заражен, а также перед любой госпитализацией и операцией, всем беременным женщинам и их половым партнерам.
Обследование целесообразно проходить людям с высоким риском заражения ВИЧ, например, при наличии заболеваний, имеющих одинаковый с ВИЧ-инфекцией механизм передачи (вирусные гепатиты В и С, заболевания, передающиеся половым путем), лицам, имеющим регулярные незащищенные половые контакты, инъекционным наркоманам, детям, рожденным от матерей с ВИЧ-инфекцией, медицинским работникам, напрямую контактирующим с кровью на работе и др.
Существуют экспресс-тесты для скрининга ВИЧ, которые можно делать в домашних условиях. Для определения специфических антител/антигенов к ВИЧ (ВИЧ-1, 2, антиген p24) используют кровь, слюну или мочу. Точность любого экспресс-теста ниже, чем теста, проводимого в лаборатории.
Для стандартного скринингового обследования определяют антитела к ВИЧ 1 и 2 и антиген ВИЧ 1 и 2 (HIV Ag/Ab Combo) в крови с помощью иммуноферментного анализа (ИФА).
Внимание. При положительных и сомнительных реакциях, срок выдачи результата может быть увеличен до 10 рабочих дней. Синонимы: Анализ крови на антитела к ВИЧ1 и 2 и антиген ВИЧ1 и 2; ВИЧ-1 p24; ВИЧ-1-антиген, p24-антиген; ВИЧ 1 и 2 антитела и антиген p24/25, ВИЧ тест-системы 4-г.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Напоминаем вам, что самостоятельная интерпретация результатов недопустима, приведенная ниже информация носит исключительно справочный характер.
Антитела к ВИЧ-1/2 и антиген ВИЧ-1/2 (HIV Ag/Ab Combo): показания к назначению, правила подготовки к сдаче анализа, расшифровка результатов и показатели нормы.
ВИЧ-инфекция - инфекционная болезнь, развивающаяся в результате многолетнего персистирования (постоянного пребывания) в лимфоцитах, макрофагах и клетках нервной ткани вируса иммунодефицита человека (далее - ВИЧ), характеризующаяся медленно прогрессирующим дефектом иммунной системы, который приводит к гибели больного от вторичных поражений, описанных как синдром приобретенного иммунодефицита (далее - СПИД).
ВИЧ (Вирус Иммунодефицита Человека) – вирус, относящийся к семейству ретровирусов (семейство РНК-содержащих вирусов, заражающих преимущественно позвоночных), который поражает клетки иммунной системы человека. Через несколько недель с момента заражения начинают вырабатываться антитела к ВИЧ.
Показания на проведение исследования
Показаниями для назначения анализа является подготовка к госпитализации и плановому оперативному вмешательству. В профилактических целях следует провести исследование при подозрении на заражение при половом контакте. В первую очередь это касается лиц групп риска: употребляющих наркотики, вводимые внутривенно, часто меняющих половых партнеров и не использующих средств защиты.
Вирус иммунодефицита человека размножается в организме человека достаточно медленно, и количественный результат в отношении антигенов и антител к вирусу можно получить, как правило, не ранее чем через 3-6 недель после инфицирования. При этом клинические симптомы заболевания еще отсутствуют.
Через три месяца антигены ВИЧ и антитела к вирусу определяются практически у всех заболевших. Благодаря появлению новых комбинированных тест-систем четвертого поколения получение точного результата качественного анализа на ВИЧ-инфекцию возможно уже через две недели с момента попадания вируса в организм. При этом исследовании выявляют антиген р24 ВИЧ – белок вирусного капсида (внешней оболочки вируса).
Анализ на антитела к ВИЧ 1/2 и антиген ВИЧ 1/2 назначают на этапе планирования и при ведении беременности, когда возможна передача вируса плоду. Анализ проводят и после родов, поскольку ребенок ВИЧ-положительной матери может быть инфицирован во время прохождения через родовые пути и при кормлении грудью.

Лихорадка, потеря веса без объективных причин, повышенная утомляемость, увеличение регионарных лимфатических узлов, потливость, особенно в ночное время, длительный кашель, диарея – эти устойчивые клинические симптомы неясного происхождения, отмечаемые в течение 2-3 недель, также служат показанием к проведению исследования на антитела к ВИЧ 1/2 и антиген ВИЧ 1/2.
Кожные проявления также могут быть симптомом ВИЧ-инфекции, поскольку развиваются на фоне ослабления иммунитета. К их числу относится рецидивирующая герпетическая сыпь, поражающая обширные участки кожи, полость рта, половые органы. Герпес поражает и глубокие слои кожи с развитием язвенно-некротической формы. Образуются язвы и эрозии с последующим образованием рубцов, которых не бывает при обычном герпесе.
Еще один характерный симптом ВИЧ-инфекции – волосатая лейкоплакия, которая связана с активацией латентной инфекции, вызванной вирусом Эпштейна-Барр (что свидетельствует об иммуносупрессии). Заболевание проявляется нитевидными образованиями белого цвета с дальнейшим ороговением пораженных участков языка и слизистой оболочки рта.
Обширные грибковые поражения (в первую очередь дрожжевыми грибками рода Candida) также служат типичным признаком, сопровождающим ВИЧ-инфекцию. Сначала кандидоз поражает слизистую оболочку рта и пищевода, затем распространяется на слизистые желудочно-кишечного и мочеполового тракта. При этом формируются обширные очаги, характеризующиеся болезненностью и склонностью к изъязвлению.
ВИЧ-инфекция может сопровождаться развитием обширного папилломатоза. У ВИЧ-инфицированных женщин папилломы цервикального канала склонны быстро вызывать рак шейки матки.
СПИД-индикаторным заболеванием служит саркома Капоши – многоочаговая сосудистая опухоль, которая поражает кожные покровы и слизистые оболочки. Ее очаги в виде красноватых или буроватых узелков и бляшек сливаются, быстро распространяясь по всему телу. Со временем они образуют опухолевые поля, которые изъязвляются и нагнаиваются.
К числу патологических состояний, которые почти у всех пациентов сопровождают ВИЧ-инфекцию, относят полиаденопатию (увеличение лимфатических узлов). Как правило, в первую очередь увеличиваются под- и надключичные, подбородочные, околоушные и шейные лимфоузлы. В дальнейшем к ним может присоединяться увеличение паховых и бедренных лимфатических узлов. Они могут быть мягкими или плотными на ощупь, безболезненными и подвижными. Иногда несколько лимфоузлов сливаются, образуя своеобразный конгломерат. Воспаление двух и более групп лимфоузлов считают признаком генерализованной лимфаденопатии. Поражение лимфатических узлов может наблюдаться в течение нескольких лет, при этом периоды обострения сменяются ремиссией.
К легочным заболеваниям, сопровождающим ВИЧ-инфекцию, относят туберкулез и пневмонию.
Анализ на антигены и антитела к ВИЧ рекомендуют сделать, если у пациента выявлены заболевания, передаваемые половым путем (сифилис, хламидиоз, гонорея, генитальный герпес, бактериальный вагиноз).
6.3. ПАТОГЕНЕЗ ВИЧ-ИНФЕКЦИИ
В связи с тем что вирусы являются патогенами внутриклеточными, ка-ждый представитель мира вирусов имеет тропность к определенному типу клеток. Тропизм вируса определяется наличием на клетке-мишени рецептора для данного вируса, а также возможностью генома вируса встроиться в геном клетки. Рецепторы для определенного вируса могут быть на клетках различ-ных типов. Рецепторную функцию выполняют различные структуры (лиган-ды): белки, липиды, углеводные компоненты белков и липидов. Эти лиганды локализованы на плазматической мембране и выполняют важнейшие функ-ции жизнеобеспечения клетки – проникновение в нее гормонов, питательных веществ, факторов роста и регуляции и т.п.
Рецепторы, независимо от их биохимического строения, имеют общую структурную характеристику, а именно, состоят из участка, расположенного вне клетки, участка, локализованного внутримембранно, и участка, погру-женного в цитоплазму.
Рецепторами для ВИЧ являются дифференцировочный антиген CD4, а также неспецифические, не зависящие от наличия CD4 компоненты. CD4 -гликопротеид с молекулярной массой 55 000, по своему строению имеющий гомологии с определенными участками иммуноглобулинов. Аналогичные гомологии имеет и белок вируса gp120, что и определяет тропность ВИЧ. Фиксация вируса через gp120 ВИЧ-1 (или gp105 в случае инфицирования ВИЧ-2) с мембранным рецептором CD4 клетки хозяина блокирует основную функцию этих иммунокомпетентных клеток - восприятие сигналов от анти-генпрезентирующих клеток. Последующая за рецепцией репликация вируса ведет к гибели клеток, выпадению функции, ими выполняемой, развитию иммунодефицита.
В организме человека имеется целый ряд иммунокомпетентных, сома-тических и ряд других клеток, имеющих рецепторы для ВИЧ (CD4+ лимфо-циты, CD8+ лимфоциты, дендритные клетки, моноциты, эозинофилы, мега-кариоциты, нейроны, микроглия, сперматозоиды), и наблюдается цитопати-ческий эффект во многих из них в случае проникновения вируса.
В 1996 году Бергер открыл корецептор для ВИЧ. Этот рецептор вместе с CD4 опосредует инфицирование СО-вариантами ВИЧ-1, адаптированных к росту в Т-хелперах, но не в макрофагах. На сегодня известно около 10 хемо-киновых рецепторов.
Таким образом, выделены белки - хемокины, блокирующие проникно-вение ВИЧ в макрофаги с антигеном CD4, и белки - корецепторы, способст-вующие инфицированию. При этом корецепторы – это рецепторы для хемо-кинов, но их использует ВИЧ в качестве рецептора, с помощью которого проникает внутрь клетки.
Проникнув в СD4+ клетки, ВИЧ сразу же начинает репликацию, при этом, чем активнее CD4+ клетки, тем выше процесс репродукции вируса. Все регуляторы, активирующие СD4+клетки, обеспечивают увеличение реплика-ции вируса. К подобным регуляторам относятся фактор некроза опухолей (ФНО), фактор, стимулирующий колонии гранулоцитов/макрофагов, интер-лейкин-6 (ИЛ-6). К негативным регуляторам, тормозящим репликацию виру-са, относятся интерферон (ИФ) и трансформирующий фактор роста.
Морфофункциональные изменения в моноцитах/макрофагах оказыва-ют разнонаправленное действие не только на Т-лимфоциты, но и естествен-ные киллеры - главные клетки противоопухолевой защиты. Активность по-следних по мере прогрессирования заболевания неуклонно снижается. Дефи-цит ИЛ-2 и γ-интерферона даже при нормальном количестве NK-клеток ве-дет к снижению функциональной активности их у больных ВИЧ-инфекцией (Ковальчук Л.В., Чередеев А.Н.,1991).
Выделено два типа CD4+клеток: Т-хелперы-1 (Th1) и Т-хелперы-2 (Th2). Тh1 продуцируют цитокины, стимулирующие клеточный иммунитет, а Тh2 – цитокины, усиливающие антителогенез. Соотношение Тh1 и Тh2 взве-шенно и конкурентно; суперэкспрессия цитокинов одного типа клеток ведет к супрессии другого. У больных ВИЧ-инфекцией идет угнетение Тh1, чем обеспечиваются и вирусная патология, и онкогенез.
Жизненный цикл ВИЧ после проникновения в организм имеет после-довательный характер: связывание вириона с поверхностью клетки, слияние мембран вириона и клетки, проникновение вируса внутрь клетки, высвобож-дение нуклеотида и геномной РНК вируса, интеграция генома вируса в геном инфицированной клетки, латентная фаза, фаза активации транскрипции с ДНК провируса и последующая транскрипция белков вируса, наработка всех компонентов вируса с формированием новых вирионов и их высвобождени-ем из клетки, влекущим за собой гибель клетки-мишени (рис.6.4.).
Рис. 6.4. Стадии проникновения ВИЧ в клетку (Ледванов М.Ю., 1997).
Судьба ДНК-транскрипта генома ВИЧ, интегрированных в хромосому пораженной клетки, может быть различна. Она определяется активностью положительных и отрицательных регуляторных генов. Если активны все по-ложительные регуляторные гены, то происходит репродукция вируса со все-ми вытекающими отсюда последствиями – идет активация инфекции.
Если активны все отрицательные регуляторные гены, синтеза компо-нентов вириона не происходит, и инфекция не развивается.
Если активны положительные регуляторные гены белков суперкапсид-ной оболочки, происходит образование этих белков, и они экспрессируются на поверхности инфицированных клеток. Такие клетки способны взаимодей-ствовать с CD4 - рецепторами клеток организма и нарушать их функции. Та-ким образом, хотя репродукции вирусов не происходит, имеют место опре-деленные проявления инфекции.
Равным образом события развиваются при активности положительных регуляторных белков капсидной оболочки. Их повреждающее действие на клетки существенно ниже, но они индуцируют образование соответствую-щих антител.
Если же активны положительные регуляторные гены только геномных белков, то в пораженных клетках образуется обратная транскриптаза, которая довольно быстро разрушается.
Сродство вирусного мембранного гликопротеида gp120 (gp105 в случае ВИЧ-2) к клеточному рецептору CD4 определяет высокую степень избира-тельного поражения клеточных структур, поэтому в патологический процесс вовлекаются, в первую очередь, и в большей степени CD4+ лимфоциты, мо-ноциты крови, макрофаги тканей, дендритные клетки крови, лимфатических узлов, селезенки, кожи, альвеолярных и интерстициальных макрофагов лег-ких, микроглия и другие клетки нервной системы, имеющие CD4 - рецепто-ры. Так же поражаются В- и О-лимфоциты, ретикулярные клетки, эпители-альные клетки кишечника, клетки Лангерганса, причем последние инфици-руются даже легче, чем CD4+ лимфоциты. Именно клеткам Лангерганса придается большое значение в распространении ВИЧ по организму, ибо в них вирус сохраняется длительное время, иногда годы.
Наличие CD4 рецептора на многих и не только иммунокомпетентных клетках, возможность поражать и клетки, не имеющие этого рецептора, оп-ределяют политропность ВИЧ и полиморфизм клинической картины. Сте-пень поражения тех или иных, содержащих СD4 рецепторы, клеток зависит от плотности этих рецепторов на мембране клеток. Наиболее высока плот-ность на Т-хелперной субпопуляции лимфоцитов, что и определяет во мно-гом патогенез болезни. Но степень поражения клеток-мишеней вирусом за-висит также и от возможности репликации вируса в том или ином виде кле-ток. Очевидно, осуществляется репликация в основном в лимфоцитах с CD4+ фенотипом и моноцитах/макрофагах.
Если на CD4+ лимфоциты вирус оказывает цитопатическое действие с лизисом клетки или слиянием в синцитий, то в моноцитах/макрофагах ВИЧ реплицируется с умеренной интенсивностью; вирионы оформляются в ок-руглые частицы еще в цитоплазме клетки и по выходе из нее не оказывают цитонекротического действия. Изучение динамики сывороточных монокинов подтверждает активное участие в патогенезе ВИЧ-инфекции моноци-тов/макрофагов, основных продуцентов фактора некроза опухолей и интер-лейкина-1b (выполняющих роль передатчика Т-лимфоцитам антигенспеци-фических сигналов, необходимых для их активации в иммунном ответе). С гиперпродукцией ФНО-a , ИЛ-1b и ИЛ-6 связывают развитие при ВИЧ-инфекции лихорадки, анемии, диареи, кахексии, патологических изменений на коже и слизистых при саркоме Капоши, церебральных симптомов. ФНО-a при этом оказывает прямое цитопатическое действие на инфицированные ВИЧ Т-хелперы. В то же время было установлено, что ВИЧ ингибирует про-дукцию ИЛ-2 и γ-ИФ, синтезируемым Т-хелперами первого типа, и не инги-бирует функцию Т-хелперов второго типа. Следовательно, играя важную роль в регуляции синтеза цитокинов, ВИЧ за счет переключения иммунного ответа с Т-хелперов первого типа на Т-хелперы второго типа, стимулирует гуморальное звено иммунитета.
После инфицирования клетки вирусом происходит соединение вирус-ной оболочки с помощью белка gp41 с мембраной клетки. Помимо того, ви-русный белок gp41 обеспечивает слияние мембран соседних клеток между собой с образованием одной многоядерной клетки - синцития. При этом слияние может быть как зараженных клеток между собой, так и зараженных с незараженными. Но синцитий в основном индуцируют вирусы, выделенные от больных с клиническими проявлениям ВИЧ-инфек-ции, и не образуют выделенные от инфицированных людей, не имеющих клинических проявле-ний.
С момента интеграции генома вируса в геном клетки начинается стадия латентной инфекции. В этот период вирус находится в клетке в виде интег-рированного в геном ДНК – провируса. Раньше полагали, что в этот период отсутствуют процессы транскрипции и трансляции с вирусных генов, а по-этому и экспрессии вирусных белков, нет иммунного ответа на вирус как в виде специфических иммуноглобулинов, так и сенсибилизированных лим-фоцитов. Но последние исследования показали, что сразу после проникнове-ния вируса в клетку начинаются и трансляция, и транскрипция.
Состояние латентной инфекции без клинических признаков болезни может длиться от 2 до 11 лет. Активация длинных концевых повторов и экс-прессия генов ВИЧ, кодирующих белки вируса, знаменуют собой манифе-стацию болезни.
В расшифровке патогенеза ВИЧ-инфекции многие вопросы решены, установлены основные этапы развития процесса в клетке после инфицирова-ния ее вирусом. Выявлен ряд факторов, активирующих экспрессию генов ВИЧ. К ним относятся факторы, активирующие Т-лимфоциты: специфиче-ские антигены (например, вирусы группы Herpes), неспецифические антиге-ны (например, митогены типа фитогемаглютинина), цитокины (например, фактор некроза опухолей, некоторые интерлейкины, гамма-интерферон), бактериальные иммуномодуляторы (например, монофосфат липида из саль-монелл). К активаторам экспрессии ВИЧ относятся глюкокортикостероидные гормоны, в частности, дексаметазон и гидрокортизон, ультрафиолетовое об-лучение, перекись водорода, свободные кислородные радикалы. Активирует инфекционный процесс беременность; более прогрессирующее течение ВИЧ-инфекции имеют психически неуравновешенные лица, дезадаптированные, по сравнению с людьми, имеющими уравновешенную психику.
Довольно сложен и до конца не выяснен механизм репликации вируса в инфицированной клетке. Известно, что в цитоплазме информация с вирус-ной РНК посредством обратной транскриптазы (ревертазы) переписывается на ДНК, первоначально образуется однонитевая структура; затем та же об-ратная транскриптаза обеспечивает образование второй нити, и линейная промежуточная форма ДНК-транскриптаза вируса - транспортируется в ядро, где с помощью фермента интегразы интегрирует в хромосому клетки, пре-вращаясь в провирус.
Исключительно важный этап патогенеза болезни – сборка вирусных частиц и выход нового потомства вируса из инфицированной клетки. Сборка происходит на плазматической мембране лимфоцита, куда поступают все компоненты вирусной частицы, в том числе и белки-предшественники. За-вершается процесс почкованием вирусных частиц с клеточной поверхности. Отличительной чертой ВИЧ является взрывной характер процессов актива-ции транскрипции, синтеза белков-пред-шественников, сборки вирионов и их почкования: за 5 мин одна лимфоцитарная клетка может образовать до 5000 вирусных частиц.
Ключевой вопрос патогенеза ВИЧ-инфекции – механизм иммунного повреждения. Как установлено, в составе белков gp120, главного комплекса гистосовместимости (HLA) класса II и CD4-рецепторов имеются сходные участки, что определяет перекрестное реагирование образующихся к ВИЧ антител с этими структурами. Например, происходит блокада кооперации CD4+ лимфоцитов и HLA II. Антитела к gp120 ВИЧ реагируют с CD4, обу-словливая неадекватную стимуляцию CD4+ клеток. На всех ядросодержащих клетках имеются антигены HLA I; вирус же нарушает синтез этих антигенов, участвующих в распознавании CD8+ лимфоцитами зараженных вирусом клеток, что тормозит процесс лизиса инфицированных клеток.
Взаимосвязь жизненного цикла вируса и иммунных сдвигов в началь-ной фазе ВИЧ-инфекции изучена в эксперименте при заражении SIV обезьян; полученные данные экстраполированы на человека. Как показали исследова-ния, вирус первоначально локализуется в лимфоидной системе, вирусная экспрессия определяет клинику ранней фазы болезни. Пик экспрессии вируса в клетках лимфоидной ткани предшествует накоплению его в плазме. Появ-ление вирусспецифических цитотоксических Т-лимфоцитов (CTL) совпадает со временем окончания экспрессии вируса в лимфатических узлах. Продук-ция комплементсвязывающих антител облегчает переход вируса в сеть денд-ритных клеток герминальных центров лимфатических узлов. Повреждающее действие CTL и продукция комплементсвязывающих антител оказывают ос-новное патогенное действие в результате виремии. Образование нейтрали-зующих антител обеспечивает переход острой фазы болезни в хроническую.
Иммунопатогенетически ВИЧ-инфекция проявляется дефицитом Т- и В-звеньев иммунной системы, дефицитом комплемента, фагоцитов, сниже-нием функции неспецифических факторов защиты. В результате идет фор-мирование анергии с проявлениями аллергического, аутоаллергического и иммунокомплексного патологического процесса. Уже во II стадии ВИЧ-инфекция характеризуется снижением абсолютного числа лейкоцитов за счет CD3+, CD4+, p24+ и gp120+ лимфоцитов, повышением уровня естественных киллеров (NК-клетки), нарастанием реакции торможения миграции лимфо-цитов с конкавалином А и фитогемагглютинином. Изменения гуморального звена иммунитета проявляются нарастанием IgG+ В-лимфоцитов и 4-5-кратным ростом уровня сывороточных IgE.
Для изменений В-звена иммунитета характерна активация В-лимфоцитов. Изменение их метаболизма сопровождается уменьшением вре-мени полуобмена иммуноглобулиновых рецепторов с повышением в крови концентрации клеточных рецепторов (Р-белки). Суммарная концентрация сывороточных иммуноглобулинов растет, но выявляется диспропорция уровней подклассов иммуноглобулинов. Так, содержание IgG1 и IgG3 у больных увеличивается, а концентрация IgG2 и IgG4 существенно уменьша-ется. Очевидно, повышение уровня IgG2 связано с высокой восприимчиво-стью больных к стафилококкам, пневмококкам, палочке инфлюэнцы. Не-смотря на гипергаммаглобулинемию, увеличение количества циркулирую-щих в крови В-лимфоцитов, их функциональная активность на митогены ос-таются относительно сниженными, что позволяет В-систему иммунитета у ВИЧ-больных расценивать как супрессированную. К тому же, количество В-клеток в периферической крови больных в стадии СПИДа может быть сни-жено в три и более раз.
Многочисленными исследованиями показано, что взаимодействие gp120 ВИЧ-1 с мембраной CD4+ лимфоцитов определяет не только отрица-тельные реакции инфицированных клеток, но и приводит к программирован-ной клеточной гибели - апоптозу зрелых CD4+ лимфоцитов или CD34+ ге-мопоэтических клеток-предшественников даже при отсутствии их инфици-рования вирусом.
Специфический иммунный ответ при ВИЧ-инфекции имеет ряд осо-бенностей. Локализуясь в иммуноците, вирус проникает в органы и ткани, пребывая вне доступности для иммунной системы, чем определяется перси-стенция в клетках как вируса, так и его компонентов – белков, нуклеокапси-дов, нуклеиновой кислоты. Активация инфекционного процесса ведет к гу-моральному иммунному ответу с образованием антител. Но в связи с наличи-ем в составе вирусного белка gp120, HLA класса II и CD4-рецептора лимфо-цита сходных участков образующиеся антитела перекрестно реагируют с ни-ми, чем обусловливают нарушение кооперативных взаимодействий в функ-ционировании иммунной системы. Все это определяет формирование ауто-аллергических реакций. Именно поэтому в ходе развития инфекционного процесса формируется гиперчувствительность замедленного и немедленного типов, преимущественно к антигенам ВИЧ, в частности, gр41 и gp120. Так, Л.Монтанье (1996) считает, что в патогенезе СПИДа основное место принад-лежит аутоиммунному процессу. В пользу этого говорят исследования харак-тера иммунных реакций у больных: наличие аутоантител и аллоантител к лимфоцитам, формирование аллергических реакций цитотоксического типа, накопление циркулирующих иммунных комплексов, наличие комплементо-посредованной цитотоксичности, активация антителозависимой клеточной цитотоксичности. Кроме того, при сильном антительном ответе возможность развития аутоиммунных процессов обусловлена мимикрией структуры gp120 под структуру иммуноглобулинов (Atlan H. et al.,1993). В пользу наличия ау-тоиммунных процессов в патогенезе ВИЧ-инфекции говорят и клинические проявления болезни, в частности, часто сопутствующие болезни такие ти-пичные аутоаллергические варианты патологии, как спондилоартропатии, системные ревматоидные синдромы: волчаночноподобный синдром Шегре-на, полимиозит, некротизирующий васкулит.
У половины больных развиваются манифестные формы аллергии, пре-имущественно в виде ринита, лекарственной аллергии, крапивницы, атопиче-ского дерматита, ангионевротического отека с повышением у них уровня специфических IgE к бытовым, эпидермальным, пыльцевым и пищевым ал-лергенам с положительной коррелятивной связью между общим уровнем IgE и содержанием СD8+ лимфоцитов (Ю.А.Митин, 1997).
Наряду с поражением иммунной системы в патологический процесс вовлекается и кроветворная ткань. Для заболевания характерны лейкопения, анемия, тромбоцитопения. Угнетается функциональная активность грануло-цитов. У больных ВИЧ-инфекцией в костном мозге резко снижено содержа-ние колониеобразующих единиц гранулоцитов, макрофагов, мегакариоцитов. Однако дисфункция стволовых клеток не связана с их прямым инфицирова-нием, ибо не обнаружено присутствия ВИЧ в кроветворных клетках при изу-чении методом гибридизации in situ и иммуногистохимическим исследова-нием гемопоэтических колоний, а также с помощью полимеразной цепной реакции. Пока нет однозначного мнения о причинах ингибиции пролифера-тивной активности стволовых клеток, хотя и установлено, что различные изоляты ВИЧ, воздействуя на CD34+ клетки, угнетают их функциональную активность. Также установлено, что подавление кроветворения в результате действия ВИЧ связано с усилением продукции костномозговыми моноцита-ми/макрофагами фактора некроза опухолей.
Таким образом, поражение иммунной системы при ВИЧ-инфекции но-сит системный характер, проявляясь глубокой супрессией Т- и В-звеньев клеточного иммунитета. В ходе развития ВИЧ-инфекции происходят законо-мерные изменения гиперчувствительности немедленного и замедленного ти-па, гуморального иммунитета и факторов неспецифической защиты, функ-циональной активности лимфоцитов и моноцитов/макрофагов. Нарастает уровень сывороточных иммуноглобулинов, циркулирующих иммунных ком-плексов. Наряду с дефицитом CD4+ лимфоцитов в динамике болезни нарас-тает функциональная недостаточность СD8+ лимфоцитов, NK-клеток, ней-трофилов. Нарушение иммунного статуса клинически проявляется инфекци-онным, аллергическим, аутоиммунным и лимфопролиферативным синдро-мами иммунологической недостаточности, синдромом, свойственным болез-ни иммунных комплексов. Все это определяет в целом клинику ВИЧ-инфекции.
Категории МКБ: Болезнь, вызванная вирусом иммунодефицита человека [вич], проявляющаяся в виде других состояний (B23), Болезнь, вызванная вирусом иммунодефицита человека [вич], неуточненная (B24), Болезнь, вызванная вирусом иммунодефицита человека [вич], проявляющаяся в виде других уточненных болезней (B22), Болезнь, вызванная вирусом иммунодефицита человека [вич], проявляющаяся в виде злокачественных новообразований (B21), Болезнь, вызванная вирусом иммунодефицита человека [вич], проявляющаяся в виде инфекционных и паразитарных болезней (B20), Острый ВИЧ-инфекционный синдром (B23.0)
Общая информация
Краткое описание
ВИЧ-инфекция - инфекционная болезнь, развивающаяся в результате многолетнего персистирования в лимфоцитах, макрофагах и клетках нервной ткани вируса иммунодефицита человека (далее - ВИЧ), характеризующаяся медленно прогрессирующим дефектом иммунной системы, который приводит к гибели больного от вторичных поражений, описанных как синдром приобретенного иммунодефицита (далее - СПИД) [1].
B20 Болезнь, вызванная вирусом иммунодефицита человека (ВИЧ), проявляющаяся в виде инфекционных и паразитарных болезней;
B21 Болезнь, вызванная вирусом иммунодефицита человека (ВИЧ), проявляющаяся в виде злокачественных новообразований;
B22 Болезнь, вызванная вирусом иммунодефицита человека (ВИЧ), проявляющаяся в виде других уточненных болезней;
Пользователи протокола: инфекционисты, терапевты, врачи общей практики, клинической лабораторной диагностики, фтизиатры.
Класс I - польза и эффективность диагностического метода или лечебного воздействия доказана и и/или общепризнаны
Класс III - имеющиеся данные или общее мнение свидетельствует о том, что лечение неполезно/ неэффективно и в некоторых случаях может быть вредным
Когортное или исследование случай-контроль или контролируемое исследование без рандомизации с невысоким риском систематической ошибки (+).
Результаты которых могут быть распространены на соответствующую популяцию или РКИ с очень низким или невысоким риском систематической ошибки (++ или +), результаты которых не могут быть непосредственно распространены на соответствующую популяцию.
Классификация
• нейтропения (
• хронический герпес (оролабиальный, генитальный или аноректальный длительностью более месяца или висцеральный любой локализации);
Диагностика
II. МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ И ЛЕЧЕНИЯ
• число лимфоцитов CD4 (абсолютное и процентное содержание) - двукратное измерение с интервалом не менее 7 дней;
Минимальный перечень обследования, который необходимо провести при направлении на плановую госпитализацию: не проводится.
Заболевание начинается постепенно.
• половые контакты (гетеро- или гомосексуальные; тип контактов: оральный, вагинальный, анальный) с ВИЧ-статус партнерами (если известно);
• патологическое увеличение лимфатических узлов, персистирующая генерализованная лимфоаденопатия.
Ротоглотка: стоматит, язвенно-некротические поражения, разрастание слизистой полости рта, преимущественно боковой поверхности языка.
Мочеполовая система и перианальная область: признаки следующих заболеваний: нефропатия, инфекция, вызванная вирусом папилломы человека (остроконечные кондиломы половых органов и заднего прохода, рак шейки матки).
Неврологический и психический статус: нарушение когнитивных функций (Приложение 1), парезы, симптомы нейропатии, нарушение сознания, менингеальные синдром.
Биохимический анализ крови: повышение уровня креатинина и мочевины в крови, гипонатриемия, гипокалиемия (при развитии ОПП).
• полимеразная цепная реакция РНК ВИЧ: определяемая вирусная нагрузка.
МРТ/КТ головного мозга: отек головного мозга, признаки менингоэнцефалита, дисциркуляторная энцефалопатия, объемные процессы;
• консультация невропатолога: при признаках/подозрении на криптококковый менингит, ВИЧ-энфефалопатию, токсоплазмоз ЦНС, ПМЛ, лимфомы головного мозга, периферической полинейропатии;
• консультация психиатра: при признаках/подозрении психического расстройства. ВИЧ-энцефалопатии/деменции;
Дифференциальный диагноз
Дифференциальный диагноз: проводится с оппортунистическими инфекциями и другими вторичными заболеваниями по результатам консультаций специалистов.
Лечение
Курс лечения АРТ – пожизненный, применяется тройная схема, кратность приема АРВ препаратов зависит от формы выпуска.
• эмтрицитабин (FTC) 200 мг, капсула; 200 мг 1 раз в сутки.
• рилпивирин* (RPV) 25 мг таблетка; 25 мг 1 раз в сутки.
• дарунавир (DRV) 400 мг, 600 мг, 800 мг таблетка; 600 мг 2 раза в сутки в комбинации с ритонавиром в дозе 100 мг 2 раза в сутки;
• типранавир* (TPV) 250 мг капсула; применяется усиленный ритонавиром, 2 раза в сутки 500 мг+200 мг ритонавира.
ИИ с целью: блокирования фермента ВИЧ, участвующий во встраивании провирусной ДНК в геном клетки-мишени.
• долутегравир (DTG) 50 мг таблетка; 50 мг 1 раз в сутки.
• элвитегравир 150 мг/кобицистат 150 мг /эмтрицитабин 200 мг /тенофовир 300 мг* 1 таблетка 1 раз в сутки;
* При регистрации в Республике Казахстан.
В приоритетном порядке АРТ назначается всем пациентам в 3-4 стадии ВИЧ-инфекции или пациентам с количеством CD4+ лимфоцитов ≤ 350 кл/мкл.
− ВИЧ-позитивным лицам в дискордантных парах (для снижения риска трансмиссии ВИЧ неинфицированным партнерам), при условии предварительного консультирования обоих партнеров;
− при подготовке ВИЧ-инфицированного пациента к применению вспомогательных репродуктивных технологий.
Схема АРТ состоит не менее, чем из трех антиретровирусных препаратов. Предпочтение отдается комбинированным препаратам в фиксированных дозировках.
b NVP использовать у лиц с низким числом лимфоцитов CD4 (у женщин с СД4 менее 250/мкл, у мужчин с СД4 менее 400/мкл)
с вместо AZT при умеренной анемии или гранулоцитопении (уровень гемоглобина> 90 г/л или количество нейтрофилов> 1000 клеток/мкл) рекомендуется назначать ABC, или TDF, а при более выраженной анемии или гранулоцитопении – АВС или TDF.
d использование комбинированного препарата фиксированной дозировки DRV/c (при регистрации)
При невозможности использования вышеперечисленных препаратов ddI может быть назначен в качестве НИОТ в комбинации 3TC/FTC +EFV.
• пациенты, получающие противотуберкулезные препараты.
− при количестве CD4+ лимфоцитов от 50 до 250 клеток/мкл и нормальном уровне АЛТ или АСТ – NVP в сочетании с АВС, или TDF, или AZT + 3ТС, или FTC;
− при любом количестве CD4+ лимфоцитов – LPV/r или DRV/r или ATV/r в сочетании с АВС, или TDF, или AZT + 3ТС, или FTC.
Рекомендуемые схемы АРТ: назначается схема из предпочтительных АРВП – 2 НИОТ + 1 ИП/r, или 2НИОТ + 1 ННИОТ, или 2 НИОТ + 1 ИИ.
LPV/r в сочетании с AZT/3TC. В качестве третьего компонента схемы АРТ являются LPV/r в таблетках (400/100 мг 2 раза в сутки).
При непереносимости LPV/r можно использовать (в порядке приоритетности) – DRV/r (600/100 мг 2 раза в сутки), NVP (при CD4 < 250 клеток/мкл и нормальном уровне АЛТ и АСТ). Частота назначения LPV/r и DRV/r – не реже 2 раз в сутки.
При непереносимости LPV/r и DRV/r, можно назначить ATV/r или другие ИП/р. В качестве нуклеозидной основы рекомендуется ZDV/3TC. Применение EFV не рекомендуется в I триместрe беременности.
Для лечения пациентов с низким уровнем CD4+-лимфоцитов рекомендуется применять схемы, включающие бустированный ИП.
В качестве нуклеозидной основы рекомендуется применять комбинацию ABC с 3TC или TDF с 3TC в стандартных дозах (или комбинированный препарат TDF/FTC). Однако у пациентов с ВН более 100 000 копий/мл препараты, содержащие ABC, применять не рекомендуется.
В качестве альтернативы третьим препаратом можно назначить FPV/r из-за минимального влияния на функцию почек либо LPV/r.
ТDF не рекомендуется больным с почечной недостаточностью.
более чем в 2,5 раза выше верхней границы нормы (ВГН) – EFV или RPV (при наличии противопоказаний к приему EFV и при уровне РНК ВИЧ < 100000 копий/мл) в сочетании с TDF+3TC или TDF/FTC;
• при уровне активности АЛТ или АСТ более чем в 2,5 раза выше ВГН – DTG, бустированный RTV ИП (DRV/r или LPV/r) в сочетании с TDF+3TC или TDF/FTC.
При снижении числа CD4+ лимфоцитов менее 500 клеток/мкл рекомендуют начать АРТ одновременно с терапией ХГС.
При количестве CD4+лимфоцитов менее 350 клеток/мкл начинают лечение ВИЧ-инфекции, а затем присоединяют терапию ХГС.
Не рекомендуется сочетание рибавирина с зидовудином (увеличивается частота развития анемии), диданозином (повышается вероятность декомпенсации заболевания печени).
Оптимальным сочетанием НИОТ является TDF + 3TC или FTC в стандартных дозировках. При невозможности применять TDF назначают АВС.
• при нормальном уровне активности АЛТ/АСТ или повышении его не более чем в 2,5 раза выше ВГН – EFV, RPV (при наличии противопоказаний к приему EFV и при уровне РНК ВИЧ < 100000 копий/мл) или DTG (при наличии противопоказаний к приему EFV и при уровне РНК ВИЧ >100000 копий/мл) в сочетании с АВС или TDF + 3TC или TDF/FTC.
• при уровне активности АЛТ/АСТ более чем в 2,5 раза выше ВГН – DTG или бустированный ИП (LPV/r или DRV/r) в сочетании с АВС или TDF + 3TC или TDF/FTC.
У больных при сочетании ВИЧ-инфекции и ХГС, не получающих лечения ХГС, в состав схемы АРТ может быть включено сочетание ZDV+3TC.
Все ЛЖВ с диагностированным туберкулезом нуждаются в лечении ТБ и ВИЧ-инфекции, независимо от числа лимфоцитов CD4.
Первым начинают противотуберкулезное лечение, а затем как можно быстрее (в первые 8 недель лечения) назначают АРТ.
Больным ВИЧ/ТБ, имеющим выраженный иммунодефицит (число лимфоцитов CD4 менее 50 клеток/мкл), необходимо начать АРТ немедленно – в течение первых 2 недель после начала лечения ТБ.
При наличии туберкулезного менингита начало АРТ следует отложить до завершения фазы интенсивной терапии ТБ.
В начале АРТ у больных, получающих противотуберкулезное лечение, предпочтительным ННИОТ является EFV, который назначают вместе с двумя НИОТ.
При отсутствии EFV рекомендована схема лечения - 3TC (или FTC) + ZDV + ABC (или TDF).
В таблице 3 представлены варианты замены антиретровирусных препаратов при развитии нежелательныхэффектов.
Неудача лечения определяется как постоянно выявляемая вирусная нагрузка более 1000 копий/мл по результатам двух последовательных измерений, проведенных с интервалом в 2-4 недели, но не ранее, чем через шесть месяцев после начала использования АРВ-препаратов.
Основные лекарственные средства, имеющие 100% вероятность применения: см пункт Медикаментозное лечение, оказываемое на амбулаторном уровне.
• эмтрицитабин (FTC) 200 мг, капсула;
• рилпивирин* (RPV) 25 мг таблетка;
• дарунавир (DRV) 400 мг, 600 мг, 800 мг таблетка; 600 мг в комбинации с ритонавиром в дозе 100 мг 2 раза в сутки;
• типранавир* (TPV) 250 мг капсула; применяется усиленный ритонавиром, 2 раза в сутки 500 мг+200 мг ритонавира.
• элвитегравир 150 мг/кобицистат 150 мг /эмтрицитабин 200 мг /тенофовир 300 мг* 1 таблетка 1 раз в сутки;
• элвитегравир 150 мг/кобицистат 150 мг* 1 таблетка 1 раз в сутки.
Хирургические вмешательства: нет.
• туберкулеза (при исключении у пациента активного туберкулеза) –однократно изониазид (5 мг/кг), но не более 0,3 г в сутки + пиридоксин (при наличии) в дозе 25 мг/сут не менее 6 месяцев;
• пневмоцистной пневмонии в случае CD4 < 200 клеток/мкл, токсоплазмоза, в случае CD4 < 100 клеток/мкл – котримоксазол (960 мг 3 раза/неделю). Отменить профилактику если у пациента более 3 месяцев количество CD4+ - лимфоцитов стабильно превышает 200 кл/мкл, возобновить при падении количества CD4+ - лимфоцитов
• Диспансерное наблюдение пациентов получающих АРТ осуществляется совместно ПМСП и территориальным центром СПИД с кратностью посещений не менее 1 раза в 3 месяца.
• Вирусная нагрузка определяется перед началом АРТ. В дальнейшем следует измерять ВН первый раз не позднее 3 месяцев, затем 1 раз в 6 месяцев, при достижении неопределяемого уровня ВН.
• В случае отсутствия снижения ВН через 6 месяцев от начала лечения на 1 lоg10 или последовательного двукратного повышения ВН после исходной супрессии, следует провести генотипический тест на определение резистентности ВИЧ к антиретровирусным препаратам.
• Число лимфоцитов CD4 нужно измерять через 3 месяца, затем каждые 6 месяцев, при необходимости чаще в течение 1-го года АРТ, далее не реже 1 раз в год (за исключением случаев неэффективности лечения).
• Лабораторные исследования необходимо проводить не менее одного раза в 6 месяцев.
Таблица 4. Сроки проведения лабораторных исследований
х - лабораторное исследование показано независимо от используемых АРВ-препаратов;
x (АРВ-препарат) - исследование показано пациентам, которые получают указанный в скобках препарат.
b Пациентам с хроническими гепатитами биохимические показатели определяют согласно клиническому протоколу диагностики и лечения хронического вирусного гепатита В и С у взрослых в РК.
Через 3 месяца после начала приема АРВ-препарата клинически проявляющиеся побочные эффекты должны отсутствовать (а также субклинические, которые со временем могут проявиться клинически )
b Вирусная нагрузка уменьшается постепенно: у большинства пациентов (за исключением имеющих изначально высокую вирусную нагрузку) через 24 недели АРТ она должна быть < 50 копий/мл либо демонстрировать выраженную тенденцию снижения до этого уровня.
При расхождении между вирусологическими и иммунологическими показателями, приоритет за вирусологическими.
Число лимфоцитов CD4 необходимо определять каждые 3 месяца, по стабилизации СД4 лимфоцитов на фоне АРТ - 1 раз в 6 месяцев.
Цель АРТ - снижение ВН до неопределяемого уровня (пороговый уровень
При показателях ВН от 200 до 400 коп/мл – развитие резистентности возможно, необходимо усилить работу по соблюдению приверженности к АРТ.
Госпитализация
III степень (тяжелая) - повседневная жизнь существенно нарушена, часто требуется дополнительная помощь близких, медицинская помощь и лечение, возможно в стационаре;
IV степень (крайне тяжелая, жизнеугрожающая) - нормальная повседневная жизнь невозможна, требуется постоянная помощь посторонних, серьезное лечение, чаще всего в стационаре.
Информация
Источники и литература
Информация
5) Трумова Жанна Зиапеденовна – доктор медицинских наук, профессор РГП на ПХВ «Казахский национальный медицинский университет имени С.Д.
Указание условий пересмотра протокола: пересмотр протокола через 3 года после его опубликования и с даты его вступления в действие или при наличии новых методов с уровнем доказательности.
Оценку нарушений познавательной деятельности (когнитивных функций) целесообразно проводить у всех ВИЧ-инфицированных пациентов без отягощающих факторов(тяжелые психиатрические заболевания, злоупотребление психоактивными веществами, в том числе алкоголем, текущие оппортунистические инфекции центральной нервной системы, другие неврологические заболевания) в течение 6 мес. со времени постановки диагноза. Данный подход позволяет точно определить исходные показатели и, соответственно, более точно оценить дальнейшие изменения. Для раннего скрининга когнитивных функций необходимо задать пациенту 3 вопроса (S.Simionietal. AIDS 2009, EACS 2012):
1. Часто ли у Вас бывают случаи потери памяти (например, Вы забываете значительные события, даже самые недавние, назначенные встречи и т.д.)?
Нейропсихологическое обследование должно включать в себя тесты для изучения следующих характеристик познавательной деятельности: слухоречевая и зрительная память, счет, скорость восприятия информации, внимание, , двигательные навыки. (Antinorietal.Neurology, 2007). В случае выявления патологии требуется обследование пациента у невролога, проведение МРТ головного мозга и исследовании спинномозговой жидкости (СМЖ) на вирусную нагрузку и, если есть к тому показания, провести исследование генотипической резистентности к препаратам в двойной пробе СМЖ и плазмы крови. Если у пациента выявлена патология нейрокогнитивных функций на этапе скрининга или при дальнейшем нейропсихологическом обследовании, необходимо рассмотреть возможность включения в схему препаратов, потенциально воздействующих на центральную нервную систему. К ним относятся либо те препараты, проникновение которых в СМЖ было продемонстрировано в исследованиях, проведенных у здоровых ВИЧ-инфицированных пациентов(концентрация выше IC90 у более чем 90% обследуемых пациентов), либо те, для которых доказана краткосрочная (3–6 мес.) эффективность воздействия на когнитивные функции или на снижение ВН на СМЖ, при условии, что оценка проводится в отсутствие каких-либо других совместно принимаемых препаратов или в рамках контролируемых исследований, результаты которых рецензируются экспертами (EACS 2012).
Читайте также:

