В отношении стафилококков вырабатывающих бета лактамазу эффективен
Обновлено: 19.04.2024
Проблема антибиотикорезистентности. Бета-лактамазы расширенного спектра действия (БЛРС)
В настоящее время четко определены основные серьезные проблемы, связанные с антибиотикорезистентностью бактерий, ответственных за развитие НКИ: MRS A, MRS-КНС, VRE, штаммы грамотрицатсльных палочек, продуцирующих БЛРС (Klebsiella pneumoniae и Е. Coli), мультирезистентные и папрезистентные штаммы энтеробактерий, неферментирующих грамотрицательных палочек А. baumannii и P. aeruginosa, появление штаммов стафилококков и энтерококков, резистентных к ванкомицину и линезолиду (Guideline for Isolation Precautions: Preventing Transmission of Infectious Agents in Healthcare Settings Recommendations of the Healthcare Infection Control Practices).
Ключевая роль лаборатории клинической микробиологии состоит в своевременном и точном выявлении MDR у микроорганизмов, представляющих возбудителей НКИ. Существуют различные доступные в настоящее время методы диагностики резистентности (стенотипический, молекулярный, микробиологические анализаторы MDR, составляет 19 и 33% соответственно. Назначение хиполонов и антипсевдомонадных пенициллинов служит независимым фактором риска резистентности к карбапенемам у зитеробактерий.
По нашим данным, Е. coli, К. pneumoniae и Е. cloacae — это основные виды грамотрицательных палочек из семейства зитеробактерий, которые вызывают послеоперационные РИ у онкологических больных. Все три вида имеют свои особенности, которые необходимо учитывать при назначении антибактериальных препаратов.
При определении чувствительности грамотрицательных палочек семейства Enterobacteriaceae весьма важен поиск штаммов, способных вырабатывать ферменты, объединенные в группу бета-лактамаз расширенного действия (БЛРС). Инфекции, обусловленные микроорганизмами, продуцирующими такие ферменты, поддаются терапии ограниченным количеством антимикробных препаратов. Обоснованные рекомендации по выявлению БЛРС фенотипическими методами распространяются только на штаммы Klebsiella spp. и Е. coli. Выработка БЛРС может быть выявлена практически у всех видов этого семейства и даже у целого ряда других грамотрицательных палочек.
Продуценты бета-лактамаз расширенного действия (БЛРС) устойчивы ко всем пенициллинам, цефалоспоринам и монобактамам, даже когда in vitro эти препараты эффективны, Существуют различные методы выявления микроорганизмов, вырабатывающих бета-лактамаз расширенного действия (БЛРС), доступные практическим лабораториям. Ориентировочно можно предположить способность грамотрицательных палочек к продукции бета-лактамаз расширенного действия (БЛРС), если in vitro отмечается снижение чувствительности к таким препаратам, как цефподоксим, цефтазидим, цефтриаксон, цефотаксим или азтреонам.
Далее, при выявлении подавления действия b-лактамаз ингибиторами (например, сульбактамом, клавулановой кислотой, тазобактамом) можно утверждать, что данный штамм вырабатывает БЛРС (CLSI, M100-S18, 2003).
При выявлении продуцентов бета-лактамаз расширенного действия (БЛРС) препаратами выбора служат карбапенемы (имипенем, меропенем). Доля продуцентов бета-лактамаз расширенного действия (БЛРС) у пациентов хирургических отделений отечественных стационаров высока и примерно одинакова как для К.pneumoniae (46,2 %), так и для Е. coli (48,2%). По данным мониторинга антибиотикорезистентности в Европе при НКИ за 2005 2008 гг. (SMART), БЛРС — продуценты Е. coli составляют 10,8% (298 из 2764 штаммов), К. pneumoniae - 19,3% (128 из 662), что статистически значимо ниже частоты выделения подобных штам мов в отечственных клиниках.
Следует отметить высокую чувствительность всех штаммов энтеробактерий отечественных клиниках к карбаненемам. При этом к имипенему отмечается более низкая по сравнению с меропенемом чувствительность, особенно в группе Proteus spp., где чувствительность к меропенему достоверно выше по сравнению с имипенемом (97,7% против 54,2% соответственно).
In vitro чувствительность энтеробактерий к препаратам группы аминогликозидов от 30 до 100% и весьма зависит не только от рода, по и от вида энтеробактерий, что подтверждает необходимость организации микробиологических исследований на высоком уровне, который может быть обеспечен в современных условиях.
Такие же выводы можно сделать и в отношении фторх и полонов (ципрофлоксацин, левофлоксацин). В крупных международных исследованиях отмечается высокий процент устойчивых к ципрофлоксацину штаммов E. coli, что наблюдается и в отечественных клиниках: около половины штаммов кишечной палочки устойчивы к ципрофлоксаципу. Многофакторный анализ показал, что профилактика фторхиполопами достоверно связана с увеличением устойчивости микроорганизмов к фторхинолонам и с продукцией БЛРС Е. coli.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Материалы предназначены исключительно для врачей и специалистов с высшим медицинским образованием. Статьи носят информационно-образовательный характер. Самолечение и самодиагностика крайне опасны для здоровья. Автор статей не дает медицинских консультаций: клинический фармаколог — это врач только и исключительно для врачей.
- Наличие в структуре бета-лактамного кольца
- Бактерицидное действие путем воздействия на клеточную стенку микроорганизмов
- Низкая токсичность (как вы помните у людей клеточной стенки нет)
- Широчайший диапазон дозировок
- И времязависимое действие – то есть бета-лактамы мы должны назначать строго по часам, через равные интервалы времени.
- Природные:
- бензилпенициллин
- феноксиметилпенициллин прокаин
- бензатин бензилпенициллин
- оксациллин
- карбенициллин
- тикарциллин
- азлоциллин
- пиперациллин
- амоксициллин/клавуланат
- амоксициллин/сульбактам
- ампициллин/сульбактам
- тикарциллин/клавуланат
- пиперациллин/тазобактам
1. Пенициллин. Был самым первым бета-лактамом и, по сути, совершил прорыв в медицине, начав эру применения антибиотиков.
- Мощного бактерицидного действия против стрептококков, менингококков, спирохет и др.представителей микробной флоры,
- Низкотоксичен и стоит копейки.
- Большинство микроорганизмов очень быстро приобрело к нему устойчивость, путем выработки беталактамаз и пенициллин сдал свои позиции в клинической практике.
- Кроме того этот препарат оказался высоко аллергичным и эта аллергия была перекрестной на весь класс пенициллинов
- И один из самых значимых недостатков – это неудобство его применения. Препарат имеет очень короткий период полувыведения, а потому требуется его 4-6 разовое введения в сутки. Если Вам не жалко ни больного, ни медсестру – то при стрептококковых инфекциях, только надо быть точно уверенным что тут именно стрептококк, можно устроить и тому и другой подобную каторгу. Но все же лучше выбрать более удобный и более безопасный препарат, например амоксициллин, который применяется перорально, что значительно безопаснее для всех участников лечения и несоизмеримо комфортнее.
К ним относятся – ампициллин и амоксициллин, по антимикробному спектру практически идентичные и в отличие от пенициллина отличаются более расширенным за счет отдельных представителей семейства Enterobacteriaceae и анаэробов спектром действия.
Амоксициллин мы используем при приеме внутрь. Его основной плюс заключается в повышенной чувствительности пневмококков к этому препарату, что и ставит его на одно из первых мест в лечении типичной внебольничной пневмонии, а так же инфекций верхних дыхательных путей.
Ампициллин мы используем только для парентерального введения, ибо при приеме per os до сосудистого русла добирается не более 30% от введенной дозы.
Ампициллин и сейчас является одним из лучших препаратов для лечения дикого энтерококка, потому и занимает в его терапии особое место.
Однако необходимо помнить, что оба препарата быстро и эффективно разрушаются ферментами защиты бактерий, а именно бета-лактамазами, но об этом чуть дальше.
3. Препарат Оксациллин мы будем обсуждать, когда речь пойдет о лечении грам(+) инфекций, а именно в антистафилококковой терапии, так как никаких других точек приложения у него нет.
Ампиокс (смесь ампициллина и оксациллина) изначально не имел особого клинического значения по нескольким причинам, это:
- Отсутствие синергизма между оксациллином и ампициллином
- Фиксированная дозировка автоматом делает один из компонентов балластом для другого. Так например, если мы решим полечить инфекцию оксациллином, которого в препарате всего 0,165 г в полуграммовом флаконе, то мы получим хороший передоз по ампициллину, потому что суточная потребность в оксациллине 8 г и дополнительно к нему мы введем 16 г ампициллина… а это 48 флаконов. По 0,5 г за сутки.
- Кто из нас изверг?
- Ну и главное – зачем мучиться с ампиоксом, когда есть более эффективные и удобные препараты, такие как цефалоспорины 1-2 поколения или ингибитор защищенные пенициллины?
Как я уже говорила ранее, все антибактериальные препараты рано или поздно теряют свою эффективность за счет развития резистентность к ним у микроорганизмов. Проще говоря, микробы эволюционируют, чтобы выжить в агрессивных для них условиях и эту эволюцию мы может наблюдать на примере антибиотикорезистентности.
Основным механизмом развития резистентности бактерий к бета-лактамным антибиотикам является выработка ими особых ферментов – беталактамаз, которые разрушают то самое беталактамное кольцо – важнейший элемент, обуславливающий бактерицидное действие препаратов.
3) Беталактамазы расширенного спектра действия (БЛРС), сочетающие в себе свойства первых двух и плюс к этому рушащие еще и ЦФ 3-4 поколений.
- Клавулановая кислота,
- Сульбактам
- Тазобактам,
которые стали соединять в комбинациях с бета-лактамами. Эти препараты и получили название ингибиторзащищенных пенициллинов.
В результате действия ингибиторов удалось добиться восстановления природной чувствительности многих микроорганизмов к пенициллинам.
Прекрасный препарат, работающий на всех тех же возбудителей, что и амоксициллин. Мы помним про особые отношения между препаратом и пневмококком, кроме того, у него усиленное действие на энтерококки продуцирующие бета-лактамазы. Препарат обладает высокой антианаэробной активностью, в т.ч. и против бактероидов.
Амоксициллин/клавулнат активен против грам(-)флоры, продуцирующей бета-лактамазы, которым относится гемофила, мораксела, нейсерия, кишечная палка, протей и клебсиелла.
- Бактериальные инфекции верхних дыхательных путей
- Бактериальные инфекции нижних дыхательных путей
- Инфекции желчевыводящих путей
- Инфекции мочевыводящих путей
- Интраабдоминальные инфекции
- Инфекции органов малого таза
- Инфекции кожи и мягких тканей
- Инфекции костей и суставов
- И периоперационная антибиотикопрофилактика… но… тут есть одно но, о котором мы будем говорить отдельной темой, а сейчас только упомянем – если препарат активно используется в антибитикотерапии ему нет места в профилактике! А потому давайте договоримся, что амоксициллином/клавуланатом мы пациентов лечим.
При этом он значительно дешевле и перекрывает как раз всю ту флору, которую нам надо перекрыть во избежание раневой инфекции.
С) Также стоит упомянуть такой препарат, как амоксициллина/сульбактам… В течение нескольких лет он довольно плотно присутствовал на нашем рынке и в наших стационарах.
D) Пиперациллин/тазобактам начал возвращаться в нашу практику совсем недавно. Препарат позиционируется как препарат выбора для терапии тяжелых, в том числе и госпитальных инфекций, но крайне высокая цена, на уровне карбопенемов, и наличие самих карбопенемов у нас в арсенале, отодвигают использование данного препарата на самый задний план.
История применения антибактериальных препаратов переживает определенную цикличность. В доантибиотиковую эру среди возбудителей тяжелых инфекций преобладали Гр(+) возбудители, потом пришли антибиотики, и во время второй мировой основными возбудителями стали Гр(-) возбудители (по принципу «свято место пусто не бывает), но тут Гр(+) опять подняли голову, т.к. выяснилось, что свыше 80% штаммов стафилококков продуцируют пенициллиназу и разрушают бензилпенициллин и аминопенициллины.
Материалы предназначены исключительно для врачей и специалистов с высшим медицинским образованием. Статьи носят информационно-образовательный характер. Самолечение и самодиагностика крайне опасны для здоровья. Автор статей не дает медицинских консультаций: клинический фармаколог — это врач только и исключительно для врачей.
Автор: врач – клинический фармаколог Трубачева Е.С.
Staphylococcus aureus делится на две группы – мецитиллинчувствительные (MSSA) и мецитиллинрезистентные (MRSA):
1. MSSA вырабатывают беталактамазы – пенициллиназы, которые разрушают незащищенные пенициллины, но сохраняют высокую чувствительность к оксациллину и цефазолину. Кроме того они обладают лейкоцидином Пантона-Валентайна, который вызывает распад тканей практически в любом очаге, что служит косвенным подтверждением стафилококковой инфекции еще до получения микробиологического анализа.
2. MRSA в свою очередь подразделяются на госпитальные, которые характеризуются тем, что:
- являются полирезистентными, т.е. нечувствительные ко всему классу бета-лактамов, включая карбапенемы;
- у них отсутствует лейкоцидин Пантона-Валентайна, поэтому реже возникают деструктивные процессы (пациенты просто тихо и долго гниют, в отличие от инфекций, вызванных дикими штаммами)
- вызывают нозокомиальные пневмонии, инфекции кожи, ран, сепсис, бак эндокардит протезированных клапанов, инфекции имплантов.
и внебольничные MRSA, характеризующиеся:
- полирезистентностью;
- наличием лейкоцидина Пантона-Валентайна, благодаря которому они более агрессивны и вызывают некротизирующие заболевания кожи, сосудов и легких (особенно четко роль лейкоцидина Пантона-Валентайна видна в развитии некротизирующей пневмонии);
- в основном характерны для наркоманов и лиц без определенного места жительства.
Факторами риска MRSA инфекций являются
- назофарингеальная колонизация MRSA;
- лечение бета-лактамами (выбивается чувствительная флора и ее место занимает MRSA;
- нахождение в ОРИТ;
- повреждение кожи при длительной госпитализации более 2-х недель (п/о раны, ожоги, язвы);
- внутрисосудистые катетеры и импланты;
- мед. работники и члены их семей (соседи – реаниматологи или хирурги, если семьи между собой общаются)
Для чего мы все это вспоминаем? Дело в том, что основные проблемы, связанные со стафилококковой инфекцией, это:
- Широкое распространение в медицине и как следствие недооценка проблемы.
- Назначение эмпирической терапии без учета риска MRSA, и как следствие – отсрочка адекватной терапии, что в случае золотистого стафилококка в прямом смысле смерти подобно.
- Клиническая эффективность антибиотика in vitro не всегда тоже самое что in vivo (мы все таки отличаемся от чашки Петри).
- Неадекватное дозирование и длительность терапии (недостаточные дозы и короткие курсы) – отсюда осложнения и рецидивы.
- Высокая летальность при неадекватной терапии
Проводить антистафилококковую терапию меньше 3-х, а то и 4-х недель нельзя, так как для этого возбудителя характерно развитие метастатических очагов и весь процесс пойдет по новому, только с учетом еще и того, что возбудитель окажется резистентным к ранее проводимой терапии.
Когда можно лечить 2 недели стафилококковую инфекцию?
- В/в катетер или другой источник инфекции удален (хорошо если катетер, а если речь об импланте – его же не удалишь).
- Инфекционный эндокардит исключен по данным чрезпищеводной ЭХО-КГ.
- Отсутствуют импланты (протезированный клапан, кардиостимулятор, А-В фистула).
- Нормализация температуры и отрицательная гемокультура в течение 72 ч после удаления источника инфекции.
- Нет признаков метастатических очагов на других органах и тканях.
Во всех остальных случаях лечим 21-28 дней. А что происходит у нас? Максимум 10-14 дней пролечили и отпустили.
Антистафилококковые препараты мы обязаны назначить сразу как только получили положительную гемокультуру на стафилококк однократно! И только потом проводим повторную проверку, так как максимально раннее начало антибактериальной терапии в 2-3 раза снижает летальность.
Итак, как уже стало понятно, основную проблему представляют устойчивые формы S.aureus. Для их эрадикации были синтезированы и предлагаются к использованию следующие препараты
- Гликопептиды – Ванкомицин (1958 год) – категория доказательств IА
- Стрептогранины – Синерцид (в РФ отсут)
- Оксазолиндиноны – Линезолид – категория доказательств IА
- Липопептиды – Даптомицин – категория доказательств IА – Тигециклин – категория доказательств IIВ
1. Ванкомицин
Внедрен в практику в 1958 году, а первый устойчивый штамм стафилококка поймали только в 1996 году. Проблема с ванкомицинустойчивыми штамма стафилококка в том, что до сих пор нет отработанных схем преодоления этой самой устойчивости. Помимо прочего у возбудителей непрерывно нарастает МПК (минимальная подавляющая концентрация) к ванкомицину и сейчас при МПК 2 мы говорим о резистентном штамме.
Еще одна проблема – это плохо очищенные формы препарата. Если ванкомицин плохо очищен, то риск токсических нефропатий достигает 20%. К сожалению надо констатировать тот факт, что Ванкомицин отечественного разлива относится к плохо очищенным формам.
Основным и самым грозным осложнением является развитие острой почечной недостаточности, а она развивается у 40% пациентов, если дозировка препарата составляет более 4 гр/сут. А потому вводить данный препарат можно только под контролем клиренса креатинина (КК). То есть первый анализ мы проводим до введения препарата, второй через 2-3 дня и смотрим, если имеет место падение КК: если он падает на 25% – это говорит о нефротоксичном действии препарата, если на 50%, то препарат следует немедленно отменить.
Ванкомицин является бактериостатическим антибиотиком, эффективность действия мы оцениваем не ранее чем через 72 часа, а то и на 5-е сутки от начала терапии. Доза должна подбираться в соответствии с МПК возбудителя и под постоянным контролем клиренса креатинина. То есть для использования этого препарата нам необходимы хорошая клиническая и микробиологическая лаборатории.
Современные рекомендации по дозированию препарата выглядят следующим образом:
У Вас есть возможность это делать? У меня такой возможности не было и нет до сих пор, а потому мы до сих пор используем этот препарат как саперы на минном поле, где ошибиться можно только один раз.
Активность против MSSA у Ванкомицина сопоставима с плацебо, а значит применять его можно только при верифицированной MRSA, либо комбинировать с препаратами, активными против MSSA (цефазолином, например)
Следует так же помнить о том, что Ванкомицин, в виду строения его молекулы, а особенно ее размера, плохо проникает в ткани и проблемными его локализациями будут дыхательные пути, ЦНС, клапаны сердца и кости. А потому быстрого действия там не дождешься и терапия требуется очень и очень длительная.
В заключении хотелось бы сказать, что препарат хорош, но будет лучше, если вы его не будете назначать в самостоятельном режиме, а вызовете врача – клинического фармаколога, ибо назначение и дозировка таких вот препаратов входит в его непосредственные обязанности.
Что делать если клин. фарма нет, а пациент есть. И что надо соблюсти, чтобы безопасно применять ванкомицин?
- Использовать хроматографически очищенные препараты – Ванкоцин, Эдицин (в настоящих условиях это практически невозможно, торги они не выигрывают)
- Требуется коррекция гиповолемии, сердечной недостаточности (перфузия почек должна быть нормальное, иначе усугубим нефротоксический эффект)
- Избегать комбинаций с нефро- или ототоксичными препаратами (аминогликозидами, НПВС и т.д.)
- Коррекция режима дозирования по клиренсу креатинина. Если в течение 2-3-х дней он снизился вдвое от изначального, а данных за то, что он мог рухнуть не только от Ванко нет – это проявление нефротоксичности препарата.
2. Линезолид
Является чистым бактериостатиком. Производителем неоднократно заявлялось, что препарат эффективнее Ванкомицина, однако проведенные независимые метаанализы клинических исследований хорошего качества рандомизированных и с двойным слепым контролем показали, что единственное, где Линезолид имеет преимущество – это вентилятор-ассоциированный пневмонии, вызванные MRSA. В других случаях, в т.ч. и стафилококковой пневмонии, преимуществ нет никаких. Зато стоимость лечения повышается в разы.
Еще один момент, о котором умалчивается – это безопасность применения Линезолида. Да, нефротоксичности нет, но по данным того же метаанализа частота возникновения тромбоцитопений при его использовании в 11,72 раза выше чем в группе плацебо.
Таким образом, Линезолид является препаратом выбора при нозокомиальной вентилятор-ассоциированной MRSA пневмонии, где при его использовании летальность ощутимо ниже, чем при использовании ванкомицина.
3. Тигециклин (или тайгециклин)
Давайте разберемся и с ним, тем более к вам будут часто приходить и рассказывать про него как про самый препаратистый антибиотик в мире.
- Препарат позиционируется как новый класс антибиотиков, на деле это производный тетерациклина со всеми исходящими отсюда последствиями.
- Он является бактериостатиком, как все тетрациклины
- Имеет хорошую тканевую фармакокинетику, но при этом крайне низкие концентрации в плазме крови (ангиогенные инфекции из его показаний выпадают сразу)
А теперь о том, куда его следует применять:
- В качестве средства целенаправленной этиотропной терапии НИ, вызванных полирезистентными бактериями:
- БРЛС: альтернатива карбопенемам
- Ацинетобактер – альтернатива сульбактаму
- Клебсиела и E.coli – устойчивые к карбопенемам
- Stenotrophomonas maltophilia
Повторюсь еще раз, место его применения это ЦЕЛЕНАПРАВЛЕННАЯ ЭТИОТРОПНАЯ ТЕРАПИЯ, т.е. когда микроб четко установлен в результате бактериологического исследования вместе с чувствительностью к антибиотикам.
Повторюсь еще раз – место этого препарата в лечении грам-отрицательной инфекции, но никак не стафилококков. Да и вообще это препарат крайне глубокого резерва, как по характеристикам, так и по цене, т.к. в ближайшие 10 лет не будет ни одного нового препарата с Гр(-) активностью, так как их просто нет даже в проекте (медицина традиционно не успевает за возбудителями, а только пытается их догонять, о чем мы в самом начале и говорили, прослеживая эволюцию возбудителей)
4. Даптомицин.
Препарат появился у нас недавно, хотя во всем мире применяется уже очень давно (в Штатах с 2003 года)
Препарат относится к классу липопептидов и от всех имеющихся на данный момент антиMRSA препаратов отличается тем, что является бактерицидным. И этот самый эффект развивается у него очень быстро и нам не надо ждать нескольких дней. То есть антибактериальный эффект мы можем оценивать как и у всех бактерицидных препаратов через 48 часов от начала применения, а это очень важно у больных в тяжелом состоянии. Еще одним несомненным плюсом является то, что не происходит лизиса клеток и не увеличивается интоксикация.
Основными показаниями к применению являются:
- Эндокардит,
- Менингит,
- Остеомиелит,
- Инфекции у больных с нейтропенией,
- Сепсис стафилококковой этиологии
Также препарат может использоваться в эмпирической терапии (кстати, единственный из всех имеющихся на данный момент) Гр(+)инфекций, так как активность против MSSA и MRSA одинаковая.
Кроме того, препарат проявляет активность против MRSA в биопленках, а значит нет необходимости в удалении протезов и имплантов. А значит Даптомицин показан при ангиогенных инфекциях (бактериемиях), остеомиелите, бактериальном эндокардите.
- Препарат откровенно дорог
- В связи с крупным размером молекулы имеются проблемы с тканевой кинетикой, а потому пневмонии и инфекции ЦНС на данный момент мы им не лечим.
- Побочные эффекты – миалгии, производитель говорит о необходимости следить за КФК и обращать пристальное внимание на пациентов уже имеющих подобные проблемы.
- Описано несколько случаев эозинофильных пневмоний, а потому и на это следует обращать внимание, так как при своевременной диагностике и вовремя назначенной терапии, данный вид пневмонии проходит без следа.
Итак, сводя все к общему знаменателю:
Ванкомицин мы используем тогда, когда у нас верифицирован MRSA стафилококк, имеется хорошая микробиологическая лаборатория, которая нам даст его МПК и это МПК не будет больше 2 (иначе он уже резистентен), в наличие есть клинический фармаколог, который посчитает дозу, будет ее контролировать и корригировать согласно изменениям клиренса креатинина. Но при этом мы помним о том, что препарат не работает на MSSA. И конечно же мы продолжаем помнить о его высокой нефротоксичности, если не имеем возможности пользоваться высокоочищенными формами.
Тигециклину нечего делать антистафилококковой терапии, этот препарат предназначен только для этиотропной терапии Гр(-)инфекции.
В связи с высокой активностью против MRSA и MSSA, быстрым бактерицидным эффектом является препаратом выбора при ангиогенных инфекциях, сепсисе и инфекционном эндокардите, а также препаратом выбора при эмпирической терапии MRSA+MSSA. Не использовать при лечении нозокомиальных пневмоний и инфекций ЦНС.
Создание группы цефалоспориновых препаратов было ответом на уменьшающуюся активность препаратов пенициллинового ряда, появление пенициллин-устойчивых стафилококков и недостаточной активности против грамм (-) возбудителей, с нарастанием активности в сторону грам (-) возбудителей.
Материалы предназначены исключительно для врачей и специалистов с высшим медицинским образованием. Статьи носят информационно-образовательный характер. Самолечение и самодиагностика крайне опасны для здоровья. Автор статей не дает медицинских консультаций: клинический фармаколог — это врач только и исключительно для врачей.
- на уменьшающуюся активность препаратов пенициллинового ряда,
- появление пенициллин-устойчивых стафилококков
- недостаточной активности против грамм (-) возбудителей, с нарастанием активности в сторону грам (-) возбудителей.
- Мощное бактерицидное действие
- Широкий спектр активности (кроме I поколения)
- Устойчивость к бета-лактамазам S.aureus
- Чувствительность к БРЛС
- Отсутствие активности против энтерококков, листерий, MRSA
- Синергизм с аминогликозидами
- Широкий терапевтический диапазон
Препараты первой генерации имеют очень узкий спектр антимикробной активности и основное их клиническое значение связано с действием на грам-положительные кокки, за исключением MRSA и энтерококков. К тому же они могут разрушаться бета-лактамазами многих гр(-) бактерий.
Правда, есть один существенный момент - исследования показали, что часто истинную аллергическую реакцию на пенициллины путают с так называемой ампициллиновой сыпью, которая встречается у 5-10% пациентов, не связана с аллергией на бета-лактамы, имеет макулопапулезный характер, не сопровождается зудом и может пройти без отмены препарата.
- инфекционный мононуклеоз (встречается в 75-100% случаев),
- цитомегалия,
- хронический лимфолейкоз.
Одним из самых часто применяемых цефалоспоринов I поколения является Цефазолин и исходя из вышеуказанного, основным для него показанием является периоперационная профилактика в хирургии. Но тут стоит помнить об одном очень интересном класс-эффекте всех цефалоспоринов, а именно о лекарственной гипертермии, которая отличается от истинной тем, что протекает на фоне брадикардии и прежде чем бросаться назначать антибиотикотерапию, у больного, помимо клинических анализов стоит просто посчитать пульс.
Второе и третье поколение цефалоспоринов некоторые исследователи давно предлагают объединить в силу их очень небольших различий между собой. Они отличаются от первого поколения более широким спектром действия в сторону грам (-) флоры и снижением активности в сторону грам (+)возбудителей.
- Цефотаксим,
- Цефоперазон, в т.ч. с сульбактамом,
- Цефтриаксон,
- Цефтазидим.
Исторически эта генерация разрабатывалась для того, чтобы бороться с госпитальной грамотрицательной инфекции (энтеробактер, серрации, индолположительный протей), устойчивых к цефалоспоринам 2-го поколения.
Благодаря большей устойчивости к бета-лактамазам эта группа обладает большей активностью в отношении Гр(-) бактерий семейства Enterobacteriaceae, включая нозокомиальные полирезистентные штаммы. Но при этом у них ниже активность в отношении Гр(+) возбудителей, чем у цефазолина.
- MRSA,
- энтерококки и листерии,
- имеют низкую антианаэробную активность,
- разрушаются БЛРС.
В настоящий момент данная генерация препаратов применяется для лечения тяжелых и смешанных инфекциях и используется в сочетании с аминогликозидами II – III поколения, метронидазолом, ванкомицином.
Основные проблемы, связанные с цефтриаксоном состоят в качестве используемых препаратов. Так оригинальный роцефин в среднем стоит 500 р, но есть его копии стоимостью в 10-15 рублей (по данным портала Фарминдекс). Смоленское НИИ антимикробной химиотерапии провело в свое время сравнительное исследование различных Цефтриаксонов и выяснилось, что качество препаратов мягко сказать разное, начиная с побочных включений и микробной контаминации, заканчивая значительной разностью данных по биоэквивалентности. Таким образом, ожидать чуда излечения от препарата в 50 раз более дешевле оригинального наверное будет достаточно наивным.
Кроме того, Цефоперазон проще и быстрее разрушается бета-лактамазами не только синегнойной палочки, но и другой грам(-) флоры. Добавление к нему сульбактама ситуацию особо не изменило, в результате препарат используется только в 2-х странах мира – России и Турции. Та же FDA отменила его регистрацию на территории США.
Если результатов из лаборатории еще нет, но есть пациент уже полеченный цефтазидимом без эффекта, то не нужно выбирать ему препарат среди III генерации цефалоспоринов, потому что использование их будет бесполезным А если пациента с грамотрицательной инфекцией лечили цефалоспоринами 2-3-й генерации, то вполне допустима терапия цефтазидимом, потому что во-первых, он активен против синегнойки, а во вторых бета-лактамаза цефуроксимаза, рушит все цефалоспорины, но не цефтазидим.
Еще одной особенностью цефтазидима является его возможность создавать высокие концентрации в ликворе, проникая через гематоэнцефалический барьер, поэтому его используют для лечения менингитов, вызванных грамотрицательной микрофлорой, при условии чувствительности к нему возбудителей.
Цефалоспорины IV поколения в России представлены только Цефепимом, который отличается от 3-го поколения более высокой активностью в отношении Гр(+) кокков, за исключением MRSA и энтерококков.
Изначально препарат использовался только для лечения тяжелых нозокомиальных инфекций, вызванных полирезистентной микрофлорой (для чего он собственно и создавался):
- Инфекции нижних дыхательных путей (пневмония, абсцесс легкого, эмпиема плевры)
- Осложненные инфекции мочевыводящих путей
- Интраабдоминальные инфекции кожи и мягких тканей, костей и суставов
- Сепсис
- Инфекции на фоне нейтропений и других иммунодефицитных состояний
Но в связи с высоким распространением БЛРС в том числе и во внебольничной среде, при обнаружении данных бета-лактамаз у грам(-)флоры пациента следует рассматривать как устойчивость ко всем цефалоспоринам, в том числе и к цефипиму. Если таковых нет, то препарат будет очень эффективен для пациентов с тяжелой грамотрицательной инфекцией.
Инфекции золотистого стафилококка (Staphylococcus aureus): диагностика, лечение, профилактика
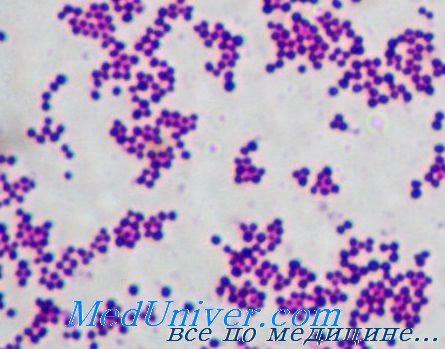
Представители этого рода — неспорообразующие неподвижные грамположительные кокки, формирующие при росте колонии в виде виноградной грозди (кластера) и входящие в состав нормальной микрофлоры кожного покрова животных и человека.
Стафилококки — представители семейства Micrococcaceae. Существует свыше 26 видов стафилококков, но лишь некоторые из них представляют угрозу для здоровья человека. Самым опасным считают золотистый стафилококк (Staphylococcus aureus), отличающийся от остальных наличием фермента коагулазы.
Staphylococcus aureus
Этот вид долгое время считали единственным патогенным микроорганизмом в своём роде. Носительство S. aureus у человека обычно протекает бессимптомно; его обнаруживают у 40% здорового населения.
Обычно он локализуется на слизистой оболочке носа, коже подмышечной области и промежности.
![золотистый стафилококк]()
Патогенез инфекции золотистого стафилококка (Staphylococcus aureus)
Коагулаза, продуцируемая Staphylococcus aureus, катализирует реакцию превращения фибриногена в фибрин и помогает микроорганизму образовывать защитный барьер. Кроме того, наличие рецепторов к поверхностным структурам клеток хозяина и матричным белкам (например, фибронектину, коллагену) обусловливает возможность адгезии возбудителя.
Он вырабатывает экстрацеллюлярные лизирующие ферменты (липазу), разрушающие ткани и способствующие инвазии. Некоторые штаммы продуцируют сильнейший экзотоксин, вызывающий синдром токсического шока. Выделяемые бактерией энтеротоксины могут быть причиной диареи.
Клиническая значимость золотистого стафилококка (Staphylococcus aureus)
Staphylococcus aureus вызывает различные заболевания. Кожные инфекции возникают в условиях повышенной температуры и влажности, а также в связи с нарушением целостности кожного покрова при некоторых заболеваниях (экзема и др.), хирургических операциях, инъекциях или внутривенной катетеризации. Даже на здоровой коже может развиться поверхностная пиодермия (импетиго), которая затем передаётся от человека к человеку.
Пневмонию, вызванную S. aureus, наблюдают достаточно редко (в большинстве случаев в качестве осложнения гриппа). Инфекция быстро профессирует (часто наблюдают образование полостей или каверн); характерен высокий уровень смертности. Быстрое течение свойственно и стафилококковому эндокардиту, возникающему при неправильном подборе антибиотиков или вследствие микробной колонизации внутривенных устройств. Заболевание часто приводит к смерти пациента. Кроме того, S. aureus — наиболее распространённая причина остеомиелита и септического артрита.
Лабораторная диагностика золотистого стафилококка (Staphylococcus aureus)
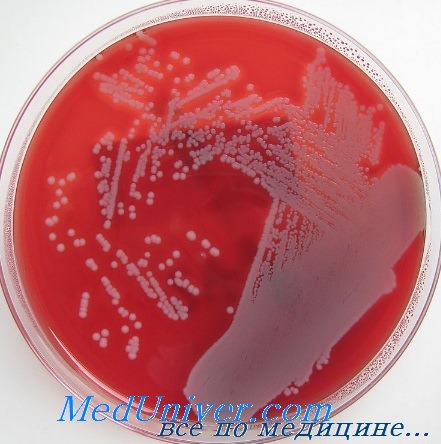
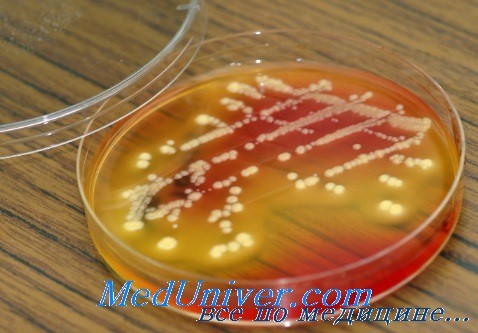
• Бактериологическое исследование: S. aureus — грамположительные кокки, располагающиеся в микропрепарате в виде виноградной грозди. Быстро растут на большинстве питательных сред. Выдерживают высокие концентрации солей, поэтому диагностическая среда может быть приготовлена с учётом этой особенности микроорганизма.
• Изучение биохимических свойств: большинство штаммов S. aureus разлагают маннитол, поэтому добавление его и характерного красителя помогает идентифицировать субкультуру бактерий. Продуцируют коагулазу, ДНКазу, каталазу.
• Типирование S. aureus с помощью набора типовых стафилококковых бактериофагов или методом рестрицирования ДНК.![золотистый стафилококк]()
Чувствительность золотистого стафилококка (Staphylococcus aureus) к антибиотикам
Изменение чувствительности S. aureus к антибиотикам можно считать настоящим пособием по антимикробной химиотерапии. Сначала против золотистого стафилококка был в полной мере эффективен бензилпенициллин, но затем возникли штаммы, способные вырабатывать бета-лактамазы. Со временем они стали преобладать над всеми остальными. С внедрением в клиническую практику метициллина и родственных ему лекарственных средств (флуклоксациллина) именно они стали препаратами выбора и в настоящее время остаются таковыми при наличии чувствительных штаммов.
Позже возникли штаммы золотистого стафилококка, устойчивые к действию метициллина. Их резистентность обусловлена геном тесА+, кодирующим белки со сниженным сродством к пенициллинам. Некоторые из устойчивых штаммов способны вызвать эпидемические вспышки заболевания, для борьбы с которыми применяют ванкомицин и тейкопланин.
В настоящее время обнаруживают всё больше микроорганизмов со средней устойчивостью (или гетерорезистентностью) к гликопептидам. Описаны случаи полной гликопептидной резистентности у некоторых штаммов, обусловленной наличием генов vanA+ и vanB+ заимствованных у энтерококков.
Другими эффективными препаратами считают линезолид, аминогликозиды, эритромицин, клиндамицин, производные фузидовая кислота, хлорамфеникол и тетрациклин.
В отношении метициллинчувствительных штаммов активны цефалоспорины первого и второго поколения. Производные фузидовой кислоты применяют при комбинированной терапии инфекционных заболеваний костей и суставов. Лечение должно сопровождаться обязательным проведением теста на чувствительность к антимикробным препаратам.
Профилактика заболеваний вызванного золотистым стафилококком (Staphylococcus aureus)
Передача инфекций, вызываемых Staphylococcus aureus, происходит посредством аэрозольного и контактного механизма. Носителей или лиц, заражённых штаммами, устойчивыми к метициллину и гликопептидам, необходимо изолировать в отдельные боксы и соблюдать меры предосторожности во избежание раневого или энтерального проникновения бактерий.
Следует помнить, что медперсонал может стать носителем инфекции и способствовать её распространению в лечебном учреждении. Именно поэтому всем работникам больницы рекомендовано применение местных растворов мупироцина и хлоргексидина.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Читайте также: