В случае развития инфекционных осложнений при острой лучевой болезни более эффективными препаратами являются
Обновлено: 13.05.2024
Инфекционные осложнения лучевой болезни. Инфекция в облученном организме
На современном этапе развития радиобиологии проблема местного лучевого воздействия отнюдь не утратила своего значения. Напротив, в связи с применением для практических целей, кроме рентгеновских лучей и у-лучей, многочисленных естественных и искусственных источников а- и бета-излучений различной мощности, нейтронов, протонов и т. д., возросла необходимость дальнейшего изучения местных биологических эффектов, особенно в сравнительном аспекте. Однако не меньшее, если не большее, значение приобрело изучение реакции целостного организма на ту или иную форму общего облучения.
Известно, что при лучевой болезни довольно часто развиваются инфекционные осложнения, среди которых на первый план выступают такие, как некротический тонзиллит, энтерит, пневмония, инфицирование ран, термические и световые ожоги [Краевский Н. А., 1957; Иванов А. Е., 1961; Мудрецов Н. М., 1957; Tullis J., Warren Sh., 1947; Lielow A. et al., 1949; de Coursey E., 1951; Hempelmann L. et al., 1952; Oughterson E., Warren Sh., 1960].
Агенты, вызывающие воспалительные осложнения при лучевой болезни, могут быть разделены на неинфекционные и инфекционные. Неинфекционные причины нередко присоединяются в момент лучевого поражения в виде термических и химических ожогов или возникают в процессе заболевания. При определенных условиях и само ионизирующее излучение, вызывая лучевую болезнь, одновременно может быть причиной местной воспалительной реакции без участия (по крайней мере на первых этапах) инфекционного агента.
Это возможно при воздействии ионизирующего излучения в очень больших дозах, способных вызвать, кроме общего заболевания, тяжелые деструктивные изменения ножи, подлежащих мягких тканей и внутренних органов. При этом воспалительная реакция в той или иной форме вокруг омертвевших тканей начинается раньше, чем наступает инфицирование некротических масс.
Инфекционные агенты, вызывающие воспалительную реакцию в облученном организме, как правило, являются представителями аутофлоры. Само собой разумеется, что в эксперименте и в практике возможно и дополнительное экзогенное заражение.
У людей, подвергшихся облучению, отмечались инфекционные воспалительные изменения в полости рта, в легких и кишечнике, Эти осложнения обычно наблюдались через 2 нед после облучения в больших дозах (более 700—800 Р) и являлись очень частой причиной летальных исходов, наступающих в основном в течение 2—6 нед болезни.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
А.А. Иванов, И.Е. Андрианова, В.Н. Мальцев, Г.А. Шальнова, Н.М. Ставракова, Т.М. Булынина, Т.А. Караулова, А.Ю. Бушманов, И.Б. Ушаков
Иммуно-микробиологическая компонента острого лучевого поражения и модификация его развития иммунотропными препаратами
Введение
Костно-мозговая форма острой лучевой болезни – тотальный вторичный иммунодефицит
Основой патогенеза костно‑мозговой формы ОЛБ является нарушение процесса кроветворения в результате радиационного повреждения клеток системы крови, обладающих на различных стадиях дифференцировки различным уровнем радиочувствительности.
Лимфоцит – главная иммунокомпетентная клетка – обладает исключительно высоким уровнем радиочувствительности D0 для различных типов клеток в силу их гетерогенности находится в широком интервале от 0,5 до 4,38 Гр [2]. Пополнение пула лимфоидных клеток происходит за счет пролиферации и дифференцировки стволовых клеток кроветворения, количество которых резко снижается при ОЛБ. За счет этих процессов развивается дефицит иммунокомпетентных клеток, и организм становится неспособным на иммунный ответ на генетически чужеродные агенты, в т.ч. возбудителей инфекции бактериального и вирусного происхождения.
Более древней, с точки зрения эволюции, является система врожденного, естественного иммунитета, которая обеспечивается в здоровом интактном организме рядом различных клеток, а также белков, ферментов и низкомолекулярных веществ. Она также нарушается после облучения [2].
Снижается барьер‑фиксирующая функция эпителиальных покровов за счет повреждения всех ее антимикробных составляющих. Бактерицидность сыворотки начинает угнетаться на уровне воздействия сублетальных доз излучения вследствие снижения содержания в ней лизоцима и пропердина. На уровне летальных доз излучения угнетение бактерицидности достигает максимальной выраженности за счет дополнительного снижения содержания в ней нормальных антител, трансферринов, интерферонов, бета‑лизинов, фибронектина и отчасти комплемента. Наиболее устойчив к действию излучения синтез нормальных IgM‑антител и комплементарная функция сыворотки крови, судя по классическому пути ее активации. Большое значение для борьбы с инфекциями имеют паттерн‑распознающие рецепторы, которые распознают и обезвреживают паттерны – токсическими субстанциями [3], свойственные как для микробов‑комменсалов, так и для патогенных агентов. Однако их значение в деле профилактики инфекционных осложнений ОЛБ еще недостаточно изучено.
Угнетение клеточных механизмов врожденного иммунитета зависит от снижения подвижности, бактерицидной и переваривающей способности свободных фагоцитов, от снижения поглотительной способности фиксированных фагоцитов, а также от снижения числа микрофагоцитов (нейтрофилов). Эффект начинается на уровне сублетальных доз и достигает максимальной выраженности на уровне летальных доз излучения, Данные о влиянии излучения на поглотительную функцию нейтрофилов крови крайне противоречивы из‑за нарушения стандартности постановки проб от облученных организмов. Судя по морфологии, наиболее устойчивы к радиации дифференцированные клетки врожденного иммунитета: макрофаги (D0 – 5 Гр [2]) и ЕК‑клетки. Однако их функциональная активность угнетается раньше, чем снижения их числа. Кроме того, блокада ионизирующим излучением клеточной пролиферации клеток приводит к снижению числа макрофагов и ЕК‑клеток. Все это повреждает механизмы врожденного иммунитета, обеспечивающие противоинфекционную резистентность облученного организма.
Таким образом, при облучении млекопитающих в среднелетальных и летальных дозах происходит разрушение системы врожденного иммунитета и нарушается способность к иммунной защите от микробов, населяющих организм человека и животных, а также экзогенных микроорганизмов.
Данное состояние квалифицируется как вторичный (пострадиационный) иммунодефицит [2], а поскольку повреждаются практически все компоненты системы иммунитета, как клеточные, так и гуморальные, то он приобретает панцитопенический и даже тотальный тип. Поскольку при облучении в среднелетальных дозах часть животных выживает и происходит спонтанное восстановление кроветворения, а вслед за ним и иммунитета, то для иммунодефицита при ОЛБ характерным является циклическое развитие с определенным латентным периодом, периодом разгара лучевого поражения и глубокого поражения системы иммунитета, сменяющегося восстановительным периодом – т.е. иммунодефицит при ОЛБ обладает определенной цикличностью.
Исходя из вышеизложенного, с точки зрения иммунолога, поражение си‑ стемы иммунитета в облученном организме можно оценивать как тотальный вторичный иммунодефицит. Данное определение является отправной точкой для подбора иммунотропных, а также иммунозамещающих средств профилак‑ тики и терапии ОЛБ, и, кроме того, для объяснения механизма противолуче‑ вого действия известных средств лечения ОЛБ.
Иммунозамещающие средства профилактики и лечения острой лучевой болезни
Трансплантация костного мозга
Наиболее полным и эффективным замещением пораженной облучением системы иммунитета является трансплантация костного мозга [4]. Успешная трансплантация костного мозга, содержащего стволовые клетки, обеспечивает восстановление систем кроветворения и иммунитета только при наличии иммунологической совместимости донора и реципиента, в частности, при использовании аутотрансплантации [5]. Поскольку трансплантация костно‑ мозговых клеток и мезенхимальных стволовых клеток является большой, самостоятельной проблемой, имеющей свои позитивные и негативные научные и организационные стороны, то мы сочли нецелесообразным обсуждать ее в рамках настоящего короткого обзора.
Фармакологические препараты
Цитокины
Цитокины, вещества эндогенного происхождения, являющиеся, как правило, продуктами жизнедеятельности лимфоидных и костномозговых клеток, обеспечивают регуляцию структуры и функции клеток систем кроветворения и иммунитета. В результате радиационного поражения системы иммунитета и кроветворения наблюдается резкий дисбаланс цитокиновой системы. фармакологическое вмешательство в систему цитокинов нельзя полностью квалифицировать как иммунозамещение, однако элементы этого эффекта, безусловно, имеют место.
Одним из примеров позитивного действия цитокинов является лечебное действие препарата лейкоцитарного лейкинферона, содержащего комплекс цитокинов: ИЛ‑1, фактор некроза опухолей, макрофагингибирующий фактор, лейкоцит‑ингибирующий фактор при облучении мышей и обезьян. В опытах на мышах многократное подкожное введение [6] препарата в период от 4 ч до 10 сут после гамма‑облучения (ЛД 75/30) увеличивало выживаемость леченных животных до 48–80 %. Многократное введение лейкинферона сублетально облученным обезьянам обеспечило сохранение на повышенном уровне числа форменных элементов в периферической крови по сравнению с контрольными облученными животными.
В то же время следует отметить, что препараты цитокинов, например ИЛ‑1β, обладающие выраженным противолучевым действием [7, 8], обусловливают ряд нежелательных фармакологических эффектов в виде озноба, головной боли, повышения температуры [7]. Вполне вероятно, что именно благодаря этим эффектам обеспечивается иммуностимулирующее, а не иммунозаместительное действие беталейкина, тем более, что лечебное действие этот препарат оказывает лишь в первые часы после облучения.
Официнальный препарат рекомбинантный гамма‑интерферона ИФНγ – ингарон – рекомендован в качестве противовирусного препарата у человека при таких заболеваниях, как вирусный гепатит В и С, герпесвирусная инфекция и др. [9].
Поскольку при ОЛБ, благодаря таким процедурам, как переливание крови и ее компонентов, велика вероятность заражения сывороточным гепатитом [1], поскольку обострение латентной герпетической инфекции сопровождает практически в 100 % случаев острой лучевой болезни человека в тяжелой форме [10], поскольку цитомегаловирусная инфекция является частым спутником иммунодефицитов [11], то представлялось целесообразным исследовать возможность применения на фоне облучения противовирусного интерферонового препарата. С этой целью в эксперименте на мышах, облученных тотально в дозе 5 Гр γ‑квантов, мы применили ингарон – рекомбинантный гамма‑интерферон. Препарат вводили подкожно в дозе 0,05–0,1 мл (5000–10000 мЕ) сразу после облучения, а затем ежедневно в течение 7 сут. После чего было исследовано состояние центральных органов кроветворения и иммуногенеза. результаты представлены в табл. 1.
Влияние интерферона у (ИФНγ) на показатели (М ± m) системы крови и иммунитета на 8 сутки после облучения мышей в дозе 5 Гр γ-квантов
Примечание:
* – статистически значимая разница между группами 2 и 3 по критерию Стьюдента (р < 0,05)
Как видно по данным табл. 1, препарат ингарон в использованных дозах в ряде случаев тормозит восстановление кроветворения у облученных мышей. Данное обстоятельство указывает на необходимость осторожного использования рекомбинантных препаратов интерферона в клинике ОЛБ.
Наиболее успешным лечебным применением при лучевом поражении и других цитопенических состояниях является использование цитокинов с выраженной стимулирующей активностью, например, гранулоцитарно‑макрофагального колониестимулирующего фактора в комбинации с интерлейкином‑2 [12].
Таким образом, при всей очевидности высокой фармакологической активности цитокиновых препаратов их использование сопряжено с определенным риском, требующим дополнительного экспериментального исследования на предмет уточнения диапазона действия, а также как показаний, так и противопоказаний для их применения при ОЛБ.
Одним из наиболее ранних [13] и до настоящего времени наиболее распространенным и эффективным способом восполнения нарушенной облучением антиинфекционной резистентности являются антибиотики различных классов.
Антибиотики
Собирательное понятие, объединяющее вещества различного, главным образом, микробного происхождения или их синтетических аналогов, по бактериостатической и бактерицидной способности. Основные принципы антибиотикотерапии при ОЛБ были сформулированы в работах Р.В. Петрова [13] и В.Л. Троицкого и М.А. Туманян [14]. антибиотикотерапия и антибиотикопрофилактика при лучевом поражении, т.е. в условиях иммунодефицита, принципиально отличается от терапии специфических инфекционных заболеваний.
Пусковым моментом в развитии инфекционных осложнений при ОЛБ является не проникновение специфического экзогенного агента, а развитие дисбактериоза [15] в местах обитания нормальной микрофлоры: пищеварительном тракте, включая ротовую полость, на коже, мочевыводящих путях, слуховом проходе и т.д. Этот процесс начинается уже в латентом периоде в форме безудержного размножения условно‑патогенных бактерий группы кишечной палочки, стафилококков, стрептококков и др., вытесняющих бактерии антагонисты: лактобациллы и бифидобактерии. развитие дисбактериоза при лучевом поражении обусловлено не экзогенными, а внутренними причинами, основной из которых является снижение иммунной защиты организма. Совокупность изложенных причин обусловливает необходимость раннего применения средств повышения антиинфекционной резистентности. Наиболее простым и доступным является использование антибиотиков и других противомикробных средств. Закономерно назначение антибиотиков широкого спектра действия уже в латентный период заболевания, когда с помощью методов физической и биологической дозиметрии установлены дозы облучения от сублетальных до абсолютно летальных. Поскольку все более широкое распространение приобретают антибиотико‑резистентные формы микробов и фармацевтическая промышленность постоянно поставляет в лечебную сеть все новые и новые антибиотики, то нецелесообразно рекомендовать конкретные антибиотики, а следует исходить из наличия имеющихся препаратов.
Необходимо иметь ввиду наличие у большинства антибиотиков выраженных побочных эффектов. Наиболее неприятным для радиационной патологии является их способность тормозить пролиферацию кроветворных и иммунокомпетентных клеток. Данное обстоятельство приводит к тому, что у облученных животных вместо терапевтического эффекта мы отмечаем замедленное восстановление кроветворения по сравнению с нелеченными, и даже сокращение продолжительности жизни.
Высказанный тезис иллюстрирует простой пример. Энтеральное применение малоадсорбируемых антибиотиков – гентамицина и ристомицина [16], а в другом опыте гентамицина и нистатина [17] с первых по 21 сут после облучения мышей γ‑квантами в летальных дозах увеличивало их выживаемость на 20–50 % по сравнению с нелечеными облученными животными. Позитивный эффект, выражающийся в увеличении продолжительности жизни, при кишечной форме ОЛБ с
5,9 ± 0,2 до 6,9 ± 0,4 сут обеспечивало применение этих антибиотиков [17] . Однако в том случае, когда у животных до облучения обнаруживали наличие протея и повышенное содержание энтерококков, лечение их антибиотиками, напротив, увеличивало смертность мышей после облучения на 20 %, сокращало продолжительность жизни при кишечной форме ОЛБ с 5,3 ± 0,3
до 4,5 ± 0,3 сут. В специальном фармакологическом эксперименте на интактных мышах было изучено влияние семидневного приема антибиотиков: гентамицина в средней суточной дозе 4 мг на животное и нистатина в дозе 20 тыс. ед. на состояние кроветворения у животных [18]. результаты представлены на табл. 2.
Гематологические показатели мышей (СВАхС57ВL)F1, получавших гентамицин и нистатин с питьевой водой в течение 7 суток (М ± m)
Примечание: * – статистически значимая разница между группами, критерий Стьюдента, р < 0,05
Показатели:
Пробиотики
Гуморальные факторы системы иммунитета
Стимуляторы иммунитета и кроветворения
Вакцины, природные и синтетические высокомолекулярные соединения
Примечание: * − статистически значимая разница по сравнению с контролем облучения, критерий Стьюдента, р < 0,05
Примечание:
* – статистически значимое различие по критерию Стьюдента между группами ЛВ и ДВ, р ≤ 0,05
** – статистически значимое различие по критерию Стьюдента между группами ЛВ и ДВ, р ≤ 0,01
Видно, что число ядросодержащих клеток в костном мозге, число эндогенных колониеобразующих единиц в селезенке и число лейкоцитов в периферической крови леченых животных (ЛВ с 35 ppm) существенно выше, чем у контрольных облученных животных. Увеличение как числа костномозговых клеток (t = 3,6, p ≤ 0,01), так и эндогенных колоний в селезенке (t = 2,6, p ≤ 0,05) было статистически значимо по критерию Стьюдента.
Анализ полученных данных позволяет сделать вывод о том, что лечение ОЛБ с помощью ЛВ повышает выживаемость животных и стимулирует восстановление гемопоэза, судя по показателям костномозгового кроветворения и числу эндогенных колоний в селезенке.
Иммуностимулирующей активностью обладают агрегированные иммуноглобулины и их Fc‑фрагменты, опосредующие свои биомедицинские свойства через активацию системы комплемента. Нами в ранних работах была про‑ демонстрирована противолучевая активность иммуноглобулина G [45] и его Fc‑фрагмента [46], не связанная с антиген‑связывающими фрагментами.
Определенные надежды на создание противолучевого препарата специалисты в области радиационной фармакологии связывают с пептидом микробного происхождения – флагеллином [47], имеющим сродство к Toll‑рецепторам и, таким образом, к активации естественного иммунитета.
Многообразие иммуномодулирующих свойств цитокинов позволяет рассматривать эту группу веществ и коммерческих препаратов, способных как ослаблять, так и усиливать лучевое поражение, в качестве одних из наиболее перспективных патогенетических средств лечения лучевой болезни.
Таким образом, совершенно очевидно, что радиационные нарушения иммунитета и микробиологического статуса являются важной составной частью патогенеза лучевого поражения, а средства коррекции иммуно‑микробиологического статуса перспективны для создания на их основе противолучевых препаратов.
Лечение острых лучевых поражений. Принципы
В условиях нынешней политической обстановки в мире вероятность нанесения ядерного удара конечно же ниже, чем во времена холодной войны. Однако, учитывая изложенные выше факты о пропажах компонентов ядерного оружия, всегда необходимо быть готовым к худшему сценарию. Спектр острых и отсроченных поражений в результате ядерного взрыва будет включать взрывные, термические, механические и проникающие ранения, а также острые и отдаленные последствия радиоактивного облучения.
В отличие от ядерного взрыва и следующего за ним облучения в довольно значительных дозах, использование устройств для рассеивания радиоактивных материалов скорее всего не вызовет значительного радиоактивного загрязнения окружающей среды и развития у пострадавших острой лучевой болезни. При взрыве такого устройства у пациентов будут наблюдаться в основном взрывные ранения и последствия ранений первичными снарядами, содержащими радиоактивные изотопы. Лечение таких пациентов должно осуществляться согласно стандартам лечения закрытых и проникающих ранений.
При выборе между оперативным и консервативным лечением проникающих ранений следует принимать во внимание риск продолжающегося облучения тканей, связанного с наличием в организме радиоактивных изотопов. Результаты лечения пациентов с комбинированными — механическими и радиационными — поражениями хуже, чем при изолированных механических или радиационных поражениях. Термические ожоги, возникающие в результате радиоактивного облучения, имеют более серьезный прогноз, чем обычные ожоги.

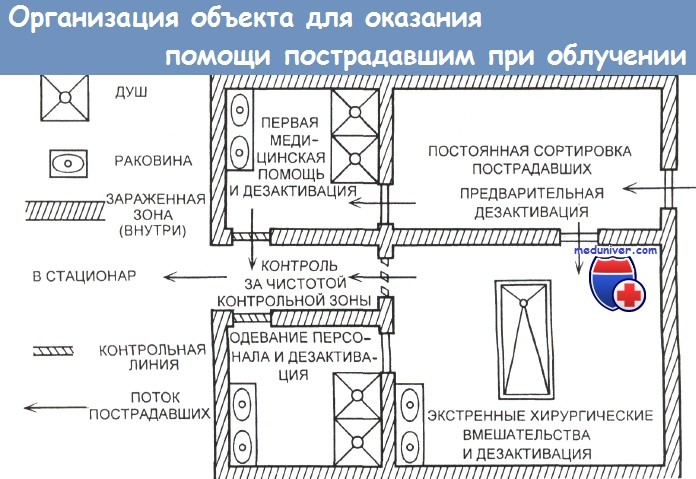
При развитии описанных выше сценариев радиоактивного загрязнения в ходе и/или после стабилизации состояния пострадавших необходимо выполнить их стандартную деконтаминацию. Объем и инвазивность деконтаминации определяются физическими свойствами источника радиации, наличием или отсутствием открытых ранений и потенциальным риском длительного наружного или внутреннего облучения.
Как правило, снятие с пострадавшего загрязненной одежды и обуви позволяет снизить степень наружного радиоактивного заражения на 90%. Использование портативных детекторов радиации позволяет оценить степень остаточного радиоактивного загрязнения. Деконтаминация должна снизить уровень радиоактивного загрязнения более чем в два раза от фонового уровня радиации окружающей среды.
После проведения деконтаминации необходимо обратить внимание на открытые ранения и ожоги. Загрязнение ожоговых и обычных ран радиоактивными материалами несет в себе гораздо более высокий риск неудовлетворительного результата лечения и даже летального исхода таких повреждений, тогда необходима адекватная обработка этих ранений. Закрытие таких ран или оставление их открытыми является спорным вопросом, решение которого должно приниматься путем тщательного взвешивания рисков замедленного заживления ран и развития инфекции в условиях закрытой раны у пациента со скомпрометированным иммунологическим статусом.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
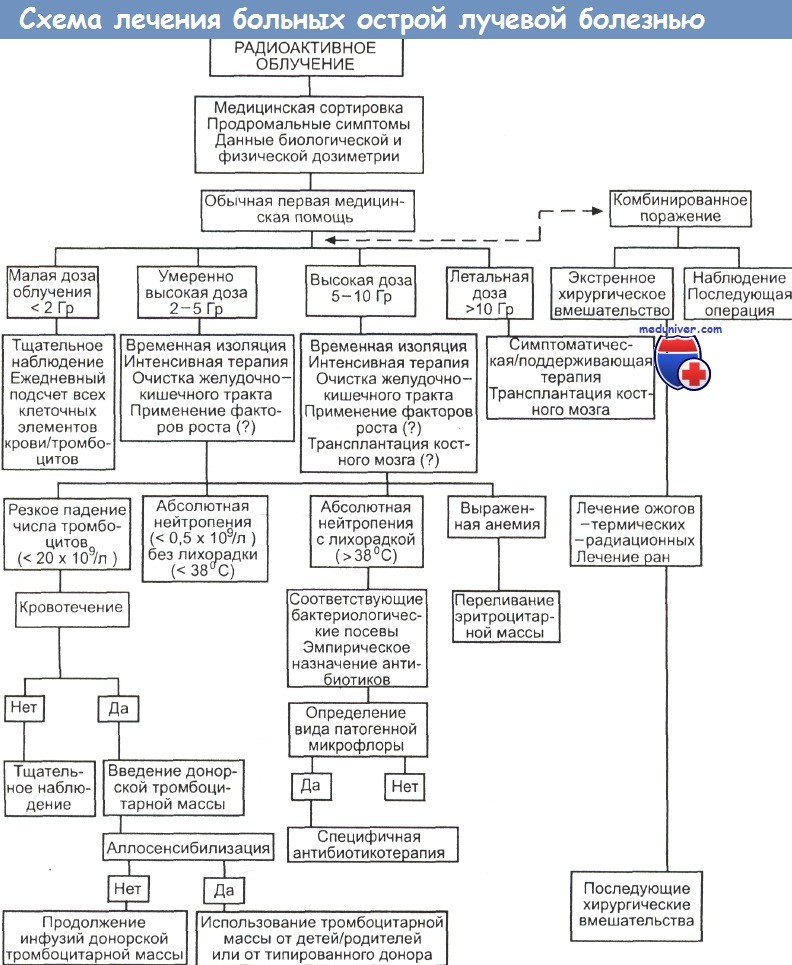
Принципы и схема лечения больных острой лучевой болезнью
а) Распределение пораженных по трем группам. На первом этапе основное внимание следует уделять не конкретному диагнозу радиационного поражения, а распределению пораженных на три категории: вряд ли подвергшихся облучению вообще; вероятно, получивших определенную дозу облучения и тяжело пораженных.
б) Лица, вряд ли подвергшиеся облучению. Отсутствие каких бы то ни было симптомов лучевой болезни. Возвращение к обычным обязанностям, если нет других травм и заболеваний.
в) Лица, вероятно, получившие дозу облучения. Отмечаются анорексия, тошнота и рвота. Число лимфоцитов в периферической крови является индикатором, позволяющим оценить состояние пациента. Никакой терапии по поводу лучевой болезни в первые дни не требуется. Ведение таких больных в первую очередь подразумевает лечение травм.
Следить нужно за функцией желудочно-кишечного тракта и за проявлениями гематологического синдрома.
г) Лица, тяжело пораженные. Очень раннее появление тошноты, рвоты, анорексии, профузного поноса, гипотензии и неврологических расстройств. Доза потенциально смертельная. Подтверждение можно получить, если произвести подсчет числа лимфоцитов. Назначается симптоматическая терапия при наличии условий для ее проведения.
- 50 Гр (5000 рад) — смертельный исход наступает неизбежно в течение 24—48 ч.
- От 30 до 50 Гр (3000—5000 рад) — с первых минут до нескольких часов: тяжелый продромальный период с неукротимой рвотой, диареей, лихорадкой, дегидратацией, комой. Смерть наступает через несколько дней. Больные погибают до того, как в периферической крови появятся признаки угнетения функции костного мозга. Показаны кровезаменители, анальгетики, симптоматическая терапия.
- От 5 до 20 Гр (500—2000 рад) — выживание возможно. Рано появляются признаки поражения ЦНС и сердечно-сосудистой системы. Течение пролонгировано. Продрома длится от 1 до 2 дней. Латентный период равен 1—2 нед. Острая лучевая болезнь (гематологический и желудочно-кишечный синдромы). Самая активная терапия, направленная на сохранение жизни пострадавшего: показаны кровезаменители, электролиты, антибиотики, переливание тромбомассы и эритромассы, трансплантация совместимого аллогенного костного мозга полное типирование тканей и перекрестное сопоставление признаков (crossmatching) до того момента, когда разовьется глубокая лимфоцитопения.
- От 2 до 5 Гр (200-500 рад). Летальная доза, если не проводится никакого лечения. При оптимальной терапии многие выживают. Объективные признаки и симптомы такие же, как в перечисленных выше группах, но они отмечаются в более отдаленные сроки и не столь резко выражены. Фаза угнетения костного мозга составляет 3—4 нед. Если больной выздоравливает, то этот процесс начинается на 6-й неделе и занимает от 2 до 3 нед.
Самая активная терапия, направленная на сохранение жизни: лечение бактериальных инфекций, борьба с синдромом кровоточивости, электролитными нарушениями, восполнение кровопотери. Пересадка костного мозга не рекомендуется, поскольку пострадавший в состоянии выжить без нее. Донорский костный мозг не может прижиться без индукции еще большей иммуносупрессии.
- От 1 до 2 Гр (100-200 рад). Пострадавший выживает. Требуется лишь небольшое лечебное вмешательство или необходимости в нем может совсем не возникнуть. У 15 % пациентов возможно появление объективных признаков и симптомов при уровне дозы, равном 1 Гр (100 рад) [Thomas]. Минимально выраженные или отсутствующие рвота и диарея, легкие симптомы на поздних стадиях. Небольшие изменения в формуле крови при наблюдении в динамике.
Генетические последствия и патология внутренних органов наблюдаются только при облучении в относительно больших дозах [обычно >1 Гр (> 100 рад)]. Никаких данных о развитии биологических эффектов у человека при воздействии низких уровней радиации нет.
- Низкие дозы облучения. Однократное воздействие радиации в дозе 0,1 Гр (10 рад) или немного большей за много дней рассматривается как слабое облучение. В Соединенных Штатах на уровне моря фоновое излучение колеблется от 0,7 до 1,5 мГр (от 70 до 150 мрад в год). Катание на лыжах или подъем в горы на большие высоты увеличивает интенсивность воздействия радиации в 2 или 3 раза. Еще более высокие уровни действуют при воздушных перелетах.
Оказывается, что даже разрешенный в настоящее время уровень облучения, равный 5 рем за год, при воздействии на все тело для работающих на атомных электростанциях фактически нельзя считать "безопасным".
Когда речь идет о воздействии слабого излучения, актуальная патология редка и, как в случае с раком, начало болезни отдалено по времени более чем на тридцатилетний период, выявление всех значимых причинно-следственных связей сильно затруднено. На сегодняшний день невозможно точно определить взаимосвязь между ионизирующим облучением малой мощности и развитием злокачественных опухолей, и вряд ли данную проблему удастся разрешить в ближайшем будущем.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Читайте также:

