В12 дефицитная анемия при гельминтозе
Обновлено: 19.04.2024
Мегалобластические анемии из-за недостатка витамина В12 при заболеваниях и инфекциях кишечника
Недостаток витамина В12 при заболеваниях кишечника, отсутствия кишечной бактериальной флоры и заражении глистами:
а) Нарушение поглощения витамина В12 при кишечных заболеваниях представляет меньшее клиническое значение, чем фолиевой кислоты, с которой иногда сочетается (как при спру, глютеновой энтеропатии).
Особо отрицательное влияние на поглощение оказывают иссечение подвздошной кишки, болезнь Крона и прочие заболевания, связанные с подвздошной кишкой. В 1968 г. Immerslund описал генетически определяемое отборное неполноценное поглощение витамина В12, сопровождающееся появлением белка в моче (в отдельных случаях и другими аномалиями), при этом выделение ВФ и солянной кислоты, гистология слизистых оболочек желудка и кишечника — укладываются в норму.
Существует и ряд других факторов, угнетающих поглощение витамина В12, в том числе отдельные медикаменты (ПАСК, кольхицин и др.), алкоголизм, облучение, фолиевый дефицит и пр.
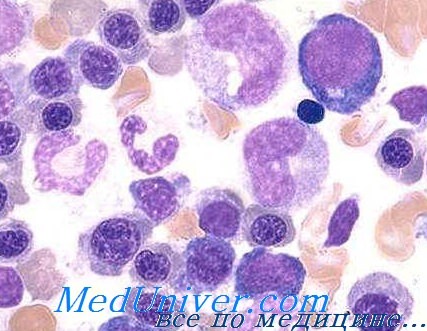
б) При бактериальном обсеменении, сопровождающем сужение, фистулу кишок, наложение соустья с выключением петель, дивертикулы и пр. иногда развивается мегалобластическая анемия с заниженным содержанием витамина В12 в крови, на что оказывают положительное влияние лечение тетрациклином (перорально) или хирургическое вмешательство.
Дефицит относится за счет повышенного расхода витамина отдельными видами бактерий (Donaldson), возможно угнетения его использования в связи с резорбцией кишечником некоторых токсических веществ (индол и пр.) (Drexler).
в) При заражении глистами, что отмечается чаще среди населения побережия Балтийского моря, питающегося рыбой, мегалобластическая анемия развивается примерно у 1—2% зараженных, в зависимости от численности паразита и его локализации (возможно и некоторой врожденной предрасположенности, как при бирмеровской болезни); при этом основным патогенетическим механизмом является потребление паразитом поступающего с пищей витамина В12.
Невропатия наблюдается редко, ахилия — не постоянное явление, показатель витамина В12 в крови занижена даже у носителей, не страдающих анемией, в то время как реакция Шиллинга показывает ложноположительный результат по причине захвата паразитами поступившей в организм радиоактивной дозы.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Что такое дифиллоботриоз? Причины возникновения, диагностику и методы лечения разберем в статье доктора Александрова Павла Андреевича, инфекциониста со стажем в 14 лет.
Над статьей доктора Александрова Павла Андреевича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
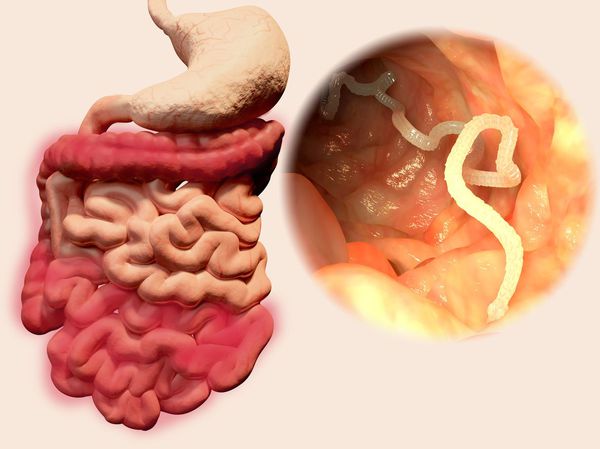
Дифиллоботриоз — это инвазионное заболевание человека, вызываемое паразитированием кишечных ленточных гельминтов рода Diphyllobothrium (преимущественно Diphyllobothrium latum). Клинически характеризуется синдромом поражения желудочно-кишечного тракта, токсико-аллергическими реакциями и в тяжёлых случаях развитием B12-дефицитной (мегалобластной) анемии.
Этиология
Тип — Plathelmintes (плоские черви)
Класс — Cestoidea (цестоды)
Отряд — Pseudophyllidea (лентецы)
Семейство — Diphyllobothriidae (дифиллоботрииды)
Род — Diphyllobothrium (лентец)
Виды — Diphyllobothrium latum (широкий лентец), Diphyllobothrium minus (малый лентец), Diphyllobothrium strictum (узкий лентец), Diphyllobothrium Tungussicum (Тунгусский лентец), D. klebanovskii, D. Dendriticum и другие.
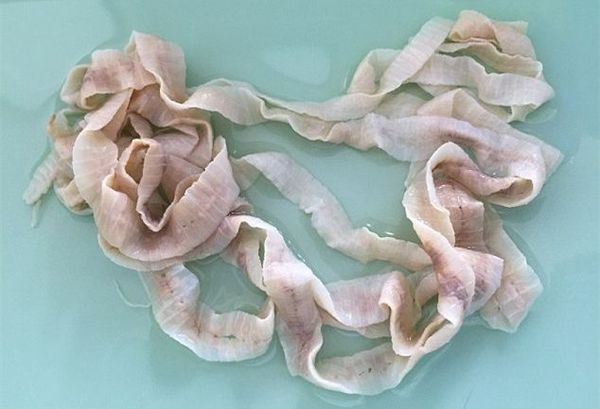
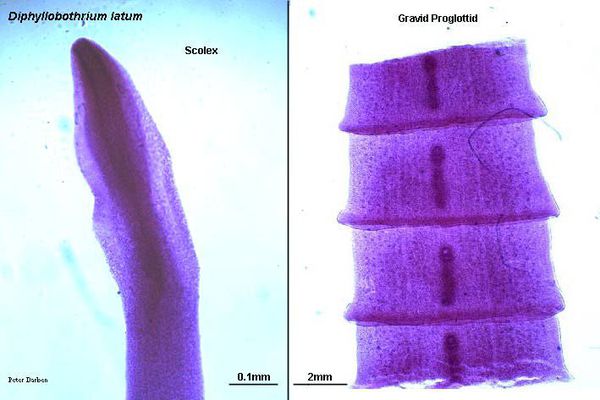
Наиболее распространённый и известный паразитический вид лентецов у человека — широкий лентец, известный науке с XVII века. Является самым длинным из цестод — его длина в отдельных случаях может достигать 25 метров. Пищеварительная, дыхательная и кровеносная системы отсутствуют. Головка (сколекс) паразита вытянута в длину, сплющена с боков, её размер составляет 3-5 мм. Она имеет специальные боковые присасывательные щели (ботрии), при помощи которых червь прикрепляется к слизистой оболочке тонкого кишечника.
От головки отходит тело паразита (стробилла), имеющее длину до 20-25 метров. Оно состоит из большого числа (до 4000) члеников (проглоттид), покрытых особым эпителием, с выростами (микротрихиями), осуществляющими функцию питания. Также на эпителии имеются специальные отверстия, выделяющие ферменты, которые защищают червя от агрессии среды хозяина. Мышечная система представлена двумя слоями (кольцевым и продольным). Ширина члеников в средней части червя значительно превышает их длину (поэтому паразит и носит название "Широкий лентец").
Тело лентеца подразделяется на молодые и зрелые проглоттиды. В начальной части тела половые органы отсутствуют. Лентец является гермафродитом: в зрелых члениках находиться половой аппарат в виде розетковидной матки (видна как тёмное пятно в середине членика) с содержащимися в ней яйцах паразита, а на боковых поверхностях члеников находятся семенники. Сформированные яйца имеют вид широкого двухконтурного овала желтоватого цвета с крышечкой на одном конце и бугорком на другом. Их размер достаточно крупный — 70 х 45 мкм. За сутки один паразит может выделять до двух миллионов незрелых яиц, которые частично содержатся в отрывающихся зрелых члениках и при распаде члеников в каловых массах). Эти яйца в дальнейшем попадают в пресноводный водоём, где и происходит их последующее развитие.
Жизнеспособность яиц при благоприятных условиях сохраняется до шести месяцев, в выгребных ямах жизнеспособны до семи недель. Понижение температуры воды увеличивает время развития зародыша, но повышает выживаемость яиц. Есть сведения о возможности развития яиц в слабосолёной морской воде (устьях рек). Они малоустойчивы к действию прямых солнечных лучей и действию дезинфицирующих средств.
Через 6-16 дней при благоприятных условиях (температура воды не ниже +15 ° С) из яиц в воде выходят свободно плавающие зародышевые личинки округлой формы (корацидии), покрытые ресничками. Они заглатывается мелкими пресноводными рачками (циклопами и диаптомусами) — первыми промежуточными хозяевами. В кишечнике рачка корацидий избавляется от оболочки и ресничек и образует онкосферу, которая через 2-3 недели после проникновения в тело превращается в тканевую первичную форму — процеркоид (размер до 60 мкм).
В дальнейшем рачки становятся пищей для пресноводных рыб, поедающих планктон. Они являются вторым промежуточным хозяином, в теле которых (в мышцах и икре) процеркоиды проходят стадию развития и через 3-4 недели превращаются в плероцеркоиды — несегментированные личинки белого цвета длиной до 2-3 см, имеющие головку (сколекс). Так как они обладают инвазионной способностью, рыба с личинками становится источником опасности для людей.
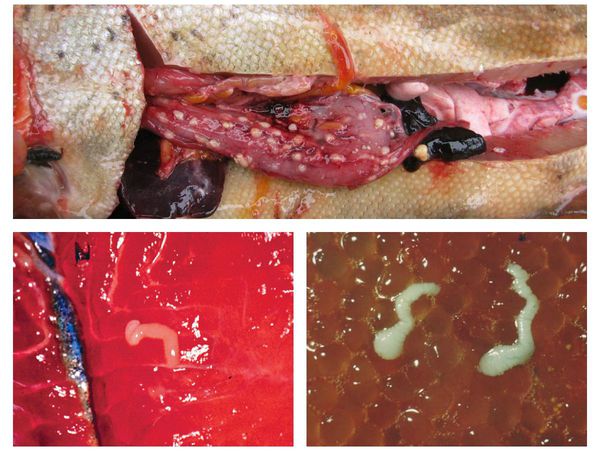
Часто первичная мирная рыба становиться источником пищи для хищных рыб (третий промежуточный хозяин и т.д.), в организме которых происходит накопление плероцеркоидов (пассивное переселение паразитов). Поэтому такие хищники, как окунь, налим, некоторые лососевые и щука, являются источником повышенной опасности для человека при нарушении технологии приготовления блюд. [1] [reference:] [5] [8]
Эпидемиология
Промежуточный хозяин — пресноводные рачки. Дополнительный хозяин — пресноводные рыбы (в том числе планктонные рыбы и далее поедающие их хищные рыбы). Окончательный хозяин — человек, медведь, свинья, собака и другие млекопитающие (всеядные или хищные), в кишечнике которых может паразитировать от одного (чаще всего) до нескольких десятков червей.
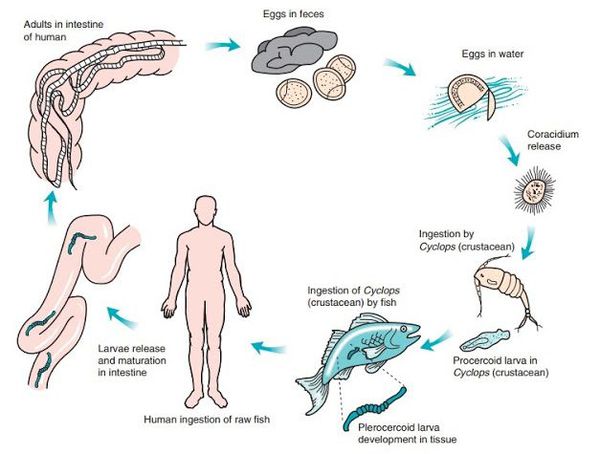
Механизм передачи — фекально-оральный (алиментарный путь). В качестве источника заражения выступает недостаточно обработанная и непросоленная пресноводная рыба и икра (чаще щучья), поражённая личинками паразита. Человек источником заражения для других людей не является и эпидемиологической опасности не представляет.
В основном болеют рыбаки, туристы и их семьи, любители свежей пресноводной рыбы.
Сезонности не отмечается, так как "дикую" рыбу люди употребляют постоянно. Восприимчивость всеобщая, иммунитет после перенесённого заболевания не формируется. Срок жизни паразита у человека — до 25 лет. [1] [2] [3] [5]
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы дифиллоботриоза
От момента заражения инкубационный период может составляет в среднем около 40-60 дней. Выраженность проявлений заболевания зависит от количества находящихся в организме гельминтов, времени их паразитирования и свойств конкретного человека. Часто больной не испытывает вообще никаких явных изменений состояния (латентное течение), однако при тщательном расспросе можно выявить некоторые необычные для него явления.
Чаще всего обращает на себя внимание постепенное снижение работоспособности, повышенная утомляемость, слабость, нарушения сна, периодические головокружения и головные боли. Нередки периодические кожные высыпания различного характера при отсутствии явной причины (иногда по типу крапивницы), ухудшение течения имеющихся хронических заболеваний, отсутствие адекватного эффекта на проводимую по их поводу терапию. Возможен периодический беспричинный субфебрилитет (повышение температуры тела до 37,5°С).
У половины больных выявляются те или иные симптомы поражения желудочно-кишечного тракта, проявляющиеся в виде периодического дискомфорта в животе различной локализации, тошнота, метеоризм, вздутие, неустойчивый стул (от запоров до умеренной диареи). Иногда наблюдается повышение аппетита (возможна и обратная реакция — снижение аппетита), слюнотечение, металлический привкус во рту и извращение вкуса.
При запущенных случаях и развитии выраженной анемии отмечается:
- нарастающая бледность кожных покровов;
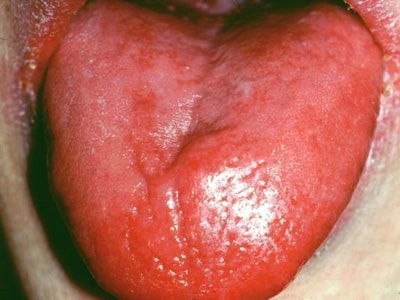
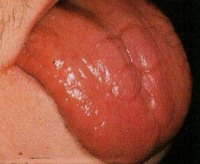
- развитие глоссита Гунтера (рельефный язык с ярко красными пятнами, впоследствии приобретающий оттенок малинового цвета с "лакированной" поверхностью);
- нарушения работы сердца;
- выраженные головокружения;
- повышенная раздражительность;
- выраженная слабость и неспособность заниматься какой-либо деятельностью.
В тяжёлых ситуациях происходит увеличение печени и селезёнки, появляются отёки (преимущественно нижних конечностей), одутловатое лицо бело-матового цвета, расстройства чувствительности. Со стороны сердечно-сосудистой системы отмечается снижение артериального давления, тахикардия и расширение границ сердца.
У беременных заболевание протекает несколько тяжелее, часто развивается выраженная анемия, повышен риск развития токсикоза. Отрицательное влияние на плод максимально в первом триместре беременности и выражается в развитии гипоксии и гипотрофии (кислородном голодании и нарушении питания), задержке общего развития и нарушениях развития нервной системы. [1] [5] [6] [7] [8]
Патогенез дифиллоботриоза
После употребления заражённой рыбы в результате переваривания освобождается личинка лентеца — плероцеркоид, которая в тонком кишечнике человека прикрепляется к слизистой оболочке посредством присосок — ботрий. Там происходит её рост и развитие: личинка всей поверхностью своего тела активно поглощает находящиеся в просвете кишечника питательные вещества, витамины и микроэлементы.
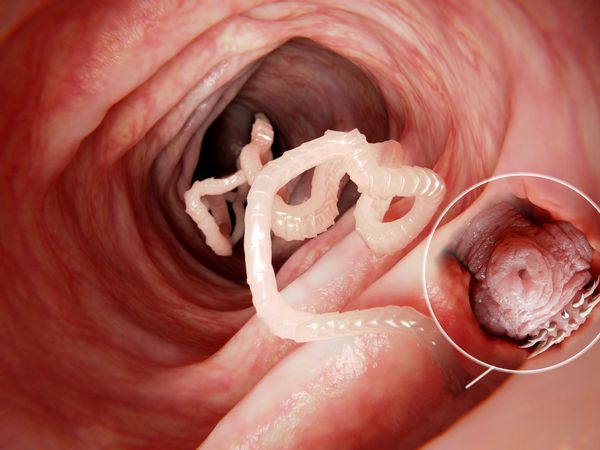
Примерно через месяц от момента заражения червь достигает половой зрелости и начинает отделять яйца, периодически отбрасывая часть зрелых, наполненных яйцами члеников.
В процессе роста и развития паразита на организм человека оказывается ряд патологических влияний:
- в результате присасывания к слизистой оболочке происходит местное нарушение её целостности, строения и функционирования — нарушается кровообращение, питание тканей, изменение нервной проводимости и нарушение пищеварения;
- поглощение лентецом большого количества питательных веществ, витаминов и железа вызывает алиментарное истощение различной степени выраженности, развитие специфической В12-дефицитной (иногда фолиевой) анемии, другие гиповитаминозы, обострение и длительное течение имеющихся хронических заболеваний;
- жизнедеятельность крупного червя в кишечнике человека неизбежно сопровождается выделением значительного количества продуктов переработки, которые, всасываясь из кишечника, попадают в кровь и разносятся по всему организму, вызывая токсико-аллергическую перестройку организма и угнетение иммунного ответа. [1][5][6][8]
Классификация и стадии развития дифиллоботриоза
По вариантам течения выделяют две формы дифиллоботриоза:
- латентную (скрытую);
- манифестную (с клиническими проявлениями).
По наличию или отсутствию осложнений заболевание бывает:
- неосложнённым;
- осложнённым (мегалобластная анемия, непроходимость кишечника и другое).
Существует три степени тяжести:
- лёгкая (отсутствие клинической симптоматики или слабовыраженные проявления, явные лабораторные изменения, часто заболевание выявляется как случайная находка при обследовании или выходе паразита);
- среднетяжёлая (появление клинической симптоматики умеренной выраженности, может наблюдаться слабо выраженная анемия, серьёзные осложнения отсутствуют);
- тяжёлая (наличие значимо выраженной клинической картины, выраженных лабораторных изменений, анемии средней или тяжёлой степени, яркой картины осложнений). [2][6]
Осложнения дифиллоботриоза
Кишечная непроходимость образуется при значительном скоплении паразитов в кишечнике. Характерны: задержка стула, повышение газообразования, нарастание интоксикации, повышение температуры тела, боли в животе различной интенсивности, тошнота, рвота. Такое состояние требует хирургического вмешательства.
В12 дефицитная анемия возникает вследствие конкурентного поглощения лентецом витамина В12 и снижения уровня гемоглобина, которое вызывает уменьшение объёма кислорода, доставляемого к тканям. Проявляется широким набором симптомов: бледность с лимонным оттенком, снижение работоспособности, тахикардия и одышка. Далее может развиться миокардиодистрофия и периферические отёки. При аускультации выслушиваются функциональные анемические шумы, на ЭКГ наблюдается снижение сегмента ST и расширение желудочкового комплекса. Появляются расстройства чувствительности, особенно в нижних конечностях, чувство "ползания мушек" по коже, иногда происходят расстройства психики. В отдельных случаях наблюдается поражение кортикоспинальных путей (фуникулярный миелоз), что ведёт к двигательным нарушениям — от лёгкой слабости до нижней спастической параплегии (пошатывания при ходьбе). Возможны нарушения остроты зрения. Падает синтез нейротрансмиттеров, что вызывает снижение когнитивной функции, деменцию, преходящую депрессию. Увеличивается печень и селезёнка, развивается глоссит Гюнтера, чувство жжения языка, атрофия слизистой верхнего отдела кишечника и желудка, появляется извращение вкусовых ощущений, тяжесть в эпигастрии, возможно возникновение шума в ушах. [1] [6] [8]
Диагностика дифиллоботриоза
Лабораторная диагностика:
- клинический анализ крови — на начальном этапе может отмечаться умеренно выраженная эозинофилия и относительный лимфоцитоз, общие лейкоциты обычно не изменены; при запущенных и тяжёлых случаях развивается анемия — снижение уровня гемоглобина и эритроцитов при сохранении высокого цветового показателя; в небольшом количестве обнаруживаются мегалобластные клетки, в эритроцитах — тельца Жоли (обломки ядер нормобластов), умеренная тромбоцитопения и повышение СОЭ;
- биохимический анализ крови — при тяжёлых формах происходит снижение уровня фолиевой кислоты и витамина В12, повышение уровня общего билирубина за счёт непрямой фракции и гипопротеинемия (крайне низкий уровень белка в крови);
- копроовоскопия — выявляются многочисленные яйца широкого лентеца в нативном мазке кала;
- прямая визуализация тела червя при отрыве его части и выходе из прямой кишки при дефекации;
- ПЦР кала (метод неотработан и широкого практического применения не имеет).
Критерии диагностики:
- характерный эпидемиологический анамнез (пребывание на территории с очагом дифиллоботриоза, употребление недостаточно обработанной свежей пресноводной рыбы);
- неспецифическая клиническая картина (диспепсические расстройства, сочетающиеся с периодическими аллергическими проявлениями);
- признаки В12-дефицитной анемии (клинические и лабораторные);
- обнаружение яиц паразита в кале или обрывков стробиллы.
Дифференциальная диагностика:
- другие паразитарные заболевания кишечной и внекишечной групп (прямая лабораторная диагностика паразитов);
- анемия Адиссона-Бирмера (отсутствие аллергических проявлений, эозинофилии, боли в области грудины, в основном зрелый возраст больных, отсутствие эпидемиологического анамнеза);
- гемолитическая анемия (отсутствие эозинофилии и характерного эпидемиологического анамнеза, гемоглобинурия, повышение ГГТ);
- другие виды анемии (характерная лабораторная диагностика);
- патология желудочно-кишечного тракта терапевтического характера (данные лабораторного и инструментального обследования, отсутствие выявления яиц паразита в кале). [1][6][7][8][9]
Лечение дифиллоботриоза
Лечение проводится, как правило, в амбулаторных условиях и обычно не требует специальной подготовки. Стационарное лечение и особая подготовка применяются лишь при запущенных, осложнённых заболеваниях и состояниях, отягощённых выраженной сопутствующей патологией.
В специальной диете нет необходимости, лишь иногда при затруднении опорожнения кишечника (запорах) показано применение слабительных средств с целью удаления погибшего червя.
Медикаментозное лечение проводится разрешёнными к применению противопаразитарными препаратами, затрагивающими жизнедеятельность паразитических червей данного ряда. Обычно длительность применения составляет не более одного дня.
После проведения лечения желательно удостовериться в выходе всего червя при дефекации (в том числе сколекса), хотя при медленной перистальтике кишечника возможно растворение погибшего паразита пищеварительными соками хозяина.
В некоторых случаях показано назначение диеты с повышенным содержанием железа, применение препаратов железа, нормализация микрофлоры кишечника посредством лекарств пробиотического ряда.
За переболевшими устанавливается наблюдение в течении 3-6 месяцев с обязательным неоднократным контролем анализов кала на я/глист в паразитологической лаборатории, выполненными с интервалом в одни месяц. [1] [8] [10]
Прогноз. Профилактика
Прогноз заболевания благоприятный при условии его своевременного выявления (до появления осложнений) и эффективного лечения. Наступает полное излечение.
В целях успешной профилактики заражения следует использовать комплекс мероприятий, направленных на разрыв пути развития и распространения паразита:
Гиповитаминоз B12 – это заболевание, обусловленное недостаточным содержанием в организме витамина B12. Проявляется анемией, воспалением и жжением языка, образованием покраснений на коже, повышенной утомляемостью, бессонницей, снижением аппетита, болями в животе, расстройством желудка, похуданием, онемением пальцев и мышечными болями. При длительном течении болезни возможно развитие энцефалопатии, паралича и остеопороза. Диагностика основывается на данных клинического опроса и результатах исследования витамина в венозной крови. Для лечения используется заместительная терапия витаминными препаратами, коррекция рациона.
МКБ-10
Общие сведения
Витамины B12 – кобальтосодержащие биологически активные вещества, кобаламины. Данная группа соединений представлена цианокобаламином, гидроксокобаламином, метилкобаламином и кобамамидом. Значительная часть витамина попадает в организм в виде цианокобаламина, поэтому можно встретить использование названия этого вещества как синонима витамина B12. Синонимичные названия гиповитаминоза B12 – витаминная недостаточность B12, недостаточность внешнего фактора Касла. Заболевание наиболее распространено среди пациентов пожилого и старческого возраста. Согласно эпидемиологическим данным, гиповитаминозом B12 страдает не менее 15% людей старше 60 лет.

Причины
В норме витамин B12 направляется в желудок, а затем в кишечник с пищей. Он образует комплекс со специальным ферментом – внутренним фактором Касла, благодаря чему становится усваиваемым и всасывается клетками эпителия в подвздошной кишке. В слизистой оболочке кишечника соединение связывается с транспортным белком транскобаламином. Основное место хранения витамина – печень. Большое количество потребляется мышцами, селезенкой и почками. Витамин выводится желчным пузырем, в кишечнике повторно абсорбируется. Гиповитаминоз B12 развивается при нарушении одного или нескольких звеньев метаболизма соединения. Причинами заболевания являются:
- Дефицит в рационе. Основными поставщиками витамина считаются продукты животного происхождения, поэтому гиповитаминоз чаще диагностируется у вегетарианцев и людей, длительно соблюдающих строгие диеты. Цианокобаламин депонируется печенью и селезенкой, его запасы достаточно велики, для развития дефицита требуется от 3 до 5 лет.
- Невозможность абсорбции. Гиповитаминозу способствуют заболевания тонкой кишки, нарушающие всасывание витамина – целиакия, болезнь Крона, ахлоргидрия, а также сокращение реабсорбирующей поверхности кишки после резекции. Частой причиной гиповитаминоза является врожденная недостаточность внутреннего фактора или транскобаламина.
- Быстрое выведение или распад. Патологии почек и печени, алкоголизм препятствуют накоплению витамина, усиливают его выведение. Потеря витамина происходит при глистных инвазиях, например, при заражении широким лентецом.
- Усиление потребления организмом. Риск гиповитаминоза повышается в третьем триместре беременности и в период выздоровления после острых заболеваний. Метаболизм витамина усиливается при гипертиреозе, тиреотоксикозе, альфа-талассемии и гемолитической анемии.
Патогенез
Кобаламины выступают коферментами реакции трансметилирования – переноса метильной группы CH3. В результате многоэтапного процесса образуется тетрагидрофолиевая кислота, необходимая для метаболизма белков и нуклеиновых кислот. При ее дефиците ослабляется синтез пуринов, тимидина, ДНК, РНК и белков в клетках. Таким образом, недостаточность витамина B12 способствует сокращению производства наиболее часто обновляемых клеток – клеток крови и эпителия.
Патологически изменяется процесс кроветворения: в костном мозге образуются крупные, но незрелые эритроциты, неспособные переносить кислород к тканям. Развивается мегалобластная анемия. Снижение скорости обновления эпителиальных клеток проявляется поражениями пищеварительного тракта: атрофируется слизистая оболочка желудка, сокращается выделение пепсина и соляной кислоты, язык становится ярко-красным, гиперчувствительным к химическим раздражителям. Витамин B12 участвует в образовании миелина, гиповитаминоз сопровождается неврологическими расстройствами. У больных развиваются дистальные парестезии, боли, нарушения походки и чувствительности, усиливаются сухожильные рефлексы.
Симптомы гиповитаминоза В12
Дефицит витамина B12 имеет полиморфную симптоматику, проявляется нарушениями сразу в нескольких системах организма. Ключевым признаком заболевания является B12-дефицитная анемия, при которой пациенты испытывают общую слабость, головные боли, одышку, тошноту, рвоту и диарею. Нередко возникают отеки, покраснения и болевые ощущения на языке (глоссит), очаговые поражения кожи, особенно в дистальных отделах конечностей. Слабое кровоснабжение головного и спинного мозга у детей провоцирует задержку физического и психического развития: наблюдается отставание в росте, медленное формирование двигательных навыков, мышечная слабость и трудности в обучении.
Расстройства нервной системы представлены хронической усталостью, частыми головными болями, головокружениями, снижением интеллектуально-мнестических функций и внимания, депрессией и раздражительностью. Неврологические синдромы включают боли, чувство покалывания и онемения конечностей, нарушения разных видов чувствительности. Со стороны желудочно-кишечного тракта наблюдаются запоры, увеличение размеров печени, воспаление слизистой оболочки двенадцатиперстной кишки и желудка, образование язв в этих отделах. Сердечно-сосудистые симптомы встречаются реже: снижается артериальное давление, повышается риск атеросклероза.
Осложнения
При отсутствии лечения длительный гиповитаминоз B12 приводит к тяжелым заболеваниям ЦНС. Усиление дегенеративных процессов провоцирует развитие паралича нижних конечностей, ослабляет нормальные рефлекторные реакции и обуславливает патологические рефлексы. Постепенно формируется энцефалопатия с ослаблением когнитивных функций вплоть до деменции и амнезии. У пожилых больных возникают галлюцинаторно-бредовые расстройства. Недостаток витамина негативно сказывается на состоянии опорно-двигательного аппарата: истончается костная ткань, наблюдается остеопороз.
Диагностика
Обследование назначается при подозрении на мегалобластную анемию, недоедание, пациентам с синдромом мальабсорбции, целиакией, болезнью Крона и алкоголизмом, пожилым людям с симптомами депрессии, паранойи и спутанности сознания. В зависимости от имеющейся симптоматики диагностика проводится врачом-гематологом, неврологом или гастроэнтерологом. Включает дифференциацию B12-дефицитной анемии с другими видами анемий, позволяет определить причину неврологических нарушений и психических расстройств в пожилом возрасте. Для подтверждения диагноза гиповитаминоза используются следующие процедуры:
- Клинический опрос. В беседе пациенты предъявляют жалобы, характерные для анемического и неврологического синдрома: слабость, головокружения, одышка в сочетании с ощущением онемения и покалывания в ногах, снижением чувствительности в конечностях. В анамнезе может отмечаться приверженность вегетарианству и строгим диетам, недоедание, хронические заболевания кишечника и синдром мальабсорбции.
- Общий анализ крови. В результатах анализа определяется сниженный уровень эритроцитов и гемоглобина, гиперхромия, макроцитоз, пойкилоцитоз, лейкопения, тромбоцитопения, лимфоцитоз, сниженное или нормальное количество ретикулоцитов. Микроскопия эритроцитов выявляет наличие телец Жолли и колец Кебота.
- Анализ на витаминB12. Исследуется концентрация витамина в сыворотке крови из вены. При гиповитаминозе итоговый показатель менее 191 пг/мл. Понижение концентрации витамина B12 подтверждает его недостаточность, но не коррелирует с тяжестью анемии или нейропатии.
- Исследование костномозгового пунктата. В отдельных случаях требуется проведение пункции красного костного мозга. О макроцитарнаой анемии свидетельствует наличие мегалобластов в образце биоматериала.
Лечение гиповитаминоза В12
При выраженном гиповитаминозе терапия проводится в стационаре гематологического или терапевтического отделения. Медикаментозное лечение основано на внутримышечном или внутривенном введении препаратов цианокобаламина. В тяжелых случаях необходимы интралюмбальные инъекции. При легких формах, вызванных исключительно пищевым дефицитом витамина, показан пероральный прием лекарств без госпитализации. Вместе с цианокобаламином назначаются препараты фолиевой кислоты. Курс лечения продолжается 1-2,5 месяца. Дополнительно используется диетотерапия, в ежедневный рацион больных вводятся продукты богатые витамином B12 – печень, мясо, рыба, яйца, сыр.
Прогноз и профилактика
Заместительная терапия цианокобаламином позволяет за 2 недели устранить неврологическую симптоматику гиповитаминоза, за 8 недель – сократить дефицит витамина и заполнить депо организма. При своевременном начале лечения до развития осложнений прогноз благоприятный. С целью профилактики рецидивов заболевания пациентам назначается введение цианокобаламина внутримышечно 1 раз в неделю. Для предупреждения первичного развития гиповитаминоза необходимо придерживаться полноценного питания, включающего ежедневный прием мяса, субпродуктов, рыбы, яиц и сыра. Больным с нарушением абсорбции питательных веществ в желудочно-кишечном тракте требуется соответствующее лечение и регулярный мониторинг уровня витаминов в кровотоке.
2. Клиническая патофизиология: курс лекций / под ред. В. А. Черешнева, П. Ф. Литвицкого, В. Н. Цыгана – 2015.
У пожилых в 10 раз чаще
У пожилых распространенность этой патологии в 10-20 раз больше, и составляет уже 1-2% в возрасте до 75 лет, и около 4% - среди представителей старшей группы.
При этом этот В-12 обусловленная анемия – заболевание довольно многофакторное, а среди основных причин ее развития:
- недостаток внутреннего фактора Касла (вырабатываемого желудком и необходимого для усвоения В12 из пищи),
- дефицит В12 в питании
- выраженный дисбактериоз кишечника или гельминтозы.
1. Недостаточность внутреннего фактора Касла
Иными словами, усвоение витамина В12 сильно нарушается при атрофии (атрофический гастрит) или резекции (удаление части органа) желудка. В то время как атрофический гастрит встречается у пожилых с частотой в 70-80%.
Причины же атрофического гастрита также отличаются разнообразием. Но у пожилых, значимую роль в этом играет аутоиммунная агрессия.
Антитела к обкладочным клеткам желудка или непосредственно самому фактору Касла встречаются у 90% пациентов с атрофией слизистой желудка. Однако на сегодня не ясно – являются ли они самостоятельной причиной таких гастритов, или развиваются как на фоне уже имеющегося нарушения.
2. Наследственность
Кроме того, среди пациентов без семейной предрасположенности средний возраст дебюта В12-анемии составляет 66 лет, а с отягощенной наследственностью - 51 год.
3. Дефицит В12 в питании
Не секрет, что у пожилых людей часто появляется склонность к растительной пище. Тогда как потребление мясных и молочных продуктов, а также яиц – сильно снижается или вообще прекращается. А ведь именно эти продукты являются незаменимым источником витамина В12, что также объясняет частоту В12-анемии у вегетарианцев.
Как заподозрить дефицит В12
Еще одним, почти обязательным, признаком В12-дефицитной анемии пожилых является поражение периферических нервов, или фуникулярный миелоз.
Правда, признаки такой нейропатии выявляются только при тщательном осмотре, ведь:
- слабость в конечностях
- постоянное ощущение холода в ногах,
- онемение,
- покалывания
- и нарушение чувствительности
Обследование
Эритроциты, при этом, характеризуются неправильной формой и/или размером (макроцитоз). А появление таких отклонений обусловлено колоссальным значением витамина В12 для нормального синтеза ДНК.
Появление характерных отклонений в общем анализе крови, необходимо уточнить причину их возникновения. Поскольку не все макроцитарные анемии имеют В12-дефицитное происхождение.
3. Подтвержденный дефицит витамина В12, очевидно, нуждается в определении причин, от которых, очевидно, зависит эффективность дальнейшего лечения:
Пернициозная анемия – нарушение красного ростка кроветворения, обусловленное недостатком в организме цианокобаламина (витамина В12). При В12-дефицитной анемии развивается циркуляторно-гипоксический (бледность, тахикардия, одышка), гастроэнтерологический (глоссит, стоматит, гепатомегалия, гастроэнтероколит) и неврологический синдромы (нарушение чувствительности, полиневриты, атаксия). Подтверждение пернициозной анемии производится по результатам лабораторных исследований (клинического и биохимического анализа крови, пунктата костного мозга). Лечение пернициозной анемии включает сбалансированную диету, внутримышечное введение цианокобаламина.
МКБ-10


Общие сведения
Причины пернициозной анемии
Ежесуточная потребность человека в витамине B12 равняется 1-5 мкг. Она удовлетворяется за счет поступления витамина с пищей (мясом, кисломолочными продуктами). В желудке под действием ферментов витамин В12 отделяется от пищевого белка, однако для усвоения и всасывания в кровь он должен соединиться с гликопротеином (фактором Касла) или другими связывающими факторами. Всасывание цианокобаламина в кровоток происходит в средней и нижней части подвздошной кишки. Последующий транспорт витамина В12 к тканям и гемопоэтическим клеткам осуществляется белками плазмы крови - транскобаламинами 1, 2, 3.
Развитие В12-дефицитной анемии может быть связано с двумя группами факторов: алиментарными и эндогенными. Алиментарные причины обусловлены недостаточным поступлением витамина В12 с пищей. Это может происходить при голодании, вегетарианстве и диетах с исключением животного белка.
Под эндогенными причинами подразумевается нарушение усвоения цианокобаламина вследствие дефицита внутреннего фактора Касла при его достаточном поступлении из вне. Такой механизм развития пернициозной анемии встречается при атрофическом гастрите, состоянии после гастрэктомии, образовании антител к внутреннему фактору Касла или париетальным клеткам желудка, врожденном отсутствии фактора.
Нарушение абсорбции цианокобаламина в кишечнике может отмечаться при энтерите, хроническом панкреатите, целиакии, болезни Крона, дивертикулах тонкого кишечника, опухолях тощей кишки (карциноме, лимфоме). Повышенное расходование цианокобаламина может быть связано с гельминтозами, в частности, дифиллоботриозом. Существуют генетические формы пернициозной анемии.
Всасывание витамина В12 нарушено у пациентов, перенесших резекцию тонкой кишки с наложением желудочно-кишечного анастомоза. Пернициозная анемия может быть ассоциирована с хроническим алкоголизмом, применением некоторых лекарственных средств (колхицина, неомицина, пероральных контрацептивов и др.). Поскольку в печени содержится достаточный резерв цианкобаламина (2,0-5,0 мг), пернициозная анемия развивается, как правило, только лишь спустя 4-6 лет после нарушения поступления или усвоения витамина В12.
В условиях недостаточности витамина В12 возникает дефицит его коферментных форм – метилкобаламина (участвует в нормальном протекании процессов эритропоэза) и 5-дезоксиаденозилкобаламина (участвует в метаболических процессах, протекающих в ЦНС и периферической нервной системе). Недостаток метилкобаламина нарушает синтез незаменимых аминокислот и нуклеиновых кислот, что приводит к расстройству образования и созревания эритроцитов (мегалобластному типу кроветворения). Они принимают форму мегалобластов и мегалоцитов, которые не выполняют кислородтранспортную функцию и быстро разрушаются. В связи с этим количество эритроцитов в периферической крови существенно сокращается, что приводит к развитию анемического синдрома.
С другой стороны, при дефиците кофермента 5-дезоксиаденозилкобаламина нарушается обмен жирных кислот, в результате чего накапливаются токсичные метилмалоновая и пропионовая кислоты, оказывающие непосредственное повреждающее действие на нейроны головного и спинного мозга. Кроме этого, нарушается синтез миелина, что сопровождается дегенерацией миелинового слоя нервных волокон – этим обусловлено поражение нервной системы при пернициозной анемии.
Симптомы пернициозной анемии
Неврологические проявления пернициозной анемии обусловлены поражением нейронов и проводящих путей. Больные указывают на онемение и скованность конечностей, мышечную слабость, нарушение походки. Возможно недержание мочи и кала, возникновение стойкого парапареза нижних конечностей. Осмотр невролога выявляет нарушение чувствительности (болевой, тактильной, вибрационной), повышение сухожильных рефлексов, симптомы Ромберга и Бабинского, признаки периферической полиневропатии и фуникулярного миелоза. При В12-дефицитной анемии могут развиваться психические нарушения – бессонница, депрессия, психозы, галлюцинации, деменция.

Диагностика пернициозной анемии
Кроме гематолога, к диагностике пернициозной анемии должны быть привлечены гастроэнтеролог и невролог. Дефицит витамина В12 (менее 100 пг/мл при норме 160-950 пг/мл) устанавливается при проведении биохимического исследования крови; возможно обнаружение Ат к париетальным клеткам желудка и к внутреннему фактору Касла. Для общего анализа крови типична панцитопения (лейкопения, анемия, тромбоцитопения). При микроскопии мазка периферической крови обнаруживаются мегалоциты, тельца Жолли и Кэбота. Исследование кала (копрограмма, анализ на яйца глистов) могут выявлять стеаторею, фрагменты или яйца широкого лентеца при дифиллоботриозе.
Проба Шиллинга позволяет определить нарушение всасывания цианокобаламина (по экскреции с мочой меченного радиоактивным изотопом витамина В12, принятого внутрь). Пункция костного мозга и результаты миелограммы отражают характерное для пернициозной анемии увеличение числа мегалобластов.
Для определения причин нарушения абсорбции витамина В12 в ЖКТ проводится ФГДС, рентгенография желудка, ирригография. В диагностике сопутствующих нарушений информативны ЭКГ, УЗИ органов брюшной полости, электроэнцефалография, МРТ головного мозга и др. В12-дефицитную анемию необходимо отличать от фолиеводефицитной, гемолитической и железодефицитной анемии.
Лечение пернициозной анемии
Установление диагноза пернициозной анемии означает, что пациент будет нуждаться в пожизненном патогенетическом лечении витамином В12. Кроме этого, показано регулярное (каждые 5 лет) проведение гастроскопии для исключения развития рака желудка.
С целью восполнения дефицита цианокобаламина назначаются внутримышечные инъекции витамина В12. Требуется коррекция состояний, приведших к В12-дефицитной анемии (дегельминтизация, прием ферментных препаратов, хирургическое лечение), а при алиментарном характере заболевания - диета с повышенным содержанием животного белка. При нарушении выработки внутреннего фактора Касла назначаются глюкокортикоиды. К гемотрансфузиям прибегают только при анемии тяжелой степени или признаках анемической комы.
На фоне терапии пернициозной анемии показатели крови обычно нормализуются через 1,5-2 месяца. Дольше всего (до 6 мес.) сохраняются неврологические проявления, а при поздно начатом лечении они становятся необратимыми.

Профилактика
Первым шагом на пути предотвращения пернициозной анемии должно стать полноценное питание, обеспечивающее достаточное поступление в организм витамина В12 (употребление мяса, яиц, печени, рыбы, молочных продуктов, сои). Необходима своевременная терапия патологий ЖКТ, нарушающих усвоение витамина. После хирургических вмешательств (резекции желудка или кишечника) необходимо проведение поддерживающих курсов витаминотерапии.
Больные с В12-дефицитной анемией входят в группу риска по развитию диффузного токсического зоба и микседемы, а также рака желудка, поэтому нуждаются в наблюдении эндокринолога и гастроэнтеролога.
Читайте также:

