Ветряная оспа и нейропатия
Обновлено: 25.04.2024
Проблема диагностики и лечения лицевых болей на сегодняшний является одной из самых распространенных во всем мире. Это связано с оказанием неадекватной медицинской помощи при наличии данной патологии [1—3, 7, 11]. Одной из причин возникновения лицевых болей является нейропатия, которая представляет собой диффузный дистрофический процесс в оболочках периферических нервных волокон, морфологически проявляющийся в виде вакуольной дистрофии или баллонирующей дегенерации.
В формировании иммунитета против вируса герпеса играют роль факторы как клеточного, так и гуморального иммунитета. У лиц с ослабленным иммунитетом латентная инфекция переходит в манифестную, а манифестные формы протекают значительно тяжелее. Таким образом, заболеваемость, течение болезни и персистенция вируса в большей степени зависят от особенностей возбудителя и активности иммунной системы человека. Состояние иммунной системы обусловлено многими факторами: генетическими, экологическими, социально-экономическими, гигиеническими и др. [8—10]. Симптоматически нейропатия тройничного нерва проявляется в виде постоянной ноющей боли различной степени интенсивности, усиливающейся в ночное время. Также может иметь место нарушение чувствительности в зоне иннервации пораженного нерва в виде гипестезии или анестезии.
По данным различных авторов выделяют 2 группы нейропатий.
I. Нейропатии центрального генеза. Они подразделяются на:
- Инфекционные: герпесвирусная инфекция, цитомегаловирус, вирус ветряной оспы, вирус Эпштейн — Барр.
- Опухоли или опухолеподобные процессы головного мозга.
- Сосудистые — изменения в сосудах головного мозга.
II. Периферические нейропатии:
- Травматические — переломы челюстей, иногда проведение проводниковых анестезий.
- Токсические — острый остеомиелит челюстей, вирусная инфекция.
- Выведение пломбировочного материала за верхушку корня зуба, раздражающее действие антисептиков.
Диагностика нейропатии тройничного нерва герпесвирусной этиологии вызывает затруднения. Поэтому врач должен тщательно собрать анамнез, в ходе которого необходимо выяснить, были ли герпетические высыпания на слизистых, с чем пациент связывает появление боли (стрессовые факторы, переохлаждение, переутомление). Уточняется характер болей: постоянная, ноющая, иррадиирует в проекции ветвей тройничного нерва, усиливается в ночное время. Наиболее подвержены постгерпетической нейропатии люди пожилого возраста и с иммунодефицитом, на что также следует обращать внимание при диагностике. При визуальном осмотре можно обнаружить места рубцевания на коже. Также необходимо проверить болевую чувствительность в зонах иннервации всех ветвей тройничного нерва (гипестезия или анестезия) [22]. Одним из методов лабораторной диагностики нейропатиигерпесвирусной этиологии является иммуноферментный анализ, который определяет антигены с помощью антител, меченных ферментом. Чувствительность метода составляет 70—80 %.
На сегодняшний день существует несколько способов лечения нейропатии тройничного нерва герпесвирусной этиологии. Для общего лечения используют прегабалин, габапентин. Американская академия неврологии рекомендует также применять трициклические антидепрессанты (амитриптилин) и опиоиды [13]. В сочетании с общим лечением рекомендуется использовать местную терапию: стимуляция периферических нервных волокон в зоне поражения, аппликации 8%-ного капсаицина и лидокаина, подкожное введение ботулотоксина А [13—19]. Авторами доказано, что дополнительное использование местных процедур уменьшает выраженность болевого синдрома и повышает качество жизни пациента. Также особое внимание уделяется профилактике развития постгерпетической нейропатии. Изучается эффект применения противовирусных препаратов при острой герпетической инфекции (ацикловир, фамцикловир) и развитие в последующем постгерпетической нейропатии. Однако авторы не обнаружили существенной разницы в снижении риска развития постгерпетической нейропатии в группах применения ацикловира, фамцикловира и контрольной группе [20]. Было проведено когортное исследование для изучения эффективности противогерпетической вакцины, которое показало, что вакцинация против вируса простого герпеса ведет к снижению заболеваемости постгерпетической нейропатией [21]. Отсутствие согласованности в действиях врачей смежных специальностей приводит к затруднениям при диагностике и лечении нейропатии герпесвирусной этиологии, а также к формированию в последующем стойких рецидивов с выраженными функциональными нарушениями и болевыми приступами.
Литература
Вирус герпеса третьего типа varicella zoster (VZV) вызывает два клинически обособленных заболевания - ветряную оспу и опоясывающий герпес (Баринский И.Ф. и др., 1986; Haanpaa M., 2001). Оба заболевания, прежде всего, характеризуются везикулярной сыпью. Первичная инфекция манифестирует в форме ветряной оспы (ветрянки), а реактивация латентного VZV обусловливает появление локализованных высыпаний - опоясывающего лишая (Хахалин Н.Н., 2002). Мысль о связи между ветрянкой оспой и опоясывающим лишаем впервые была высказана в 1888 венским врачом Яношом Бокеем (von Bokay J., 1909).
Эпизод ветряной оспы в детстве способствует формированию специфической клеточной и гуморальной иммунной защиты. Считается, что рецидив инфекции у таких пациентов может развиться только на фоне недостаточности иммунной защиты, вследствие снижения активности специфических натуральных киллеров, Т-киллеров и системы интерферонов (Fleming D.M. et al., 2004). После первичной инфекции излюбленным местом персистенции VZV являются ганглий тройничного нерва и спинномозговые ганглии чувствительных корешков грудного отдела спинного мозга, где VZV находится в латентном состоянии. В течение этого времени вирус не размножается и не проявляет патогенных свойств. По-видимому, время латентного состояния вируса определяется уровнем специфических антител к VZV. Снижение их количества ведет к реактивации вируса, вирусной репликации (размножению), что на клиническом уровне и проявляется в виде опоясывающего лишая (Arvin A., 2005). Данный вывод подтверждается высокой корреляцией между вероятностью возникновения опоясывающего лишая у людей пожилого возраста и возрастным ослаблением активности клеточного звена иммунитета (Gilden et al., 2000)., На это также указывают данные, свидетельствующие о более высокой заболеваемости опоясывающим герпесом среди лиц, инфицированных вирусом иммунодефицита человека (Gilson I.H. et al., 1989), однако точные механизмы, лежащие в основе перехода вируса из латентного состояния в активное неизвестны.
В случае реактивации VZV ганглии чувствительных нервов становятся местами репликации вируса, именно в них обнаруживаются наиболее выраженные дегенеративные повреждения нейронов (Zerboni L. et al., 2005; Reichelt M. et al., 2008). В результате развивается ганглионит, сопровождаемый распространением инфекции вниз по нервным аксонам к коже. Каким образом происходит транспортировка вируса в поврежденных аксонах неизвестно. Инфекция также может распространяться центрально, приводя к воспалению оболочек в области передних и задних рогов спинного мозга (Gray F. et al. 1994). Отдельные патолого-анатомические наблюдения также свидетельствуют о наличии воспалительных изменений и в контралатеральных спинномозговых ганглиях (Miller S. E. et al., 1997), отмечается снижение количества нейронов и наличие воспалительных инфильтратов в ганглиях, периферических нервах, и спинномозговых корешках (Gowrishankar K. et al., 2007). В некоторых случаях отмечается выраженные некротические изменения в спинномозговых ганглиях. Большинство изменений в периферическом нерве протекает по типу Валлериановской дегенерации, имеющей место, как в толстых, так и в тонких волокнах. (Denny-Brown et al., 1944).
Острая VZV инфекция клинически характеризуется стадией продрома и стадией везикулярных высыпаний (Arvin A., 2005).
Сыпь обычно локализуется в одном или нескольких смежных дерматомах и сопровождается развитием острой невропатической боли. У 50% больных сыпь встречается на туловище, у 20% - на голове, у 15% - на руках, и у 15% - на ногах (Arani R.B. et al., 2001).
Клинический диагноз опоясывающего лишая в типичных случаях достаточно прост. Однако иногда требуется проведение лабораторной диагностики с целью идентификации вируса. Наиболее быстрым и высокочувствительным методом является полимеразная цепная реакция.
В остром периоде болезни или после него возможно развитие осложнений, захватывающих различные системы организма. Наиболее серьезными считаются неврологические осложнения. В структуре неврологических расстройств ведущее место занимает поражение периферической нервной системы. При данном заболевании воспалительный процесс затрагивает региональные, чувствительные ганглии с развитием ганглиолитов. Наличие у больных корешковых болей, парастезий, сегментарных нарушений чувствительности отмечается практически у каждого больного (Stankus S. et al., 2000; Thyregod H. G. et al., 2007). Болевой синдром имеет выраженную вегетативную окраску в виде жгучих, приступообразных, резких болей, усиливающихся в ночное время. В головном мозге при опоясывающем герпесе могут быть обнаружены явления отека, выраженная диффузная инфильтрация подпаутинного пространства, геморрагии в белом веществе, базальных ганглиях (Sissoko D. et al., 1998). Следует заметить, что осложнения со стороны головного и спинного мозга в настоящее время встречаются редко. В случаях развития VZV-инфекции в области тройничного нерва часто наблюдаются осложнения со стороны глаз - кератит, ирит, ретинит, офтальмит. Ранее, при отсутствии специфической противогерпетической терапии, к частым осложнениям VZV-инфекции относились пневмонии, энцефалиты или гепатиты, иногда приводившие к летальному исходу.
Вместе с тем, из всех перечисленных осложнений VZV инфекции самым распространенным считается постгерпетическая невралгия (Dworkin R.H., Portenoy R.K., 1996).
Различают острую герпетическую невралгию (в течение 30 дней после начала заболевания) и постгерпетическую невралгию (Choo P. et al.,1997). К ПГН относят упорные боли в областях, затронутых герпесной инфекцией после заживления кожи (Dworkin R. et al. 2003). Наиболее хорошо установленными факторами риска для ПГН являются пожилой возраст, большая распространенность высыпаний на коже и выраженная боль перед везикулярной сыпью (Desmond R.A. et al., 2002; Fleming D.M. et al., 2004). Все эти факторы находятся во взаимосвязи, поэтому пациенты 50 лет и старше в большинстве случаев испытывают тяжелую, нестерпимую боль и значительные кожные высыпания, что гораздо чаще приводит к развитию ПГН. У пациентов со всеми этими факторами риск развития ПГН превышает 50-75 % (Gnann J., Whitley R. 2002; Jung B.F., 2004). Постгерпетическая невралгия может развиться в любом возрасте, однако для нее характерна прямая корреляция частоты встречаемости и длительности ПГН с возрастом. Более 50% всех пациентов с ПГН - старше 60 лет, 75% больных с указанной патологией приходится на возрастную группу старше 75 лет (Nurmikko T.J., 2001). Половина всех пациентов с ПГН старше 60 лет испытывает постоянную боль более 6 месяцев, в то время как в возрастной группе 30-50 лет ПГН более 6 месяцевь наблюдается у 10% больных (Whitley R. et al. 1996). В США ежегодно регистрируется 100-200 тыс. новых случаев ПГН (Nurmikko T.J., 2001). Однако, истинная распространенность ПГН не известна, не только потому, что эпидемиологические данные недостаточны, но также из-за отсутствия конценсусса по определению ПГН. Некоторые авторы относят к ПГН боли, возникающие в любой период герпесной инфекции, другие считают, что ПГН - это боль, сохраняющаяся спустя 3 месяца после заживления кожи. В первом случае определения ПГН ее распространенность составляет 8%, во втором - 4,5% (Choo P. et al. 1997). Постоянную боль в течение 1 мес после сыпи испытывают до 15% пациентов и около 4% пациентов от общего количества перенесших опоясывающий лишай отмечают сохранение боли в течение года (Lancaster T. et al. 1995).
Классическое проспективное исследование, проведенное Hope-Simpson (1975), продемонстрировало, что из 321 пациента с опоясывающим лишаем 10 % имеют выраженную боль спустя 3 месяца после острой герпетической инфекции, а 4 % - и через 12 месяцев. Подобные результаты были получены и в других проспективных исследованиях (Helgason S. et al. 1996; 2000; Scott F.T. et al., 2006), в которых также было показано, что наибольший риск пролонгации болевого синдрома после перенесенного опоясывающего лишая имеют пациенты в возрасте около 60 лет.
Постгерпетическая невралгия занимает третье место по частоте встречаемости среди различных типов невропатической боли и уступает только болям в нижней части спины и диабетической невропатии (Montero H.J. et al., 2005; Breivik H. et al, 2006; Torrance N. et al., 2006).
Локализация болевого синдрома практически всегда соответствует зоне кожных высыпаний. Интенсивность болевого синдрома как правило высокая. Кроме глубоких ноющих и стреляющих болей очень характерны поверхностные жгучие боли и наличие стимулозависимых болей - динамической гипералгезии и аллодинии (Baron R., 2004).
При клиническом осмотре в зоне болей выявляются нарушения поверхностной чувствительности. Качество боли в острый период опоясывающего лишая и при ПГН различно. Вместе с тем, несмотря на разный выбор дескрипторов из МакГилловского болевого вопросника, пациенты с опоясывающим лишаем и ПГН для описания своих болевых ощущений выбирают похожие по смыслу слова, например, горячая и жгучая боль или пронзающая и простреливающая боль (Bennett M., 2001).
Схожие проявления наблюдаются и при описании вызванной боли пациентами с опоясывающим лишаем и ПГН. И те, и другие отмечают наличие схожих типов гипералгезии и аллодинии (Haanpaa M. et al., 2000; Berry J.D., Rowbotham M.C., 2004).
У большинства пациентов боль, связанная с ПГН, уменьшается в течение первого года. Однако у части больных она может сохраняться годами и даже в течение всей оставшейся жизни, причиняя немалые страдания (Cunningham A.L., Dworkin R.H., 2000). Затяжной, тяжелый характер заболевания с длительным, выраженным болевым синдромом способствует формированию расстройств психики (Dworkin R.H., et al., 1992). У таких пациентов выявляются тревожно-депрессивные расстройства, когнитивные нарушения - снижение активного внимания, памяти, затруднения осмысления происходящего, отмечается некритичность, нетерпеливость, неряшливость, страх боли, неуверенность в завтрашнем дне, отмечается снижение социальной активности (Haythornthwaite J.A. et al., 2003). ПГН оказывает значительное отрицательное влияние на качество жизни и функциональный статус пациентов особенно пожилого возраста (Lydick E. et al., 1995). У пациентов с ПГН отмечается хроническая усталость, снижение массы тела, физической активности, нарушения сна (Morin C.M., Gibson D., Wade J., 1998).
В основе боли, связанной с ПГН, лежат воспалительные изменения или повреждения ганглиев задних корешков спинного мозга и периферических нервов в пораженных зонах тела. Такие боли относят к невропатическим болям, их выделяют в отдельную самостоятельную группу и определяют как боли, возникающие вследствие первичного повреждения соматосенсорной нервной системы (Treede R.D. et al., 2008).
Патофизиологической основой невропатических болевых синдромов являются нарушения генерации и проведения ноцицептивного сигнала в нервных волокнах, а также механизмов контроля возбудимости ноцицептивных нейронов в структурах спинного и головного мозга (Кукушкин М.Л., Хитров Н.К., 2004; Baron R. 2000).
Лечебная тактика при опоясывающем лишае включает два основных направления: противовирусная терапия и купирование невропатической боли, как в острый период заболевания, так и в стадии постгерпетической невралгии. Результаты нескольких рандомизированных контролируемых испытаний свидетельствуют о том, что раннее начало лечения простого герпеса может предотвратить развитие постгерпетической невралгии или способствовать ее скорейшему разрешению (Исаков В.А. и др., 2004; Helgason S. et al., 1996; Jackson J.L. et al., 1997 ; Volmink J. et al., 1996).
Наиболее широкое применение нашли такие специфические противогерпетические препараты, как ацикловир, фамцикловир и валацикловир, которые, являясь нуклеозидными аналогами, блокируют вирусную репликацию (Романцев М.Г., 1996; Beutner K. et al., 1995; Bruxelle J., 1995). Важно, что противовирусное лечение проявляет наивысшую активность, если назначено в течение 72 ч от начала герпетических высыпаний (Johnson R., 2001; Johnson R., Dworkin R.H., 2003). В ряде исследований доказана высокая эффективность ацикловира в уменьшении тяжести, продолжительности острой герпесной инфекции и профилактике ПГН, особенно при его раннем назначении. Оценка эффективности фамцикловира также продемонстрировала уменьшение времени до разрешения сыпи (Dworkin R.H. et al., 1998). В сравнительном исследовании ацикловира и валацикловира показана эквивалентная эффективность в сокращении продолжительности невропатической ПГН (Beutner K. et al. 1995). В другом клиническом испытании установлена терапевтическая эквивалентность фамцикловира и валацикловира для неосложненного герпеса (Tyring S. et al. 2000). Возможно также сочетанное использование противовирусной терапии и глюкокортикостероидов (Whitley R. et al. 1999). Выявлено, что такая комбинация эффективнее монотерапии противовирусными препаратами, особенно для лечения острой боли и коррекции различных аспектов качества жизни пациентов. Комбинация ацикловир+преднизолон значительно быстрее купирует острую невралгию и возвращает пациента к обычной жизнедеятельности, но существенно не влияет на течение ПГН, то есть она наиболее показана в остром периоде в старших возрастных группах для терапии острого болевого синдрома. Доказано, что хотя преднизолон является иммуносупрессором, его использование не увеличивает частоты развития ПГН и в этом смысле его действие сравнимо с влиянием плацебо, то есть данная комбинация может быть спокойно использована в старших возрастных группах. Для некупируемых тяжелых случаев ПГН некоторые исследователи рекомендуют интратекальное введение метилпреднизолона (Kost R., Straus S., 1996).
В настоящее время в США делается акцент на профилактику герпетической инфекции. С 1995 г. в США проводится всеобщая вакцинация от ветряной оспы, особенно пожилых лиц, и с 1999 г. отмечается резкое снижение заболеваемости (Hambleton S., Gershon A., 2005; Oxman M.N. et al., 2005).
При постгерпетической невралгии препаратами с доказанной эффективностью (класс А - терапия первой линии) являются: пластины с 5% лидокаином, габапентин, прегабалин, трициклические антидепрессанты, трамадол (Attal et al., 2006).
На сегодняшний день эффективность применения пластин с 5% лидокаином (Версатис, Grunenthal Gmbh) убедительно доказана при лечении ПГН. Так, в нескольких рандомизированных клинических исследованиях установлено, что применение пластин с 5% лидокаином статистически достоверно более значимо облегчает проявления болевого синдрома у пациентов с постгерпетической невралгией по сравнению с плацебо (Rowbotham M.C., 1996; Galer B.S., 1999, 2002). На основании полученных данных FDA одобрило применение данного препарата в качестве стартовой терапии у пациентов с постгерпетической невралгией. (Richard L. et al., 2004)
Версатис - это топический анальгетик, который действует непосредственно там, где болит. Он выпускается в виде мягких пластин размером 10х14 см, которые наклеиваются на неповрежденную кожу без признаков воспаления. Медленно высвобождающийся из пластины лидокаин создает более или менее значительную концентрацию лишь в поверхностных слоях кожи, где проходят тонкие волокна, обеспечивающие болевую и температурную чувствительность (Gammaitoni AR, Davis MW. 2002.). Лидокаин лишь в незначительной степени проникает в более глубокие слои кожи, где проходят кровеносные сосуды, поэтому его попадание в системный кровоток сведено к минимуму. У пациентов, использовавших пластины Версатис, не наблюдалось никаких известных системных эффектов лидокаина (влияние на деятельность ЦНС и сердечно-сосудистой системы). Таким образом, важнейшим преимуществом пластин Версатис служит отсутствие системного действия, что гарантирует безопасность лечения. Практически полное отсутствие системного эффекта позволяет назначать Версатис совместно с любыми другими препаратами для лечения нейропатической боли.
Механизм лечебного эффекта препарата Версатис не ограничивается только действием высвобождающегося из них лидокаина. Важное значение имеет также то, что пластина выполняет роль механического барьера, препятствуя раздражению участка кожи с измененной чувствительностью (аллодиния), а также оказывает не него легкое охлаждающее действие (Galer BS, Gammaitoni AR, Oleka N et al., 2004)
Пластины Версатис рекомендуется прикреплять на 12 ч в течение суток, затем следует 12-часовой перерыв. Обезболивающий эффект часто начинается в течение 30 мин после прикрепления пластины, но может проявляться и позже, нарастает в течение 4 ч и затем поддерживается в течение длительного времени, пока пластина прикреплена к коже. Более того, он может сохраняться и после ее удаления.
Для объективной оценки эффективности каждого из препаратов при лечении ПГН используется показатель NNT (number needed to treat - количество больных, которых нужно пролечить, чтобы получить у одного 50% снижение боли). Чем ниже NNT, тем более эффективен препарат при данной патологии. NNT для пластин с 5% лидокаином при лечении пациентов с ПГН составляет 2,0; для амитриптилина - 2,6; габапентина - 4,4; прегабалина - 4,6 (Wu C.L., Raja S.N., 2008); для трамадола - 3,9 (Kalso E., 2006).
Кроме того, в клинической практике очень важен показатель NNH (number needed to harm - число пациентов, которых необходимо пролечить данным препаратом, чтобы получить развитие 1 случая неблагоприятной побочной реакции, приводящей к отмене препарата). Он показывает, насколько безопасен данный препарат при его использовании. Величина NNH для трамадола, рассчитанная по результатам нескольких клинических исследований, составила 9.0, для ТЦА 14.7, для габапентина 26.1. Рассчитать показатель NNH для пластин с 5% лидокаином не представляется возможным в связи благоприятным профилем безопасности препарата, сравнимым с плацебо.
Таким образом, оценка препарата Версатис с позиций доказательной медицины делает его препаратом выбора при лечении постгерпетической невралгии, что подтверждено в соответствующих рекомендациях.
СПИСОК ЛИТЕРАТУРЫ
Л. Н. Мазанкова 2 , д-р мед. наук, проф., зав. кафедрой детских инфекционных болезней, Заслуженный врач России, Э. Р. Самитова, канд. мед. наук, зам. главного врача по инфекции 1 , ассистент кафедры детских инфекционных болезней 2 , С. Г. Горбунов 2 , д-р мед. наук, проф., В. П. Зыков 2 , д-р мед. наук, проф., зав. кафедрой детской неврологии, И. М. Османов 1 , д-р мед. наук, проф., главный врач, В. В. Никитин 1 , зав. отделением общей реанимации и интенсивной терапии, М. Н. Ермакова 1 , зав. 1-м инфекционным отделением.
Резюме: В статье представлено клиническое описание случая ветряной оспы у ребенка 11 месяцев, осложнившейся энцефалитом и флегмоной мягких тканей подбородка на фоне гипогаммаглобулинемии с благоприятным исходом. Показан алгоритм диагностики хирургического и неврологического осложнений ветряной оспы, в том числе методы нейровизуализации. На данном примере продемонстрирована эффективность комплексного лечения осложненной формы этой инфекции, включающего противовирусную, антибактериальную и противосудорожную терапию, позволившего добиться благоприятного исхода.
Ключевые слова: ветряная оспа, дети, осложнения ветряной оспы, менингоэнцефалит, васкулит, флегмона
Summary: The article presents a clinical description of a chickenpox case in a 11-month-old child, complicated by encephalitis and phlegmon of the soft tissues of the chin against the background of hypogammaglobulinemia with a favorable outcome. The algorithm for diagnosing surgical and neurological complications of chickenpox, including methods of neuroimaging, is shown. This example demonstrates the effectiveness of the complex treatment of a complicated form of this infection, including antiviral, antibacterial and anticonvulsant therapy, which has led to a favorable outcome.
Keywords: chickenpox, children, chickenpox complications, meningoencephalitis, vasculitis, phlegmon
Ветряная оспа (МКБ-10: В01) - острое инфекционное заболевание, вызываемое вирусом Varicella-zoster (VZV) из семейства Herpesviridae, передающееся воздушно-капельным путем, характеризующееся лихорадкой, интоксикацией, появлением характерной макулопапулезной и везикулезной сыпи и доброкачественным течением [1].
Ветряная оспа - широко распространенное заболевание в детском возрасте, что связано со всеобщей восприимчивостью, легкостью передачи инфекции и отсутствием массовой специфической профилактики. Заболевают дети всех возрастов, включая новорожденных и детей 1-го года жизни. Возможна трансплацентарная передача инфекции, развитие врожденной ветряной оспы, отличающейся тяжелым течением, генерализацией процесса в виде висцеральной формы с полиорганным поражением [2]. Ветряная оспа может быть причиной летальных исходов, в том числе у детей с онкогематологическими заболеваниями, у новорожденных, а также у пациентов, получающих химиотерапию, глюкокортикостероиды, лучевую терапию, у иммунокомпрометированных больных, в том числе при ВИЧ-инфекции [3].
Тяжесть состояния при ветряной оспе часто обусловлена развитием осложнений, частота которых составляет от 4,83 до 67,7%, по данным разных авторов. По оценке ВОЗ, в мире ежегодно госпитализируются по поводу осложнений ветряной оспы около 4 млн больных, а умирают от этой инфекции более 4000 больных. В России среди госпитализированных детей с ветряной оспой в 40,4% случаев регистрируются осложнения, наиболее часто встречаются бактериальные инфекции кожи (8,4%) и неврологические осложнения (4,2%) [4, 5].
Самым частым неврологическим осложнением при ветряной оспе у детей является энцефалит, составляющий 75% среди других неврологических синдромов и характеризующийся развитием церебеллярной (мозжечковой) формы с атаксией [6], [7]. Реже встречаются оптикомиелит, поперечный миелит, серозный менингит, менингоэнцефалит, энцефалит с деменцией, нейропатии, асептический менингит, синдром Гийена-Барре, парез лицевого нерва [2]. Разнообразие клинических форм поражения нервной системы при ветряной оспе представлено в работе Билялетдиновой И.Х. с соавт. (2016) такими состояниями, как мозжечковая атаксия (44%), менингоэнцефалит (40,5%), менингит (8,3%), полирадикулонейропатия (4,8%), острый диссеминированный энцефаломиелит (1,2%), ишемический инсульт (1,2%) [8]. При наблюдении за 65 детьми в возрасте от 1 года до 17 лет с ветряночным энцефалитом Скрипченко Н.В. с соавт. (2009) установлено преобладание мозжечковой формы заболевания, составляющей 93,9%, над церебральной формой. При этом изменения на МРТ являются редкостью и составляют 12,3%. Исходом мозжечковой формы было выздоровление в 100% случаев, а при церебральной форме - развитие эпилепсии в 50% и летального исхода у 25% [9].
Бактериальные осложнения ветряной оспы характеризуются развитием вторичного инфицирования элементов ветряночной сыпи с образованием на коже абсцессов, импетиго, флегмоны, стрептодермии, рожи и др. Возможно сочетание бактериальных и неврологических осложнений у детей с иммунодефицитными состояниями, однако такие формы встречаются редко, отличаются тяжестью течения и неблагоприятным исходом. Ниже представлен случай ветряной оспы у ребенка 11 месяцев с развитием комбинированного осложнения в виде флегмоны и менингоэнцефалита.

Рис. 1. Ребенок 11 месяцев с признаками ветряной оспы
На 3-й день госпитализации (7-й день болезни) отмечалось ухудшение состояния за счет гипертермии, распространения флегмоны с подбородочной области на шею и грудь, появления правостороннего гемипареза и тонико-клонических судорог в пораженной конечности. В анализе крови при этом отмечалась анемия 1-2-й степени, тромбоцитопения до 100 х 10 9 /л, гиперлейкоцитоз 43,3 х 10 9 /л со сдвигом влево до миелоцитов по типу лейкемоидной реакции миелоидного типа, повышение СОЭ до 55 мм/ч. Наблюдался выраженный системный воспалительный ответ в виде повышения уровня С-реактивного белка до 98,3 мг/л (норма до 10 мг/л) и прокальцитонина до 1,5 нг/л (норма до 0,5 нг/л). В протеинограмме отмечалась гипогаммаглобулинемия до 6,63%. Коагулограмма без изменений. На ЭКГ -неполная блокада правой ветви пучка Гиса.
Появление неврологической симптоматики в сочетании с воспалительными изменениями в анализах крови послужили показанием к проведению компьютерной томографии (КТ) головного мозга, на которой визуализированы ишемические изменения вещества головного мозга левой лобной и затылочной доли с очагами пониженной плотности до 2 см в диаметре, не изменяющимися при введении контрастного вещества, что характерно для течения энцефалита (рис. 2). Ребенку была выполнена спинномозговая пункция.

Рис. 2. КТ головного мозга: ишемические изменения вещества головного мозга левой лобной и затылочной долей, что, вероятнее всего, является проявлением энцефалита
В анализе ликвора наблюдался невысокий преимущественно нейтрофильный цитоз (24 клетки, из них 19 -нейтрофилы, 5 - лимфоциты), содержание белка и глюкозы в норме. При ПЦР исследовании ликвора на ДНК вирусов группы герпеса обнаружена ДНК VZV.
Ребенок был осмотрен оториноларингологом, офтальмологом, хирургом, неврологом. Учитывая ухудшение состояния, появление правостороннего гемипареза, судорог, выраженных воспалительных изменений в анализах крови, данные молекулярно-генетического исследования ликвора и КТ головного мозга, можно было думать о развитии у пациента осложнений ветряной оспы в виде энцефалита с высокой вероятностью церебрального васкулита и флегмоны мягких тканей подбородочной области, шеи и грудной клетки. В связи с этим для дальнейшего лечения ребенок был переведен в ОРИТ, где находился 14 дней.

Рис. 3. МРТ головного мозга: ишемические изменения в бассейне левой средней мозговой артерии и атрофия коры головного мозга в височной и лобной долях слева
Консультация проф., зав. кафедрой неврологии детского возраста РМАНПО Зыкова В.П. от 14.03.17: ветряночный энцефалит с высокой вероятностью церебрального васкулита. По данным видео-ЭЭГ-мониторинга, выявлена эпилептиформная активность теменно-лобной лотенции. С учетом клинико-ЭЭГ-проявлений рекомендуется продолжить антиконвульсантную терапию в течение 6 месяцев от начала заболевания, с повторным видео-ЭЭГ-монторингом.
Консультация в НПЦ медицинской радиологии ДЗМ канд. мед. наук, доц. Петряйкина А.В. от 23.03.17: по результатам представленных КТ и МРТ изображений, учитывая клиническую картину вероятно речь идет о течении ветряночного VZV. Зона поражения затрагивает корково-подкорковые области левого полушария (всех долей), область головки хвостатого ядра. Вероятно, имел место васкулит с поражением периферических отделов сосудистого русла, без убедительных данных за геморрагический компонент.
Была продолжена антибактериальная терапия с последовательной сменой антибиотиков на 10-дневные курсы меропенема и ванкомицина (в комбинации), линезолида, ципрофлоксацина и рифампицина. Кроме того, пациент получал ацикловир по 160 мг х 3 р/сут. внутривенно в течение 3 недель, инфузионную терапию глюкозо-солевыми растворами, человеческий иммуноглобулин для внутривенного введения из расчета 1,5 г/кг на курс, трансфузию эритроцитарной взвеси, противосудорожную (диазепам, затем вальпроевую кислоту), сосудистую и прочую симптоматическую терапию.
На фоне проводимого лечения отмечалась положительная клинико-лабораторная динамика. При выписке состояние ребенка удовлетворительное, температура тела стойко в пределах нормы, симптомы интоксикации отсутствуют. Кожные покровы и слизистые оболочки чистые, обычной окраски. В подчелюстной области вокруг послеоперационного рубца сохранялась небольшая инфильтрация мягких тканей размерами 10 х 4 мм, цвет кожи на данном участке не изменен, флюктуация отсутствовала. Со стороны сердечно-сосудистой системы, легких и ЖКТ патологии не выявлено. Физиологические отправления в норме. Неврологический статус: сознание ясное, очаговых и менингеальных симптомов нет. Снижен объем движений в правой руке. Сухожильные рефлексы и сила в мышцах рук справа снижены, в ногах - одинаковы с обеих сторон.
В анализах крови в динамике нормализовалось количество эритроцитов, лейкоцитов и тромбоцитов с преобладанием в лейкоцитарной формуле лимфоцитов (76%). Показатели СОЭ и прокальцитонина также пришли в норму, сохранялось небольшое повышение уровня С-реактивного белка (15,2 мг/л). Содержание общего белка приблизилось к нижней границе нормы (58 г/л). Показатели ликвора при повторной люмбальной пункции - без патологии, ДНК VZV при контрольном ПЦР-исследовании не обнаружена.
При выписке пациенту рекомендован домашний режим и диета по возрасту, продолжить прием вальпроевой кислоты до 1 года с контролем концентрации через 1 месяц, витамины В1, В6, В 12, L-карнитин, медицинский отвод от профилактических прививок на 1 год, ежемесячный контроль общего анализа крови, ежеквартальный контроль ЭЭГ, повторить видео-ЭЭГ-мониторинг через 1 месяц и МРТ головного мозга через полгода, продолжить ЛФК и массаж под наблюдением участкового педиатра и невролога.
Катамнез невролога от 10.12.18. Диагноз: последствие ветряночного менингоэнцефалита с явлениями васкулита. Симптоматическая эпилепсия, левополушарная лобно-височная. Медикаментозная ремиссия. Рекомендовано: продолжить конвулекс, программу отмены начать постепенно, под контролем ЭЭГ. Судороги не повторялись.
На данном примере продемонстрированы особенности раннего развития поражения ЦНС в виде менингоэнцефалита с явлениями васкулита и формированием симптоматической фокальной эпилепсии с благоприятным исходом у ребенка 11 месяцев с тяжелой типичной формой ветряной оспы, осложненной флегмоной мягких тканей подбородочной области, шеи и грудной клетки на фоне гипогаммаглобулинемии. Применяемые методы диагностики, в том числе нейровизуализация, позволили своевременно диагностировать развившиеся осложнения и скорректировать проводимую терапию.
ЛИТЕРАТУРА
1. Детские инфекции: Справочник практического врача / Под ред. Л.Н. Мазанковой. 2-е изд., перераб. и доп. М.: МЕД-пресс-информ, 2016.
2. Ветряная оспа у детей в современных условиях (эпидемиология, клиника, диагностика, терапия, профилактика): Учебное пособие / Под ред. Ю.В. Лобзина. СПб., 2011.
3. Зрячкин Н.И., Бучкова Т.Н., Чеботарева Г.И. Осложнения ветряной оспы (обзор литературы) // Журнал инфектологии. 2017. Т. 9. № 3. С. 117-128.
4. Лещинская Е.В., Мартыненко И.И. Острые вирусные энцефалиты у детей. М.: Медицина, 1990.
5. Сорокина М.Н., Скрипченко Н.В. Вирусные энцефалиты и менингиты у детей. М., Медицина, 2004.
6. Ветряная оспа у детей: Руководство для врачей / Под ред. Н.В. Скрипченко. СПб.: Тактик-Студио, 2015.
7. Science M., MacGregor D., Richardson S.E. Central nervous system complication of varicella-zoster virus // J. Pediatr. 2014. Vol. 165. № 4. Р. 779-785.
8. Билялетдинова И.Х., Малинникова Е.Ю., Митрофанова И.В., Прыткова М.И. Поражения нервной системы, вызванные вирусом варицелла-зостер // Детские инфекции. 2016. № 3. С. 10-15.
9. Скрипченко Н.В., Иванова Г.П., Команцев В.Н., Савина М.В. Современные особенности ветряночных энцефалитов у детей // Журнал инфектологии. 2009. Т. 1. № 4. С. 36-43. Л. С. Чутко 1 , д-р мед. наук, проф., С. Ю. Сурушкина 1 , канд. мед. наук, Е. А. Яковенко 1 , канд. биол. наук, Т. Л. Корнишина 2 , канд. мед. наук
Постгерпетическая невралгия (ПГН) — это осложнение опоясывающего герпеса, вызванного тем же вирусом, что и ветряная оспа (лат. herpes zoster virus). При этом заболевании поражаются кожа и нервные волокна, что проявляется сильной жгучей болью уже после заживления герпетических пузырей.
Риск возникновения постгерпетической невралгии увеличивается с возрастом; чаще всего этому заболеванию подвержены люди старше 60-ти лет. Данное состояние возникает примерно у 10–20% пациентов, перенесших опоясывающий герпес . Его вылечить нельзя, но лечение постгерпетической невралгии может облегчить симптомы и снять боль. Больше чем у половины пациентов боли проходят сами по себе спустя некоторое время.
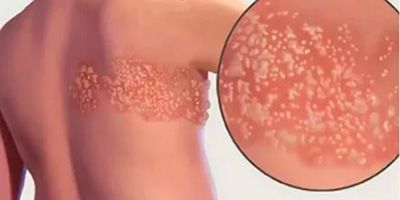
Симптомы постгерпетической невралгии, как правило, ограничиваются той областью кожи, где впервые возникли высыпания — чаще всего они опоясывают туловище или появляются сбоку, впрочем заболевание может поражать и лицо.
Болевые ощущения могут длиться в течение 3-х месяцев и дольше после заживления герпетических пузырьков. Пациенты описывают её, как жгучую, острую, пронзающую или глубокую, она возникает даже при малейшем прикосновении к коже в поражённой области, в том числе и от лёгкого прикосновения одежды (аллодиния). Гораздо реже больные чувствуют зуд и онемение.
Причины постгерпетической невралгии
После того как человек перенёс ветряную оспу, вирус остаётся в организме на всю жизнь. С возрастом иммунная система ослабевает (в частности — от приёма лекарств или химиотерапии) и вирус может активизироваться, в результате чего возникает опоясывающий лишай.
Повреждение нервных окончаний при высыпаниях приводит к возникновению постгерпетической невралгии. Будучи повреждёнными, нервные волокна не могут посылать сигнал от кожи к мозгу так, как они это делают в норме. Вместо этого, ими передаются усиленные сигналы, а пациент чувствует мучительную боль, которая может длиться месяцами или даже годами.
Факторы риска
Если у вас появились признаки опоясывающего лишая, то риск возникновения постгерпетической невралгии значительно усиливается при следующих условиях:
- возраст старше 50-ти лет;
- ярко выраженные симптомы опоясывающего лишая, имеются обильные высыпания и интенсивная боль;
- наличие сопутствующих заболеваний, в том числе сахарного диабета;
- наличие высыпаний на лице.
Осложнения
При длительном течении заболевания, особенно если оно сопровождается очень сильным болевым синдромом, у пациентов часто возникают следующие осложнения:
- депрессия;
- усталость;
- нарушения сна;
- потеря аппетита;
- сложности с концентрацией внимания.
Наши врачи
Методики лечения
На вопрос о том, как лечить постгерпетическую невралгию невозможно дать однозначный ответ, поскольку не существует универсального лечения данного заболевания, которое бы подходило всем больным. Как правило, требуется кропотливый подбор лекарственных препаратов и методик (а иногда — и их сочетание) для того, чтобы облегчить боль пациента.
Лидокаиновые пластыри
Это пластыри, содержащие местное обезболивающее средство — лидокаин. Их следует наклеивать на поражённый участок кожи. За счёт постоянного равномерного выделения анестетика, такие пластыри приносят временное облегчение, снижая болевые ощущения и давая передышку.
Пластыри с высоким содержанием капсаицина
Это современный метод обезболивания при постегрпетической невралгии, который заключается в следующем: содержащееся в пластыре вещество является производным жгучего перца, который блокирует болевые рецепторы кожи. Аппликация такого пластыря может проводиться только врачом. Процедура занимает 2 часа, но хороший обезболивающий эффект от неё пролонгирован и может сохраняться до 3-х месяцев. Если возникнет необходимость, процедуру повторяют.
Медикаментозная терапия
Медикаментозная терапия предусматривает использование следующих групп препаратов:
Эпидуральное введение анестетиков и стероидных гормонов
Эпидуральная блокада позвоночника предусматривает введение препаратов в эпидуральное пространство, что приводит к утрате чувствительности в области воздействия. Это значит, что данная процедура предусматривает введение действующего вещества непосредственно в источник боли. Достижение лечебного эффекта в данном случае возможно за счёт следующих факторов:
- обезболивающие свойства препарата;
- максимально возможная концентрация в поражённой области;
- рефлекторное действие на всех уровнях нервной системы.
Радиочастотная деструкция нервов
Радиочастотная деструкция нервов обеспечивает стойкий обезболивающий эффект, который сохраняется до года и более. Это малоинвазивная нехирургическая процедура, которая позволяет значительно облегчить боль в тех случаях, когда другие способы
Лечение постгерпетической невралгии в ЦЭЛТ
Если у вас или ваших близких присутствует данная патология мы рекомендуем обратится в Клинику Боли ЦЭЛТ. Наши специалисты по лечению боли (алгологи) владеют всеми перечисленными методиками и смогут подобрать наиболее эффективную для каждого пациента.
Важно, что при некоторых из них пациент получает практически мгновенный устойчивый эффект обезболивания, который длится продолжительное время.
Читайте также:

