Вич что убивает его клетки
Обновлено: 25.04.2024
В середине 1980-х ученые идентифицировали вирус иммунодефицита человека и сразу же стали искать лекарство. История антиретровирусной терапии началась в 1987 году, когда для лечения ВИЧ-инфекции стали использовать препарат зидовудин. Но его эффективность была невысокой, а побочные эффекты слишком сильными. Первая высокоэффективная терапия появилась только через десять лет — в 1996 году. Эта комбинация из нескольких лекарств блокирует размножение попавшего в организм вируса сразу на нескольких этапах его цикла. С тех пор ВИЧ-инфекция — не смертельное, а хроническое заболевание, которое можно контролировать при должном лечении.
Антиретровирусные препараты (АРВ) подавляют размножение ВИЧ, но неспособны полностью удалить вирус из организма, именно поэтому их нужно принимать постоянно в течение всей жизни. Как только концентрация препарата в крови падает ниже порогового значения, вирус снова начинает размножаться. Это особенно опасно, ведь если вирус размножается в присутствии небольшого количества лекарства, то он вырабатывает устойчивость к этому препарату.
Пить таблетки на протяжении всей жизни с точностью до минут — не самая простая задача. Этому мешают и банальная забывчивость, и разные случайные обстоятельства. А чем чаще человек нарушает время приема терапии, тем выше риск развития у вируса устойчивости. Именно поэтому врачи стараются назначать схемы с приемом лекарств один раз в день и с минимальным числом таблеток — чем реже и меньше нужно принимать лекарств, тем проще соблюдать режим. Правильное соблюдение режима приема терапии называют высокой приверженностью лечению.
Сейчас лучшими схемами считаются те, при которых пациенту нужно принимать одну таблетку один раз в день, да еще и независимо от приема пищи. Но настоящим прорывом в АРВТ станет разработка схем, при которых лекарство достаточно будет принимать всего один или несколько раз в месяц, — пролонгированных схем терапии. Хотя в настоящее время неизвестно, как поведут себя пролонгированные режимы в рутинной практике. Будет ли к ним сохраняться высокая приверженность — как это показывают исследования?
по теме

Общество
Грудное молоко VS смеси при ВИЧ: что говорят эксперты в 2020 году?
Основной недостаток таких таблеток — срок их действия ограничено временем нахождения таблетки в кишечнике и не превышает 12—24 часов. В случае же диареи таблетка может покинуть организм гораздо быстрее, а значит, уменьшится концентрация лекарства в крови, что может быть опасно. Для антиретровирусных препаратов создание таблеток или капсул с замедленным высвобождением лекарственного вещества не очень перспективно — современные схемы уже позволяют принимать терапию один раз в день. То есть удобство применения терапии такие таблетки не повысят.
Если нужно добиться продления эффекта препарата на дни и недели, а лекарство всасываться через кожу упорно не хочет, приходится прибегать к парентеральным пролонгированным формам. Можно зашить под кожу специальную стерильную таблетку, которая будет медленно растворяться и выделять лекарственное вещество: на коже делается небольшой разрез, в него вводят таблетку и зашивают рану.
Помимо таблеток, под кожу можно вводить специальные полимерные импланты, содержащие нужное лекарство. Преимущество имплантов — они могут выделять лекарственное вещество очень долго, до нескольких лет. Чаще всего такие импланты используют для гормональной контрацепции. Так как гормоны действуют в очень маленьких дозах, даже в небольшой по размерам имплант можно сразу поместить запас препарата на несколько лет. Например, противозачаточный препарат Имплантон, который вводится под кожу, продолжает действовать три года. Если действие препарата нужно прекратить — достаточно просто извлечь имплант.
Более простой вариант — ввести в мышцу взвесь маленьких крупинок лекарства в подходящем растворителе. Выглядит это как обычный укол, при этом крупинки лекарства задерживаются в мышце, медленно растворяются и попадают в кровь. Такие способы введения лекарства особенно удобны в случаях, когда пациент может часто пропускать прием препарата, или забывать, принял ли он лекарство. Например, в случае лечения психических заболеваний. Но есть и недостатки: вводить такой препарат должен медицинский работник, а в случае непереносимости или выраженных побочных эффектов лекарство очень трудно быстро удалить из организма.
Что уже доступно на рынке?
Многие фармацевтические компании проводят исследования пролонгированных АРВ-препаратов, но разработка одного такого препарата сама по себе очень большой пользы не принесет — ведь для лечения ВИЧ-инфекции необходимо сочетание нескольких препаратов, то есть нужна комбинированная пролонгированная схема.
Такую схему, разработанную ViiV Healthcare совместно с Janssen, одобрили в марте 2020 года в Канаде — первый пролонгированный комбинированный АРВ-препарат Cabenuva. Схема показала высокую эффективность и безопасность в клинических исследованиях LATTE-2, FLAIR, ATLAS с участием более тысячи пациентов. В состав Cabenuva входят каботегравир и рилпивирин, то есть это двухкомпонентная схема. Препарат вводят один раз в месяц внутримышечно.
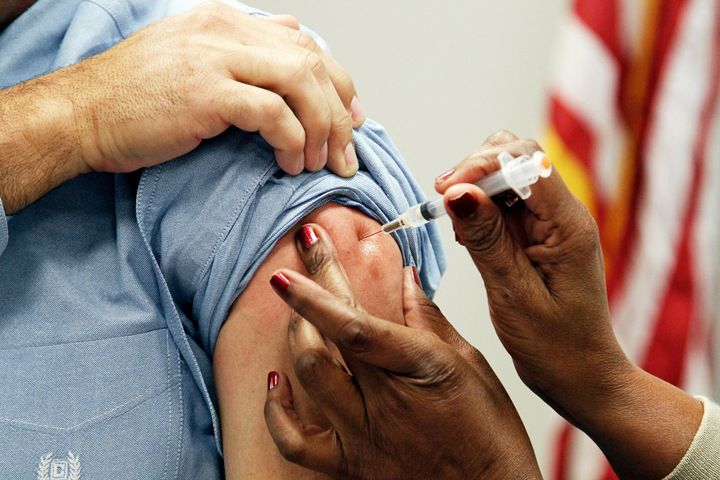
Перед началом применения Cabenuva пациент не менее месяца принимает каботегравир в таблетках (называется Vocabria) в комбинации с Эдюрантом — таблетками рилпивирина. Это необходимо, чтобы проверить переносимость такой схемы у конкретного пациента и оценить побочные эффекты. Если схема переносится хорошо, пациенту вводят первую нагрузочную дозу Cabenuva — 3 миллилитра суспензии, содержащей 600 миллиграммов каботегравира, и 3 миллилитра суспензии, содержащей 900 миллиграммов рилпивирина. Суспензии вводятся в разные участки ягодичной мышцы, то есть делают два укола. После этого поддерживающие дозы вводят ежемесячно: 2 мл (400 мг) каботегравира и 2 мл (600 мг) рилпивирина. Если по каким-то причинам введение очередной ежемесячной поддерживающей дозы невозможно, пациент до момента следующей инъекции может принимать пероральную схему (Vocabria + Эдюрант). Пролонгированная форма каботегравира также имеет большие перспективы для использования в качестве доконтактной профилактики ВИЧ-инфекции.
Еще один препарат, который уже применяется в клинической практике, — ибализумаб (Трогарзо) — можно назвать пролонгированным с несколькими оговорками. По химической природе ибализумаб — моноклональное антитело, то есть близок к человеческим иммуноглобулинам. Ибализумаб связывается с некоторыми белками на поверхности вируса и мешает проникновению ВИЧ в клетки. Препарат вводят внутривенно один раз в две недели и часто сочетают с другими АРВ-препаратами. Такая схема — не самый удобный вариант, поэтому сейчас ибализумаб используется только для лечения ВИЧ с множественной лекарственной устойчивостью, когда другие схемы оказываются неэффективными. Поэтому ибализумаб правильнее будет отнести к нишевым препаратам.
К сожалению, на этом и заканчивается не очень длинный перечень пролонгированных АРВ-препаратов, которые уже применяются на практике. Дальше пойдет речь о препаратах, находящихся на разных стадиях исследований.
Что сейчас находится в разработке?
PRO 140
С точки зрения места в клинической практике на ибализумаб похоже еще одно моноклональное антитело, находящееся в стадии клинических исследований, — PRO 140. Этот препарат также можно будет использовать для лечения ВИЧ-инфекции, если у пациента не работают другие схемы. А по механизму действия PRO 140 похож на уже существующий на рынке препарат маравирок (Целзентри). Он связывается с CCR-5 рецепторами на поверхности клеток-мишеней и мешает проникновению вируса в клетку. Строение активного центра молекулы PRO 140 отличается от маравирока, поэтому он активен даже в тех случаях, когда вирус выработал устойчивость к маравироку. Как и маравирок, PRO 140 активен только против CCR-5-тропных подтипов ВИЧ, то есть подойдет не всем пациентам. Препарат вводят внутривенно, один раз в неделю.
Нейтрализующие антитела
На разных стадиях клинических исследований находятся несколько перспективных антител, которые связываются с вирусным белком gp120 и нейтрализуют вирус: VRC01, 3BNC117 и 10-1074. Предполагается, что эти препараты достаточно будет вводить раз в месяц или даже реже и их можно будет применять совместно с другими пролонгированными АРВ-препаратами.
Албувиртид
Аналог уже применяющегося на практике энфувиртида (Фузеон). Этот препарат связывается с вирусным белком gp-41 и мешает проникновению вируса в клетку. Основное отличие в том, что Фузеон вводят подкожно два раза в сутки, что очень неудобно, а албувиртид — только один раз в 2—4 недели. Препарат должен применяться совместно с другими АРВ-лекарствами.

Обзор
Распространенность СПИДа в мире на 2009 год.
Автор
Редакторы

Спонсор конкурса — дальновидная компания Thermo Fisher Scientific. Спонсор приза зрительских симпатий — фирма Helicon.
Иммунная система

Рисунок 1. Упрощенная схема иммунного ответа. Молниями указано, как один тип клеток активирует другие. Мф — макрофаг, Б — бактерия, ТХ — Т-хелпер, ВКл — B-клетка, ПлКл — плазматическая клетка, Ат — антитела, Б+Ат — бактерия, покрытая антителами, привлекающими макрофагов, В — вирус, ЗМф — зараженный макрофаг, ТК — Т-киллер, ЗК — клетка, зараженная вирусом, УК — умирающая (апоптотирующая) клетка, В+Ат — вирус, покрытый антителами.
рисунок автора статьи
Жизненный цикл ВИЧ
Видео. Жизненный цикл ВИЧ.
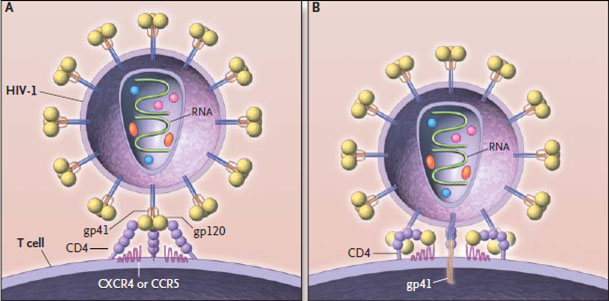
Таким образом, после того как копия вируса в геноме клетки начинает действовать, на её поверхности появляются знакомые нам белки gp41 и gp120, в цитоплазме — остальные вирусные белки и вирусная РНК. И через некоторое время от зараженной клетки начинают отпочковываться всё новые и новые копии ВИЧ.
Способы уничтожения иммунной системы
При отпочковывании вирус использует клеточную мембрану клетки, и со временем это должно вызвать ее разрушение. К тому же, вирусный белок Vpu вызывает увеличение проницаемости мембраны клетки [6]. При активации вируса в клетке появляется неинтегрированная в геном двуцепочечная ДНК [19], наличие которой может рассматриваться клеткой как повреждение ее генетического материала и индуцировать ее смерть через апоптоз (С точки зрения организма такая клетка потенциально может стать раковой). Помимо этого, вирусные белки напрямую нарушают баланс про- и противоапоптотических белков в клетке. К примеру, вирусная протеаза p10 может разрезать противоапоптотический фактор Bcl-2. Белки Nef [26], Env [22] и Tat [24] вовлечены в возрастание количества клеточных белков CD95 и FasL, служащих индукторами апоптоза по т.н. Fas-опосредованному пути. Белок Tat положительно регулирует каспазу 8 [2] — ключевой фактор индукции апоптоза.
Если же клетки не погибли сами, они активно уничтожаются Т-киллерами. (Это стандартный ответ иммунитета на заражение любыми вирусами.)
Помимо этого, при производстве gp120 и Tat часть их выбрасывается зараженной клеткой в кровоток, а это оказывает токсическое действие на организм [4], [28]. gp120 оседает на все СD4 + -клетки (в том числе и здоровые), что имеет три последствия:
- Белок СD4 важен для взаимодействия Т-хелпера с фагоцитом, при слипании же СD4 с gp120 T-хелпер перестает выполнять эту функцию.
- На gp120 как на чужеродный белок образуются антитела; после оседания gp120 на здоровые клетки, последние маркируются антителами, и иммунная система их уничтожает [9].
- После обильного связывания Т-хелпером gp120 клетка умирает сама. Дело в том, что CD4 — это корецептор. Он усиливает сигнал от TCR (T-cell receptor) — главного белка, позволяющего выполнять Т-клеткам функцию иммунитета. В норме эти рецепторы активируются вместе. Если же активируется один тип рецепторов, но не активируется другой, это является сигналом, что что-то пошло не так, и клетка умирает посредством апоптоза.
Антитела, призванные препятствовать инфекции, в случае с ВИЧ часто, наоборот, ее усиливают [28]. Почему так происходит — не совсем понятно. Одну причину мы рассмотрели выше. Возможно, дело в том, что антитела сшивают несколько вирусных частиц вместе, и в клетку попадает не один, а сразу много вирусов. Помимо этого, антитела активируют клетки иммунитета, а в активированной клетке вирусные белки синтезируются быстрее.
Вдобавок, gp120 и gp41 имеют участки, похожие на участки некоторых белков, участвующих в иммунитете (например, MHC-II [25], IgG [23], компонент системы комплемента Clq-A [14]). В результате на эти участки образуются антитела, способные помимо вируса маркировать совершенно здоровые клетки (если на них будут эти белки), с соответствующими для них последствиями.
Так как на поверхности зараженной клетки появляется gp120, то она, как и вирусная частица, будет сливаться с другими СD4-содержащими клетками, образуя огромную многоядерную клетку (синцитий), неспособную выполнять какие-либо функции и обреченную на смерть.
На самом деле, помимо Т-хелперов, СD4 содержатся во множестве других клеток — предшественниках Т-киллеров/Т-хелперов, дендритных клетках, макрофагах/моноцитах, эозинофилах, микроглии (последние четыре — разновидности фагоцитов), нейронах (!), мегакариоцитах, астроцитах, олигодендроцитах (последние две — клетки, питающие нейроны), клетках поперечно-полосатых мышц и хорионаллантоиса (присутствует в плаценте) [29]. Все эти клетки способны заражаться ВИЧ, но сильно токсичен он лишь для Т-хелперов. Это и определяет основное клиническое проявление СПИДа — сильное снижение количества Т-хелперов в крови. Однако для других клеток заражение тоже не проходит бесследно — у больных СПИДом часто снижена свертываемость крови, имеются неврологические и психиатрические отклонения [16], наблюдается общая слабость.
Пути заражения ВИЧ
Внимание! Ввиду того, что СПИД является венерическим заболеванием, информация, приведенная в этом разделе, может вас оскорбить либо вызвать неприятные эмоции при прочтении. Будьте осторожны.
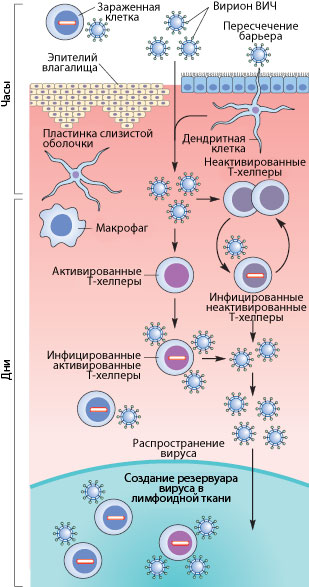
Рисунок 3. Пути проникновения ВИЧ в организм при половом контакте. Слева указано примерные временные рамки каждого этапа.
Как же происходит первичное заражение человека ВИЧ? Думаю, что с переливанием крови или с использованием общего шприца при употреблении наркотиков читателю все понятно — вирус доставляется напрямую из зараженной крови в здоровую. При вертикальном способе передачи инфекции (от матери к ребенку) заражение может произойти во время внутриутробного развития, в момент родов или в период кормления ребенка грудью (т.к. вирус и зараженные вирусом клетки содержатся в молоке матери) [17], [20]. Тем не менее, даже у ребенка, рожденного от ВИЧ-инфицированной матери, есть шанс остаться здоровым, особенно если мать использует ВААРТ (высокоактивную антиретровирусную терапию) [5]. А почему же люди заражаются при половом контакте?
Механизмы передачи вируса при половом акте не до конца ясны. Тем не менее, они понятны в общих чертах. Итак, рассмотрим барьеры, которые необходимо преодолеть вирусу, чтобы добраться до макрофагов и Т-хелперов. К сожалению, рассматривать особо нечего: барьер только один — это слой эпителиальных клеток и вырабатываемая ими слизь, находящиеся во влагалище (а также пенисе, прямой кишке, глотке). Барьер этот тонок — он может быть всего одну клетку в толщину, — но для вируса труднопреодолим, доказательством чего может служить сравнительно небольшой процент заражений — примерно 1–2 случая на 100 половых контактов. Итак, и какими же путями преодолевает вирус это препятствие?
Наиболее очевидный механизм — это микротравмы. При обычном половом контакте, а особенно при анальном сексе, почти неизбежно появляются микротрещины; при наличии же венерических заболеваний часто возникают изъязвления слизистой. Через эти микротравмы вирус, содержащийся в сперме и влагалищном секрете, может проникнуть к иммунокомпетентным клеткам [17], [20].
Помимо дендритных клеток, в кишечнике существует другой тип клеток, предназначенный для ознакомления организма с антигенами внешней среды. Это так называемые М-клетки, пропускающие через себя довольно крупные объекты неповрежденными из просвета кишечника. В т.ч. через них может проходить и вирион ВИЧ.
Свой вклад в заражение вносит и провоспалительный процесс, в норме присутствующий в женских половых путях из-за наличия в них спермы. Благодаря ему Т-клетки подвержены активации, что способствует их восприимчивости к инфекции.
Итак, риск заразиться ВИЧ возрастает в ряду (Классический секс → Анальный секс → переливание крови / использование общих шприцов при принятии наркотиков). Что же касается орального секса, то весьма небольшой шанс заразиться есть только у принимающей стороны — слюна и тем более желудочный сок инактивирует ВИЧ. Теоретически, этим способом может заразиться и мужчина, но для этого необходимы ранки на пенисе.
При поцелуях и обычных бытовых контактах вирус не передается — он очень неустойчив в окружающей среде .
Заключение
. Все эти факты позволяют надеяться, что вскоре ВИЧ, как и оспа, останется в прошлом.
Вирусы могут размножаться только внутри клетки-хозяина, перестраивая ее работу так, что клетка начинает производить новые вирусные частицы. Это серьезно нарушает работу самой клетки и в большинстве случаев ведет к ее гибели. Процесс проникновения и размножения вируса в ней сложный и содержит много стадий, а значит, специальные лекарства могут тормозить его на различных этапах.
В случае с ВИЧ это выглядит так.

по теме

Лечение
Лучшие научпоп-статьи 2018 года
После того как вирусная частица приклеилась к рецепторам CD4 и CCR5/CXCR4 и закрепилась на поверхности клетки, другой специальный белок вируса gp41 соединяет оболочку вируса с мембраной клетки-мишени и помогает вирусу проникнуть внутрь клетки (цифра 2 на схеме). На этом этапе остановить вирус может другая группа препаратов — ингибиторы слияния, например, энфувиртид. Препарат связывается с вирусным белком gp41 и нарушает его работу.

На этом этапе размножение вируса блокирует очень большое количество препаратов из двух классов — нуклеозидные ингибиторы обратной транскриптазы (НИОТ — ламивудин, абакавир, тенофовир) и ненуклеозидные ингибиторы обратной транскриптазы (ННИОТ — эфавиренз, рилпивирин). Принцип действия у веществ из обеих групп похожий: молекула лекарства связывается с обратной транскриптазой вируса, нарушает ее работу и так блокирует перенос генов вируса из РНК в ДНК. Это не позволяет генам вируса встроиться в ДНК клетки-хозяина и начать производство новых вирусных частиц.
На следующем этапе инфицирования (цифра 4 на схеме) готовая вирусная ДНК проникает в ядро и встраивается в ДНК клетки-хозяина с помощью специального вирусного фермента — интегразы. Работу этого фермента блокируют ингибиторы интегразы, например, долутегравир, не позволяя ДНК вируса встроиться в наши гены.
После того как вирусная ДНК встраивается в ДНК клетки-хозяина, клетка получает неправильную программу и начинает производить вирусные белки и РНК, необходимые для сборки новых частиц вируса (цифра 5 на схеме), используя для этого структуры, которые в норме производят собственные белки клетки. Такая перенастройка производства белка сильно нарушает работу клетки и через некоторое время вызывает ее гибель. Лекарств, которые бы влияли на этот этап размножения вируса, нет, так как здесь вирус использует собственные ферментные системы клетки-хозяина и блокирование их работы какими-то веществами навредит здоровым клеткам.
по теме

Лечение
Ошибка системы. Почему в регионах опять не хватает таблеток от ВИЧ
После синтеза вирусных белков клеткой-хозяином в работу вступает еще один фермент вируса — протеаза (цифра 6 на схеме). Дело в том, что белки ВИЧ синтезируются в виде длинных цепочек белков-предшественников, но они неактивные. Протеаза разрезает эти цепочки на более короткие фрагменты, которые становятся активными белками вируса: из одних собирается вирусная оболочка, другие выполняют функции ферментов (обратная транскриптаза, интеграза, протеаза, о которых мы говорили выше). Класс лекарств, нарушающих работу вирусной протеазы, включает большое количество препаратов от достаточно старого лопинавира до современного дарунавира. Основной недостаток препаратов этого класса — высокая степень перекрестной устойчивости: если вирус приобретает устойчивость к одному препарату, скорее всего, на него не подействует ни один другой препарат из этого класса.
На последнем этапе (цифра 7 на схеме) вирусные частицы собираются из готовых компонентов (синтезированных клеткой вирусных белков и РНК), как конструктор, и покидают клетку-хозяина. Лекарств, которые бы тормозили эти процессы, пока не существует.
ВИЧ имеет высокую склонность к мутациям, что позволяет ему быстро приобретать устойчивость к лекарствам. Мутации изменяют форму молекул ферментов вируса. Если при этом форма изменится существенно, то фермент не сможет нормально работать и такой вирус размножаться перестанет — это вредная для вируса мутация. Однако в некоторых случаях — при полезных мутациях — форма молекулы фермента меняется не сильно, а так, что сам фермент продолжает нормально работать, но молекула лекарства уже не может с ним связаться.
Поэтому для эффективного подавления размножения ВИЧ обычно назначают три разных препарата из разных групп, влияющих на разные ферменты вируса, блокируя его воспроизводство на разных этапах. Исключением является группа ингибиторов обратной транскриптазы (НИОТ и ННИОТ) — эти лекарства связываются с разными участками молекулы вирусного фермента, поэтому могут назначаться вместе, несмотря на то, что относятся к одной группе. В условиях такой терапии вирусу очень трудно выработать устойчивость, потому что одновременно должно произойти несколько полезных мутаций в разных генах вируса, а это бывает крайне редко.
Есть несколько перспективных технологий, например, CRISPR/Cas9, которые могут позволить полностью удалить вирусную ДНК из организма человека, но пока ни одна из них не прошла все необходимые исследования для подтверждения эффективности и безопасности. Исследования продолжаются.
Исцеление – не то слово, которое часто используется в связи с термином "ВИЧ-инфекция". 35 лет прошло с момента обнаружения вируса и большую часть времени врачи рассматривали полное выздоровление скорее как фантазию, а не возможную перспективу. Всю потому, что ВИЧ не похож ни на один другой вирус. Он уничтожает те самые иммунные клетки, которые предназначены для того, чтобы с ним бороться. Он разрушает иммунную защиту месяцами, а иногда – годами.
На сегодняшний день с заболеванием живут 37 млн человек по всему миру. Однако сегодня ученые больше понимают о том, как вирус "скрывается" в клетках организма и почему наша бдительная иммунная система "не замечает" его.
Национальные институты здравоохранения (NIH) США финансируют усилия по лечению ВИЧ, а фонды – например AmfAR – ищут ресурсы, которые позволят полностью искоренить эпидемию.
"Абсолютно точно, что ВИЧ можно излечить, – говорит Ровена Джонстон, вице-президент и директор по исследованиям AmfAR. – Вопрос на миллиард долларов: "Как это сделать?".
Профессор медицины из Медшколы при Университете Джона Хопкинса Роберт Силичано одним из первых идентифицировал резервуары ВИЧ.
"Проблема в том, что такая форма ВИЧ не видна иммунной системе и на нее не влияют лекарственные препараты", – говорит Силичано. По словам доктора, вирус покидает свою укреплённую башню и идёт на штурм лишь тогда, когда человек перестаёт принимать лекарства.
В одном из докладов, которые представили на конференции по ретровирусам и оппортунистическим инфекциям 2018 года в Бостоне, исследователи обнаружили убедительные доказательства того, что резервуары могут быть активированы и устранены, по крайней мере – у животных. Дэн Барух и его коллеги из Медицинского центра Beth Israel Deaconess и Гарвардской медицинской школы показали, что препарат, который стимулирует иммунную систему и активирует резервуары, в сочетании с мощным антителом может нейтрализовать ВИЧ у инфицированных обезьян на полгода.
"Я думаю, что наши данные повышают вероятность получить препарат для полного вызоровления. Это возможно", – заявил Барух.
Такой метод в научной среде называют shock and kill: он основан на "выталкивании" спящего вируса из резеруаров и последующем уничтожении. Это шаг к избавлению людей от пожизненной зависимости от АРВ-препаратов.
Этот метод еще не был протестирован на людях и вопрос полного выздоровления еще в процессе изучения. Исследователи напоминают, что на сегодняшний день единственным полностью излечившимся от ВИЧ человеком является "берлинский" пациент, которому пересадили костный мозг от донора с особой мутацией, которая не позволяет вирусу иммунодефицита "прикрепляться" к клеткам. Браун прекратил прием АРВ-препаратов после пересадки. Прошло уже больше 10 лет и его тест на ВИЧ остаётся отрицательным.
[Подробнее об излечении Тимоти Рэя Брауна – в материале СПИД.ЦЕНТРа]
Случай Брауна доказывает, что полное выздоровление возможно, но врачи дожны добраться до "каждого закутка" организма, где может прятаться вирус, говорит доктор Стивен Дикс, профессор медицины Калифорнийского университета в Сан-Франциско.
Сейчас некоторые исследователи даже полагают, что возможно полностью реконструировать иммунную систему человека, чтобы она была способна успешно устранить любой вирус. Этим уже пользуются онкологи в борьбе с опухолями: иммунную систему программируют таким образом, что та сама атаковала злокачественные клетки.
"Я настроен оптимистично, поскольку параллели в терапии ВИЧ-инфекции и онкологии настолько тесны, что мы сможем применять товые технологии и в терапии ВИЧ", – говорит Дикс.
Никто из специалистов не ожидает, что ВИЧ будет побежден в следующем году или ближайшие пару лет. Но они более чем уверены, что в будущем мы победим эпидемию.

Борьба с вирусом иммунодефицита человека (ВИЧ) не прекращается, и пока он остается нерешенной проблемой человечества. Современные методы лечения продлевают жизнь инфицированных людей практически до продолжительности жизни здоровых, но при этом они лишь подавляют репликацию вируса, не позволяя добиться полного излечения. Некоторая доля зараженных ВИЧ клеток не погибает и становится латентным (скрытым) резервуаром вируса. Ученые из США разработали специальные антитела, направляющие цитотоксичные Т-клетки на атаку латентных ВИЧ-клеток. Перспективы прямого применения этого подхода не очевидны, но полученные результаты могут оказаться важным шагом на пути разработки средств и методов полного излечения от СПИДа.
По данным Всемирной организации здравоохранения, на конец 2014 года с момента определения вируса иммунодефицита человека в 1981 году в мире заразились ВИЧ-инфекцией более 70 миллионов человек. Из них более 35 миллионов умерли, почти 37 миллионов живут инфицированными. Из-за широкого распространения и относительно быстрого роста числа зараженных ВИЧ присвоен статус пандемии (см. Epidemiology of HIV/AIDS). Особенно широко ВИЧ распространен на юге Африки (в некоторых странах этого региона, например в ЮАР и Ботсване, заражено больше 20% населения). В России, по данным на начало 2016 года, зафиксировано около миллиона ВИЧ-инфицированных, но по статистике только около половины больных знает о том, что они заражены ВИЧ, так что реальная картина может оказаться гораздо хуже.
ВИЧ заражает клетки иммунной системы и перестраивает их функции под свои потребности. В результате иммунная система подавляется и развивается синдром приобретенного иммунного дефицита (СПИД). Организм больного теряет возможность защищаться от инфекций и опухолей. Без лечения человек, зараженный ВИЧ, погибает в течение 9–11 лет от так называемых оппортунистических заболеваний, с которыми здоровый организм обычно успешно справляется.
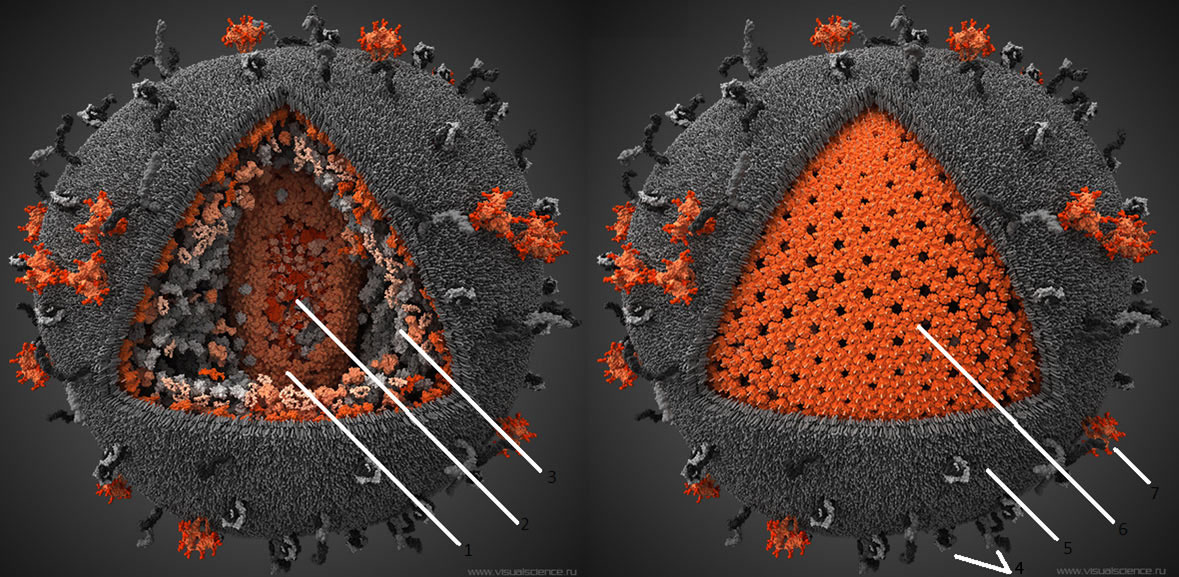
ВИЧ во внешней среде нестабилен и передается только через кровь или биологические жидкости. Заражение происходит через поврежденные кожу и слизистые оболочки или при медицинских процедурах. В цикле репродукции ВИЧ вирусная РНК с помощью вирусной обратной транскиптазы превращается в ДНК и включается в геном клетки (рис. 2). Затем она транскрибируется в РНК, которая направляет синтез вирус-специфических белков, обеспечивающих размножение вируса и формирующих вирусную частицу, которая затем отпочковывается от клетки.

На разработку вакцин против ВИЧ были брошены значительные силы и средства, но об окончательной победе остается только мечтать. Причины неудач — в удивительной способности вируса изменять иммунологические свойства и таким образом уклоняться от действия антител, индуцированных вакциной.
Впрочем, в последние годы достигнут значительный прогресс в поддержании качества жизни больных СПИДом. Применение высокоэффективной комбинированной терапии, направленной против вирусных обратной транскриптазы и протеазы, при условии своевременного диагноза заражения позволяет продлить жизнь инфицированных людей практически до продолжительности жизни здоровых. Но некоторая доля клеток, зараженных ВИЧ (примерно одна из миллиона), не погибает и остается латентным резервуаром вируса, в котором ДНК ВИЧ интегрирована в геном, — и если противовирусную терапию прекратить, резервуар может активироваться и болезнь возобновится. Поэтому терапию приходится продолжать на протяжении всей жизни зараженного человека. Но противовирусная терапия стоит весьма дорого и может быть сопряжена с нежелательными побочными эффектами. Поэтому разработка подходов для ликвидации ВИЧ-резервуаров весьма актуальна и с медицинской, и с экономической точки зрения.
Недавно два коллектива исследователей, независимо друг от друга, практически одновременно опубликовали статьи, в которых описали оригинальный подход для ликвидации латентных ВИЧ-клеток. Обе статьи подготовлены научными коллективами из США. В обсуждаемых работах сделана попытка подойти к решению этой проблемы с помощью биспецифических антител (bi-specific antibodies).
Разработку биспецифических антител можно считать одним из наиболее важных достижений последнего времени в иммунологии и медицине, особенно в лечении онкологических заболеваний. Такой подход к лечению стали изучать в середине 80-х годов ХХ века, и довольно быстро исследования in vitro показали, что у него большой потенциал. В отличие от обычных природных антител (рис. 3), биспецифические антитела представляют собой искусственные белковые конструкции состоящие из фрагментов двух различных антител (рис. 4) и поэтому связывающиеся с двумя различными антигенами. Наиболее часто и успешно они используются для лечения рака. В этих случаях они чаще всего устроены так, что связывают цитотоксические Т-клетки (T-киллеры) иммунной системы (по их поверхностному антигену CD3) с раковыми клетками-мишенями, подлежащими уничтожению (по их поверхностному антигену).





Рис. 6. А, B — схема строения искусственно сконструированных биспецифических антител к антигену CD3 цитотоксических Т-клеток и поверхностному антигену ВИЧ; вариабельный домен из тяжелой белковой цепи (VH) соединен с вариабельным доменом из легкой цепи (VL). C — схема атаки клеток, зараженных ВИЧ. Изображение из обсуждаемой статьи J. Sung et al.
Авторы обеих работ полагают, что созданные ими биспецифические антитела потенциально могут стать эффективным иммунотерапевтическим средством для истребления латентных резервуаров ВИЧ. И научное сообщество, и общество в целом должны приветствовать и поддерживать исследования, направленные на полное излечение от ВИЧ. Но в данном случае перспективы клинического применения описанного подхода пока не вполне очевидны, необходимы дополнительные детальные исследования. Описанные исследования проводились in vitro, и неизвестно, в какой мере достигнутые эффекты будут иметь место в организме. Известно, что иммунотерапия с помощью чужеродных антител вызывает в организме иммунный ответ, направленный против этих антител. И такой побочный эффект действительно наблюдался группой A. Pegu et al. в опытах на обезьянах.
Агент, который бы индуцировал продукцию антигенов ВИЧ в латентно зараженных клетках, не повреждая при этом здоровые клетки, пока неизвестен. Более того, латентные резервуары ВИЧ могут находиться, например, в центральной нервной системе, куда проникновение белковых молекул затруднено из-за наличия гематоэнцефалического барьера. В общем, до применения полученных результатов пока очень далеко, и необходимо провести еще много исследований. Тем не менее, обсуждаемые работы представляются важным шагом на пути разработки средств и методов полного избавления от ВИЧ.
Источники:
1) Julia A. M. Sung et al. Dual-Affinity Re-Targeting proteins direct T cell-mediated cytolysis of latently HIV-infected cells // The Journal of Clinical Investigations. 2015. V. 125. P. 4077–4090.
2) Amarendra Pegu et al. Activation and lysis of human CD4 cells latently infected with HIV-1 // Nature Communications. 2015. V. 6. Article number: 8447.
3) Douglas D. Richman. HIV: Cure by killing // Nature. 2015. V. 528. P. 198–199. (Популярный синопсис к обсуждаемым статьям.)
Вячеслав Калинин
Снеер 17.02.2016 12:32 Ответить
ВИЧ/СПИД - РЕАЛЬНОСТЬ ИЛИ ВЫМЫСЕЛ?
Борьба со СПИДом идёт во всём мире уже более 30 лет. Однако, есть и такое мнение, что вируса иммунодефицита человека не существует в природе, и поэтому вся эта борьба совершенно бессмысленна.
Это альтернативное мнение разделяют тысячи людей по всему миру, включая известных учёных, врачей, журналистов, а также тех, кто лично столкнулся с этой проблемой, получив диагноз ВИЧ-инфекция, или этот диагноз был поставлен их близким.
Большинству людей практически ничего не известно об этом альтернативном мнении. И когда им предлагают, а зачастую можно сказать навязывают пройти обследование на ВИЧ-инфекцию, они делают это, совершенно не зная о том, какие последствия может вызвать это обследование. Причём эти последствия могут оказаться весьма и весьма неприятными, и даже трагическими.
Противники официальной теории ВИЧ/СПИДа считают, что тестирование на ВИЧ необходимо немедленно прекратить, а также прекратить назначение ВИЧ-позитивным пациентам так называемой антиретровирусной терапии против ВИЧ. По их мнению, эта практика, основанная на ложной ВИЧ/СПИД-теории, не несёт населению ничего, кроме геноцида.
Чтобы каждый человек смог самостоятельно разобраться в этой проблеме, и сделать для себя свои собственные выводы, и решить, стоит ли ему когда-либо тестироваться на ВИЧ-инфекцию или принимать лекарственные препараты против ВИЧ, стоит ознакомиться с этим альтернативным мнением. Ниже по ссылкам Вы можете найти 6 книг, 6 статей и 6 фильмов, достаточно подробно раскрывающих это мнение.
Если ранее Вы были абсолютно уверены в истинности официальной ВИЧ/СПИД-теории, то Вам стоит обратить внимание на эти материалы, чтобы избежать возможных негативных последствий, связанных с тестированием на ВИЧ или приёмом антиретровирусной терапии.
protopop " />
Снеер 17.02.2016 15:40 Ответить
Grecko " />
Снеер 19.02.2016 22:04 Ответить
Докажите делом, сходите в центр ВИЧ-профилактики, введите себе пару кубиков инфицированной крови и ни в коем случае не начинайте антиретровирсную терапию. Если это всё "миф" и "заговор", то Вам ничего не грозит, кроме всемирного признания и Нобелевки за опровержение вирусной теории ВИЧ/СПИД. Как, слабО?
aa 19.02.2016 01:04 Ответить
Может не совсем по теме - но так, задумался. Мы все знаем, что человек не может жить без кожи. Не только человек, но всякий зверь, даже гидра имеет свою примитивную кожу. Если объяснения появления мембраны у клетки еще как -то есть, например, пропусканием ультразвука
через раствор - подобие "липосом". Но то далекое и очень далекое подобие реальной клеточной мембраны. А как же быть с многоклеточными? Неужели, появление "кожи" объясняется только через начальный "симбиоз"? Конечно, мы то знаем, что мир был сотворен Богом. Но иногда интересно немного пофантазировать и конечно, теория эволюции является подходящей.
Gli4i " />
aa 20.02.2016 18:21 Ответить
aa 19.02.2016 01:10 Ответить
Хотя, в наше время, наверно, даже школьнику ясно, что если человек говорит, что все появилось случайно, а сам не сможет "создать" даже блошиной лапки - то тот человек просто умничает, либо шутит.
Grecko 19.02.2016 22:02 Ответить
Но если ВИЧ постоянно мутирует, то а) в организме с большой вероятностью одновременно будут сосуществовать несколько генетически различных линий вируса, и как результат б) данные антитела либо не будут действовать вообще, либо будут быстро "выдыхаться" в силу "генетического убегания" вируса. По-моему, это гораздо более серьёзный барьер для их перспективы, чем гематоэнцефалический.
Читайте также:

