Вич и опухоль яичка
Обновлено: 24.04.2024
Эмбриональный рак — злокачественное новообразование из группы несеминомных герминогенных опухолей. Является наиболее частой герминогенной опухолью яичка (40% от всех герминогенных опухолей и 87% несеминомных в структуре заболеваемости).
К герминогенным ракам относятся опухоли, развивающиеся из клеток-предшественников высокоспециализированного герминогенного эпителя половых желез. Один из подвидов этой группы злокачественных новообразований — семинома, злокачественная опухоль, построенная из герминогенного атипичного эпителия. Остальные — собственно эмбриональный рак, тератома и хорионкарцинома — относятся к несеминомным опухолям. Опухолевый узел может содержать как морфологические признаки только одного вида рака, так и сочетания структур различных новообразований. Только 2,3-16% опухолей являются чистым эмбриональным раком.
Причины развития эмбрионального рака
Этиология до сих пор неизвестна. Фактором риска развития эмбрионального рака считается наследственность — наблюдения показывают, что риск выше у тех лиц, братья или сёстры которых также болеют этим видом рака. Кроме того эмбриональный рак может быть ассоциирован с пороками развития гонад, например, крипторхизмом или дисгенезией гонад. Кроме того, предрасполагающим фактором может быть синдром Кляйнфельтера, так как одним из его морфологических проявлений является атрофия гонад и нарушение сперматогенеза. Наконец, определенную роль играет гормональный фон — в частности, продолжительный прием препаратов эстрогена матерью в период беременности.
В каких органах возникает эмбриональный рак
Эмбриональный рак может локализоваться как в половых железах (яичках или яичниках), так и вне них — в пресакральной области, забрюшинном пространстве, средостении, в сосудистых сплетениях желудочков головного мозга, в области шишковидного тела, в полости носа и челюстях. Такая широкая вариативность расположения эмбрионального рака объясняется возможной задержкой зачатков герминогенного эпителия при его миграции из стенки желточного мешка к месту закладки гонад на 4-5 неделе эмбрионального развития.
Диагностика
Клиническая картина заболевания определяется локализацией процесса, морфологическим строением опухоли и возрастом пациента. Наиболее частыми жалобами являются увеличение размеров пораженного органа или лимфатических узлов и болевой синдром. Могут быть, в зависимости от локализации опухолевого узла, жалобы на затрудненное мочеиспускание, кишечную непроходимость, появления клинических признаков сдавления органов средостения или поражения центральной нервной системы.
Из инструментальных методов диагностики больным с подозрением на эмбриональный рак показаны следующие:
- УЗИ области первичной опухоли и регионарных лимфоузлов,
- Рентгенография или КТ органов грудной клетки для исключения метастатического процесса в лёгких и поражения средостения,
- Магнитно-резонансная томография или УЗИ брюшной полости, малого таза, печени.

Большое значение имеют данные лабораторной диагностики:
- Альфа-фетапротеин (АФП). АФП является онкофетальным маркером, то есть в норме вырабатывается только тканями плода. Уровень АФП в сыворотке крови повышается у 60−70% мужчин с несеминомными опухолями яичек, особенно при наличии метастазов. При несеминомном раке отмечается прямая связь между частотой выявления увеличенного уровня АФП и стадией заболевания.
- Хорионгонадотропин человека (ХГЧ). При чистом эмбриональном раке сывороточный уровень ХГЧ не увеличен, но поскольку чистый эмбриональный рак встречается довольно редко, то наличие структур, связанных с другими гистологическими вариантами несеминомного рака, или же наличие синцитиотрофобласта могут приводить к повышению данного маркера.
- Лактатдегидрогеназа (ЛДГ). У пациентов с метастатической болезнью рекомендуется дополнительно определять уровень ЛДГ, так как она является маркером тканевой деструкции. ЛДГ характеризуется меньшей специфичностью, но его концентрация пропорциональна объему опухоли, поэтому его уровень может быть косвенным маркером распростраённости опухолевого процесса.
- Также может быть повышен уровень онкомаркера СА19-9.
Увеличение уровней этих маркеров встречается в 51% случаев опухолей яичка. АФП повышен у 50–70%, ХГЧ — у 40–60% пациентов с несеминомными герминогенными опухолями яичка. Таким образом, нормальный уровень маркеров не исключает диагноза герминогенной опухоли.
При иммуногистохимическом исследовании часто определяется маркер CD30 (но его уровень может падать после проведенной химиотерапии), а p53 позитивен в половине случаев эмбрионального рака.
Гистологическое строение эмбрионального рака многообразно. Выделяют следующие подтипы эмбрионального рака:
- Взрослого типа,
- Юношеского типа,
- Полиэмбриому.
Эти подтипы могут сочетаться между собой или с другим герминогенным раком в одном опухолевом узле.
Эмбриональный рак взрослого типа наиболее часто локализуется в яичках, дебютирует в возрасте 20-30 лет. Рак юношеского типа также локализуется преимущественно в яичках, но диагностируется обычно у детей в возрасте от 3 месяцев до 3 лет.
Эмбриональный рак, особенно взрослого типа, отличается высокой степенью злокачественности, что и обуславливает его высокую химиочувствительность.
Течение заболевания
Средний возраст пациентов на момент выявления заболевания — 25-32 лет, но эмбриональный рак может быть диагностирован и у детей, так как предпосылки к его развитию формируются ещё на этапе эмбрионального развития. Эмбриональный рак характеризуется очень быстрым ростом — у 10% пациентов на момент диагностики рака уже выявляются метастазы. Наиболее часто поражаются забрюшинные лимфатические узлы, а у 20% пациентов выявляется поражение наддиафрагмальных лимфоузлов; также могут быть поражены надключичные лимфоузлы и лимфоузлы средостения. Эмбриональный рак метастазирует также гематогенно — в лёгкие и печень, реже в кости и головной мозг.
Лечение
Эмбриональный рак требует комплексного подхода к лечению, в основе которого лежит операция, которая имеет не только куративное, но и диагностическое значение, так как позволяет получить весь опухолевый узел в качестве материала для гистологического и иммуногистохимического исследований.
Требуемые методики лечения эмбрионального рака и их последовательность определяются стадией и прогнозом заболевания.
- При I стадии на первом этапе лечения рака показано хирургическое лечение. Если послеоперационное гистологическое исследование не выявило сосудистой или лимфатической инвазии, то пациент может быть оставлен под наблюдением; в противном случае увеличивается риск развития рецидива, поэтому может быть назначено 1-2 курса полихимиотерапии по схеме BEP, или же, в случае отказа, профилактическое нервосберегающее удаление забрюшинных лимфоузлов.
- При IIА стадии заболевания, когда в забрюшинных лимфатических узлах уже определяются метастазы, но их размер менее 2 см, также рекомендуется начать комбинированное лечение с хирургического метода. Но в этой клинической ситуации основным методом лечения рака является химиотерапия. Выбор терапии осуществляется на основе прогностической классификации IGCCCG (см. ниже): больным с благоприятным прогнозом показано проведение 2-3 курсов полихимиотерапии по схеме ВЕР или 4 курса ЕР, а больным с промежуточным и неблагоприятным прогнозом необходимо назначить 4 курса химиотерапии по схеме BEP. Альтернативой химиотерапевтическому лечению является удаление забрюшинных лимфоузлов или же является выполнение КТ в динамике при условии проведения химиотерапии при появлении признаков прогрессирования заболевания.
- При IIB стадии заболевания, для которой характерны метастазы в забрюшинных лимфатических узлах размером 2-5 см, допустимо использование той же схемы лечения, что и при IIA стадии, если уровень опухолевых маркеров нормальный, а метастазы в лимфоузлах малочисленны, не проявляют себя симптоматикой и локализуются в одной зоне. При множественных симптомных метастазах показано проведение 2-3 курсов полихимиотерапии по схеме ВЕР а при повышенном уровне опухолевых маркеров химиотерапия проводится сообразно прогностической группе.
- IIC и III стадии требуют химиотерапевтического лечения согласно тому, к какой прогностической группе по классификации IGCCCG отнесен пациент.
Отдельно хотелось бы остановиться на лечении рецидивных опухолей. Согласно рекомендациям Европейской Ассоциации Урологов, в случае, если рецидив произошёл при изначальной I стадии заболевания, лечение начинается с химиотерапии (3–4 курса BEP (или VIP)), и только после её завершения проводится хирургическое удаление опухоли при ее наличии. Рекомендации RUSSCO допускают выполнение хирургического лечения при его технической возможности на первом этапе, так как удаление рецидивной опухоли позволит провести гистологическое исследование на большом количестве материала. Для химиотерапевтического лечения рекомендуются иные схемы, нежели при лечении первичного рака, — TIP, VeIP. При поздних рецидивах, которые возникают в срок более 2 лет после завершения первичного лечения, отмечается низкая их чувствительность к химиотерапии, поэтому основным методом лечения становится хирургический.

Возможные осложнения проводимого лечения
При лечении эмбрионального рака встречаются типичные для хирургического и химиотерапевтического методов лечения осложнения, и хотелось бы отдельно выделить характерные осложнения лечения именно для этой патологии:
- Как уже упоминалось ранее, при ранних стадиях эмбрионального рака, особенно локализованного в яичке, одним из возможных методов лечения может быть удаление забрюшинных лимфоузлов — с профилактической или, при их поражении, лечебной целью. Осложнением этой операции является развитие ретроградной эякуляции, имеющей место в 3–8% случаев даже при выполнении нервосберегающей операции. Пациент должен быть предупрежден о риске развития такого осложнения при разработке тактики лечения.
- Проводимая химиотерапия может вызвать угнетение сперматогенеза. Несмотря на то, что в 50% это обратимое состояние, следует рассмотреть вопрос о возможности криоконсервации спермы.
Динамическое наблюдение
Пациенты с эмбриональным раком после завершения активного лечения нуждаются в активном динамическом наблюдении. Оно включает в себя определение уровней маркеров АФП и ХГЧ, выполнение рентгенографии грудной клетки и УЗИ забрюшинного пространства с периодичностью:
- каждые 4-6 недель в течение первого года,
- каждые 2 месяца в течение второго года,
- ежеквартально — на третьем году
- и далее каждые полгода до 5 лет.
Такое наблюдение показано больным с опухолями яичка после проведения хирургического лечения, а также больным с диссеминированным процессом, у которых установлена полная или частичная регрессия на фоне проведенной химиотерапии и операции. Столь интенсивный мониторинг, особенно в первый год, объясняется тем, что около 80% рецидивов заболевания возникают именно в этот период. Такой подход позволяет выявить прогрессирование на ранних стадиях, что улучшает результаты последующего лечения.
Прогноз
В общем и целом, эмбриональный рак характеризуется благоприятным прогнозом, но выживаемость может варьировать в зависимости от течения заболевания. Так, согласно классификации International Germ Cell Cancer Collaborative Group (IGCCCG), выделяются три группы сообразно прогнозу заболевания:
- Благоприятный прогноз. К этой группе относится около 56% больных несеминомными раками, пятилетняя общая выживаемость составляет 92%. Характерны локализация первичной опухоли в яичке или забрюшинном пространстве, отсутствие метастазов вне лёгких и следующие лабораторные показатели: АФП < 1000 МЕ/мл, ХГЧ < 5000 мМЕ/мл и ЛДГ превышает верхнюю границу нормы не более, чем в 1,5 раза.
- Промежуточный прогноз. К этой группе можно отнести до 28% больных, 5-летняя общая выживаемость составляет 80%. У пациентов этой группы также наблюдается локализация первичной опухоли в яичке или забрюшинном пространстве, отсутствие метастазов вне лёгких, но лабораторные показатели уже выше по сравнению с группой благоприятного прогноза: АФП 1000–10000 МЕ/мл и/или ХГЧ 5000–50000 мМЕ/мл и/или ЛДГ превышает верхнюю границу нормы в 1,5–10 раз.
- Неблагоприятный прогноз. К данной группе относится наименьшее количество больных несеминомными раками, 5-летняя общая выживаемость составляет всего 48%. У этих пациентов первичная опухоль располагается в средостении и\или уже дала метастазы в другие органы, кроме лёгких; также эти аспекты могут сочетаться со следующими лабораторными показателями АФП > 10000 МЕ/мл и/или ХГЧ > 50000 мМЕ/ мл и/или ЛДГ превышает верхнюю границу нормы более чем в 10 раз.
В зависимости от стадии, на которой был выявлен эмбриональный рак, общая выживаемость пациентов составляет:
- при I стадии — 95%,
- при II стадии — 80%,
- при III стадии — 70%,
- при IV стадии — 55%.
Кроме того, неблагоприятными факторами прогноза являются разрыв опухоли и её химиорезистентность. Рецидивная опухоль также характеризуется худшим прогнозом заболевания.
Наконец, прогноз различается в зависимости от гистологического подтипа — эмбриональный рак юношеского течения имеет относительно благоприятное течение, при эмбриональном раке взрослого типа — прогноз наименее благоприятный.
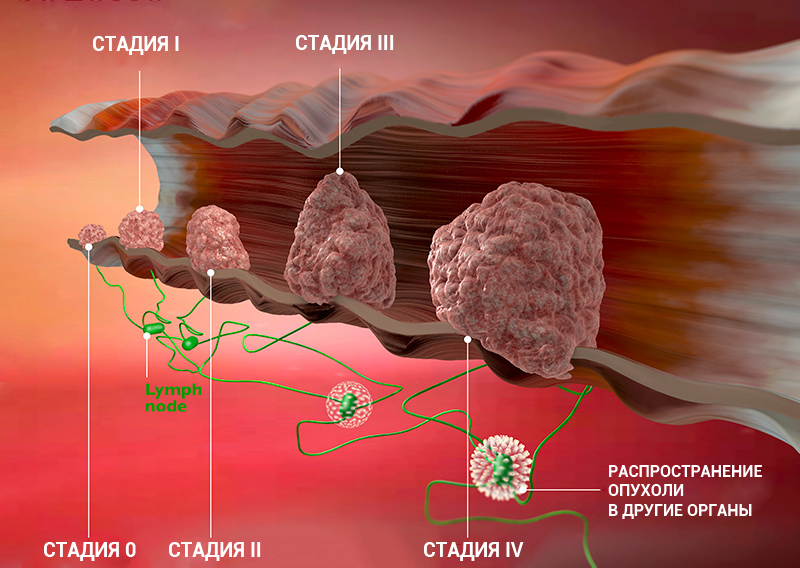
Стадия онкологического заболевания дает информацию о том, насколько велика опухоль и распространилась ли она по организму. Это помогает врачам определять прогноз пациента и план лечения.
С помощью врача-онколога, резидента Высшей школы онкологии Сергея Югая разбираемся, как врачи устанавливают стадии рака и что каждая из них означает.
На что влияет стадия онкологического заболевания?
Стадирование нужно, чтобы спрогнозировать, какие у пациента шансы на выздоровление, а также чтобы определить, какой метод лечения будет наиболее эффективен в конкретном случае, — поясняет Сергей Югай.
Все начинается с медицинского осмотра и обследований — УЗИ, КТ, МРТ, ПЭТ-КТ и других методов в зависимости от вида рака. Затем врач берет кусочек опухоли — биопсию или удаляет опухоль целиком во время операции, а после отправляет материал на гистологический анализ, чтобы поставить диагноз.
Стадии рака по TNM-классификации
Стадии онкологического процесса описывают разными способами — это зависит от вида опухоли. Один из самых распространенных способов — стадирование с помощью TNM-классификации.
Т характеризует первичную опухоль, ее размеры и вовлечение окружающих структур в опухолевый рост, например, прорастание в стенку кишки или желудка. N говорит о наличии в лимфоузлах метастазов и количестве пораженных лимфоузлов, а М — о наличии отдаленных метастазов (во внутренних органах, костях, ЦНС или лимфоузлах, которые расположены далеко от первичной опухоли), — объясняет Сергей Югай.
Индекс Т принимает значения от 0 до 4. 0 означает, что первичная опухоль не обнаружена, 1 — опухоль маленькая, а 4 — опухоль проросла в прилегающие ткани. Таким образом, чем больше цифра рядом с Т, тем ситуация сложнее. При некоторых видах рака N принимает значение 0 или 1, при других — 0, 1 или 2, а иногда — 0, 1, 2 и 3. 0 означает, что опухоль не проникла в ближайшие лимфоузлы, а 3 — что поражено множество лимфоузлов. M0 показывает, что метастазов нет, а 1 — что метастазы есть.
Онкологи выставляют стадию по TNM клинически — до операции или когда операция не планируется и патоморфологически — при изучении удаленной во время операции опухоли, — объясняет Сергей.
От правильной стадии зависит тактика лечения. Например, пациент — мужчина с раком желудка и стадией cT1N0M0. Это значит, что опухоль прорастает в слизистую и подслизистый слой стенки желудка. В этом случае пациенту показана операция. Если же стадия выше (cT2N1M0, например), то есть опухоль пациента прорастает в мышечный слой, и есть метастазы в лимфоузлах, то может понадобиться химиотерапия перед операцией, которая позволит улучшить результаты лечения, — добавляет Сергей.
Стадию рака могут обозначать с помощью цифр — 0, I, II, III, IV. Что это значит?
- Стадия 0 — предраковое состояние. Предрак почти всегда успешно лечится, вовремя проведенное лечение позволяет избежать развития онкологического заболевания. Следующие стадии обозначают уже онкологический процесс.
- Стадии I, II — чем выше цифра, тем больше размер опухоли, но ее клетки, скорее всего, еще не проникли в ближайшие лимфоузлы.
- Стадия III — опухоль растет и распространилась на окружающие ткани и/или лимфоузлы.
- Стадия IV — есть отдаленные метастазы.
Клинические стадии (0, I, II, III, IV) тесно связаны с системой TNM. Как правило, одна клиническая стадия включает в себя несколько вариантов стадирования по TNM. Эти варианты характеризуются схожими прогнозом и подходом к лечению. Например, стадии T1N3M0, T2N3M0, T3N2M0 рака легкого объединяются в IIIВ стадию, так как при любой из этих ситуаций пациент будет иметь примерно одинаковый прогноз и тактику лечения. В этом конкретном примере необходима химиолучевая терапия, а не операция, — комментирует Сергей Югай.
Меняется ли стадия после лечения, при прогрессировании заболевания?
Нет, стадия выставляется один раз. Но есть нюансы:
Например, мы хотим посмотреть, как опухоль ответила на лечение, чтобы понять, можно ли делать операцию. После лечения опухоль уменьшилась, и мы добавляем к стадии новые данные. При прогрессировании опухолевого процесса первоначальная стадия также остается прежней, но, к сожалению, прогноз будет менее благоприятный. Например, у человека II стадия рака желудка. Он прооперирован, и прогноз у него хороший. Через 2 года врачи обнаруживают у пациента метастазы в легких. Стадия остается II, но рак у пациента уже метастатический, что очень усложняет положение, — говорит Сергей.
Бывает, что люди сравнивают свою ситуацию с историями других пациентов. Если речь идет о разных онкологических заболеваниях, то такие сравнения некорректны — это заболевания с разными прогнозами и схемами лечения:
Например, с нейроэндокринным раком поджелудочной железы люди могут жить десятилетиями, а при метастатической стадии рака поджелудочной железы — полгода или год, — объясняет врач-онколог.
Тем не менее, в последние десятилетия адекватная противовирусная терапия позволила не только улучшить результаты противоракового воздействия, но и в разы уменьшить вероятность развития злокачественного процесса у ответственного пациента.
Когда при ВИЧ появляются злокачественные опухоли
Рак и другие злокачественные опухоли развиваются при переходе ВИЧ-инфекции в позднюю стадию болезни, когда концентрация иммунных клеток устремляется к минимальной, позволяя активно и почти беспрепятственно размножаться разнообразной микрофлоре — от простейший и грибов до бактерий и вирусов.
Всё, что происходило в организме инфицированного пациента ранее, было обычной ВИЧ-инфекцией, появление рака или других опухолей, а также тяжёлых распространённых инфекций — это уже СПИД.
Благодаря лечению период от заражения вирусом иммунодефицита до последней стадии болезни растянулся почти на три десятилетия, тогда как в конце 1980-х годов занимал несколько лет.
Какие раки развиваются при ВИЧ-инфекции
В конце ХХ века выявление определённых, практически не встречающихся при нормальном иммунитете заболеваний и злокачественных процессов, позволяло ставить диагноз ВИЧ/СПИД без сложных лабораторных исследований. Такие процессы обозначили как ассоциированные с вирусом иммунодефицита или, по-современному, СПИД-индикаторные. В этот список наряду с необычными инфекциями включены инвазивный рак шейки матки, саркома Капоши и злокачественные лимфомы, вероятность которых у инфицированного пациента возрастает в сотни раз.
Значительно чаще, но не в сотни раз, при ВИЧ-инфекции вероятно развитие плоскоклеточного рака анального канала и рака вульвы, карциномы лёгкого и злокачественных опухолей яичка, плоскоклеточного рака головы и шеи, меланомы и рака кожи.
Для большинства злокачественных процессов доказана основополагающая патогенетическая роль вирусов, в первую очередь, папилломы человека (ВПЧ) и гепатита В, С и D. Способствует раннему развитию злокачественных новообразований носительство вирусов герпеса, особенно 4 типа — вируса Эпштейна-Барр. Традиционно значимы у ВИЧ-инфицированных факторы риска злокачественного перерождения клеток бронхолегочной системы — курение и наследственная предрасположенность.
Как ВИЧ-инфекция влияет на течение рака
Однозначно — очень неблагоприятно, усугубляя скорость прогрессирования и увеличивая массив опухолевого поражения. И хотя рак у ВИЧ-инфицированного пациента возникает много раньше, чем в общей популяции, практически в молодом возрасте, пациенты не могут похвастать исходным хорошим здоровьем.

Как ВИЧ сказывается на переносимости химиотерапии
В большинстве случаев злокачественный процесс на фоне ВИЧ-инфекции течёт агрессивнее, поэтому на первом этапе требует системного лечения с использованием противоопухолевых препаратов, гарантирующих разнообразный спектр токсических реакций. При этом ни в коем случае нельзя отказываться от специфической противовирусной терапии, также изобилующей неблагоприятными проявлениями.
В итоге переносимость противоракового лечения, проводимого на фоне ВААРТ, ухудшается, а продолжительность жизни пациентов не в пример короче, чем это могло быть в отсутствии ВИЧ. При активной противоопухолевой и противовирусной терапии больше года после выявления опухоли живёт только каждый четвёртый, пятилетку — всего 19%.
Существует ещё одна серьёзная проблема — клинического изучения эффективности противоопухолевой терапии у ВИЧ-инфицированных не проводится из-за малочисленности групп пациентов и, следовательно, сомнительной достоверности результатов. Поэтому очень важно в этот тяжёлый период найти клинику и специалистов одинаково высоко компетентных в вопросах лечения ВИЧ и противораковой химиотерапии.
Как лечат рак у ВИЧ-инфицированных
В большинстве случаев терапия рака не должна отличаться от таковой у пациентов с нормальными показателями иммунитета.
При технической возможности хирургической операции ВИЧ-пациенту от неё нельзя отказываться, поскольку излечение возможно только при удалении всех очагов рака. Если для злокачественной опухоли лимфатической системы признана необходимость высокодозной химиотерапии с трансплантацией стволовых клеток, то и инфицированный вирусом пациент должен получить программное лечение. При раке шейки матки практически невозможно обойтись без лучевой терапии.
ВИЧ-компрометированному пациенту потребуется ВААРТ и гораздо более серьёзное сопроводительное лечение. Чтобы провести химиотерапию без сокращения доз и интервалов необходима индивидуальная программа реабилитационного воздействия. Кроме того, пациент должен получать множество препаратов для лечения грибковых поражений и сдерживания вирусов герпеса, разнообразные антибактериальные средства, каждое из которых имеет собственную токсичность.

Такое комплексное воздействие способна осуществить только команда врачей разных специальностей, блестяще ориентированная как в потребностях онкологического пациента, так и в возможностях организма инфицированного.
Рак в яичке тоже бывает, но это особый эмбриональный рак, развивающийся у взрослого мужчины из эпителия гонад, его относят к герминогенным злокачественным опухолям яичка. Предполагается, что герминогенные опухоли закладываются ещё в период эмбрионального развития в утробе матери, когда в первую половину беременности половая клетка плода приобретает злокачественный потенциал.
Злокачественные опухоли яичка не очень часты, на их долю приходится не более 2% от всех злокачественных новообразований, но последние 2–3 десятилетия они демонстрируют удвоение заболеваемости. Россияне болеют злокачественными опухолями яичка раза в 4 реже европейцев, правда, по скорости ежегодного прироста заболеваемости опухоли прочно вышли в топ, занимая второе место. Благо, что на сегодняшний день от рака яичка, который совсем не рак, а другая злокачественная опухоль, излечивается до 90% больных.
Распространение их необъяснимо. Никто не скажет, почему испанцы и португальцы болеют в 5 раз реже датчан, и даже ближайшие к Дании северные соседи финны страдают раком яичка в 4 раза реже. К злокачественным опухолям яичка более склонны белокожие мужчины, для чернокожих они совсем не характерны. Главную озабоченность вызывает то, что болеют злокачественными опухолями яичка молодые мужчины от 15 до 44 лет.
При неуклонном росте заболеваемости, с 1970-х годов смертность от злокачественных опухолей яичка снизилась почти четырёхкратно. В ХХ веке смертность от опухолей яичка росла ровно до времени выхода на фармацевтический рынок препаратов платины, совершивших химиотерапевтическую революцию. Препаратам платины очень помогли новые диагностические методики, а особенно, определение опухолевых маркёров. Всё это в совокупности обеспечивает крайне низкую смертность: один на 300 тысяч мужского населения.
Причины развития и факторы риска опухоли яичка
Научившись лечить злокачественные опухоли яичка, ещё не вполне определились с факторами риска, приводящими к злокачественному росту. Во всяком случае, их несколько, но главного и ведущего не определено, правда, герминогенные опухоли уже серьёзно считают пороком эмбрионального развития.
В первую очередь предполагают неблагоприятное действие материнских эстрогенов на гонады плода мужского пола в первую половину беременности, когда идёт активное формирование половых желёз. Эстрогены, вроде бы, впрямую тормозят процесс опущения яичек в мошонку, неблагоприятно меняют половые клетки, подготавливая их к развитию предшественника всех злокачественных опухолей carcinoma in situ. Заметили, что выраженный токсикоз беременности или приём препаратов эстрогенов способствует увеличению рака яичка у сына.
Виновна в злокачественном росте и атрофия яичка, возникающая при крипторхизме, травме, инфекционном паротите — свинке. Атрофированное яичко производит мало тестостерона, поэтому главный регулятор эндокринной деятельности — гипоталамус увеличивает выработку гормонов-стимуляторов гонад, в ответ на которые начинается размножение половых клеток. Клетки сбиваются с правильного пути развития — мутируют, и появляется всё та же carcinoma in situ.
Не опустившееся в мошонку яичко — крипторхизм - пятикратно увеличивает вероятность рака, а двусторонний крипторхизм — в 10 раз. Так окончательно и не определились, помогает ли операционное низведение яичка избавиться от будущего рака или нет. С другой стороны, операционная травма тоже влияет, способствуя атрофии ткани яичка. Но точно известно, что в низведённом яичке развиваются совсем другие опухоли, нежели возникают в оставленном в брюшной полости яичке, прогноз их хуже.
Операционная травма при лечении паховой грыжи тоже увеличивает заболеваемость раком яичка, и просто повреждение органов мошонки не стоит в стороне.
В 2–4 раза увеличивается вероятность рака у сына, если папа болел злокачественной опухолью яичка. Отмечены случаи семейного рака яичка, особенно высока вероятность опухоли у родных братьев — в 8–10 раз чаще. У больных медицинские генетики находят дефекты 4, 5, 6 и 12 хромосом, в некоторых хромосомах генетический материал в избытке, в других — в недостатке. При многих других раках находят мутацию белка р53, в норме при повреждении клетки запускающего программу её гибели. Мутантный белок р53 позволяет повреждённой клетке выжить и размножаться, производить подобных себе. При злокачественных опухолях яичка белок р53 не только остаётся совершенно нормальным, но и вырабатывается в больших количествах, что, как считают, помогает высокой эффективности химиотерапии и облучения.
Родителей мальчиков всегда предупреждали, что осложнение эпидемического паротита (свинки) — вирусный орхит - может привести к раку яичка, но статистика этого не подтверждает и не отвергает. А вот ВИЧ-инфицирование увеличивает риск тестикулярного рака. Одно время с риском развития злокачественной опухоли яичка связывали высокий рост пациента, но пока не подтвердили и не отвергли.
Классификация. Виды опухолей яичка
Опухоли яичка по клеточному строению весьма разнообразны, но 90–95% их относится к компании герминогенных опухолей:
- внутриканальцевая неоплазия;
- опухоль желточного мешка;
- семинома;
- тератома;
- эмбриональный рак;
- смешанные опухоли
Остальные 5–10% составляют доброкачественные и злокачественные опухоли из клеток Лейдига или Сертоли, взрослые и ювенильные гранулёзоклеточные опухоли, тека-фибромы и смешанные.
Дающую начало раковой инвазии — проникновении клеток через ограничительную базальную мембрану — внутриканальцевую неоплазию (TIN) или carcinoma in situ часто находят в окружении опухоли яичка, и у 2–5% больных обнаруживают её даже в здоровом яичке, поэтому лечение её очень серьёзное. Поскольку четыре из 10 герминогенных опухолей — семиномы, а остальные — все прочие гистологические типы с одинаковым ответом на лечение, то клинически все герминогенные опухоли яичка (ГОЯ) делят на две группы: семиномы и несеминомы, которые лечатся по-разному.
Симптомы опухолей яичек
Пик несеминомных опухолей регистрируется после 20 лет, семиномы, как правило, проявляются после 30-летия. Одновременное поражение обеих яичек отмечается очень редко — один из сотни больных.
Первый и самый частый симптом — увеличение размеров яичка. Второй симптом — боли в месте развития метастазов из-за сдавления органа, а метастазы появляются чрезвычайно рано, разносит злокачественные клетки преимущественно лимфатическая жидкость. Метастазами поражаются забрюшинные лимфатические узлы в 90% случаев, что даёт не связанные с движением боли в пояснице, тогда как при радикулите боли возникают при движениях позвоночника.
Возможно сдавление мочеточника увеличенными лимфоузлами забрюшинного пространства, что приводит к застою мочи в почечной лоханке и блокировке работы почки. Лимфатические узлы могут нарушить отток крови по нижней полой вене, вызывая односторонний отёк ноги, не проходящий при приёме мочегонных. Метастазы в лимфатические узлы средостения способны инициировать одышку и кашель, но чаще эти симптомы дают метастазы в лёгкие, тоже очень частые.
Гранулёзоклеточные опухоли яичка могут вырабатывать женские гормоны, что отражается на внешности: утрачивается мужественность, прогрессирует гинекомастия — увеличение молочных желёз, как у женщин жировая клетчатка распределяется на бедрах, снижено либидо и возможна импотенция. Повышенную продукцию андрогенов гранулёзоклеточной опухолью у мужчины сразу не заметишь, разве что половое поведение меняется на крайне активное.
Диагностика рака яичка
Обычно, если во время осмотра врач обнаруживает в мошонке у пациента опухоль, первым делом он назначает УЗИ. Это быстрое и доступное исследование помогает визуализировать новообразование, определить его расположение, размеры, изучить внутреннюю структуру.
Проводят анализ на онкомаркеры: альфа-фетопротеин и хорионический гонадотропин человека. Их присутствие в крови свидетельствует в пользу рака яичка.
Если результаты ультразвукового исследования и анализов указывают на онкологическое заболевание, яичко удаляют и отправляют в лабораторию для цитологического и гистологического исследования. Удалять для биопсии только часть яичка нецелесообразно, так как это повышает риск распространения раковых клеток.
Если есть подозрение на отдаленные метастазы, назначают компьютерную томографию, магнитно-резонансную томографию (она особенно хорошо помогает обнаруживать очаги в головном и спинном мозге), позитронно-эмиссионную томографию, рентгенографию костей.
Вовремя обнаружить патологические изменения и обратиться к врачу помогут регулярные самостоятельные осмотры мошонки. Процедура довольно проста, ее можно проводить во время приема душа:
- Встаньте перед зеркалом и осмотрите мошонку. Проверьте, нет ли на ней припухлостей, покраснений.
- Ощупайте яичко большим пальцем, придерживая четырьмя остальными. В норме оно не должно быть увеличено, в нем не должно быть уплотнений и узелков, ощупывание не должно быть болезненным. Затем аналогичным образом ощупайте второе яичко.
Если вы обнаружили какие-либо патологические изменения, нужно обратиться к врачу. Но не стоит паниковать раньше времени: возможно, это не рак.

Лечение рака яичка
Основной метод лечения — хирургический. Яичко удаляют через разрез в паховой области. На его место можно вставить имплант: функции мужской половой железы он, ясное дело, выполнять не сможет, но косметический эффект обеспечит.
Если высока вероятность того, что раковые клетки распространились в близлежащие лимфатические узлы, последние тоже удаляют. Для предотвращения рецидива врач может назначить курс лучевой терапии или химиотерапии.
Лечение имеет некоторые побочные эффекты. Если хирург повредит нервы во время удаления лимфатических узлов, возникнут проблемы с эякуляцией. Химиотерапия и лучевая терапия вызывают бесплодие.
Прогноз при раке яичка
В первую очередь прогноз зависит от того, насколько сильно рак успел распространиться в организме. Все злокачественные опухоли яичка условно делят на три вида:
- Локализованные — в пределах яичка.
- Регионарные — успевшие прорасти в соседние органы и распространиться в близлежащие лимфоузлы.
- Распространенные — при наличии отдаленных метастазов.
Главным прогностическим показателем является пятилетняя выживаемость — процент пациентов, оставшихся в живых в течение пяти лет с момента диагностики заболевания. При разных стадиях рака яичка пятилетняя выживаемость составляет:
- При локализованных — 99%.
- При регионарных — 96%.
- При распространенных — 73%.
Помимо стадии, имеют значение и другие факторы, в частности, тип опухоли и уровни онкомаркеров в крови после удаления яичка.
Профилактика рака яичка
Эффективных способов профилактики заболевания не существует. При неопущении яичка — крипторхизме — требуется его низведение в мошонку хирургическим путем. Операция необходима по многим причинам, но неизвестно, помогает ли она снизить риск опухоли.
Читайте также:

