Вич т-хелперы т киллеры
Обновлено: 24.04.2024
6.3. ПАТОГЕНЕЗ ВИЧ-ИНФЕКЦИИ
В связи с тем что вирусы являются патогенами внутриклеточными, ка-ждый представитель мира вирусов имеет тропность к определенному типу клеток. Тропизм вируса определяется наличием на клетке-мишени рецептора для данного вируса, а также возможностью генома вируса встроиться в геном клетки. Рецепторы для определенного вируса могут быть на клетках различ-ных типов. Рецепторную функцию выполняют различные структуры (лиган-ды): белки, липиды, углеводные компоненты белков и липидов. Эти лиганды локализованы на плазматической мембране и выполняют важнейшие функ-ции жизнеобеспечения клетки – проникновение в нее гормонов, питательных веществ, факторов роста и регуляции и т.п.
Рецепторы, независимо от их биохимического строения, имеют общую структурную характеристику, а именно, состоят из участка, расположенного вне клетки, участка, локализованного внутримембранно, и участка, погру-женного в цитоплазму.
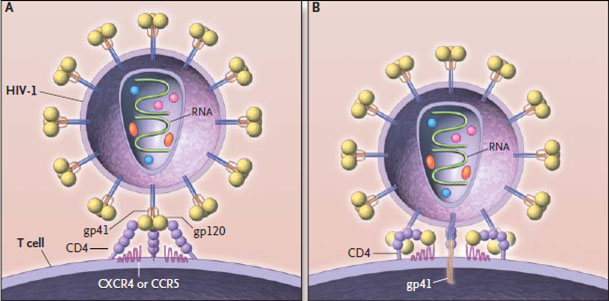
Рецепторами для ВИЧ являются дифференцировочный антиген CD4, а также неспецифические, не зависящие от наличия CD4 компоненты. CD4 -гликопротеид с молекулярной массой 55 000, по своему строению имеющий гомологии с определенными участками иммуноглобулинов. Аналогичные гомологии имеет и белок вируса gp120, что и определяет тропность ВИЧ. Фиксация вируса через gp120 ВИЧ-1 (или gp105 в случае инфицирования ВИЧ-2) с мембранным рецептором CD4 клетки хозяина блокирует основную функцию этих иммунокомпетентных клеток - восприятие сигналов от анти-генпрезентирующих клеток. Последующая за рецепцией репликация вируса ведет к гибели клеток, выпадению функции, ими выполняемой, развитию иммунодефицита.
В организме человека имеется целый ряд иммунокомпетентных, сома-тических и ряд других клеток, имеющих рецепторы для ВИЧ (CD4+ лимфо-циты, CD8+ лимфоциты, дендритные клетки, моноциты, эозинофилы, мега-кариоциты, нейроны, микроглия, сперматозоиды), и наблюдается цитопати-ческий эффект во многих из них в случае проникновения вируса.
В 1996 году Бергер открыл корецептор для ВИЧ. Этот рецептор вместе с CD4 опосредует инфицирование СО-вариантами ВИЧ-1, адаптированных к росту в Т-хелперах, но не в макрофагах. На сегодня известно около 10 хемо-киновых рецепторов.
Таким образом, выделены белки - хемокины, блокирующие проникно-вение ВИЧ в макрофаги с антигеном CD4, и белки - корецепторы, способст-вующие инфицированию. При этом корецепторы – это рецепторы для хемо-кинов, но их использует ВИЧ в качестве рецептора, с помощью которого проникает внутрь клетки.
Проникнув в СD4+ клетки, ВИЧ сразу же начинает репликацию, при этом, чем активнее CD4+ клетки, тем выше процесс репродукции вируса. Все регуляторы, активирующие СD4+клетки, обеспечивают увеличение реплика-ции вируса. К подобным регуляторам относятся фактор некроза опухолей (ФНО), фактор, стимулирующий колонии гранулоцитов/макрофагов, интер-лейкин-6 (ИЛ-6). К негативным регуляторам, тормозящим репликацию виру-са, относятся интерферон (ИФ) и трансформирующий фактор роста.
Морфофункциональные изменения в моноцитах/макрофагах оказыва-ют разнонаправленное действие не только на Т-лимфоциты, но и естествен-ные киллеры - главные клетки противоопухолевой защиты. Активность по-следних по мере прогрессирования заболевания неуклонно снижается. Дефи-цит ИЛ-2 и γ-интерферона даже при нормальном количестве NK-клеток ве-дет к снижению функциональной активности их у больных ВИЧ-инфекцией (Ковальчук Л.В., Чередеев А.Н.,1991).
Выделено два типа CD4+клеток: Т-хелперы-1 (Th1) и Т-хелперы-2 (Th2). Тh1 продуцируют цитокины, стимулирующие клеточный иммунитет, а Тh2 – цитокины, усиливающие антителогенез. Соотношение Тh1 и Тh2 взве-шенно и конкурентно; суперэкспрессия цитокинов одного типа клеток ведет к супрессии другого. У больных ВИЧ-инфекцией идет угнетение Тh1, чем обеспечиваются и вирусная патология, и онкогенез.
Жизненный цикл ВИЧ после проникновения в организм имеет после-довательный характер: связывание вириона с поверхностью клетки, слияние мембран вириона и клетки, проникновение вируса внутрь клетки, высвобож-дение нуклеотида и геномной РНК вируса, интеграция генома вируса в геном инфицированной клетки, латентная фаза, фаза активации транскрипции с ДНК провируса и последующая транскрипция белков вируса, наработка всех компонентов вируса с формированием новых вирионов и их высвобождени-ем из клетки, влекущим за собой гибель клетки-мишени (рис.6.4.).
Рис. 6.4. Стадии проникновения ВИЧ в клетку (Ледванов М.Ю., 1997).
Судьба ДНК-транскрипта генома ВИЧ, интегрированных в хромосому пораженной клетки, может быть различна. Она определяется активностью положительных и отрицательных регуляторных генов. Если активны все по-ложительные регуляторные гены, то происходит репродукция вируса со все-ми вытекающими отсюда последствиями – идет активация инфекции.
Если активны все отрицательные регуляторные гены, синтеза компо-нентов вириона не происходит, и инфекция не развивается.
Если активны положительные регуляторные гены белков суперкапсид-ной оболочки, происходит образование этих белков, и они экспрессируются на поверхности инфицированных клеток. Такие клетки способны взаимодей-ствовать с CD4 - рецепторами клеток организма и нарушать их функции. Та-ким образом, хотя репродукции вирусов не происходит, имеют место опре-деленные проявления инфекции.
Равным образом события развиваются при активности положительных регуляторных белков капсидной оболочки. Их повреждающее действие на клетки существенно ниже, но они индуцируют образование соответствую-щих антител.
Если же активны положительные регуляторные гены только геномных белков, то в пораженных клетках образуется обратная транскриптаза, которая довольно быстро разрушается.
Сродство вирусного мембранного гликопротеида gp120 (gp105 в случае ВИЧ-2) к клеточному рецептору CD4 определяет высокую степень избира-тельного поражения клеточных структур, поэтому в патологический процесс вовлекаются, в первую очередь, и в большей степени CD4+ лимфоциты, мо-ноциты крови, макрофаги тканей, дендритные клетки крови, лимфатических узлов, селезенки, кожи, альвеолярных и интерстициальных макрофагов лег-ких, микроглия и другие клетки нервной системы, имеющие CD4 - рецепто-ры. Так же поражаются В- и О-лимфоциты, ретикулярные клетки, эпители-альные клетки кишечника, клетки Лангерганса, причем последние инфици-руются даже легче, чем CD4+ лимфоциты. Именно клеткам Лангерганса придается большое значение в распространении ВИЧ по организму, ибо в них вирус сохраняется длительное время, иногда годы.
Наличие CD4 рецептора на многих и не только иммунокомпетентных клетках, возможность поражать и клетки, не имеющие этого рецептора, оп-ределяют политропность ВИЧ и полиморфизм клинической картины. Сте-пень поражения тех или иных, содержащих СD4 рецепторы, клеток зависит от плотности этих рецепторов на мембране клеток. Наиболее высока плот-ность на Т-хелперной субпопуляции лимфоцитов, что и определяет во мно-гом патогенез болезни. Но степень поражения клеток-мишеней вирусом за-висит также и от возможности репликации вируса в том или ином виде кле-ток. Очевидно, осуществляется репликация в основном в лимфоцитах с CD4+ фенотипом и моноцитах/макрофагах.
Если на CD4+ лимфоциты вирус оказывает цитопатическое действие с лизисом клетки или слиянием в синцитий, то в моноцитах/макрофагах ВИЧ реплицируется с умеренной интенсивностью; вирионы оформляются в ок-руглые частицы еще в цитоплазме клетки и по выходе из нее не оказывают цитонекротического действия. Изучение динамики сывороточных монокинов подтверждает активное участие в патогенезе ВИЧ-инфекции моноци-тов/макрофагов, основных продуцентов фактора некроза опухолей и интер-лейкина-1b (выполняющих роль передатчика Т-лимфоцитам антигенспеци-фических сигналов, необходимых для их активации в иммунном ответе). С гиперпродукцией ФНО-a , ИЛ-1b и ИЛ-6 связывают развитие при ВИЧ-инфекции лихорадки, анемии, диареи, кахексии, патологических изменений на коже и слизистых при саркоме Капоши, церебральных симптомов. ФНО-a при этом оказывает прямое цитопатическое действие на инфицированные ВИЧ Т-хелперы. В то же время было установлено, что ВИЧ ингибирует про-дукцию ИЛ-2 и γ-ИФ, синтезируемым Т-хелперами первого типа, и не инги-бирует функцию Т-хелперов второго типа. Следовательно, играя важную роль в регуляции синтеза цитокинов, ВИЧ за счет переключения иммунного ответа с Т-хелперов первого типа на Т-хелперы второго типа, стимулирует гуморальное звено иммунитета.
После инфицирования клетки вирусом происходит соединение вирус-ной оболочки с помощью белка gp41 с мембраной клетки. Помимо того, ви-русный белок gp41 обеспечивает слияние мембран соседних клеток между собой с образованием одной многоядерной клетки - синцития. При этом слияние может быть как зараженных клеток между собой, так и зараженных с незараженными. Но синцитий в основном индуцируют вирусы, выделенные от больных с клиническими проявлениям ВИЧ-инфек-ции, и не образуют выделенные от инфицированных людей, не имеющих клинических проявле-ний.
С момента интеграции генома вируса в геном клетки начинается стадия латентной инфекции. В этот период вирус находится в клетке в виде интег-рированного в геном ДНК – провируса. Раньше полагали, что в этот период отсутствуют процессы транскрипции и трансляции с вирусных генов, а по-этому и экспрессии вирусных белков, нет иммунного ответа на вирус как в виде специфических иммуноглобулинов, так и сенсибилизированных лим-фоцитов. Но последние исследования показали, что сразу после проникнове-ния вируса в клетку начинаются и трансляция, и транскрипция.
Состояние латентной инфекции без клинических признаков болезни может длиться от 2 до 11 лет. Активация длинных концевых повторов и экс-прессия генов ВИЧ, кодирующих белки вируса, знаменуют собой манифе-стацию болезни.
В расшифровке патогенеза ВИЧ-инфекции многие вопросы решены, установлены основные этапы развития процесса в клетке после инфицирова-ния ее вирусом. Выявлен ряд факторов, активирующих экспрессию генов ВИЧ. К ним относятся факторы, активирующие Т-лимфоциты: специфиче-ские антигены (например, вирусы группы Herpes), неспецифические антиге-ны (например, митогены типа фитогемаглютинина), цитокины (например, фактор некроза опухолей, некоторые интерлейкины, гамма-интерферон), бактериальные иммуномодуляторы (например, монофосфат липида из саль-монелл). К активаторам экспрессии ВИЧ относятся глюкокортикостероидные гормоны, в частности, дексаметазон и гидрокортизон, ультрафиолетовое об-лучение, перекись водорода, свободные кислородные радикалы. Активирует инфекционный процесс беременность; более прогрессирующее течение ВИЧ-инфекции имеют психически неуравновешенные лица, дезадаптированные, по сравнению с людьми, имеющими уравновешенную психику.
Довольно сложен и до конца не выяснен механизм репликации вируса в инфицированной клетке. Известно, что в цитоплазме информация с вирус-ной РНК посредством обратной транскриптазы (ревертазы) переписывается на ДНК, первоначально образуется однонитевая структура; затем та же об-ратная транскриптаза обеспечивает образование второй нити, и линейная промежуточная форма ДНК-транскриптаза вируса - транспортируется в ядро, где с помощью фермента интегразы интегрирует в хромосому клетки, пре-вращаясь в провирус.
Исключительно важный этап патогенеза болезни – сборка вирусных частиц и выход нового потомства вируса из инфицированной клетки. Сборка происходит на плазматической мембране лимфоцита, куда поступают все компоненты вирусной частицы, в том числе и белки-предшественники. За-вершается процесс почкованием вирусных частиц с клеточной поверхности. Отличительной чертой ВИЧ является взрывной характер процессов актива-ции транскрипции, синтеза белков-пред-шественников, сборки вирионов и их почкования: за 5 мин одна лимфоцитарная клетка может образовать до 5000 вирусных частиц.
Ключевой вопрос патогенеза ВИЧ-инфекции – механизм иммунного повреждения. Как установлено, в составе белков gp120, главного комплекса гистосовместимости (HLA) класса II и CD4-рецепторов имеются сходные участки, что определяет перекрестное реагирование образующихся к ВИЧ антител с этими структурами. Например, происходит блокада кооперации CD4+ лимфоцитов и HLA II. Антитела к gp120 ВИЧ реагируют с CD4, обу-словливая неадекватную стимуляцию CD4+ клеток. На всех ядросодержащих клетках имеются антигены HLA I; вирус же нарушает синтез этих антигенов, участвующих в распознавании CD8+ лимфоцитами зараженных вирусом клеток, что тормозит процесс лизиса инфицированных клеток.
Взаимосвязь жизненного цикла вируса и иммунных сдвигов в началь-ной фазе ВИЧ-инфекции изучена в эксперименте при заражении SIV обезьян; полученные данные экстраполированы на человека. Как показали исследова-ния, вирус первоначально локализуется в лимфоидной системе, вирусная экспрессия определяет клинику ранней фазы болезни. Пик экспрессии вируса в клетках лимфоидной ткани предшествует накоплению его в плазме. Появ-ление вирусспецифических цитотоксических Т-лимфоцитов (CTL) совпадает со временем окончания экспрессии вируса в лимфатических узлах. Продук-ция комплементсвязывающих антител облегчает переход вируса в сеть денд-ритных клеток герминальных центров лимфатических узлов. Повреждающее действие CTL и продукция комплементсвязывающих антител оказывают ос-новное патогенное действие в результате виремии. Образование нейтрали-зующих антител обеспечивает переход острой фазы болезни в хроническую.
Иммунопатогенетически ВИЧ-инфекция проявляется дефицитом Т- и В-звеньев иммунной системы, дефицитом комплемента, фагоцитов, сниже-нием функции неспецифических факторов защиты. В результате идет фор-мирование анергии с проявлениями аллергического, аутоаллергического и иммунокомплексного патологического процесса. Уже во II стадии ВИЧ-инфекция характеризуется снижением абсолютного числа лейкоцитов за счет CD3+, CD4+, p24+ и gp120+ лимфоцитов, повышением уровня естественных киллеров (NК-клетки), нарастанием реакции торможения миграции лимфо-цитов с конкавалином А и фитогемагглютинином. Изменения гуморального звена иммунитета проявляются нарастанием IgG+ В-лимфоцитов и 4-5-кратным ростом уровня сывороточных IgE.
Для изменений В-звена иммунитета характерна активация В-лимфоцитов. Изменение их метаболизма сопровождается уменьшением вре-мени полуобмена иммуноглобулиновых рецепторов с повышением в крови концентрации клеточных рецепторов (Р-белки). Суммарная концентрация сывороточных иммуноглобулинов растет, но выявляется диспропорция уровней подклассов иммуноглобулинов. Так, содержание IgG1 и IgG3 у больных увеличивается, а концентрация IgG2 и IgG4 существенно уменьша-ется. Очевидно, повышение уровня IgG2 связано с высокой восприимчиво-стью больных к стафилококкам, пневмококкам, палочке инфлюэнцы. Не-смотря на гипергаммаглобулинемию, увеличение количества циркулирую-щих в крови В-лимфоцитов, их функциональная активность на митогены ос-таются относительно сниженными, что позволяет В-систему иммунитета у ВИЧ-больных расценивать как супрессированную. К тому же, количество В-клеток в периферической крови больных в стадии СПИДа может быть сни-жено в три и более раз.
Многочисленными исследованиями показано, что взаимодействие gp120 ВИЧ-1 с мембраной CD4+ лимфоцитов определяет не только отрица-тельные реакции инфицированных клеток, но и приводит к программирован-ной клеточной гибели - апоптозу зрелых CD4+ лимфоцитов или CD34+ ге-мопоэтических клеток-предшественников даже при отсутствии их инфици-рования вирусом.
Специфический иммунный ответ при ВИЧ-инфекции имеет ряд осо-бенностей. Локализуясь в иммуноците, вирус проникает в органы и ткани, пребывая вне доступности для иммунной системы, чем определяется перси-стенция в клетках как вируса, так и его компонентов – белков, нуклеокапси-дов, нуклеиновой кислоты. Активация инфекционного процесса ведет к гу-моральному иммунному ответу с образованием антител. Но в связи с наличи-ем в составе вирусного белка gp120, HLA класса II и CD4-рецептора лимфо-цита сходных участков образующиеся антитела перекрестно реагируют с ни-ми, чем обусловливают нарушение кооперативных взаимодействий в функ-ционировании иммунной системы. Все это определяет формирование ауто-аллергических реакций. Именно поэтому в ходе развития инфекционного процесса формируется гиперчувствительность замедленного и немедленного типов, преимущественно к антигенам ВИЧ, в частности, gр41 и gp120. Так, Л.Монтанье (1996) считает, что в патогенезе СПИДа основное место принад-лежит аутоиммунному процессу. В пользу этого говорят исследования харак-тера иммунных реакций у больных: наличие аутоантител и аллоантител к лимфоцитам, формирование аллергических реакций цитотоксического типа, накопление циркулирующих иммунных комплексов, наличие комплементо-посредованной цитотоксичности, активация антителозависимой клеточной цитотоксичности. Кроме того, при сильном антительном ответе возможность развития аутоиммунных процессов обусловлена мимикрией структуры gp120 под структуру иммуноглобулинов (Atlan H. et al.,1993). В пользу наличия ау-тоиммунных процессов в патогенезе ВИЧ-инфекции говорят и клинические проявления болезни, в частности, часто сопутствующие болезни такие ти-пичные аутоаллергические варианты патологии, как спондилоартропатии, системные ревматоидные синдромы: волчаночноподобный синдром Шегре-на, полимиозит, некротизирующий васкулит.
У половины больных развиваются манифестные формы аллергии, пре-имущественно в виде ринита, лекарственной аллергии, крапивницы, атопиче-ского дерматита, ангионевротического отека с повышением у них уровня специфических IgE к бытовым, эпидермальным, пыльцевым и пищевым ал-лергенам с положительной коррелятивной связью между общим уровнем IgE и содержанием СD8+ лимфоцитов (Ю.А.Митин, 1997).
Наряду с поражением иммунной системы в патологический процесс вовлекается и кроветворная ткань. Для заболевания характерны лейкопения, анемия, тромбоцитопения. Угнетается функциональная активность грануло-цитов. У больных ВИЧ-инфекцией в костном мозге резко снижено содержа-ние колониеобразующих единиц гранулоцитов, макрофагов, мегакариоцитов. Однако дисфункция стволовых клеток не связана с их прямым инфицирова-нием, ибо не обнаружено присутствия ВИЧ в кроветворных клетках при изу-чении методом гибридизации in situ и иммуногистохимическим исследова-нием гемопоэтических колоний, а также с помощью полимеразной цепной реакции. Пока нет однозначного мнения о причинах ингибиции пролифера-тивной активности стволовых клеток, хотя и установлено, что различные изоляты ВИЧ, воздействуя на CD34+ клетки, угнетают их функциональную активность. Также установлено, что подавление кроветворения в результате действия ВИЧ связано с усилением продукции костномозговыми моноцита-ми/макрофагами фактора некроза опухолей.
Таким образом, поражение иммунной системы при ВИЧ-инфекции но-сит системный характер, проявляясь глубокой супрессией Т- и В-звеньев клеточного иммунитета. В ходе развития ВИЧ-инфекции происходят законо-мерные изменения гиперчувствительности немедленного и замедленного ти-па, гуморального иммунитета и факторов неспецифической защиты, функ-циональной активности лимфоцитов и моноцитов/макрофагов. Нарастает уровень сывороточных иммуноглобулинов, циркулирующих иммунных ком-плексов. Наряду с дефицитом CD4+ лимфоцитов в динамике болезни нарас-тает функциональная недостаточность СD8+ лимфоцитов, NK-клеток, ней-трофилов. Нарушение иммунного статуса клинически проявляется инфекци-онным, аллергическим, аутоиммунным и лимфопролиферативным синдро-мами иммунологической недостаточности, синдромом, свойственным болез-ни иммунных комплексов. Все это определяет в целом клинику ВИЧ-инфекции.
Существует целый ряд дополняющих друг друга механизмов взаимодействия ВИЧ с клетками Т-хелперов. Последние стимулируют работу Т-киллеров и макрофагов, индуцируют продукцию антител В-лимфоцитами. Лимфоциты-носители молекул Т8 (CD8) могут быть либо киллерами, либо супрессорами. Некоторые из механизмов еще спорны, подвергаются изменениям; постоянно появляются новые детали и нюансы влияния ВИЧ на иммунную систему
1-й механизм
При продуктивном процессе состоявшейся репродукции и массированном (несколько тысяч вирионов в генерации одной клетки) выходе из лимфоцитов ВИЧ интенсивно лизирует Т-хелперы. Но даже если вирусы спонтанно отпочковываются от Т-клетки-хелпера (без ее лизиса), клетка не успевает восстанавливать целостность мембран, молекулы цитоплазмы свободно элиминируют из клетки, и Т-хелпер гибнет. Поскольку Т-хелперы составляют порядка 60% циркулирующих Т-клеток, быстрая их гибель приводит к глубоким нарушениям иммунной системы инфицированного человека. СПИД развивается на фоне острой недостаточности CD4-лимфоцитов.
2-й механизм
3-й механизм

Частицы ВИЧ изменяют реактогенные зоны поверхности Т-хелперов, что приводит к образованию нежизнеспособных синцитиев. Компоненты вирусной оболочки, синтезируемые в процессе репродукции вируса, резко нарушают цитоплазматическую мембрану клетки-хозяина: в результате элиминации протоплазмы клетки сливаются, образуются нежизнеспособные многоядерные структуры
Исследования подтвердили, что вирус резко изменяет мембраны Т-лимфоцитов и приводит к их слиянию в нежизнеспособные многоядерные клетки-монстры. Образование синцитиев возможно по типу гемагглютинирующего эффекта, когда здоровые лимфоциты при соприкосновении с инфицированными в свою оболочку включают поверхностные белки вируса, и взаимодействие рецепторных зон приводит к образованию крупных нежизнеспособных конгломератов.
4-й механизм
ВИЧ не разрушает CD4-лимфоциты, а изменяет и значительно замедляет их рост в периодической культуре, тогда как другие виды Т-клеток продолжают размножаться нормально. Отмечено, что скорость гибели зараженных клеток пропорциональна количеству CD4-рецепторов на их поверхности. Со временем число CD4-клеток становиться меньше, хотя некоторая их часть выживает и сохраняет вирус в латентном состоянии в виде провируса.
5-й механизм
ВИЧ маскирует CD4-маркер. Было показано, что в выживших CD4-лимфоцитах вирус может маскировать CD4-маркер на поверхности клеток или предотвращать его появление там. В результате получается, что число CD4-клеток еще меньше, чем на самом деле. С исчезновением CD4-клеток падает уровень ИЛ-2 и в результате замедляется рост клонов зрелых Т-клеток, индуцируемых этим лимфокином. Из-за ослабления синтеза интерлейкина и интерферона падает активность К-клеток и макрофагов, которые в номе стимулируютя этими белками.
![]()
6-й механизм
В инфицированных CD4-клетках ВИЧ вызывает секрецию растворимого фактора супрессии. Это вещество блокирует иммунные реакции, зависящие от Т-клеток как in vitro, так и in vivo. При этом угнетается образование специфических антител и пролиферация Т-клеток.
Считают, что геном вируса не кодирует последовательность растворимых факторов супрессии, а только индуцирует в CD4-клеткет его синтез. Такой же механизм, возможно, лежит в основе иммуносупрессии при других инфекциях. Интересно было бы сравнить этот супрессивный фактор с иммуносупрессивным фактором продуктов перекисного окисления липидов.
7-й механизм
Проникший в лимфоциты ВИЧ изменяет геном Т-хелперов, в результате чего они лишаются способности к трансформации и нормальному ответу на ИЛ-2.
- В чем опасность ЗППП
- Венерические заболевания
- Группы риска заражения ЗППП
- Диагностика ЗППП
- ЗППП - заболевания, передающиеся половым путем
- Инкубационный период ЗППП
- Инфекционные заболевания
- ИППП – инфекции, передающиеся половым путем
- Легенды и мифы о венерических заболеваниях
- Лечение ЗППП
- Подготовка к анализам на инфекции
- Последствия и осложнения ЗППП
- Профилактика заболеваний, передающихся половым путем (ЗППП)
- Профилактика ЗППП
- Пути передачи ЗППП
- Симптомы и признаки ЗППП
- СПИД
- Анализы на ВИЧ и СПИД
- Взаимодействие ВИЧ с другими клетками организма
- Взаимодействие ВИЧ с моноцитами
- Взаимодействие ВИЧ с Т-супрессорами
- ВИЧ-2
- ВИЧ-инфекция
- Влияние ВИЧ на Т-хелперы
- Возможности разработки вакцин
- Гены и белки ВИЧ
- Диагностика ВИЧ инфекции
- Заключение
- Клинические проявления ВИЧ инфекции
- Ко-факторы ВИЧ-инфекции
- Лечение ВИЧ и СПИД
- Лечение ВИЧ инфекции
- Макрофаги и вич
- Механизмы взаимодействия ВИЧ с различными звеньями иммунной системы
- Новые варианты вируса СПИД
- Оппортунистические инфекции и опухоли
- Особенности инфицирования и заболевания детей
- Патогенез и клиника ВИЧ инфекции
- Передача ВИЧ инфекции
- Последствия ВИЧ и СПИДа
- Профилактика СПИДа и ВИЧ-инфекции
- Пути передачи ВИЧ
- Регуляция экспрессии вирусных генов
- Результаты взаимодействия ВИЧ с В-клетками
- Симптомы ВИЧ
- Система интерферона при ВИЧ инфекции
- СПИД-ассоциированный комплекс
- Строение вирусной частицы ВИЧ
- Строение генома и экспрессия генов ВИЧ
До 30 апреля "Знакомство с доктором" на первичный прием врача скидка 20%
* Подробности уточняйте у администраторовИзвестно, что лишь наличие трех клеточных типов (Т и В-клеток и макрофагов) в кооперации индуцирует полноценный иммунный ответ. Какая-либо одна или две из указанных популяций клеток не способны дать стимул к антителообразованию. При ВИЧ-инфекции скорее всего неполноценны два звена — Т-хелперное и макрофагальное.
При ВИЧ-инфекции из клеток РЭС макрофаги поражаются в первую очередь. Будучи инфицированы вирусом, эти клетки погибают не так быстро, как лимфоциты. Это, возможно, объясняется малым количеством рецепторов CD4 на их мембране.
![Макрофаги и вич]()
Исходя из предположения, что ВИЧ тропен к одной из популяций макрофагов, а именно — к клеткам Лангерганса, проследим за сдвигами в иммунной системе инфицированного ВИЧ. Наличие в крови таких людей достаточно высокого уровня антител к вирусу иммунодефицита человека свидетельствует о том, что Ir-гены макрофага реализуют в полной мере свою функцию, в то время как низкие концентрации специфических антител объясняются поражением макрофагов. Поражение макрофагов отдельных органов (костного мозга, селезенки, лимфоузлов, легких), а также гистиоцитов соединительной ткани, микроглии, остеокластов, перитонеальных и плевральных макрофагов, звездчатых ретикулоцитов печени обуславливает направленность преимущественного поражения того или иного органа или ткани, что проявляется в клиническом течении СПИДа и фазах его развития. В то же время взаимодействие ВИЧ с клетками Лангерганса и Грэнстейна предшествует локальным поражениям других популяций макрофагов и является фоном для более агрессивного проявления Т-киллеров, предопределяющих гибель клеток-мишеней.
Взаимодействие ВИЧ с клетками Лангерганса и Грэнстейна интересно и с другой стороны. Когда Ia-белок в силу структурных особенностей антигена не может образовать с ним комплекс, последний оказывается на поверхности макрофага в свободной форме. Такой антиген кооперируется с Т-супрессором; в результате наблюдается подавление или полное отсутствие иммунного ответа. Известно, что супрессорные клетки могут связывать антиген с помощью молекул, сходных с иммуноглобулинами.
![Макрофаги и вич]()
![]()
Обзор
Распространенность СПИДа в мире на 2009 год.
Автор
Редакторы
![]()
Спонсор конкурса — дальновидная компания Thermo Fisher Scientific. Спонсор приза зрительских симпатий — фирма Helicon.
Иммунная система
![]()
Рисунок 1. Упрощенная схема иммунного ответа. Молниями указано, как один тип клеток активирует другие. Мф — макрофаг, Б — бактерия, ТХ — Т-хелпер, ВКл — B-клетка, ПлКл — плазматическая клетка, Ат — антитела, Б+Ат — бактерия, покрытая антителами, привлекающими макрофагов, В — вирус, ЗМф — зараженный макрофаг, ТК — Т-киллер, ЗК — клетка, зараженная вирусом, УК — умирающая (апоптотирующая) клетка, В+Ат — вирус, покрытый антителами.
рисунок автора статьи
Жизненный цикл ВИЧ
Видео. Жизненный цикл ВИЧ.
![]()
Таким образом, после того как копия вируса в геноме клетки начинает действовать, на её поверхности появляются знакомые нам белки gp41 и gp120, в цитоплазме — остальные вирусные белки и вирусная РНК. И через некоторое время от зараженной клетки начинают отпочковываться всё новые и новые копии ВИЧ.
Способы уничтожения иммунной системы
При отпочковывании вирус использует клеточную мембрану клетки, и со временем это должно вызвать ее разрушение. К тому же, вирусный белок Vpu вызывает увеличение проницаемости мембраны клетки [6]. При активации вируса в клетке появляется неинтегрированная в геном двуцепочечная ДНК [19], наличие которой может рассматриваться клеткой как повреждение ее генетического материала и индуцировать ее смерть через апоптоз (С точки зрения организма такая клетка потенциально может стать раковой). Помимо этого, вирусные белки напрямую нарушают баланс про- и противоапоптотических белков в клетке. К примеру, вирусная протеаза p10 может разрезать противоапоптотический фактор Bcl-2. Белки Nef [26], Env [22] и Tat [24] вовлечены в возрастание количества клеточных белков CD95 и FasL, служащих индукторами апоптоза по т.н. Fas-опосредованному пути. Белок Tat положительно регулирует каспазу 8 [2] — ключевой фактор индукции апоптоза.
Если же клетки не погибли сами, они активно уничтожаются Т-киллерами. (Это стандартный ответ иммунитета на заражение любыми вирусами.)
Помимо этого, при производстве gp120 и Tat часть их выбрасывается зараженной клеткой в кровоток, а это оказывает токсическое действие на организм [4], [28]. gp120 оседает на все СD4 + -клетки (в том числе и здоровые), что имеет три последствия:
- Белок СD4 важен для взаимодействия Т-хелпера с фагоцитом, при слипании же СD4 с gp120 T-хелпер перестает выполнять эту функцию.
- На gp120 как на чужеродный белок образуются антитела; после оседания gp120 на здоровые клетки, последние маркируются антителами, и иммунная система их уничтожает [9].
- После обильного связывания Т-хелпером gp120 клетка умирает сама. Дело в том, что CD4 — это корецептор. Он усиливает сигнал от TCR (T-cell receptor) — главного белка, позволяющего выполнять Т-клеткам функцию иммунитета. В норме эти рецепторы активируются вместе. Если же активируется один тип рецепторов, но не активируется другой, это является сигналом, что что-то пошло не так, и клетка умирает посредством апоптоза.
Антитела, призванные препятствовать инфекции, в случае с ВИЧ часто, наоборот, ее усиливают [28]. Почему так происходит — не совсем понятно. Одну причину мы рассмотрели выше. Возможно, дело в том, что антитела сшивают несколько вирусных частиц вместе, и в клетку попадает не один, а сразу много вирусов. Помимо этого, антитела активируют клетки иммунитета, а в активированной клетке вирусные белки синтезируются быстрее.
Вдобавок, gp120 и gp41 имеют участки, похожие на участки некоторых белков, участвующих в иммунитете (например, MHC-II [25], IgG [23], компонент системы комплемента Clq-A [14]). В результате на эти участки образуются антитела, способные помимо вируса маркировать совершенно здоровые клетки (если на них будут эти белки), с соответствующими для них последствиями.
Так как на поверхности зараженной клетки появляется gp120, то она, как и вирусная частица, будет сливаться с другими СD4-содержащими клетками, образуя огромную многоядерную клетку (синцитий), неспособную выполнять какие-либо функции и обреченную на смерть.
На самом деле, помимо Т-хелперов, СD4 содержатся во множестве других клеток — предшественниках Т-киллеров/Т-хелперов, дендритных клетках, макрофагах/моноцитах, эозинофилах, микроглии (последние четыре — разновидности фагоцитов), нейронах (!), мегакариоцитах, астроцитах, олигодендроцитах (последние две — клетки, питающие нейроны), клетках поперечно-полосатых мышц и хорионаллантоиса (присутствует в плаценте) [29]. Все эти клетки способны заражаться ВИЧ, но сильно токсичен он лишь для Т-хелперов. Это и определяет основное клиническое проявление СПИДа — сильное снижение количества Т-хелперов в крови. Однако для других клеток заражение тоже не проходит бесследно — у больных СПИДом часто снижена свертываемость крови, имеются неврологические и психиатрические отклонения [16], наблюдается общая слабость.
Пути заражения ВИЧ
Внимание! Ввиду того, что СПИД является венерическим заболеванием, информация, приведенная в этом разделе, может вас оскорбить либо вызвать неприятные эмоции при прочтении. Будьте осторожны.
![]()
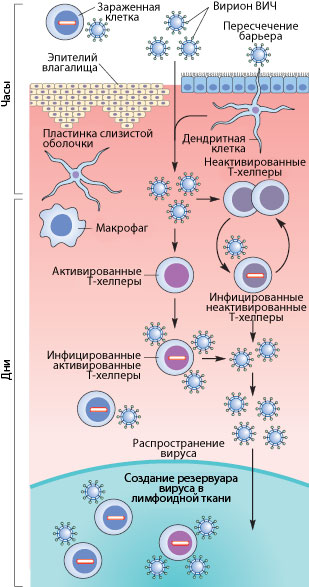
Рисунок 3. Пути проникновения ВИЧ в организм при половом контакте. Слева указано примерные временные рамки каждого этапа.
Как же происходит первичное заражение человека ВИЧ? Думаю, что с переливанием крови или с использованием общего шприца при употреблении наркотиков читателю все понятно — вирус доставляется напрямую из зараженной крови в здоровую. При вертикальном способе передачи инфекции (от матери к ребенку) заражение может произойти во время внутриутробного развития, в момент родов или в период кормления ребенка грудью (т.к. вирус и зараженные вирусом клетки содержатся в молоке матери) [17], [20]. Тем не менее, даже у ребенка, рожденного от ВИЧ-инфицированной матери, есть шанс остаться здоровым, особенно если мать использует ВААРТ (высокоактивную антиретровирусную терапию) [5]. А почему же люди заражаются при половом контакте?
Механизмы передачи вируса при половом акте не до конца ясны. Тем не менее, они понятны в общих чертах. Итак, рассмотрим барьеры, которые необходимо преодолеть вирусу, чтобы добраться до макрофагов и Т-хелперов. К сожалению, рассматривать особо нечего: барьер только один — это слой эпителиальных клеток и вырабатываемая ими слизь, находящиеся во влагалище (а также пенисе, прямой кишке, глотке). Барьер этот тонок — он может быть всего одну клетку в толщину, — но для вируса труднопреодолим, доказательством чего может служить сравнительно небольшой процент заражений — примерно 1–2 случая на 100 половых контактов. Итак, и какими же путями преодолевает вирус это препятствие?
Наиболее очевидный механизм — это микротравмы. При обычном половом контакте, а особенно при анальном сексе, почти неизбежно появляются микротрещины; при наличии же венерических заболеваний часто возникают изъязвления слизистой. Через эти микротравмы вирус, содержащийся в сперме и влагалищном секрете, может проникнуть к иммунокомпетентным клеткам [17], [20].
Помимо дендритных клеток, в кишечнике существует другой тип клеток, предназначенный для ознакомления организма с антигенами внешней среды. Это так называемые М-клетки, пропускающие через себя довольно крупные объекты неповрежденными из просвета кишечника. В т.ч. через них может проходить и вирион ВИЧ.
Свой вклад в заражение вносит и провоспалительный процесс, в норме присутствующий в женских половых путях из-за наличия в них спермы. Благодаря ему Т-клетки подвержены активации, что способствует их восприимчивости к инфекции.
Итак, риск заразиться ВИЧ возрастает в ряду (Классический секс → Анальный секс → переливание крови / использование общих шприцов при принятии наркотиков). Что же касается орального секса, то весьма небольшой шанс заразиться есть только у принимающей стороны — слюна и тем более желудочный сок инактивирует ВИЧ. Теоретически, этим способом может заразиться и мужчина, но для этого необходимы ранки на пенисе.
При поцелуях и обычных бытовых контактах вирус не передается — он очень неустойчив в окружающей среде .
Заключение
![]()
. Все эти факты позволяют надеяться, что вскоре ВИЧ, как и оспа, останется в прошлом.
![]()
Новость
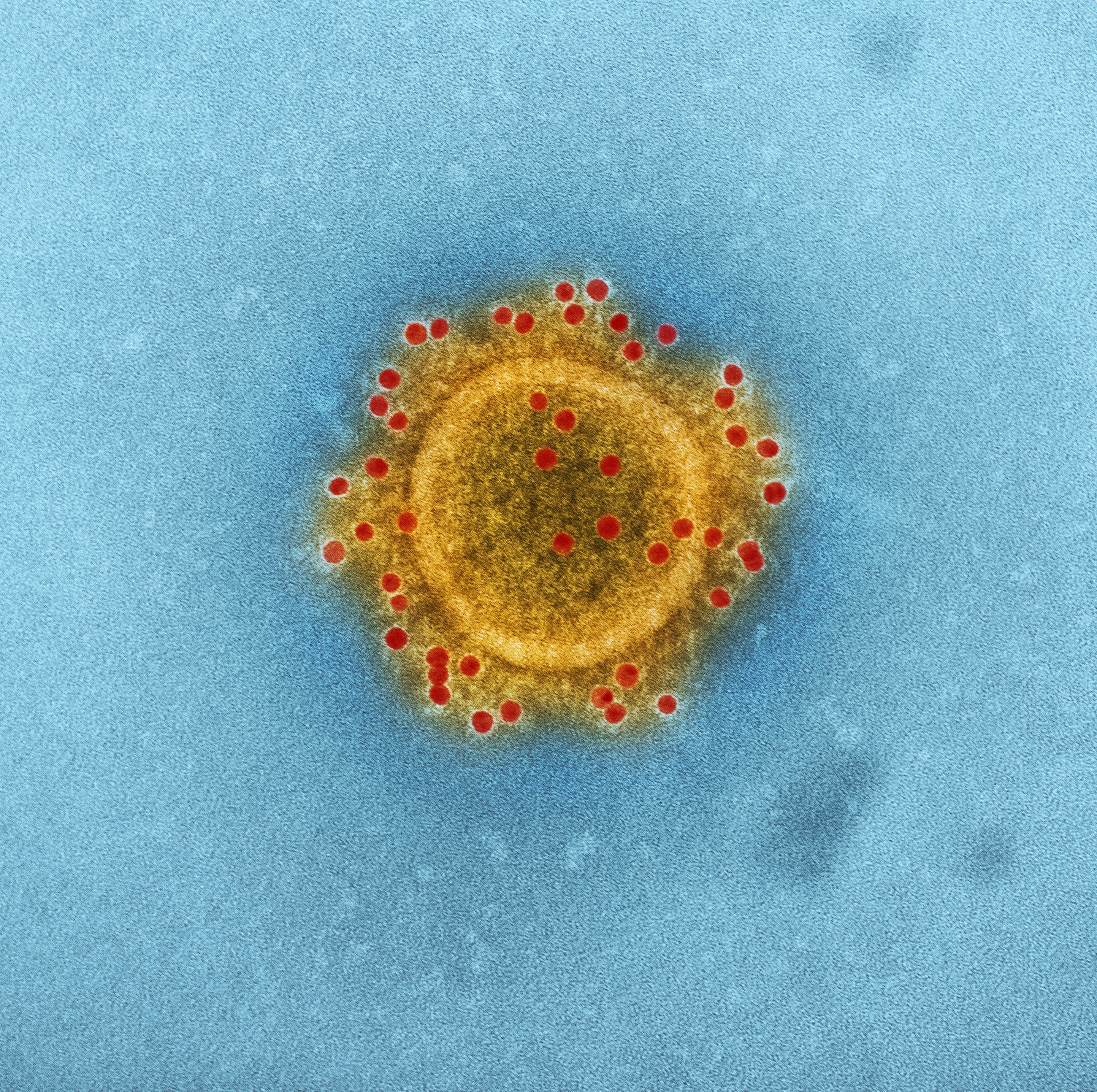
Комплекс-белок Cas9/sgRNA/viral RNA (слева) и модель вируса иммунодефицита человека (справа), построенная коллективом Visual science.
Автор
Редактор
![]()
Генеральным спонсором конкурса, согласно нашему краудфандингу, стал предприниматель Константин Синюшин, за что ему огромный человеческий респект!
Спонсор публикации этой статьи — Виктор Татарский.
Врага нужно знать в лицо
Об иммунитете, апоптозе и вообще.
Иммунная система развивалась сотни миллионов лет. По типу реакции ее обычно делят на врожденный (неспецифичный) и приобретенный (специфичный) иммунитет [1], [2]. Считается, что специфичный (то есть вырабатываемый к конкретному патогену) иммунитет впервые появился у челюстноротых (рыб и всех вышестоящих по эволюционному древу таксонов) после отделения от бесчелюстных (миног и миксин), хотя у вторых имеется аналогичная система защиты [3]. К клеткам специфичного иммунитета относят В-лимфоциты, Т-лимфоциты и NK-клетки (естественные киллеры, natural killer cells). Помимо этого существуют моноциты, которые хоть и не являются истинными инструментами приобретенного иммунитета, однако выполняют некоторые функции по нейтрализации патогена: фагоцитоз, презентация антигена, выделение бактерицидных веществ и цитокинов.
![Взаимодействия Т-киллеров и Т-хелперов]()
Рисунок 1. Взаимодействия Т-киллеров (слева) и Т-хелперов (справа) с зараженными клетками. Для передачи сигнала о заражении необходимо выполнение двух условий: контакт комплекса МНС-патоген с TcR (T-cell Receptor, рецептор Т-клеток) и CD. Двигаясь по организму, Т-лимфоциты проверяют каждую клетку на предмет наличия у нее антигена в комплексе с МНС. Их можно сравнить с подслеповатой глуховатой бабушкой, пришедшей забирать дитятко из детского сада. Для опознания ей надо подойти вплотную и по нескольким (в данном случае по двум) признакам определить, ее ли это чадо или нет.
Т-лимфоциты, в свою очередь, необходимы для уничтожения клеток, зараженных внутриклеточными паразитами, и опухолевых клеток. Они делятся на два основных типа в зависимости от класса рецепторов, находящихся на внешней стороне их мембраны.
Т-киллеры несут CD8 рецепторы и отвечают за:
Т-хелперы имеют CD4 рецепторы и ответственны за секрецию цитокинов, которые:
- активируют макрофаги для борьбы с внутриклеточными паразитами;
- способствуют продукции антител В-лимфоцитами.
Но не менее важна роль Т-хелперов в подготовке зрелых Т-киллеров из клеток-предшественниц, активации NK-клеток и моноцитов.
Как же происходит опознавание антигена на молекулярном уровне? Здесь надо упомянуть еще об одном очень важном классе рецепторов — МНС (Major Histocompability Complex или главном комплексе гистосовместимости). Они бывают двух классов: I и II. МНС I присутствует на поверхности всех ядерных клеток организма человека. Он необходим для опознавания клетки натуральным киллером и Т-киллером (рис. 1, 2). Если по какой-то причине МНС I изменен, несет на себе антиген или отсутствует, клетка будет подвергнута апоптозу. МНС II находится на поверхности В-лимфоцитов, макрофагов и дендритных клеток. Он необходим для презентации антигена Т-хелперам (рис. 1, 2). Жизнь пула Т-хелперов можно представить как прогулку с ребенком в зоопарке, только вместо животных — антигены, вместо ребенка — Т-хелпер, а вместо взрослых, объясняющих, кто есть кто, — три перечисленных типа клеток.
![Процесс передачи сигнала]()
Рисунок 2. Процесс передачи сигнала Т-киллеру и Т-хелперу. Первый этап — сборка комплекса МНС-антиген, второй этап — презентация комплекса на поверхности клетки.
Первый этап проникновения вируса в клетку — взаимодействие вирусного белка gp120 (рис. 3) с рецептором CD4. Отсюда понятно, почему ВИЧ размножается именно в Т-хелперах. Взаимодействию способствуют корецепторы CCR5 и CXCR4 [8]. В норме они являются рецепторами цитокинов, а при взаимодействии ВИЧ с клеткой их связь является необходимым условием проникновения вируса внутрь. Мутации в генах этих рецепторов обеспечивают частичную устойчивость носителей таких мутаций (таких людей около 2%, причем некоторые штаммы вируса все равно могут их поражать) [9]. Затем в мембрану клетки погружается белок gp41, после чего мембрана вируса сливается с клеточной, и происходит распаковка генетического материала. По принципу обратной транскрипции с РНК-матрицы вируса с помощью фермента ревертазы (обратной транскриптазы) синтезируются молекулы кДНК (комплементарной ДНК). Синтезированная кДНК вставляется вирусной интегразой в геном клетки хозяина. После попадания в геном хозяина вирус может никак себя не проявлять до нескольких лет — протекает так называемый инкубационный период. Только когда клетки активно пролиферируют, а значит, синтезируют белки на матрице ДНК, начинается сборка вирусных частиц , выход их из клеток и гибель последних (так как каждая частица забирает с собой часть клеточной мембраны клетки, вирусы попросту разрывают клетку).
![Строение ВИЧ]()
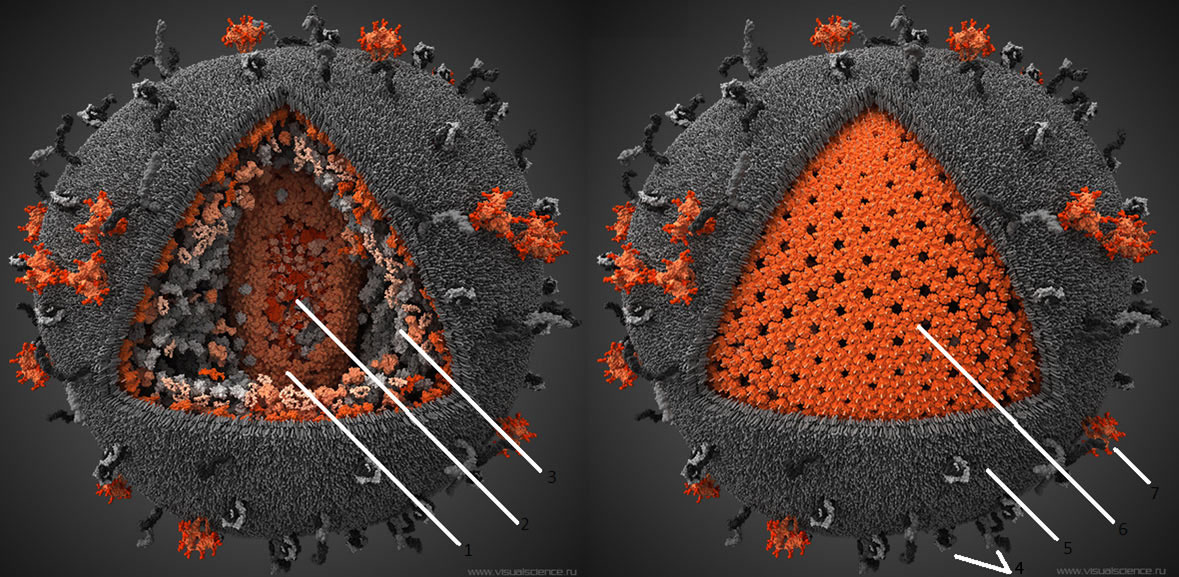
Рисунок 3. Строение ВИЧ. Белки gp120 и gp41 участвуют в рецепции вируса клеткой и проникновении вирусной частицы внутрь. Липидная оболочка захватывается от клетки хозяина вместе с частью мембранных белков. Белки матрикса синтезируются в клетке после встраивания кДНК в геном в момент наработки клеточных белков для деления. Протеаза, возможно, необходима для разрезания противоапоптотического фактора Bcl-2 [9]. Ферменты обратная транскриптаза и интеграза создают кДНК на матрице РНК и встраивают кДНК в геном Т-хелпера соответственно. Tat — белок, вовлеченный в индукцию апоптоза. Нуклеокапсид — комплекс из РНК и белков вируса, представляющий собой компактную упакованную форму генома. Капсид — белковая оболочка, защищающая содержимое от воздействия внешних условий.
Как иммунитет бактерий правит геномы
Система редактирования геномов CRISPR/Cas известна уже довольно давно (впервые локус описал в 1987 году Есизуми Исино из университета Осаки), но только недавно (в 2005 году) ученые поняли ее истинное предназначение [11], [12].
Как вы уже поняли, система состоит из двух компонентов: CRISPR-локуса (Clustered Regularly Interspaced Short Palindromic Repeats или сгруппированные и регулярно разделенные короткие палиндромные повторы) и белков Cas, которые, являются нуклеотид-специфичными эндонуклеазами (а название получили за работу в команде с CRISPR — Crispr associated).
Помимо CRISPR-локуса и блока генов Cas в ДНК бактерии (не обязательно в нуклеоиде [12]) находится ген tracrРНК (transactivated crispr RNA), частично комплементарной палиндромам.
Для формирования специфичной устойчивости к вирусу бактерия, как и человек, должна встретиться с ним дважды.
Первый раз после внедрения вирусной ДНК в клетку происходит разрезание ДНК белками Cas1 и Cas2 на протоспейсеры и встраивание их в начало CRISPR-локуса. Cas1 и Cas2 формируют при этом комплекс, причем Cas2 играет только структурную роль, удерживая ДНК, тогда как Cas1 встраивает ее. Каждый протоспейсер вставляется в CRISPR-локус так, чтобы от другого (уже имеющегося) спейсера его отделял палиндром.
Соответственно, после транскрипции ДНК всего комплекса образуются три продукта (рис. 4):
- tracrРНК;
- РНК белка Cas (наиболее изученным является Cas9, поэтому далее повествование пойдет о нем), далее транслирующаяся;
- pre-crРНК (poly-spacer precursor crRNA или многоспейсерный предшественник crРНК), которая представляет собой транскрипт спейсеров, разделенных образовавшимися из палиндромов шпильками или петлями.
![Строение CRISPR-локуса]()
Рисунок 4. Строение CRISPR-локуса и результат транскрипции. leader — лидерная последовательность, отвечающая за начало транскрипции, со стороны которой вставляется новый спейсер. repeat — палиндромный повтор, который после транскрипции превращается в шпильку или петлю.
Второй этап — образование комплекса pre-crРНК/Cas9/РНКаза III. Очевидно, что вся длинная pre-crРНК не может участвовать в опознавании инвазивной ДНК, так как, во-первых, очень длинна, что конформационно неудобно, а во-вторых, при сравнении спейсеров РНК с протоспейсерами инвазивной ДНК длинный транскрипт начнет путаться и в итоге образует клубок, непригодный для дальнейшей работы. Самое логичное — разделить длинную последовательность на короткие участки, которые могли бы проверятся на соответствие инвазивной ДНК белком Cas9. И тащить за собой не надо, и не запутается.
С помощью фермента РНКазы III и при участии tracrРНК pre-crРНК разделяется по границам повторов так, что в белково-нуклеиновый комплекс входят один спейсер и один повтор, комплементарно связанный с tracrРНК (рис. 5) [13]. Повтор полностью теряет свою вторичную структуру, tracrРНК же оставляет несколько шпилек (обычно три).
![Белково-нуклеиновый комплекс]()
Рисунок 5. Белково-нуклеиновый комплекс после созревания транскрипта. crРНК состоит из спейсера (слева) и повтора, соединенного с частью tracrРНК (справа). Три петли на tracrРНК нужны для удержания ее эндонуклеазой Cas9.
- комплементарность спейсера комплекса Cas9/crРНК/tracrРНК протоспейсеру инвазивной (например, вирусной) ДНК;
- наличие в геноме вируса около протоспейсера последовательности из трех нуклеотидов — РАМ (Protospacer Adjacent Motif, прилежащий к протоспейсеру мотив).
Таким образом клетка страхуется от уничтожения своей ДНК. Но даже просто разрезанная в одном месте вирусная ДНК может представлять опасность, поэтому завершает инактивацию негомологическое сращивание концов (non-homologous end joining, NHEJ). При этом происходит инсерция/делеция одного или нескольких нуклеотидов, что приводит к потере инфекционности.
![Механизм работы CRISPR/Cas9]()
Рисунок 6. Полная схема механизма работы CRISPR/Cas9 системы. а — Транскрипция CRISPR локуса с образованием pre-crРНК. б, в — Разрезание РНК РНКазой III и образование комплексов Cas9/tracrРНК/crРНК. г — Вторичное проникновение в клетку чужеродной ДНК. д — Соединение комплекса с инвазивной ДНК. е — Образование двухнитевого разрыва в протоспейсере.
А где же тут редактирование геномов? А вот где:
- во-первых, таким образом можно просто нокаутировать целевой ген и добиться прекращения экспрессии того или иного белка;
- во-вторых, после создания двухцепочечного разрыва в образовавшуюся брешь можно вставить нужный нам ген и заставить организм синтезировать нужный нам белок.
![Систем CRISPR/Cas9]()
Рисунок 7. Сравнение искусственной (а) и естественной (б) систем CRISPR/Cas9. Отличие состоит лишь в том, что искусственная РНК едина, а природная — состоит из двух частей, гены которых разделены.
Битва века
Однако вернемся к теме этой статьи.
Так как система редактирования геномов может помочь в избавлении от ВИЧ? Очень просто: вирус можно вырезать! Нацелив Cas9, путем создания sgРНК с последовательностью, комплементарной вирусной кДНК.
Некоторое время назад группа ученых из немецкого Института экспериментальной вирусологии и иммунологии уже пыталась использовать инструмент редактирования геномов для удаления ВИЧ из культуры HeLa [15]. Они модифицировали Cre-рекомбиназу методом направленной эволюции и один из полученных вариантов использовали для удаления вируса путем контролируемой рекомбинации [16]. Однако надо учитывать, что между Т-хелперами и опухолевой HeLa есть немало различий, к тому же, авторы не предлагают вариантов доставки или экспрессии гена Tre-рекомбиназы (усовершенствованный вариант фермента Cre).
С другой стороны, группа американских исследователей опубликовала в марте этого года статью [17], где подробно описывались метод доставки и механизм удаления вируса. Ученые ставили перед собой задачу не только полностью избавить клеточную культуру Т-хелперов от вируса, но и проверить отсутствие цитотоксического действия самой CRISPR/Cas9 системы. Единственный недостаток этого геномного инструмента в том, что из-за сравнительно небольшой длины спейсера, даже при наличии страхующего элемента PAM, в больших геномах могут быть найдены нецелевые сайты, подверженные разрезанию (off-target sites). Именно поэтому исследователи уделяли данной проблеме немало внимания.
Работа проводилась с использованием штамма ВИЧ-1 и клеточной линии Т-хелперов 2D10, зараженной вирусом в покоящейся стадии. Доставка и экспрессия sgРНК/Cas9 осуществлялась с помощью лентивирусного вектора.
Для оценки того, вырезался ли вирус из двух мест встраивания (1-я и 16-я хромосомы), было проведено полногеномное секвенирование. Оно показало, что в клетках, где экспрессировались и гены Cas9, и sgРНК, провирусная ДНК отсутствует.
Был проведен анализ того, могут ли гены, куда встроился провирус (RSBN1 и MSRB1), и близлежащие гены нормально транскрибироваться после его вырезания. Ученые показали, что как RSBN1, так и MSRB1 нормально экспрессируются. Соседние гены также не претерпели изменений.
С помощью биоинформатических методов и анализа баз данных было показано, что sgРНК/Cas9 не проявляет активности по отношению к нецелевым сайтам.
Таким образом, можно с уверенностью сказать, что группа Камински впервые успешно удалила ВИЧ из культуры зараженных Т-хелперов. Данное достижение приблизило человечество к победе на ВИЧ. Да, это только культура клеток. Да, до внедрения данной техники в медицину пройдут годы, а может и десятки лет, но данная работа является уникальной в своем роде, ибо ученые не только бросили вызов одному из страшнейших заболеваний на планете, но и смогли победить его — пусть даже масштаб сражения пока невелик.
Перспективы применения данной технологии очевидны: введя пациенту вектор, содержащий гены Cas9 и sgРНК, мы добьемся их экспрессии и полного удаления вируса из клеток. Современная терапия, направленная против ретровирусов, являющаяся основным средством борьбы с ВИЧ, не удаляет вирус из клеток, так как провирус остается встроенным в ДНК хозяина. В свою очередь, данный подход не оставляет вирусу шансов укрыться.
Читайте также: