Вич терапия в польше
Обновлено: 19.04.2024
История Георгия — не единственная. Сейчас обеспокоены все люди с положительным ВИЧ-статусом. И это понятно. Перерывы в терапии пациентов с ВИЧ опасны тем, что вирус снова начинает размножаться, приобретет лекарственную устойчивость, а значит, постепенно будет угнетать иммунную систему.
Что делать в случае перебоев с АРТ
«Всегда хорошо иметь запас, но также важно не устраивать „ажиотажные визиты“ в центры борьбы со СПИДом. Если таблетки в центре закончились, врач может предложить перейти на другую схему лечения. Если и таких вариантов нет, то можно попробовать самостоятельно найти препарат бесплатно в резервных аптечках (часто на базе НКО) или за деньги в обычных аптеках.
В крайнем случае перерыв в приеме терапии — если у вас нормальный иммунный статус и нет вторичных заболеваний на фоне ВИЧ — не должен сказаться на здоровье в долгосрочной перспективе.
Какие препараты вошли в список ЖНВЛП в 2022 году
По словам Норова, иностранные граждане также могут рассчитывать на качественную и эффективную помощь на территории России.
Справка: еще раз объясняем про схемы АРТ и их смену
-
Какие используются схемы терапии?
Сам смысл терапии, как известно, в комбинации нескольких препаратов. Бывает комбинация в одной таблетке (в России встречается нечасто), бывает в разных, от трех до восьми. Как правило, меняются один или два компонента. Есть так называемая основа схемы, препараты, которые используются чаще всего, и к ним добавляется третий, иногда третий плюс четвертый препарат. Чаще всего проблемы возникают именно с этим третьим или четвертым препаратом либо с какими-то комбинированными их формами.
Это очень сильно зависит от самой схемы. Например, если мы говорим о замене внутри одного класса препаратов, то есть из той же группы, то не грозит практически ничем.
Сказать однозначно, чем грозит замена терапии, нельзя, потому что может быть, наоборот, произойдет оптимизация схемы: какой-то препарат начинает использоваться меньше и будет заменен на более современный. Такое тоже бывает.
В теории пропасть может любой препарат, другое дело, что на практике во многих центрах этого не происходит уже довольно давно. Сейчас ситуация у нас, конечно, нестандартная, и предсказать что-либо сложно.
Но важно помнить, что любая полноценная современная схема АРТ лучше, чем отказ от приема терапии.
Почему не стоит бояться смены схемы терапии АРТ
— Понятно, что врачи исходят из того, что доступно на сегодняшний день. Они прекрасно понимают, что необходимо следовать трем основным принципам: эффективность лечения (подавление вирусной нагрузки), хорошая переносимость (отсутствие побочных эффектов) и долгосрочное влияние на организм пациента во избежание каких-либо ассоциированных с препаратом побочных действий длительного эффекта (речь идет о влиянии на сердечно-сосудистую систему, на метаболизм и прочее).
Если схема терапии неизбежна, то в идеале препараты должны меняться на более современные и более благоприятные для пациента по всем этим трем параметрам, в чем и заключается весь смысл индивидуального подбора терапии.
Если говорить о реалиях, то бывает по-разному. Конечно, мы всегда ожидаем перебоев, готовы к сложностям, но однозначно сейчас сказать, что это ударит по пациентам, нельзя. Дело в том, что не всегда смена терапии может нести негативную коннотацию. Бывало, что измененная схема не подходила какому-то человеку, но ведь это возможно с любой схемой терапии. Врачи не заинтересованы в том, чтобы безосновательно менять схемы, создавая тем самым сложности пациенту — безусловно, они всегда будут искать и ищут какой-то компромисс, баланс.
Пока мы не понимаем, насколько серьезно все отразится на препаратах и их доступности, но мне хотелось бы дать умеренно обнадеживающий прогноз, все-таки это сфера, попадающая под санкции далеко не в первую очередь, область эта достаточно сильно локализована (не всегда полностью) и важная стратегически, находящаяся на особом контроле. Надеюсь, что так и будет продолжаться.
Больше в эту больницу я не ходила, за свой счет в город ездила лечиться. Терапию [получала] и тесты сдавала в областном центре СПИДа — тоже, чтобы в нашей больнице не появляться. Болтливые там у нас, как выяснилось, специалисты.
О диагнозе знают близкие родственники и одна подруга, которым я открылась. Но больше никому не рассказываю: люди-то разные, мало ли как отреагируют!
Я замужем, но детей нет. Сейчас временно живу в другом городе, работаю продавцом, два раза в год езжу сдавать анализ в центр СПИДа и получать терапию. Ну или родственники по доверенности получают. В областном центре с этим проблем нет, препараты всегда в наличии.
Там, где я живу сейчас, тоже сложности с восприятием ВИЧ-положительных людей: городок маленький, не хочется распространяться о диагнозе…
Страх стигмы

Главными проблемами людей, живущих с ВИЧ в России, врачи и общественники называют нехватку современной антиретровирусной терапии, стигматизацию и низкую информированность медработников. Если речь идет о пациентах, проживающих в селах и деревнях, каждая из этих проблем становится еще глубже.
Галина — первая героиня этого текста — живет в Новосибирской области, и мы не знаем, ни как она выглядит, ни даже ее настоящего имени. Такая конспирация понятна и, скорее всего, оправдана, ведь чем населенный пункт меньше — тем и односельчане знакомы лучше между собой, а слухи распространяются быстрее. Кроме того, она работает в магазине, а продавец в сельской местности — личность весьма заметная и узнаваемая.
И все же, по словам Маяновского, с годами люди даже в отдаленных населенных пунктах стали терпимее к ЛЖВ. Он вспомнил случай из 2000-х: жители Калужской области прознали, что у односельчанки ВИЧ, начали ее травить и подожгли дом.
Тест за тридевять земель
Однако рост лояльности россиян к ВИЧ-положительным гражданам в первую очередь заметен в крупных городах. В деревнях и селах, где и за меньшее отличие от общества приходится ловить косые взгляды, ситуация хуже.
По словам экспертов, постоянная боязнь стигматизации вынуждает ВИЧ-положительных жителей сельской местности перестраховываться: не рассказывать о статусе даже старым приятелям, не сдавать анализы в местных учреждениях здравоохранения.

Ольга Саража, главный внештатный специалист по ВИЧ при департаменте здравоохранения Тюменской области
По словам Ольги Саражи, в Тюменский центр СПИДа регулярно приезжают сдавать анализы и получать терапию ЛЖВ из Свердловской и Курганской областей.

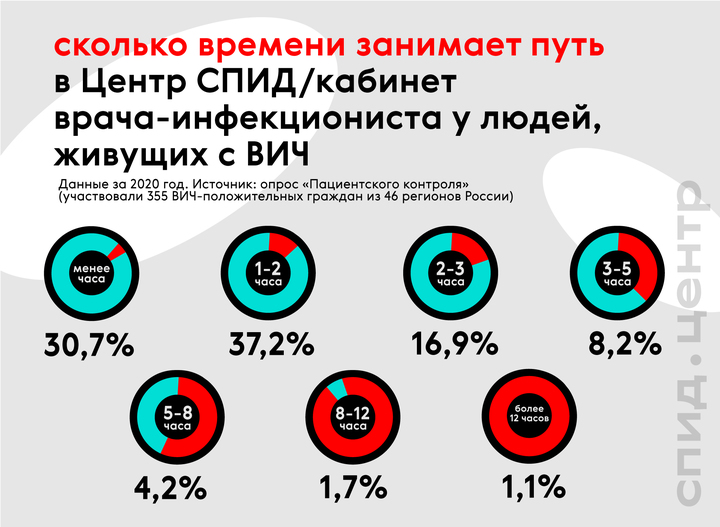
У 22% опрошенных регулярные расходы на дорогу до местного центра СПИДа или врача-инфекциониста составляют от 500 рублей до восьми тысяч рублей разово. 15% респондентов вынуждены добираться до медучреждения от трех до 12 часов и более.
Эти цифры, пусть и косвенно, подтверждают сказанное экспертами: немало людей, живущих с ВИЧ, готовы ехать в другой населенный пункт и даже регион, лишь бы в местной больнице не узнали об их статусе. И в последние годы государство идет в этом вопросе навстречу, поскольку по закону ЛВЖ могут получить антиретровирусную терапию в любом регионе, независимо от места прописки.
Анастасия (имя изменено), 32 года:
— Диагноз мне поставили пять лет назад. О нем знают только родственники и несколько близких друзей.
В селе я оказалась случайно — родственники попросили за домом присмотреть. Сама я из города, там мне комфортнее, и я планирую туда вернуться, когда ребенок подрастет — ему год. Я живу с мужем, своим ребенком и падчерицей. Пока не работаю. Да и работы тут нет.
В селе, где я оказалась, проживают около 1 000 человек. Из медицинских учреждений — только ФАП (фельдшерско-акушерский пункт. — Прим. ред.). Поскольку я тут недавно, с какими-то трудностями, связанными с восприятием окружающими моего ВИЧ-статуса, не сталкивалась. Но я, хоть и не стесняюсь своего статуса, все-таки стараюсь не афишировать его. Тесты прохожу в городе, за терапией — туда же езжу с ребенком. Это обходится мне в 2–2,5 тысячи рублей.
Терапия молчания
Врачи и общественные фонды признают, что сейчас в России дела с обеспечением пациентов с ВИЧ антиретровирусной терапией обстоят как никогда хорошо, и любой пациент с этим диагнозом, независимо от места жительства, может получить препараты. Пусть медучреждения, где это можно сделать, и не всегда в шаговой доступности, регионы разрабатывают свои схемы обеспечения необходимыми лекарствами.
При этом, по его мнению, отчасти благодаря доступности лечения, ВИЧ в России стал менее обсуждаем, хотя риск заражения высок, как и прежде, и масштабы заболевания в стране растут все больше.
Марина (имя изменено), 35 лет:
— 14 лет назад я проходила обследование в частной клинике, и у меня обнаружили ВИЧ. Но о диагнозе я узнала от мамы: из платной больницы почему-то в первую очередь позвонили в местную районную больницу, а уже оттуда поступил звонок моей маме. Ей очень грубо сообщили, что у меня…
Теперь уже — бывший муж. Он употреблял наркотики, я об этом не знала.
И тут начались трудности. Много трудностей. Поселок маленький (менее 9 тысяч человек, до Новосибирска — больше 50 километров), слухи разошлись быстро. А люди-то малограмотные и злые, как оказалось. Смотрели косо…
У меня есть сын, ему 12, он тоже ВИЧ-положительный. Регулярно с ним ездим в центр СПИДа, сдаем анализы и получаем терапию. Врачи там все очень хорошие, грамотные и самое главное — с душой относятся.
В дальнейшем я планирую переехать в областной центр. Не из-за себя, так сыну будет лучше. Там возможностей гораздо больше, чем в районе.
Анализ на смелость
В сельских районах Тюменской области проживают около шести тысяч ВИЧ-положительных граждан. Основной путь инфицирования — как и везде сейчас — половой, гетеросексуальный. Только здесь, в отличие от городов, так было и десять, и двадцать лет назад.
Деревни и поселки в любой области России в плане инфраструктуры похожи тем, что наличие тех или иных госучреждений в них регламентируется в зависимости от населенности. Например, тип медицинских учреждений в сельской местности напрямую зависит от того, сколько человек проживают там: при численности населения больше двух тысяч человек — в селах и поселках должна быть врачебная амбулатория, а если меньше — только фельдшерско-акушерский пункт с одним фельдшером, который чаще всего живет неподалеку, в приписанном к ФАПу доме.
Но практика Тюменской области показывает, что даже в таких условиях можно обеспечить необходимыми медицинскими услугами каждого деревенского жителя.
Но специалист по ВИЧ тюменского депздрава признает, что несмотря на доступность тестирования, в сельской местности — это больная тема. Все упирается в конфиденциальность информации. Пациенты боятся разглашения, и если уговорить их пройти скрининг на сердечно-сосудистые заболевания или, скажем, онкопатологии труда не составляет, то заставить протестироваться на ВИЧ непростая задача.
Всего в рамках проекта был протестирован 1 031 человек — 25 подтвержденных положительных результатов.
Боязнь раскрыться
По словам равного консультанта по ВИЧ Таисии Ланюговой, ВИЧ-инфицированные люди боятся признать свой статус, так как считают, что стоит им сделать это — и с нормальной жизнью можно попрощаться.
Но при этом Ланюгова, которая живет с ВИЧ с 2004 года, а с 2006-го занимается равным консультированием и развитием пациентского сообщества, также уверена, что и российское общество, и ЛВЖ уже готовы к совместному диалогу, который поможет стереть клеймо стереотипов о заболевании.
История Георгия — не единственная. Сейчас обеспокоены все люди с положительным ВИЧ-статусом. И это понятно. Перерывы в терапии пациентов с ВИЧ опасны тем, что вирус снова начинает размножаться, приобретет лекарственную устойчивость, а значит, постепенно будет угнетать иммунную систему.
Что делать в случае перебоев с АРТ
«Всегда хорошо иметь запас, но также важно не устраивать „ажиотажные визиты“ в центры борьбы со СПИДом. Если таблетки в центре закончились, врач может предложить перейти на другую схему лечения. Если и таких вариантов нет, то можно попробовать самостоятельно найти препарат бесплатно в резервных аптечках (часто на базе НКО) или за деньги в обычных аптеках.
В крайнем случае перерыв в приеме терапии — если у вас нормальный иммунный статус и нет вторичных заболеваний на фоне ВИЧ — не должен сказаться на здоровье в долгосрочной перспективе.
Какие препараты вошли в список ЖНВЛП в 2022 году
По словам Норова, иностранные граждане также могут рассчитывать на качественную и эффективную помощь на территории России.
Справка: еще раз объясняем про схемы АРТ и их смену
-
Какие используются схемы терапии?
Сам смысл терапии, как известно, в комбинации нескольких препаратов. Бывает комбинация в одной таблетке (в России встречается нечасто), бывает в разных, от трех до восьми. Как правило, меняются один или два компонента. Есть так называемая основа схемы, препараты, которые используются чаще всего, и к ним добавляется третий, иногда третий плюс четвертый препарат. Чаще всего проблемы возникают именно с этим третьим или четвертым препаратом либо с какими-то комбинированными их формами.
Это очень сильно зависит от самой схемы. Например, если мы говорим о замене внутри одного класса препаратов, то есть из той же группы, то не грозит практически ничем.
Сказать однозначно, чем грозит замена терапии, нельзя, потому что может быть, наоборот, произойдет оптимизация схемы: какой-то препарат начинает использоваться меньше и будет заменен на более современный. Такое тоже бывает.
В теории пропасть может любой препарат, другое дело, что на практике во многих центрах этого не происходит уже довольно давно. Сейчас ситуация у нас, конечно, нестандартная, и предсказать что-либо сложно.
Но важно помнить, что любая полноценная современная схема АРТ лучше, чем отказ от приема терапии.
Почему не стоит бояться смены схемы терапии АРТ
— Понятно, что врачи исходят из того, что доступно на сегодняшний день. Они прекрасно понимают, что необходимо следовать трем основным принципам: эффективность лечения (подавление вирусной нагрузки), хорошая переносимость (отсутствие побочных эффектов) и долгосрочное влияние на организм пациента во избежание каких-либо ассоциированных с препаратом побочных действий длительного эффекта (речь идет о влиянии на сердечно-сосудистую систему, на метаболизм и прочее).
Если схема терапии неизбежна, то в идеале препараты должны меняться на более современные и более благоприятные для пациента по всем этим трем параметрам, в чем и заключается весь смысл индивидуального подбора терапии.
Если говорить о реалиях, то бывает по-разному. Конечно, мы всегда ожидаем перебоев, готовы к сложностям, но однозначно сейчас сказать, что это ударит по пациентам, нельзя. Дело в том, что не всегда смена терапии может нести негативную коннотацию. Бывало, что измененная схема не подходила какому-то человеку, но ведь это возможно с любой схемой терапии. Врачи не заинтересованы в том, чтобы безосновательно менять схемы, создавая тем самым сложности пациенту — безусловно, они всегда будут искать и ищут какой-то компромисс, баланс.
Пока мы не понимаем, насколько серьезно все отразится на препаратах и их доступности, но мне хотелось бы дать умеренно обнадеживающий прогноз, все-таки это сфера, попадающая под санкции далеко не в первую очередь, область эта достаточно сильно локализована (не всегда полностью) и важная стратегически, находящаяся на особом контроле. Надеюсь, что так и будет продолжаться.

Когда надо говорить правду?
Во всех медицинских учреждениях, куда бы ни пришёл ВИЧ-носитель, ему необходимо заявить о своём статусе, потому что в Уголовном Кодексе есть статья, предусматривающая наказание за сокрытие информации в случае заражения третьего лица. Лечение зубов, обследование с внедрением внутрь органов – любая инвазивная манипуляция может привести к контакту с кровью и инфицированию медицинского работника. В амбулаторной карте врач пометит статус, внесёт его в электронную историю болезни, чтобы все были предупреждены о соблюдении определённых мер, предотвращающих распространение вируса иммунодефицита дальше.
Не понимают граждане, что ничего постыдного в ВИЧ-статусе нет, любой может нечаянно получить вирус даже при абсолютно праведной жизни, как 5 лет назад заразились три женщины, лечившиеся от бесплодия. По инновационной методике в частной клинике им ввели лимфоциты медсестры, не подозревавшей о носительстве ВИЧ. Это было преступной халатностью, но именно такие небрежения и приводят к человеческим трагедиям.
Что ищут в крови?
В анализе крови ищут не сам вирус, вирус – невидимка, ищут выработанные организмом человека антитела к вирусу. Порядок проведения анализа определён приказом Министерства здравоохранения, он неизменен: от простого скринингового – поискового анализа следуют к более сложному исследованию крови, неоднократно проверяя правильность результата.
Обычно антитела к вирусу начинают вырабатываться со второй недели после заражения, к концу месяца уровень их значительно повышается и уже не падает, если не лечиться. У девяти из десяти инфицированных титр – количество антител повышается в течение первых 3 месяцев после внедрения ВИЧ, только одному человеку для начала продукции антител потребуется 3–6 месяцев. И только у одного из двух сотен антитела появляются много позже.
Какие делают анализы на ВИЧ?
Стандартное исследование крови - иммуноферментный анализ (ИФА) не 100% специфичен, но если он выявляет антитела к ВИЧ, то следом проводятся два аналогичных теста реактивами других производителей. Анализ делается с той же сывороткой, получаемой при центрифугировании крови пациента. Всё это выполняется в обычной лаборатории, не специализирующейся на инфекционных заболеваниях. Если хотя бы один тест ИФА выявляет антитела к ВИЧ, то сыворотка направляется в лабораторию СПИД центра для второго этапа анализов – иммуноблотинг.
ИФА чувствительный тест, иначе его не использовали бы в скрининге – поиске вируса при массовых обследованиях. Но кровь человека весьма нежная субстанция, в плазме могут плавать элементы, которые способны дать ошибочный положительный результат и в отсутствии вируса. Все вопросы должен снять следующий этап исследований, если иммуноблот отрицательный – можно выдохнуть и жить дальше, радуясь себе и жизни.
Куда идти, если обнаружен ВИЧ?
При обнаружении ВИЧ-инфекции необходимо встать на учёт в специализированном учреждении – Центре по профилактике и лечению СПИД. При постановке на учёт анонимность исключена, предоставляется весь пакет документов. Первичное обследование обширно и серьёзно, ищутся возможные сопутствующие инфекции и просто скрытые хронические заболевания, делаются всевозможные анализы крови, мочи и кала, проводятся консультации специалистов, УЗИ брюшной полости и рентгенография лёгких. Всё обследование - в рамках программы государственных гарантий, бесплатно, но очень долго и некомфортно.
Диспансерное наблюдение призвано контролировать процесс течения инфекционного процесса – регулярное обследование и обеспечивать бесплатное лечение при необходимости. Всё исключительно на добровольных началах, только при согласии пациента, письменно им выраженном. Начало лечения определяется вирусной нагрузкой, которую определяют по количеству специальных клеток крови - CD4-лимфоцитов, в которых живёт и размножается вирус. Чем меньше численность CD4-лимфоцитов, тем больше вируса в организме человека.
Есть проблемы?
Когда надо сдавать анализ на ВИЧ-инфекцию?
Обычно антитела к вирусу начинают вырабатываться через неделю после заражения, через месяц уровень их повышается и без лечения не снижается. Поэтому ИФА делают через две недели после контакта с больным ВИЧ. У девяти из десяти инфицированных уровень антител повышается в первые 3 месяца после проникновения вируса. При чётком подозрении на инфицирование и отсутствии антител в первом ИФА, необходимо повторить через 3 и 6 недель. Только одному человеку для начала продукции антител потребуется 3–6 месяцев. И только у одного из двухсот заразившихся антитела появляются по прошествии полугода. Высокопрофессиональные врачи-инфекционисты и современное диагностическое оборудование международной клиники Медика24 позволяют выявить все предрасполагающие факторы для развития заболевания и составить индивидуальную поведенческую программу при наличии инфицированного родственника.
Лечение ВИЧ современными методами
Испытания лекарств от ВИЧ часто включает в себя аналитическое прерывание лечения, когда пациенты с ВИЧ прекращают прием антиретровирусной терапии (АРТ), чтобы ученые могли понаблюдать, как неконтролируемый вирус реагирует на исследуемые препараты.
Участие в такого рода клинических испытаниях может вызвать страх у человека с ВИЧ, который привык поддерживать неопределяемую вирусную нагрузку. Кроме того, предыдущее исследование, проведенное доктором Лау, показало, что многие люди с ВИЧ не были уверены в том, как работают эти испытания, и многие из них не были готовы к длительным периодам определяемой вирусной нагрузки.
Ученые работают над различными стратегиями излечения ВИЧ-инфекции. Некоторые методы нацелены на сокращение латентных резервуаров ВИЧ — инфицированных иммунных клеток, которые не производят новые вирионы в течение многих месяцев или лет. Другие виды терапии пытаются повысить способность иммунной системы контролировать вирус.
Существуют два типа исследований, основанных на прерывании лечения, которые используются для оценки потенциальной терапии: изучение времени до восстановления вирусной активности (TVR) и изучение контрольных точек. В исследованиях TVR после того, как участники прекращают АРТ, ученые измеряют время, необходимое, чтобы вирусная нагрузка сначала достигла обнаруживаемого уровня (50 копий/мл), а затем время, необходимое для достижения более высокого порога (часто 10 000 копий/мл), после чего участники возобновляют прием АРТ. Если тем, кто получает лечение, требуется больше времени для достижения этих пороговых значений по сравнению с контрольной группой, это указывает на то, что терапия замедляет восстановление вирусной активности. Исследования TVR часто используются для оценки методов терапии, нацеленной на резервуары, обычно они длятся всего несколько недель.
Исследования контрольных точек демонстрируют, насколько эффективно иммунная система участников контролирует ВИЧ самостоятельно. В этих гораздо более длительных исследованиях (до нескольких месяцев) исследователи позволяют вирусным нагрузкам участников достигать высоких уровней, имитируя острую фазу ВИЧ, чтобы проследить, сможет ли их иммунная система в дальнейшем снизить эту нагрузку. Порог для возобновления АРТ обычно устанавливается на высоком уровне (часто 100 000 копий/мл). Когда участники, получающие лечение, способны контролировать ВИЧ при более низких уровнях вирусной нагрузки и в течение более длительного времени, чем участники контрольной группы, это говорит о том, что терапия повышает их иммунитет против вируса.
Несмотря на то, что нет конкретных рекомендаций, определяющих, как планировать исследования с прерыванием лечения, группа ученых, занимающихся исследованием ВИЧ, встретилась в 2018 году, чтобы обсудить этические стороны и выработать методы для снижения риска. Прекращение АРТ во время этих исследований не просто подвергает участников риску длительных периодов определяемой, а в некоторых случаях и высокой вирусной нагрузки. Более высокие вирусные нагрузки также могут подвергать опасности и ВИЧ-отрицательных половых партнеров участников.
До сих пор в большинстве исследований риск снижался за счет небольшого числа участников и отсутствия контрольной группы, которая вместо лечения принимала неактивное плацебо. Включение контрольной группы важно, потому что это позволяет ученым сравнивать тех, кто принимает лекарства, с теми, кто находится на плацебо. Тем не менее научное сообщество обсуждало этичность использования контрольных групп в подобных испытаниях лекарств, потому что они подвергаются длительным периодам повышенной вирусной нагрузки в отсутствие каких-либо препаратов, даже экспериментальных.
Исследование
Доктор Лау и ее коллеги использовали данные предыдущих клинических испытаний для создания математических моделей, позволяющих оценить, как различные их параметры влияют на статистическую мощность испытания.
Статистическая мощность аналогична чувствительности. Например, тест на ВИЧ с чувствительностью 80% успешно идентифицирует вирус у 80% людей, которые на самом деле ВИЧ-положительны, но не выявит у остальных 20% ВИЧ-положительных людей. Когда клиническое испытание, оценивающее лечебную терапию, должно достигнуть статистической мощности в 80% (при условии, что терапия имеет реальную пользу для тех, кто ее принимает), в испытании будет 80-процентная вероятность обнаружить пользу и 20-процентная вероятность ее упустить.
Проще говоря, чем больше данных задействовано в испытании, тем большей статистической мощностью оно будет обладать. Такие факторы, как количество участников, число контрольных параметров, продолжительность испытания и частота анализов крови, влияют на статистическую мощность испытания.
Результаты пробного моделирования TVR
В отношении недавнего исследования TVR с участием 13 человек такая модель показала, что при мощности 80% исследование выявило бы только лечение со значительным снижением реактивации (от 70 до 80%). Чтобы исследование TVR выявило снижение реактивации на 30%, потребуется уже по 120 участников в группе терапии и в контрольной группе. Поскольку в большинстве исследований TVR задействовано малое число участников, они, вероятно, не устанавливают умеренных результатов терапии.
Может показаться нелогичным планирование исследования для выявления меньшего эффекта от лечения, когда конечной целью является поиск максимальной пользы (т. е. терапия, приводящая к 100% снижению реактивации). Тем не менее на начальных этапах поиска лекарства необходимо фиксировать даже умеренные результаты, чтобы решить, требует ли этот метод дальнейшего изучения.
Помимо рекомендации увеличить количество участников, команда предлагает использовать ретроспективные контрольные данные в дополнение к контрольным группам. Данные из предыдущих испытаний, в которых люди прерывали АРТ, могли бы повысить потенциал выявления умеренной пользы от лечения. Они смоделировали гипотетическое исследование TVR, в которое вошли 50 участников и 50 человек из контрольной группы. При мощности 80% эта конструкция может обнаруживать снижение реактивации до 43%. Добавление ретроспективных данных еще 150 участников позволило бы в том же испытании выявить снижение до 36%.
Такое моделирование также не показало практически никакого улучшения способности обнаруживать снижение реактивации при увеличении продолжительности испытаний TVR свыше пяти недель. После этого срока модель предсказала улучшение обнаружения не более чем на 1%. Точно так же они не обнаружили практически никакой пользы от проведения лабораторного мониторинга чаще, чем раз в неделю. Наблюдение за людьми два раза в неделю почти не помогло обнаружить снижение реактивации.
Ученые провели отдельный анализ для оценки максимального риска передачи ВИЧ во время исследований TVR на основе предыдущих данных. Они оценили максимальный риск передачи, предполагая, что участники занимались незащищенным сексом и что доконтактная или другие методы профилактики не использовались. Кроме того, если во время еженедельного мониторинга не сообщать пациенту показатель вирусной нагрузки сразу же, то участник, которому необходимо возобновить АРТ (если его вирусная нагрузка превысила 1000), скорее всего, отложит это до следующего еженедельного визита.
Было подсчитано, что в этом случае во время пятинедельного исследования TVR с порогом вирусной нагрузки 1000 для повторного начала АРТ максимальный риск передачи ВИЧ составил 3,6 на 1000 участников, занимающихся вагинальным сексом. При анальном сексе для вводящих партнеров максимальный риск составлял около 7 на 1000, а для принимающих партнеров — около 70 из 1000. Изменение схемы исследования, включающее экспресс-тестирование на вирусную нагрузку и возобновление АРТ в тот же день, снижает предполагаемый максимальный риск до 0,9, 1,8 и 18 на 1000 соответственно.
Результаты моделирования исследования по контрольным величинам
Исследования контрольных точек должны иметь достаточную статистическую мощность, чтобы отделять преимущества предлагаемой лечебной терапии от контроля после лечения. Используя результаты исследования CHAMP, ученые предположили, что исходный уровень контроллеров после лечения ниже 4%. Если целью исследования было определить увеличение количества контролеров до 20% (это означает, что терапия помогла людям, которые не являются естественными контроллерами, подавить вирус), их модель показала, что 24-недельное исследование со статистической мощностью 80% потребует участия 60 пациентов.
Из-за чрезвычайно высоких вирусных нагрузок в типичных исследованиях контрольных величин (до 100 000) авторы сравнили, как использование более консервативного порогового значения (1000) для возобновления АРТ повлияет на способность этих исследований обнаруживать увеличение числа контроллеров после лечения. CHAMP показало, что у 55% контроллеров после лечения первоначальные всплески вирусной нагрузки не превышали 1000 копий/мл, и в дальнейшем они сохраняли вирусную нагрузку ниже этого порога.
Используя эти данные, Лау и Кромер предположили, что использование порога в 1000 копий маскирует 45% естественных контроллеров после лечения, что может помешать обнаружить, когда терапия усиливает иммунный контроль участников над ВИЧ. Чтобы восстановить статистическую мощность, потребуется больше участников. Как и в приведенном выше примере, при мощности 80% и цели выявления 20-процентного повышение числа контроллеров после лечения свыше базового уровня 4%, более низкий порог вирусной нагрузки потребует увеличить количество участников с 60 до 120 как в лечебных, так и контрольных группах.
Как и в случае исследований TVR, ученые также оценили максимальный риск передачи ВИЧ во время определения контрольных величин, используя те же предположения, что и описанные выше (отсутствие стратегий профилактики и экспресс-тестирования на вирусную нагрузку, незащищенный секс, недельная задержка перед возобновлением АРТ). Из-за гораздо большей продолжительности испытаний и высоких пороговых значений вирусной нагрузки (для этого они сослались на исследование контрольных величин, в котором использовали данные 50 000 человек) они оценили максимальный риск передачи ВИЧ как 13 случаев на 1000 при вагинальных половых контактах, около 25 на 1000 — для вводящего партнера при анальном сексе, 214 на 1000 — крайне высокий — для принимающего партнера при анальном сексе.
Предлагаемая гибридная схема испытаний
Основываясь на собственном моделировании и оценках максимального риска передачи, ученые предлагают использовать гибридную модель для анализа прерывания лечения. В озвученной ими схеме прерывания будут начинаться с пятинедельного исследования TVR. Хотя оно, как правило, применяется, когда терапия нацелена на резервуары ВИЧ, у людей, отвечающих на терапию, направленную на усиление иммунитета, также будет наблюдаться более медленное восстановление вируса (если лечение было эффективным).
Начало испытания для оценки потенциального лечения с помощью исследования TVR подвергнет участников гораздо более коротким перерывам в лечении, что позволит исследователям определить, имела ли эта терапия достаточную эффективность, чтобы перейти к более длительному изучению заданных значений. Если медики согласятся с необходимостью дальнейшего исследования, а пациенты с вирусной нагрузкой ниже 1000 согласятся перейти к следующей фазе, они продолжат тщательное наблюдение в течение 24 недель или до тех пор, пока вирусная нагрузка участников не превысит 1000 копий/мл, после чего они возобновят АРТ.
Ученые рекомендуют провести экспресс-тестирование на вирусную нагрузку и возобновить АРТ в тот же день, чтобы свести к минимуму риск передачи инфекции. По их оценке, ограничение контрольной точки теми, кто уже демонстрирует контроль за вирусом, до вирусной нагрузки ниже 1000, снижение порога вирусной нагрузки для возобновления АРТ до 1000, ограничение продолжительности до 24 недель, а также включение тестирования по месту оказания медицинской помощи и возобновление АРТ в тот же день снижают максимальный риск передачи до 0,2 на 1000 при вагинальном сексе, до 0,35 на 1000 — для вводящего партнера при анальном сексе и до 3,1 на 1000 — для принимающего партнера при анальном сексе. И это значительное улучшение показателей по сравнению с оценкой, полученной в ходе традиционных исследований контрольных величин.
Если первоначальное исследование TVR показывает, что лечение не требует дальнейшего изучения (например, если не обнаружено позитивного эффекта), то ученые смогут избежать затрат на проведение длительного исследования контрольных величин.
Выводы
Ученые пришли к выводу, что в испытаниях лекарств недостаточно участников для обеспечения знаковой статистической мощности при умеренных результатах лечения. Поскольку чаще всего при испытаниях терапии также не используются контрольные группы, количественная оценка пользы лечения чрезвычайно сложна. Специалисты рекомендуют сотрудничать всем заинтересованным структурам для создания ретроспективной контрольной базы данных, которая позволила бы разработать схему испытаний, не полностью полагающуюся на контрольные группы плацебо. Тем не менее они отмечают, что задействование ретроспективных контрольных данных означает включение людей, которые с большей вероятностью начали АРТ во время хронической ВИЧ-инфекции, и тех, кто использует более старые схемы АРТ, которые могут действовать как искажающие факторы.
Тем не менее сокращение числа участников, получающих плацебо, снижение пороговых значений вирусной нагрузки, продолжительности испытаний и рисков передачи ВИЧ могут побудить большее число людей с ВИЧ участвовать в исследованиях с прерыванием лечения.
Читайте также:

