Вич у женщин лекарства
Обновлено: 24.04.2024
Испытания лекарств от ВИЧ часто включает в себя аналитическое прерывание лечения, когда пациенты с ВИЧ прекращают прием антиретровирусной терапии (АРТ), чтобы ученые могли понаблюдать, как неконтролируемый вирус реагирует на исследуемые препараты.
Участие в такого рода клинических испытаниях может вызвать страх у человека с ВИЧ, который привык поддерживать неопределяемую вирусную нагрузку. Кроме того, предыдущее исследование, проведенное доктором Лау, показало, что многие люди с ВИЧ не были уверены в том, как работают эти испытания, и многие из них не были готовы к длительным периодам определяемой вирусной нагрузки.
Ученые работают над различными стратегиями излечения ВИЧ-инфекции. Некоторые методы нацелены на сокращение латентных резервуаров ВИЧ — инфицированных иммунных клеток, которые не производят новые вирионы в течение многих месяцев или лет. Другие виды терапии пытаются повысить способность иммунной системы контролировать вирус.
Существуют два типа исследований, основанных на прерывании лечения, которые используются для оценки потенциальной терапии: изучение времени до восстановления вирусной активности (TVR) и изучение контрольных точек. В исследованиях TVR после того, как участники прекращают АРТ, ученые измеряют время, необходимое, чтобы вирусная нагрузка сначала достигла обнаруживаемого уровня (50 копий/мл), а затем время, необходимое для достижения более высокого порога (часто 10 000 копий/мл), после чего участники возобновляют прием АРТ. Если тем, кто получает лечение, требуется больше времени для достижения этих пороговых значений по сравнению с контрольной группой, это указывает на то, что терапия замедляет восстановление вирусной активности. Исследования TVR часто используются для оценки методов терапии, нацеленной на резервуары, обычно они длятся всего несколько недель.
Исследования контрольных точек демонстрируют, насколько эффективно иммунная система участников контролирует ВИЧ самостоятельно. В этих гораздо более длительных исследованиях (до нескольких месяцев) исследователи позволяют вирусным нагрузкам участников достигать высоких уровней, имитируя острую фазу ВИЧ, чтобы проследить, сможет ли их иммунная система в дальнейшем снизить эту нагрузку. Порог для возобновления АРТ обычно устанавливается на высоком уровне (часто 100 000 копий/мл). Когда участники, получающие лечение, способны контролировать ВИЧ при более низких уровнях вирусной нагрузки и в течение более длительного времени, чем участники контрольной группы, это говорит о том, что терапия повышает их иммунитет против вируса.
Несмотря на то, что нет конкретных рекомендаций, определяющих, как планировать исследования с прерыванием лечения, группа ученых, занимающихся исследованием ВИЧ, встретилась в 2018 году, чтобы обсудить этические стороны и выработать методы для снижения риска. Прекращение АРТ во время этих исследований не просто подвергает участников риску длительных периодов определяемой, а в некоторых случаях и высокой вирусной нагрузки. Более высокие вирусные нагрузки также могут подвергать опасности и ВИЧ-отрицательных половых партнеров участников.
До сих пор в большинстве исследований риск снижался за счет небольшого числа участников и отсутствия контрольной группы, которая вместо лечения принимала неактивное плацебо. Включение контрольной группы важно, потому что это позволяет ученым сравнивать тех, кто принимает лекарства, с теми, кто находится на плацебо. Тем не менее научное сообщество обсуждало этичность использования контрольных групп в подобных испытаниях лекарств, потому что они подвергаются длительным периодам повышенной вирусной нагрузки в отсутствие каких-либо препаратов, даже экспериментальных.
Исследование
Доктор Лау и ее коллеги использовали данные предыдущих клинических испытаний для создания математических моделей, позволяющих оценить, как различные их параметры влияют на статистическую мощность испытания.
Статистическая мощность аналогична чувствительности. Например, тест на ВИЧ с чувствительностью 80% успешно идентифицирует вирус у 80% людей, которые на самом деле ВИЧ-положительны, но не выявит у остальных 20% ВИЧ-положительных людей. Когда клиническое испытание, оценивающее лечебную терапию, должно достигнуть статистической мощности в 80% (при условии, что терапия имеет реальную пользу для тех, кто ее принимает), в испытании будет 80-процентная вероятность обнаружить пользу и 20-процентная вероятность ее упустить.
Проще говоря, чем больше данных задействовано в испытании, тем большей статистической мощностью оно будет обладать. Такие факторы, как количество участников, число контрольных параметров, продолжительность испытания и частота анализов крови, влияют на статистическую мощность испытания.
Результаты пробного моделирования TVR
В отношении недавнего исследования TVR с участием 13 человек такая модель показала, что при мощности 80% исследование выявило бы только лечение со значительным снижением реактивации (от 70 до 80%). Чтобы исследование TVR выявило снижение реактивации на 30%, потребуется уже по 120 участников в группе терапии и в контрольной группе. Поскольку в большинстве исследований TVR задействовано малое число участников, они, вероятно, не устанавливают умеренных результатов терапии.
Может показаться нелогичным планирование исследования для выявления меньшего эффекта от лечения, когда конечной целью является поиск максимальной пользы (т. е. терапия, приводящая к 100% снижению реактивации). Тем не менее на начальных этапах поиска лекарства необходимо фиксировать даже умеренные результаты, чтобы решить, требует ли этот метод дальнейшего изучения.
Помимо рекомендации увеличить количество участников, команда предлагает использовать ретроспективные контрольные данные в дополнение к контрольным группам. Данные из предыдущих испытаний, в которых люди прерывали АРТ, могли бы повысить потенциал выявления умеренной пользы от лечения. Они смоделировали гипотетическое исследование TVR, в которое вошли 50 участников и 50 человек из контрольной группы. При мощности 80% эта конструкция может обнаруживать снижение реактивации до 43%. Добавление ретроспективных данных еще 150 участников позволило бы в том же испытании выявить снижение до 36%.
Такое моделирование также не показало практически никакого улучшения способности обнаруживать снижение реактивации при увеличении продолжительности испытаний TVR свыше пяти недель. После этого срока модель предсказала улучшение обнаружения не более чем на 1%. Точно так же они не обнаружили практически никакой пользы от проведения лабораторного мониторинга чаще, чем раз в неделю. Наблюдение за людьми два раза в неделю почти не помогло обнаружить снижение реактивации.
Ученые провели отдельный анализ для оценки максимального риска передачи ВИЧ во время исследований TVR на основе предыдущих данных. Они оценили максимальный риск передачи, предполагая, что участники занимались незащищенным сексом и что доконтактная или другие методы профилактики не использовались. Кроме того, если во время еженедельного мониторинга не сообщать пациенту показатель вирусной нагрузки сразу же, то участник, которому необходимо возобновить АРТ (если его вирусная нагрузка превысила 1000), скорее всего, отложит это до следующего еженедельного визита.
Было подсчитано, что в этом случае во время пятинедельного исследования TVR с порогом вирусной нагрузки 1000 для повторного начала АРТ максимальный риск передачи ВИЧ составил 3,6 на 1000 участников, занимающихся вагинальным сексом. При анальном сексе для вводящих партнеров максимальный риск составлял около 7 на 1000, а для принимающих партнеров — около 70 из 1000. Изменение схемы исследования, включающее экспресс-тестирование на вирусную нагрузку и возобновление АРТ в тот же день, снижает предполагаемый максимальный риск до 0,9, 1,8 и 18 на 1000 соответственно.
Результаты моделирования исследования по контрольным величинам
Исследования контрольных точек должны иметь достаточную статистическую мощность, чтобы отделять преимущества предлагаемой лечебной терапии от контроля после лечения. Используя результаты исследования CHAMP, ученые предположили, что исходный уровень контроллеров после лечения ниже 4%. Если целью исследования было определить увеличение количества контролеров до 20% (это означает, что терапия помогла людям, которые не являются естественными контроллерами, подавить вирус), их модель показала, что 24-недельное исследование со статистической мощностью 80% потребует участия 60 пациентов.
Из-за чрезвычайно высоких вирусных нагрузок в типичных исследованиях контрольных величин (до 100 000) авторы сравнили, как использование более консервативного порогового значения (1000) для возобновления АРТ повлияет на способность этих исследований обнаруживать увеличение числа контроллеров после лечения. CHAMP показало, что у 55% контроллеров после лечения первоначальные всплески вирусной нагрузки не превышали 1000 копий/мл, и в дальнейшем они сохраняли вирусную нагрузку ниже этого порога.
Используя эти данные, Лау и Кромер предположили, что использование порога в 1000 копий маскирует 45% естественных контроллеров после лечения, что может помешать обнаружить, когда терапия усиливает иммунный контроль участников над ВИЧ. Чтобы восстановить статистическую мощность, потребуется больше участников. Как и в приведенном выше примере, при мощности 80% и цели выявления 20-процентного повышение числа контроллеров после лечения свыше базового уровня 4%, более низкий порог вирусной нагрузки потребует увеличить количество участников с 60 до 120 как в лечебных, так и контрольных группах.
Как и в случае исследований TVR, ученые также оценили максимальный риск передачи ВИЧ во время определения контрольных величин, используя те же предположения, что и описанные выше (отсутствие стратегий профилактики и экспресс-тестирования на вирусную нагрузку, незащищенный секс, недельная задержка перед возобновлением АРТ). Из-за гораздо большей продолжительности испытаний и высоких пороговых значений вирусной нагрузки (для этого они сослались на исследование контрольных величин, в котором использовали данные 50 000 человек) они оценили максимальный риск передачи ВИЧ как 13 случаев на 1000 при вагинальных половых контактах, около 25 на 1000 — для вводящего партнера при анальном сексе, 214 на 1000 — крайне высокий — для принимающего партнера при анальном сексе.
Предлагаемая гибридная схема испытаний
Основываясь на собственном моделировании и оценках максимального риска передачи, ученые предлагают использовать гибридную модель для анализа прерывания лечения. В озвученной ими схеме прерывания будут начинаться с пятинедельного исследования TVR. Хотя оно, как правило, применяется, когда терапия нацелена на резервуары ВИЧ, у людей, отвечающих на терапию, направленную на усиление иммунитета, также будет наблюдаться более медленное восстановление вируса (если лечение было эффективным).
Начало испытания для оценки потенциального лечения с помощью исследования TVR подвергнет участников гораздо более коротким перерывам в лечении, что позволит исследователям определить, имела ли эта терапия достаточную эффективность, чтобы перейти к более длительному изучению заданных значений. Если медики согласятся с необходимостью дальнейшего исследования, а пациенты с вирусной нагрузкой ниже 1000 согласятся перейти к следующей фазе, они продолжат тщательное наблюдение в течение 24 недель или до тех пор, пока вирусная нагрузка участников не превысит 1000 копий/мл, после чего они возобновят АРТ.
Ученые рекомендуют провести экспресс-тестирование на вирусную нагрузку и возобновить АРТ в тот же день, чтобы свести к минимуму риск передачи инфекции. По их оценке, ограничение контрольной точки теми, кто уже демонстрирует контроль за вирусом, до вирусной нагрузки ниже 1000, снижение порога вирусной нагрузки для возобновления АРТ до 1000, ограничение продолжительности до 24 недель, а также включение тестирования по месту оказания медицинской помощи и возобновление АРТ в тот же день снижают максимальный риск передачи до 0,2 на 1000 при вагинальном сексе, до 0,35 на 1000 — для вводящего партнера при анальном сексе и до 3,1 на 1000 — для принимающего партнера при анальном сексе. И это значительное улучшение показателей по сравнению с оценкой, полученной в ходе традиционных исследований контрольных величин.
Если первоначальное исследование TVR показывает, что лечение не требует дальнейшего изучения (например, если не обнаружено позитивного эффекта), то ученые смогут избежать затрат на проведение длительного исследования контрольных величин.
Выводы
Ученые пришли к выводу, что в испытаниях лекарств недостаточно участников для обеспечения знаковой статистической мощности при умеренных результатах лечения. Поскольку чаще всего при испытаниях терапии также не используются контрольные группы, количественная оценка пользы лечения чрезвычайно сложна. Специалисты рекомендуют сотрудничать всем заинтересованным структурам для создания ретроспективной контрольной базы данных, которая позволила бы разработать схему испытаний, не полностью полагающуюся на контрольные группы плацебо. Тем не менее они отмечают, что задействование ретроспективных контрольных данных означает включение людей, которые с большей вероятностью начали АРТ во время хронической ВИЧ-инфекции, и тех, кто использует более старые схемы АРТ, которые могут действовать как искажающие факторы.
Тем не менее сокращение числа участников, получающих плацебо, снижение пороговых значений вирусной нагрузки, продолжительности испытаний и рисков передачи ВИЧ могут побудить большее число людей с ВИЧ участвовать в исследованиях с прерыванием лечения.
В середине 1980-х ученые идентифицировали вирус иммунодефицита человека и сразу же стали искать лекарство. История антиретровирусной терапии началась в 1987 году, когда для лечения ВИЧ-инфекции стали использовать препарат зидовудин. Но его эффективность была невысокой, а побочные эффекты слишком сильными. Первая высокоэффективная терапия появилась только через десять лет — в 1996 году. Эта комбинация из нескольких лекарств блокирует размножение попавшего в организм вируса сразу на нескольких этапах его цикла. С тех пор ВИЧ-инфекция — не смертельное, а хроническое заболевание, которое можно контролировать при должном лечении.
Антиретровирусные препараты (АРВ) подавляют размножение ВИЧ, но неспособны полностью удалить вирус из организма, именно поэтому их нужно принимать постоянно в течение всей жизни. Как только концентрация препарата в крови падает ниже порогового значения, вирус снова начинает размножаться. Это особенно опасно, ведь если вирус размножается в присутствии небольшого количества лекарства, то он вырабатывает устойчивость к этому препарату.
Пить таблетки на протяжении всей жизни с точностью до минут — не самая простая задача. Этому мешают и банальная забывчивость, и разные случайные обстоятельства. А чем чаще человек нарушает время приема терапии, тем выше риск развития у вируса устойчивости. Именно поэтому врачи стараются назначать схемы с приемом лекарств один раз в день и с минимальным числом таблеток — чем реже и меньше нужно принимать лекарств, тем проще соблюдать режим. Правильное соблюдение режима приема терапии называют высокой приверженностью лечению.
Сейчас лучшими схемами считаются те, при которых пациенту нужно принимать одну таблетку один раз в день, да еще и независимо от приема пищи. Но настоящим прорывом в АРВТ станет разработка схем, при которых лекарство достаточно будет принимать всего один или несколько раз в месяц, — пролонгированных схем терапии. Хотя в настоящее время неизвестно, как поведут себя пролонгированные режимы в рутинной практике. Будет ли к ним сохраняться высокая приверженность — как это показывают исследования?
по теме

Общество
Грудное молоко VS смеси при ВИЧ: что говорят эксперты в 2020 году?
Основной недостаток таких таблеток — срок их действия ограничено временем нахождения таблетки в кишечнике и не превышает 12—24 часов. В случае же диареи таблетка может покинуть организм гораздо быстрее, а значит, уменьшится концентрация лекарства в крови, что может быть опасно. Для антиретровирусных препаратов создание таблеток или капсул с замедленным высвобождением лекарственного вещества не очень перспективно — современные схемы уже позволяют принимать терапию один раз в день. То есть удобство применения терапии такие таблетки не повысят.
Если нужно добиться продления эффекта препарата на дни и недели, а лекарство всасываться через кожу упорно не хочет, приходится прибегать к парентеральным пролонгированным формам. Можно зашить под кожу специальную стерильную таблетку, которая будет медленно растворяться и выделять лекарственное вещество: на коже делается небольшой разрез, в него вводят таблетку и зашивают рану.
Помимо таблеток, под кожу можно вводить специальные полимерные импланты, содержащие нужное лекарство. Преимущество имплантов — они могут выделять лекарственное вещество очень долго, до нескольких лет. Чаще всего такие импланты используют для гормональной контрацепции. Так как гормоны действуют в очень маленьких дозах, даже в небольшой по размерам имплант можно сразу поместить запас препарата на несколько лет. Например, противозачаточный препарат Имплантон, который вводится под кожу, продолжает действовать три года. Если действие препарата нужно прекратить — достаточно просто извлечь имплант.
Более простой вариант — ввести в мышцу взвесь маленьких крупинок лекарства в подходящем растворителе. Выглядит это как обычный укол, при этом крупинки лекарства задерживаются в мышце, медленно растворяются и попадают в кровь. Такие способы введения лекарства особенно удобны в случаях, когда пациент может часто пропускать прием препарата, или забывать, принял ли он лекарство. Например, в случае лечения психических заболеваний. Но есть и недостатки: вводить такой препарат должен медицинский работник, а в случае непереносимости или выраженных побочных эффектов лекарство очень трудно быстро удалить из организма.
Что уже доступно на рынке?
Многие фармацевтические компании проводят исследования пролонгированных АРВ-препаратов, но разработка одного такого препарата сама по себе очень большой пользы не принесет — ведь для лечения ВИЧ-инфекции необходимо сочетание нескольких препаратов, то есть нужна комбинированная пролонгированная схема.
Такую схему, разработанную ViiV Healthcare совместно с Janssen, одобрили в марте 2020 года в Канаде — первый пролонгированный комбинированный АРВ-препарат Cabenuva. Схема показала высокую эффективность и безопасность в клинических исследованиях LATTE-2, FLAIR, ATLAS с участием более тысячи пациентов. В состав Cabenuva входят каботегравир и рилпивирин, то есть это двухкомпонентная схема. Препарат вводят один раз в месяц внутримышечно.
Перед началом применения Cabenuva пациент не менее месяца принимает каботегравир в таблетках (называется Vocabria) в комбинации с Эдюрантом — таблетками рилпивирина. Это необходимо, чтобы проверить переносимость такой схемы у конкретного пациента и оценить побочные эффекты. Если схема переносится хорошо, пациенту вводят первую нагрузочную дозу Cabenuva — 3 миллилитра суспензии, содержащей 600 миллиграммов каботегравира, и 3 миллилитра суспензии, содержащей 900 миллиграммов рилпивирина. Суспензии вводятся в разные участки ягодичной мышцы, то есть делают два укола. После этого поддерживающие дозы вводят ежемесячно: 2 мл (400 мг) каботегравира и 2 мл (600 мг) рилпивирина. Если по каким-то причинам введение очередной ежемесячной поддерживающей дозы невозможно, пациент до момента следующей инъекции может принимать пероральную схему (Vocabria + Эдюрант). Пролонгированная форма каботегравира также имеет большие перспективы для использования в качестве доконтактной профилактики ВИЧ-инфекции.
Еще один препарат, который уже применяется в клинической практике, — ибализумаб (Трогарзо) — можно назвать пролонгированным с несколькими оговорками. По химической природе ибализумаб — моноклональное антитело, то есть близок к человеческим иммуноглобулинам. Ибализумаб связывается с некоторыми белками на поверхности вируса и мешает проникновению ВИЧ в клетки. Препарат вводят внутривенно один раз в две недели и часто сочетают с другими АРВ-препаратами. Такая схема — не самый удобный вариант, поэтому сейчас ибализумаб используется только для лечения ВИЧ с множественной лекарственной устойчивостью, когда другие схемы оказываются неэффективными. Поэтому ибализумаб правильнее будет отнести к нишевым препаратам.
К сожалению, на этом и заканчивается не очень длинный перечень пролонгированных АРВ-препаратов, которые уже применяются на практике. Дальше пойдет речь о препаратах, находящихся на разных стадиях исследований.
Что сейчас находится в разработке?
PRO 140
С точки зрения места в клинической практике на ибализумаб похоже еще одно моноклональное антитело, находящееся в стадии клинических исследований, — PRO 140. Этот препарат также можно будет использовать для лечения ВИЧ-инфекции, если у пациента не работают другие схемы. А по механизму действия PRO 140 похож на уже существующий на рынке препарат маравирок (Целзентри). Он связывается с CCR-5 рецепторами на поверхности клеток-мишеней и мешает проникновению вируса в клетку. Строение активного центра молекулы PRO 140 отличается от маравирока, поэтому он активен даже в тех случаях, когда вирус выработал устойчивость к маравироку. Как и маравирок, PRO 140 активен только против CCR-5-тропных подтипов ВИЧ, то есть подойдет не всем пациентам. Препарат вводят внутривенно, один раз в неделю.
Нейтрализующие антитела
На разных стадиях клинических исследований находятся несколько перспективных антител, которые связываются с вирусным белком gp120 и нейтрализуют вирус: VRC01, 3BNC117 и 10-1074. Предполагается, что эти препараты достаточно будет вводить раз в месяц или даже реже и их можно будет применять совместно с другими пролонгированными АРВ-препаратами.
Албувиртид
Аналог уже применяющегося на практике энфувиртида (Фузеон). Этот препарат связывается с вирусным белком gp-41 и мешает проникновению вируса в клетку. Основное отличие в том, что Фузеон вводят подкожно два раза в сутки, что очень неудобно, а албувиртид — только один раз в 2—4 недели. Препарат должен применяться совместно с другими АРВ-лекарствами.
С самого зарождения эпидемии ВИЧ медицинское научное сообщество было занято поиском эффективного способа предотвращения передачи ВИЧ-инфекции.
Кроме использования средств барьерной контрацепции (презервативов) существуют и иные способы обезопасить себя от ВИЧ-инфекции. Самый главный из них — PrEP, или так называемая доконтактная профилактика (ДКП).
Препараты PrEP — это те же вещества, которыми лечат ВИЧ, но принимаются они по усеченной, неполной схеме. Механизм действия ДКП прост: если лекарство успело попасть в организм заранее, то при попадании в него вируса оно способно убить ВИЧ еще до того, как тот успеет закрепиться в нем.
Защита, которую предлагает PrEP, достаточно надежна и приближается к 100 %, если принимать таблетки правильно.
Что это за таблетки?
Сразу стоит дать названия, существуют две схемы ДКП, которые рекомендованы для использования:
(в одной таблетке — тогда они называются Трувада, либо по отдельности);
Почему именно эти препараты? Для того чтобы ответить на вопрос, можно или нет использовать конкретное лекарство для ДКП, надо провести клиническое исследование. Без клинических исследований подтвердить такой тезис невозможно. Поэтому придерживаться стоит тех схем, которые уже были испытаны и утверждены в качестве PrEP.
Именно поэтому, когда мы говорим о доконтактной профилактике, как правило, речь идет о двух препаратах, как это уже было сказано: тенофовире и эмтрицитабине. Если вы обратитесь в аптеку, то их комбинация в одной таблетке будет стоить порядка 14 000 рублей. Однако допустимо применение и других апробированных для ДКП лекарств. Например, тенофовира и ламивудина. Эта схема также одобрена Всемирной организацией здравоохранения (ВОЗ), они, купленные по отдельности, будут стоить не 14 000, а порядка 1000 рублей.
Какой схемой воспользоваться — решать вам. В целом ДКП сейчас доступна в разных формах для пациентов с разным достатком, и самые дешевые ее схемы могут стоить не более двух тысяч рублей в месяц.
А можно подробнее про механизм действия?
Можно. Итак, доконтактная профилактика заключается в приеме двух препаратов, относящихся к классу ингибиторов обратной транскриптазы, ВИЧ-отрицательными людьми. То есть людьми, в чьем организме вируса пока еще нет.
Что делают эти препараты? На картинке ниже вы можете увидеть жизненный цикл вируса иммунодефицита, как он прикрепляется к клетке и вбрасывает внутрь нее свой генетический материал.
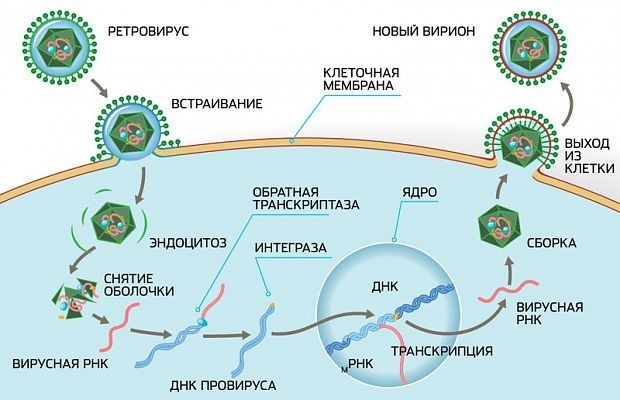
Этот генетический материал под воздействием особого фермента — обратной транскриптазы — запускает процесс репликации новых вирусов.
Два исследования — iPrEx и Partners (оба они проводились в США и Западной Европе) — продемонстрировали крайне высокую эффективность защиты PrEP, в отдельных случаях приближающуюся к 99 %.
В обоих лекарство тенофовир + эмтрицитабин, известное как Трувада, тестировалось на людях, относящихся к ключевым, то есть наиболее уязвимым для эпидемии, группам, — на мужчинах, практикующих секс с мужчинами, и трансгендерных женщинах (mtf). И именно у них этот метод профилактики показал свою наибольшую эффективность.
(Противо)показания к началу ДКП
В настоящее время в России ДКП одобрена Министерством здравоохранения в качестве дополнительного метода профилактики ВИЧ-инфекции и даже попала в клинические рекомендации, так что врач, пусть пока и не имеет возможности выдавать ее бесплатно, как выдаются препараты АРВТ, все же может легально рассказать своим пациентам, где можно приобрести необходимые таблетки, что для этого нужно сделать и как их принимать.
Главным противопоказанием к началу ДКП, конечно, является наличие у пациента ВИЧ-инфекции или симптомов, указывающих на так называемую острую фазу ВИЧ, которая имеет место примерно через две недели после проникновения вируса в организм.
Побочные эффекты
Безопасна ли ДКП? Да. Она безопасна. Оба режима одинаково эффективны. Всего в настоящий момент мы знаем лишь о семи случаях получения вируса на PrEP. А учитывая, что во всем мире примерно полмиллиона человек принимают доконтактную профилактику, семь случаев — это весьма немного.
Два из них были связаны с низкой приверженностью (пропуском приема профилактического препарата), два — с наличием резистентного к эмтрицитабину штамма ВИЧ. Два человека были инфицированы еще до начала доконтактной профилактики. Буквально недавно мировые СМИ сообщили о еще одном случае инфицирования ВИЧ на доконтактной профилактике. На этот раз вирус получил активист в Австралии, который более пяти лет принимал PrEP именно в разовом режиме.
Сейчас идет расследование этого инцидента, и мы пока не знаем точно, в чем была его причина. Что же касается побочных эффектов, они встречаются крайне редко и при должном внимании врача легко контролируются.
Долгосрочные эффекты, например деминерализация костной ткани, появляются не сразу, и, по большому счету, слишком бояться их не стоит. Деминерализация костной ткани, связанная с тенофовиром, проходит в течение, как правило, месяца после остановки приема и не является необратимой. То же самое касается снижения функции почек.
Когда он появится на наших прилавках — сказать сложно. Но в любом случае стоит помнить: даже если это лекарство и появится в России, ДКП — это не витамины, которые можно принимать самостоятельно. Любые побочные эффекты должен отслеживать врач, равно как и назначать сам препарат. Кому стоит обратиться к ДКП, а кому повременить? В идеале такое решение должен принимать не сам пациент в режиме самолечения, а специалист, обладающий достаточной квалификацией.
Как правильно приостановить прием ДКП?
Если вы мужчина или трансгендерная женщина и хотите безопасно прекратить прием доконтактной профилактики, вам необходимо принимать ДКП как минимум еще два дня после последнего рискованного полового контакта. И только через два дня в случае отсутствия в течение этого времени опасных контактов перестать пить таблетки.
Для женщин на ДКП необходимо как минимум семь дней приема ДКП после последнего рискованного контакта. Это связано с особенностями женского организма и того, как ведут себя препараты PrEP в нем.
Чтобы возобновить прием доконтактной профилактики, вы должны быть уверены в отсутствии рисков в период без ДКП. Если риски все же были, то необходимо сделать тест на ВИЧ. Но помните про период серонегативного окна — 4-6 недель с момента последнего риска.
Чтобы начать пить доконтактную профилактику на постоянной основе, необходимо непрерывно принимать ДКП на протяжении семи дней до первого рискованного контакта. Либо (только для мужчин) можно принять двойную дозировку, а затем каждые 24 часа принимать по одной дозе ДКП.
Постконтактная профилактика ВИЧ (ПКП)
Если опасный контакт все-таки случился, а вы не успели обезопасить себя ни с помощью презерватива, ни с помощью препаратов ДКП, и со времени контакта прошло не более 72 часов, избежать инфицирования вам может помочь так называемая постконтактная профилактика.
Заключается она в том, что в указанный срок вам необходимо начать прием препаратов, которыми обычно лечат ВИЧ-инфекцию, но, в отличие от PrEP, тут принимать лекарства придется в полной дозировке, такой, какую принимают люди, у которых уже диагностирована инфекция.
Многочисленными исследованиями доказано: если начать такой прием вовремя, есть большой шанс, что вирус не успеет закрепиться в организме и заболевания удастся избежать. Идеально начать прием лекарств в первые два часа или хотя бы в первые сутки после контакта. Чем позже будет начат такой прием, тем меньше вероятность, что терапия сработает.
Курс профилактики длится 28 дней, и по завершении его необходимо сделать тест, чтобы удостовериться в его эффективности.
Важно! Лекарства, которые вам придется принимать, по факту продаются БЕЗ РЕЦЕПТА, но найти их можно не в каждой аптеке. Поэтому времени на раздумья у вас немного. Возможно, на то, чтобы собрать необходимую комбинацию таблеток, у вас может уйти более суток, так что поиск стоит начать прямо сейчас.
Всего вам придется купить три препарата и принимать нужно будет все три. По отдельности они не работают.
На сегодняшний день ВИЧ-инфекция неизлечима полностью. Но своевременная и грамотно подобранная высокоактивная антиретровирусная терапия (ВААРТ), успешно сдерживает прогрессирование заболевания и его переход в стадию СПИД. Прием терапии позволяет ВИЧ-инфицированному пациенту жить полноценной жизнью – учится, работать, создавать семью, заниматься любимым делом и даже иметь здоровых детей. При своевременном выявлении ВИЧ, на время приема терапии вирус в крови не обнаруживается, человек безопасен для окружающих, инфекция не влияет на продолжительность жизни.

Каждый год для борьбы с ВИЧ разрабатывают новые препараты.
Что такое антиретровирусная терапия?
Высокоактивная антиретровирусная терапия – это современный метод терапии ВИЧ-инфекции. Она подразумевает прием 3-4 препаратов, действие которых направлено на подавление вируса иммунодефицита. Проводимая терапия преследует сразу 3 жизненно важных цели.
- Вирусологическая – подавляет самовоспроизведение вирионов вируса в организме пациента.
- Иммунологическая – поддерживает стабильность иммунной системы для формирования адекватного иммунного ответа.
- Клиническая – тормозит развитие СПИДа и сопутствующих ему заболеваний, тем самым повышая качество жизни и увеличивая ее продолжительность.
Отказ от терапии неизбежно приводит к осложнениям и развитию СПИДа. Люди, живущие без терапии, сталкиваются с онкологическими патологиями и оппортунистическими инфекциями, вызывающими развитие туберкулеза, менингита, энцефалита, пневмонии и других заболеваний. Продолжительность жизни на стадии СПИД без лечения не превышает 6-9 месяцев.
Принцип действия терапии анти-ВИЧ
В основе ВААРТ лежит комбинация 3-4 препаратов, действие которых подавляет ВИЧ на всех стадиях развития, в том числе и его мутации. Проблема в том, что помимо способности создавать собственные копии (репликации), вирус иммунодефицита характеризуется высокой мутагенностью – он способен подстраиваться под любые неблагоприятные условия, продолжая создавать свои репликации и мутации.
Как принимать АРВТ?
Антиретровирусная терапия проводится с соблюдением следующих принципов.
- Лекарства принимаются в строго определенное время!
- Пропускать прием препаратов нельзя!
- Самостоятельно увеличивать или уменьшать дозу препарата недопустимо!
- Препараты, режим приема и дозу препарата назначает только врач!
В процессе лечения состав АРВТ может корректироваться, что позволяет добиться максимальной эффективности проводимого лечения.
Важно понимать, что вопросы по типу, “принимать ли мне сегодня лекарства или не принимать?”, в данном случае не уместны. Конечно, соблюдать столь строгий режим, по понятным причинам, по силу не каждому пациенту. Но жить с ВИЧ без терапии – это равносильно собственноручно подписанному смертному приговору, когда у человека есть выбор и возможности для спасения.
Где выписать лекарства от ВИЧ?
Лечением ВИЧ-инфекции занимается врач-инфекционист Свердловского областного центра профилактики и борьбы со СПИД. Главное помнить – самолечение не допустимо! При подозрении на ВИЧ и после подтверждения диагноза, лечением инфекции должен заниматься исключительно профильный специалист.
Большая часть лекарств от ВИЧ находятся в списке жизненно необходимых и важнейших лекарственных препаратов. Поэтому расходы на лечение пациентов оплачиваются государством – за счет федерального и регионального бюджета. Препараты выдаются ВИЧ-позитивным пациентам в Свердловском областном центре профилактике и борьбе со СПИДили в аптеках при наличии рецепта от лечащего врача. Для их получения, пациента в обязательном порядке ставят на диспансерный учет.
Какие лекарства лечат ВИЧ?
Для общего ознакомления перечислим классы лекарств, принцип их действия и препараты с помощью наглядной таблицы.
Нуклеозидные ингибиторы* обратной транскриптазы
Подавляют обратную транскриптазу - фермент ВИЧ, который отвечает за создание ДНК репликаций
Абакавир, Зальцитабин, Ламивудин, Ставудин и др.
Ненуклеозидные ингибиторы обратной транскриптазы
Воздействуют на обратную транскриптазу
Невирапин, Рилпивирин, Эфавиренз, Элсульфавирин и др.
Блокируют фермент-протеазу вируса, в результате чего образуются вирионы, не способные заражать новые клетки организма
Ампренавир, Индинавир, Нелфинавир, Ритонавир и др.
Блокируют фермент вируса, который участвует в процессе встраивания вирусной ДНК в геном клетки-мишени
Ралтегравир, Долутегравир, Элвитегравир.
Препятствуют проникновению вирионов ВИЧ в клетку-мишень
Блокируют последний этап проникновения вирионов ВИЧ в клетку-мишень
*Ингибиторы – вещества, подавляющие течение физиологических процессов.
Несмотря на важность и жизненную необходимость лечения, в некоторых случаях, пациенты могут не выдерживать график приема лекарств, что затрудняет проведение терапии и снижает ее эффективность. Поэтому сегодня специалисты активно разрабатывают новые схемы ВААРТ, предполагающие однократный прием препарата - 1 раз в сутки. Для однократного приема уже одобрены такие лекарства, как Атазанавир, Абакавир, Диданозин, Тенофовир, Ламивудин, Эмтрицитабин, Эфавиренз и другие самые современные антиретровирусные средства.
Популярные вопросы и проблемы ВААРТ
Можно ли заразиться, если партнер принимает терапию?
Грамотно проводимая ВААРТ угнетает активность вируса, поэтому риск заражения минимальный. Но только в том случае, если у ВИЧ-позитивного пациента зафиксированы низкие или неопределяемые показатели вирусной нагрузки на организм. Если же вирусная нагрузка высокая, то риск инфицирования возрастает.
Половые партнеры должны быть информированы о ВИЧ-статусе друг друга. Наличие сопутствующих инфекций, передающихся половым путем, а также гепатита, увеличивает вероятность передачи инфекции в 3-5 раз. Даже при условии, что уровень вирусной нагрузки снижается до 3500 копий РНК ВИЧ и ниже в 1 мл крови, все равно риск передачи инфекции сохраняется. Поэтому половым партнерам необходимо использовать презервативы при любой форме полового акта.
Можно ли пить алкоголь во время терапии?
Препараты антиретровирусной терапии не совместимы с алкоголем. Более того! Прием алкоголя угнетает функции и без того ослабленной иммунной системы, создает повышенную нагрузку на организм и усиливает токсическое влияние ингибиторов – принимаемые в ходе ВААРТ препараты.
Можно ли родить здорового ребенка, если принимать ВИЧ терапию?
Применение грамотной ВААРТ позволяет снизить риск передачи инфекции до 2% и ниже. Поэтому у новорожденных от ВИЧ-инфицированной матери есть все шансы не унаследовать заболевание. Подтвердить или опровергнуть ранний диагноз позволяет своевременная диагностика методом ПЦР (полимеразной цепной реакции). Для этого кровь малыша исследуют два раза - в возрасте 1-4 месяцев, и в возрасте старше 4 месяцев. Если оба раза результаты ПЦР отрицательные, то можно говорить о том, что ребенок родился здоровым.
Мне назначили ВААРТ, но мне от нее хуже, что делать?
Антиретровирусные препараты для лечения ВИЧ обладают побочным действием, собственно, как и любые лекарства. Часть побочных эффектов проявляется практически сразу. Например, у пациента повышается температура, появляются проблемы с желудочно-кишечным трактом, кожные высыпания, увеличивается уровень инсулина в крови. ВИЧ-позитивный пациент может заметно худеть или набирать вес. Возникающие побочные эффекты создают дополнительную нагрузку на организм. Чтобы избежать этого, необходимо регулярно проходить обследование и при необходимости корректировать схему проводимой ВААРТ. Именно корректировать, а не отказываться от лечения!
Можно ли заразиться ВИЧ, если принять терапию после вероятного заражения?
У моего полового партнера ВИЧ, нужно ли мне проходить терапию, чтобы не заразиться?
Проходить ВААРТ здоровому человеку с целью профилактики ВИЧ не нужно. Достаточно использовать презерватив во время каждого полового контакта в любой форме.
Важно знать! Продолжительность жизни ВИЧ-инфицированного пациента зависит не только от эффективности ВААРТ, но и общего состояние здоровья и иммунитета. Организм людей с крепким иммунитетом, которые не имеют в своем анамнезе хронических заболеваний и врожденных патологий, лучше противостоит развитию ВИЧ-инфекции. И наоборот, ослабленный организм не в состоянии бороться с вирусом. Поэтому помимо антиретровирусной терапии, всем ВИЧ-положительным пациентам рекомендован здоровый образ жизни и правильное питание. Они должны беречь себя от инфекционных и простудных заболеваний. Укреплять свой иммунитет и в обязательном порядке проходить регулярное обследование организма.
Все интересующие вопросы лучше задавать профильным специалистам Свердловского СПИД-центра или лечащему врачу по месту жительства.

Вирус иммунодефицита человека (ВИЧ) ― серьезное заболевание, которое на данный момент невозможно вылечить. При грамотной медикаментозной поддержке инфицированный человек способен жить полноценной жизнью до глубокой старости. Женщина с ВИЧ может родить здорового и крепкого малыша, несмотря на свой диагноз. Однако существуют четко прописанные правила, которых следует придерживаться на этапе подготовки к беременности и родам.
ВИЧ-инфицированная мать может передать болезнь своему ребенку тремя путями:
- во время беременности;
- во время родов;
- в процессе грудного вскармливания.
Антиретровирусная терапия (АРТ) и снижение вирусной нагрузки могут предотвратить перинатальную передачу ВИЧ, повысив защиту организма роженицы и малыша. Беременная женщина должна осознавать степень ответственности, которая на нее ложится. Соблюдение рекомендаций врачей на этапе планирования беременности, вынашивания плода и родов существенно повысит шанс родить здорового ребенка.
Как предотвратить передачу ВИЧ ребенку?
Женщины, которые планируют беременность, в обязательном порядке должны пройти тестирование на ВИЧ. Чем раньше обследование будет сделано, тем лучше. При обнаружении вируса необходимо незамедлительно встать на учет для получения медицинской поддержки и назначения лекарств, которые помогут свести к нулю риск передачи заболевания ребенку.
Анализ проводится в начале беременности и на 30-й неделе вынашивания плода. Этого достаточно, чтобы подтвердить болезнь или опровергнуть ее существование. Зная о заражении и не предпринимая никаких мер, женщина создает беспрецедентную ситуацию, в которой риск передачи болезни ребенку возрастает до 30-40%. При осуществлении профилактических мер противодействия, ВИЧ у детей проявляется в менее чем в 2% случаев.
Как организм пытается защитить ребенка во время беременности?
Природа предусмотрела естественные механизмы защиты ребенка от ВИЧ во время беременности. Этому способствует несколько фактов:
- Неблагоприятная кислотная среда влагалища для выживания сперматозоидов. Эта среда точно также неблагоприятна для вируса, она остается такой на протяжении всей беременности при условии, что нет инфекций, передающихся половым путем.
- Гормональный фон во время беременности способствует утолщению стенок влагалища, что создает хороший защитный барьер против проникновения инфекций извне.
- Защитная слизистая оболочка шейки матки остается неизменной на протяжении всего периода вынашивания плода, что осложняет проникновение вируса внутрь.
В дополнение к этому, неповрежденная плацента является еще одним барьером против передачи ВИЧ ребенку во время беременности. Однако всего этого недостаточно без целенаправленной и персонально разработанной помощи врачей.
Как вирус ВИЧ может передаться ребенку?
Женщины с ВИЧ-инфекцией в одном случае из четырех могут передать болезнь своему ребенку при отсутствии квалифицированной медицинской поддержки. Эти риски существенно возрастают, когда появление малыша на свет преждевременно. Высоки они при разрывах тканей, кровотечениях, использовании щипцов. Врачи снижают опасность, разрабатывая индивидуальные решения для благополучных родов.
Наблюдение в СПИД-центре во время беременности
Если у Вас обнаружам ВИЧ во время обследования в женской консультации, вас направят в городский СПИД-центр. Здесь все создано для того, чтобы оказавшиеся в сложной ситуации люди, получили помощь специалистов. Квалифицированные врачи работают с пациентами, предлагая современные методы терапии с высокой эффективностью и минимальными побочными реакциями. При первичном посещении центра вас направят на контрольный скрининг крови, а затем на обследование к эпидемиологу.
Специалист проведет с вами беседу. Расскажет, как жить с болезнью, как предотвратить ее передачу другим людям. Обязателен визит к гинекологу центра, если беременность уже развивается. После тщательного изучения ситуации и постановки сроков вы будете направлены к врачу-инфекционисту. Беременные женщины не стоят в общей очереди, отношение к ним максимально деликатно на всех этапах обследования. Именно инфекционист принимает решение о начале ВААРТ. При этом учитывается клиническая картина заболевания, выявляются показатели вирусной нагрузки, статус.
Главная задача врачей СПИД-центра заключается в снижении нагрузки до уровня, когда ее невозможно определить. Это поможет защитить развивающегося в утробе матери малыша от опасности заражения.
Кто назначает анти-ВИЧ терапию для беременных?
При выборе препаратов для лечения врач руководствуется максимальной безопасностью их действия на плод. Использование этих средств подтверждено мировой клинической практикой. Лекарства выписываются для получения в аптеке СПИД-центра. Наблюдение за состоянием будущей роженицы также осуществляется по месту жительства. Перед поступлением в родильный дом женщина получает необходимые рекомендации от инфекциониста и полный перечень лекарств, которые будут необходимы во время пребывания в предродовом и родильном отделении.
Опасны ли антиретровирусные препараты для малыша?
Классические роды или кесарево сечение - что выбрать при ВИЧ?
Чтобы не передать ВИЧ от матери к младенцу, способ появления ребенка на свет принимается в каждом отдельном случае индивидуально. Все зависит от вирусной нагрузки на сроке 36 недель. Если нагрузка вируса на организм высока, может быть рекомендовано кесарево сечение. Если уровень нагрузки низкий, может приниматься решение в пользу классических родов.
Может ли мать кормить грудью ребенка при ВИЧ-положительном статусе?
Передача вируса через грудное молоко является одним из источников опасности распространения болезни. По данным ВОЗ, грудное вскармливание ― бесценный ресурс здоровья для малышей. Назначение АРТ-препаратов маме и малышу способно свести к минимуму риск заражения. Однако решение о кормлении грудью все же остается за матерью.
Как узнать, является ли ребенок ВИЧ-положительным после появления на свет?
Определить, есть ли у ребенка вирус иммунодефицита человека, помогают анализы крови. Обычно они проводятся трижды для получения объективных результатов:
- в течение первых нескольких дней;
- в возрасте 1-2 месяца;
- в возрасте 4-6 месяцев.
Если все проведенные тесты отрицательны, у ребенка нет ВИЧ. Рекомендуется также сдать анализы по достижению ребенком 1-2 лет. Если анализы показали присутствие вируса в крови, должно быть назначено лечение антиретровирусными препаратами. Эти лекарственные средства эффективны, безопасны и помогут сохранить иммунитет малыша.
Анализы крови на ВИЧ у новорожденного ребенка
Ребенок, рожденный от ВИЧ-положительной матери, с момента появления на свет дает отрицательный результат при тестировании. Это является нормой, ведь ему передаются антитела матери на физиологическом уровне для создания защитного барьера от инфекции.
Белки, которые определяет скрининг-система, уходят из поля видимости примерно к 1,5 годам. Положительный результат ПЦР-анализа может свидетельствовать о возможном заражении ребенка, однако для окончательной установки диагноза важно полное обследование на базе СПИД-центра.
Самым лучшим исходом событий после родов считается отрицательный ПЦР у ребенка на следующий день после рождения от ВИЧ-положительной матери. Этот результат подтверждает, что передачи ВИЧ во время беременности не было. Если такой же ответ при использовании ПЦР будет получен в 1 месяц жизни, это станет показателем того, что инфицирования не было и при родах. В среднем достоверность таких данных составляет 93%.
Если в период с 4 до 6 месяцев ПЦР показывает еще один отрицательный результат ― вероятность отсутствия вируса в крови ребенка максимально приближена к 100%. Чтобы полностью исключить риски, достаточно провести 2 и более исследования крови после 1 месяца, а также сделать 2 скрининга после исполнения года. Также должно отсутствовать грудное вскармливание на протяжении последних 12 месяцев.
Читайте также:

