Вид анемии возникающей при сепсисе
Обновлено: 19.04.2024
Сепсис представляет собой заражение крови продуктами гнилостного распада, имеющего место в организме вследствие воспалительного неадекватного леченого процесса. По сути, сепсис - это воспаление, распространившееся на весь организм. Это системный ответ на обильное пребывание в крови бактерий, независимо от места их проникновения и скопления.
Это достаточно опасное для организма состояние, стремительно идущее к летальному исходу и потому требующее немедленной и адекватной терапии.
Вопреки постоянно совершенствующимся медицинским технологиям сепсис сегодня, как и много лет назад остается актуальной проблемой. Для лечения сепсиса используются новые поколения антибактериальных препаратов, однако и это не устраняет болезнь из рейтинга причин смерти в отделениях интенсивной терапии. Примечательно, что 18% из тех, по отношению к кому применялась интенсивная терапия лечения в условиях медицинского учреждения, сталкивались с развитием сепсиса, еще в 63% случаев он сопровождал внутрибольничные инфекции.
К инфекциям, распространение которых по организму рискует завершиться сепсисом, относят:
- бактерии
- стафилококк,
- стрептококк,
- пневмококк,
- синегнойная палочка,
- клебсиелла,
- кандида,
- герпес,
- токсоплазмоз.
Для того чтобы инфекционный процесс в организме перерос в сепсис необходимо сочетание трех обстоятельств:
- наличие возбудителя инфекции;
- отрицательное состояние первичного очага инфекции;
- соответственная реактивность организма.
Риск развития сепсиса обуславливается не столько свойствами инфекции, сколько ее концентрацией в первичном очаге, распространением отсюда вглубь организма и ток крови. Непоследнюю роль играет и резистентность организма, которая легко подавляется под воздействием неблагоприятных факторов. Среди последних:
- любые заболевания
- эндокринные и обменные, в частности сахарный диабет,
- онкологические,
- гематологические,
- иммунологические,
- низкое содержание белка,
- хронические гиповитаминозы,
Механизм развития сепсиса берет начало с того, что из первичного очага инфицирования через кровеносные или лимфатические сосуды происходит, соответсвенно, гематогенная или лимфогенная диссеминация инфекции. Следственно, происходит образование вторичных септических очагов, так называемых метастазов, из которых инфекция также распространяется в кровь. Каковой будет локализация метастазов, зависит от типа возбудителя. Гнойники могут образовываться в любых внутренних органах.
![сепсис]()
При сепсисе случаются органно-системные повреждения, чем продолжается механизм заболевания. Это случается в силу отсутствия контроля над распространением провоспалительных медиаторов из первичного очага инфекции. Затем происходит их активация под влиянием макрофагов, нейтрофилов, лимфоцитов и других клеток в любых органах и тканях; повторно выделяются те же провоспалительные медиаторы и повреждается эндотелий.
Разновидности сепсиса
Чаще всего сепсис случается после воспалительного процесса конкретной локализации. Однако не менее распространен и раневой сепсис. И тот, и другой развивается на фоне сниженной резистентности макроорганизма к распространяющейся патогенной микрофлоре и на фоне ослабленного иммунитета. Упадок защитных способностей организма вследствие воспаления, раны, операционного вмешательства или тяжелого заболевания нередко дополняется крупной кровопотерей и недостаточным питанием.
Частыми источниками септической инфекции медики называются нагноения при выше описанных условиях. Нечто подобное способно развиться и при местных гнойных заболеваниях как то фурункул, карбункул, флегмона.
Зависимо от первичного очага сепсиса и его происхождения различают:
- хирургический сепсис - вследствие нагноения в ране, локализированных гнойниках;
- акушерско-гинекологический сепсис - вследствие родов или абортов, случившихся в нестерильных условиях, когда микротрещины или разрывы в родовых путях становятся "входными воротами" для инфекции;
- урологический сепсис - вследствие гнойных процессов и отяжеленных воспалений в мочеполовых органах, что обычно сопровождается и застоем, инфицированием мочи;
- риногенный, тонзилогенный, отогенный сепсис - редкие формы заражения крови, которые берут начало с локализации инфекции в полости рта, носу, околоносовых пазухах, носоглотке, ухе; для того чтобы течение инфекции обрело столь тяжелую форму необходимым условием становится тромбофлебит кавернозного синуса или тромбоз вен клетчатки глазницы, тромбофлебит сигмовидного и каменистого синусов.
Кроме того, выделяют септичемическую и септикопиемическую разновидность сепсиса:
- септицемическая - не сопровождается образованием метастатических очагов гнойной инфекции, однако склонная к перерастанию в септикопиемическую;
- септикопиемическую - характеризуется образованием метастатических очагов гнойной инфекции, откуда происходит все более глубокое распространению инфекции.
Заражение крови может протекать в четырех формах:
- молниеносная - несколько суток;
- острая - 5-7 суток;
- подострая - менее 6 недель;
- хроническая - более 6 недель.
Симптомы сепсиса
Коварство заболевания заключается в риске его симптомов оказаться размытыми. Объясняется это тем, что в разгар первичного заболевания свойства возбудителей поддаются изменениям из-за массивной антибиотикотерапии, несколько угнетаются, однако не всегда сам возбудитель уничтожается. Такое латентное его пребывание в организме чревато дальнейшим распространением даже при относительно невысокой температуре тела. Хотя именно устоявшаяся лихорадка гектического типа считается отличительным признаком сепсиса при наличии предпосылок к тому, то есть выше перечисленных факторов. Кроме нее возможны:
- обильное потоотделение при снижении температуры тела,
- в соответствии со скачками температуры скачкообразным становится и пульс,
- ознобы и головная боль, общая слабость,
- рвота и понос,
- утрата аппетита,
- обезвоживание и стремительная утрата веса,
- землистый цвет кожных покровов (если нарушается функция печени, кожа желтеет), утрата ими эластичности и упругости;
- образование флегмон и абсцессов различной локализации.
Возможны изменения психоэмоционального статуса вплоть до грубых общемозговых расстройств - коматозное состояние. В последующем присоединяются воспалительные изменения со стороны внутренних органов: почек, эндокарда, печени, кишечника, селезенки.
При сепсисе наблюдается тахикардия (более 90 ударов в минуту) и тахипноэ (более 20 вдохов в минуту).
Диагностика сепсиса
Заподозрить сепсис стоит если при инфекционно-воспалительном заболевании, вследствие ранения или операционного вмешательства лихорадка держится более 5 дней, и скачки температуры становятся немотивированными. Лабораторные анализы крови показывают:
- лейкоцитоз;
- лейкопению;
- палочко-ядерный сдвиг влево;
- тромбоцитопению.
Положительные результаты бактериологического исследования крови - обнаружение гемокультуры. Для получения достоверного результата необходим 3-кратный забор крови в объеме 20-30 мл. с интервалами 1 ч. во время подъема температуры по возможности до начала антибиотикотерапии.
При диагностике на предмет наличия сепсиса важно различить:
- синдром системного воспалительного ответа - системная реакция организма на воздействие различных сильных раздражителей (инфекция, травма, операция и т.д.);
- сепсис - та же совокупность изменений, что и при ССВО, но дополнительно обнаруживаются патогенны в одной или нескольких тканях, признаки перитонита, пурпуры, пневмонии и пр.;
- отяжеленный сепсис - клиническая картина сепсиса дополняется гипотензией и гипоперфузией, нарушением функций отдельных органов, например, печени или почек;
- септический шок - тяжелая форма заражения формы, когда нарушение функций не удается восстановить даже интенсивной терапией и реанимирующими мероприятиями; отличается высокой летальностью.
Лечение сепсиса
Лечение сепсиса представляет собой комплекс процедур, которые проводятся преимущественно в условиях медицинского учреждения. Так называемая интенсивная терапия состоит из мер, нацеленных на санацию очага инфекции, и дополняется антибиотикотерапией, призванной устранить инфекцию в крови. Отмечается, что сохранение жизни больного и устранение органных дисфункций не будет возможным без назначения интенсивной терапии.
Этиотропное лечение сепсиса должно быть не просто своевременным, а максимально ранним. Изначально препараты назначаются в столь высоких дозировках, чтобы обеспечить достаточную концентрацию действующего вещества в зараженной крови, а также в очагах инфекции. Этиотропная терапия может быть эффективной лишь при условии выявления возбудителя, конкретной инфекции, а также его чувствительности к выбираемым антибиотикам. Верный выбор антибиотика лежит в основе качественного лечения сепсиса.
Этиотропная терапия длится вплоть до достижения устойчивой положительной динамики состояния пациента и исчезновения основных симптомов инфекции. Если этого не происходит в течение первой недели лечения, необходимо провести дополнительное обследование для выявления осложнений или очага инфекции другой локализации.
Если установить первичный очаг инфекции не удается, равно как и выявить тип возбудителя, как минимум необходимо определить условия возникновения сепсиса - вследствие пребывания пациента в клинических условиях и развития инфекции на фоне определенной болезни (госпитальная форма) или внебольничная.
Как показывает практика, внебольничный сепсис поддается лечению:
- нефалоспоринами 3-го и 4-го поколения,
- фторхинолонами - благодаря широкому спектру действия являются препаратами выбора при лечении инфекций неизвестной этиологии
Госпитальная форма сепсиса лечится:
- карбапенемами - препаратами с широким спектром действия, к которым внутрибольничные штаммы грамнегативных бактерий низкорезистентны.
Лечение разных форм сепсиса определяется его происхождением:
- при анаэробном сепсисе применяются метронидазол, линкомицин, клиндамицин;
- для лечения сепсиса, вызванного грамотрицательными бактериями, уместен препарат с моноклональными антителами против эндотоксина грамотрицательных бактерий;
- сепсис вследствие распространения грибковой инфекции лечится амфотерными оксидами и флуконазолом;
- при стафилококковом сепсисе эффективен противостафилококковый иммуноглобулин, а также внутривенное введение противостафилококковой плазмы;
- когда инфекционный процесс достиг уровня генерализированной септической болезни, назначают ацикловир, ганцикловир, фамцикловир.
Параллельно с этиотропными средствами целесообразно использование пассивной иммунотерапии, среди разнообразия которых предпочтение отдается иммуноглобулину, идеально подходящему для внутривенного введения.
Ведущую роль в лечении сепсиса любой локализации играет инфузионная терапия. Она относится к первичным мероприятиям поддержания гемодинамики и сердечного выброса. Основными задачами, которые стоят перед врачом и которые удается решить посредством инфузионной терапии, оказываются:
- восстановление адекватной тканевой перфузии,
- нормализация клеточного метаболизма,
- коррекция расстройств гомеостаза,
- снижение концентрации медиаторов септического каскада и токсических метаболитов.
Использование этого алгоритма действий способствует выживаемости при септическом шоке и тяжелом сепсисе. Объем инфузионной терапии рекомендуют поддерживать на таком уровне, чтобы давление заклинивания в легочных капиллярах не превышало коллоидно-онкотическое давление плазмы. Это позволяет исключить риск отека легких и увеличить сердечный выброс.
Инфузионная терапия - это составляющая общей целенаправленной интенсивной терапии сепсиса. Для инфузий применяют кристаллоидные и коллоидные инфузионные растворы. Отмечается, что адекватная коррекция венозного возврата и уровня перенапряжения требует вдвое, а порой и вчетверо большего введения кристаллоидов, нежели коллоидов. Инфузия кристаллоидов более связана с риском отека тканей, а их гемодинамический эффект менее продолжителен, чем у коллоидов. Вместе с тем кристаллоиды не влияют на коагуляционный потенциал и не вызывают анафилактических реакций. В связи с этим выбор того или иного раствора диктуется особенностями течения сепсиса в конкретном случае:
- степенью гиповолемии,
- фазой ДВС-синдрома,
- наличием периферических отеков,
- уровнем альбумина крови,
- тяжестью острого легочного повреждения.
При выраженном дефиците объема циркуляционной крови показаны плазмозаменители:
- декстраны,
- гидроксиэтилкрохмал - имеет потенциальное преимущество перед декстранами вследствие низкого риска утечки через мембрану и отсутствия клинически значимого влияния на гемостаз.
В ранние сроки в связи с наличием тромбогеморрагического синдрома назначают гепарин, введение которого проводят под контролем клинических проявлений и коагулограммы.
В случае развития тяжелой степени сепсиса проноз неблагоприятен, оправданным становится гемодиализ. Для профилактики стрессовых язв в пищеварительном канале обязательны ингибиторы протонной помпы или блокаторы гистаминорецепторов. Назначают также препараты, ингибирующие протеолиз.
Серповидно-клеточная анемия – наследственная гемоглобинопатия, обусловленная синтезом аномального гемоглобина S, изменением формы и свойств эритроцитов крови. Серповидно-клеточная анемия проявляется гемолитическими, апластическими, секвестрационными кризами, тромбозами сосудов, костно-суставными болями и припухлостью конечностей, изменениями скелета, сплено- и гепатомегалией. Диагноз подтверждается по данным исследования периферической крови и пунктата костного мозга. Лечение серповидно-клеточной анемии является симптоматическим, направленным на предупреждение и купирование кризов; может быть показано переливание эритроцитов, прием антикоагулянтов, проведение спленэктомии.
![Симметричное опухание суставов при серповидно-клеточной анемии]()
![Серповидно-клеточная анемия]()
Общие сведения
Серповидно-клеточная анемия (S-гемоглобинопатия) – разновидность наследственной гемолитической анемии, характеризующаяся нарушением структуры гемоглобина и присутствием в крови эритроцитов серповидной формы. Заболеваемость серповидно-клеточной анемией распространена, главным образом, в странах Африки, Ближнего и Среднего Востока, Средиземноморского бассейна, Индии. Здесь частота носительства гемоглобина S среди коренного населения может достигать 40%. Любопытно, что больные серповидно-клеточной анемией имеют повышенную врожденную устойчивость к заражению малярией, поскольку малярийный плазмодий не может проникнуть в эритроциты серповидной формы.
Причины
В основе серповидно-клеточной анемии лежит генная мутация, обусловливающая синтез аномального гемоглобина S (HbS). Дефект структуры гемоглобина характеризуется заменой глутаминовой кислоты валином в ß-полипептидной цепи. Образующийся при этом гемоглобин S после потери присоединенного кислорода приобретает консистенцию высокополимерного геля и становится в 100 раз менее растворимым, чем нормальный гемоглобин А. В результате этого эритроциты, несущие деоксигемоглобин S, деформируются и приобретают характерную полулунную (серповидную) форму. Измененные эритроциты становятся ригидными, малопластичными, могут закупоривать капилляры, вызывая ишемию тканей, легко подвергаются аутогемолизу.
Наследование серповидно-клеточной анемии происходит по аутосомно-рецессивному типу. При этом, гетерозиготы наследуют дефектный ген серповидно-клеточной анемии от одного из родителей, поэтому, наряду с измененными эритроцитами и HbS, имеют в крови и нормальные эритроциты с HbА. У гетерозиготных носителей гена серповидно-клеточной анемии признаки заболевания возникают лишь в определенных условиях. Гомозиготы наследуют по одному дефектному гену от матери и от отца, поэтому в их крови присутствуют только серповидные эритроциты с гемоглобином S; заболевание развивается рано и протекает тяжело.
Таким образом, в зависимости от генотипа, в гематологии различают гетерозиготную (HbAS) и гомозиготную (HbSS, дрепаноцитоз) форму серповидно-клеточной анемии. К редко встречающимся вариантам заболевания относятся промежуточные формы серповидно-клеточной анемии. Обычно они развиваются у двойных гетерозигот, несущих один ген серповидно-клеточной анемии и другой дефектный ген - гемоглобина C (HbSC), серповидной β-плюс (HbS/β +) или β-0 (HbS/β0) талассемии.
Симптомы серповидно-клеточной анемии
Гомозиготная серповидно-клеточная анемия обычно проявляется у детей к 4-5 месяцу жизни, когда увеличивается количество HbS, а процентное содержание серповидных эритроцитов достигает 90%. В таких случаях раннее возникновение гемолитической анемии у ребенка обуславливает задержку физического и умственного развития. Характерны нарушения развития скелета: башенный череп, утолщение лобных швов черепа в виде гребня, кифоз грудного или лордоз поясничного отдела позвоночника.
В развитии серповидно-клеточной анемии выделяют три периода: I - с 6 месяцев до 2-3 лет, II - с 3 до 10 лет, III - старше 10 лет. Ранними сигналами серповидно-клеточной анемии служат артралгии, симметричное опухание суставов конечностей, боли в груди, животе и спине, желтушность кожи, спленомегалия. Дети с серповидно-клеточной анемией относятся к категории часто болеющих. Степень тяжести течения серповидно-клеточной анемии тесно коррелирует с концентрацией HbS в эритроцитах: чем она выше, тем тяжелее выражена симптоматика.
В условиях интеркуррентной инфекции, стрессовых факторов, обезвоживания, гипоксии, беременности и пр. у больных данным видом наследственной анемии могут развиваться серповидно-клеточные кризы: гемолитический, апластический, сосудисто-окклюзионный, секвестрационный и др.
При развитии гемолитического криза состояние больного резко ухудшается: возникает фебрильная лихорадка, в крови повышается непрямой билирубин, усиливается желтушность и бледность кожных покровов, появляется гематурия. Стремительный распад эритроцитов может привести к анемической коме. Апластические кризы при серповидно-клеточной анемии характеризуются угнетением эритроидного ростка костного мозга, ретикулоцитопенией, снижением гемоглобина.
Следствием депонированием крови в селезенке и печени служат секвестрационные кризы. Они сопровождаются гепато- и спленомегалией, сильными болями в животе, резкой артериальной гипотонией. Сосудисто-окклюзионные кризы протекают с развитием тромбоза сосудов почек, ишемии миокарда, инфаркта селезенки и легких, ишемического приапизма, окклюзии вен сетчатки, тромбоза мезентериальных сосудов и др.
Гетерозиготные носители гена серповидно-клеточной анемии в обычных условиях ощущают себя практически здоровыми. Морфологически измененные эритроциты и анемия у них возникают только в ситуациях, связанных с гипоксией (при тяжелой физической нагрузке, авиаперелетах, восхождении в горы и др.). Вместе с тем, остро развившийся гемолитический криз при гетерозиготной форме серповидно-клеточной анемии может иметь летальный исход.
![Симметричное опухание суставов при серповидно-клеточной анемии]()
Осложнения
Хроническое течение серповидно-клеточной анемии с повторными кризами приводит к развитию целого ряда необратимых изменений, нередко становящихся причиной гибели больных. Примерно у трети больных отмечается аутоспленэктомия – сморщивание и уменьшение размеров селезенки, вызванное замещением функциональной ткани рубцовой. Это сопровождается изменением иммунного статуса больных серповидно-клеточной анемией, более частым возникновением инфекций (пневмонии, менингита, сепсиса и др.).
Исходом сосудисто-окклюзионных кризов могут стать ишемические инсульты у детей, субарахноидальные кровоизлияния у взрослых, легочная гипертензия, ретинопатия, импотенция, почечная недостаточность. У женщин с серповидно-клеточной анемией отмечается позднее становление менструального цикла, склонность к самопроизвольному прерыванию беременности и преждевременным родам. Следствием ишемии миокарда и гемосидероза сердца служит возникновение хронической сердечной недостаточности; повреждения почек - хронической почечной недостаточности.
Длительный гемолиз, сопровождаемый избыточным образованием билирубина, приводит к развитию холецистита и желчнокаменной болезни. У больных серповидно-клеточной анемией часто возникают асептические некрозы костей, остеомиелит, язвы голеней.
Диагностика
Диагноз серповидно-клеточной анемии выставляется гематологом на основании характерных клинических симптомов, гематологических изменений, семейно-генетического исследования. Факт наследования ребенком серповидно-клеточной анемии может быть подтвержден еще на этапе беременности с помощью биопсии ворсин хориона или амниоцентеза.
В периферической крови отмечается нормохромная анемия (1-2х1012/л), снижение гемоглобина (50-80 г/л), ретикулоцитоз (до 30%). В мазке крови обнаруживаются серповидно измененные эритроциты, клетки с тельцами Жолли и кольцами Кабо. Электрофорез гемоглобина позволяет определить форму серповидно-клеточной анемии – гомо- или гетерозиготную. Изменение биохимических проб крови включает гипербилирубинемию, увеличение содержания сывороточного железа. При исследовании пунктата костного мозга выявляется расширение эритробластического ростка кроветворения.
Дифференциальная диагностика направлена на исключение других гемолитических анемий, вирусного гепатита А, рахита, ревматоидного артрита, туберкулеза костей и суставов, остеомиелита и др.
![Серповидно-клеточная анемия]()
Лечение серповидно–клеточной анемии
Серповидно-клеточная анемия относится к категории неизлечимых болезней крови. Таким пациентам требуется пожизненное наблюдение гематолога, проведение мероприятий, направленных на предупреждение кризов, а при их развитии – проведение симптоматической терапии.
В период развития серповидно-клеточного криза требуется госпитализация. С целью быстрого купирования острого состояния назначается кислородотерапия, инфузионная дегидратация, введение антибиотиков, обезболивающих средств, антикоагулянтов и дезагрегантов, фолиевой кислоты. При тяжелом течении обострений показано переливание эритроцитарной массы. Проведение спленэктомии не способно повлиять на течение серповидно-клеточной анемии, однако может на время уменьшить проявления заболевания.
Прогноз и профилактика
Прогноз гомозиготной формы серповидно-клеточной анемии неблагоприятный; большая часть пациентов погибает в первое десятилетие жизни от инфекционных или тромбоокклюзионных осложнений. Течение гетерозиготных форм патологии гораздо более обнадеживающее.
Для предупреждения быстро прогрессирующего течения серповидно-клеточной анемии следует избегать провоцирующих условий (обезвоживания, инфекций, перенапряжения и стрессов, экстремальных температур, гипоксии и пр.). Детям, страдающим данной формой гемолитической анемии, в обязательном порядке показана вакцинация против пневмококковой и менингококковой инфекции. При наличии в семье больных серповидно-клеточной анемией необходима медико-генетическая консультация для оценки риска развития заболевания у потомства.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Анемии: причины появления, симптомы, диагностика и способы лечения.
Определение
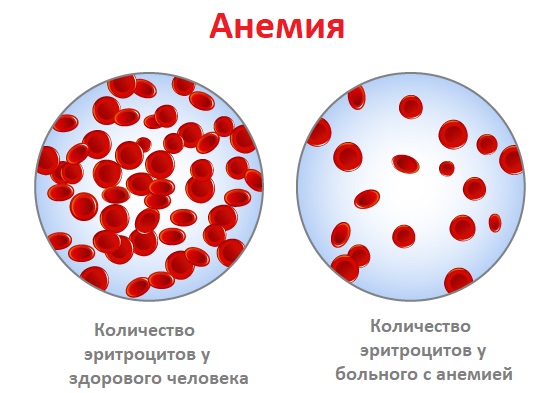
Анемия – это уменьшение содержания гемоглобина и/или снижение количества эритроцитов в единице объема крови, приводящее к снижению снабжения тканей кислородом.
Анемия встречается при ряде заболеваний (язвы и полипы желудочно-кишечного тракта, хроническая болезнь почек, онкологические, инфекционные заболевания, глистные инвазии и др). Чем ниже уровень гемоглобина, тем тяжелее протекает анемия.
![Анемия.jpg]()
Причины появления анемии
Анемия может возникнуть в результате нарушения образования эритроцитов, повышенного их разрушения или потери эритроцитов с кровью.Статистика утверждает, что самой распространенной является анемия, возникшая после кровопотери (острой или хронической). Острой считается кровопотеря с объемом крови более 500-700 мл (у взрослых), которая происходит в течение короткого промежутка времени. Потеря крови может быть видимой (кровотечение из ран, кровавая рвота, маточное, носовое кровотечения) и первоначально скрытой (кровотечения в кишечник, в полость живота и/или плевры, большие гематомы).
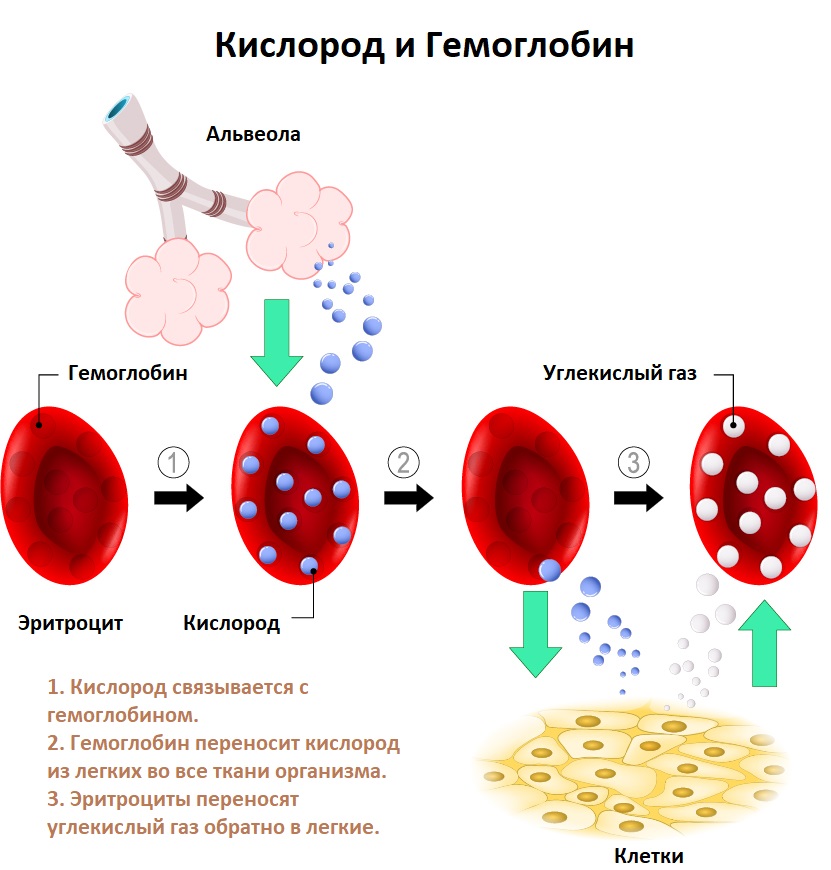
Хронические кровопотери развиваются в результате незначительных, но длительных потерь крови (обильные и длительные менструации, язва желудка, рак, геморрой, проведение процедур гемодиализа и др.). С течением времени незначительные кровопотери приводят к истощению запасов железа в организме, когда количество теряемого организмом железа превышает его поступление с пищей. В результате дефицита железа нарушается синтез гемоглобина.
![Кислород и гемоглобин.jpg]()
Дефицит железа может возникнуть из-за снижения всасывания железа в результате различных заболеваний двенадцатиперстной кишки и начальных отделов тонкой кишки (энтеритов, опухолей, состояний после оперативных вмешательств на данном участке кишечника). Состояния, приводящие к снижению уровня белков крови, являющихся переносчиками железа (нефротический синдром, нарушение белково-синтетической функции печени, синдром нарушенного всасывания, алиментарная недостаточность), также могут привести к его снижению и, как следствие, к анемии.
Железодефицитные анемии, связанные с исходно недостаточным уровнем железа (недостаток железа у матери в период беременности), наблюдаются у новорожденных и детей младшего возраста.
Анемии вследствие нарушенного кроветворения возникают:
- при недостаточном поступлении в организм или нарушении всасывания в желудочно-кишечном тракте компонентов, необходимых для образования эритроцитов (витамина В6, витамина В12, фолиевой кислоты и др.);
- поражении клеток костного мозга - предшественников эритроцитов токсическими веществами, ионизирующей радиацией;
- образовании вторичных очагов опухолевых клеток в костном мозге (метастазировании);
- нарушении синтеза небелковой части гемоглобина (гема) и накоплении его токсичных продуктов;
- нарушении регуляции образования эритроцитов (уменьшении продукции гормона, стимулирующего рост и размножение эритроцитов (эритропоэтин) или воздействии ингибиторов).
Развитие наследственных гемолитических анемий связано с генетическими дефектами (нарушением активности ферментов эритроцитов, нарушением структуры или синтеза гемоглобина, дефектами мембран эритроцитов).
Приобретенные гемолитические анемии могут быть обусловлены разрушением эритроцитов в результате воздействия на них антител, механических повреждений оболочки эритроцитов, химических повреждений эритроцитов, недостатка витаминов, разрушения эритроцитов паразитами.
Классификация анемий
1. Анемии, связанные с кровопотерей:
- анемии, связанные с нарушением образования гемоглобина;
- анемии, связанные с нарушением синтеза ДНК и РНК;
- анемии, связанные с нарушением процессов деления эритроцитов;
- анемии, связанные с угнетением пролиферации (размножения) клеток костного мозга.
- наследственные гемолитические анемии;
- приобретенные гемолитические анемии.
Существуют общие (неспецифические) проявления анемии и признаки, которые специфичны для определенного вида анемий.
Отсутствие этих признаков не исключает наличие анемии, поскольку при легкой и среднетяжелой форме заболевания, а также его медленном развитии клиническая картина может быть смазанной.
Клинические проявления недостатка железа в организме: сухость кожи, нарушение целостности эпидермиса, ломкость ногтей, волос, изъязвления и трещины в углах рта, мышечная слабость. Может наблюдаться чувство жжения языка, извращение вкуса в виде неукротимого желания есть мел, зубную пасту, землю, сырую крупу, сырое мясо, а также пристрастие к некоторым запахам (ацетона, бензина).
Дефицит витамина В12 также может проявляться поражением желудочно-кишечного тракта (атрофическим гастритом) и неврологической симптоматикой (парестезиями, нарушением чувствительности, онемением конечностей). При крайне тяжелом течении заболевания наблюдаются психические нарушения, бред, галлюцинации, приобретенное слабоумие и др.
Клиническая картина дефицита фолиевой кислоты очень похожа на дефицит витамина В12, но при фолиеводефицитных состояниях отсутствует неврологическая симптоматика и редко возникает воспаление языка. Дефицит фолиевой кислоты приводит к обострению шизофрении, учащению и утяжелению приступов эпилепсии.
Для гемолитических анемий характерны желтушность кожных покровов и слизистых, увеличение размера селезенки, склонность к образованию камней в желчных путях.
При массивном гемолизе эритроцитов (гемолитическом кризе) кроме анемии, желтухи и ухудшения общего состояния могут наблюдаться тошнота, рвота, расстройство сознания, судороги, развитие острой почечной и/или сердечно-сосудистой недостаточности.
При апластической анемии, которая возникает на фоне угнетения пролиферации клеток костного мозга, происходят кровоизлияния (преимущественно в области бедер, голеней, живота, в местах инъекций образуются гематомы). Часто диагностируются бронхиты, пневмонии.
Диагностика анемии
Анемия может возникать под влиянием самых разнообразных факторов. Чаще всего встречаются дефицитные анемии (железодефицитные, B12-дефицитные, фолиеводефицитные и др.).Большую роль в выявлении причины анемии играют сведения, полученные при опросе пациента: возраст, наличие профессиональных вредностей, характер диеты, наличие сопутствующих заболеваний, прием лекарственных препаратов, информация о наследственности и др. Не менее важны данные осмотра: изменение цвета и состояния кожи; увеличение лимфатических узлов, печени, селезенки; наличие поражения нервной системы.
Первый этап диагностики анемии обычно включает следующие исследования:
-
клинический анализ крови: определение концентрации гемоглобина, количества эритроцитов, лейкоцитов, величины гематокрита и эритроцитарных индексов (MCV, RDW, MCH, MCHC), лейкоцитарной формулы и СОЭ (с микроскопией мазка крови при наличии патологических сдвигов);
Синонимы: Общий анализ крови, ОАК. Full blood count, FBC, Complete blood count (CBC) with differential white blood cell count (CBC with diff), Hemogram. Краткое описание исследования Клинический анализ крови: общий анализ, лейкоформула, СОЭ См. также: Общий анализ – см. тест № 5, Лейкоцит.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Сепсис: причины появления, симптомы, диагностика и способы лечения.
Определение
Сепсис – это патологический процесс, в основе которого лежит реакция организма в виде генерализованного воспаления на инфекцию различной природы. При сепсисе бактерии преодолевают иммунную защиту человека и распространяются из очага воспаления по всему организму. Местное воспаление, сепсис, тяжелый сепсис и септический шок – это различные формы выраженности воспалительной реакции организма на инфекционный процесс.
![Сепсис_дисфункция.jpg]()
Истинная частота возникновения случаев сепсиса остается неизвестной, однако по оценкам исследователей, во всем мире сепсис является лидирующей причиной летальности у пациентов в критическом состоянии. Согласно результатам большого европейского исследования SOAP, включившего 3147 пациентов из 198 европейских медицинских центров, сепсис развился в 37,4% случаев, а госпитальная летальность от него колебалась от 14% случаев в Швейцарии до 41% в Португалии, в среднем составив 24,1%. Данные другого крупного исследования PROGRES (12 881 больной тяжелым сепсисом в 37 странах) показали, что госпитальная летальность в среднем составила 49,6%.
Причины возникновения сепсиса
Возбудителями сепсиса могут быть бактерии, вирусы или грибы. Но чаще сепсис имеет бактериальную природу - его причиной становятся стафилококки, стрептококки, пневмококки, менингококки, сальмонеллы, синегнойная палочка и др.
В большинстве случаев патологический процесс вызывают условно-патогенные микроорганизмы, которые присутствуют на коже, слизистых оболочках дыхательного и пищеварительного трактов, мочевыводящих путей и половых органов. Иногда при сепсисе выделяют сразу 2-3 микроорганизма.
Причиной сепсиса могут стать гнойно-воспалительные заболевания кожи (абсцессы, фурункулы, флегмоны), обширные травмы, ожоги, инфекционно-воспалительные заболевания мочевыводящей системы (пиелонефрит), живота (например, гнойно-некротический деструктивный панкреатит), тяжелая ангина, гнойный отит, пневмония, инфицирование во время родов или абортов и др.
![Сепсис.jpg]()
Возможность возникновения сепсиса зависит не только от свойств возбудителя, но и от состояния иммунной системы человека - нарушения в ее работе предрасполагают к распространению инфекции. Причинами таких нарушений могут быть врожденные дефекты иммунитета, хронические инфекционные болезни (ВИЧ, гнойные процессы), эндокринные заболевания (сахарный диабет), онкологические болезни, хронические интоксикации (алкоголизм, наркомания), проникающая радиация, прием иммуносупрессоров (кортикостероидов, цитостатиков) и др.
В ответ на внедрение возбудителя вырабатываются цитокины – особые белковые молекулы, которые выполняют защитные функции сначала на местном уровне, а затем, попадая в системный кровоток, продолжают работать уже на уровне всего организма. Цитокины бывают провоспалительными и противовоспалительными. В самом начале инфекционного процесса их количество находится в равновесии. Если регулирующие системы организма не способны поддерживать это равновесие, то цитокины накапливаются в кровотоке в сверхвысоких объемах, начинают доминировать их деструктивные, разрушающие эффекты, в результате повреждается сосудистая стенка, запускается синдром диссеминированного внутрисосудистого свертывания (ДВС-синдром) и полиорганная дисфункция. Вследствие полиорганной дисфункции печени, почек, кишечника появляются новые повреждающие факторы (лактат, мочевина, билирубин и др.), которые усиливают деструктивные процессы. При ДВС-синдроме в сосудах микроциркуляторного русла образуются множественные тромбы в сочетании с несвёртываемостью крови, приводящей к множественным кровоизлияниям.
Классификация заболевания
В зависимости от локализации входных ворот и первичного очага сепсис подразделяют на:
- перкутанный (чрескожный) – развивается при попадании возбудителя в организм через поврежденный кожный покров (ранки, царапины, фурункулы и др.);
- акушерско-гинекологический – развивается после родов и абортов;
- оральный (одонтогенный и тонзиллогенный) – развивается в результате первичной инфекции в полости рта;
- оториногенный – развивается в результате распространения инфекции из полости уха и/или носа;
- пневмогенный – при наличии инфекционного очага в нижних дыхательных путях;
- хирургический;
- урологический;
- пупочный – развивается у новорожденных вследствие проникновения инфекционных агентов в кровь через пупочную ранку;
- криптогенный (идиопатический, эссенциальный, генуинный) – сепсис неизвестного происхождения: первичный очаг гнойного воспаления неизвестен.
- молниеносный сепсис,
- острый сепсис,
- подострый сепсис,
- хронический сепсис (хрониосепсис).
По клиническим признакам:
1. Синдром системного воспалительного ответа (ССВО) – системная реакция организма на воздействие различных сильных раздражителей (инфекции, травмы, операции и др.) характеризуется двумя или более признаками:
- температура тела ≥ 38°С или ≤ 36°С;
- частота сердечных сокращений (ЧСС) ≥ 90 ударов в минуту;
- частота дыхания (ЧД) > 20 в минуту или гипервентиляция (РаСО2 ≤ 32 мм рт. ст.);
- лейкоциты крови > 12х109 /л или < 4х109 /л, или незрелых форм >10%.
По виду и характеру возбудителя:
- аэробный сепсис,
- анаэробный сепсис,
- смешанный сепсис,
- грибковый сепсис,
- вирусный сепсис.
Клинические проявления сепсиса могут варьировать от незначительных до критических. При молниеносном течении патологическое состояние развивается бурно - за несколько часов или суток. При остром сепсисе симптомы развиваются за несколько дней. Для хрониосепсиса характерно вялое течение и наличие малозаметных изменений, формирующихся месяцами. Рецидивирующий сепсис протекает с эпизодами обострений и затуханий.
Инкубационный период после выявления ворот инфекции или первичного очага составляет от 1 до 3-5 суток. Начало сепсиса, как правило, острое, хотя иногда может быть подострым или постепенным. Интоксикация проявляется резкой слабостью, адинамией, анорексией, нарушением сна, головной болью, расстройством сознания, менингеальным синдромом (поражением оболочек головного и спинного мозга), тахикардией, артериальной гипотензией. Температура тела держится высокой, со скачками утром и вечером. Признаки интоксикации особенно выражены на высоте лихорадки. На коже у трети больных появляется геморрагическая сыпь.
Со стороны дыхательной системы наблюдаются одышка и хрипы в легких. При нарушении функции почек снижается количество выделяемой мочи (олигурия) вплоть до полного прекращения мочеиспускания (анурия), в моче появляются следы крови, гноя. Наблюдается ухудшение функции печени с развитием желтухи и явлениями гепатита, увеличивается селезенка. Повреждение органов ЖКТ проявляется нарушением пищеварения, отсутствием аппетита, язык сухой, обложенный, нередко наблюдаются упорные септические поносы, тошнота и рвота. Метастазирование возбудителя из первичного очага с образованием вторичных очагов инфекции может приводить к инфаркту легкого, гангрене легкого, гнойному плевриту, эндокардиту (поражению внутренней оболочки сердца), воспалению сердечной мышцы (миокардиту), воспалению околосердечной сумки (перикардиту), гнойному циститу, абсцессам мозга и воспалению оболочек мозга (гнойному менингиту), гнойным артритам, флегмонам и абсцессам в мышцах.
Недостаточность функции одного органа длительностью более суток сопровождается летальностью до 35%, при недостаточности двух органов – 55%, при недостаточности функции трех и более органов летальность к четвертому дню возрастает до 85%.
Производят посевы крови, мочи, ликвора, мокроты, гнойного экссудата из элементов сыпи, абсцессов, пунктатов плевры, суставов и других септических очагов. Посевы делают многократно, чтобы определить чувствительность к максимальному количеству антибиотиков. Используется также обнаружение антигенов в крови методом ИФА и определение генома возбудителя методом ПЦР.
Одним из наиболее специфичных и чувствительных маркеров бактериальной инфекции служит прокальцитониновый тест. Прокальцитонин – один из основных маркёров системного воспаления, вызванного бактериями.
Синонимы: Анализ крови на прокальцитонин; ПКТ. Procalcitonin; PCT. Краткая характеристика определяемого вещества Прокальцитонин Прокальцитонин является прогормоном кальцитонина, состоящим из 116 аминокислот с молекулярной массой 14,5 кDa. Биосинтез прокальцитонина в физиологических условиях прои.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Лейкоз: причины появления, симптомы, диагностика и способы лечения.
Определение
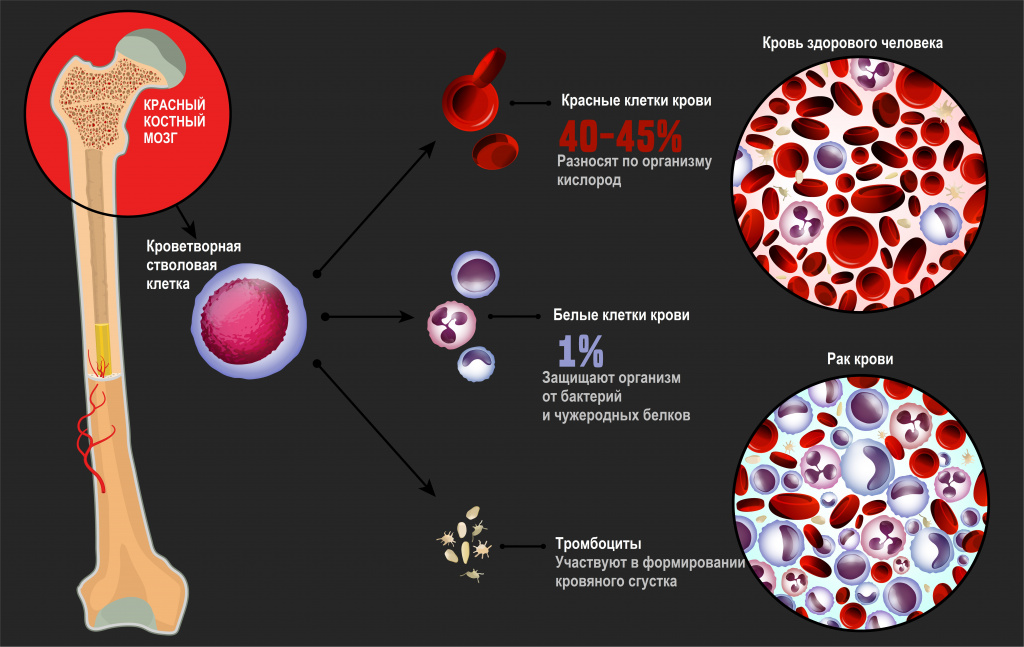
Лейкозы – большая группа заболеваний кроветворной системы. Кроветворение (гемопоэз) – это многоэтапный процесс образования форменных элементов крови в специализированных органах кроветворения. К форменным элементам крови относятся лейкоциты (белые кровяные тельца), которые участвуют во врожденном и приобретенном иммунитете, эритроциты (красные кровяные тельца), которые осуществляют транспорт кислорода и углекислого газа, и тромбоциты, обеспечивающие свертываемость крови.Главный орган, где располагаются полипотентные стволовые клетки, - костный мозг, который как раз и поражается при лейкозах.
В результате повреждения (мутации) в генетическом материале полипотентной стволовой клетки-предшественницы нарушается процесс созревания клеток. При остром лейкозе возникает большое количество незрелых (бластных) клеток, из которых образуется опухоль, разрастается в костном мозге, замещает нормальные ростки кроветворения и имеет тенденцию к метастазированию – распространению с током крови или лимфы в здоровые органы. При хронических лейкозах заболевание течет годами, происходит частичная задержка созревания клеток и опухоль образуется из созревающих и зрелых клеток.
![Рак крови.jpg]()
Причины возникновения лейкозов
К факторам риска развития лейкоза относятся:
- ионизирующая радиация: лучевая терапия по поводу других опухолей, облучение на рабочем месте, ультрафиолетовое излучение;
- воздействие на организм химических канцерогенных веществ;
- некоторые вирусы: HTLV (Т-лимфотропный вирус человека);
- бытовые факторы: добавки в пищевые продукты, курение, плохая экологическая обстановка;
- наследственная предрасположенность к раковым заболеваниям.
Лейкозы подразделяют на острые и хронические, а по типу поражения ростка кроветворения - на лимфоидные и миелоидные. Острый лейкоз никогда не переходит в хронический, а хронический не может стать острым (но его развитие может перейти в стадию бластного криза).
В зависимости от преобладания тех или иных опухолевых клеток выделяют бластные, цитарные и недифференцированные лейкозы.
Острый лимфобластный лейкоз (ОЛЛ) диагностируется у лиц любого возраста, начиная с младенческого и заканчивая пожилым, однако пик заболеваемости приходятся на детский возраст (60% пациентов с ОЛЛ моложе 20 лет). Острый лимфобластный лейкоз – самая распространенная опухоль кроветворной ткани у детей, которая составляет 30% всех злокачественных опухолей детского возраста. Заболеваемость ОЛЛ у пациентов пожилого возраста неуклонно возрастает: так, ежегодная частота ОЛЛ увеличивается с 0,39 случая на 100 тыс. населения в возрасте 35–39 лет, до 2,1 случая на 100 тыс. населения в возрасте ≥85 лет. Кроме того, приблизительно 30% ОЛЛ диагностируются в возрасте ≥60 лет.
Острым миелоидным лейкозом (ОМЛ) страдает в среднем 3-5 человек на 100 тыс. населения в год. Заболеваемость резко возрастает в возрасте старше 60 лет и составляет 12–13 случаев на 100 тыс. населения у лиц в возрасте старше 80 лет.
Хронический лимфобластный лейкоз (ХЛЛ) – самый частый вид лейкозов у взрослых, в то время как у детей этот вид опухоли не регистрируется. В европейских странах его частота составляет 4 случая на 100 тыс. населения в год и непосредственно связана с возрастом. У лиц старше 80 лет она составляет более 30 случаев на 100 тыс. в год.
Хронический миелолейкоз (ХМЛ) – редкое заболевание: 0,7 на 100 тыс. взрослого населения, пик заболеваемости приходится на 50-59 лет, однако до 33% больных ОМЛ - люди моложе 40 лет.
Симптомы лейкозов
Острый лейкоз в большинстве случаев дебютирует резко - внезапно повышается температура, появляются озноб, боль в горле, в суставах, отмечается резко выраженная слабость. Реже острый лейкоз может проявиться кровотечением. Иногда острый лейкоз начинается с постепенного ухудшения состояния больного, появления невыраженной боли в суставах и костях, кровоточивости. В единичных случаях возможно бессимптомное начало заболевания. У многих больных увеличиваются лимфоузлы и селезенка.
При хроническом лейкозе на начальной стадии, которая длится от года до трех лет, пациенты могут ни на что не жаловаться. Иногда беспокоят слабость, потливость, частые простудные заболевания, могут отмечаться тупые, ноющие боли в костях.
При подавлении эритроидного ростка, дающего красные кровяные тельца, возникает анемия и гемическая гипоксия (снижение количества кислорода в крови). При этом пациенты отмечают слабость, утомляемость, бледность кожных покровов.
При поражении мегакариоцитарного ростка падает количество тромбоцитов, поэтому возникает кровоточивость десен, слизистой оболочки носа, пищеварительного тракта, образуются синяки, кровоизлияния в различные органы. При прогрессировании лейкоза могут развиваться массивные кровотечения в результате ДВС синдрома (синдрома диссеминированного внутрисосудистого свертывания).
В результате недостатка лейкоцитов и снижения иммунитета развиваются инфекционные осложнения различной степени тяжести, что чаще всего проявляется лихорадкой.
Могут возникать язвенно-некротическая ангина, перитонзиллярные абсцессы, некротический гингивит, стоматит, пиодермия, параректальные абсцессы, пневмония, пиелонефрит. Существует значимый риск тяжелого течения инфекционных осложнений вплоть до развития сепсиса.
С током крови и лимфы опухолевые клетки попадают в здоровые органы, нарушают их структуру и функцию - наиболее подвержены метастатическим процессам печень, селезенка, лимфатические узлы, но метастазы могут поражать и кожу, и мозговые оболочки, и почки, и легкие.
Основные причины летальности у пациентов с лейкозом связаны с тем, что осложнения могут спровоцировать развитие сепсиса, полиорганную недостаточность, кровоизлияния в различные органы. Острый лейкоз без лечения приводит к смертельному исходу в течение нескольких недель или месяцев.
Диагностика лейкозов
Диагностика лейкозов основывается на оценке морфологических особенностей клеток костного мозга и периферической крови. Поэтому всем пациентам с подозрением на лейкоз назначают общий анализ крови с подсчетом лейкоцитарной формулы и определением числа тромбоцитов.
Синонимы: Общий анализ крови (ОАК); Гемограмма; КАК; Развернутый анализ крови. Full blood count; FBC; Complete Blood Count (CBC); Hemogram; CBC with White Blood Cell Differential Count; Peripheral Blood Smear; Blood Film Examination; Complete blood count (CBC) with differential white blood cell coun.
Для определения объема опухолевого поражения, вероятности развития синдрома лизиса опухоли рекомендовано выполнение общетерапевтического биохимического анализа крови: АСТ, АЛТ, общий билирубин, глюкоза, мочевина, креатинин, общий белок, ЛДГ, магний, натрий, калий, кальций.
Аланинаминотрансфераза − внутриклеточный фермент, участвующий в метаболизме аминокислот. Тест используют в диагностике поражений печени, сердечной и скелетных мышц. Синонимы: Глутамат-пируват-трансаминаза; Глутамат-пируват-трансаминаза в сыворотке; СГПТ. Alanine aminotransferase; S.
Синонимы: Глутамино-щавелевоуксусная трансаминаза; Глутамат-оксалоацетат-трансаминаза сыворотки крови (СГОТ); L-аспартат 2-оксоглутарат аминотрансфераза; ГЩТ. Aspartateaminotransferase; Serum Glutamicoxaloacetic Transaminase; SGOT; GOT. Краткая характеристика определяемого вещества АсАТ .
Синонимы: Общий билирубин крови; Общий билирубин сыворотки. Totalbilirubin; TBIL. Краткая характеристика определяемого вещества Билирубин общий Билирубин – пигмент коричневато-желтого цвета, основное количество которого образуется в результате метаболизма гемовой части гемоглобина при дест.
Материал для исследования Сыворотка или плазма крови. Если нет возможности центрифугировать пробу через 30 минут после взятия для отделения сыворотки/плазмы от клеток, пробу берут в специальную пробирку, содержащую ингибитор гликолиза (флюорид натрия). Синони.
Синонимы: Диамид угольной кислоты; Карбамид; Мочевина в крови; Азот мочевины. Urea nitrogen; Urea; Blood Urea Nitrogen (BUN); Urea; Plasma Urea. Краткая характеристика аналита Мочевина Мочевина является основным азотсодержащим продуктом катаболизма белков и аминокислот в организме человека. .
Синонимы: Анализ крови на креатинин; Сывороточный креатинин; Креатинин сыворотки, оценка СКФ. Сreat; Сre; Blood Creatinine; Serum Creatinine; Serum Creat. Краткая характеристика определяемого вещества Креатинин Креатинин – низкомолекулярное азотсодержащее вещество, продукт метаболизма креа.
Синонимы: Общий белок сыворотки крови; Общий сывороточный белок. Total Protein; Serum Тotal Protein; Total Serum Protein; TProt; ТР. Краткая характеристика определяемого вещества Общий белок Сыворотка крови (плазма крови, лишенная фибриногена) содержит множество белков, выполняющих разнообразны.
Синонимы: Анализ крови на ЛДГ; Лактатдегидрогеназа; L-лактат; НАД+Оксидоредуктаза; Дегидрогеназа молочной кислоты. Lactate dehydrogenase, Total; Lactic dehydrogenase; LDH; LD. Краткая характеристика определяемого вещества Лактатдегидрогеназа ЛДГ – цитоплазматический.
Синонимы: Анализ крови на магний; Общий магний; Ионы магния. Serum Magnesium Test; Magnesium test; Magnesium, blood; Serum magnesium. Краткая характеристика определяемого аналита Магний Магний, как и калий, содержится преимущественно внутри клеток. 1/3-1/2 всего магния организма .
Синонимы: Анализ крови на электролиты; Электролиты в сыворотке крови. Electrolyte Panel; Serum electrolyte test; Sodium, Potassium, Chloride; Na/K/Cl. Краткая характеристика определяемых веществ (Калий, Натрий, Хлор) Калий (К+) Основной внутриклеточный катион. Кал.
Общий кальций – основной компонент костной ткани и важнейший биогенный элемент, обладающий важными структурными, метаболическими и регуляторными функциями в организме. Синонимы: Анализ крови на общий кальций; Общий кальций в сыворотке. Total blood calcium; Total calcium; Bl.
Для определения вероятности развития тяжелых коагуляционных нарушений (как геморрагических, так и тромботических) рекомендовано исследование свертывающей системы крови.
С целью исключения поражения почек выполняют общий анализ мочи.
Диагностику хронического лейкоза проводят с помощью иммунофенотипического исследования лимфоцитов крови (ИФТ) методом проточной цитометрии.
Рекомендовано проведение стернальной пункции (пункции грудины) для получения цитологического препарата костного мозга и цитологическое и цитохимическое исследование мазка с целью уточнения диагноза и определения прогноза.
В ряде случаев показана биопсия опухолевого образования или лимфатического узла (или другого метастатического очага) и патологоанатомическое исследование полученного биопсийного материала.
Кроме того, врач может рекомендовать проведение иммунофенотипирования гемопоэтических клеток-предшественниц в костном мозге, цитогенетическое исследование аспирата костного мозга, молекулярно-генетические исследования мутаций в генах и др.
Из инструментальных методов диагностики проводятся:
-
эхокардиография для оценки функционального состояния сердечной мышцы;
Исследование, позволяющее оценить функциональные и органические изменения сердца, его сократимость, а также состояние клапанного аппарата.
Сканирование головного мозга, черепа и окружающих их тканей, позволяющее диагностировать различные патологии.
Исследование, позволяющее получить данные о состоянии органов грудной клетки и средостения.
Сканирование внутренних органов брюшной полости для оценки его функционального состояния и наличия патологии.
Лечение лейкозов
Лечение лейкозов проводится в стационаре. Медикаментозное воздействие на опухоль специальными препаратами, губительно действующими на быстро делящиеся клетки, называется химиотерапией. При лечении острых лейкозов химиотерапию проводят в несколько этапов: индукция ремиссии, консолидация (закрепление) ремиссии, поддерживающая терапия и профилактика нейролейкемии (метастазирования опухолевых лейкозных клеток в головной и спинной мозг).
Период индукции ремиссии - это начальный этап, цель которого максимально уменьшить опухолевую массу и достичь ремиссии. Обычно для этого требуется 1-2 курса химиотерапии. Далее идет консолидация достигнутого эффекта - наиболее агрессивный и высокодозный этап лечения, задачей которого является по возможности еще большее уменьшение числа остающихся после индукции лейкемических клеток. Этот этап также занимает 1-2 курса. За ним следует противорецидивное или поддерживающее лечение. При некоторых вариантах острых лейкозов требуется профилактика или, при необходимости, лечение нейролейкемии.
Для разных видов лейкозов у разных возрастных групп профессиональными сообществами разработаны схемы химиотерапии.
При лечении ХМЛ основными препаратами выбора являются ингибиторы тирозинкиназы, применяемые в непрерывном режиме – ежедневно, длительно, постоянно. Перерывы в приеме могут способствовать снижению эффективности терапии и прогрессированию заболевания. В случае неэффективности терапии может быть проведена трансплантацию гемопоэтических стволовых клеток или костного мозга.
В терапии ХЛЛ цели и схемы терапии химиотерапии определены возрастом пациента, числом и тяжестью сопутствующих заболеваний. Разработаны протоколы лечения для разных пациентов, в том числе схемы моно- и полихимиотерапии. Для профилактики инфекционных осложнений применяют внутривенное введение иммуноглобулина, рекомендована вакцинация от гриппа и пневмококковой инфекции.
Помимо химиотерапии пациенту может потребоваться трансфузионная терапия: переливание эритроцитарной массы, тромбоцитарной массы, изотонических растворов.
При присоединении инфекций показана антибиотикотерапия. На фоне лечения могут возникать тромботические осложнения, что требует антикоагулянтной терапии. Пациентам высокого риска в связи с вероятностью рецидива лейкоза применяют трансплантацию гемопоэтических стволовых клеток.
Профилактика лейкозов
Так как причины возникновения лейкозов не установлены, методов специфической профилактики до сих пор не существует.
Однако доказано, что между курением и риском развития острого лейкоза существует дозовая зависимость, которая особенно очевидна для лиц старше 60 лет.
Ряд исследователей предполагают, что около 20% случаев ОМЛ являются следствием курения.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Читайте также: