Виферон при цитомегаловирусной инфекции схема лечения ребенка
Обновлено: 18.04.2024
Эпштейна-Барр вирусная инфекция (ЭБВИ) относится к наиболее распространенным инфекционным заболеваниям человека. Антитела (Ат) к вирусу Эпштейна-Барр (ВЭБ) обнаруживают у 60% детей первых двух лет жизни и у 80–100% взрослых [3, 13]. Заболеваемость острой формой ЭБВИ (ОЭБВИ) в различных регионах мира колеблется от 40 до 80 случаев на 100 тыс. населения [2]. Хроническая форма ЭБВИ (ХЭБВИ) развивается у 15–25% лиц после ОЭБВИ [1, 5, 15]. Установлена роль ВЭБ в развитии злокачественных новообразований, аутоиммунных заболеваний и синдрома хронической усталости [3, 5, 14, 15]. Все это свидетельствует об актуальности проблемы ЭБВИ.
ВЭБ, открытый в 1964 г. M. Epstein и Y. Barr, относится к γ-герпес-вирусам [3]. ВЭБ имеет в своем составе 3 антигена: капсидный (VCA), ранний (EA) и ядерный (EBNA). Своеобразие патологического процесса при ЭБВИ определяется способностью ВЭБ к трансформации В-лимфоцитов, пожизненной персистенции в организме человека, индукции вторичного иммунодефицитного состояния (ИДС), аутоиммунных реакций, злокачественных опухолей [1, 3, 5, 12].
Источник заражения ВЭБ — больные манифестными и бессимптомными формами. 70–90% лиц, перенесших ОЭБВИ, выделяют вирус в последующие 1–18 мес. Пути передачи ВЭБ: воздушно-капельный, контактно-бытовой, парентеральный, половой, вертикальный. ОЭБВИ характеризуется эпидемическими подъемами 1 раз в 6–7 лет, чаще регистрируется в возрасте от 1 до 5 лет, в организованных коллективах [4, 7, 9].
Иммунный статус 109 больных ОЭБВИ в возрасте от 5 до 14 лет в нашей работе выявил признаки активации Т-клеточного звена иммунной системы — повышение количества Т-лимфоцитов (CD3), цитотоксических Т-лимфоцитов (CD8), клеток с маркерами поздней активации (HLA-DR); поликлональную активацию В-лимфоцитов — увеличение количества CD20-клеток, иммуноглобулинов (Ig) IgA, IgM, IgG, циркулирующих иммунных комплексов (ЦИК). Обнаружены признаки угнетения иммунной системы: нормальное содержание Т-хелперов (CD4), снижение иммунорегуляторного индекса CD4/CD8, количества естественных киллерных клеток NK (CD16), повышение готовности иммунокомпетентных клеток к апоптозу (CD95). Наблюдалась активация кислородзависимого метаболизма нейтрофилов и редукция его адаптационных возможностей.
У трети обследованных детей (33,9%) ОЭБВИ протекала в форме микст-инфекции с цитомегаловирусами (ЦМВ), вирусами простого герпеса 1 и 2 типов (ВПГ-1, ВПГ-2). При бактериологическом исследовании мазков из ротоглотки у 41,3% пациентов выделены Streptococcus (S.) viridans, у 11,9% — Candida albicans, у 8,2% — Staphilococcus (Staph.) epidermidis, у 6,4% — S. pyogenes, у 2,7% — Klebsiella (Kl.) pneumoniae, у 41,3% — ассоциация бактерий. У 43,1% пациентов — серологические маркеры активной формы хламидийной инфекции, у 30,3% — микоплазмоза.
Возможны следующие исходы ОЭБВИ: латентная инфекция, ХЭБВИ, ИДС, онкологические, аутоиммунные заболевания, синдром хронической усталости [5, 8, 10, 11]. Переход в ХЭБВИ связан с комплексом неблагоприятных факторов в анте-, интра- и постнатальном периодах, нарушением нейроиммунноэндокринной регуляции, генетической предрасположенностью.
Проведенное нами обследование 60 детей в возрасте от 5 до 14 лет с ХЭБВИ показало, что в этой группе у 86,7% матерей имел место отягощенный акушерский анамнез; у 83,3% детей обнаружены перинатальная и постнатальная патология ЦНС, ЛОР-органов и др.
Нарушения иммунного статуса приводили к активации условно-патогенной микрофлоры, вирусных и грибковых инфекций. В микробном спектре слизистой ротоглотки пациентов с ХЭБВИ выделены S. Viridans (30%), Candida albicans (28,3%), Staph. Epidermidis (25%), S. Pyogenes (20%), Kl. Pneumoniae (8,4%), ассоциация бактерий (41,7%); у 28,3% — серологические маркеры активной формы хламидиоза, у 26,7% — микоплазмоза. У 90% пациентов заболевание протекало в форме микст-инфекции с участием герпес-вирусов: ВЭБ + ЦМВ, ВЭБ + ВПГ-1, ВПГ-2.
Классификация. Общепринятая классификация заболевания отсутствует; рекомендуем использовать разработанную нами рабочую классификацию ЭБВИ.
- По периоду возникновения: врожденная, приобретенная.
- По форме: типичная (инфекционный мононуклеоз), атипичная: стертая, бессимптомная, висцеральная.
- По тяжести: легкая, среднетяжелая, тяжелая.
- По течению: острая, затяжная, хроническая.
- По фазе: активная, неактивная.
- Осложнения: гепатит, разрыв селезенки, менингоэнцефалит, полирадикулонейропатия, миокардит, синусит, отит, гемолитическая анемия, тромбоцитопения, нейтропения, панкреатит и др.
- Микст-инфекция.
Примеры оформления диагноза:
- Осн.: Приобретенная ЭБВИ, типичная тяжелая форма (инфекционный мононуклеоз), острое течение, активная фаза. Осл.: Острый гепатит.
- Осн.: Приобретенная ЭБВИ, висцеральная форма (менингоэнцефалит, гепатит, нефрит), тяжелое хроническое течение, активная фаза. Осл.: острая печеночно-почечная недостаточность. Сопp.: Респираторный хламидиоз (ринофарингит, бронхит, пневмония).
Клиническая картина острой ЭБВИ впервые была описана Н. Ф. Филатовым (1885) и Е. Пфейфером (1889). Инкубационный период длится от 4-х дней до 7 нед. Полный симптомокомплекс формируется к 4–10-му дням болезни [4, 7].
Нами обследованы 109 детей с ОЭБВИ. У большинства пациентов заболевание начинается остро, с повышения температуры тела и появления симптомов интоксикации; реже отмечается постепенное начало: несколько дней наблюдается недомогание, слабость, вялость, снижение аппетита. Температура тела субфебрильная или нормальная. Ко 2–4-му дням болезни температура достигает 39–40 °С; лихорадка и симптомы интоксикации могут сохраняться в течение 2–3 и более недель.
Тонзиллит — наиболее частый и ранний симптом ОЭБВИ, сопровождается увеличением миндалин до II-III степени. Лакунарный рисунок подчеркнут за счет инфильтрации ткани миндалин или сглажен из-за лимфостаза. На миндалинах — налеты желтовато-белого или грязно-серого цвета в виде островков, полосок. Они исходят из лакун, имеют шероховатую поверхность (напоминают кружево), легко снимаются без кровоточивости, растираются, не тонут в воде. Характерно несоответствие размера налета и степени увеличения регионарных ЛУ. При фибринозно-некротическом характере налетов в случае их распространения за пределы миндалин необходим дифференциальный диагноз с дифтерией. Налеты на миндалинах исчезают, как правило, через 5–10 дней.
Гепатомегалия может быть обнаружена с первых дней болезни, однако чаще выявляется на второй неделе. Нормализация размеров печени происходит в течение полугода. У 15–20% больных в качестве осложнения развивается гепатит.
Спленомегалия относится к поздним симптомам, встречается у большинства больных. Нормализация размеров селезенки происходит в течение 1–3 нед.
Экзантема при ОЭБВИ появляется на 3–14-й дни болезни, имеет полиморфный характер — пятнистая, папулезная, пятнисто-папулезная, розеолезная, мелкоточечная, геморрагическая. Определенной локализации нет. Сыпь наблюдается в течение 4–10 дней, иногда оставляет пигментацию. У детей, получавших ампициллин или амоксициллин, сыпь появляется чаще (90–100%).
Гематологические изменения включают лейкоцитоз (10–30 х 10 9 /л), нейтропению с палочкоядерным сдвигом влево, увеличение количества лимфоцитов, моноцитов, атипичных мононуклеаров до 50–80%, повышение СОЭ до 20–30 мм/час. Характерный гематологический признак — атипичные мононуклеары в количестве 10–50%: они появляются к концу первой недели заболевания, сохраняются в течение 1–3 нед.
Хроническая ЭБВИ является исходом ОЭБВИ или развивается как первично-хроническая форма [2, 5, 8, 10, 11, 15]. Нами обследовано 60 детей с ХЭБВИ, клиника которой включала хронический мононуклеозоподобный синдром и полиорганную патологию. У всех пациентов обнаружены лимфопролиферативный синдром (генерализованная лимфаденопатия, гипертрофия небных и глоточной миндалин, увеличение печени и селезенки) и признаки хронической интоксикации (длительный субфебрилитет, слабость, снижение аппетита и др.). Вследствие развития ИДС наблюдались острые инфекции респираторного тракта и ЛОР-органов с обострениями до 6–11 раз в год: ринофарингиты (28,3%), фаринготонзиллиты (91,7%), аденоидиты (56,7%), отиты (11,7%), синуситы (20%), ларинготрахеиты (18,3%), бронхиты (38,3%), пневмонии (25%). Обращала внимание высокая частота полиорганной патологии, обусловленная длительной репликацией ВЭБ, вторичным ИДС, аутоиммунными реакциями (патология ЦНС; хронический гастрит, дискинезия желчевыводящих путей; кардиальный синдром, артралгии).
В последние годы описана врожденная ЭБВИ. Установлено, что риск ее при первичной ЭБВИ во время беременности составляет 67%, при реактивации — 22%. Клиника врожденной ЭБВИ сходна с ЦМВИ.
Установлена роль ВЭБ в развитии онкологических заболеваний и паранеопластических процессов — лимфомы Беркетта, назофарингеальной карциномы, лимфогранулематоза, опухолей желудка, кишечника, слюнных желез, матки, лейкоплакии языка и слизистой ротовой полости, а также ряда аутоиммунных заболеваний — системной красной волчанки, ревматоидного артрита, синдрома Шегрена, лимфоидного интерстициального пневмонита, хронического гепатита, увеита и др. [3, 5, 14, 15]. ВЭБ, наряду с вирусами герпеса человека 6 и 7 типов, является этиологическим фактором синдрома хронической усталости и наиболее частой причиной (15%) развития длительной лихорадки неясного генеза.
Диагностика ЭБВИ основана на учете групп риска, ведущих клинических синдромов и данных лабораторного исследования [8–11]. К группам риска у матери относят отягощенный анамнез, маркеры герпес-вирусных инфекций и др., у ребенка — перинатальное поражение ЦНС, аллергический фенотип, ИДС, маркеры герпес-вирусных инфекций и др. Ведущими клиническими синдромами ЭБВИ являются мононуклеозоподобный, общеинфекционный синдромы, экзантема, синдром полиорганной патологии.
В обязательный стандарт диагностики ЭБВИ входят клинический анализ крови, общий анализ мочи, биохимическое исследование крови, бактериологическое исследование слизи ротоглотки и носа, серологические маркеры ВЭБ, других герпес-вирусов, хламидий, микоплазм, УЗИ органов брюшной полости, консультация ЛОР-врача, по показаниям — рентгенография придаточных пазух носа, органов грудной клетки, ЭКГ. Дополнительный стандарт диагностики (в специализированном лечебно-профилактическом учреждении): маркеры ВЭБ, других герпес-вирусов, хламидий, микоплазм методом полимеразной цепной реакции (ПЦР), иммунограмма второго уровня, консультация иммунолога, по показаниям — коагулограмма, морфологическая картина стернальной пункции, консультация гематолога, онколога.
Методом иммуноферментного анализа (ИФА) определяют Ат к антигенам ВЭБ, что позволяет осуществить лабораторную диагностику ЭБВИ и определить период инфекционного процесса.
Ат класса IgM к VCA появляются одновременно с клиникой ОЭБВИ, сохраняются в течение 2–3 мес, повторно синтезируются при реактивации ВЭБ. Длительная персистенция высоких титров этих Ат характерна для ХЭБВИ, ВЭБ-индуцированных опухолей, аутоиммунных заболеваний, ИДС.
Ат класса IgG к EA достигают высокого титра на 3–4-й нед ОЭБВИ, исчезают через 2–6 мес. Они появляются при реактивации, отсутствуют при атипичной форме ЭБВИ. Высокие титры Ат данного класса выявляют при ХЭБВИ, ВЭБ-индуцированных онкологических и аутоиммунных заболеваниях, ИДС.
Ат класса IgG к EBNA появляются через 1–6 мес после первичной инфекции. Затем их титр уменьшается и сохраняется в течение всей жизни. При реактивации ЭБВИ происходит повторное увеличение их титра.
Большое значение имеет исследование авидности Ат класса IgG (прочности связывания антигена с Ат). При первичной инфекции сначала синтезируются Ат с низкой авидностью (индекс авидности (ИА) менее 30%). Для поздней стадии первичной инфекции характерны Ат со средней авидностью (ИА — 30–49%). Высокоавидные Ат (ИА — более 50%) образуются через 1–7 мес после инфицирования ВЭБ.
Серологическими маркерами активной фазы ЭБВИ являются Ат IgM к VCA и Ат IgG к EA, низкая и средняя авидность Ат IgG к маркерам неактивной фазы, Ат IgG к EBNA.
Материалом для ПЦР служат кровь, ликвор, слюна, мазки со слизистой ротоглотки, биоптаты органов и др. Чувствительность ПЦР при ЭБВИ (70–75%) ниже, чем при других герпесвирусных инфекциях (95–100%). Это связано с появлением ВЭБ в биологических жидкостях лишь при иммуноопосредованном лизисе инфицированных В-лимфоцитов.
На основании опыта лечения 169 детей с ЭБВИ нами разработан стандарт лечения этого заболевания.
Базисная терапия: охранительный режим; лечебное питание; противовирусные препараты: вироцидные препараты — инозин пранобекс (Изопринозин), аномальные нуклеозиды (Валтрекс, Ацикловир), Арбидол; препараты ИФН — рекомбинантный ИФН α-2β (Виферон), Кипферон, Реаферон-ЕС-Липинт, интерфероны для в/м введения (Реаферон-EC, Реальдирон, Интрон А, Роферон А и др.); индукторы ИФН — Амиксин, сверхмалые дозы антител к γ-ИФН (Анаферон), Циклоферон, Неовир. По показаниям: локальные антибактериальные препараты (Биопарокс, Лизобакт, Стопангин и др.); системные антибактериальные препараты (цефалоспорины, макролиды, карбапенемы); иммуноглобулины для внутривенного введения (Иммуновенин, Габриглобин, Интраглобин, Пентаглобин и др.); витаминно-минеральные комплексы — Мульти-табс, Вибовит, Санасол, Киндер Биовиталь гель и др.
Интенсификация базисной терапии по показаниям:
Симптоматическая терапия.
При лихорадке — жаропонижающие препараты (парацетамол, ибупрофен и др.); при затруднении носового дыхания — назальные препараты (Изофра, Полидекса, Називин, Виброцил, Адрианол и др.); при сухом кашле — противокашлевые препараты (Глаувент, Либексин), при влажном кашле — отхаркивающие и муколитические препараты (АмброГЕКСАЛ, бромгексин, ацетилцистеин и др.).
Эффективность этиотропной терапии ОЭБВИ оценена в двух группах больных. Пациенты 1-й группы (52 человека) получали инозин пранобекс (Изопринозин) в сочетании с рекомбинантным ИФН α-2β (Вифероном), больные 2-й группы (57 детей) — монотерапию рекомбинантным ИФН α-2β (Вифероном). Клинико-серологические показатели до начала лечения и через 3 мес терапии представлены в табл. 1. У пациентов обеих групп в динамике отмечалось достоверное уменьшение таких симптомов, как генерализованная лимфаденопатия, тонзиллит, аденоидит, гепатомегалия и спленомегалия. Вместе с тем на фоне комбинированной терапии, положительная динамика клинических показателей была более значительной; острые респираторные инфекции (ОРИ) лишь у 19,2% больных 1-й группы и у 40,3% больных 2-й группы (p < 0,05). На фоне комбинированной терапии наблюдалось более быстрое исчезновение серологических маркеров репликации.
Эффективность этиотропной терапии исследована у 60 больных ХЭБВИ. Пациенты 1-й группы (30 детей) получали инозина пранобекс (Изопринозин) и рекомбинантный ИФН α-2β (Виферон), 2-я группа (30 человек) — монотерапию рекомбинантным ИФН α-2β (Вифероном). Независимо от схемы лечения через 3 мес после начала терапии отмечалось достоверное уменьшение частоты генерализованной лимфаденопатии, гипертрофии небных и глоточной миндалин, спленомегалии, интоксикационного, инфекционного и вегето-висцерального синдромов (табл. 2). Комбинация инозина пранобекса (Изопринозина) с рекомбинантным ИФН α-2β (Вифероном) способствовало более существенной динамике клинических показателей. Количество эпизодов ОРИ снизилось с 6–11 (7,9 ± 1,1) до 4–6 (5,2 ± 1,2) в год на фоне монотерапии рекомбинантным ИФН α-2β (Вифероном), и до 2–4 (2,5 ± 1,4) в год на фоне комбинированной терапии (p < 0,05). В обеих группах уменьшалась частота репликации ВЭБ, однако при сочетанном применении противовирусных препаратов этот эффект был более выраженным.
Побочных эффектов при использовании инозина пранобекса (Изопринозина) и рекомбинантного ИФН α-2β (Виферона) не было.
Результаты проведенного исследования свидетельствуют о потенцировании эффектов при комбинации инозина пранобекса (Изопринозина) с рекомбинантным ИФН a-2b (Вифероном) у больных ЭБВИ.
Потенцирование противовирусных, иммуномодулирующих и цитопротекторных эффектов этих препаратов приводит к более существенной, чем при монотерапии, положительной динамике проявлений клинических симптомов ЭБВИ, к исчезновению серологических маркеров активности инфекционного процесса. Следует отметить высокую эффективность и безопасность комбинированной терапии с использованием инозина пранобекса (Изопринозина) и рекомбинантного ИФН α-2β (Виферона).
Реабилитация. Ребенок наблюдается участковым врачом и инфекционистом, снимается с учета через 6–12 мес после исчезновения клинико-лабораторных показателей активности инфекционного процесса. Кратность осмотров — 1 раз в месяц. По показаниям рекомендуют консультацию ЛОР-врача, иммунолога, гематолога, онколога и др. Лабораторные и инструментальные исследования пациентов включают: клинический анализ крови 1 раз в месяц в течение 3 мес, затем 1 раз в 3 месяца, по показаниям — чаще; серологические маркеры ВЭБ методом ИФА один раз в три месяца, по показаниям — чаще; ПЦР крови, мазков из ротоглотки 1 раз в 3 месяца, по показаниям — чаще; иммунограмма — 1 раз в 3–6 мес; биохимическое и инструментальное исследования — по показаниям.
Реабилитационная терапия включает: охранительный режим, лечебное питание, противовирусные препараты по пролонгированным схемам. Под контролем иммунограммы осуществляют иммунокоррекцию. По показаниям назначают локальные антибактериальные препараты, курсы витаминно-минеральных комплексов, про- и пребиотиков, препаратов метаболической реабилитации, энтеросорбентов, антигистаминные препараты, гепато-, нейро- и ангиопротекторы, кардиотропные препараты, ферменты, гомеопатические средства, немедикаментозные методы лечения.
Таким образом, ЭБВИ характеризуется широким распространением, длительным течением с периодической реактивацией инфекционного процесса у части пациентов, возможностью развития осложнений и неблагоприятных исходов (онкозаболеваний, аутоиммунной патологии). Важную роль при ЭБВИ играет формирование вторичного ИДС. Ведущими клиническими синдромами ЭБВИ являются острый и хронический мононуклеозоподобный синдромы, интоксикационный, инфекционный, церебральный, гастроинтестинальный, кардиальный и артралгический синдромы. Диагностика ЭБВИ основана на анализе групп риска, выделении ведущих клинических синдромов и лабораторном исследовании. Лечение ЭБВИ является комплексным и включает этиотропные средства (виростатические препараты, интерферон и его индукторы), препараты патогенетической, иммуномодулирующей, симптоматической терапии. Сочетанное пролонгированное использование инозина пранобекс (Изопринозина) и рекомбинантного ИФН α-2β (Виферона), потенцирующих свои иммунокорригирующие и цитопротекторные эффекты, существенно повышает эффективность лечения. Больные ЭБВИ нуждаются в длительной реабилитации с обязательным контролем клинико-лабораторных показателей активности инфекционного процесса.
По вопросам литературы обращайтесь в редакцию.
Э. Н. Симованьян, доктор медицинских наук, профессор
В. Б. Денисенко, кандидат медицинских наук
Л. Ф. Бовтало, кандидат медицинских наук
А. В. Григорян
Ростовский ГМУ, Ростов-на-Дону
Цитомегаловирусная инфекция в настоящее время является одной из наиболее актуальных в структуре инфекционной патологии. Пристальный интерес к данной проблеме специалистов обусловлен не только возможностью развития тяжелых форм этого заболевания у новорожденных и детей первого года жизни, но и потенциальным риском формирования прогностически неблагоприятных последствий. Принципы лечения детей, больных ЦМВИ, предусматривают одновременное решение нескольких задач, в том числе предупреждение дальнейшего развития и генерализации патологического процесса, а также профилактика формирования остаточных явлений и инвалидизации. Лечение детей с ЦМВИ включает режим, диету, этиотропные препараты, симптоматические средства, а также иммунотерапию и иммунокоррекцию.
Цитомегаловирусная инфекция (ЦМВИ, цитомегалия) – широко распространенное вирусное заболевание, характеризующееся многообразными проявлениями, которые могут отличаться бессимптомным течением или же приводить к тяжелым генерализованным формам болезни с поражением внутренних органов и центральной нервной системы, что у детей нередко приводит к инвалидизации. i Поэтому педиатров во всем мире волнует важный вопрос – как лечить цитомегаловирус у детей.
Особенности возбудителя инфекции
Возбудителем ЦМВИ является ДНК-содержащий вирус Cytomegalovirus hominis, который был открыт в средине прошлого века. Согласно международной классификации, ЦМВ относится к группе Human Herpesvirus-5 (вирус герпеса 5 типа) и обладает свойствами, общими для всех представителей семейства Herpesviridae. Геном ЦМВ человека – самый крупный из всех геномов представителей герпесвирусов.
Инфицированность цитомегаловирусом в разных странах достаточно высокая. От 20 до 60 % детей и от 40 до 95% взрослых в мире инфицировано этим вирусом. Среди беременных женщин частота выявления антител к ЦМВ по разным исследованиям колеблется от 40 до 90%. Первичная ЦМВИ развивается примерно в 1%. Внутриутробное инфицирование плода у будущих матерей с первичной ЦМВИ во время беременности достигает 30-50%. ii Но только у 5-18% наблюдается манифестная врожденная ЦМВИ, которая характеризуется тяжелым течением и может привести к летальному исходу.
Попав однажды в организм, ЦМВ персистирует в нем пожизненно. При этом большая часть людей даже не подозревает о его наличии. По мнению исследователей, ЦМВ-инфекция наиболее широко распространена в развивающихся странах, а в развитых странах – в регионах с низким социально-экономическим статусом. Заболеваемость ЦМВ эндемична и не подвержена сезонным колебаниям. Эндемичность – это постоянная приуроченностъ инфекционных болезней или их групп к определенным территориям, обусловленная специфическими локальными природно-географическими условиями. Европейским региональным бюро ВОЗ ЦМВИ отнесена к группе болезней, которые определяют будущее инфекционной патологии.
В настоящее время рост заболеваемости цитомегаловирусом отмечается во всех странах мира, что связано как с повышением качества диагностики, так и с истинным ростом заболевания. Установлено, что многие серонегативные женщины (с отсутствием в крови антител к ЦМВ) детородного возраста имеют высокий риск заражения во время беременности и рождения ребенка с врожденной ЦМВ-инфекцией.
Пути заражения ЦМВИ
Источником вируса могут служить моча, секрет из носоглотки, цервикальная слизь и влагалищный секрет, сперма, грудное молоко, слезы, слюна, кровь. Иначе говоря, ЦМВ может передаваться при кормлении, трансфузии крови и ее препаратов, контактах с секретами и экскретами, оседающими на игрушках и предметах обихода, а также через все биологические жидкости и выделения организма (слюна, моча и др.), при кашле (контактно-бытовой путь заражения).
Ученые в жизни человека выделяют два наиболее уязвимых периода, когда цитомегаловирус передаётся от человека к человеку. Прежде всего, это период жизни ребенка до 5 лет. Также передача вируса малышу может произойти внутриутробно через плаценту во время беременности, при грудном вскармливании, контактным и воздушно-капельным путями.[iii] Вторым критическим периодом является возраст 16-30 лет, когда инфицирование чаще всего осуществляется половым путем.
У будущих матерей с латентной ЦМВ-инфекцией плод поражается далеко не всегда. Необходимым условием для этого является обострение инфекции у матери с развитием вирусемии (состояния организма, при котором вирусы попадают в кровоток и могут распространяться по всему телу) и последующим заражением плода. Вероятность внутриутробного заболевания всегда значительно выше при инфицировании матери во время беременности.
Цитомегаловирусная инфекция по МКБ 10
Согласно Международной классификации болезней, выделяют врожденную ЦМВИ и приобретенные формы, проявляющиеся в виде пневмонии, гепатита, панкреатита, инфекционного мононуклеоза, хориоретинита, тромбоцитопении и других заболеваний.
Также цитомегаловирусную инфекцию классифицируют по клиническим проявлениям:
- латентная;
- субклиническая;
- клинически выраженные (манифестные) формы (может протекать по типу острой, подострой и хронической инфекции).
Степень тяжести заболевания может быть легкой, среднетяжелой и тяжелой.
При легкой степени тяжести и крепком иммунитете поражения внутренних органов незначительны и не сопровождаются функциональными нарушениями. При среднетяжелой степени отмечаются поражения внутренних органов, которые сопровождаются функциональными нарушениями. Тяжелая форма характеризуется резко выраженной интоксикацией и поражениями внутренних органов с тяжелыми функциональными нарушениями.
Среди возможных исходов заболевания:
- клиническое выздоровление с устранением вируса из организма или сохранением его в моче;
- поражение центральной нервной системы с устранением вируса из организма или сохранением его в моче;
- летальный исход;
- трансформация вируса в латентную форму.
Цитомегаловирус у ребенка: симптомы

При ЦМВ инкубационный период колеблется от 2-х до 4-12 недель. О перинатальном развитии заболевания можно судить по выявлению клинических признаков болезни у новорожденного. Врожденная ЦМВИ проявляется не позже, чем в течение первых двух недель жизни ребенка. Если же симптомы наблюдаются позже, это свидетельствует о приобретенной ЦМВИ в послеродовом периоде. Причем ребенок может заразиться как от матери через слюну, грудное молоко, так и от ухаживающего персонала при воздушно-капельном пути передачи возбудителей болезни. Также инфицирование может произойти при переливании донорской крови новорожденному.
Существует три формы острой врожденной цитомегаловирусной инфекции:
Первая форма с триадой симптомов:
а) желтуха, которая по своим проявлениям напоминает гипербилирубинемию новорожденных с постепенным исчезновением в течение двух-трех месяцев;
б) гепатоспленомегалия – вторичный патологический синдром, который сопровождает течение многих заболеваний и характеризуется значительным одновременным увеличением в размерах печени и селезенки;
в) геморрагический синдром – патологическое состояние, характеризующееся повышенной кровоточивостью сосудов и проявляющееся петехиями (мелкими кровоизлияниями на коже), экхимозами (крупными кровоизлияния в кожу или слизистую оболочку), носовым и пупочным кровотечением, кровоизлияниями в склеры, кровавой рвотой и меленой – черными дегтеобразными испражнениями, которые формируются при обильных кровотечениях из разных отделов желудочно-кишечного тракта.
Вторая форма цитомегаловирусной инфекции
проявляется энцефалитом со слабовыраженной клинической симптоматикой и проявлением следующих признаков:
- повышенная сонливость, судороги, увеличение лимфоузлов, нарушение сосания и глотания, тремор конечностей;
- гипотония, сменяемая гипертонией.
Третья форма ЦМВИ
проявляется поражением висцеральных органов и характеризуется высокой летальностью в первые недели жизни.
Цитомегаловирус у грудничка
По данным статистики, у большей части новорожденных ЦМВИ не развивается из-за наличия высокого уровня протективных антител у беременной или они переносят инфекцию в бессимптомной форме.
Однако, из всех врожденно инфицированных детей примерно 10% рождаются с симптомами инфекционного процесса. Характер поражения плода и новорожденного зависит от сроков инфицирования и отличается многообразием проявлений – от серьезных дефектов развития и генерализованных форм до бессимптомного течения инфекции. Конечно, чаще всего источником заражения цитомегаловирусной инфекцией новорожденных и детей первого года жизни, родившихся неинфицированными от серопозитивных по ЦМВИ матерей, являются сами матери. Наиболее значимым фактором передачи в этом случае служит грудное молоко, содержащее вирус.
Обследование новорожденного целесообразно проводить совместно с обследованием матери. Диагностика ЦМВИ проводится на основании данных специфических лабораторных исследований, в том числе анализа крови с выявлением антител IgG.
Последствия цитомегаловирусной инфекции у детей
У ребенка в ближайшие два года после рождения или позднее при наличии ЦМВ в организме могут быть выявлены дефекты зрения, слуха, зубов, нарушение поведения, отставание в умственном развитии, ДЦП. iv
Цитомегаловирус во многих случаях опасен для жизни и здоровья ребенка. При острой форме врожденной ЦМВИ гибель детей наступает в первые недели или месяцы жизни, чаще всего от присоединившихся бактериальных инфекций. У детей, перенесших острую форму заболевания, отмечается волнообразное течение хронической формы ЦМВИ. Часто формируются врожденные пороки развития ЦНС, в частности микроцефалия – почти в 40% случаев. Может развиться хронический гепатит, в редких случаях переходящий в цирроз. Изменения в легких у 25% детей характеризуются развитием пневмосклероза и фиброза.
Если в течение первых двух триместров беременности выявлена первичная ЦМВИ, в некоторых случаях может возникнуть вопрос о прерывании беременности, поскольку прогнозирование вероятных исходов беременности, осложненной вирусом, представляет собой непростую задачу. ЦМВИ отличается от других TORCH-инфекций тем, что поражения плода, вызываемые инфекцией, могут возникать в течение всех трех триместров.
Как лечить цитомегаловирус у детей

При активной ЦМВИ показан особый режим дня и соблюдение определенной диеты, которую порекомендует врач. Также необходимо комплексное медикаментозное лечение и применение противовирусных препаратов, которые борются с вирусом и не допускают развития осложнений. Один из таких препаратов, который разрешен для лечения детей с первых дней жизни, – это противовирусный препарат ВИФЕРОН, который применяется при ЦМВИ и сопутствующих заболеваниях. Противовирусные свойства позволяют ему блокировать размножение вируса, а иммуномодулирующий эффект способствует восстановлению иммунитета. Препарат разработан в результате фундаментальных исследований в области иммунологии, доказавших, что в присутствии антиоксидантов (витамины С, Е и другие) усиливается противовирусное действие основного действующего вещества – интерферона.
Инструкция по применению для новорожденных и недоношенных детей
Рекомендуемая доза препарата ВИФЕРОН Свечи для новорожденных, в т.ч. недоношенных с гестационным возрастом более 34 недель, – препарат 150 000 ME ежедневно по 1 суппозиторию 2 раза/сут через 12 ч. Курс лечения – 5 суток.
Недоношенным новорожденным с гестационным возрастом менее 34 недель назначают ВИФЕРОН 150 000 ME ежедневно по 1 суппозиторию 3 раза/сут через 8 ч. Курс лечения – 5 суток.
Рекомендуемое количество курсов для лечения цитомегаловируса у детей – 2-3 курса. Перерыв между курсами составляет 5 суток. По клиническим показаниям терапия может быть продолжена.
Инструкция по применению для беременных женщин
ВИФЕРОН также применяется для лечения цитомегаловируса у беременных женщин. Так, согласно исследованиям, применение препарата с целью сокращения развития патологических состояний у ребенка способствует снижению развития тяжелых форм внутриутробных инфекций (ВУИ) в 1,7 раза, а среднетяжелых ВУИ в 1,9 раз; сокращению числа детей с задержкой внутриутробного развития в 1,7 раза; уменьшению случаев развития асфиксии в 1,9 раз; снижению числа новорожденных с поражением ЦНС в 2,3 раза; оптимальному функциональному созреванию иммунной системы ребенка за счет антигенной стимуляции иммунитета плода. 2vi
Одно из главных преимуществ суппозиториев при лечении беременных женщин и новорожденных – бережное воздействие на организм. При использовании препарата в виде свечей печень и желудок не испытывают дополнительной нагрузки. Свечи (суппозитории) не содержат красителей и подсластителей, как сиропы и другие препараты для перорального приема. Следовательно, их применение позволяет свести к минимуму риск возникновения аллергических реакций.
Цитомегалия – это широко распространенная инфекция вирусного генеза (ЦМВИ), которая характеризуется разнообразными проявлениями: от бессимптомного течения до очень тяжелых, генерализованных форм с поражением внутренних органов и центральной нервной системы. Поскольку данный вирус был открыт сравнительно недавно, в 1956 году, то он считается еще недостаточно изученным, и в научном мире до настоящего времени борьба с ним является предметом активных дискуссий.
Суть проблемы ЦМВИ заключается в том, что она относится к так называемым оппортунистическим инфекциям, клиническое проявление которых дает о себе знать лишь в условиях первичного или вторичного иммунодефицита. У лиц с крепкой иммунной системой в подавляющем большинстве случаев инфекция протекает по типу вирусоносительства.
Число больных ЦМВ в разных странах колеблется от 0,2% до 3%, что представляет собой весьма обширную группу жителей нашей планеты. Вирус весьма широко представлен в популяции. Как правило, антитела обнаруживают у 10-15 % подростков и 40 % людей от 30-35 лет. i Распространенность этой инфекции, возможность длительной персистенции (длительного сохранения вируса в организме человека) с поражением различных органов и систем, трудности лабораторной диагностики и отсутствие лекарственных препаратов, которые могли бы раз и навсегда победить эту болезнь, подчеркивают актуальность этой проблемы.
Пути передачи цитомегаловирусной инфекции у взрослых

Современная статистика говорит о том, что на первом году жизни этой инфекцией заражается каждый пятый ребенок. Среди путей заражения наиболее опасным является внутриутробное инфицирование, т.е. во время беременности. Таким образом заражается 5-7% детей. Примерно 30% случаев передачи вируса ребенку происходит во время вскармливания малыша грудью ii . Также дети часто заражаются в детских коллективах. Доля пациентов, у которых можно обнаружить сам вирус в организме, в разных регионах мира колеблется от 44% до 85%. А вот доля болеющих цитомегаловирусной инфекцией людей составляет, по данным из разных источников, 0,2-3%.
Чаще всего заражение происходит при длительных контактах с носителями этого вируса. Он передается следующими путями:
- воздушно-капельным: при чихании, кашле, разговоре, поцелуях и т.д.;
- половым путем: через сперму, влагалищную и шеечную слизь;
- гемотрансфузионным: при переливании крови, лейкоцитарной массы, а также при пересадке органов и тканей;
- трансплацентарным: во время беременности от матери плоду.
Виды цитомегаловируса
Среди разновидностей цитомегалии выделяют следующие виды:
- Врожденная цитомегаловирусная инфекция, iii которая проявляется в большинстве своем в виде увеличения селезенки и печени. Опасность заболевания также заключается и в возможной желтухе, возникающей на фоне инфекции. Заболевание может привести к нарушению в работе центральной нервной системы, кроме того, у женщин инфекция может спровоцировать внематочную беременность или выкидыш.
- Острая цитомегаловирусная инфекция. В качестве основных путей заражения здесь преимущественно выделяют половые контакты, однако не исключено заражение и при переливании крови. По своим проявлениям цитомегалия в этом случае напоминает обычную простуду, кроме того, отмечается также увеличение слюнных желез и образование на деснах и языке белого налета.
- Генерализованная ЦМВИ. В этом случае заболевание приводит к формированию воспалительных процессов в селезенке, почках, надпочечниках, поджелудочной железе. Как правило, это происходит по причине ослабления иммунитета, при этом заболевание протекает в комплексе с бактериальной инфекцией.
Симптомы цитомегаловируса у мужчин, женщин и детей

ЦМВ инфекция является персистирующей, то есть имеющей хронический характер. Она характеризуется многообразием клинических проявлений, выраженность которых зависит от формы патологии.
При внутриутробном инфицировании могут наблюдаться недоношенность и задержка развития плода, заболевания печени, петехиальная сыпь (мелкие кожные кровоизлияния) и острые воспалительные заболевания сетчатки глаза. Летальность при внутриутробном инфицировании цитомегаловирусом достигает 30%. Из оставшихся в живых детей многим диагностируют отставание в умственном развитии или инвалидность по слуху и зрению. Но все же в большинстве случаев внутриутробное инфицирование не вызывает развития заболевания, а протекает бессимптомно.
У недоношенных младенцев ЦМВИ может привести к увеличению лимфатических узлов, гепатиту, развитию тяжелой пневмонии, к которой часто присоединяется бактериальная инфекция. Таких детей необходимо срочно лечить в условиях стационара.
Цитомегаловирусная инфекция у взрослых приводит к развитию мононуклеозоподобного синдрома, который по своим симптомам напоминает ОРВИ. Заболевание проявляется следующими клиническими признаками:
- повышенная температура тела, которая наблюдается до месяца и более;
- суставные и мышечные боли, головная боль;
- боли в горле;
- выраженные слабость, недомогание, вялость, повышенная утомляемость;
- увеличение лимфоузлов и слюнных желез;
- кожные высыпания.
Также могут развиться заболевания печени и редко – пневмония. Длительность течения мононуклеозоподобного синдрома может составлять до 60 и более дней.
Особенно тяжело ЦМВ переносят пациенты, которые страдают синдромом врожденного и приобретенного иммунодефицита (СПИД iv ). Те, кто перенес пересадку внутренних органов и тканей, вынуждены постоянно принимать иммунодепрессанты, что приводит к подавлению иммунных реакций. Это тоже может стать причиной активизации ЦМВИ в организме. Множественное поражение органов этим видом вируса и отсутствие адекватной терапии может привести к их дисфункции и даже гибели пациента.
С целью диагностики данной инфекции проводятся лабораторные исследования и определение в крови специфических антител к цитомегаловирусу – иммуноглобулинов М и G. Наличие иммуноглобулинов М может свидетельствовать о первичном заражении этим заболеванием либо о наличии в организме хронической цитомегаловирусной инфекции. Повышение количества иммуноглобулинов G наблюдается в период затухания активности инфекции. Их наличие в крови говорит о присутствии вируса в организме, но не свидетельствует об активности инфекционного процесса.
Лечение цитомегаловируса: лекарства, применяемые при терапии
Поскольку важным звеном в активации и распространении этой инфекции в организме больного является снижение иммунной защиты, для поддержания иммунитета на необходимом уровне применяются препараты с содержанием интерферонов. Один из таких препаратов – это комплексный противовирусный иммуномодулирующий препарат ВИФЕРОН широкого спектра действия для детей и взрослых. Он обладает двойным действием – способствует блокировке вируса и восстановлению иммунитета. Оригинальная формула препарата включает сочетание интерферона альфа-2b и высокоактивных актиоксидантов (витамины С, Е). Препарат входит в группу цитокинов и обладает универсальным действием при лечении в отношении широкого спектра вирусов и других возбудителей заболеваний.
ВИФЕРОН Свечи при цитомегаловирусе
ВИФЕРОН в виде Свечей (суппозиториев) для лечения цитомегаловируса взрослым можно применять при беременности (с 14-й недели), а также в период грудного вскармливания. Также препарат разрешен детям, в том числе новорожденным и недоношенным. ВИФЕРОН помогает снижать частоту рецидивов 1 и применяется в составе комплексной терапии для борьбы с рядом заболеваний, в том числе инфекционно-воспалительными заболеваниями урогенитального тракта у взрослых (вирус папилломы человека, хламидиоз, цитомегаловирусная инфекция, уреаплазмоз, трихомониаз, гарднереллез, бактериальный вагиноз, рецидивирующий влагалищный кандидоз, микоплазмоз).
Дозировка
Рекомендуемая доза для взрослых – ВИФЕРОН 500 000 ME по 1 суппозиторию 2 раза/сут через 12 ч ежедневно в течение 5-10 суток. По клиническим показаниям терапия может быть продолжена.
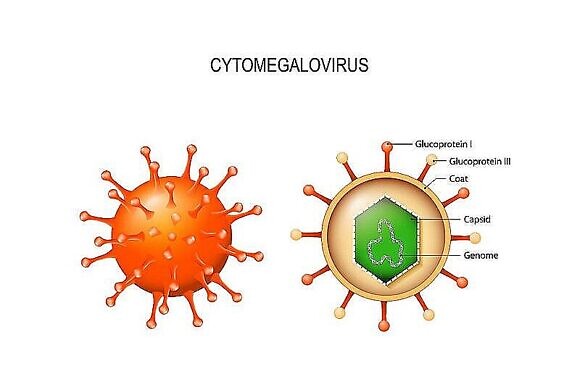
Что такое ЦМВ (цитомегаловирус)?
Цитомегаловирус (Cytomegalovirus Hominis) человека (ЦМВ) – условно-патогенный возбудитель, относящийся к семейству герпесвирусов. Вирус представляет опасность для беременных женщин, так как может крайне негативно повлиять на развитие плода и здоровье будущего ребенка.
Врачи отмечают важность выявления активной инфекции у беременной и ранней диагностики у новорожденного, чтобы постараться оказать своевременную помощь и снизить ее последствия. Физиологическая иммунная недостаточность детей раннего возраста, иммунодефицит, вызванный беременностью, неблагоприятной экологией среды, а также ВИЧ-инфекция обусловливают реактивацию ЦМВИ и ее клинические проявления. В то же время подавление клеточного иммунитета может быть следствием прямого воздействия вируса на Т-лимфоциты. Кроме того, нарушается регуляция иммунного ответа, в основе которого лежит повреждение системы интерлейкинов. При снижении иммунитета вирус разносится в различные органы.
С последствиями внутриутробной инфекции врачам приходится сталкиваться не только у младенцев, инфекция может иметь отдаленные последствия, могут развиваться достаточно серьезные болезни вплоть до инвалидизации. Для скорейшего реагирования и назначения адекватной терапии, если этого требует конкретная ситуация, необходимо не просто вовремя получить результаты анализов, но и правильно их расшифровать. Наиболее компетентным будет заключение врача-инфекциониста. С этиологической расшифровкой данной патологии у новорожденных по ряду причин могут возникать сложности, в следствие чего, помощь и адекватное лечение иногда запаздывает.
Риск передачи цитомегаловирусной (ЦМВ) инфекции у новорождённых
Существует зависимость между социально-экономической ситуацией в регионе, уровнем бытовой и половой культуры и распространенностью ЦМВИ. Например, если во всем мире показатели зараженности среди молодежи очень высокие (80-90%), то в развитых странах – США и Европе они составляют 43-50%. В России 70-80% беременных имеют антитела к этой инфекции.
Врожденная ЦМВИ диагностируется у 2% новорожденных. Заражение происходит через плаценту или во время родов. Врачи выделяют в отдельную проблему первичное заражение беременных. Если говорить простыми словами, то первичное заражение – это, когда женщина впервые заболевает цитомегаловирусной инфекцией именно в период беременности. Такая инфекция носит острый характер и может крайне негативно сказаться на состоянии плода.
При развитии острой ЦМВ во время вынашивания риск передачи вируса ребенку зависит от срока гестации. В процентном соотношении – 30% в первом, 40% – во втором и 70% в третьем триместре. Опасность развития последствий у ребенка обратно пропорциональна, то есть чем на более раннем сроке беременная была инфицирована, тем сильнее ребенок будет страдать.

Если же имеющаяся в организме матери инфекция по каким-либо причинам реактивирована во время беременности, то вероятность заражения плода будет существенно ниже: при реактивации – до 0,2%, при реинфекции от 0,5-20% случаев. По наблюдениям специалистов, занимающихся этой проблематикой, клинически выраженная симптоматика присутствует примерно в 10-15% случаев, то есть 85-90% проходят бессимптомно. Отсутствие симптомов не означает, что дети не будут испытывать тяжелые осложнения.
Симптомы ЦМВ у беременных женщин
При заражении 32% случаев не имеют симптомов, а в 68% они есть. Однако проблема заключается в том, что повышение температуры, слабость, головную боль, боль в мышцах и суставах, насморк, а также сухой кашель и фарингит можно спутать с ОРВИ и, тем самым, пропустить опасное заболевание. Анализ крови может указывать на повышение активности печеночных ферментов и лимфоцитоз. Первичное инфицирование на ранних сроках может привести к тяжелым последствиям; пороки развития, связанные с внутриутробной инфекцией, могут привести к гибели ребенка. Исследование амниотической жидкости, пуповинной жидкости и видимые отклонения от нормы при УЗИ на разных сроках могут быть основанием для проведения ПЦР диагностики для выявления активного течения ЦМВИ.
Как проявляется цитомегаловирусная инфекция у детей до 1 месяца (новорожденных)

Одной из основных мишеней вируса являются сосуды. Поэтому для детей, родившихся с ЦМВ, характерна сыпь, воспаления на коже, кровоизлияния, язвенные дефекты.
Врожденная манифестная цитомегаловирусная инфекция в большинстве случаев может повлечь за собой тяжелые отдаленные последствия:
- IQ менее 70
- Сенсорноневральную глухоту
- Снижение слуха
- Нарушение восприятия речи
- Микроцефалия, судороги, парезы, параличи, хореоретинит
Бессимптомная форма врожденной инфекции также способна дать тяжелые последствия, к счастью, намного реже чем манифестная.
Внутриутробное инфицирование не всегда приводит к развитию активных форм заболевания и во многом зависит от состояния плода и новорожденного. Так, риск значительно возрастает, если ребенок недоношенный, родился с задержкой развития или поражениями центральной нервной системы либо при тяжелом течении беременности i .
Также степень поражения органов, выраженность воспалительных процессов при врожденной ЦМВИ зависят от ряда факторов: свойств возбудителя, обширности инфицирования, зрелости плода, состояния иммунитета матери и ребенка. Врачи считают важным, на каком сроке произошло инфицирование, и как инфекция проявилась у матери (была ли это первичная инфекция или реактивация латентной инфекции). Инфекция считается первичной, если организм впервые инфицирован данным возбудителем и не сталкивался с ним ранее. Если же инфекционный процесс развивается в результате активизации возбудителя, находившегося до этого в латентном состоянии, или из-за повторного инфицирования, то это вторичная инфекция. Установлено, что наиболее часто инфицирование плода и развитие тяжелых последствий отмечаются, если беременная переносит первичную инфекцию.
Последствия врожденной ЦМВ у детей первого года жизни
Мы помним, что цитомегаловирусная инфекция – наиболее частая врожденная вирусная патология. Она является основной причиной врожденных пороков, задержки психического и умственного развития у детей раннего возраста, не имеющих хромосомных нарушений. Врачи считают этот вирус главной причиной врожденной глухоты. Есть данные о связи данного вируса с церебральным параличом, некоторыми формами шизофрении, имеется теория о вирусной причине нейрокогнитивных расстройств.
Риск передачи ЦМВ у ребенка после рождения

Раннее постнатальное заражение имеет гораздо меньше последствий, особенно, если ребенок доношенный и в остальном здоровый. Основной путь заражения ребенка до года – через грудное молоко. Угроза реальна, так как по статистике инфицированные матери передают инфекцию 40-76% детей, находящимся на грудном вскармливании больше месяца. Однако нахождение вируса в грудном молоке не является противопоказанием к грудному вскармливанию у здоровых, неослабленных детей.
Заражение может произойти при прохождении плода через инфицированные родовые пути, вследствие попадания околоплодных вод в организм ребенка либо через поврежденные кожные покровы.
Разница между врождённой и приобретённой ЦМВИ у детей
При интранатальном (во время родов) заражении заболевание проявляется симптомами в 2-10% случаев, грозя малышу в первые два месяца жизни желтухой, пневмонией, анемией и другими заболеваниями. У детей первого года жизни, которые заразились уже в постнатальном периоде, бывают затяжные ОРВИ, кашель, пневмония, стоматит, но поражений ЦНС не отмечается. У детей от года до 14 инфекция может проявляться сиалодениом, фарингитом, ларингитом, бронхитом и бронхиальной астмой.
Так как по симптомам узнать о заражении сложно, рекомендуется проведение лабораторных исследований. Определяют наличие или отсутствие антител к ЦМВ. Метод показателен для беременных, у которых выявление антител IgM, если их не было ранее, указывает на острый период заболевания и первичное заражение с риском передачи вируса плоду.
Что делать при выявлении ЦМВ у беременной женщины?
Если у беременной не обнаружено антител IgG, ей следует чаще проходить мониторинг, а также следовать рекомендациям врачей по профилактике. Со специалистом как правило оговариваются методы контрацепции, ограничение слишком близкого физического контакта со старшими детьми, особенно, если они ходят в детское дошкольное учреждение, отдельное белье, полотенца, не нужно доедать за детьми из одной тарелки. Беременные женщины, у кого не было ранее ЦМВИ, работающие в детских дошкольных учреждениях, домах малютки и проч., могут на время изменить условия своей деятельности.
Следы вируса, обнаруженные в разных биологических жидкостях будущей матери, свидетельствуют о различном уровне опасности для ребенка. Существует корреляция между количеством ДНК вируса в амниотической жидкости матери и вероятностью развития у будущего ребенка манифестной ЦМВИ. Беременные женщины с симптомами ОРВИ фарингита, при повышенной температуре должны пройти ДНК-диагностику цитомегаловируса, чтобы не пропустить его активацию или реактивацию, в случае чего может быть назначено лечение. Если у будущей матери в той или иной форме был выявлен вирус, ребенка обследуют в обязательном порядке, так как эта инфекция существенно влияет на развитие, качество жизни и на возможные заболевания, возникающие на фоне этой инфекции. Целью такого тщательного подхода к выявлению вируса является своевременное лечение и профилактика.
Цели терапии и профилактики
- недопущение или окончание фазы активного размножения вируса;
- предотвращение передачи вируса от клетки к клетке;
- инактивация свободных вирусов в экстраклеточном пространстве;
- переведение активно размножающегося вируса в состояние латентной персистенции
На данном этапе развития науки не существует средства, с помощью которого можно полностью элиминировать цитомегаловирус, таким образом хроническая ЦМВ инфекция присутствует в организме у тех, кто с ней столкнулся.
Лечение ЦМВ
Лечение больных цитомегаловирусной инфекцией включает режим, диету, этиотропные препараты, симптоматические средства, иммунотерапию и иммунокорекцию. Выбор метода лечения детей больных ЦМВИ зависит от клинической картины, степени проявлений симптомов и синдромов, степени тяжести заболевания, осложнений. В Клинических рекомендациях (протоколе лечения) оказания медицинской помощи детям больным цитомегаловирусной инфекцией, в основу которых легли авторитетные материалы в области доказательной медицины, интерферон альфа указывается как средство, применимое при легких и среднетяжелых формах заболевания с высокой степенью достоверности ii .
ВИФЕРОН при цитомегаловирусе у детей
Поскольку от уровня иммунитета во многом зависит активация и распространение инфекции в организме, лечение ЦМВ у детей может включать комплексный противовирусный иммуномодулирующий препарат ВИФЕРОН широкого спектра действия для детей и взрослых. Он обладает двойным действием – способствует блокировке вируса и восстановлению иммунитета. Оригинальная формула препарата включает сочетание интерферона альфа-2b и витаминов С и Е. Препарат входит в группу цитокинов и обладает универсальным действием при лечении в отношении широкого спектра вирусов и других возбудителей заболеваний. В инструкции к препарату ВИФЕРОН Суппозитории указано:
Рекомендуемая доза для новорожденных детей, в том числе недоношенных с гестационным возрастом более 34 недель, – ВИФЕРОН 150 000 МЕ ежедневно по 1 суппозиторию 2 раза в сутки через 12 ч. Курс лечения — 5 суток.
ВИФЕРОН при ЦМВ можно применять недоношенным новорожденным детям с гестационным возрастом менее 34 недель рекомендовано применение препарата ВИФЕРОН 150 000 МЕ ежедневно по 1 суппозиторию 3 раза в сутки через 8 ч. Курс лечения — 5 суток.
Рекомендуемое количество курсов при цитомегаловирусной инфекции — 2–3 курса, Перерыв между курсами составляет 5 суток. По клиническим показаниям терапия может быть продолжена.
ВИФЕРОН при цитомегаловирусе у беременных
Схема применения препарата ВИФЕРОН при цитомегаловирусе у беременных была специально разработана для обеспечения пролонгированного эффекта на протяжении периода с 14 недели и до родов. Уникальность способа заключается в том, что он не только помогает блокировать размножение вируса, но и способствует удерживать его в латентном состоянии. Таким образом препарат оказывает воздействие как на организм самой женщины, так и помогает снизить риск неблагоприятных последствий для плода. При этом важно помнить, что если инфекция была выявлена позже, например, на 18 неделе, то основные лечебные курсы с использованием препарата в дозировке 500 000 МЕ (на рисунке – зеленым) не сокращаются, а начинаются также с 18 недели (согласно примеру). Сокращается в этом случае количество поддерживающих курсов с использованием препарата в дозировке 150 000 МЕ (на рисунке – синим).
Читайте также:

