Висцеральная форма заболеваний вызываемая миграцией личинок гельминтов
Обновлено: 18.04.2024
Larva migrans, мигрирующая личинка (лат. larva маска, личинка; migrans переходящий),— группа болезней человека, вызываемая мигрирующими личинками несвойственных ему гельминтов животных. Наименование впервые ввел Бивер (Р. С. Beaver) с соавт. в 1952 г. Заражение человека гельминтами животных происходит теми же путями, что и специфичными для него видами. В организме человека гельминты животных, как правило, проходят лишь первые стадии развития, мигрируя в тканях нередко длительное время.
Выделяют кожную и висцеральную формы Larva migrans, возбудителями к-рых являются личинки разных видов гельминтов. Кожная форма (ползучая сыпь) вызывается преимущественно личинками нематод (см. Нематодозы) и трематод (см. Трематодозы), а висцеральная форма — личинками нематод и цестод (см. Цестодозы). Нек-рые авторы ошибочно называют Larva migrans болезнь, вызываемую миграцией личинок оводов (см. Миазы).
Кожная форма
Наиболее частыми возбудителями являются анкилостомиды животных Ancylostoma braziliens, Faria, 1910; A. caninum (Ercolan, 1859) Linstow, 1889; Uncinaria stenocephala (Railliet, 1884); стронгиляты крупного рогатого скота (Strongyloididae spp.); шистосоматиды водоплавающих птиц.
Известны единичные заболевания кожной формой Larva migrans в разных климатических зонах мира, в частности в США (личинки анкилостомид собак, нематоды крупного рогатого скота), в Китае (парагонимусы собак и кошек), в СССР (шистосоматиды птиц).
Заражение, вероятно, возможно при контакте с почвой или водой (при купании, умывании), в к-рых находятся личинки в инвазионной фазе.
Кожная форма характеризуется линейными поражениями кожи, возникающими но ходу продвижения личинок и сопровождающимися резким зудом кожи. Кожные поражения вначале захватывают эпидермис. Небольшие папулы, позднее переходящие в везикулы, образуются на месте проникновения личинки и, поскольку личинка мигрирует из этого участка, ее путь отмечается неправильной линией папуловезикулярного высыпания, удлиняющегося за день на 1—3 см. Высыпания на коже продолжаются от нескольких дней до нескольких недель. Более старые места поражений на 2—3-й день покрываются корочкой, через 10—14 дней полностью исчезают. Подвижная личинка располагается в зернистом слое эпидермиса, сразу под базальным слоем. В нек-рых случаях личинки проникают в более глубокие слои кожи, но затем могут снова возвращаться в эпидермис. Воспалительная реакция вокруг мигрирующих личинок носит в основном аллергический характер.
Лечение проводят минтезолом или вермоксом.
Прогноз всегда благоприятный, даже без лечения.
Профилактика — ограничение контакта незащищенной кожи с почвой и водой в местах возможного нахождения личинок в инвазионной фазе.
Висцеральная форма
Заражение нек-рыми гельминтами животных может происходить в случаях заглатывания инвазионных яиц или личинок с загрязненными почвой продуктами питания, водой (напр., личинками токсокар и др.). В других случаях люди заражаются при употреблении в пищу моллюсков, креветок, рыб без термической обработки.
Висцеральная форма наблюдается преимущественно у детей в возрасте 1—4 лет, хотя известны случаи этого заболевания среди взрослых. Патологический процесс является следствием механического воздействия личинок ка ткани и воспалительной реакции на их присутствие. В пораженных тканях обнаруживаются аллергические гранулемы и некрозы. Патологический процесс может возникнуть в любом органе и ткани, куда проникают личинки, но наиболее часто в печени. Вокруг погибших личинок наблюдается более острая аллергическая реакция, чем вокруг живых.
Основными симптомами болезни являются лихорадка (см.), пневмония (см.), гепатомегалия (см. Печень), гиперглобулинемия (см. Протеинемия), эозинофилия (см.). Температура повышается в полдень или вечером и может сопровождаться обильным потоотделением. У большинства больных развивается пневмония. Наблюдается сухой кашель, в некоторых случаях — тяжелая одышка с астматическим дыханием и цианозом. При рентгенологическом исследовании выявляются летучие эозинофильные инфильтраты, усиление легочного рисунка, иногда картина бронхолегочной инфильтрации.
Гепатомегалия — типичный признак, хотя при легких инвазиях она может отсутствовать. Печень при пальпации плотная, гладкая, часто напряжена. При лапароскопии могут быть видны множественные белесоватые узелки, к-рые при микроскопическом исследовании оказываются эозинофильными гранулемами. Уровень общего белка сыворотки крови повышен за счет увеличения количества гамма-глобулинов, особенно IgM.
Известны случаи тяжелого миокардита и гранулематозного эозинофильного панкреатита. Иногда наблюдаются судорожные припадки по типу petit mal, обусловленные, по-видимому, эозинофильными гранулемами в мозге. Эозинофилия стойкая, длительная, составляет ок. 50% в лейкоцитарной формуле, но может достигать 90%. Общее количество лейкоцитов существенно повышается.
Точный прижизненный диагноз висцеральной формы Larva migrans не всегда возможен, т. к. обнаружить мигрирующие личинки очень трудно, а идентифицировать их в большинстве случаев невозможно. Ведущими методами диагностики являются серологические реакции со специфическими антигенами. Заболевание необходимо дифференцировать с ранней стадией свойственных человеку гельминтозов (аскаридоза, некатороза, описторхоза, фасциолеза, шистосоматоза и др.), а также с многочисленными заболеваниями, сопровождающимися выраженной эозинофилией.
Лучшими препаратами для специфической терапии являются антигельминтики широкого спектра действия — минтезол (тиабендазол) и вермокс (мебендазол). Минтезол назначают из расчета 25—50 мг/кг в сутки в три приема в течение 5—7 дней подряд, вермокс — по 100 мг два раза в день в течение 5—7 дней подряд. При необходимости лечение повторяют через 1 — 2 мес.
Длительность течения болезни — от нескольких месяцев до нескольких лет.
Прогноз в большинстве случаев благоприятный, однако описаны единичные случаи летальных исходов.
Профилактика: соблюдение правил личной гигиены, достаточная термическая обработка пищевых продуктов.
Библиогр.: Многотомное руководство по микробиологии, клинике и эпидемиологии инфекционных болезней, под ред. Жукова-Вережникова, т. 9, с. 665, М., 1968; Faust E. С., Вeaver P. С. а. Jung R. С. Animal agents and vectors of human disease, Philadelphia, 1968.
Мигрирующая личинка – это группа инфекционных кожных заболеваний, связанных с поражением личинками гельминтов. Основным симптомом является дерматит в виде нитевидных линий, образуемых при передвижении возбудителя в верхних слоях дермы. Сыпь сопровождается сильным зудом, чаще всего поражаются нижние конечности. Типичные симптомы позволяют поставить диагноз по клинической картине и анамнезу, возможно обнаружение личинок в коже при биопсии. Лечение этиотропное (антигельминтные препараты) и симптоматическое; допускается местное применение хлорэтила, в редких случаях показано хирургическое вмешательство.
МКБ-10
Общие сведения
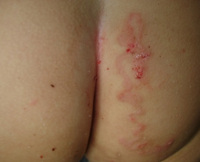
Мигрирующая личинка (larva migrans, ползучая болезнь) является собирательным названием для группы кожных личиночных поражений. Первые письменные упоминания заболевания датируются 1874 годом, клиническую характеристику нозологии дали Уайт и Дав в 1929 году. Патология распространена в тропических странах, на территории бывшего СССР, США, Европы. Наблюдается прямая зависимость заболеваемости от сезона – дожди способствуют рассеиванию яиц и личинок паразита. Частота нетипичных локализаций поражения (туловище, ягодицы, голова) также зависят от сезонных изменений вследствие использования либо неиспользования обуви и закрытой одежды.

Причины
Наиболее распространенными возбудителями являются личинки анкилостом Ancylostoma braziliense, A. ceylanicum, A. caninum. Путь заражения – контактный (через кожу). Для гельминтов человек является биологическим тупиком – паразиты за редким исключением не могут пройти через базальную мембрану эпидермиса, вследствие чего личинки погибают в коже, не достигая половой зрелости. Хаотичная миграция внутри верхних слоев кожи приводит к появлению извитых (серпигинозных), реже линейных ходов.
Источниками инфекции служат собаки и кошки, в кишечнике которых обитают половозрелые особи. Считается, что анкилостомами поражено до 50% бродячих собак. С фекалиями яйца паразитов выделяются в окружающую среду, где в условиях высокой влажности, затененности и тепла развиваются личиночные формы. При нахождении на песке без обуви и длительном лежании личинки активно проникают в кожу. Факторы риска – мужской пол, молодой возраст, проживание в неудовлетворительных социально-гигиенических условиях, на территории с загрязнением испражнениями животных.
Патогенез
Личинки проникают в организм человека при случайном контакте сквозь отверстия волосяных фолликулов, микротрещины или через неповрежденную кожу, которая разрушается протеазой, вырабатываемой паразитами. Дермальное ограничение продвижения обусловлено малым количеством либо отсутствием продуцируемой личинкой коллагеназы, необходимой для расщепления базальной мембраны. Обычно возбудитель находится в зернистом эпидермальном слое, крайне редко проникает в нижележащие покровы, но быстро возвращается обратно.
Расположение хода не связано с локализацией личинки, поскольку движение последней хаотично и беспорядочно. Возможно наличие как одиночных, так и множественных ходов, заполненных серозным отделяемым. Иногда выявляются уртикарные и эритематозные высыпания. В толще эпидермиса в надбазальных слоях обнаруживаются непосредственно личинки, а также воспалительные явления аллергического генеза: некротизированные кератиноциты, спонгиоз, внутриэпидермальные везикулы, большое количество нейтрофилов и эозинофилов.
Симптомы мигрирующей личинки
Инкубационный период составляет 1-5 суток, может укорачиваться до нескольких часов либо удлиняться до месяца и более. На месте внедрения личинки возникает сильный зуд, болезненность, жжение, появляется красный бугорок. Около 40% случаев инвазии приходится на кожные покровы нижних конечностей, 20% – на ягодицы, гениталии, 15% – на область живота. По мере продвижения личинки на коже возникают возвышающиеся извилистые нитевидные линии красновато-коричневого цвета, исходящие из первичного бугорка.
Паразит двигается относительно медленно, до 1-3 см в сутки, его передвижение может не ощущаться пациентом, редкими проявлениями считаются отеки области инвазии, гнойнички вокруг волосяных фолликулов. Симптомы сохраняются от 4 недель до 6 месяцев, могут самостоятельно регрессировать. Около 50% больных отмечают появление сухого надсадного кашля со скудной мокротой. Температура тела обычно остается нормальной, резкое повышение может свидетельствовать о присоединении вторичной бактериальной инфекции.
Осложнения
Наиболее частыми осложнениями мигрирующей личинки являются гнойные воспалительные процессы в коже, связанные с присоединением гноеродной флоры: импетиго, абсцессы, фолликулит. Нередко наблюдаются осложнения на фоне приема этиотропных лекарств, их воздействия на ЖКТ, ЦНС и другие органы. Реже встречающаяся массивная инвазия паразита приводит к отечности и лимфостазу конечностей, описаны случаи синдрома Леффлера, эозинофильного энтерита, мультиформной экссудативной эритемы и буллезных кожных поражений. В случае миграции личинок по кровеносному руслу и попадания в легочную ткань формируются бронхиты, пневмонии, плевриты.
Диагностика
Диагноз мигрирующей личинки подтверждается инфекционистом, нередко требуется осмотр дерматовенеролога и других врачей. Обязателен тщательный сбор эпидемиологического анамнеза с уточнением поездок в природные зоны, эндемичные по данному заболеванию. Диагностические методы, необходимые для верификации личиночного поражения, включают следующие методики:
- Физикальное обследование. При объективном осмотре на коже стоп, ягодиц, живота, реже других частях тела обнаруживаются характерные серпигинозные нитевидные извитые ходы, приподнятые над кожными покровами, буровато-коричневого оттенка до 5 см длиной и 3 мм шириной. Наблюдаются расчесы вследствие сильного зуда. Внутренние органы и системы обычно в норме.
- Лабораторные исследования. Характерными изменениями в общеклиническом анализе крови считаются лейкоцитоз, эозинофилия (до 50%) и незначительное ускорение СОЭ. Биохимические параметры в пределах нормы за исключением гипергаммаглобулинемии. Иммунограмма может выявить повышение уровня Ig E. В редчайших случаях аллергического поражения легких возможно обнаружение до 90% эозинофилов в мокроте.
- Выявление инфекционных агентов. Доказательством инвазии служит визуализация личинок в биоптатах кожи. С целью дифференциального диагноза исследуются кожные и перианальные соскобы, проводится ИФА с боррелиозными антигенами, микроскопия кала с целью выявления яиц и живых паразитов, в некоторых случаях осуществляется вскрытие ходов скальпелем, обработанным вазелином, для обнаружения возбудителя.
- Инструментальные методики. Рентгенография легких необходима для исключения поражения нижних отделов респираторного тракта. Ультразвуковое исследование органов брюшной полости назначается для исключения паразитарных инвазий с висцеральными проявлениями, по показаниям выполняют УЗИ мягких тканей, лимфатических узлов в зоне кожных симптомов.
Дифференциальную диагностику проводят с мигрирующим миазом, для которого типично быстрое (до 30 см в день) продвижение внутри кожи личинок насекомых, кольцевидной эритемой при иксодовом клещевом боррелиозе в виде пятен с прямыми контурами, не приподнятыми над поверхностью. При грибковых кожных инфекциях отмечаются бляшки, шелушение. Симптомы мигрирующей личинки также сходны с чесоткой, характеризующейся прямыми линейными ходами белесовато-серого цвета, и контактным дерматитом, который возникает после контакта кожи с аллергеном, сопровождается появлением везикул и гиперемии при отсутствии серпигинозных ходов.
Лечение мигрирующей личинки
Лечение обычно проводится амбулаторно. Специальные диетические рекомендации не разработаны, назначается общий стол и адекватный водный режим. Этиотропная терапия мигрирующей личинки предусматривает пероральный прием препаратов альбендазола, ивермектина и тиабендазола, эффективность составляет 75-89%. Возможно местное нанесение крема либо суспензии с альбендазолом, эффект достигается в 96-98% случаев.
Для облегчения зуда рекомендовано использование антигистаминных и десенсибилизирующих средств, при возникновении гнойных осложнений показаны антибиотики. Описана некоторая эффективность местной криотерапии жидким азотом, однако при ее неправильном применении могут образовываться длительно незаживающие язвы. Высока вероятность отсутствия личики в обрабатываемом азотом ходе и выживания гельминта, поскольку паразит способен сохранять жизнеспособность при -21° C более 5 минут.
Прогноз и профилактика
Прогноз благоприятный, летальных исходов зафиксировано не было. При неосложненном течении болезни симптомы склонны к самостоятельному исчезновению примерно в течение 3-5 недель. Ежегодно до 22-58% случаев мигрирующей личинки неверно интерпретируются медицинскими работниками, вследствие чего возникают осложнения, не назначается адекватное лечение. Причиной диагностических ошибок становится неявная или нерезко выраженная симптоматика с преобладанием кожного зуда при отсутствии других жалоб.
Специфические профилактические средства (вакцины) не разработаны. Неспецифическими мерами предотвращения заражения являются личная гигиена, отказ от купания и проглатывания воды в случайных водоемах, хождение по песку и почве в прорезиненной закрытой обуви, использование перчаток и одежды закрытого типа при работе с грунтом и растениями. Необходимо проведение плановой дегельминтизации домашних питомцев, исключение выгула собак на детских игровых площадках.
4. Epidemiology and morbidity of hookworm-related cutaneous larva migrans (HrCLM): Results of a cohort study over a period of six months in a resource-poor community in Manaus, Brazil/ F. Reichert, D. Pilger, A. Schuster// PLoS Negl Trop Dis - 2018 Jul; - №7.
Токсокароз – это хроническое инфекционное заболевание, вызываемое личинками круглого червя токсокары. Для инвазии характерна лихорадка, рецидивирующие высыпания и увеличение размеров печени. Патология сопровождается поражением глазных яблок и внутренних органов: сердца, головного мозга, легких. Диагностика заключается в обнаружении специфических антител к возбудителю. Лечение этиотропное (антигельминтные препараты), также применяются средства симптоматической терапии, в некоторых случаях производятся хирургические вмешательства.
МКБ-10
B83.0 Висцеральная форма заболеваний, вызываемых миграцией личинок гельминтов [висцеральная Larva migrans]
Общие сведения

Причины токсокароза
Возбудитель – круглый червь Toxocara, наиболее часто встречаются инвазии видами Т. сanis (собачий) и T. сati (кошачий). Основной цикл развития паразита не включает в себя человеческий организм, поэтому люди оказываются случайными хозяевами гельминта, который в подобных условиях неспособен достигать половозрелой формы. Источником инфекции является больное животное (чаще собака), больной человек эпидемиологически не опасен. Считается, что доля зараженных токсокарозом среди взрослых собак варьирует от 15 до 50%, щенков – до 80%.
Больные животные выделяют яйца гельминтов с фекалиями, сами паразиты в половозрелой форме находятся у постоянного хозяина в пищеварительном тракте. Наиболее опасными считаются дворы, детские площадки, парки, поскольку контаминация земли яйцами паразита встречается в 10-40% почвенных проб. Инфицирование людей происходит контактным и пищевым путем – при поглаживании, играх со зверями, особенно бродячими, употреблении в пищу немытых ягод, фруктов и овощей. Отмечено, что тараканы могут поглощать яйца токсокар с последующим выделением до 25% потенциально жизнеспособных особей, что играет важную роль в распространении инфекции в быту.
Патогенез
После попадания яиц токсокары в тонкий кишечник человека (преимущественно двенадцатиперстную кишку) высвобождаются личинки, проникающие в системный кровоток через слизистую оболочку. Сначала токсокары заносятся в печень и правую половину сердца, затем в легочную артерию и левый желудочек, откуда выходят в большой круг кровообращения. Распространяясь по организму, личинки оседают в различных органах и тканях, вызывая геморрагические и некротические изменения, образование воспалительных очагов в виде гранулем, в центре которых находится некротизированная ткань и личинка, вокруг – воспалительный инфильтрат.
При попадании в кровеносное русло продуктов жизнедеятельности возникают аллергические реакции. Часть личинок гибнет, оставшиеся гельминты выделяют особую маскирующую субстанцию, которая позволяет им персистировать в организме до 10 лет, периодически мигрируя по кровеносной системе и поражая новые ткани. Характерной особенностью токсокар является формирование гранулем в поджелудочной железе, головном мозге, печени, легких, миокарде и мезентериальных лимфатических узлах. Патогенез поражения глаз до конца не изучен, имеются гипотезы о низкой активности инвазии и малой выраженности иммунного ответа.
Патогенез эпилепсии при токсокарозе окончательно не ясен. Предполагается, что поражение головного мозга может привести к формированию волокнистых рубцов после острого воспаления или хронических гранулем. Другая теория объясняет появление эпилептических припадков при повреждении нейронов усиленным образованием провоспалительных цитокинов из-за повышения проницаемости гематоэнцефалического барьера, вызываемого паразитами, а также аутоантителами к нейрональным элементам, которые нередко обнаруживаются у больных токсокарозом.
Классификация
Классификация токсокароза у человека основывается на глубине инвазии в организм человека. Гельминтоз практически всегда протекает с минимальной либо неспецифической клиникой (субклинически), бессимптомная форма встречается в 13% случаев заболевания, органные поражения более характерны для детей. Выделяют следующие виды токсокароза:
- Глазной.Типичен для детей старше 8 лет, подростков и молодых взрослых. Поражение зрительного аппарата обычно одностороннее, протекает в виде хронического эндофтальмита, увеита, абсцессов стекловидного тела, папиллитов, кератитов и косоглазия. При длительном течении возможна слепота.
- Висцеральный.Протекает остро или хронически с вовлечением дыхательной системы, сердца, кожи, лимфатических узлов, селезенки, печени, суставов и мышц. Часто наблюдается диарея, тошнота и рвота. Описаны поражения головного мозга: рецидивирующие головные боли, менингоэнцефалит, эпилептические припадки.
Симптомы токсокароза
Инкубационный период определить сложно, считается, что он может занимать несколько лет. При остром начале наблюдается лихорадка до 38,5°C и выше, поражения дыхательной системы – от заложенности носа, сухого кашля и першения в горле до тяжелой одышки и астматического статуса. На коже появляется зудящая сыпь в виде волдырей и пятен, при подкожном расположении личинок видны приподнятые над поверхностью прямые или извилистые красновато-коричневые ходы. У детей нередко выявляются увеличенные плотноэластические безболезненные лимфоузлы. Пациенты с токсокарозом часто предъявляют жалобы на боли в животе, тошноту, иногда – рвоту и срывы стула.
Осложнения
Наиболее частые осложнения висцерального токсокароза – бронхиальная астма, хронический бронхит и эпилепсия, глазного – отслойка сетчатки и односторонняя слепота. Подкожное расположение личинок токсокар приводит к присоединению вторичной бактериальной инфекции, образованию инфильтраов, абсцессов и флегмон, поражение легких – к тяжелым пневмониям смешанной этиологии с нарастающей дыхательной недостаточностью. Массивная инвазия гельминтов, полиорганное поражение могут стать причиной летального исхода. У беременных женщин токсокароз часто выявляется невынашивание, задержка внутриутробного развития плода.
Диагностика
Диагноз токсокароза подтверждается врачом-инфекционистом. Для исключения сочетания висцерального и глазного гельминтоза обязательным является осмотр офтальмолога, по показаниям назначаются консультации других специалистов. Диагностические методы, необходимые для верификации токсокарозного поражения, включают следующие методики:
Дифференциальную диагностику проводят с аскаридозом, при котором нередко наблюдаются кишечная непроходимость, острая обструкционная дыхательная недостаточность. Необходимо исключить описторхоз и стронгилоидоз, которые протекают с желтухой, болями в правом подреберье и срывами стула. Глазную форму токсокароза дифференцируют от ретинобластомы, проявляющейся лейкокорией, косоглазием, слезотечением, светобоязнью, вторичной глаукомой. Кожные проявления могут быть следствием укусов насекомых, воздействия аллергенов.
Лечение токсокароза
Показанием для стационарного лечения являются висцеральные формы болезни. Постельный режим назначается только при наличии лихорадки и рекомендуется до 2-4 дней устойчивого отсутствия высоких цифр температуры тела. Специальной диеты нет, однако, учитывая некоторые побочные эффекты применяемых препаратов, рекомендуется воздержаться от приема жирной, жареной пищи, алкоголя, специй, маринадов, сладостей. Важно соблюдение питьевого режима, исключение контакта с возможными пищевыми и бытовыми аллергенами. Недопустимо самовольное прекращение начатого медикаментозного лечения.
- Антигельминтная терапия. Высокоэффективными антигельминтными средствами для разрушения мигрирующих личинок считаются албендазол, мебендазол, диэтилкарбамазин, которые применяются в таблетированных формах. В отношении токсокар, находящихся в гранулемах, данные препараты не обладают выраженным нейтрализующим эффектом.
- Хирургические методы лечения применяются при глазном токсокарозе и включают в себя микрохирургическое удаление гранулем, лазерную коагуляцию для расщепления личинок в средах глаза и коррекции отслойки сетчатки.
- Симптоматическая терапия проводится по показаниям. Включает жаропонижающие (парацетамол, целекоксиб), дезинтоксикационные (хлосоль, глюкозо-солевые растворы), десенсибилизирующие (глюконат, хлорид кальция), антигистаминные (хлорапирамин, дезлоратадин), отхаркивающие (ацетилцистеин, мукалтин), ферментативные (панкреатин) и другие средства.
Прогноз и профилактика
Прогноз при неосложненных формах благоприятный, летальных случаев не описано. Длительность приема лекарственных средств может составлять до 3-4 недель и более, иногда требуются несколько курсов с перерывами в 2-4 месяца. Критериями эффективности считаются исчезновение клиники, снижение уровня антител и эозинофилии крови. Описаны случаи диссеминированного токсокароза среди ВИЧ-инфицированных лиц в стадии СПИДа, а также пациентов, длительно принимающих системные глюкокортикостероиды или проходящих лучевую терапию по поводу онкологических болезней.
Профилактические вакцины на основе ДНК показали положительный эффект в экспериментах на мышах, исследования в настоящее время продолжаются. Рекомендуется осуществлять контроль за популяцией бродячих животных, проводить выгул собак на специально отведенных территориях. Важными мерами неспецифической борьбы с заболеваемостью являются отучение детей от поедания земли, привитие навыков личной гигиены после игр на улице, песочнице, общения с животными; тщательное мытье ягод, зелени, овощей и фруктов перед едой; назначение антигельминтных препаратов беременным собакам, новорожденным щенкам.
2. Токсокароз. Клиника. Диагностика. Лечение. Профилактика. Информационно¬методическое пособие. – 2004.
4. Токсокароз у детей/ Глазунова Л.В., Артамонов Р.Г., Бекташянц Е.Г., Куйбышева Е.В., Шиц О.Л., Кирнус Н.И., Иванова Е.Ю. // Лечебное дело. – 2008.
Висцеральный лейшманиоз – это хроническое инфекционное протозойное заболевание с поражением печени и селезенки, развитием анемии и кахексии. Другими симптомами являются лихорадка, увеличение лимфоузлов, кожные проявления. Диагностика включает выявление возбудителя из крови и биоптатов внутренних органов, реже путем биопроб на грызунах, поиск антител к возбудителю. Лечение состоит из курса этиотропных препаратов (преимущественно пятивалентной сурьмы) и коррекции органных дисфункций в качестве симптоматической терапии. В некоторых случаях показаны гемотрансфузии.
МКБ-10
Общие сведения
Висцеральный лейшманиоз (лихорадка дум-дум, кала-азар, черная лихорадка) принадлежит к трансмиссивным инфекциям, вызываемым простейшими. В 1903 году английский патолог Лейшман совместно с итальянским ученым Донованом описал морфологию органных поражений и выделил возбудителя. В честь исследователей инфекционный агент получил своё название Leishmania donovani. Болезнь наиболее распространена в тропических и субтропических странах, сезонный рост заболеваемости зависит от особенностей жизненного цикла переносчика и приходится на период с мая по ноябрь.

Причины
Возбудитель инфекции – простейший паразитический микроорганизм лейшмания. Источниками и резервуарами инфекции служат теплокровные дикие и домашние животные (грызуны, ленивцы, лисы, собаки), люди. Путь инфицирования преимущественно трансмиссивный, переносчики – самки москитов рода Phlebotomus. Имеются данные о единичных случаях заражения при переливаниях крови, передачи лейшманий от матери плоду, при использовании нестерильного медицинского инструментария и игл во время внутривенного введения наркотических средств.
В своем развитии лейшманиям необходимо пройти две стадии: безжгутиковую и жгутиковую в организме человека либо животного и переносчика соответственно. Амастиготы обитают внутри клеток, лишены способности к перемещению, промастиготы имеют жгутики для активных движений в пространстве. Находясь внутри самки москита, лейшмании активно размножаются в пищеварительном канале насекомого, после чего перемещаются к хоботку. Наиболее подвержены заражению дети до 5 лет, молодые мужчины, сельскохозяйственные работники, туристы, пациенты с ВИЧ-инфекцией, онкопатологиями.
Патогенез
В месте укуса переносчика формируется первичный аффект в виде гранулемы, которая состоит из макрофагов с размножающимися внутри лейшманиями, ретикулоцитов, эпителиоцитов и гигантских клеток. Через некоторое время гранулема подвергается обратному развитию, реже рубцеванию, а находящиеся в макрофагах возбудители с током лимфы и крови попадают во внутренние органы. При нормальном состоянии иммунной системы происходит разрушение пораженных клеток. В случае иммунодефицита лейшмании размножаются с увеличенной скоростью, поражают паренхиматозные органы.
Это приводит к возникновению воспалительных изменений, активному фиброзированию и увеличению размеров органов. В печеночной ткани при патогистологическом исследовании обнаруживаются участки интерлобулярного фиброза и дистрофия гепатоцитов, в лимфатических узлах – дистрофические изменения зародышевого центра и аплазия костного мозга, в селезенке – атрофия пульпы, зоны инфарктов, некроза и геморрагических инфильтратов. При длительном течении висцерального лейшманиоза возникает амилоидоз внутренних органов.
Классификация
Разделение висцерального лейшманиоза на сельский и городской виды подразумевает разные источники инфекции (домашние и дикие животные), а также тяжесть течения патологии – считается, что при городском типе болезнь протекает доброкачественнее. Выделяют острый, подострый и хронический варианты органного лейшманиоза. Наиболее благоприятным течением отличается хроническая форма, острый тип данной протозойной инфекции чаще всего встречается у детей, характеризуется бурным развитием симптомов и нередкими летальными исходами. Для подострого варианта типично наличие осложнений.
Симптомы висцерального лейшманиоза
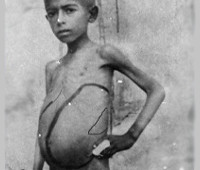
Инкубационный период составляет от 20 дней до 1 года, чаще 3-5 месяцев. Для манифестации болезни характерно постепенное начало, появление кожной папулы бледно-розового цвета на месте внедрения возбудителя, сменяющейся участком депигментации (лейшманоид). Отмечается слабость, беспричинная усталость, снижение аппетита, похудание. В дальнейшем присоединяется лихорадка до 39-40° C, которая протекает с чередованием высокой и нормальной температуры тела на продолжении нескольких месяцев.
Наблюдается безболезненное увеличение всех групп лимфатических узлов, изменение их консистенции до плотно-эластической. Пациенты с висцеральным лейшманиозом почти всегда отмечают тяжесть и дискомфорт в подреберьях. При прогрессировании болезни наблюдается гепатоспленомегалия с появлением отеков и увеличением живота. Снижается количество выделяемой мочи. В связи с развитием гиперспленизма и поражения костного мозга возникают кровотечения. Обнаруживается одышка, язвенно-некротические поражения ротовой полости, бледность кожи, нарушения дефекации.
Осложнения
Наиболее частые осложнения (тромбогеморрагический синдром, гранулоцитопения, агранулоцитоз) связаны с поражением кроветворной системы, следствием чего является некроз миндалин, слизистой рта и десен (нома). Отечно-асцитический синдром при висцеральном лейшманиозе возникает из-за вовлечения печени, сопровождается хронической сердечной недостаточностью, нарушениями в работе ЖКТ (энтероколитом), нефритом, снижением либидо, олиго- и аменореей. Характерны случаи бактериальной пневмонии ввиду высокого стояния диафрагмы и снижения дыхательной емкости легких. К редким осложнениям относят разрывы селезенки, геморрагический шок, ДВС-синдром.
Диагностика
Определение висцеральной формы лейшманиоза требует осмотра инфекциониста, по показаниям назначаются консультации других специалистов. Важно уточнить у пациента факт пребывания в эндемичных зонах земного шара в течение предшествующих пяти лет, наличие вакцинации от лейшманиоза, род профессиональных занятий. Лабораторные и инструментальные методы верификации болезни включают в себя:
- Физикальное исследование. Во время объективного осмотра обращает на себя внимание бледность, сухость, истончение кожи, наличие язв в полости рта. Лимфоузлы плотные, увеличенные, безболезненные. При аускультации тоны сердца приглушены, выслушивается тахикардия, шумы, в легких могут определяться участки ослабленного дыхания. Пальпация живота безболезненна, размеры селезенки и печени резко увеличены. Часто обнаруживаются периферические отеки, асцит.
- Лабораторные исследования. Признаками лейшманиоза в общем анализе крови служат анемия, пойкилоцитоз, анизоцитоз, лейкопения, нейтропения, анэозинофилия, тромбоцитопения, резкое ускорение СОЭ. Биохимические параметры изменены в сторону повышения АЛТ, АСТ, СРБ, креатинина и мочевины, гипоальбуминемии. Наблюдается увеличение времени свертывания крови. В общеклиническом анализе мочи отмечается повышение плотности мочевого осадка, протеинурия, гематурия.
- Выявление инфекционных агентов. Для обнаружения лейшманий проводится микроскопия, посев биологических препаратов и крови, реже биопробы на хомячках. Серологическая диагностика (ИФА) направлена на выявление противолейшманиозных антител. Использование внутрикожной пробы Монтенегро является косвенным методом подтверждения диагноза в период реконвалесценции, применяется при эпидемиологических исследованиях в популяции.
- Инструментальные методики. Рентгенография ОГК выполняется для исключения пневмонии, туберкулезного поражения. Сонография брюшной полости визуализирует увеличение размеров печени, селезенки, признаки портальной гипертензии, наличие асцита. УЗИ и биопсию лимфатических узлов, стернальную пункцию, трепанобиопсию костного мозга, диагностическую торакоскопию и лапароскопию осуществляют по показаниям.
Туберкулез проявляется длительным субфебрилитетом, редко сухим кашлем и симптомами дисфункции вовлеченных в патологический процесс органов; часто диагноз верифицируется только лабораторно-инструментальными методиками. Схожесть клинических симптомов заболевания наблюдается с такими патологиями, как лейкоз и лимфогранулематоз, при данных патологиях диагностическими критериями становятся данные анализов крови и биопсии костного мозга. Сепсис клинически протекает схоже, но обычно имеет первичный очаг поражения (рана, гнойное образование и др.).
Лечение висцерального лейшманиоза
Пациенты с данным заболеванием госпитализируются в стационар. В обязательном порядке необходимо ограничить возможность контакта с москитами, поэтому над кроватями и в оконных проемах устанавливают противомоскитные сетки. Постельный режим показан до устойчивых нормальных цифр температуры тела в течение 3-5 дней, из-за риска разрыва селезенки при её значительном увеличении не рекомендуются резкие наклоны, повороты, поднятие тяжестей более 10 кг. Режим питания предусматривает высококалорийную, богатую белками пищу, водная нагрузка подбирается индивидуально.
Этиотропная терапия висцерального лейшманиоза должна включать препараты сурьмы (натрия стибоглюконат) либо пентамидин, милтефозин, липосомальный амфотерицин В. Некоторые исследования показали эффективность терапевтического приема производных пятивалентной сурьмы в сочетании с сульфатом паромомицина, при этом сокращается длительность курса лечения. Пациентам с осложнениями, ВИЧ-инфекцией, тяжелыми сопутствующими болезнями рекомендовано курсовое введение амфотерицина В как первой линии лечения висцерального лейшманиоза.
Выраженная анемия является показанием для эритроцитарных гемотрансфузий, реже требуется введение тромбомассы и донорских лейкоцитов. Коррекция анемии заключается в длительном приеме препаратов железа, по показаниям – колониестимулирующих факторов. Симптоматическое лечение предполагает дезинтоксикацию, прием жаропонижающих средств (аспирин – с осторожностью), антибиотиков в случае присоединения вторичных инфекций. Важной составляющей лечения является борьба с отеками, в числе прочего в план терапии включаются мочегонные средства и растворы альбумина.
Прогноз и профилактика
Прогноз при ранней диагностике благоприятный за исключением случаев болезни у ВИЧ-инфицированных пациентов – у данной категории больных даже слабопатогенные штаммы лейшманий вызывают органные поражения. Продолжительность лечения составляет 14-30 дней, наблюдение за реконвалесцентами занимает 4-6 месяцев из-за возможных рецидивов лейшманиоза. У 17% пролеченных пациентов в течение 5 лет после выздоровления могут обнаруживаться симптомы посткала-азарного дермального лейшманиоза, протоколы диагностики и лечения для которого окончательно не разработаны.
Специфическая профилактика заключается в плановом введении живой вакцины, рекомендована лицам, проживающим или планирующим длительное либо кратковременное пребывание на эндемичных территориях, туристам. Введение препарата необходимо осуществлять зимой или осенью минимум за три месяца до поездки. Неспецифические меры предотвращения висцерального лейшманиоза включают своевременное выявление, изоляцию и лечение больных, использование противомоскитных сеток, вакцинацию собак, устранение свалок, меры дезинсекции и дератизации. Борьба с москитами заключается, в том числе, в осушении болот, подвалов и овощехранилищ.
4. A Treatment outcomes of visceral leishmaniasis in Ethiopia from 2001 to 2017: a systematic review and meta-analysis / Eyob Alemayehu Gebreyohannes, Akshaya Srikanth Bhagvathula, Tadesse Melaku Abegaz// Infect Dis Poverty – 2018 - №7.
Что такое тениоз? Причины возникновения, диагностику и методы лечения разберем в статье доктора Александрова Павла Андреевича, паразитолога со стажем в 14 лет.
Над статьей доктора Александрова Павла Андреевича работали литературный редактор Юлия Липовская , научный редактор Сергей Федосов и шеф-редактор Лада Родчанина

Определение болезни. Причины заболевания
Тениоз (Taeniosis) — паразитарное заболевание человека, вызываемое половозрелой стадией ленточного гельминта (свиного цепня), который проникает в организм человека при употреблении плохо приготовленного мяса, паразитирует в тонком кишечнике и вызывает расстройства пищеварения. В некоторых случаях может осложняться цистицеркозом — паразитированием в тканях организма личинок свиного цепня, что приводит к серьёзным последствиям и даже смерти.
Возбудитель
- домен — эукариоты;
- царство — животные;
- тип — плоские черви;
- класс — ленточные черви;
- отряд — циклофиллиды;
- семейство — тенииды;
- род — Taenia;
- вид — свиной цепень (Taenia solium).
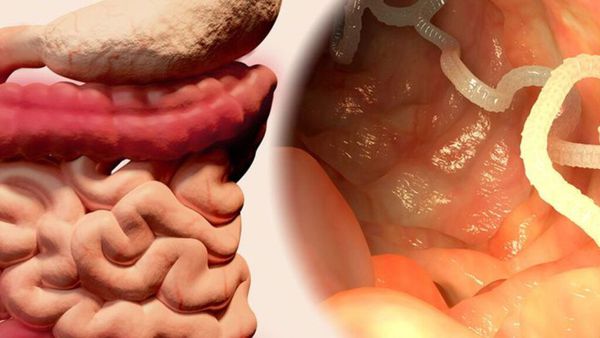
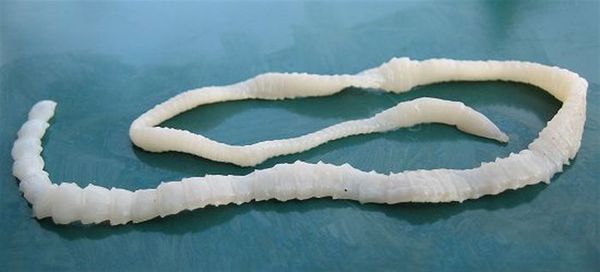
Свиной цепень (устаревшее название "cолитёр") — это плоский (ленточный) паразитический червь, длина которого в кишечнике человека достигает 3 метров, а по данным Ц ентра по контролю и профилактике заболеваний США (CDC) его длина может достигать 7 метров. Как правило, паразитирует только 1 червь. Паразит имеет головку, шейку и тело. Тело червя (стробила) состоит из члеников (п роглоттидов), их число может достигать 1000 . Головка (сколекс) размерами до 2 мм в диаметре имеет хоботок и 4 мышечные присоски (органы прикрепления), расположенные крестообразно. На хоботке есть крючья в количестве от 22 до 32, из-за этого есть второе название паразита — вооружённый цепень.
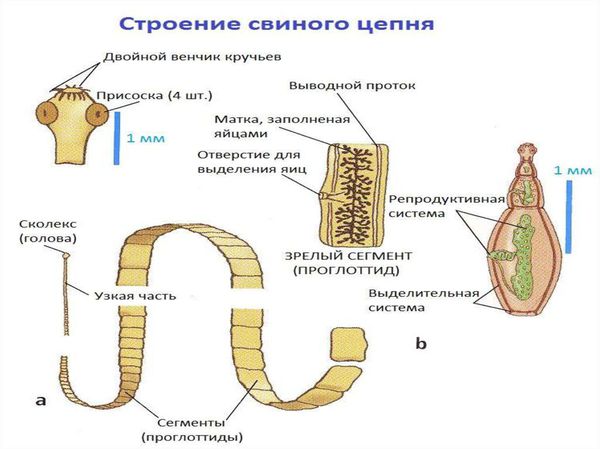
Яйца паразита попадают с калом человека в окружающую среду. Животные (свиньи, собаки, кошки и даже человек при несоблюдении гигиены) поедают яйца, зародыши проходят через кишечную стенку и разносятся кровью по всему организму, после чего оседают в тканях (в основном в соединительной ткани между мышцами). Через пару месяцев яйца превращаются в финны (цистицерки), которые живут до 5 лет, после чего они погибают и обызвествляются (накапливают минеральные вещества, соли кальция). Цистицерки имеют вид полупрозрачных беловатых пузырьков диаметром до 1,5 см, внутри видна мелкая сформированная головка.
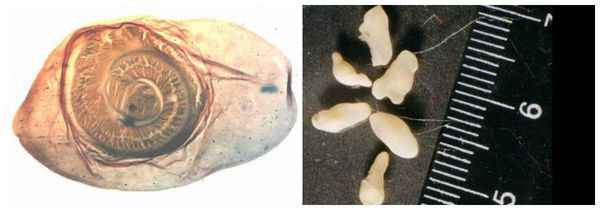
Для полноценного развития свиного цепня необходима смена хозяев за его жизнь. Человек является окончательным хозяином. В его кишечнике паразитирует взрослый гельминт, который развивается за 2 месяца из финны (личинки червя в тканях), съеденной с мясом. Паразит прикрепляется к стенке тонкого кишечника и растёт, поглощая пищу и постепенно наращивая членики (от шейки), которые по мере созревания отрываются и выходят в окружающую среду при дефекации. Паразит может жить в кишечнике десятки лет.
Человек может стать и промежуточным хозяином (при поедании яиц). В этом случае для паразита наступит "экологический тупик" — он не сможет развиться до половозрелой стадии и продолжить свой род, потому что мясо человека с финнами никто не ест.
Яйца выживают в окружающей среде в течение нескольких месяцев в зависимости от условий. Высыхание могут выдерживать в течение 10 месяцев, способны зимовать под снегом, в воде живут до 4 месяцев. При кипячении погибают практически мгновенно, при 65 °С сохраняют жизнеспособность в течение 3 минут, при 20-25 °С под воздействием прямых солнечных лучей сохраняются до 2 дней, если они закрыты травой — до полутора месяцев. Раствор хлорной извести 10-20 % убивает яйца за 5-6 часов. Цистицерки в мясе погибают при его замораживании при температуре -12 °С и поддержании в толще мяса температуры не ниже -10 °С в течение 10 дней [1] [2] [9] [10] .
Эпидемиология
Тениоз является одним из древнейших известных заболеваний. Первые упоминания встречаются ещё в 16 веке до нашей эры (Древний Египет), имеются записи Аристотеля и Гиппократа (финноз свиней). В настоящее время ВОЗ относит тениоз и цистицеркоз к группе забытых ("пренебрегаемых") болезней, т. е. тех, о которых мало говорят и обращают внимание развитые страны.
Распространение повсеместное, но наиболее поражены отдельные регионы: Индия, Африка, Южная Америка, Азия, Северный Китай, Восточная Европа, Белоруссия, Украина. Это регионы, где уровень дохода низкий или ниже среднего, где люди едят много плохо приготовленной свинины и недостаточно соблюдается гигиена. Здесь цистицеркоз является причиной эпилепсии в 30 % случаев, а в некоторых областях, где свиньи и люди живут вместе — до 70 %, по данным ВОЗ [3] . В РФ в среднем выявляется до 500 случаев в год [11] . Есть тенденция к повышенной заболеваемости сельских жителей и работников свиноводческих хозяйств.
Механизм передачи фекально-оральный, путь заражения пищевой. Источник инфекции и окончательный хозяин — заражённый человек, выделяющий с фекалиями яйца гельминта. Промежуточные хозяева — иногда человек, но чаще животные, которые поедают корм, загрязнённый фекалиями человека: свиньи (отсюда происходит название вида), кабаны, обезьяны, собаки, кошки.
Факторы передачи:
- При тениозе — недостаточно термически обработанное мясо свиней или диких кабанов. Наиболее опасно мясо, не прошедшее ветеринарный контроль. В этом случае человек заражается, поедая финны, т. е. зародыши червя, с инфицированным мясом.

- При цистицеркозе — загрязнённые яйцами пища и объекты внешней среды при несоблюдении людьми правил гигиены. Фактором передачи также может быть аутоинвазия, когда у человека с паразитом в кишечнике из-за нарушения перистальтики ЖКТ яйца из кишечника попадают в желудок. Т. е. яйца свиного цепня заразны и опасны для человека сразу, как только покидают организм с каловыми массами. Поэтому риск заражения цистицеркозом есть для любого человека, особенно если пренебрегать правилами гигиены и правилами обработки пищевых продуктов (тщательное мытьё) [1][3][5][7][11] .
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы тениоза
Множество случаев заражения и болезни проходит бессимптомно или малосимптомно. Жалобы таких больных обычно незначительны и связаны в основном с расстройствами пищеварения. Примерно через 1-1,5 месяца от момента заражения (а может и раньше) может наблюдаться лёгкое недомогание, головокружение, слабость, нарушения сна, умеренные головные боли, раздражительность, сниженный или повышенный аппетит, тошнота, дискомфорт и несильные боли в разных отделах живота. Развиваются запоры, чередующиеся с диареей, возможен анальный зуд, больной может умеренно худеть.
Характерной особенностью является периодическое (раз в несколько месяцев) выделение с калом оторвавшихся члеников паразита начиная с 2-3 месяцев паразитирования и так десятки лет. Их хорошо видно невооружённым глазом. Могут быть симптомы гипохромной анемии (недостатка железа): бледность кожи и слизистых, быстрая утомляемость при физической нагрузке, шум в ушах, обмороки, чувство мурашек по коже. Развивается гиповитаминоз В1 (тёмно-красный сухой язык со сглаженными сосочками). В результате отравления организма продуктами жизнедеятельности паразита, а также из-за расстройства пищеварения повышается склонность к необъяснимым высыпаниям токсико-аллергического характера на коже.
Тениоз у беременных
У беременных заболевание может протекать более тяжело, что обусловлено характерными физиологическими процессами в организме женщины этого периода. Наиболее часто наблюдаются расстройства пищеварения (запоры, диарея), тошнота, рвота, снижение гемоглобина, зуд кожи, перианальный зуд. Может быть плохой набор веса у плода. Вследствие более частого нарушения желудочно-кишечной перистальтики (моторики) повышается риск заброса яиц паразита в желудок и развития цистицеркоза [1] [4] [6] [10] .
Патогенез тениоза
Во время паразитирования свиной цепень повреждает слизистую при помощи крючьев и присосок, что вызывает расстройство пищеварения и нарушает моторику кишечника. Кроме того, гельминт потребляет много важных для человека питательных веществ, микроэлементов и отравляет организм продуктами своей жизнедеятельности, что приводит к токсико-аллергическому отравлению.
При заглатывании яиц паразита извне или при рефлюксной болезни, когда нарушается моторика кишечника и яйца из кишки попадают в желудок, развивается цистицеркоз. В различных органах и тканях развиваются соединительнотканные капсулы, содержащие зародыш — цистицерк. Вокруг наблюдаются воспалительные изменения в виде аллергической реакции и дистрофически-атрофические изменения из-за механического давления на окружающую ткань.
При локализации в головном мозге вокруг капсулы наблюдается воспаление мелких сосудов и инфильтрация окружающей ткани плазматическими клетками, что вызывает расстройство движения спинномозговой жидкости (ликвора), отёк мозговой ткани, развитие менингита и энцефалита. При паразитировании в оболочках мозга у его основания возможно развитие рацемозной (ветвистой) формы цистицеркоза до 25 см в длину.
С течением времени (до 5 лет) цистицерк претерпевает дегенеративные изменения — происходит его набухание и разложение (расплавление), что сопровождается усилением токсического и местного воспалительного воздействия. Исходом гибели личиночной формы паразита является кальцификация и местное рубцевание. Специфичных симптомов при этом процессе нет, после полной гибели цистицерков болезнь заканчивается, если, они не находятся в жизненно важных органах [1] [5] [6] [9] .
Классификация и стадии развития тениоза
По Международной классификации болезней 10-го пересмотра (МКБ 10):
- Тениоз:
- B68.0 Инвазия, вызванная Taenia solium.
- B68.9 Тениоз неуточнённый (при подозрении на болезнь, но отсутствии лабораторного подтверждения).
- Цистицеркоз:
- B69.0 Цистицеркоз центральной нервной системы (судороги, эпилепсия, необъяснимая рвота).
- B69.1 Цистицеркоз глаза (нарушения зрения, слепота).
- B69.8 Цистицеркоз других локализаций.
- B69.9 Цистицеркоз неуточнённый [1][2] .
Осложнения тениоза
Острый аппендицит. В правой половине живота снизу постепенно нарастают боли, появляется тошнота, характерен субфебрилитет (температура тела от 37,1 до 38,0 °С). В анализе крови наблюдается нейтрофильный лейкоцитоз со сдвигом влево — повышенный уровень нейтрофилов с преобладанием незрелых форм, которые не могут в полной мере осуществлять защитную функцию.
Панкреатит ( воспаление поджелудочной железы) . Характеризуется тошнотой, рвотой, опоясывающими болями в животе.
Кишечная непроходимость. Симптомы — с хваткообразные боли в животе без связи с приёмом пищи, запоры, метеоризм, вздутый живот, учащение пульса, рвота, бледность кожи.
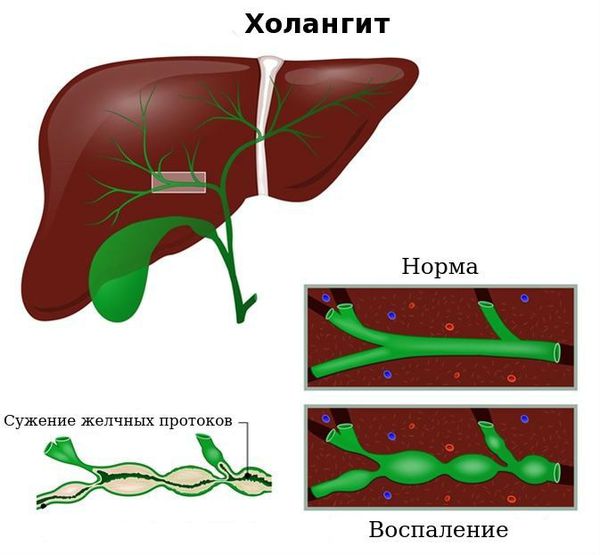
Холангит ( воспаление жёлчных протоков) . Субфебрильная или фебрильная лихорадка, выраженные боли в правом подреберье, озноб, повышенная потливость, тошнота и рвота, желтуха и кожный зуд.
Гипохромная анемия. Бледность кожи и слизистых оболочек, повышенная утомляемость, чувство мурашек и покалывания, головокружения, шум в ушах, обмороки.
Цистицеркоз. Может быть осложнением тениоза, а может быть отдельным заболеванием. В основном симптоматика проявляется при поражении центральной нервной системы (ЦНС) — головного и спинного мозга и глаз. В зависимости от локализации возникают головные боли различной интенсивности, рвота, эпилептические припадки, нарушения речи, расстройства личности, бред и галлюцинации, деменция. При поражении глаз могут наблюдаться воспалительно-дистрофические процессы в различных отделах глаз — рецидивирующие конъюнктивиты, увеиты, отслоение сетчатки, атрофия глазного яблока, что может привести к слепоте. При поражении сердца могут возникать нарушения ритма. При поражении мышц и подкожной клетчатки иногда может наблюдаться некоторая болезненность при ощупывании и приподнятость этого участка в виде подкожного плотного опухолевидного бугорка [1] [5] [5] [8] .
Диагностика тениоза
Тениоз или цистицеркоз может быть заподозрен на основании следующих признаков:
- эпиданамнез — проживание на территории развитого свиноводства, употребление плохо приготовленной свинины, низкий социально-экономический уровень страны или региона;
- расстройства пищеварения;
- астено-невротические проявления — слабость, повышенная утомляемость, эмоциональная нестабильность, раздражительность, повышенная потливость;
- выход с калом неподвижных члеников паразита;
- развитие неврологической симптоматики (эпилепсия), патологии органов зрения.
Дифференциальная диагностика
Основывается на данных анамнеза, типичном виде члеников паразита и их микроскопическом исследовании.
Лабораторная диагностика
Клинический анализ крови — изменений может не быть, иногда наблюдаются гипохромная анемия, умеренное повышение эозинофилов, повышение скорости оседания эритроцитов (СОЭ), редко выявляется небольшое повышение лейкоцитов за счёт сегментоядерных клеток (наиболее большой группы иммунных клеток).
Общий анализ мочи — как правило, без отклонений.
Биохимический анализ крови — возможны отклонения при развитии осложнений:
- При холангитах — повышение маркеров нарушения выработки или оттока желчи: АСТ, ГГТ, ЩФ, общего билирубина.
- При панкреатитах — повышение амилазы.
- При поражении сердца — повышение ЛГД и КФК-МВ.
Серологические специфические исследования:
- Иммуноферментный анализ (ИФА) антител IgG — в основном применяются с целью диагностики внекишечного поражения — цистицеркоза, результаты могут быть ложноположительными;
- Иммунный блоттинг — более точный метод лабораторного исследования сыворотки крови на присутствие антител , который применяют для подтверждения результатов ИФА. Этот метод позволяет снизить число ложных результатов, но в РФ он недоступен.
ПЦР кала — выявление антигенов свиного цепня. Это достаточно чувствительный метод, однако может дать ложноотрицательный результат ввиду ограниченного количества материала в кале.
Копроовоскопия — микроскопическое изучение кала с целью обнаружения яиц и зрелых члеников паразита. По яйцам невозможно установить точный диагноз, т. к. они очень похожи на яйца других представителей этого рода, проводится не менее трёх раз в разные дни. Для определения вида паразита необходимо исследование члеников.
Инструментальная диагностика
Компьютерная (КТ) и магнитно-резонансная томография (МРТ), ультразвуковое исследование (УЗИ), прямая офтальмоскопия — применяются для выявления цистицеркоза. КТ лучше выявляет кальцификаты цистицерков (особенно небольшие). МРТ больше подходит для обнаружения цистицерков в некоторых трудновизуализируемых местах мозга, также МРТ указывает на местные окружающие изменения (отёк) и возможную гибель паразита.
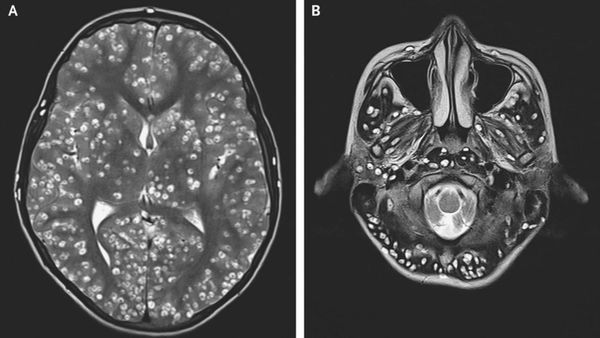
Исследования спинномозговой жидкости при поражении цистицерками ЦНС (лимфоцитарный плеоцитоз, увеличение уровня эозинофилов, белка).
Биопсия — морфологическое исследование биоптатов при оперативном вмешательстве [1] [3] [6] [10] .
Лечение тениоза
Госпитализации подлежат больные с тяжёлыми сопутствующими заболеваниями, а также больные с цистицеркозом ЦНС и глаз. Остальные больные могут лечиться амбулаторно.
В качестве этиотропной терапии (направленной на уничтожение возбудителя) применяется Празиквантел и Никлозамид. Есть данные об эффективности Альбеназола, но они ограничены. Продолжительность лечения — 3 дня.
При лечении цистицеркоза выбор способа уничтожения паразита зависит от его локализации и количества. При локализации под кожей и в тканях (кроме ЦНС и глаз) лечение, как правило, не проводят, так как риск последствий от приёма препарата выше пользы от лечения. Однако, если наличие паразита ведёт к каким-то физическим и эстетическим недостаткам, лечение назначается.
При локализации цистицерков в ЦНС и глазах лечение проводят только в условиях неврологического стационара, применяются Празиквантел и Альбендазол в сочетании с глюкокортикостероидами (т. к. есть риск местного воспаления и повреждения нервной системы и глаз).
В качестве мер патогенетической и симптоматической терапии при тениозе могут назначаться средства нормализации моторики кишечника (прокинетики) и микрофлоры кишечника (пре- и пробиотики).
При цистицеркозе головного мозга применяют противосудорожные препараты.
Возможно хирургическое лечение (удаление цистицерков при поражении головного и спинного мозга).
Контроль излеченности тениоза:
- визуальный — осмотры кала (о выздоровлении говорит отсутствие периодического отделения члеников червя);
- 4 отрицательных анализа кала на яйца гельминтов с интервалом в 1 месяц [2][4][5][8] .
Прогноз. Профилактика
При изолированном тениозе прогноз благоприятный. При развитии осложнений, особенно цистицеркозе ЦНС и глаз, прогноз серьёзный: возможно развитие тяжёлых стойких поражений (эпилепсия, слепота) и летальный исход.
Читайте также:

