Влияет ли циклоферон на анализ вич
Обновлено: 19.04.2024
Ключевые слова: индукторы интерферона, меглюмина акридонацетат, Циклоферон ® , схемы лечения, инфекционные заболевания
Keywords: inducers of interferon, meglumine acridonacetates Cycloferon ® , treatment regimens, infectious diseases
Резюме. Обзор содержит сведения о фармакологических свойствах меглюмина акридонацетата (Циклоферона) и его применении в клинической практике. Описаны различные по продолжительности схемы лечения, приводятся данные об эффективности меглюмина акридонацетата при тяжелых формах пневмоний, обусловленных инфицированием SARS-CoV и MERS-CoV (2002-2012), при различных моно- и смешанных острых респираторных инфекциях. Обобщены результаты экспериментальных исследований меглюмина акридонацетата. Положительные результаты получены при использовании этого препарата в терапии длительно текущих, тяжелых форм боррелиоза, смешанных герпетических инфекций, а также в лечении часто болеющих детей. Практика показала, что меглюмина акридонацетат может применяться в комплексной терапии в сочетании с антибактериальными, противовирусными препаратами.
Summary. This review contains information about Cycloferon ® and its use in clinical practice. The pharmacological properties of the drug, different in duration of treatment regimens, are presented. There are data on the use of Cycloferon ® in severe forms of pneumonia caused by SARS-CoV and MERS-CoV (2002-2012), in various mono- and mixed acute respiratory infections. The review contains experimental data on Cycloferon ® . Positive results of treatment were obtained for long-term, severe forms of tuberculosis, borreliosis, mixed herpetic infections, in often-ill children. Practice has shown that Cycloferon ® can be simultaneously used in complex therapy with antibacterial and antiviral drugs.
Введение
Среди современных отечественных препаратов для лечения и профилактики острых респираторных вирусных инфекций (ОРВИ) и других инфекционных заболеваний привлекают особое внимание индукторы эндогенного интерферона (ИИ). Повышенный интерес к интерферонам и ИИ объясняется универсально широким спектром антивирусной активности, которая не вызывает при этом формирования резистентных форм вирусов.
Исследователи разных стран сходятся во мнении, что инфекция COVID-19 может приводить к чрезмерной продукции провоспалительных цитокинов, которые нарушают регуляцию интерферонов I типа. Несбалансированный синтез интерферонов может способствовать развитию COVID-19 3. Поскольку в международном сообществе мнения по вопросу необходимости применения интерферона разделились, недавно был опубликован систематический обзор и метаанализ, целью которого стала оценка безопасности, переносимости интерферонов I типа при инфицировании человека новым коронавирусом и исходов такого заболевания. Метаанализ обобщил данные 1081 статьи, из которых заявленным критериям отбора соответствовали лишь 15. Авторы этой работы сделали вывод о том, что интерфероны могут быть адаптированы для лечения SARS-CoV-2 [5]. Изучение эффективных методов лечения разных коронавирусных инфекций, особенно тяжелых, позволяет заключить, что эффект от применения интерферона при COVID-19 положительный.
Семейство ИИ включает высокомолекулярные природные и синтетические соединения, выделенные отечественными исследователями. Ранее проведенные исследования в области экзогенных интерферонов были успешно продолжены изучением эндогенных интерферонов. Все известные ИИ (за исключением Амплигена) были разработаны отечественными учеными (см. таблицу).
Индукторы интерферонов, применяемые в медицинской практике [6]
| Химическая природа | Препарат (коммерческое название) |
| Синтетические соединения | |
| Низкомолекулярные: флуореноны, акриданоны | тилорон (Амиксин) меглюмина акридонацетат (Циклоферон ® ) оксодигидроакридинилацетат натрия (Неовир) |
| Полимеры (дсРНК) | Полудан |
| Природные соединения | |
| Полифенолы | Мегосин, Кагоцел, Гозалидон |
| Полимеры (дсРНК) | Ларифан, рибонуклеат натрия (Ридостин) |
Основными требованиями при создании пригодных для клинического использования ИИ были специфическая активность, низкая токсичность, отсутствие мутагенности, канцерогенности, эмбриотоксичности [6].
Данная группа препаратов широко используется при ОРВИ, гриппе, герпесвирусной инфекции, энцефалите, бешенстве, туберкулезе, вирусных гепатитах и др.
Главная особенность системы интерферона – способность быстро активироваться и мгновенно реагировать на чужеродные патогены (вирусы и бактерии). Именно от своевременности активации системы интерферона зависит исход заболевания. При патологических состояниях изменяется соотношение уровней циркулирующего и индуцированного интерферона, а также способность лейкоцитов периферической крови продуцировать интерфероны-α и -β (ранние интерфероны, обладающие противовирусной активностью) и интерферон-γ (поздний, иммунный интерферон).
Проведенное нами ранее исследование в группе часто болеющих детей продемонстрировало недостаточность выработки интерферона-α у 66% из них, а снижение гуморального иммунитета – у 34%, что требует как этиотропной терапии, так и применения ИИ [7].
Фармакологические свойства циклоферона
Акридонуксусная кислота (АУК) активна в отношении РНК- и ДНК-содержащих вирусов, что обусловлено индукцией эндогенного интерферона. В эксперименте на мышах соли АУК вызывали прямую индукцию 3 типов сывороточных интерферонов. Меглюминовая соль АУК в оптимальных дозах (2,0-3,5 мг на 1 мышь) опосредует индукцию интерферона I типа и его циркуляцию в крови в течение 46 ч после введения, III типа – в течение 36 ч, II типа – в течение 60 ч [9]. В эксперименте на мышах установлено, что пероральное введение меглюминовой или натриевой соли АУК вызывало прямую дозозависимую индукцию-продукцию сывороточных интерферонов 3 типов. Однако меглюминовая соль АУК вызывает индукцию интерферона I типа продолжительностью 46 ч, тогда как натриевая – продолжительностью 18 ч. Аналогичные данные о длительности описанного эффекта были получены при внутрижелудочном введении меглюминовой соли АУК и натриевой соли [10]. Опыт применения Циклоферона – более 20 лет.
Циклоферон ® выпускается в 2 формах:
- таблетки с дозировкой 150 мг (в упаковке 10, или 20, или 50 табл.);
- раствор для внутривенного и внутримышечного введения с дозировкой 125 мг/мл (в упаковке 5 ампул по 2 мл).
Циклоферон ® в таблетках, согласно инструкции, принимают внутрь 1 раз в сутки за 30 мин до еды, не разжевывая, запивая 1/2 стакана воды. Доза препарата зависит от возраста пациента:
- взрослым и детям старше 12 лет назначают по 450-600 мг (3-4 табл.) на прием;
- детям в возрасте 7-11 лет назначают по 300-450 мг (2-3 табл.) на прием;
- детям в возрасте 4-6 лет назначают по 150 мг (1 табл.) на прием.
Парентеральное введение у детей возможно с 4 лет по тем же схемам, что и применение таблетированной формы.
Повторный курс целесообразно проводить через 2-3 нед после окончания первого курса.
Циклоферон ® совместим и хорошо сочетается со всеми лекарственными препаратами, традиционно применяемыми при лечении вирусных инфекций (с интерферонами, химиотерапевтическими лекарственными средствами и др.). Он усиливает действие интерферонов и аналогов нуклеозидов, уменьшает побочные эффекты химиотерапии, интерферонотерапии. Это важное свойство Циклоферона используется для лечения различных острых и хронических заболеваний, в частности герпесвирусных.
Схемы лечения и профилактики
Н.К. Мазина и соавт. выполнили систематический обзор и метаанализ исследований клинической эффективности Циклоферона и сделали заключение о том, что его применение в качестве профилактического и лечебного средства при ОРВИ и гриппе у детей и взрослых более чем в 5 раз повышает шансы избежать заболевания или перенести его в более легкой форме [11].
Результаты лечения респираторных инфекций
Большинство публикаций описывают эффективность применения Циклоферона у детей и взрослых с вирусной респираторной инфекцией. Так, В.А. Терешин и соавт. назначили Циклоферон ® 108 детям в возрасте от 4 до 18 лет в период повышенной заболеваемости гриппом и ОРВИ (4-5 курсов по 10-дневной схеме). У детей, получавших Циклоферон ® с профилактической целью, отмечено снижение заболеваемости гриппом и ОРВИ в 5,44 раза, коэффициент защищенности составил 81,6%. При использовании Циклоферона в качестве лечебного средства в комплексной терапии авторы наблюдали более легкое течение заболевания, сокращение сроков клинической манифестации гриппа и респираторной вирусной инфекции, снижение частоты осложнений [12].
Х.М. Вахитова и соавт. поставили цель оценить динамику клинических симптомов ОРВИ у детей на фоне приема меглюмина акридонацетата, для чего амбулаторно обследовали 87 детей. В 1-ю группу вошли 48 детей, которые принимали Циклоферон ® , во 2-ю – 39 детей, в лечении которых использованы только симптоматические средства. Результаты этого исследования свидетельствуют о целесообразности включения Циклоферона в комплексное лечение ОРВИ у детей; отмечен высокий профиль его безопасности [13].
Как известно, инфекции у часто болеющих детей (или детей с рекуррентными заболеваниями) достаточно разнородны по этиологии и вызывают определенные сложности при подборе терапии. Л.А. Харитонова и соавт. сравнили 3 схемы лечения соответственно в 3 группах больных детей. Включение Циклоферона в схемы лечения респираторных инфекций у часто болеющих детей в сочетании с антибиотиками оказало иммуномодулирующее действие, выражавшееся в сбалансированной положительной динамике иммунных показателей [14]. В аналогичной работе этих же авторов оценена эффективность монотерапии Циклофероном у часто болеющих детей в сравнении с комбинированной терапией Деринатом и Циклофероном. Циклоферон ® был более эффективен, чем Деринат, который изменял процессы на уровне носо- и ротоглотки, но практически не влиял на разрешение пневмонии [15].
С.А. Кособуцкая, С.Н. Золотарева изучили клинико-иммунологические и микробиологические параметры у 38 часто болеющих детей с острыми респираторными заболеваниями и нарушениями функций кишечника (дисбиозом). Работа проводилась на базе детских садов г. Воронежа. Часто болеющие дети в возрасте 4-6 лет с 12-15 эпизодами ОРВИ в год в организованных коллективах одновременно получали Циклоферон ® в таблетках и пробиотический препарат Биовестин-лакто. Далее профилактическая эффективность комплекса препаратов оценивалась при диспансерном наблюдении через 3 мес после окончания курса лечения. Установлено, что комплекс Циклоферона и Биовестина-лакто стимулирует гуморальный и клеточный иммунный ответ, нормализуя состав субпопуляций CD8, иммунорегуляторный индекс, повышая содержание иммуноглобулина А, эффективно влияя на нарушенный микробиоценоз кишечника, что уменьшало частоту острых респираторных заболеваний и их осложнений соответственно в 2 и 1,5 раза по сравнению с контрольной группой [16].
Результаты лечения и профилактики пневмоний
Циклоферон ® в комплексной терапии пневмоний, вызванных вирусом гриппа, также дал явный положительный эффект. При этом не только улучшались клинические показатели, но и восстанавливался иммунный гомеостаз, усиливалась микроциркуляция, сокращались сроки госпитализации [8].
Крайне актуальные для современной медицинской повестки исследования были проведены в 20032005 гг. в Санкт-Петербурге: они были направлены на лечение тяжелого острого респираторного синдрома (severe acute respiratory syndrome, SARS), вызванного коронавирусом SARS-CoV. Использование Циклоферона в таблетках или внутривенное/внутримышечное его введение одновременно с 1,5%-ным инфузионным раствором Реамберина (300-400 мл) и ингибиторами протеазы, антибиотиками принесло положительные результаты. Известен опыт применения Циклоферона при гриппе, вызванном вирусами H5N1 и H7N9, которые за последние годы значительно изменили свои биологические свойства, приобрели способность непосредственно инфицировать людей, минуя промежуточного хозяина, и вызывать очень тяжелые клинические формы инфекций, большая часть которых заканчивается летальным исходом. Специальных вакцин против этих типов вируса гриппа не создано [8].
Результаты лечения кашля
Одной из важных проблем педиатрии считается лечение длительно кашляющих детей. Причины затяжного кашля могут быть как инфекционного характера, так и неинфекционного. Конечно, детям с данной проблемой необходимо углубленное обследование, которое требует микробиологических, серологических исследований, исключения гастроэзофагеального рефлюкса, хронических заболеваний лор-органов. В работе Е.В. Мелехиной и соавт. продемонстрировано, что длительный кашель в 62,8% случаев вызван сочетанием инфекционной и неинфекционной патологии. Из инфекционных агентов часто выявляется микоплазма (43,9%), герпесвирусы (42,2%), пневмоцисты (21,4%). Ввиду большой роли данных инфекций в развитии затяжного кашля у детей рекомендован Циклоферон ® [18].
Применение циклоферона при бронхиальной астме
Еще одна группа больных – это дети с аллергическими заболеваниями, которые проходили лечение Циклофероном в условиях детского санатория (в Витебской области). К.А. Афанасенко и соавт. разработали методику лечения детей с бронхиальной астмой, которая включала комбинированное применение ингаляционных глюкокортикостероидов, Циклоферона и аутосеротерапии. В результате такого лечения наблюдалось статистически значимое повышение содержания иммуноглобулина A. Включение Циклоферона в схему лечения и реабилитации детей с инфекционной бронхиальной астмой способствовало снижению тяжести эпизодов, частоты их рецидивов и достижению более длительной ремиссии [19].
Применение циклоферона при герпесвирусных инфекциях
Применение циклоферона при боррелиозе
Циклоферон ® успешно применялся в комплексной терапии клещевого боррелиоза: снижалась температура тела, быстро регрессировала эритема. Длительно сохранялась положительная динамика и после лечения [22]. Назначение стандартной эрадикационной терапии и Циклоферона больным хроническим эрозивным гастритом, ассоциированным с Helicobacterpylori и герпесвирусной инфекцией, снижало частоту обострений, обусловленных данным возбудителем [23].
Заключение
Результаты анализа научных данных подтверждают актуальность включения Циклоферона в схемы лечения и профилактики различных инфекционных заболеваний: ОРВИ, герпесвирусных инфекций, тяжелых форм пневмоний. Следует подчеркнуть, что ранее проведенные исследования применения Циклоферона в лечении пневмоний, вызванных вирусами SARS-CoV и MERS-CoV, а также вирусами гриппа H5N1 и H7N9, свидетельствуют о его эффективности. Этот опыт следует иметь в виду в период распространения новой коронавирусной инфекции COVID-19 и возможной циркуляции новых вирусов гриппа. Циклоферон ® применяется при моно- и микст-инфекциях, причем схемы лечения могут быть разными по продолжительности – короткими и более длинными. Возможно повторение курсов лечения в течение года. Кроме этого, препарат хорошо комбинируется с антибиотиками, антигерпетиками и другими препаратами.
Oдним из первых препаратов, использованных для лечения ВИЧ-инфекции, был азидотимидин (АЗТ). У нас он выпускался под названием тимозид, на Западе известен как ретровир, зидовудин (ЗДВ). Суточная доза определяется стадией инфекции и переносимостью препара
Oдним из первых препаратов, использованных для лечения ВИЧ-инфекции, был азидотимидин (АЗТ). У нас он выпускался под названием тимозид, на Западе известен как ретровир, зидовудин (ЗДВ). Суточная доза определяется стадией инфекции и переносимостью препарата. Препарат относится к ингибиторам обратной траскриптазы.
Препаратами второго поколения являются дидеоксииназин (ДДИ), дидеоксицитидин (ДДС). В настоящее время спектр препаратов этой группы значительно расширился (ставудин-ДДТ, хивид, фосфозид и другие).
Эта группа лекарственных средств (ЛС) имеет ряд существенных недостатков. Указанные ЛС не подавляют полностью репликацию вируса, который может быть выделен у большинства больных во время терапии.
Как показали исследования, к ЗДВ достаточно быстро развивается устойчивость, в особенности на поздних стадиях болезни с усиленной репликацией ВИЧ, когда, по-видимому, возникает резистентность и к другим аналогам нуклеозидов.
Обычный фактор, существенно ограничивающий применение ЛС этой группы, — их токсичность. Для ЗДВ характерно главным образом токсическое действие на костный мозг, тогда как ДДИ и ДДС обладают нейротоксическим действием. Кроме того, ДДИ может вызывать тяжелый острый геморрагический панкреатит.
Установлена тесная связь между клинической неэффективностью ЗДВ и резистентностью к нему in vitro.
Вторая группа препаратов, открытая сравнительно недавно и уже широко используемая, — это ингибиторы протеаз: индиновир (криксиван), инвираза (саквиновир), вирасепт (нельфиновир) и другие.
В настоящее время речь не идет уже о монотерапии антиретровирусными средствами, а только о ди-, три- и даже тетратерапии. Такие методики позволяют снижать концентрацию вируса до величин, не определяемых с помощью современных тест-систем (< 200 копий/1 мл).
Предпочтительность комбинированной терапии обосновывается следующими положениями (В. В. Покровский).
- Использование многих этиотропных агентов более эффективно подавляет жизнедеятельность вируса, воздействуя на различные болевые точки или синергически воздействуя на одну из них.
- Это позволяет снизить дозы препаратов, что уменьшает частоту и выраженность побочных эффектов.
- Различные лекарства имеют различную способность проникать в ткани (головной мозг и т. д.).
- Комбинация лекарств затрудняет формирование устойчивости, или она появляется позднее.
Все описанные выше подходы к терапии ВИЧ-инфекции предполагали непосредственное воздействие на репликацию вируса. Другая возможная методика лечения ВИЧ-инфекции состоит в усилении защитных сил макроорганизма. Некоторые варианты такого подхода в большинстве случаев неспецифические, изредка специфические и могут воздействовать на защитные свойства клетки-хозяина.
Интерфероны, как природные, так и рекомбинантные, имеют ряд недостатков: антигенность, необходимость многократного введения для поддержания достаточной концентрации в организме, большое количество побочных эффектов и т. д.
Этих недостатков лишены многие индукторы эндогенного интерферона, некоторые из них способны включаться в синтез ИФН в некоторых популяциях клеток, что в ряде случаев имеет определенное преимущество перед поликлональной стимуляцией иммуноцитов интерфероном.
Специфическая активность циклоферона при ВИЧ-инфекции изучена в 1997 году в Институте гриппа РАМН
- Выявлена выраженная ингибирующая активность циклоферона на репродукцию ВИЧ в культуре клеток моноцитов.
- По показателям ингибирующей активности циклоферон значительно превосходит азидотимидин.
- Представленные экспериментальные данные обосновывают клиническое использование циклоферона для лечения больных ВИЧ-инфекцией.
Пятилетний опыт применения циклоферона у ВИЧ-инфицированных позволяет оценить результаты этой работы.
В период 1992 – 1997 годы в Санкт-петербургском городском центре по профилактике и борьбе со СПИД циклоферон получили 40 пациентов с разными стадиями ВИЧ-инфекции. Следует отметить, что 11 больных прошли два курса терапии циклофероном, в связи с чем общее число лиц, получивших один курс лечения циклофероном, составило 29 человек. В основном это были молодые люди в возрасте до 40 лет (20 человек), в том числе трое детей до 14 лет.
Все больные отмечали хорошую переносимость циклоферона, отсутствие пирогенных реакций после его введения.
Пациенты также констатировали улучшение общего состояния, сна и аппетита, повышение жизненного тонуса, работоспособности. 30% из числа получавших препарат и перенесших в осенне-зимний период грипп или ОРВИ отметили, что заболевание протекало непривычно легко и выздоровление наступило быстрее обычного.
Из клинической практики
После курса циклоферона отмечалось существенное снижение вирусной нагрузки (в 3,6 раза). Число CD4+ возросло на 62%. Монотерапия циклофероном оказала положительное стабильное влияние на изученные показатели у пациентов.
Определенный интерес представляют результаты многолетнего наблюдения больных ВИЧ-инфекцией, которые получали длительно циклоферон в своеобразном профилактическом режиме с целью стабилизации процесса и профилактики прогрессирования заболеваний.
В 1998 году на базе Российского научно-методического Центра по профилактике и борьбе со СПИД (руководитель член-корр. АМН В. В. Покровский) была изучена динамика суррогатных маркеров ВИЧ-инфекций (уровень CD4+) и вирусная нагрузка у больных ВИЧ-инфекцией при лечении циклофероном.
Оценка достоверности полученных результатов проводилась с помощью непараметрических критериев (критерий знаков, максимум-критерий, критерий Вилкоксона для сопряженных совокупностей).
В испытуемую группу вошли 10 взрослых больных ВИЧ-инфекцией в стадии первичных проявлений по Российской классификации ВИЧ-инфекции (В. И. Покровский, 1989 г.). Результаты исследования уровня CD4-лимфоцитов представлены в таблице и на рисунке, из которых видно, что после первых четырех недель исследования наметилась тенденция к повышению среднего уровня CD4-лимфоцитов, которое к 12-й неделе стало статистически достоверным. Это повышение сохранилось до конца исследования, несмотря на
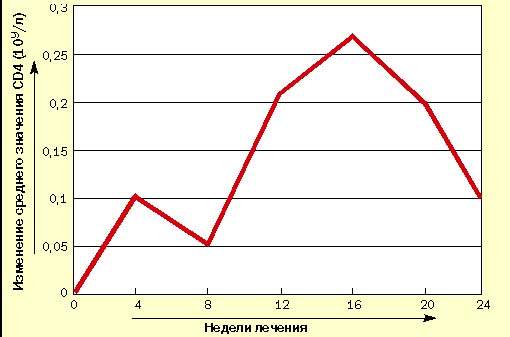 |
| Рисунок 1. Изменение уровня CD4-лимфоцитов у больных ВИЧ-инфекцией при лечении циклофероном (в сравнении с исходным уровнем) |
 |
| Рисунок 2. Средние значения изменения концентрации РНК ВИЧ (log10/мл) |
Таким образом, применение циклоферона в терапии ВИЧ-инфекций сопровождается стабилизацией клинических проявлений заболевания, улучшением состояния, а также гематологических и иммунологических показателей больных.
Циклоферон как монопрепарат оказывает иммуномодулирующее и противовирусное действие при лечении ВИЧ-инфицированных (стадии А1 3Б) в тех случаях, когда нет значительного снижения числа CD4+ клеток (<200). Хорошо зарекомендовало себя назначение циклоферона по следующей схеме.
- По 4 мл препарата в 1, 2, 4, 6, 8, 10, 13, 16, 19 и 22-й дни лечения (у детей по 2 мл). Первые две инъекции могут вводиться внутривенно, остальные внутримышечно. Повторные курсы циклоферона рекомендуется проводить через 6 месяцев под иммунологическим контролем.
- Циклоферон хорошо сочетается со всеми основными лекарственными средствами, его рекомендуется использовать в случае, когда имеются признаки активной репликации ВИЧ (высокие показатели вирусной нагрузки), у больных с обострениями различных оппортунистических заболеваний.
Исчезновение у некоторых больных иммунологических и вирусологических показаний для проведения противоретровирусной терапии может иметь важное значение для разработки новых подходов к проведению лечения больных ВИЧ-инфекцией, для снижения стоимости терапии и отсрочки развития резистентности к ней или преодолению последней.
Циклоферон может оказаться перспективным профилактическим средством при сомнительных контактах и контактах с заведомо ВИЧ-инфицированными партнерами.
Различные нарушения развития, дифференцировки иммунокомпетентных клеток, их функционирования, синтеза их продуктов или регуляции данных процессов ведут к нежелательным изменениям иммунологических функций. Эти нарушения могут оставаться бессимптомными или
Н. А. Дидковский, доктор медицинских наук, профессор
А. Л. Коваленко, кандидат химических наук
М. Г. Романцов, доктор медицинских наук, профессор
Различные нарушения развития, дифференцировки иммунокомпетентных клеток, их функционирования, синтеза их продуктов или регуляции данных процессов ведут к нежелательным изменениям иммунологических функций. Эти нарушения могут оставаться бессимптомными или проявляются клинически. По тяжести клинические проявления колеблются от мягких до фатальных. Такие нарушения могут касаться основных клеток иммунной системы Т- и В-лимфоцитов, фагоцитов, естественных киллеров и их продуктов: белков системы комплемента, иммуноглобулинов, цитокинов.
Наблюдающийся в настоящее время неуклонный рост числа хронических воспалительных заболеваний респираторного тракта на фоне вторичных иммунодефицитов (ВИД) является одной из важнейших проблем здравоохранения. Большая роль в развитии и хронизации вторично-иммунодефицит-ассоциированных заболеваний во многих случаях принадлежит реактивации вирусов, особенно тропных к клеткам иммунной системы. При том что вторичный иммунодефицит часто протекает с выраженными расстройствами интерферонового статуса, а общепринятые схемы иммунокорригирующей терапии обнаруживают невысокую эффективность, объектом все большего внимания становятся новые классы препаратов — индукторов эндогенного интерферона (ИФН).
Целью исследования явилась разработка методических подходов к применению циклоферона в лечении и иммунореабилитации больных с хроническими заболеваниями органов дыхания на фоне вторичного иммунодефицитного состояния.
Проведена оценка эффективности применения циклоферона у больных с хроническими воспалительными заболеваниями органов дыхания, протекающими на фоне вторичного иммунодефицитного состояния. Изучена динамика показателей иммунного ответа после однократного введения циклоферона (2 ампулы по 2 мл 12,5%-ного раствора).
Под наблюдением находилось 55 больных в возрасте от 36 до 46 лет, страдающих хроническим воспалительным процессом нижних отделов дыхательного тракта. У всех пациентов заболевание сопровождалось хламидийной инфекцией в респираторном тракте (подтверждено методом PCR в мазках из зева и клетках бронхиального смыва), инфицированием вирусом герпеса 2, 6 типа, HCV и HBV (шесть случаев).
Изменение показателей иммунного ответа после курсового введения циклоферона. На фоне курсового лечения циклофероном содержание CД3+, СД4+ и значение иммунорегуляторного индекса повысились, достигнув достоверных различий в сравнении с исходным уровнем (табл. 1).
После назначения циклоферона наиболее значимые изменения отмечались в содержании IgM, IgE и низкоавидных функционально неполноценных АТ. Исходно повышенный уровень IgM к концу курсового лечения постепенно снизился до нормального. К концу четвертой недели наблюдалось также достоверное снижение исходно повышенного уровня низкоавидных АТ. Зафиксированы колебания при исследовании в динамике среднего уровня IgE с увеличением его содержания в конце первой и третьей недели и снижением на второй и четвертой неделе. Наблюдалась тенденция к нормализации исходно сниженного содержания IgA, в то время как уровень IgG существенно не менялся (табл. 2).
Как было отмечено выше, при мониторинге значений Кхл (отражающего функциональную активность нейтрофилов) после введения одной дозы циклоферона произошло восстановление чувствительности нейтрофилов к стимулирующему действию иммунокорректоров. На фоне курсового лечения циклофероном через одну неделю Кхл при инкубации крови с тимогеном и дибазолом также существенно повысился (с 1,00±0,01 до 1,68±0,009 и с 1,30±0,06 до 1,48±0,04 соответственно). Степень активации клеток под действием тимогена уменьшалась. После второй недели терапии циклофероном она была выше, чем до начала терапии; ответ нейтрофилов на стимуляцию дибазолом увеличивался на второй неделе терапии, сохранялся повышенным на третьей неделе и возвращался к исходному после четвертой недели. Таким образом, восстановление чувствительности нейтрофилов периферической крови к стимуляции тимогеном и дибазолом происходит уже после введения одной дозы циклоферона и сохраняется в течение одной недели. На фоне курсового лечения чувствительность клеток к этим иммунокорректорам также выше, чем до лечения.
Таким образом, данные, полученные в результате мониторинга параметров иммунной системы у больных с хроническими заболеваниями органов дыхания на фоне вторичного иммунодефицитного состояния, свидетельствуют о том, что циклоферон обладает прямыми и опосредованными иммунотропными свойствами. Так, исследования функциональной активности нейтрофилов (ФАН) in vitro (через 30 и 60 минут, когда продукции ИФИ под действием ЦФ еще нет) подтвердили ее стимуляцию под влиянием ЦФ.
Курсовая терапия циклофероном приводит к переходу нейтрофилов от состояния гипореактивности по отношению к воздействию иммуностимуляторов к состоянию повышенной чувствительности, при этом клетки отвечают увеличением генерации активных форм кислорода не только на средние, но и на малые дозы препаратов, в частности, циклоферона. Данные о динамике показателей гуморального и клеточного звеньев иммунитета могут отражать как прямое, так и опосредованное действие на них циклоферона. Быстрое изменение (уже на вторые-третьи сутки) содержания иммуноглобулинов классов А и М нехарактерно для реакции на повышение уровня ИФН в крови, и, по-видимому, свидетельствует либо о непосредственном воздействии циклоферона на трансляционном уровне на биосинтез этих иммуноглобулинов В-клетками, либо об изменении (повышении) продукции отдельных цитокинов, которые в свою очередь стимулируют биосинтез названных иммуноглобулинов. Тот факт, что у пациентов с гипо-IgA-глобулинемией (снижение содержания IgA в три раза от среднестатистического показателя здоровых лиц и в два раза от нижней границы нормы), в отличие от лиц с неизмененным его уровнем, введение циклоферона не приводит к повышению продукции иммуноглобулина А, также может говорить в пользу влияния циклоферона на продукцию антител через систему цитокинов. Наличие периодов значительного подъема содержания иммуноглобулина Е (через 24—48 часов и через одну неделю после введения циклоферона) у лиц с исходно повышенным его уровнем, по-видимому, отражает изменение содержания цитокинов, стимулирующих продукцию иммуноглобулина Е (ИЛ-4, ИЛ-10).
На фоне курсового лечения циклофероном наиболее выраженные изменения соотношения субпопуляций лимфоцитов наблюдаются через одну-две недели после начала лечения. Через три-четыре недели рост относительного и абсолютного числа общих Т-лимфоцитов (СД3+) и Т-хелперов (СД4+) замедляется, однако их значения остаются в пределах нормы, а за счет достоверного снижения числа Т-супрессоров иммунорегуляторный индекс также сохраняется на оптимальном уровне, в то же время содержание В-лимфоцитов снижается.
Комбинированная антиретровирусная терапия разработана несколько лет назад в США и уже более года используется в России. Использование сочетаний ингибиторов обратной транскриптазы (АЗТ, фосфазид и т. д.) и ингибиторов протеаз (индинавир, невирапин и т.
Комбинированная антиретровирусная терапия разработана несколько лет назад в США и уже более года используется в России.
Использование сочетаний ингибиторов обратной транскриптазы (АЗТ, фосфазид и т. д.) и ингибиторов протеаз (индинавир, невирапин и т. д.) в ряде случаев позволяет при нормальном уровне СД4 добиться снижения вирусной нагрузки до уровня менее 200 копий в 1 мл плазмы.
Проводимый при лечении ингибиторами мониторинг СД4 и ВН (вирусной нагрузки) позволяет заключить, что комбинации препаратов необходимо достаточно часто менять из-за быстрой выработки резистентных штаммов. У данной комплексной терапии есть и ряд других отрицательных сторон: токсичность препаратов, высокая стоимость терапии — от 1000 долл. и выше. В настоящее время речь уже не идет о монотерапии, а только о ди-, а чаще тритерапии. Кроме того, сроки лечения ингибиторами удлинились до 5 и более лет.
Рост числа ВИЧ-инфицированных во всем мире, и в России в том числе, отсутствие достоверных сведений о возможности излечения с помощью существующих ныне методов, неизбежный летальный исход делают проблему терапии и разработку новых методов лечения ВИЧ-инфекции крайне актуальной. Среди возможных подходов к лечению ВИЧ-инфекции — усиление защитных сил макроорганизма. Одним из наиболее широко используемых с этой целью средств являются интерфероны (ИНФ). В последнее время все глубже изучаются механизмы противовирусной активности интерферонов, в том числе и при ВИЧ-инфекции [4, 5, 6, 7, 8].
Среди ИНФ-индуцируемых белков, обладающих противовирусной активностью, лучше всего изучены 2', 5'-олигоаденилатсинтетаза (ОАС), двухцепочная (дц) РНК-зависимая протеинкиназа и белок Мх. Протеинкиназа и ОАС обладают ферментативной активностью, однако до момента инфицирования клеток вирусами остаются в неактивном состоянии.
Протеинкиназа активируется дцРНК-зависимым автофосфорилированием. При этом протеинкиназа имеет две киназные активности: первая из них важна для автофосфорилирования, вторая — для субстратного фосфорилирования.
Белки Мх составляют семейство IFN-стимулируемых, антигенно родственных белков, детерминирующих селективную устойчивость клеток к ряду РНК-содержащих вирусов. Механизмы противовирусного действия белков Мх специфичны для разных систем вирус — хозяин. Доказано, что противовирусная активность и специфичность действия определенного белка Мх зависят от внутриклеточной локализации белка и стратегии размножения вирусов. Характерной особенностью белков Мх является то, что одни белки функционируют в ядре, а другие — в цитоплазме. В связи с этим чувствительны к действию определенного белка Мх вирусы, места внутриклеточного размножения которых совпадают с локализацией белка Мх.
В основе ингибирующего влияния белков Мх на вирусы лежит общий механизм, обусловленный взаимодействием белков Мх с компонентами РНК-полимеразного комплекса. Этот механизм для разных вирусов может, вероятно, действовать на разные этапы их внутриклеточного онтогенеза, вызывая либо ингибирование инициации транскрипции, либо преждевременную терминацию элонгации, либо нарушение транспорта вирусных белков из цитоплазмы в ядро.
Доказано, что в то время как другие вирусы производят нормальный интерферон, защищающий клетки от вирусной инфекции, ВИЧ способствует появлению ненормального интерферона, который помогает вирусу выжить.
В ходе лабораторных исследований острого и хронического ВИЧ-заболевания выявлено значительное антивирусное воздействие интерферонов a и b. К тому же интерферон a обладает значительным терапевтическим воздействием на ряд СПИД-индикаторных инфекций, в том числе cаркому Капоши. Натуральный ИФН a более эффективно подавляет воспроизводство ВИЧ 1, чем рекомбинантный a-интерферон [6].
Необходимо отметить, что, так как интерфероны включены в некоторые патогенетические аспекты ВИЧ-инфекции и СПИДа, они могут служить важными средствами в ограничении распространения вируса и прогрессирования заболевания; то есть борьба с одним из звеньев цепи репликации вируса может косвенно уничтожить ВИЧ и помочь в восстановлении иммунной системы [7].
Обычно длительное использование интерферонов, как природных, так и рекомбинантных, представляется проблематичным, так как они обладают антигенностью; необходимо их многократное введение в течение суток для поддержания достаточной концентрации в организме. Кроме того, ИФН дают большое количество побочных эффектов.
В этом плане хорошо себя зарекомендовали индукторы интерферона, обладающие не только иммунокорригирующим, но и антивирусным действием.
Использование их позволяет уменьшить лекарственную нагрузку и ее токсический эффект, а также преодолеть развитие резистентности.
Более чем пятилетний опыт работы с циклофероном на базе Санкт-Петербургского городского центра по профилактике и борьбе со СПИДом показал высокую эффективность препарата в поддержании иммунного статуса и профилактике СПИД-индикаторных инфекций при отсутствии побочного действия [2].
В 1998 году на базе Российского научно-методического центра по профилактике и борьбе со СПИДом была изучена динамика суррогатных маркеров ВИЧ-инфекции (уровень СД4 лимфоцитов) и вирусная нагрузка у ВИЧ-инфицированных лиц при лечении 12,5%-ным циклофероном. Полученные результаты свидетельствуют о достоверном росте уровня СД4 и снижении вирусной нагрузки на 0,5-1,5 log10, причем в ряде случаев (25%) до неопределяемых величин(
Вышеуказанное стало предпосылкой для проведения настоящего исследования, позволяющего изучить эффективность таблетированной формы циклоферона при длительном (6 месяцев) непрерывном использовании у ВИЧ-инфицированных лиц на разных стадиях заболевания с целью перспективной разработки моно- и комбинированной терапии, снижающей токсичность и резистентность традиционных методов лечения ВИЧ-инфекций [4].
Диагноз ВИЧ-инфекции ставился на основании клинико-эпидемиологических данных и подтверждается серологическими методами иммуноферментного анализа и иммунного блотинга. Стадия заболевания определялась согласно Российской классификации ВИЧ-инфекции (В. И. Покровский, 1989). Исходно в опытную и контрольную группы входили по 35 человек в каждую. Однако уже к моменту обследования больных во второй стандартной точке контрольная группа состояла из 31 человека. Состав опытной группы, до завершения исследования, не менялся.
Таблица 1. Группы исследуемых больных
| Стадия ВИЧ-инфекции | Исследуемая группа (чел.) | |
| Контрольная | Опытная | |
| 2Б + 2В | 14 | 17 |
| 3А + 3Б | 17 | 18 |
В связи с тем что стадии инфицирования 2Б и 3Б оказались представлены незначительным числом обследуемых, для дальнейшего анализа больные были объединены в подгруппы (табл. 1).
Исследование проводили двойным слепым методом с использованием плацебо.
Оценка эффективности проводимой терапии осуществлялась по клиническим и лабораторным критериям оценки прогрессирования ВИЧ-инфекции.
Клинико-лабораторное обследование больных проводили в трех стандартных точках:
1. Перед началом лечения.
2. Через три месяца после начала лечения.
3. Через шесть месяцев после начала лечения.
Количественное определение РНК ВИЧ в ПЦР проводили в первой и третьей стандартных точках. Включение в исследование разрешалось только после получения от больного письменного информированного согласия.
За шесть месяцев не отмечено ни одного случая перехода больных в следующую стадию как в опытной, так и в контрольной группе. Однако в опытной группе в 34% случаев отмечено уменьшение размеров лимфатических узлов, что может косвенно свидетельствовать об обратном развитии процесса. В контрольной группе такие явления отмечались в 9,6% случаев. Как в опытной, так и в контрольной группе отмечалось в 30% случаев уменьшение размеров печени и в 10% случаев — размеров селезенки. Исследование проводилось в осенне-зимний период (вспышка гриппа), что позволило отследить тяжесть перенесенных простудных заболеваний в опытной и контрольной группах. Существенной количественной разницы между заболевшими ОРВИ не отмечалось, однако длительность заболевания в опытной группе была на 25% меньше, а тяжесть токсических проявлений — значительно ниже.
В опытной группе за весь период исследования не отмечено появления новых СПИД-индикаторных инфекций, в то время как в контрольной группе в 16% случаев добавился диагноз оральный кандидоз и в 9,6% — Herpes simplex.
Показатели периферической крови не выявили достоверных различий между опытной и контрольной группами, однако в опытной группе наметилась тенденция к снижению абсолютности содержания нейтрофильных гранулоцитов.
Биохимические показатели периферической крови и анализ вирусспецифических белков и маркеров гепатита В и С также не выявили различий в опытной и контрольной группах. Динамика изменений иммунологических показателей в процессе лечения в опытной и контрольной группах достаточно показательна.
Таблица 2. Динамика средних значений количества СД4-Т-лимфоцитов для больных с исходным иммунодефицитом (количество СД4-Т-лимфоцитов до начала лечения менее 500 кл/мл)
| Периоды наблюдения | Количество CД4-Т-лимфоцитов (M±m) | |
| ОГ | КГ | |
| До начала лечения | 370,0±39,1 | 376,2±23,4 |
| Через 3 месяца | 505,0±130,3 | 366,3±50,9 |
| Через 6 месяцев | 609,0±58,7 | 368,3±53,8 |
Исследование функциональной активности лимфоцитов показало, что под влиянием циклоферона происходит достоверное повышение контрольных значений лимфакинпродуцирующей способности клеток (РТМЛ). Имеющий место в начале исследования компенсаторный энергетический дисбаланс (активностьЛДГ>СДГ) исчезает, и восстанавливается физиологическое соотношение циклов Кребса и трикарбоновых кислот.
Особенно показательной была динамика средних значений СД4-Т-лимфоцитов у больных с исходным иммунодефицитом (500 кл/мл) (см. табл. 2).
Характерными и прогнозируемыми с учетом анализа результатов использования ампульной формы циклоферона оказались показатели вирусной нагрузки при лечении ВИЧ-инфекции таблетированной формой циклоферона (табл. 3, 4).
Таблица 3. Параметры улучшения и увеличения ВН за 6 месяцев
| Параметры изменений ВН | Количество больных | p | 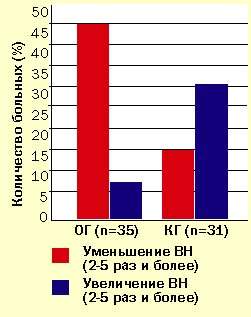 | |||
| ОГ (n=35) | КГ (n=31) | |||||
| абс. % | абс. % | |||||
| Уменьшени | ||||||
| до 2-х раз | 8 | 7 | p | |||
| в 2-5 раз | 7 | > 45.7 | 5 | > 16.1 | ||
| более 5 раз | 9 | - | ||||
| Увеличение | ||||||
| до 2-х раз | 4 | 8 | p | |||
| в 2-5 раз | 2 | > 8.6 | 7 | > 32.3 | ||
| более 5 раз | 1 | 3 | ||||
| Уменьшение до следовых значений ( | 5 | 0 | ||||
Таблица 4. Сопоставление показателей ВН до начала лечения и через 6 месяцев
| Показатели ВН (коий/мл) | Количество больных | |||||||
| ОГ (n=35) | КГ (n=31) | |||||||
| До лечения | Через 6 месяцев | До лечения | Через 6 месяцев | |||||
| абс. | % | абс. | % | абс. | % | абс. | % | |
| до 10000 | 10 | 28.6 | 18 | 51.4 | 15 | 48.4 | 14 | 45.2 |
| 10000 — 30000 | 13 | 37.1 | 9 | 25.7 | 5 | 16.1 | 5 | 16.1 |
| 30000 — 100000 | 5 | 14.3 | 5 | 14.3 | 5 | 19.4 | 3 | 9.7 |
| Более 100000 | 7 | 20.0 | 3 | 8.6 | 6 | 16.1 | 9 | 29.0 |
| Примечание: р | ||||||||
Отмечено значительное (более 70%) снижение концентрации РНК ВИЧ в опытной группе в стадии 2Б + 2В. Одновременно с этим нарастает и доля больных с низким, вплоть до неопределяемого уровня РНК. Аналогичная тенденция наблюдается в данной группе и на стадии инфицирования 3А + 3Б. Однако в данном случае снижение вирусной нагрузки составляет всего лишь 31,1%.
Литература
1. Романцов М. Г., Ершов Ф. И., Коваленко А. Л., Голубев С. Ю. Иммунодефицитные состояния: коррекция циклофероном. 1988. 80 с.
2. Ершов Ф. И., Коваленко А. Л., Аспель Ю. В., Романцов М. Г. Циклоферон в терапии вирусных гепатитов и ВИЧ-инфекций. 1999. 40 с.
3. Ершов Ф. И., Романцов М. Г., Коваленко А. Л., Исаков В. А., Аспель Ю. В. Циклоферон 12,5%-ный для инъекций: итоги и перспективы клинического применения. 1999, 80 с.
4. Отчет о клинико-иммунологической эффективности циклоферона (таблетированная форма) в терапии ВИЧ-инфекции СПб, гор. центр СПИД, ВМА им. С. М. Кирова, ин-т им. Пастера. 1999. 60 с.
5. Бажан С. И., Белова О. Е. Молекулярно-генетические аспекты индукции и противовирусного действия интерферона. 1998. 10 с.
6. Ямомото Дж. К., Крузель М. Л., Луи Х., Георгий Адис Дж. А. Ингибиция вируса иммунодефицита человека 1-го типа интерферонами человека альфа, бета и гамма. США, 1993.
7. Поли Г., Бисвас П., Фоки А. С. Интерфероны в патогенезе и лечении вируса иммунодефицита человека (обзор литературы). Италия, 1994.
8. Амбрус Дж. Л., Амбрус-мл. Дж. Л., Чадха С., Новик С., Рубинштейн М., Гопалакришнан Б., Бернштейн З., Приоре Р. Л., Чадха К. С. Механизмы ингибиторного действия интерферона в крови больных СПИДом и у больных красной волчанкой с васкулитом. США, 1997.
Влияние ВИЧ на течение туберкулеза многопланово: с одной стороны -это снижение иммунитета, сопровождающегося увеличением числа случаев повторного заражения и развития заболевания, зачастую приводящего к смерти. С другой стороны - туберкулез у больных ВИЧ/СПИДом может выступать в качестве оппортунистической инфекции, знаменуя собой терминальную стадию основного заболевания, в данном случае туберкулез гак же является основной причиной смерти больных ВИЧ/СПИДом. Так как с момента регистрации первых случаев ВИЧ-инфекции в России прошло более 20 лет, то число больных, имеющих туберкулез в качестве оппортунистической инфекции, неуклонно растет. Увеличивается также и число больных ВИЧ/СПИДом и туберкулезом, нуждающихся в назначении ВААРТ. Следовательно, появился новый аспект в лечения больных ТВ и СПИДом, связанный с необходимостью одновременного назначения антиретро-вирусных и противотуберкулезных препаратов. Сегодня в качестве антиретровирусных препаратов используются в основном средства зарубежного производства, отличающиеся высокой стоимостью и поэтому не всегда доступны для практического применения. В этой связи, актуальным является разработка и клиническое изучение недорогих и, в то же время, высокоэффективных отечественных препаратов для лечения как ВИЧ-инфицированных, так и больных СПИДом. Среди таких препаратов обращает на себя внимание индуктор интерферона - препарат Циклоферон. Исследованиями отечественных ученых показана эффективность применения Циклоферона при ВИЧ-инфекции, вирусном гепатите В и С (Содогуб Т.В., Романцов М.Г. и соавт., 2006; Исаков В.А., Аспель Ю.В., Богоявленский Г.В., и соавт., 1997). Эффективность циклоферона у больных туберкулезом и ВИЧ-инфекцией до настоящего времени не изучалась. Не изучалась также целесообразность использования препарата Ингарон в комплексной терапии больных ВИЧ/СПИД-инфекцией в сочетании с туберкулезом легких.
Целью работы явилось изучение эффективности применения препарата Ингарон® и Циклоферон в комплексном лечении больных ВИЧ-инфекцией в сочетании с туберкулезом легких.
Материал и методы исследования. Всего было обследовано 102 больных ВИЧ-инфекцией и туберкулезом. Исследование проведено на базе 5 отделения городской туберкулезной больницы № 2 Санкт-Петербурга в период с 2004 по 2005 гг. Первую группу (I ГР.) наблюдения составил 51 пациент, получивший на фоне адекватной химиотерапии (ХТ) индуктор интерферона Циклоферон в дозе 600 мг однократно, через день в течение 8 недель. Вторую группу (II ГР.) составили 16 пациентов, которые получили адекватную ХТ и интераль + Ингарон® через день (Интераль по 3 млн МЕ и Ингароном по 500 тыс. МЕ) в течение 8 недель. 35 ВИЧ-инфицированных больных, страдающих туберкулезом — группа сравнения (ГС), получали стандартную ХТ.
Пациенты всех групп обследованы по общепринятой методике. Кроме того, всем больным произведены углубленные иммунологические исследования крови с определением относительного и абсолютного содержания СDЗ+, СD4+ и СD8+ Т-лимфоцитов на проточном цитометре FACSCAUBUR фирмы BECTON DICKINSON.
Наряду с клиническими показателями, эффективность комплексного лечения оценивали и по гематологическим данным. Наиболее выраженные отличия между группами обнаружены в динамике показателей уровня гемоглобина. Исходно средний уровень гемоглобина оставался в пределах нормы у пациентов I ГР и ГС (соответственно 125,0 ±5,9 г/л и 125,4 ± 6,7 г/л), наименьшее его значение наблюдалось в II ГР. (117,8 ± 8,0 г/л). К концу 4-ой недели ХТ содержание гемоглобина в ГС снизилось до 120,7 ± 6,0 г/л (р = 0,05), в то время как в II-ой гр. его уровень повысился до 121,6 ± 8,5 г/л. К концу 8 недели ХТ содержание гемоглобина во всех группах было в пределах нормы, вместе с тем, самые высокие цифры были характерны для I ГР. (132,1 ± 4,6 г/л), а ГС характеризовалась наименьшим средним значением гемоглобина (122,9 ± 6,7 г/л), в сравнении с I ГР. (р < 0,05) (рис. 1). Таким образом, наименьшие компенсаторные возможности системы кроветворения определялись у пациентов ГС, по сравнению с обследуемыми I ГР и II ГР.
При изучении других гематологических показателей установлено, что уровень СОЭ превышал нормальные значения у всех наблюдаемых больных. Наиболее выраженные изменения были в I ГР и II ГР на протяжении всего курса ХТ, исходно более низкие показатели СОЭ отмечались во II ГР (рис. 2). К концу 8 недели ХТ в II ГР (22,3 ± 6,0 мм/ч) значение СОЭ также было достоверно выше, чем в I ГР (18,0 ± 3,3 мм/ч), (р < 0,05). Таким образом, СОЭ, как неспецифический тест, указывающий на активно протекающий воспалительный процесс, в динамике была наиболее высокой у больных ГС, в отличие от пациентов I ГР и II ГР.
Прекращение бактериовыделения у больных I ГР. происходило опережающими темпами по сравнению с ГС. Так, к концу 4-ой недели лечения бактериовыделение прекратилось у 50,0% больных I гр., у 58,3% больных II ГР и только у 14,6% больных ГС. Подобное соотношение сохранилось и к концу курса терапии (90,0% в I ГР, 83,3% в II ГР. и 52,3%) в ГС).
Таким образом, применение Циклоферона и Ингарона® при лечении туберкулеза у ВИЧ-инфицированных позволяет в более короткие сроки и в большем проценте случаев прекратить бактериовыделение.
Оценивая динамику инволюции инфильтратов в легких у больных I ГР., II ГР и ГС мы установили, что во всех группах наиболее выраженная регрессия наблюдалась у больных с крупными инфильтратами. В то же время полости распада перестали определяться у 20,4% больных I ГР, у 25% больных II ГР, и только у 11,8% больных ГС. Таким образом, препараты Циклоферон и Ингарон оказывают позитивное влияние и на репаративные процессы, ускоряя процессы морфологического выздоровления.
Наибольший интерес представляли данные о характере влияния препаратов на состояние иммунологической реактивности организма. Так, средний уровень абсолютного содержания С04-лимфоцитов у пациентов 1ГР составил 421,6 ± 72,6 кл/мкл, II-ой ГР- 322,1 ±122,1 кл/мкл и 446,3 ± 98,0 кл/мкл в ГС (норма 570-1 100 кл/мкл). К концу 8 недели показатель СD4 возрос до 441,0 ± 51,7 кл/мкл в I ГР (р>0,05), в II ГР - до 331,1 ± 127,9 кл/мкл (р > 0,05), а в ГС снизился до 392,4 ± 126,4 кл/мкл. (р < 0,05). В динамике, на фоне терапии, отмечалось нарастание абсолютного содержания СD4-клеток в I ГР на 5,0% и в II ГР-на 2,3%.
С целью определения показания к назначению циклоферона и препаратов интерферонового ряда (Интераль и Ингарон®) у больных туберкулезом и ВИЧ/СПИДом в процессе лечения изучено влияние этих препаратов у 67 пациентов туберкулезом и ВИЧ/СПИДом. Больные были разделены на 2 группы: 51 пациент получил циклоферон (I группа) и 16 пациентов получили интераль (а-ИФН) и Ингарон® (у-ИФН) - (II группа) совместно с противотуберкулезными препаратами.
Среди пациентов I группы 27 больных имели стартовое значение СD4-лимфоцитов больше 350 кл/мкл.— 1 ПГ, 24 больных имели стартовое значение С04-лимфоцитов меньше 350 кл/мкл.- 2 ПГ. Пациенты обеих подгрупп не отличались по полу, возрасту и наличию сопутствующих заболеваний. Препарат циклоферон назначался рег os в дозе 600 мг через день.
На фоне лечения пациенты отмечали улучшение самочувствия и повышения общего уровня качества жизни. Опережающие темпы были отмечены у пациентов 1-ой подгруппе (1 ПГ) 11Г по четырем из пяти симптомов интоксикации (слабость, потливость, повышенная температура, нарушение аппетита).
Наиболее выраженное различие было получено при изучении иммуннологическпх показа¬телей. Так, у больных с исходным количеством СD4+- больше 350 кл/мкл. (1ПГ) к концу 8 недоли терапии (окончание курса циклоферо-
на) наблюдали повышение СD4 на 1 1,0%) - с 656,2 + 41,3 кл/мкл до 728,4 + 74,7 кл/мкл, а у больных с исходным количеством СD4 - мень¬ше 350 кл/мкл., у больных 1 1-ой подгруппы (2Г1Г) не только не наблюдался прирост Т-лимфоцитов с рецепторами СD4, а отмечалось их снижение на 17,9% (с 187,1 + 43,1 кл/мкл до 153,6 + 27,0 кл/мкл). Такая же тенденция на¬блюдалась и в отношении относительного и аб¬солютного содержания СDЗ+ и СD8+ лимфоци¬тов. В 1-ой подгруппе отмечалось их повышение, а во второй-снижение. (табл. 1).
Среди пациентов II группы (7 больных), получивших Интераль и Ингарон®, имели стартовое значение С04-лимфоцитов больше 350 кл/мкл.-1 ПГ2, 9 больных имели С04-лим-фоцитов менее 350 кл/мкл.- 2ПГ2. На фоне лече¬ния пациенты отмечали улучшение самочувствия и повышения общего уровня качества жизни. Опережающие темпы были отмечены у пациентов 1ИГ2 по четырем из пяти симптомов интоксикации (слабость, потливость, повышенная температура, нарушение аппетита). Наиболее выраженное различие было получено при изучении иммуннологических показателей. У пациентов с исходным количеством СD4+ более 350 кл/мкл. (1ПГ2) к концу 8 недели терапии (окончание курса иытераля и ингарона) наблюдали повышение СD4 клеток на 19,5% (соответственно 556,7 ± 120,0 кл/мкл и 665,5 ± 106,6 кл/мкл), а у больных с исходным количеством СD4+ менее 350 кл/мкл. (2ПГ, не только Fie наблюдалось увеличение содержания Т лимфоцитов с рецепторами СD4, а отмечалось их снижение на 9,0% (соответственно 157,4 ± 66,0 кл/мкл и 143,6 ± 78,5 кл/мкл) (табл. 2).
Таким образом, можно заключить, что у больных с уровнем СD4+ ниже 350 кл/мкл. не показана иммуннокорригирующая терапия циклофероном и препаратами интерферонового ряда (интералем и ингароном). Назначение этих препаратов в данную стадию заболевания не только не способствует повышению CD4+ клеток, но и приводит к снижению этого класса Т-лимфоцитов, что свидетельствует об ухудшении патологического процесса и переходе больного в более тяжелую стадию болезни. Назначение этих препаратов у больных с уровнем СD4+ выше 350 кл/мкл, напротив, повышает их количественного содержания и препятствует переходу ВИЧ-инфекции в стадию СПИДа.
Читайте также:

