Влияние железа на вич
Обновлено: 18.04.2024
В статье собраны и проанализированы имеющиеся сведения о патогенезе, особенностях диагностики и течения острого панкреатита у ВИЧ-инфицированных пациентов на основе зарубежных наиболее цитируемых научных работ за последние годы.
Пациенты с ВИЧ/СПИДом могут быть подвержены широкому спектру факторов развития ОП, таких как условно-патогенные инфекции, новообразования и метаболические изменения вследствие применения антиретровирусных препаратов. С введением комбинированных антиретровирусных препаратов проявились новые метаболические нарушения, такие как стеатоз печени и лактоацидоз, так же оказывающие токсическое влияние на поджелудочную железу.
Анализ произведен по признакам отличия от популяции без ВИЧ-инфекции, наличия ВААРТ, лабораторным и морфологическим особенностям, коморбидности по вирусным гепатитам, степени иммуносупрессии и гендерному признаку. Проведено сравнение течения панкреатита у пациентов с ВИЧ и в общей популяции.
В результате сформированы наиболее актуальные для изучения вопросы по данной тематике.
Ключевые слова: ВИЧ, панкреатит.
ACUTE PANCREATITIS IN HIV-INFECTED PATIENTS: THE CURRENT DEVELOPMENTS
Petri S.I. 1, *, Darvin V.V. 2
1 ORCID: 0000-0002-8509-6691;
2 ORCID: 0000-0002-1121-9636;
1, 2 Surgut State University, Department of Surgical Diseases, Surgut, Russia
Abstract
The current article collects and analyzes the available data about the pathogenesis, features of the diagnosis and course of acute pancreatitis in HIV-infected patients on the basis of the most cited foreign research works in recent years.
Patients with HIV / AIDS may be exposed to a wide range of acute pancreatitis development factors, such as opportunistic infections, neoplasms, and metabolic changes due to the use of antiretroviral drugs. With the introduction of combined antiretroviral drugs, new metabolic disorders, such as hepatic steatosis and lactic acidosis, also have a toxic effect on the pancreas.
The analysis was performed based on the signs of differences from the population without HIV infection, the presence of HAART, laboratory and morphological characteristics, comorbidity for viral hepatitis, the degree of immunosuppression, as well as gender differences. The course of pancreatitis in patients with HIV and in the general population was also compared.
As a result, the study forms the most relevant research issues on this topic.
Keywords: HIV, pancreatitis.
Введение
Инфекция вируса иммунодефицита человека (ВИЧ) и синдром приобретенного иммунодефицита (СПИД) являются проблемами общественного здравоохранения во всем мире. Внедрение комбинированного антиретровирусного лечения, известного под аббревиатурой ВААРТ – высокоактивная антиретровирусная терапия, для лечения ВИЧ/СПИДа, позволило добиться ремиссии вируса ВИЧ-1 в течение длительных периодов времени, улучшая качество жизни этих людей и способствуя снижение числа осложнений и смертей, связанных с вирусом ВИЧ.
По данным UNAIDS [31] в 2019 году в мире количество людей, инфицированных ВИЧ-инфекцией, составило 38 (31,6–44,5) миллионов человек, 26 (25,1–26,2) миллионов человек проходили лечение антиретровирусными схемами терапии. Количество новых случаев инфицирования ВИЧ достигло 1,7 (1,2-2,2) миллионов человек за 2019 год. В 2019 году количество пациентов, умерших от сопутствующих СПИДу заболеваний составило 690 000 (500 000–970 000) человек. Для наглядности приведем показатели 2004 года, составлявшие 1,7 (1,2–2,4) миллионов человек и 1,1 (830 000– 1,6) миллионов человек в 2010 году.
В настоящее время Россия – единственная страна в мире, использующая принцип широкого охвата населения обследованием на ВИЧ и индивидуальный (полицевой) учет всех пациентов [1].
Несмотря на все плюсы антиретровирусной терапии, длительное лечение АРВТ-препаратами вызывает выраженные токсические эффекты. Частота острого панкреатита (ОП) может достигать в отдельных регионах 40% от числа ВИЧ-положительных пациентов, что значительно выше, чем среди населения в целом, заболеваемость которого составляет 2% [24].
Поражение поджелудочной железы у пациентов в стадии СПИД было обычным явлением в посмертных исследованиях в период до ВААРТ, так как вирус иммунодефицита человека напрямую разрушительно воздействует на поджелудочную железу. Chehter et al.[8] обнаружили атрофию ацинарных клеток в 60% образцов из 109 посмертных поджелудочных желез, в дополнение к уменьшению гранул зимогена (52%) и изменений ядра (64%).
Кроме того, Cappell и Marks [3] показали, что лишь 25% ВИЧ-серопозитивных пациентов, подвергшихся УЗИ брюшной полости, и лишь 33% из тех, кто был подвергнут КТ-сканированию, имели патологию поджелудочной железы, включая очаговые или диффузные увеличения, расширение Вирсунгова протока, формирование псевдокист и абсцессов.
В эпоху до ВААРТ пентамидин и диданозин четко коррелировали с увеличением частоты ОП, что объяснялось длительным лечением высокими дозами антиретровирусных препаратов и тяжелой иммуносупрессией [21].
Пациенты с ВИЧ/СПИДом подвержены широкому спектру факторов развития ОП, таких как условно патогенные инфекции, злокачественные и доброкачественные новообразования, а также дисметаболические явления вследствие применения антиретровирусных препаратов. С введением комбинированных схем лечения стали проявляться новые метаболические нарушения, такие как стеатоз печени и лактоацидоз, также оказывающие токсическое влияние на поджелудочную железу [25], [26].
Цель настоящей работы – обобщить имеющиеся сведения о патогенезе, особенностях диагностики и течения острого панкреатита у ВИЧ-инфицированных пациентов.
Основная часть
Сравнение течения панкреатита у пациентов с ВИЧ и в общей популяции
В популяции ВИЧ-инфицированных пациентов заболеваемость острым панкреатитом достигает 40% по сравнению с 2% в общей популяции [21].
Медицинским институтом в Нью-Джерси проведено ретроспективное исследование, в котором осуществлено прямое сравнение 44 пациентов с острым панкреатитом и ВИЧ и 44 контрольных пациентов с острым панкреатитом без ВИЧ. В результате выявлено, что панкреатит у пациентов сравниваемых групп проявляется аналогично, кроме некоторых значимых отличий, например таких, как высокая частота панкреатита, связанного с приемом лекарств (чаще всего препаратов ВААРТ), низкая частота панкреатита, связанного с холелитиазом, дополнительные симптомы, обусловленные степенью иммуносупрессии (тяжелые анемии, гипоальбуминемии и лейкопении и повышение частоты лихорадки, диареи, и гепатомегалии) и увеличенная длительность стационарного лечения. В этом же исследовании показано, что шкала APACHE II может быть использована у больных с ВИЧ для прогнозирования длительности госпитализации или летального исхода в стационаре. Шкала APACHE II сравнивалась со шкалами Рэнсона и модифицированной Глазго, последние показали себя плохими предикторами тяжести заболевания у пациентов с ВИЧ, что связано в первую очередь с отсутствием у этих шкал маркеров иммуносупрессии [3]. В исследовании Bhurwal A. et al. [20] с ВИЧ-инфекцией был связан с 1% всех острых панкреатитов. Несмотря на то, что ВИЧ-статус связан с более высокой частотой полиорганной недостаточности и длительным стационарным лечением, смертность в стационаре значительно не повышается при контроле факторов при многомерном анализе. В исследовании Anderson F., Thomson S. R. Показано, что, несмотря на тот факт, что панкреонекроз был более распространенным при ВИЧ-ассоциированном панкреатите, смертность была одинаковой [19].
Зависимость от АРВТ
В течение последнего десятилетия в нескольких исследованиях ставился вопрос о том, является ли ВААРТ причиной возникновения панкреатита. До начала ВААРТ в нескольких докладах под подозрение попадали такие нуклеозидные ингибиторы обратной транскриптазы (НИОТ), как диданозин и ставудин [5], [6], [7]. Связь между НИОТ и острым панкреатитом была впервые отмечена вскоре после их введения для лечения ВИЧ в середине 90-х годов. Наиболее выраженным патологическим воздействием на поджелудочную железу при этом обладал ставудин [21]. Из различных комбинаций НИОТ, изученных Reisler et al [5], частота панкреатита для ингибиторов обратной транскриптазы с одним, двумя и тремя нуклеозидами была одинаковой, показатели же частоты развития панкреатита в группах с диданозином зависели от дозы. Частота панкреатита в группах диданозин/гидроксимочевина существенно не отличалась от показателей для одного диданозина. Общие показатели острого панкреатита для исследований диданозин/ставудин были высокими. Самые высокие показатели наблюдались при комбинации индинавир/диданозин/ставудин с включением или исключением гидроксимочевины. Тем не менее, несмотря на большое количество наблюдений (8451 человек), исследователи наблюдали значительную вариабельность показателей заболеваемости острым панкреатитом среди различных групп исследования.
Острый панкреатит может быть вызван прямым воздействием вируса на ткани поджелудочной железы, либо, чаще всего, схемами антиретровирусных препаратов (ВААРТ), такими как нуклеозидный ингибитор обратной транскриптазы или ингибиторы протеаз, которые вызывают гипертриглицеридемию, которая впоследствии вызывает острый панкреатит [22].
Терапия ВААРТ на основе ингибиторов протеазы (ИП) была впервые введена в 1996 году, после чего обнаружено значительное увеличение гипертриглицеридемического панкреатита после введения и широкого применения ИП. Manfredi и соавт. [29] доказали повышенный риск развития панкреатита при воздействии ВААРТ на основе ИП, однако, это исследование включало в анализ эпизоды как клинического, так и субклинического (т.е. только лабораторного – по меньшей мере, трехкратного увеличения уровней сывороточной амилазы и/или липазы).
При этом в исследовании Raza S. et al. [4] только треть пациентов с диагнозом ОП проходили терапию ВААРТ, что позволило предположить, что другие факторы риска по крайней мере в равной степени способствуют развитию острого панкреатита у пациентов с низким уровнем CD4. ИП могут вызывать метаболические нарушения, включая развитие резистентности к инсулину, гипергликемию, гиперхолестеринемию и гипертриглицеридемию. Однако уровни триглицеридов могут быть и нормальными. Согласно нескольким исследованиям, никакого значительного увеличения частоты острого панкреатита не происходит после введения ИП для лечения [23].
Anderson F., Thomson S. R. [19] в своем исследовании связали антиретровирусную терапию с острым панкреатитом у 35,8% из 106 пациентов, имевших панкреатит в сочетании с ВИЧ.
В серии исследований Cappell and Marks, [3] среди 18 пациентов с ОП, пентамидин был признан причинным фактором в 12 случаях, за ним следовали диданозин (в 4 случаях) и сульфаметоксазолтриметоприм (в 2 случаях). Riedel D. J. et al. [27] в своем исследовании при проведении многомерного анализа связали острый панкреатит c применением аэрозольного пентамидина и ставудина, при этом не найлено никаких доказательств того, что более новые антиретровирусные препараты, включая ИП (например, атазанавир и лопинивир / ритонавир), НИОТ (например, тенофовир и абакавир) или ННИОТ (например, эфавиренц), были связаны с повышенным риском развития панкреатита.
Лабораторные показатели при панкреатите у ВИЧ-инфицированных пациентов
Во многих исследованиях отсутствует комплексный подход к определению понятия острого панкреатита. Используется либо клиническая диагностика панкреатита (высокая специфичность), с недооценкой уровня заболеваемости, либо определение панкреатита с лабораторной точки зрения (высокая чувствительность), которая, напротив, завышает уровень заболеваемости [5], особенно в исследованиях, использующих в качестве однозначного признака острого панкреатита уровни амилазы. Высокие уровни сывороточной амилазы могут отражать высокие уровни изоамилазы S-типа, секретируемой главным образом слюнными железами, что обычно наблюдается при гиперплазии слюнной и околоушной желез [11].
Кроме того, гиперамилаземия может быть связана с почечной недостаточностью, патологией печени, мальабсорбцией в желудочно-кишечном тракте, заболеваниями женской половой сферы, неспецифицеским ацидозом, онкологической патологией и ВИЧ-инфекцией [11], [12], [13]. В свою очередь, гиперлипаземия может быть связана с почечной недостаточностью, болезни печени [12], [13], [14], онкопатологией [15] и ВИЧ [13].
Хотя уровень сывороточной липазы обладает большей чувствительностью и специфичностью в отношении острого панкреатита, чем анализ сывороточной амилазы, могут возникать несоответствия, обусловленные высоким биологическим разбросом в результатах конкретного пациента и методов калибровки аппаратуры [16]. В исследовании Riedel D. J. et al. [27] среди 85 больных острым панкреатитом средний уровень амилазы составлял 445 ед / л (диапазон 73–4924 ед / л), а средний уровень липазы составлял 393 ед / л (диапазон 39–7770 ед / л). Calleja и Barkin [17] предложили для улучшения специфичности анализа липазы увеличение верхней границы нормы в 3 раза. Это предложение поддержано наблюдениями Byrne et al. [18], выявившими, что слабое повышение уровня ферментов поджелудочной железы (менее чем в 3 раза по сравнению с верней границей нормы) не сопровождалось значительными изменениями в поджелудочной железе.
Морфологические особенности
Chehter и др. [8] посмертно изучили поджелудочную железу у 109 пациентов со СПИДом и 38 контрольных пациентов и обнаружили в группе ВИЧ-инфицированных пациентов ацинарную атрофию в 60% случаев, небольшое количество гранул зимогена в ацинарной цитоплазме (52%), аномалии в ацинарном ядре (65%), стеатоз поджелудочной железы (66%) и очаговый некроз (17%).
Ferreira F. M. et al. [30] в своем исследовании двух групп пациентов (С АРВТ и без АРВТ) показали значимые различия между группами, островки Лангерганса были склонны к гипертрофии в группе высокоактивной антиретровирусной терапии и не имели изменений в контрольной группе.
Коморбидность с вирусными гепатитами
Одним из важных наблюдений в исследовании Raza S. et al. [4] была высокая распространенность инфекций вируса гепатита С и вируса гепатита В у ВИЧ-инфицированных пациентов. Ранее Reisler и соавторы [5] так же сообщали об аналогичных результатах в своем исследовании. Повышенная распространенность вирусов гепатита В и С подняла несколько вопросов о тяжести острого панкреатита у этих пациентов. Также возможно, что вирус ВИЧ сам по себе или сопутствующая инфекция вирусным гепатитом B и гепатитом C могли утяжелять течение панкреатита.
Иммунный статус
Гендерный фактор
В исследованиях Reisler R. B. et al. и Mocroft A. et al. [5], [6] сообщалось, что женский пол является потенциальным фактором риска острого панкреатита, как и в исследовании Dragovic G. et al. [28], которые обнаружили связь между женским полом и острым панкреатитом. В двухфакторном анализе факторы риска острого панкреатита Riedel D. J. et al. [27] включали женский пол. Тогда исследователи выдвинули гипотезу, что меньшая масса тела может увеличить токсичность НИОТ.
В ретроспективном анализе Moore et al. [10] также предполагают, что к значительным факторам риска панкреатита относится женский пол, но в то же время некоторые другие исследования, такие как Cappell и Marks [3], обнаружили повышенный риск развития панкреатита у мужчин. В исследовании Bhurwal A. et al. [20] ВИЧ-ассоциированный панкреатит так же наблюдался чаще у мужчин.
Raza S. et al. [4] и Manfredi R. et al. [29] не обнаружили никакой гендерной связи с процентным соотношением мужчин и женщин.
Заключение
Приведенный анализ свидетельствует о довольно низкой активности научного сообщества в отношении изучения хирургической патологии при ВИЧ-инфекции в целом и острого панкреатита в частности. Достоверно можно судить об отсутствии зависимости гендерной принадлежности пациента и тяжести течения панкреатита. Так же не вызывает сомнений наличие четкой связи между тяжестью течения острого панкреатита и степенью иммунносупрессии, что подтверждено как минимум пятью авторами в своих исследованиях. В отношении антиретровирусных препаратов наибольшую панкреатогенную активность представляет ставудин и комбинации с ним, тогда как более новые антиретровирусные препараты не ассоциируются в настоящее время с токсическим воздействием на поджелудочную железу. Справедливости ради надо отметить, что исследований подобного рода в настоящее время недостаточно, чтобы сделать однозначные выводы.
Острый панкреатит и панкреонекроз при сравнении групп ВИЧ-инфицированных пациентов и без ВИЧ-инфекции показывал большую частоту возникновения и повышенную тяжесть течения заболевания в первой группе, однако, на итоговую летальность в обеих популяциях это не влияло. Тяжелое течение и высокая заболеваемость в этом случае, вероятно, связаны с наличием сопутствующих инфекционных заболевания, таких, например, как вирусные гепатиты, наличие которых утяжеляло течение панкреатита.
Корреляция тяжести панкреатита у ВИЧ-инфицированных пациентов и уровней панкреатоэнзимемии так же весьма вариабельна и подлежит более углубленному изучению.
В настоящее время представляются наиболее актуальными следующие вопросы изучения панкреатита у ВИЧ-инфицированных пациентов:
- Частота возникновения панкреатита у ВИЧ-инфицированных пациентов на фоне приема препаратов ВААРТ с учетом режима дозирования и комбинаций препаратов.
- Изучение функционального состояния поджелудочной железы у ВИЧ-инфицированных пациентов без ВААРТ и на фоне терапии, изучение корреляции триглицеридемии, липаз- и амилаземии с вероятностью развития острого панкреатита.
- Зависимость тяжести течения панкреатита от имеющейся у пациента сопутствующей инфекционной и неинфекционной патологии.
- Разработка высокочувствительных алгоритмов ранней диагностики панкреатита у ВИЧ-инфицированных пациентов с учетом коморбидности, иммунного статуса и функционального состояния поджелудочной железы.
Список литературы / References
Список литературы на английском языке / References in English
Показатели метаболизма железа определены у 86 ВИЧ-инфицированных пациентов с анемией. У 51,2 и 61,6% пациентов, соответственно, было выявлено снижение уровня сывороточного железа и коэффициента насыщения трансферрина. В соответствии с модифицированным алгоритмом G.Weiss у 30,2% пациентов со сниженным коэффициентом насыщения трансферрина диагностирована железодефицитная анемия, у 58,5% пациентов — анемия хронического заболевания (АХЗ), у 11,3% больных — сочетанный вариант анемии. Доля АХЗ была наиболее значимой у пациентов с высокой вирусной нагрузкой и клинико-лабораторными признаками иммуносупрессии. Антиретровирусная терапия сопряжена с улучшением показателей гемоглобина у всех больных с анемией хронического заболевания.
Anemia of chronic disease and HIV-infection
Indicators of iron metabolism are defined in 86 HIV-infected patients with anemia. At 51.2 and 61.6% of patients, respectively, showed a reduction in serum iron and transferrin saturation ratio. In accordance with the modified algorithm G. Weiss in 30.2% of patients with a reduced rate of transferrin saturation diagnosed with iron deficiency anemia, with 58.5% of patients — anemia of chronic disease (ACD), in 11.3% of patients — combines option anemia. The share of ACD was most significant in patients with high viral load and clinical and laboratory evidence of immunosuppression. Antiretroviral therapy involves improvements in hemoglobin in all patients with anemia of chronic disease.
Цель нашего исследования — оценить долю и значимость АХЗ в структуре анемии у пациентов с ВИЧ-инфекцией для совершенствования диагностической и лечебной тактики.
Статистическая обработка полученных данных проводилась при помощи программ СТАТИСТИКА 7.0, SPSS Statistics 17.0 и Microsoft Exell 2007.
Результаты исследования и их обсуждение
У 51,2 и 61,6% пациентов, соответственно, было выявлено снижение СЖ и КНТ ниже нормы, свидетельствующее о высокой распространенности дефицита функционального (сывороточного) железа в популяции ВИЧ-инфицированных. Для дифференциальной диагностики ЖДА и АХЗ был применен модифицированный нами алгоритм Guenter Weiss, 2005 [5] .
Изменения диагностического алгоритма заключались в следующем:
1) В отличие от автора, дифференциальная диагностика проводилась всем пациентам с уровнем КНТ менее 0,20 (т.е. ниже нормальных значений), а в оригинальной методике — при КНТ ниже 0,16.
2) Авторы методики определяли отношение концентрации РРТ к десятичному логарифму уровня ферритина только у пациентов с уровнем ферритина 30-100 нг/мл, тогда как пациенты с уровнем ферритина более 100 нг/мл автоматически были отнесены ими в группу страдающих АХЗ. У наших же пациентов с показателями ферритина выше 100 нг/мл наблюдались несомненные клинико-анамнестические и лабораторные признаки ЖДА (проявления геморрагического синдрома, крайне низкие показатели сывороточного железа и пр.). В связи с этим во избежание диагностической ошибки мы расширили показания для определения РРТ, включив в исследуемую группу всех пациентов с уровнем ферритина более 30 нг/мл.
Итоговый диагностический алгоритм анемий выглядел следующим образом (рисунок 1):
Рисунок 1. Алгоритм дифференциальной диагностики АХЗ, ЖДА и сочетанного варианта течения анемии

Из рисунка видно, что КНТ менее 0,2 был выявлен нами у 53 пациентов (62% пациентов исследуемой группы). У всех этих пациентов было проведено определение уровня ферритина. Показатель его концентрации менее 30 нг/мл выявлен у 16 пациентов; им был выставлен диагноз железодефицитной анемии, подтвержденный также другими клинико-лабораторными данными. У всех этих пациентов за исключением двоих, получающих зидовудин или ставудин, наблюдались выраженные микроцитоз и гипохромия, т.е., признаки, характерные для ЖДА (одним из побочных эффектов зидовудина и ставудина является, как известно, макроцитоз эритроцитов). Кроме того, семеро больных этой группы имели анамнестические и клинические признаки геморрагического синдрома (в т.ч., у двух — кровотечения из трофических язв, у двух женщин — дисфункциональные маточные кровотечения, у одного пациента — рецидивирующие кровотечения из геморроидальных вен, у одного — частые и обильные носовые кровотечения и у одного — кишечное кровотечение).
У пациентов с уровнем ферритина более 30 нг/мл было определено отношение РРТ к десятичному логарифму ферритина, при этом отношение менее 1,5 установлено у 31 пациента, отношение более 1,5 — у шестерых.
Мы попытались установить возможную связь разных видов анемии в группах пациентов с гендерными, клиническими и лабораторными различиями. Корреляция изучаемых показателей с полом заболевших не выявлена. Чаще всего АХЗ диагностировалась в группе больных с легкой степенью анемии (показатели Нb≥90 г/л) — у 65,7% пациентов, тогда как нарастание ее тяжести (снижение уровня Нb ниже 90 г/л) ассоциировалось с уменьшением доли больных с АХЗ до 44,4% и, соответственно, с увеличением доли пациентов с ЖДА.
Свою самостоятельную роль в генезе анемии хронического заболевания при ВИЧ-инфекции могут играть как сам вирус и оппортунистические патогены, напрямую воздействующие на процессы созревания и разрушения эритроцитов, так и образующиеся в процессе болезни провоспалительные цитокины [6, 7].
Мы проанализировали частоту АХЗ и ЖДА в подгруппах пациентов с различными уровнями вирусной нагрузки и иммуносупрессии (таблица 1).
Анемия и показатели активности инфекционного процесса у обследованных пациентов с ВИЧ-инфекцией
Американские ученые выяснили механизм, позволяющий иммунной системе некоторых пациентов подавлять размножение вируса иммунодефицита на протяжении практически неограниченного времени. По данным исследователей, подобная неуязвимость для ВИЧ-инфекции связана с особенностями созревания T-лимфоцитов в вилочковой железе.
Американские ученые выяснили механизм, позволяющий иммунной системе некоторых пациентов подавлять размножение вируса иммунодефицита на протяжении практически неограниченного времени. По данным исследователей, подобная неуязвимость для ВИЧ-инфекции связана с особенностями созревания T-лимфоцитов в вилочковой железе.
У большинства людей заражение ВИЧ при отсутствии лечения неизбежно приводит к разрушению иммунной системы и развитию синдрома приобретенного иммунодефицита (СПИДа). Однако иммунная система очень небольшой группы больных способна самостоятельно бороться с вирусом. СПИД у этих людей не развивается на протяжении многих лет и даже десятилетий после заражения. Предыдущие исследования показали, что большинство таких пациентов обладают особым вариантом гена из группы человеческих лейкоцитарных антигенов HLA B57. Наличие этого гена также связано с повышенным риском развития аутоиммунных заболеваний.
Учитывая эти данные, сотрудники Массачусетского технологического института построили компьютерную модель, описывающую особенности созревания T-лимфоцитов у носителей гена HLA B57, а также влияние этих особенностей на способность иммунной системы выявлять и уничтожать клетки, пораженные вирусом иммунодефицита. Достоверность результатов такого моделирования была подвержена исследованием с участием 1900 ВИЧ-инфицированных, 1000 из которых обладали устойчивостью к развитию СПИДа.
В процессе созревания T-лимфоцитов в вилочковой железе эти клетки подвергаются воздействию различных антигенов, образующих комплекс с протеинами, кодируемыми генами HLA. Клетки, слишком активно реагирующие на эти антигены, получают сигнал к самоуничтожению. Таким образом происходит отсев Т-лимфоцитов, которые способны атаковать собственные ткани организма.
По данным американских ученых, наличие варианта гена HLA B57 приводит к тому, что созревающим в вилочковой железе лимфоцитам предлагается меньшее число "контрольных" антигенов. В результате в организм поступают более "агрессивные" T-лимфоциты, способные взаимодействовать с большим числом антигенов. Эта особенность позволяет иммунной системе носителей гена HLA B57 быстро опознавать мутировавшие формы ВИЧ, которые остаются незаметными для иммунной системы других людей. По данным исследователей, аналогичным защитным эффектом при ВИЧ-инфекции обладает еще один вариант человеческого лейкоцитарного антигена – HLA B27.
По словам одного из соавторов исследования Брюса Уолкера, выводы ученых, возможно, окажутся полезными при разработке новых методов лечения ВИЧ-инфекции. В частности, возможно создание вакцин, искусственно увеличивающих число агрессивных Т-лимфоцитов у зараженных ВИЧ пациентов.
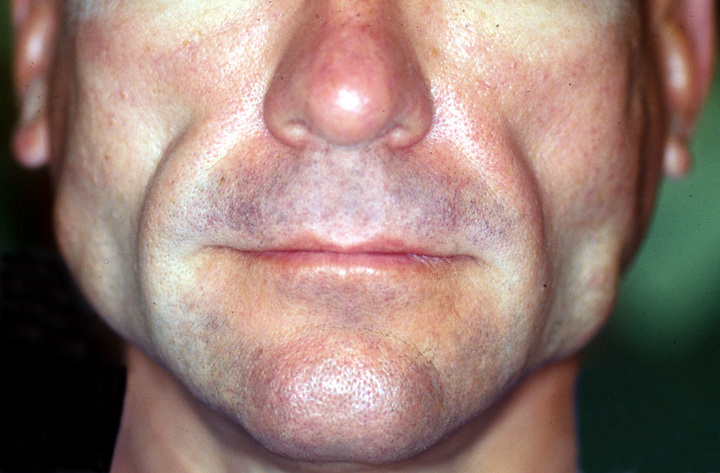
Является побочным эффектом АРТ и проявляется в изменении распределения подкожного и висцерального жира в организме.
Как часто: Согласно AIDS Map (исследование за 2001 год), у 83% людей, принимающих АРТ, симптомы липодистрофии развились через 21 месяц лечения, а у 11% участников исследования симптомы носили достаточно выраженный характер.
Другое исследование, проведенное во Франции, показало, что 85% людей, принимающих препараты против ВИЧ, имели хотя бы одно из проявлений липодистрофии в течение первых 18 месяцев лечения, включая увеличение толщины брюшной стенки, увеличение размера талии и истончение подкожно-жировой клетчатки в области нижних конечностей и/или ягодиц.
Лечение: Инъекции полиактида (поли-L-лактозная кислота, New Fill, Sculptra) в лицо; липосакция, чтобы перераспределить подкожный жир на другие части тела; инъекции тезаморелина (Egrifta), который уменьшает избыток отложений жира на животе у людей, принимающих препараты против ВИЧ.
Диарея
Как часто: Встречается очень часто. Считается, что диарея является одной из наиболее распространенных причин, из-за которой, живущие с ВИЧ, прекращают лечение или меняют схему лечения.
Лечение: Применение антидиарейных средств, которые замедляют перистальтику кишечника. К ним относятся Имодиум (лоперамид), Ломотил (дифеноксилат и атропин). Данные препараты необходимо применять только по назначению врача, так как бесконтрольное их применение может нести угрозу жизни и здоровья.
Препарат Майтези (Mytesi) – единственный лекарственный препарат для облегчения симпотомов диареи у ВИЧ-позитивных людей и второе лекарственное средство растительного происхождения, который одобрен FDA. Его получают из сока растения Croton lechleri.
В некоторых ситуациях требуется коррекция АРТ.

Изменения настроения, включая депрессию и тревожность
Как часто: По данным AIDS Beacon, 63% ВИЧ-положительных участников недавно проведенного исследования сообщилио том, что имели симптомы депрессии либо в настоящее время, либо в встречались с ними в прошлом, 26% – имели суицидальные мысли, а 13% участников предпринимали попытку самоубийства.
Лечение: Наиболее эффективными препаратами, облегчающими данное состояние, признаны ингибиторы обратного захвата серотонина. Национальный институт здравоохранения США рекомендует принимать следующие лекарственные средства для лечения депрессии у пациентов с ВИЧ: имипрамин, дезипрамин, нортриптилин, амитриптилин, флуоксетин, сертралин, пароксетин, циталопрам, эсциталопрам, флувоксамин, венлафаксин, нефазодон, тразодон, бупропион и миртазапин.

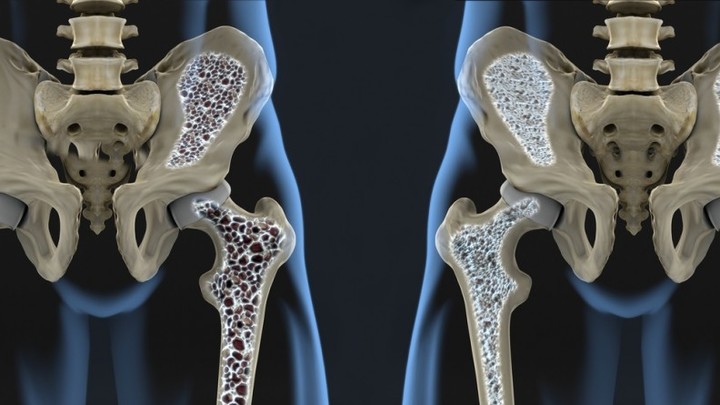
Остеопороз и остеопения
Остеопения – это патологическое состояние, характеризующееся уменьшением минеральной плотности костей. Разница между остеопенией и остеопорозом в том, что при остеопорозе потеря костной массы значительно выше, что приводит к повышенному риску переломов костей.
Как часто: Гораздо больше людей с ВИЧ имеют остеопению (60%) нежели остеопороз (10-15%). По этой причине переломы чаще встречаются у ВИЧ-позитивных молодых людей. Считается, что чем ниже вес вашего тела, тем больше риск развития остеопороза.
Лечение: Терапия бисфосфонатами с витамином D и добавками кальция, включая: Фосамакс, Бонвиву, Актонель, Ательвию и Рекласт. Также рекомендуют занятия спортом.
Заболевания сердечно-сосудистой системы
Как часто: Это вторая ведущая причина смертности среди людей, живущих с ВИЧ.
Лечение: Необходим комплексный подход, который включает в себя различные виды лечения. Существуют препараты, снижающие уровень холестерина, такие как Крестор (розувастатин) и другие. Полезны программы, которые помогают вам бросить курить, снизить лишний вес и заняться спортом. Необходимо сократить потребление алкоголя и соли. Если ваше артериальное давление не находится на нормальном уровне, то ваш врач поможет назначить необходимые лекарства. Среди вариантов: ингибиторы АПФ, блокаторы рецепторов ангиотензина II, бета-блокаторы, блокаторы кальциевых каналов.

Сахарный диабет
Как часто: Существует тип диабета, обусловленный повреждением поджелудочной железы, вызванным лекарствами против ВИЧ. Он менее распространен, чем два других типа, но также опасен.
Лечение: Основными видами лечения являются контроль за уровнем глюкозы в крови, применение сахароснижающих препаратов, лечение инсулином и правильное питание, а также регулярные осмотры врачом для скрининга осложнений, которые легко не заметить.
Артериальная гипертензия
Как часто: Очень часто. Например, Департамент по делам ветеранов США сообщает, что 45% пациентов с ВИЧ имеют диагноз артериальная гипертензия. Однако, среди ученых нет полной уверенности, чо это может быть связано только с ВИЧ-инфекцией или лечением антиретровирусными препаратами, или комбинацией этих факторов.
Лечение: Прекратить курение, снижение веса, ограничение соли. Применяют сосудорасширяющие средства (например, гидралазин), антигипертензивные препараты (см. выше), диуретики (гипотиазид и др.).
У меня ВИЧ. Теперь я должен придерживаться определенной диеты?
Скорее нет. Однако теперь вам придется соблюдать определенные условия, потому что ваше пищеварение может измениться: как от самого заболевания, так и от АРВ-терапии, которую вы принимаете. ВИЧ-позитивные люди часто сталкиваются с такими проблемами как потеря веса, диарея, повышение уровня холестерина.
Каковы основные принципы здорового питания при ВИЧ?
Не существует серьезных различий в принципах здорового питания у ВИЧ-положительных и ВИЧ-отрицательных людей.
Выбирайте нежирную свинину или говядину, куриную грудку, рыбу, цельнозерновые и бобовые продукты. Потребляйте кисломолочные продукты, либо альтернативное молоко (например, соевое), обогащенное кальцием. Выбирайте продукты без добавленного сахара, ограничьте потребление простых углеводов. Не менее 30% ежедневной нормы калорий должно приходиться на жиры, в том числе мононенасыщенные: орехи, авокадо, рыба, оливковое масло.
Какие витамины нужно принимать при ВИЧ-инфекции?
Витамин А и бета-каротин (здоровье кожи и легких): зеленые, желтые, оранжевые или красные овощи и фрукты; печень; яйца; молоко. Помните о том, что витамин А — жирорастворимый, а значит овощные салаты лучше заправлять оливковым маслом.
Витамины группы В (поддержка иммунной и нервной системы): мясо, рыба, курица, орехи, бобы, авокадо, брокколи и зеленые листовые овощи.
Витамин C (защищает от инфекций, что особенно важно на фоне ВИЧ): цитрусовые.
Витамин D (у ВИЧ-позитивных людей критически важен для профилактики развития остеопороза): рыбий жир либо инъекции.
Витамин Е (защищает клетки и помогает бороться с инфекциями): зеленые листовые овощи, арахис и растительные масла.
Железо (борьба с анемией): зеленые листовые овощи, цельнозерновой хлеб, печень, рыба, яйца.
Селен и цинк (важны для иммунной системы): орехи, птица, рыба, яйца и арахис, фасоль, молоко и другие молочные продукты.
Если вам кажется, что вы не получаете достаточно витаминов и микроэлементов с пищей — обсудите с врачом возможность приема поливитаминов.
Что нельзя есть при ВИЧ-инфекции?
На фоне приема Эфавиренца (Стокрин) не рекомендуется есть грейпфруты и помело, пить грейпфрутовый сок и принимать препараты на основе гинкго. Лопиновир (Калетра) не сочетается со зверобоем.
Кроме того, на фоне приема АРВ-терапии следует более внимательно отнестись к препаратам: кальций, железо, магний, алюминий или цинк. Их прием с АРВТ нужно разделять на несколько часов. По этому вопросу лучше проконсультироваться с лечащим врачом.
Может ли диета скорректировать проблемы на фоне приема АРВ-препаратов?
Правильную рекомендацию может дать только врач. Но вот несколько советов, которые точно не сделают хуже.

Если ВИЧ-инфекция и прием АРВ-препаратов сопровождается:
Тошнотой и рвотой
Ешьте небольшими порциями каждые 1-2 часа. Избегайте жирных и острых блюд. Пейте имбирный чай. Следите за тем, чтобы ваша еда была не слишком горячей.
Пейте больше жидкости, чем обычно. Ограничьте прием молочных продукт, свежих овощей и фруктов, сладких напитков или напитков с кофеином. Ешьте медленно. Избегайте жирного.
Попробуйте упражнения (или йогу), которые помогут вам повысить аппетит. Не пейте слишком много прямо перед едой. Настройтесь на прием пищи, ешьте с семьей или друзьями. Пробуйте новые блюда, отнеситесь с фантазией к презентации.
Слишком большой потерей веса
Увеличьте порции. Ешьте сухофрукты, орехи и мороженое. Спросите у врача о возможности принимать белковые добавки. К слишком большой потере веса стоит отнестись серьезно — она может быть связана с присоединением оппортунистических инфекций.
Проблемами с глотанием
Ешьте мягкие продукты: йогурт или картофельное пюре. Не ешьте сырые овощи, отдавайте предпочтение мягким фруктам: бананы или груши. Ограничьте кислое (апельсины, лимоны и помидоры). Посоветуйтесь с врачом: проблемы с глотанием могут быть признаком оппортунистических инфекций.
Липодистрофией (Патологическое состояние, которые характеризуется атрофией или гипертрофией жировой ткани. Чаще встречается у пациентов, которые принимают старые препараты)
Ограничьте жир, особенно насыщенные и трансжиры. Выбирайте “полезные” ненасыщенные жиры и источники омега-3 жирных кислот. Старайтесь меньше потреблять алкоголь и рафинированный сахар. Ешьте больше продуктов, богатых клетчаткой.
Сочетается ли ВИЧ-инфекция с вегетарианством и веганством?
Неопровержимых доказательств обратного пока нет. Но можно отметить, что это тема пока мало изучена.
Если вы собираетесь стать веганом или отказались от животной пищи еще до постановки диагноза, то следует помнить о том, что ВИЧ-инфекцию часто сопровождает потеря веса, а значит вам нужно особенно тщательно подойти к своему рациону и добавкам.
Когда пойдете обсуждать рацион со своим лечащим врачом — вооружитесь. Например, зачитайте ему статью о том, что ВИЧ-позитивный веган стал финалистом конкурса PETA “Самый сексуальный веган по соседству”.
Можно ли пить алкоголь?
Можно, но не усердствуйте! Дело в том, что сегодня люди с ВИЧ живут примерно столько же, сколько и ВИЧ-отрицательные. Но потребление алкоголя может сказаться на долгосрочном качестве жизни. Кроме того, алкоголь может повлиять на способность человека принимать лекарства, а проблемы с приверженностью ведут к последствиям, вплоть до развития лекарственной резистентности.
Также стоит помнить, что алкоголь влияет на печень, что особенно актуально для тех, у кого ВИЧ-инфекция сочетается с гепатитом B или C. Кроме того, недавние исследования показывают, что у ВИЧ-позитивных людей может быть ниже порог “безопасного” потребления этанола.
Читайте также:
- Что такое лямблии в печени у детей симптомы и лечение
- Как в домашних условиях избавить котенка от глистов в домашних условиях
- Что можно есть при эрозивном гастрите и хеликобактер
- Презентация лабораторная диагностика вич инфекции презентация
- Как остановить рвоту после алкогольного отравления в домашних условиях

