Внутриутробное инфицирование плода кишечной палочкой
Обновлено: 18.04.2024
Кафедра акушерства, гинекологии и перинатологии факультета повышения квалификации и последипломной подготовки специалистов Кубанского государственного медицинского университета
Кафедра акушерства, гинекологии и перинатологии факультета повышения квалификации и последипломной подготовки специалистов Кубанского государственного медицинского университета;
Городская больница №2
Краевой перинатальный центр, Краснодар
Кафедра акушерства, гинекологии и перинатологии факультета повышения квалификации и последипломной подготовки специалистов Кубанского государственного медицинского университета
Краевой перинатальный центр, Краснодар
Кафедра акушерства, гинекологии и перинатологии факультета повышения квалификации и последипломной подготовки специалистов Кубанского государственного медицинского университета
Роль инфекции в преждевременном разрыве плодных оболочек
Журнал: Российский вестник акушера-гинеколога. 2012;12(6): 35‑39
Новикова В.А., Пенжоян Г.А., Рыбалка Е.В., Аутлева С.Р., Сикальчук О.И., Асеева Е.В. Роль инфекции в преждевременном разрыве плодных оболочек. Российский вестник акушера-гинеколога. 2012;12(6):35‑39.
Novikova VA, Penzhoian GA, Rybalka EV, Autleva SR, Sikal'chuk OI, Aseeva EV. Role of infection in premature rupture of the membranes. Russian Bulletin of Obstetrician-Gynecologist. 2012;12(6):35‑39. (In Russ.).
Кафедра акушерства, гинекологии и перинатологии факультета повышения квалификации и последипломной подготовки специалистов Кубанского государственного медицинского университета
Кафедра акушерства, гинекологии и перинатологии факультета повышения квалификации и последипломной подготовки специалистов Кубанского государственного медицинского университета
Кафедра акушерства, гинекологии и перинатологии факультета повышения квалификации и последипломной подготовки специалистов Кубанского государственного медицинского университета;
Городская больница №2
Краевой перинатальный центр, Краснодар
Кафедра акушерства, гинекологии и перинатологии факультета повышения квалификации и последипломной подготовки специалистов Кубанского государственного медицинского университета
Краевой перинатальный центр, Краснодар
Кафедра акушерства, гинекологии и перинатологии факультета повышения квалификации и последипломной подготовки специалистов Кубанского государственного медицинского университета
Проблема преждевременных родов считается приоритетной для изучения акушерами-гинекологами и неонатологами, так как, с одной стороны, 60-70% недоношенных детей обусловливают раннюю неонатальную смертность [16], с другой, преждевременные роды являются серьезным фактором риска развития послеродовых гнойно-воспалительных осложнений [14]. Число случаев преждевременных родов составляет 6-10% от всех родов и различается в зависимости от срока беременности: в период с 22 до 28 нед беременности - 5-7% от всех случаев преждевременных родов, в период с 29 до 34 нед беременности - 33-42%, в период с 34 до 37 нед беременности - 50-60% [1]. По механизму возникновения преждевременные роды делятся на самопроизвольные и индуцированные. Факторами риска развития преждевременных родов с преждевременным разрывом плодных оболочек (ПРПО) могут быть: низкое социально-экономическое положение женщины; экстрагенитальные заболевания (артериальная гипертензия, нарушение функции щитовидной железы, заболевания сердца, анемия с уровнем гемоглобина менее 90 г/л и др.); наркомания и курение; профессиональные вредности; наследственность; перенесенная вирусная инфекция; преждевременные роды в анамнезе; истмико-цервикальная недостаточность (ИЦН); пороки развития матки; перерастяжение матки (многоводие, многоплодная беременность, макросомия при сахарном диабете); хирургические операции во время беременности, особенно на органах брюшной полости, или травмы [1].
Динамическое изменение видовой структуры возбудителей заболеваний, формирование устойчивых к антибиотикам штаммов, увеличение иммунокомпетентных лиц среди беременных и родильниц диктуют необходимость периодического пересмотра стратегии и тактики лечения [8]. Разработка и совершенствование методов диагностики, рациональной комплексной терапии и профилактики привели к значительному снижению частоты и тяжести агрессивных форм послеродовой инфекции (сепсиса, перитонита, гнойного мастита). Тем не менее до сих пор отсутствует тенденция к значительному уменьшению частоты наиболее распространенных у беременных и родильниц гнойно-воспалительных заболеваний: эндомиометрита, раневой инфекции, пиелонефрита [18, 21].
Необходимо подчеркнуть, что дородовое излитие вод связано с 40% преждевременных родов и, как следствие, часто является причиной неонатальной заболеваемости и смертности [17]. Три основные причины неонатальной смертности связаны с ПРПО при недоношенной беременности: незрелость органов и систем, сепсис и гипоплазия легких. ПРПО представляет риск для матери прежде всего в связи с хориоамнионитом. Доказана связь между восходящей инфекцией из нижних отделов генитального тракта и ПРПО. Каждая третья пациентка с ПРПО при недоношенной беременности имеет положительные результаты посевов содержимого из генитального тракта, более того, исследования доказали возможность проникновения бактерий через интактные мембраны. Имеется множество публикаций, в которых обсуждаются вопросы выявления плодов с внутриутробной инфекцией (ВУИ), профилактического назначения антибиотиков, токолитиков и кортикостероидов, оптимального гестационного возраста для родоразрешения [3, 9-13, 19, 22, 23, 25]. Известно, что вероятность развития родовой деятельности при излитии околоплодных вод находится в прямой зависимости от гестационного срока: чем меньше срок, тем больше период до развития регулярной родовой деятельности (латентный период). В пределах первых суток после преждевременного излития вод спонтанные роды начинаются: в 26% при массе плода 500-1000 г, в 51% при массе плода 1000-2500 г, в 81% при массе плода более 2500 г.
ПРПО встречается в 2-4% при одноплодной и в 7-20% при многоплодной беременности, является причиной увеличения заболеваемости не только новорожденного, но и матери, может явиться причиной неонатальной смерти [6, 7, 26, 31].
ПРПО осложняет течение 10% беременностей и только в 3% наблюдений ПРПО происходит в сроке менее 37 нед. Тем не менее 1 /3 преждевременных родов происходит вследствие ПРПО в недоношенном сроке беременности. ПРПО в США ежегодно осложняет течение доношенной беременности в 400 000 случаев, при недоношенной - в 120 000 случаев [27].
Таким образом, преждевременные роды, обусловленные инфекцией, являются прогнозируемым фактором риска развития осложнений беременности и родов как для женщины, так и для плода и новорожденного. В.М. Сидельникова и соавт. [15] указывали, что в последние 10 лет необходимость понимания связи между инфекцией и преждевременными родами возросла. При ПРПО в сроке 34 нед и более длительная (более 12-24 ч) выжидательная тактика не показана, так как повышает риск внутриматочной инфекции без улучшения исходов для плода. Но решение о вмешательстве должно приниматься, основываясь прежде всего на комплексной клинической оценке ситуации после получения информированного согласия пациентки [17]. Острая необходимость снижения частоты данной патологии требует своевременного поиска мер профилактики как преждевременных родов, особенно с ПРПО, так и послеродовых гнойно-воспалительных заболеваний.
В настоящее время существует необходимость однозначно трактуемых рекомендаций по методу преиндукции преждевременных родов с ПРПО (показания и противопоказания для различных методов, дозировка, кратность введения, курсовая доза фармпрепарата в зависимости от паритета, срока беременности, состояния шейки матки и т.д).
Терапевтическую тактику определяют, разделяя сроки беременности в зависимости от того, в каком сроке ПРПО произошел: менее 23 нед, 23-31 нед, 32-33 нед, 34-36 нед. Если имеются признаки хориоамнионита, рекомендована антибактериальная терапия широкого спектра действия [29].
Увеличение частоты преждевременных родов обусловлено в США не только увеличением числа многоплодных беременностей, возраста беременных, но и увеличением частоты показаний к индукции преждевременных родов (R. Roberto, Ch. Lockwood, 1999).
Относительно выживаемости новорожденных известно, что только некоторые новорожденные могут выжить в сроке 22 нед беременности, но не в сроке 20 нед. Выхаживание недоношенных детей гестационного возраста 22 нед возможно только при применении усовершенствованных технологий (R. Roberto, Ch. Lockwood, 1999). Масса тела в 500 г исторически рассматривается как лимит по выживаемости.
Осложнения ПРПО
Интерлейкин-6, а также прокальцитонин в материнской сыворотке повышаются раньше, чем СРБ, и могут быть использованы для ранней диагностики субклинических форм инфекции.
Еще одна проблема лабораторной диагностики обусловлена необходимостью проведения профилактики респираторного дистресс-синдрома (РДС) с применением глюкокортикоидов, так как применение последних может оказать влияние на количество лейкоцитов, по крайней мере, в течение времени созревания легких.
Для матери ПРПО при недоношенной беременности в 30% случаев может осложниться клинически или субклинически выраженным хориоамнионитом, септицемией или эндометритом. К возможным осложнениям дополнительно относят не только ПОНРП, но и нервно-психические расстройства, смерть. Особо подчеркивается, что ПРПО для матери может осложниться в послеродовом периоде эндомиометритом, послеродовым сепсисом (септицемией), послеродовым кровотечением, венозным тромбозом.
Для плода ПРПО при недоношенной беременности может осложниться: 1) проявлениями недоношенности у новорожденного: РДС, некротическим энтероколитом, наличием открытого артериального протока, внутрижелудочковым кровоизлиянием, ретинопатией недоношенных, слуховыми расстройствами, церебральным параличом; 2) маловодием (результат - лицевые аномалии, нарушения членорасположения, гипоплазия легких, задержка роста плода); 3) гипоксией плода вследствие компрессии пуповины, отслойки плаценты; 4) неонатальной заболеваемостью вследствие неправильного членорасположения, маловодия, недоношенности. При ПРПО обнаруживаются врожденные пороки развития плода, с которыми может быть и связан ПРПО.
S. Suzuki и соавт. [34, 35] изучили акушерские и неонатальные исходы преждевременных родов при одноплодной беременности, осложненной ПОНРП, после ПРПО и без ПРПО. Проанализированы 95 случаев при сроке беременности от 22 до 36 нед. В общем число случаев отслойки плаценты при одноплодной беременности с ПРПО составляет 4,7%, отношение шансов (odds ratio - OR) - 6,50 (р<0,01). В данном исследовании из 95 случаев ПОНРП при недоношенной одноплодной беременности в 64 (67,4%) случаях она произошла без ПРПО и в 31 (32,6%) случае - с ПРПО. Частота гистологически подтвержденного хориоамнионита у женщин после ПРПО была значительно выше, чем у пациенток без ПРПО (р=0,02).
E. Reece и соавт. [30] представили обзор исследований, посвященных оценке OR и доверительного интервала (CI, confidence intervals) развития осложнений при трех вариантах ведения ПРПО при доношенной беременности: индукции родов окситоцином, простагландином и применение выжидательной тактики. Так, отношение шансов развития хориоамнионита было выше при индукции родов простагландином по сравнению с их индукцией окситоцином (OR=1,55, CI=1,09-2,21), при индукции родов окситоцином по сравнению с применением выжидательной тактики (OR=0,91, CI=0,51-1,62). Установлен наименьший риск развития хориоамнионита при индукции родов простагландином по сравнению с применением выжидательной тактики (OR=0,68, CI=0,51-0,91). Однако при сравнении индукции родов простагландином и применением выжидательной тактики OR проведения кесарева сечения было 0,95 (CI=0,76-1,20), что больше, чем при индукции родов простагландином в сравнении с окситоцином (OR=0,67, CI=0,34-1,29), но меньше, чем при сравнении индукции родов окситоцином и применением выжидательной тактики (OR=1,24, CI=0,89-1,73).
T. Mohr [28] считает, что основными причинами ПРПО являются: бактериальный вагиноз, многоплодная беременность, многоводие, преждевременные сокращения миометрия, кровотечение в I триместре беременности, никотиновая зависимость, преждевременные роды или ПРПО при недоношенной беременности в анамнезе. ПРПО происходит, если устойчивость амниона к давлению снижается, что может иметь разные причины. Неповрежденный амнион с достаточным количеством амниотической жидкости необходим не только для развития плода (легких, движений), а также защищает плод от восходящей инфекции. Конечно, это может быть следствием механического напряжения мембраны. Например, во время родов, при многоплодной беременности или многоводии. Однако возможной причиной может явиться уменьшение сопротивления амниона. Начиная с 20 нед беременности, уменьшается синтез коллагена (уменьшение коллагена-мРНК) и снижается выработка коллаген-стабилизирующих ферментов, таких как лизилоксидаза. Другим механизмом является увеличение разрушения коллагена конкретными матричными металлопротеиназами (ММП), в основном MMП-1, -8 и -9 (специфические ингибиторы роста ткани). Роды при хориоамнионите приводят к дисбалансу уровня матричных металлопротеиназ. Повышенная способность коллагена к растворению приводит к разрушению амниона и, следовательно, к снижению сопротивления мембраны.
Независимо от срока беременности, синдром амниотической инфекции значительно ухудшает прогноз для новорожденного. Чувствительность лабораторных маркеров (например, интерлейкина-6 и прокальцитонина), которые могут выборочно обнаружить субклинические формы АИС, не до конца изучена.
Одной из основных причин ПРПО является восходящая вагинальная инфекция. Патофизиологически инфекция приводит к усилению производства цитокинов и простагландинов (Е2 и F2) и через каскад - к развитию родовой деятельности. Основными инфекционными агентами при ПРПО T. Mohr [28] называет: Streptococci группы В, E. coli, Fusobacteria, Peptostreptococci, Bacterioides, Ureaplasma urealyticum. Таким образом, в зависимости от срока беременности нужно решить, следует ли продлить беременность, так как существует повышенный риск развития АИС и преждевременных родов.
K. Shimoya и соавт. [33] пришли к выводу, что хориоамнионит снижает риск развития РДС плода, что связано с повышением уровня интерлейкина-6 (ИЛ-6) в плазме крови плода. С другой стороны, назначение глюкокортикоидов напрямую приводит к подавлению концентрации ИЛ-6 и ИЛ-8 в крови плода, что может подавлять ассоциированное с ИЛ-6 созревание легких плода.

V. Phupong и соавт. [26] считают, что в сроке 32-34 нед при родоразрешении необходимо прогнозировать осложнения, связанные не только с недоношенностью (см. таблицу), но и с риском инфекционных осложнений.
При изучении роли инфекционного фактора в генезе преждевременных родов J. Rzanek-Głowacka и соавт. [32] в 1999-2001 гг. провели собственные исследования. Приведены убедительные доказательные сведения о роли бактериального вагиноза в возникновении ПРПО. Авторы пришли к выводу, что число случаев внутриутробной инфекции при беременности составляет от 1 до 10%. Клинически выраженный хориоамнионит осложняет течение от 1 до 5% беременностей, но почти 25% преждевременных родов в значительной степени повышают заболеваемость и смертность новорожденных, а также являются причиной заболеваемости матерей. Очень важно выявить риск развития внутриутробного инфицирования плода от матери и провести своевременную диагностику хориоамнионита у матери. Авторы провели оценку взаимосвязи бактериальной флоры цервикального канала беременной с ПРПО при преждевременных родах ранее 32 нед с клиническими и лабораторными признаками инфекции у матери и наличием бактериальной флоры в крови новорожденных. Обследованы 37 беременных женщин в возрасте от 20 до 43 лет в сроки беременности от 24 до 32 нед. Средняя продолжительность от начала подтекания околоплодных вод до родов составила 11,1±8,63 дня. В результате бактериологического исследования отделяемого из цервикального канала женщин обследуемой группы выявили: Staphylococcusepidermidis - у 27%, кишечная палочка - у 19%, Streptococcus группы B - у 10,8%, Enterococcus faecalis - у 8,1%. В результате бактериологических исследований крови новорожденных выявили: Staphylococcus epidermisis - у 13,5%, Staphylococcushaemolyticus - у 10,8%, Klebsiella pneumoniae - у 10,8%, синегнойная палочка - у 8,1%. В 97,3% случаев у новорожденных выявлены врожденные инфекции в форме пневмонии, подтвержденные рентгенологически. Подтверждение внутриутробной инфекции при гистологическом исследовании плаценты в форме хориоамнионита имело место в 25 (67,5%) случаях. Исследователи пришли к выводу, что при ПРПО у женщин бактериальный вагиноз (БВ) является фактором риска развития внутриутробных инфекций у новорожденных.
Учитывая этот факт, в настоящее время общепризнанной является необходимость санации всех беременных с клиническими проявлениями бактериального вагиноза [2, 4, 36]. Препаратами выбора в этом случае являются метронидазол и клиндамицин.
Центр по контролю и профилактике заболеваний США (Centres for Disease Control and Prevention, 2010) рекомендует для лечения беременных метронидазол в дозах 500 мг 2 раза в сутки или 250 мг 2 раза в сутки на протяжении 7 дней как препарат первой линии. Альтернативой является пероральный прием клиндамицина по 300 мг 2 раза в сутки в течение 7 дней [36]. Европейское общество по лечению заболеваний, передающихся половым путем, кроме вышеуказанных способов приема препаратов рекомендует прием метронидазола однократно в дозе 2 г, а также местное применение метронидазола в форме геля или клиндамицина в виде 2% вагинального крема (5 г на ночь в течение 7 дней) [4].
Российские клинические рекомендации отдают предпочтение местному лечению БВ в первой половине беременности и пероральному применению метронидазола со второй половины беременности [2].
Таким образом, прогнозирование ПРПО рекомендовано до наступления беременности при наличии следующих факторов риска развития преждевременных родов: низкий социально-экономический статус женщин, индекс массы тела менее 19,0, курение, преждевременные роды в анамнезе, истмико-цервикальная недостаточность, аномалии развития матки, акушерские осложнения (гипертензия, кровотечение во время беременности, инфекция, многоводие), инфекция генитального тракта, наследственные генетические расстройства, антифосфолипидный синдром. И если некоторые факторы риска (социально-экономический статус, наследственность, аномалии развития половых органов и т.д.) являются немодифицируемыми, то инфекция, дисгормональные нарушения или приобретенная патология системы гемостаза могут быть прогнозируемы и предотвратимы. Роль инфекции значима более всего как причины преждевременного разрыва плодных оболочек. Профилактика и лечение хронической генитальной инфекции [20] являются залогом профилактики ПРПО.
Внутриутробные инфекции – группа заболеваний плода и новорожденного, развивающихся вследствие заражения в дородовом периоде или в родах. Внутриутробные инфекции могут приводить к гибели плода, самопроизвольному аборту, задержке внутриутробного развития, преждевременным родам, формированию врожденных пороков, поражению внутренних органов и ЦНС. Методы диагностики внутриутробных инфекций включают микроскопические, культуральные, иммуноферментные, молекулярно-биологические исследования. Лечение внутриутробных инфекций проводится с использованием иммуноглобулинов, иммуномодуляторов, противовирусных, антибактериальных препаратов.

Общие сведения
Внутриутробные инфекции – патологические процессы и заболевания, обусловленные антенатальным и интранатальным инфицированием плода. Истинная распространенность внутриутробных инфекций не установлена, однако, согласно обобщенным данным, с врожденными инфекциями рождается не менее 10% новорожденных. Актуальность проблемы внутриутробных инфекций в педиатрии обусловлена высокими репродуктивными потерями, ранней неонатальной заболеваемостью, приводящей к инвалидизации и постнатальной гибели детей. Вопросы профилактики внутриутробных инфекций лежат в плоскости рассмотрения акушерства и гинекологии, неонатологии, педиатрии.

Причины внутриутробных инфекций
Внутриутробные инфекции развиваются в результате инфицирования плода в дородовом периоде или непосредственно во время родов. Обычно источником внутриутробной инфекции для ребенка выступает мать, т. е. имеет место вертикальный механизм передачи, который в антенатальном периоде реализуется трансплацентарным или восходящим (через инфицированные околоплодные воды) путями, а в интранатальном - аспирационным или контактным путями.
Реже происходит ятрогенное инфицирование плода в период беременности при проведении женщине инвазивной пренатальной диагностики (амниоцентеза, кордоцентеза, биопсии ворсин хориона), введении плоду препаратов крови через сосуды пуповины (плазмы, эритроцитарной массы, иммуноглобулинов) и т. д.
В антенатальном периоде инфицирование плода обычно связано с вирусными агентами (вирусами краснухи, герпеса, цитомегалии, гепатита В и С, Коксаки, ВИЧ) и внутриклеточными возбудителями (токсоплазмоза, микоплазмоза).
В интранатальном периоде чаще происходит микробная контаминация, характер и степень которой зависит от микробного пейзажа родовых путей матери. Среди бактериальных агентов наиболее распространены энтеробактерии, стрептококки группы В, гонококки, синегнойная палочки, протей, клебсиелла и др. Плацентарный барьер непроницаем для большинства бактерий и простейших, однако при повреждении плаценты и развитии фетоплацентарной недостаточности, может произойти антенатальное микробное инфицирование (например, возбудителем сифилиса). Кроме этого, не исключается и интранатальное вирусное заражение.
Факторами возникновения внутриутробных инфекций служат отягощенный акушерско-гинекологический анамнез матери (неспецифические кольпиты, эндоцервициты, ЗППП, сальпингофориты), неблагополучное течение беременности (угроза прерывания, гестозы, преждевременная отслойка плаценты) и инфекционная заболеваемость беременной. Риск развития манифестной формы внутриутробной инфекции существенно выше у недоношенных детей и в том случае, когда женщина инфицируется первично во время беременности.
Известно, что тяжесть проявлений инфекционного процесса у беременной и у плода может не совпадать. Бессимптомное или малосимптомное течение инфекции и у матери может вызвать тяжелые поражения плода, вплоть до его гибели. Это связано с повышенным тропизмом вирусных и микробных возбудителей к эмбриональным тканям, преимущественно ЦНС, сердца, органа зрения.
Классификация
Этиологическая структура внутриутробных инфекций предполагает их деление на:
- вирусные (вирусный гепатит, герпес, краснуха, ОРВИ, цитомегалия, эпидемический паротит, энтеровирусная инфекция)
- бактериальные (туберкулез, сифилис, листериоз, сепсис)
- паразитарные и грибковые (микоплазмоз, токсоплазмоз, хламидиоз, кандидоз и др.)
Для обозначения группы наиболее распространенных внутриутробных инфекций используется аббревиатура TORCH-синдром, объединяющий токсоплазмоз (toxoplasmosis), краснуху (rubella), цитомегалию (cytomegalovirus), герпес (herpes simplex). Буквой О (other) обозначаются другие инфекции, в числе которых - вирусные гепатиты, ВИЧ-инфекция, ветряная оспа, листериоз, микоплазмоз, сифилис, хламидиоз и др.).
Симптомы внутриутробных инфекций
Наличие внутриутробной инфекции у новорожденного может быть заподозрено уже во время родов. В пользу внутриутробного инфицирования может свидетельствовать излитие мутных околоплодных вод, загрязненных меконием и имеющих неприятный запах, состояние плаценты (полнокровие, микротробозы, микронекрозы). Дети с внутриутробной инфекцией часто рождаются в состоянии асфиксии, с пренатальной гипотрофией, увеличенной печенью, пороками развития или стигмами дисэмбриогенеза, микроцефалией, гидроцефалией. С первых дней жизни у них отмечается желтуха, элементы пиодермии, розеолезных или везикулезных высыпаний на коже, лихорадка, судорожный синдром, респиратрные и кардиоваскулярные расстройства.
Ранний неонатальный период при внутриутробных инфекциях нередко отягощается интерстициальной пневмонией, омфалитом, миокардитом или кардитом, анемией, кератоконъюнктивитом, хориоретинитом, геморрагическим синдромом и др. При инструментальном обследовании у новорожденных могут обнаруживаться врожденная катаракта, глаукома, врожденные пороки сердца, кисты и кальцификаты мозга.
В перинатальном периоде у ребенка отмечаются частые и обильные срыгивания, мышечная гипотония, синдром угнетения ЦНС, серый цвет кожных покровов. В поздние сроки при длительном инкубационном периоде внутриутробной инфекции возможно развитие поздних менингитов, энцефалитов, остеомиелита.
Рассмотрим проявления основных внутриутробных инфекций, составляющих TORCH-синдром.
Врождённый токсоплазмоз
Внутриутробное инфицирование одноклеточным протозойным паразитом Toxoplasma Gondii приводит к тяжелым поражениям плода – задержке развития, врожденным порокам развития мозга, глаз, сердца, скелета.
После рождения в остром периоде внутриутробная инфекция проявляется лихорадкой, желтухой, отечным синдромом, экзантемой, геморрагиями, диареей, судорогами, гепатоспленомегалией, миокардитом, нефритом, пневмонией. При подостром течении доминирую признаки менингита или энцефалита. При хронической персистенции развивается гидроцефалия с микроцефалией, иридоциклит, косоглазие, атрофия зрительных нервов. Иногда встречаются моносимптомные и латентные формы внутриутробной инфекции.
К числу поздних осложнений врожденного токсоплазмоза относятся олигофрения, эпилепсия, слепота.
Врождённая краснуха
Внутриутробная инфекция возникает из-за заболевания краснухой при беременности. Вероятность и последствия инфицирования плода зависят от гестационного срока: в первые 8 недель риск достигает 80%; последствиями внутриутробной инфекции могут служить самопроизвольное прерывание беременности, эмбрио- и фетопатии. Во II триместре риск внутриутробного инфицирования составляет 10-20%, в III – 3-8%.
Дети с внутриутробной инфекцией обычно рождаются недоношенными или с низкой массой тела. Для периода новорожденности характерна геморрагическая сыпь, длительная желтуха.
Классические проявления врожденной краснухи представлены триадой Грега: поражением глаз (микрофтальмией, катарактой, глаукомой, хориоретинитом), ВПС (открытым артериальным протоком, ДМПП, ДМЖП, стенозом легочной артерии), поражением слухового нерва (сенсоневральной глухотой). В случае развития внутриутробной инфекции во второй половине беременности у ребенка обычно имеется ретинопатия и глухота.
Кроме основных проявлений врожденной краснухи, у ребенка могут выявляться и другие аномалии: микроцефалия, гидроцефалия, расщелины нёба, гепатит, гепатоспленомегалия, пороки развития мочеполовой системы и скелета. В дальнейшем внутриутробная инфекция напоминает о себе отставанием ребенка в физическом развитии, ЗПР или умственной отсталостью.
Врождённая цитомегалия
Внутриутробное заражение цитомегаловирусной инфекцией может приводить к локальному или генерализованному поражению многих органов, иммунодефициту, гнойно-септическим осложнениям. Врожденные дефекты развития обычно включают микроцефалию, микрогирию, микрофтальмию, ретинопатию, катаракту, ВПС и др. Неонатальный период врожденной цитомегалии осложняется желтухой, геморрагическим синдромом, двусторонней пневмонией, интерстициальным нефритом, анемией.
К отдаленным последствиям внутриутробной инфекции относятся слепота, нейросенсорная глухота, энцефалопатия, цирроз печени, пневмосклероз.
Врождённая герпетическая инфекция
Внутриутробная герпес-инфекция может протекать в генерализованной (50%), неврологической (20%), слизисто-кожной форме (20%).
Генерализованная внутриутробная врожденная герпетическая инфекция протекает с выраженным токсикозом, респираторным дистресс-синдромом, гепатомегалией, желтухой, пневмонией, тромбоцитопенией, геморрагическим синдромом. Неврологическая форма врожденного герпеса клинически проявляется энцефалитом и менингоэнцефалитом. Внутриутробная герпес-инфекция с развитием кожного синдрома сопровождается появлением везикулярной сыпи на кожных покровах и слизистых оболочках, в т. ч. внутренних органов. При наслоении бактериальной инфекции развивается сепсис новорожденных.
Внутриутробная герпес-инфекция у ребенка может приводить к формированию пороков развития - микроцефалии, ретинопатии, гипоплазии конечностей (кортикальной карликовости). В числе поздних осложнений врожденного герпеса - энцефалопатия, глухота, слепота, задержка психомоторного развития.
Диагностика
В настоящее время актуальной задачей является пренатальная диагностика внутриутробных инфекций. С этой целью на ранних сроках беременности проводится микроскопия мазка, бактериологический посев из влагалища на флору, ПЦР-исследование соскоба, обследование на TORCH-комплекс. Беременным из группы высокого риска по развитию внутриутробной инфекции показана инвазивная пренатальная диагностика (аспирация ворсин хориона, амниоцентез с исследованием амниотической жидкости, кордоцентез с исследованием пуповинной крови).
Возможно выявление эхографических маркеров внутриутробных инфекций с помощью акушерского УЗИ. К косвенным эхографическим признакам внутриутробного инфицирования относятся маловодие или многоводие; наличие гиперэхогенной взвеси в околоплодных водах или амниотических тяжей; гипоплазия ворсин хориона, плацентит; преждевременное старение плаценты; отечный синдром плода (асцит, перикардит, плеврит), гепатоспленомегалия, кальцификаты и пороки развития внутренних органов и др. В процессе допплерографического исследования кровотока выявляются нарушения плодово-плацентарного кровотока. Кардиотокография обнаруживает признаки гипоксии плода.
После рождения ребенка с целью достоверной верификации этиологии внутриутробной инфекции используются микробиологические (вирусологические, бактериологические), молекулярно-биологические (ДНК-гибридизация, ПЦР), серологические (ИФА) методики обследования. Важное диагностическое значение имеет гистологическое исследование плаценты.
По показаниям новорожденные с внутриутробными инфекциями в первые сутки жизни должны быть осмотрены детским неврологом, детским кардиологом, детским офтальмологом и др. специалистами. Целесообразно провести ЭхоКГ, нейросонографию, офтальмоскопию, исследование слуха методом вызванной отоакустической эмиссии.
Лечение внутриутробных инфекций
Общие принципы лечения внутриутробных инфекций предполагают проведение иммунотерапии, противовирусной, антибактериальной и посиндромной терапии.
Иммунотерапия включает применение поливалентных и специфических иммуноглобулинов, иммуномодуляторов (интерферонов). Противовирусная терапия направленного действия осуществляется, главным образом, ацикловиром. Для противомикробной терапии бактериальных внутриутробных инфекций используются антибиотики широкого спектра действия (цефалоспорины, аминогликозиды, карбапенемы), при микоплазменной и хламидийной инфекциях – макролиды.
Посиндромная терапия внутриутробных инфекций направлена на купирование отдельных проявлений перинатального поражения ЦНС, геморрагического синдрома, гепатита, миокардита, пневмонии и т. д.
Прогноз и профилактика
При генерализованных формах внутриутробных инфекций летальность в неонатальном периоде достигает 80%. При локальных формах возникают серьезные поражения внутренних органов (кардиомиопатии, ХОБЛ, интерстициальный нефрит, хронический гепатит, цирроз и т. д.). Практически во всех случаях внутриутробные инфекции приводят к поражению ЦНС.
Профилактика внутриутробных инфекций заключается в проведении предгравидарной подготовки, лечении ЗППП до наступления беременности, исключении контактов беременной с инфекционными больными, коррекции программы ведения беременности у женщин групп риска. Женщины, ранее не болевшие краснухой и не получавшие прививки против краснухи, должны быть вакцинированы не позднее, чем за 3 месяца до предполагаемой беременности. В ряде случаев внутриутробные инфекции могут являться основанием для искусственного прерывания беременности.
Внутриутробная пневмония – воспаление легочной ткани, возникшее антенатально, сопровождающееся развитием клинических проявлений в первые 72 часа жизни ребенка. Проявляется выраженной дыхательной недостаточностью, явлениями респираторного дистресс-синдрома, интоксикацией, неврологическими нарушениями вследствие отека мозга и др. Внутриутробная пневмония диагностируется рентгенологически, лабораторные исследования позволяют выявить конкретного возбудителя инфекции. Показана этиотропная терапия (антибиотики, противовирусные препараты и др.), кислородотерапия, коррекция симптомов полиорганной недостаточности.
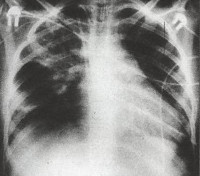
Общие сведения
Внутриутробная пневмония – одна из наиболее часто встречающихся патологий в структуре внутриутробных инфекций. Примерно 30% всех внутриутробных пневмоний протекает в виде локализованных форм, в остальных случаях воспаление легких у новорожденных возникает в рамках генерализованной внутриутробной инфекции. В настоящее время внутриутробные пневмонии продолжают представлять опасность. Средний показатель заболеваемости – около 2 случаев на 1000 новорожденных, также на долю заболевания приходится до 80-90% младенческой смертности. Отдельный акцент делается на внутриутробной пневмонии, вызванной условно-патогенной флорой. Во-первых, оппортунистическим микроорганизмам, как правило, не уделяется должного внимания. Во-вторых, именно они часто остаются резистентными к терапии.
Внутриутробная пневмония остается актуальной проблемой современной педиатрии. Даже будучи успешно вылеченной, болезнь наносит серьезный удар по детскому иммунитету. Впоследствии любая простуда легко может осложняться пневмонией. Если диагностика была запоздалой, высок риск развития осложнений, опасных для жизни (плеврит, сепсис и др.). Часто у детей, перенесших внутриутробную пневмонию, развивается спаечный процесс в плевре, что ведет к хронической дыхательной недостаточности с неизбежной инвалидностью.

Причины внутриутробной пневмонии
Внутриутробная пневмония одинаково часто вызывается бактериями и вирусами, реже – бактериально-вирусными ассоциациями и грибами. Бактерии, наиболее часто являющиеся причинами инфекции, – стрептококк, стафилококк, энтерококк, кишечная палочка, микоплазма и др. Вирусная внутриутробная пневмония развивается, как правило, при участии вирусов TORCH-группы, вирусов гриппа и др. Грибковая этиология связана с грибами рода Candida. Особую роль играют ИППП, которые также могут быть причиной заболевания. Встречается также врожденная сифилитическая пневмония.
Помимо причин заболевания, существует множество факторов риска, способствующих развитию внутриутробной пневмонии. Отдельно выделяют факторы риска со стороны матери и со стороны плода. К акушерско-гинекологическим патологиям, повышающим вероятность развития заболевания, относятся аборты и выкидыши в анамнезе женщины, патологии родов, гестозы и хронические заболевания малого таза, в том числе вследствие широкого применения внутриматочных контрацептивов. К факторам риска со стороны плода относится недоношенность и низкая масса ребенка при рождении, воспалительные процессы в плаценте и фетоплацентарная недостаточность.
Существует два пути заражения плода – восходящий и гематогенный. Первый из них подразумевает наличие у матери инфекции внутренних половых органов, чаще бактериальной природы. Гематогенный путь инфицирования – это трансплацентарное проникновение возбудителя через пупочную вену в кровь плода, характерное в большей степени для внутриутробной пневмонии вирусной этиологии. Независимо от ворот инфекции, микроорганизм попадает в кровь плода и уже оттуда достигает легочной ткани. Поскольку в утробе матери ребенок не дышит воздухом, инфекционный агент остается в тканях бессимптомно до момента родов. С первых вдохом кровоснабжение в легких резко возрастает. Именно этот момент является пусковым, и внутриутробная пневмония начинает проявляться клинически.
Классификация внутриутробных пневмоний
Этиологически выделяют бактериальную, вирусную и грибковую внутриутробную пневмонию, иногда встречаются бактериально-вирусные инфекции. По степени тяжести заболевание делится на легкую, средней тяжести и тяжелую формы. В зависимости от момента заражения внутриутробная пневмония бывает врожденной и интранатальной, когда инфицирование происходит в момент прохождения плода по родовым путям. Течение заболевания может быть острым и затяжным, с осложнениями и без. Различают легочные осложнения в виде пневмоторакса, ателектаза, абсцедирования легкого, а также внелегочные осложнения, основными из которых являются менингит, поражение оболочек сердца и сепсис. Отдельно выделяют 3 степени дыхательной недостаточности.
Симптомы внутриутробной пневмонии
Часто развиваются осложнения со стороны легких, такие как пневмоторакс, ателектаз легкого, респираторный дистресс-синдром, абсцессы легкого, сепсис. Внутриутробная пневмония редко встречается как локализованное заболевание. В связи с этим всегда имеются другие, внелегочные симптомы внутриутробных инфекций: со стороны нервной, сердечно-сосудистой, пищеварительной системы, органов слуха и зрения. У недоношенных детей заболевание протекает тяжелее, вероятность осложнений всегда выше.
Неврологическая симптоматика представлена запрокидыванием головы назад, повышением или снижением мышечного тонуса. Среди осложнений – менингит, который особенно часто встречается при микоплазменной внутриутробной пневмонии. Неврологические расстройства связаны в первую очередь с отеком мозговых оболочек, причиной которого является дыхательная недостаточность. Примерно у половины заболевших детей диагностируются гастроинтестинальные нарушения, в частности, срывания и позывы на рвоту, метеоризм, парез кишечника. Таким образом, при внутриутробной пневмонии речь часто идет о полиорганной недостаточности, основные причины которой – генерализация инфекции и общее нарушение кровообращения.
Диагностика внутриутробной пневмонии
Дыхательная недостаточность легко выявляется при физикальном осмотре ребенка. На рентгенограмме легких заметно усиление легочного рисунка, перибронхиальные изменения, многочисленные очаги инфильтрации легочной ткани. Изменения на рентгенограмме сохраняются до месяца с момента начала острой фазы внутриутробной пневмонии. В тяжелых случаях инфекции возможно отсутствие признаков заболевания по данным рентгенографии легких в течение первых трех дней.
Лабораторная диагностика внутриутробной пневмонии включает общий и биохимический анализ крови, мазок из зева на флору, микробиологическое исследование трахеобронхиального аспирата, анализ отделяемого из полости носа. Анализ крови позволяет выявить признаки воспалительного процесса, анемию разной степени, гипербилирубинемию и др. Обязательно проводятся серологические исследования (ИФА-диагностика) для обнаружения различных классов антител к конкретным возбудителям. В отношении диагностики вирусной этиологии внутриутробной пневмонии эффективен метод ПЦР. Необходимо выявление первичного очага инфекции у матери.
Лечение внутриутробной пневмонии
Лечение проводится в отделении интенсивной терапии или реанимации новорожденных. В зависимости от выраженности дыхательной недостаточности используются различные методы кислородной поддержки: кислородная маска, ИВЛ. Этиотропная терапия внутриутробной пневмонии – антибиотики, противовирусные, противогрибковые препараты – может назначаться эмпирически, либо подбираться исходя из других признаков, патогномоничных для конкретных внутриутробных инфекций (краснуха, токсоплазмоз, хламидиоз и др.). Список антибиотиков ограничен возрастом, противопоказано применение препаратов аминогликозидного ряда.
Недоношенным детям обязательно назначение сурфактантов, способствующих развитию легочной ткани и расправлению спавшихся альвеол. Санация трахеобронхиального дерева проводится практически всем детям, частота регулируется тяжестью состояния. Проводятся дегидратационные мероприятия, детоксикация солевыми растворами, коррекция ацидоза, анемии, нарушений свертываемости крови, симптоматическая терапия. Переливание эритроцитарной массы осуществляется по показаниям. По окончании острой фазы внутриутробной пневмонии показана физиотерапия.
Прогноз и профилактика внутриутробной пневмонии
Прогноз внутриутробной пневмонии определяется конкретной нозологией и тяжестью состояния. Заболевание было и остается одной из основных причин детской смертности. Более благоприятное течение отмечается при внутриутробной пневмонии стафилококковой этиологии (кроме золотистого стафилококка) и вирусного генеза. Частота летального исхода выше в случае инфицирования энтерококками, кишечной палочкой, микоплазмой, золотистым стафилококком; особенно опасны бактериально-вирусные ассоциации. Также уровень смертности повышается в случае развития осложнений, в частности, сепсиса.
Первичная профилактика внутриутробной пневмонии сводится к определению возможных факторов риска заболевания у беременной женщины. Это обеспечит высокую настороженность и готовность медицинского персонала к реанимационным мероприятиям непосредственно в родовом зале. Также необходима своевременная диагностика внутриутробных инфекций, поскольку клиника многих из них включает поражение легких в виде внутриутробной пневмонии. Всем детям, перенесшим заболевание в период новорожденности, проводится профилактика повторной пневмонии: витаминотерапия, массаж, гимнастика и др.
Кафедра акушерства и гинекологии №1 Башкирского государственного медицинского университета
Кафедра акушерства и гинекологии №1 Башкирского государственного медицинского университета
Кафедра акушерства и гинекологии №1 Башкирского государственного медицинского университета
Кафедра акушерства и гинекологии №1 Башкирского государственного медицинского университета
Кафедра акушерства и гинекологии №1 Башкирского государственного медицинского университета
Кафедра акушерства и гинекологии №1 Башкирского государственного медицинского университета
Кафедра акушерства и гинекологии №1 Башкирского государственного медицинского университета;
Клинический родильный дом №4, Уфа
Внутриутробное инфицирование плода: современный взгляд на проблему
Журнал: Российский вестник акушера-гинеколога. 2013;13(5): 16‑20
Хамадьянов У.Р., Русакова Л.А., Хамадьянова А.У., Тихонова Т.Ф., Хамадьянова С.У., Галимов А.И., Иваха В.И. Внутриутробное инфицирование плода: современный взгляд на проблему. Российский вестник акушера-гинеколога. 2013;13(5):16‑20.
Khamad'ianov UR, Rusakova LA, Khamad'ianova AU, Tikhonova TF, Khamad'ianova SU, Galimov AI, Ivakha VI. Intrauterine fetal infection: the present view of the problem. Russian Bulletin of Obstetrician-Gynecologist. 2013;13(5):16‑20. (In Russ.).
Кафедра акушерства и гинекологии №1 Башкирского государственного медицинского университета
В статье на основании данных современной литературы и результатов ранее выполненных собственных исследований представлены вопросы этиологии и патогенеза, диагностики, лечения и профилактики внутриутробной инфекции (ВУИ). Особое внимание обращено на роль инфекционного фактора в реализации ВУИ и значение цитокинового статуса. Приведена интерпретация диагностических тестов при ВУИ на современном этапе.
Кафедра акушерства и гинекологии №1 Башкирского государственного медицинского университета
Кафедра акушерства и гинекологии №1 Башкирского государственного медицинского университета
Кафедра акушерства и гинекологии №1 Башкирского государственного медицинского университета
Кафедра акушерства и гинекологии №1 Башкирского государственного медицинского университета
Кафедра акушерства и гинекологии №1 Башкирского государственного медицинского университета
Кафедра акушерства и гинекологии №1 Башкирского государственного медицинского университета
Кафедра акушерства и гинекологии №1 Башкирского государственного медицинского университета;
Клинический родильный дом №4, Уфа
Прогрессирующий рост числа случаев внутриутробного инфицирования плода является одной из наиболее актуальных проблем современного акушерства и перинатологии. Этому способствует полиэтиологичность данной патологии, отсутствие четкой взаимосвязи между выраженностью клинических проявлений инфекции у матери и степенью поражения плода, многофакторное воздействие инфекционного агента на плод.
Несмотря на повышенное внимание к проблеме внутриутробной инфекции (ВУИ), нерешенными остаются многие вопросы. В дальнейших поисках и разработке нуждаются вопросы диагностики, лечения и профилактики ВУИ. До сих пор нет четких критериев лечебной тактики, не обобщены данные об эффективности комплексной терапии.
Эпидемиология, этиология и патогенез внутриутробной инфекции
В развитии инфекционного процесса у плода имеют значение вид возбудителя, его вирулентность, пути проникновения инфекции от матери к плоду, защитные резервы организма матери и способность плода к иммунному ответу [11].
Известно, что большинство бактерий существуют в природе в виде специфически организованных биопленок (biofilms) [2, 25, 27]. Такая форма существования создает бактериям массу преимуществ. Бактерии в биопленках имеют повышенную выживаемость в присутствии агрессивных веществ, факторов иммунной защиты и антибиотиков [27]. В этой связи одной из основных проблем практической медицины становится проблема лечения заболеваний микробного происхождения.
В нашем исследовании [15, 17] по результатам бактериологического анализа видового состава вагинального биотопа было выявлено наиболее сильное влияние Streptococcus faecalis (p=0,00171), E. coli (p=0,01424) и Staphylococcus epidermidis (p=0,02714) на реализацию внутриутробного инфицирования плода. При оценке возбудителей, выявленных в цервикальном канале беременных путем полимеразной цепной реакции (ПЦР) и иммуноферментного анализа (ИФА), установлено следующее: в группе без реализации ВУИ микоплазмы, хламидии и уреаплазмы составили 8%, ЦМВ - 20%, ВПГ - 36%, кандида - 3%, ассоциации - 60%. При анализе группы новорожденных с реализацией ВУИ были выделены наиболее частые возбудители. Так, микоплазмы, хламидии и ВПГ встречались в 50%, ЦМВ-инфекция была выявлена в 45% случаев, реже встречались уреаплазмы (20%) и кандида (15%), ассоциации наблюдались в 95%. Частота обнаружения патогенных возбудителей у новорожденных с признаками ВУИ была выше, чем у пациентов без реализации инфекции.
Основным источником инфекции при ВУИ является мать ребенка, из организма которой возбудитель проникает в организм плода (вертикальный механизм передачи). При этом инфицирование происходит как восходящим, трансплацентарным и трансовариальным путями, так и контактным, и аспирационным (непосредственно во время родов) путями. Причем для антенатальных инфекций наиболее типичен гематогенный, а для интранатальных - восходящий пути инфицирования [4, 10, 20, 21].
Влияние ВУИ на эмбрион и плод заключается в воздействии комплекса следующих факторов [22]:
1. Патологическое действие микроорганизмов и их токсинов (инфекционное заболевание, гипоксия плода, задержка развития плода).
2. Нарушение процесса имплантации и плацентации (низкая плацентация, предлежание плаценты).
3. Снижение метаболических процессов и иммунной защиты плода.
В патогенезе возникновения и развития ВУИ особое значение имеет срок беременности [13, 22]. Плод до 14 нед беременности не реагирует на инфекционные антигены, так как у него отсутствуют иммунокомпетентные клетки, иммуноглобулины и не проявляются иммунные реакции. С началом II триместра беременности механизм воздействия восходящей инфекции меняется из-за слияния decidua vera и deciduas capsularis в единый комплекс deciduas parietalis. В это время восходящая инфекция может проникнуть к плоду из влагалища или шеечного канала. С этого срока беременности внутренний зев шеечного канала соприкасается с водными оболочками плода и при наличии инфекции микроорганизмы проникают в околоплодные воды. Антимикробные свойства амниотическая жидкость приобретает лишь после 20-й недели беременности, когда в ответ на воздействие инфекционного агента развивается воспалительная пролиферативная реакция, ограничивающая дальнейшее проникновение инфекции, благодаря появлению лизоцима, комплемента, интерферонов, иммуноглобулинов [1, 22]. В III триместре беременности антибактериальная защита околоплодных вод возрастает. В этот период в воспалительной реакции тканей плода преобладает роль экссудативного компонента, когда в ответ на проникновение инфекции развиваются воспалительные лейкоцитарные реакции у плода (энцефалит, гепатит, пневмония, интерстициальный нефрит) [22].
Особенно опасным при ВУИ во II и III триместрах беременности является повреждение мозга плода, что может приводить к умственной отсталости, задержке психомоторного развития детей [3, 7]. Внутриутробное поражение возбудителями инфекции структур ЦНС у плода сопровождается различными тяжелыми нарушениями в формировании мозга (гидроцефалия, субэпендимальные кисты, кистозная дегенерация вещества мозга, аномалии развития коры, микроцефалия). Возможно также развитие вентрикулита (деформация сосудистого сплетения, неоднородность или удвоение отражения от эпендимы желудочков) [11].
Таким образом, инфицирование плода в более поздние сроки беременности не приводит, как правило, к формированию грубых пороков развития, но может нарушать функциональные механизмы дифференцировки клеток и тканей [10, 11, 13].
Изменения состояния плода и функционирования фетоплацентарной системы, вызванные внутриутробным инфицированием плода, отражаются на составе и свойствах амниотической жидкости [1, 9, 26, 30]. При попадании в амниотическую жидкость инфекционного агента происходит его беспрепятственное размножение с последующим развитием хориоамнионита [1, 9]. Плод оказывается в инфицированной среде, что создает благоприятные условия для заражения плода контактным путем, т.е. через кожу, слизистые оболочки, респираторный и желудочно-кишечный тракты.
1. При заглатывании и аспирации инфицированных вод у новорожденного появляются признаки внутриутробной инфекции (пневмония, энтероколит, везикулез, омфалит, конъюнктивит и др.).
3. Многоводие при внутриутробном инфицировании обычно носит вторичный характер и служит проявлением поражения почек или мочевыводящих путей плода. Причиной его развития является и изменение соотношения процессов продукции и резорбции околоплодных вод клетками амниотического эпителия на фоне амнионита.
4. В генезе симптомокомплекса плацентарной недостаточности при ВУИ основная роль принадлежит сосудистым расстройствам.
5. Типичным проявлением внутриутробного инфицирования служат невынашивание беременности и преждевременные роды [24]. Преждевременное развитие родовой деятельности и несвоевременный разрыв плодных оболочек обусловлены действием бактериальных фосфолипаз, запускающих простагландиновый каскад, и повреждающим действием воспалительных токсинов на плодные оболочки.
6. В связи с тем что фосфолипазы грамотрицательных бактерий способствуют разрушению сурфактанта в легких плода, у новорожденного развиваются респираторные расстройства.
В современной литературе [4, 9, 29] имеется немало работ, посвященных изучению взаимосвязи иммунологических показателей и тяжести инфекционно-воспалительного процесса во время беременности. Все чаще в зарубежной и отечественной литературе появляются данные о взаимосвязи бактериальной инвазии и синтеза цитокинов клетками амниона, хориона, децидуальной и плодовыми тканями [5, 29]. Размножение микроорганизмов в амниотической жидкости приводит к повышению уровня липополисахаридов, которые активируют синтез цитокинов клетками фетального трофобласта. Перспективным при ВУИ представляется изучение изменений в системе цитокинов, которая обеспечивает процессы межклеточной кооперации, роста и дифференцировки лимфоидных клеток, гемопоэза и нейроиммуноэндокринных взаимодействий. Цитокины в предымплантационном периоде и в ходе развития беременности активно продуцируются множеством материнских и эмбриональных клеток, в частности, децидуальными клетками матки и клетками трофобласта. При этом установлено, что клеточные культуры обладают неодинаковой способностью к синтезу цитокинов под влиянием липополисахаридов. Так, фактор некроза опухоли (ФНО) продуцируется клетками амниона, интерлейкины (ИЛ)-6 и ИЛ-8 - амнионом и хорионом, а ИЛ-1 продуцируется только хорионом [9, 11, 28]. По данным Н.В. Орджоникидзе [14], из множества провоспалительных (ИЛ-1, ИЛ-2, ИЛ-6, ИЛ-8, ИЛ-15, ФНО и др.) и противовоспалительных (ИЛ-4, ИЛ-10, ИЛ-13, трансформирующий фактор роста и др.) цитокинов основными маркерами воспалительного процесса в тканях и органах человека считают ИЛ-1, ИЛ-6, ИЛ-10, ФНО [9, 16, 28].
Клиническая характеристика внутриутробной инфекции
В предымплантационный период под воздействием инфекционного агента зародыш гибнет (альтеративное воспаление) или продолжает развиваться.
Инфекционное повреждение эмбриона на 3-12-й неделе обычно связано с вирусной инфекцией, свободно проникающей через хорион. Плод еще не имеет систем противоинфекционной защиты, и в период органогенеза, плацентации ВУИ приводит к формированию пороков развития (тератогенный) или гибели эмбриона (эмбриотоксический эффект) [5, 23].
Инфекционные фетопатии возникают с 16-27-й недели гестации, когда происходит генерализация инфекции у плода, формирование псевдопороков (фиброэластоз миокарда, поликистоз легких, гидроцефалия, гидронефроз). При заражении после 28 нед плод приобретает способность к специфической локальной реакции на внедрение возбудителя, в результате возможны ВУИ (энцефалит, пневмония, гепатит, интерстициальный нефрит), недонашивание беременности, задержка внутриутробного развития, гибель плода [2, 3, 10].
В настоящее время выделяют следующие типы внутриутробных поражений при ВУИ [20, 21]:
- бластопатия - при сроке гестации 0-14 дней; возможны гибель эмбриона, самопроизвольный выкидыш или формирование системной патологии, сходной с генетическими заболеваниями;
- эмбриопатия - при сроке 15-75 дней; характерны пороки развития на органном или клеточном уровнях (истинные пороки), самопроизвольный выкидыш;
- ранняя фетопатия - при сроке 76-180 дней; характерно развитие генерализованной воспалительной реакции с преобладанием альтеративного и экссудативного компонентов и исходом в фиброзно-склеротические деформации органов (ложные пороки), прерывание беременности;
- поздняя фетопатия - при сроке 181 день до родов; возможно развитие манифестной воспалительной реакции с поражением различных органов и систем (гепатит, энцефалит, тромбоцитопения, пневмония).
ВУИ часто не имеет ярких клинических проявлений [4, 10, 15, 17]. Редко первые признаки у новорожденного имеются сразу после рождения, чаще проявляются в течение первых 3 сут жизни. При инфицировании в постнатальном периоде симптомы инфекционного процесса выявляются в более поздние сроки. Клинические появления врожденного бактериального или микотического поражения кожи у новорожденного могут иметь характер везикуло-пустулеза [4]. Конъюнктивит, ринит и отит, появившиеся на 1-3-е сутки жизни, также могут быть проявлениями ВУИ. Врожденная аспирационная пневмония может проявиться и на 2-3-й день жизни. С момента рождения у детей наблюдаются признаки дыхательной недостаточности: одышка, цианоз, часто притупление перкуторного звука и мелкопузырчатые влажные хрипы. Течение внутриутробной пневмонии тяжелое, поскольку в результате аспирации выключаются из дыхания обширные участки легкого (нижняя и средняя доли) вследствие обтурации бронхов инфицированными околоплодными водами, содержащими примесь мекония, чешуек кожи плода. Энтероколит у новорожденных возникает в результате проникновения возбудителя вместе с околоплодными водами в желудочно-кишечный тракт. Диспепсические явления обычно развиваются на 2-3-е сутки жизни. Характерны вялое сосание, срыгивание, вздутие кишечника, гепатоспленомегалия, расширение венозной сети передней брюшной стенки, частый жидкий стул. При микробиологическом исследовании кишечного содержимого преобладание клебсиелл, протея и синегнойной палочки. Поражение ЦНС при ВУИ у новорожденных может быть как первичным (менингит, энцефалит), так и вторичным, обусловленным интоксикацией. При поражении сосудистых сплетений боковых желудочков мозга развивается врожденная гидроцефалия. Необходимо уделять внимание таким симптомам, как вялость, плохое сосание, срыгивание, замедленное восстановление или вторичное снижение массы тела, задержка заживления пупочной ранки, развитие омфалита. Типичными симптомами инфекционной интоксикации у новорожденного являются нарушения дыхания и тканевого метаболизма. Отмечается бледно-цианотичная окраска кожных покровов с выраженным сосудистым рисунком. Интоксикация сопровождается нарушением экскреторной функции печени и почек, увеличением селезенки и периферических лимфоузлов.
Современные методы диагностики внутриутробных инфекций
Превалирование ВУИ среди причин неблагоприятных исходов, высокий уровень инфицированности у беременных и родильниц обусловливают необходимость поиска достоверных методов ее диагностики. Неспецифичность клинических проявлений ВУИ создает диагностические трудности, что диктует необходимость сочетанного применения клинических и лабораторных методов исследования. В последнее десятилетие основными методами диагностики ВУИ являются бактериологические и иммунологические [10, 11, 21].
Можно выделить 3 этапа в диагностике внутриутробного инфицирования: 1) диагностика во время беременности; 2) ранняя диагностика в момент рождения ребенка; 3) диагностика при развитии клинических признаков инфекции в раннем неонатальном периоде [12].
Любые изменения гомеостаза в организме матери находят свое отражение в клеточных и химических показателях амниотической жидкости, которые очень тонко характеризуют течение патологического процесса, в связи с чем амниотическая жидкость может служить важным диагностическим материалом [1, 6, 16]. По мнению И.В. Бахаревой [1], наиболее значимым в диагностике ВУИ является определение антимикробной активности амниотической жидкости, основанной на миграции в ней лейкоцитов при скоплении в околоплодной оболочке бактерий, превышающем 103 КОЕ/мл. Появление в околоплодных водах большого числа лейкоцитов, увеличение цитоза за счет эпителиоцитов без обнаружения микрофлоры могут свидетельствовать о ВУИ.
В настоящее время большое значение придается ультразвуковым методам исследования, с помощью которых можно определить косвенные признаки ВУИ плода (многоводие, вентрикуломегалия, микроцефалия, гепатомегалия, увеличение толщины плаценты, мелкодисперсная взвесь в околоплодных водах) и структурные изменения в различных органах [4, 11, 18, 26].
Нами был разработан необходимый перечень диагностических мероприятий с целью раннего выявления ВУИ [19].
В комплекс обследования беременных женщин вошли:
1. Общеклинический и биохимический анализы крови и мочи с определением стандартных показателей.
2. Определение возбудителей TORCH-комплекса с помощью ПЦР в вагинальных мазках, околоплодных водах.
3. Определение антител в крови к хламидиям, микоплазмам и уреаплазмам, ЦМВ и ВПГ методом ИФА.
4. Проведение аминного теста, pH-метрии влагалищного содержимого.
5. Бактериоскопическое исследование содержимого влагалища, цервикального канала и уретры.
6. Бактериологическое исследование материнской поверхности плаценты, околоплодных вод, содержимого кишечника.
7. Определение уровня провоспалительных (ИЛ-1β, ФНО) и противовоспалительного (ИЛ-10) цитокина в околоплодных водах, сыворотках венозной крови матери и пуповинной крови плода.
8. Ультразвуковое сканирование плода, околоплодных вод и плаценты.
9. Гистоморфологическое исследование плаценты.
В комплекс обследования новорожденных вошли:
1. Оценка по шкале Апгар, измерение массы тела и длины при рождении, динамика нарастания массы тела до выписки из родильного дома.
2. Определение антител в крови к хламидиям, микоплазмам и уреаплазмам, ЦМВ и ВПГ методом ИФА.
3. Бактериологическое исследование соскобов с конъюнктивы, задней стенки глотки и вульвы.
4. Выявление клинических признаков ВУИ совместно с врачом-неонатологом.
Комплексное исследование видового состава микроорганизмов родовых путей, околоплодных вод, плаценты, новорожденного, определение антигенов и антител к предполагаемому возбудителю в пуповинной крови и амниотической жидкости, гистологическое исследование последа позволяют определить путь инфицирования ребенка, природу возбудителя и уточнить объем дополнительных диагностических исследований при ВУИ, а также определить лечебно-профилактические мероприятия в раннем неонатальном периоде.
Читайте также:

