Волчанка можно пить алкоголь
Обновлено: 18.04.2024
Чтобы исследовать состояние у пациентов с СКВ, которые принимали или недавно прекратили принимать противомалярийные препараты, исследователи выявили 1573 потенциальных участника из долгосрочного наблюдательного когортного исследования в университетской клинике.
Из этой многочисленной группы было выделено 88 клинических случаев - пациентов, которые достигли клинической ремиссии в течение как минимум года и прекратили прием противомалярийной терапии.
Первая контрольная группа была представлена пациентами, которые достигли ремиссии и продолжали принимать лекарства. Также был произведен второй контроль, в результате чего общее количество участников исследования составило 173.
Все пациенты наблюдались не менее 2 лет.
Обострение СКВ было определено как любое увеличение показателей по шкале SLEDAI-2K, при значительном обострении – превышение нормы на 4 или более баллов.
Средний возраст исследуемых составил 44 года, средний возраст в контрольной группе - 46 лет.
Представителями обеих групп были преимущественно белокожие женщины.
Причины отмены препаратов включали собственную инициативу, ремиссию, а также токсическое повреждение сетчатки, кожи, слизистых оболочек и органов сердечно-сосудистой системы.
20 участников экспериментальной группы сообщили о неблагоприятных побочных эффектах противомалярийных препаратов, связанных с их высоким профилем токсичности.
Врачи также сравнили результаты 26 пожилых пациентов с волчанкой, которые принимали гидроксихлорохин в течение как минимум 5 лет до момента прекращения приема препарата, с 32 пациентами контрольной группы, которые продолжали принимать гидроксихлорохин на момент исследования.
Обострение СКВ произошло в 61,4% случаев по сравнению с 45,1% в контрольной группе (P = 0,002), причем наиболее распространенными вариантами обострений были обострения со стороны кожи и скелетно-мышечной системы.
После многомерного анализа риск обострения более чем в два раза возрастал у тех, кто прекратил лечение (отношение шансов, 2,26; 95% доверительный интервал, 1,24–4,11; P = 0,008).
Более чем в половине случаев (n = 46) противомалярийные препараты возобновляли после отмены, что в основном было связано с обострением заболевания.
Из группы пациентов, возобновивших лечение в связи с обострением СКВ: у 88% вновь был достигнут контроль над заболеванием \ произошло улучшение состояния, у оставшихся 12% случились новые обострения.
Из 88 пациентов 51 пациент резко прекратили прием терапии тогда, как 37 пациентов отмену препаратов производили постепенно.
У пациентов, придерживающихся постепенной отмены, было меньше обострений (45,9%) по сравнению с пациентами, прекратившими лечение внезапно (72,6%).
После многофакторного анализа риск обострения более чем в три раза увеличился для группы внезапной отмены лекарств (OR 3,42; 95% ДИ 1,26-9,26; P = 0,016).
Пациенты, снизившие дозу противомалярийных препаратов, позднее возобновили полноценную терапию по сравнению с группой резкой отмены лекарств (37,8% против 62,7%; P = 0,02).
Только у 5 пожилых пациентов из каждой группы - 19,2% в группе отмены и 15,6% в группе пролонгирования терапии произошел эпизод обострения СКВ (OR 1,28; 95% ДИ 0,31-5,30; P = 0,73). Большинство обострений были кожными и скелетно-мышечными по своей природе; ни в одной из групп не было развития серьезных патологических состояний.
Медленное снижение дозы или продолжение приема противомалярийных препаратов может помочь предотвратить обострение болезни у пациентов с СКВ, достигших клинической ремиссии в течение как минимум года.
У пожилых пациентов с СКВ, которые постепенно прекращают прием гидроксихлорохина, также отсутствует повышенный риск обострения болезни.

Разработчик сайтов, журналист, редактор, дизайнер, программист, копирайтер. Стаж работы — 25 лет. Область интересов: новейшие технологии в медицине, медицинский web-контент, профессиональное фото, видео, web-дизайн. Цели: максимально амбициозные.
- Запись опубликована: 14.05.2020
- Reading time: 1 минут чтения
К таким заболеваниям относятся ревматизм, рассеянный склероз, волчанка, некоторые виды диабета, воспаления внутренних органов, вызванные аутоиммунным процессом. Исследования показали, что при таких заболеваниях могут помочь небольшие дозы алкоголя.
Участники исследования выяснили, что небольшие дозы спиртного особенно полезны при ревматоидном артрите. Наблюдения за больными подтвердили содержащиеся в медицинской литературе сведения, что умеренное употребление спиртного при ревматических поражениях улучшает состояние здоровья.
Алкоголь полезен только в малых дозах, поэтому нужно соблюдать умеренность
Однако в больших дозах спиртное вызывает негативные последствия, отрицательно влияя на состояние организма. Оно отравляет внутренние органы, которые и так страдают от болезни. Особенно опасны чрезмерные дозы алкоголя при аутоиммунных заболеваниях печени. У таких больных за короткое время может начаться цирроз – болезнь, при которой орган теряет способность выполнять свои функции.
Нельзя употреблять спиртное больным аутоиммунными патологиями, которым назначены лекарства, несовместимые с алкоголем. В этом случае может развиться тяжелая реакция, которая приведёт к госпитализации или даже создаст угрозу для жизни. Поэтому, перед тем как лечится таким способом, нужно обязательно проконсультироваться у врача.
Здравствуйте. У меня красная волчанка, вроде как не системная, поражена только кожа рук. Сейчас болезнь заснула почти и начала снижать дозы лекарств. Интересует такой вопрос: мне придется всю жизнь пить лекарства либо можно делать перерывы в приеме. Можно ли по праздникам выпить вина, если да то как лучше поступить, пропустить прием несколько дней или пить таблетки как и пила. Переживаю за последствия и отказалась от спиртного вообще пока лечусь и начал интересовать этот вопрос.
Похожие и рекомендуемые вопросы
Не забывайте оценивать ответы врачей, помогите нам улучшить их, задавая дополнительные вопросы по теме этого вопроса.
Также не забывайте благодарить врачей.
Какие препараты вы принимаете?
как давно? С какой дозировки начинали, и какая дозировка препаратов на сегодня?
На основании одной кожи диагноз системной волчанки не поставили бы (было что то еще вначале? Были ли определены антитела?)
Что было с кожей.
Ниже картинку прикрепила, слово системная в СКВ, говорит, что поражает много систем (кровь в виде лейкопении, тромбоцитопении, анемии, нейтропении, почки - с неясной протенурией, сердце и легкие в виде плеврита и перикардита). Это все может встречаться в течении жизни, не в один временной промежуток.
Но на основании одной кожи и антител СКВ не устанавливается (это мои размышления в сторону задуматься, я не вижу всейй картины полностью, это если идти к врачам и разбираться в диагнозе.
Так и не написали как давно принимаете метипред, допустимая поддерживающая дозировка 8мг в сутки (2 таб).
С учетом отсутствия клиники на сегодня ( начинайте снижать метипред по 1/2 таб в неделю до 1 таб, далее по 1/4 таб в неделю до полной отмены)
Алена, я до сих пор сомневаюсь в правильности диагноза изначального, сохранились ли ото повреждений кожи, или остались рубцы или белые пятна, проводилась ли вам биопсия?
Метипред снижайте по 1/2 таб в 10 дней. (на 1 таб остановитесь на мес), потом решим убирать ли ее до конца.
после года приема метипреда его практически не возможно убрать.
Я сдавала анализы недавно, сейчас не в норме:
Антинуклеарный фактор титр 1: 1280
SS-B(La) 62,1
Былм отеки рук и лица, на лице были красные пятна, но не долго, несколько дней.
В основном только руки раньше отекали и были очень сухие, трескались, шелушились и появлялись красные пятна, которые сильно зудели. Долго заживали трещины.
Сейчас также руки иногда пересыхают и краснеют, рубцов и белых пятен нет, лицо не повреждено.
Биопсию не делали.
Обсудите с доктором который ведет назначение плаквенила (иммард) 200мг 2 таб,
Метипред снижайте, постепенно до полной отмены.
Поиск по сайту
Что делать, если у меня похожий, но другой вопрос?

Обзор
Автор
Редакторы

Эта Статья заслужила приз зрительских симпатий.
Однако есть заболевания, возможно, не столь смертельные, но куда сильнее бьющие по нам экономически. Это аутоиммунные заболевания, такие, как рассеянный склероз, системная красная волчанка или диабет 1-го типа. Если рак и инсульты чаще всего встречаются у пожилых людей, то аутоиммунные состояния обычно манифестируют (проявляются в виде симптомов) у молодых людей трудоспособного возраста и либо ложатся тяжким бременем на бюджет страны или больного (россияне, больные диабетом, если не получают инсулин от государства, тратят на поддержание собственной жизни от 1 до 5–6 тысяч рублей в месяц), либо, как в случае рассеянного склероза, просто ставят крест на карьере и жизни пациента.
Особенность аутоиммунных заболеваний состоит в том, что практически ни для одного из них мы за долгие годы исследований и экспериментов не научились достигать стойкой ремиссии. Текущие решения сводятся либо к поддерживающей терапии (как в случае с инсулинозависимым диабетом), либо к попыткам отсрочить терминальную стадию заболевания, на что нацелены препараты от рассеянного склероза. До недавнего времени ситуация выглядела довольно плачевно. Дополнительно усугубляет ее тот факт, что количество людей с аутоиммунными заболеваниями растет каждый год, и мы находимся на пороге настоящей эпидемии.
Однако там, где фармацевтическая отрасль терпит одну неудачу за другой, внезапно сама природа показала, куда смотреть исследователям и откуда брать по-настоящему работающее лекарство.
История вопроса
Чтобы понять, откуда возникла проблема с аутоиммунными заболеваниями, придется заглянуть далеко в прошлое.
Дело в изменившемся в ходе FET образе жизни человека. До этого мы жили небольшими группами, состоявшими не более чем из 50 особей, занимавшими довольно обширные пространства. К тому же мы постоянно меняли место жительства, нигде не оставались надолго. Культура гигиены была довольно низкой — зачем следить за чистотой убежища, если ты уже съел всех мамонтов вокруг и завтра надо искать новое место?
В ходе FET люди начали надолго оставаться на одном месте, формировать более крупные группы для защиты от набегов соплеменников. Скученность и загрязнение места обитания создали оптимальные условия для развития у нас инфекций. Начались эпидемии, которые были тем свирепее, чем больше был город и чем плотнее жили в нем люди.

Довольно долгое время, около 5000 лет, понадобилось человечеству, чтобы научиться справляться с инфекциями. Где-то раньше, где-то позже люди осознали важность гигиены для жизни и здоровья. Были эмпирически найдены лекарства от многих болезней. Можно сказать, весь прогресс медицины и человечества в целом происходил под постоянно довлеющим страхом новых эпидемий.

Рисунок 2. Обложка Le petit journal от 1 сентября 1912 года, посвященного эпидемии холеры в Индии и на Ближнем Востоке в начале 20-го века.
В настоящее время мы настолько чисты, насколько не были никогда в истории. Особенно хорошо это видно в развитых странах. Мы привыкли к тому, что во все дома подведена вода и всегда есть возможность принять ванную или душ. Мы пользуемся мылом, влажными салфетками, асептическими гелями. Мы даже моем наши дороги шампунем!
Казалось бы, ну чистые и чистые, что тут такого? При чем тут аутоиммунные заболевания? Оказывается, связь самая прямая.
Гигиеническая гипотеза
Этот переход стал возможен благодаря появлению антибиотиков и других высокоэффективных противопаразитических лекарств. В развитых странах он завершился к концу 20-го века. Если в середине века в Европе каждый третий житель был поражен гельминтами [1], то в настоящий момент обнаружение носителя этих паразитов скорее редкость. Россия в этом отношении практически не отстает от развитого мира благодаря нашим сильным гигиеническим традициям. Дополнительный вклад вносит городской образ жизни, централизованное снабжение очищенной водой, контроль качества пищи и так далее.

Рисунок 3. Обратное отношение между частотой инфекционных заболеваний и частотой иммунных расстройств с 1950 по 2000 годы. а — Изменение относительного количества заболевших различными инфекционными заболеваниями. б — Относительный рост заболеваемости аутоиммунными заболеваниями за тот же период.
Впоследствии многие исследователи показали то же самое на примере других аллергий и аутоиммунных реакций. К примеру, если детям из неблагополучных по гигиене регионов вроде Чили или Тайланда провести европейскую программу дегельминтизации, у них букетом высыпают аллергии [4].
Наверное, самым интересным примером тут является история с рассеянным склерозом [5–8]. Ученые решили посмотреть, что происходит, когда больной этим страшным заболеванием заражается гельминтами, и начали искать инфицированных червями пациентов с РС. Результаты были ошеломляющи. У пациентов, которые заражались определенными гельминтами (например, власоглавом Trichuris trichiura) течение заболевания практически останавливалось [6]. Во время инфекции у них на 95% снижалось количество новых бляшек в мозге (рис. 4). Результат, недостижимый ни одним современным методом терапии! Если же по каким-то причинам гельминтов требовалось удалить (например, развивалось острое воспалительное поражение кишечника), болезнь возобновлялась с той стадии, на которой остановилась при инфекции.

Рисунок 4. График появления новых бляшек в мозге (когортное исследование 2011 года). Круги — неинфицированные гельминтами пациенты, квадраты — инфицированные, треугольники — инфицированные, но вылеченные от гельминта (момент излечения показан черной стрелкой).
Иммунный ответ
Иммунная система призвана защищать организм от внутренних и внешних врагов. Внешними врагами являются вирусы, бактерии, простейшие и черви, которые постоянно попадают в наш организм и уничтожаются на дальних рубежах. Внутренними врагами являются раковые клетки, а также клетки, зараженные вирусами или внутриклеточными бактериями.
Когда паразит попадает в организм, первым делом его встречает врожденный иммунитет, клетки которого (макрофаги) есть во всех тканях. Антигеном в данном случае служат нехарактерные для нашего организма молекулы — клеточная стенка бактерий, двухцепочечная РНК некоторых вирусов, свободно плавающая в межклеточном пространстве наша ДНК и так далее. При обнаружении пришельцев, клетки врожденного иммунитета пытаются их уничтожить, параллельно выделяя провоспалительные молекулы (рис. 5). Воспаленная ткань блокирует выход паразита из места проникновения в остальной организм и привлекает новые клетки иммунитета к месту повреждения.

Рисунок 5. Фагоцит пожирает бактерии.
Если врожденному иммунитету не удается уничтожить захватчиков, в дело вступает адаптивный иммунитет. Происходит это отнюдь не сразу: активации адаптивного ответа предшествуют 3–4 дня подготовки в лимфоузлах (при этом лимфоузлы увеличиваются в размерах, что является признаком инфекционного заболевания). Начинается все с того, что некоторые из клеток врожденного иммунитета прибывают в лимфоузел, неся на себе антигены из места поражения. Антигенами в данном случае выступают короткие (от 8 до 20 аминокислот) пептиды из белков инфекционного агента и окружающих тканей. По сути, макрофаг (или специализированный активатор адаптивного иммунитета — дендритная клетка) просто захватывает из места воспаления образцы растворенных белков, ошмётков паразита и погибших клеток и приносит в лимфоузел.
В лимфоузле его встречают наивные (неактивированные) клетки адаптивного иммунитета — Т-лимфоциты. Каждый лимфоцит, выйдя из места своего формирования, несет на себе уникальный рецептор, который формируется путем направленного внесения мутаций в геном. Заранее неизвестно, может ли этот рецептор распознать какой-либо антиген, но его вариантов так много (по некоторым оценкам, у нас может быть до 10 48 разных типов этого рецептора, но большая часть их будет нефункциональна), что в течение нескольких часов в лимфоузле обнаруживается как минимум несколько клеток, способных распознать антигены паразита. Затем эти клетки делятся, активируются и отправляются в поврежденную ткань, где отыскивают свои антигены и уничтожают как самих захватчиков, так и зараженные клетки, если мы говорим о вирусе или внутриклеточной бактерии (рис. 6).

Рисунок 6. Т-лимфоциты (красные) убивают раковую клетку (синяя) своего же организма. После получения сигнала раковая клетка начинает распадаться на небольшие пузырьки, которые затем съедят клетки врожденного иммунитета.
Иммунологическая толерантность
Иммунная система — единственная из систем организма, в чью задачу входит уничтожение других живых существ — отдельных клеток или многоклеточных организмов. Причем наши собственные клетки тоже часто должны уничтожаться, если они заражены вирусом, бактерией или превратились в раковые. При этом необходимо избегать иммунного ответа на нормальные клетки. Если такой ответ развивается — возникает аутоиммунное заболевание.
Периферическая толерантность возникает, когда Т-лимфоцит распознает антиген в лимфоузлах, но никакого воспаления в месте, откуда этот антиген попал в лимфоузел, нет. Напротив, высока концентрация противовоспалительных молекул. Такой лимфоцит опять-таки или уничтожается, или превращается в регуляторный.
Паразиты и симбионты
Миллиарды лет эволюции крупные многоклеточные организмы были домом и едой для более мелких одноклеточных и многоклеточных. Человек тут не исключение — ведь мы являемся как хорошим источником пищи, так и отличным защитником для всего, что сумеет поселиться внутри нас или на нас.
Эволюция поделила этих сожителей на 2 большие группы — паразиты и симбионты. Паразиты делают ставку на быстрое размножение. У них есть возможность подавления врожденного иммунитета, а пока адаптивный активируется, они уже успевают размножиться за счет наших ресурсов и передать инфекцию дальше. Так действует, например, вирус гриппа или бактериальная пневмония.
Симбионты же научились подавлять как врожденный, так и адаптивный иммунитеты. Для этого им пришлось умерить свои аппетиты — если клетки организма постоянно повреждаются, то никакие уловки не смогут предотвратить активацию иммунитета. Потому они поселились на поверхностях нашего тела, прежде всего на поверхности ЖКТ, где они получают лишь часть нашей пищи, но не покушаются на сам организм.
Помимо этого, они научились подавлять воспаление, выделяя вещества, которые похожи на наши противовоспалительные молекулы. Макрофаги врожденного иммунитета, столкнувшись с такими бактериями, могут почувствовать антигены клеточной стенки, но не активируются, так как подавлены противовоспалительным фоном вокруг.
Третьим механизмом защиты стала антигенная мимикрия. Для адаптивного иммунитета основным антигеном являются пептиды из белков. И многие наши симбионты в ходе эволюции поменяли свой белковый состав так, чтобы в нем был максимум пептидов, похожих на наши. Таким образом они встают под защиту регуляторных лимфоцитов. Этот механизм характерен для всех видов наших сожителей — бактерий, червей (рис. 7), вирусов и так далее.

Рисунок 7. Власоглав — один из гельминтов, активно изучаемых в рамках гигиенической гипотезы.
В течение миллионов лет каждая особь нашего вида, рождаясь, сразу же вступала в контакт с симбионтами, населявшими кожу, слизистые и кишечники своих собратьев. Со временем организм научился извлекать выгоду из такого постоянного неустранимого сосуществования. В частности, способность бактерий и червей создавать сильный противовоспалительный фон в месте своего обитания стала за это время ключевым фактором создания периферической толерантности. Она распространилась как на антигены самих сожителей, так и на сопутствующие им — антигены пищи (в кишечнике), пыли и пыльцы (в легких) и собственного организма (те самые антигены, которые сожители развили в ходе антигенной мимикрии).
И снова гигиеническая гипотеза
Особенно сильно на риск развития таких заболеваний влияет первый год жизни. Если в этот период ребенок оказывается в деревне, проводит некоторое время в больших группах сверстников (в больнице или в детском саду) и вообще чаще встречается с инфекциями — риск развития аутоиммунных заболеваний серьезно снижается [11], [12].
Разумеется, не только микробиом (совокупность всех симбиотических микроорганизмов конкретного человека) [13] и гельминты влияют на риск развития аутоиммунных и аллергических реакций. Есть и генетическая предрасположенность, и условия, в которых человек впервые встречается с тем или иным внешним антигеном. Есть некоторые микроорганизмы, которые не защищают, а, напротив, провоцируют аутоиммунные заболевания. Например, стрептококк способен вызывать ревматизм, а некоторые стафилококки производят суперантиген, который неспецифически запускает все клоны Т-лимфоцитов с любым рецептором — это тоже может привести к аутоиммунным заболеваниям.
| Заболевание | Количество исследований | Общее количество пациентов | Результаты |
|---|---|---|---|
| Болезнь Крона | 6 | 543 | Показана безопасность и статистически значимые улучшения у большинства пациентов. |
| Неспецифический язвенный колит | 3 | 192 | Показана безопасность и статистически значимые улучшения у большинства пациентов. |
| Рассеянный склероз | 6 | 156 | Показана безопасность, статистически значимые улучшения у части пациентов. |
| Непереносимость глютена (целиакия) | 2 | 35 | Исследования только начались |
| Расстройства аутического спектра | 3 | 90 | Пилотное исследование показало эффективность, подтверждающие только начаты |
| Псориаз | 3 | 55 | Исследования только начались |
| Аллергия на арахис | 1 | 18 | Исследования только начались |
| Бронхиальная астма | 1 | 32 | Зафиксированы статистически недостоверные улучшения |
| Аллергический риноконъюнктивит | 2 | 130 | Эффективность не показана |
| Ревматоидный артрит | 1 | 50 | Исследование только началось |
Что же делать нам, простым смертным, пока ученые по кусочкам разбирают эту тайну и ищут решение? Начать стóит со снижения маниакального стремления к чистоте во всем. Я не предлагаю не мыть руки перед едой. Но довольно часто в последнее время мы перегибаем палку. Антибиотики при каждом чихе, асептические спиртосодержащие гели каждые 10 минут, антибактериальное мыло вместо обычного в ванной. Все эти меры способны спасти вас от эпидемии. Но каждодневное их применение, особенно детьми, способно нанести куда больший урон, чем грипп или пищевое отравление.

Новость
Автор
Редакторы
Системная красная волчанка — это мультифакторное заболевание, развивающееся на основе генетического несовершенства иммунной системы и характеризующееся выработкой широкого спектра аутоантител к компонентам клеточного ядра. Молекулярно-генетические основы болезни изучены довольно плохо, в связи с чем специфического лечения до сих пор не создано, а в основе проводимой в клинике патогенетической терапии лежат иммунодепрессанты — глюкокортикостероиды и цитостатики. И вот, после более чем 50 лет попыток разработать специфическое лечение волчанки, произошел сдвиг: Управление по контролю за качеством пищевых продуктов и лекарств США официально утвердило в качестве лекарства от волчанки препарат Бенлиста (Benlysta) на основе моноклональных антител, специфически блокирующих B-лимфоцит-стимулирующий белок (BLyS).
Системная красная волчанка (СКВ) — одно из самых распространённых аутоиммуных заболеваний, в основе которого лежит генетически обусловленное комплексное нарушение иммунорегуляторных механизмов. При заболевании происходит образование широкого спектра аутоантител к различным компонентам ядра клеток и формирование иммунных комплексов. Развивающееся в различных органах и тканях иммунное воспаление приводит к обширным поражениям микроциркуляторного кровяного русла и системной дезорганизации соединительной ткани [1], [2].
Патогенез СКВ

Рисунок 1. Патогенез СКВ
Волчанка во многом связана с нарушениями на уровне пролиферации различных клонов В-клеток, активируемых многочисленными антигенами, в роли которых могут выступать медицинские препараты, бактериальная или вирусная ДНК и даже фосфолипиды мембраны митохондрий. Взаимодействие антигенов с лейкоцитами связано либо с поглощением антигенов антиген-презентирующими клетками (АПК), либо с взаимодействием антигена с антителом на поверхности В-клетки.
В результате поочередной активации то T-, то B-клеток увеличивается продукция антител (в том числе, аутоантител), наступает гипергаммаглобулинемия, образуются иммунные комплексы, чрезмерно и неконтролируемо дифференцируются Т-хелперы. Разнообразные дефекты иммунорегуляции, свойственные СКВ, связаны также с гиперпродукцией цитокинов Th2-типа (IL-2, IL-6, IL-4, IL-10 IL-12).
Одним из ключевых моментов в нарушении иммунной регуляции при СКВ является затрудненное расщепление (клиренс) иммунных комплексов, — возможно, вследствие их недостаточного фагоцитоза, связанного, в частности, с уменьшением экспрессии CR1-рецепторов комплемента на фагоцитах и с функциональными рецепторными дефектами.
Распространённость СКВ колеблется в пределах 4–250 случаев на 100 000 населения; пик заболеваемости приходится на возраст 15–25 лет при соотношении заболевших женщин к мужчинам 18:1. Наиболее часто заболевание развивается у женщин репродуктивного возраста с увеличением риска обострения во время беременности, в послеродовом периоде, а также после инсоляции и вакцинации.
СКВ часто становится причиной инвалидности. В развитых странах в среднем через 3,5 года после постановки диагноза 40% больных СКВ полностью прекращают работать, — в основном, в связи с нейрокогнитивными дисфункциями и повышенной утомляемостью. К потере трудоспособности чаще всего приводят дискоидная волчанка и волчаночный нефрит.
Клинические проявления СКВ чрезвычайно разнообразны: поражение кожи, суставов, мышц, слизистых оболочек, лёгких, сердца, нервной системы и т.д. У одного пациента можно наблюдать различные, сменяющие друг друга варианты течения и активности заболевания; у большинства больных периоды обострения заболевания чередуются с ремиссией. Более чем у половины больных есть признаки поражения почек, сопровождающиеся ухудшением реологических свойств крови [4].
Поскольку молекулярные и генетические механизмы, лежащие в основе заболевания, до сих пор как следует не изучены, специфического лечения волчанки до недавнего времени не существовало. Базисная терапия основана на приёме противовоспалительных препаратов, действие которых направлено на подавление иммунокомплексного воспаления, как в период обострения, так и во время ремиссии. Основными препаратами для лечения СКВ являются:
- глюкокортикоиды (преднизолон, метилпреднизолон);
- цитостатические препараты (циклофосфамид, азатиоприн, метотрексат, мофетила микофенолат, циклоспорин).
Исследователи, желая специфически блокировать BLyS, сделали ставку на человеческое моноклональное антитело, разработанное совместно с английской биотехнологической фирмой Cambridge Antibody Technology, и названное белимумаб (belimumab). В начале марта 2011 года американское Управление по контролю за качеством пищевых продуктов и лекарственных препаратов (FDA) впервые за 56 лет одобрило препарат, предназначенный для специфического лечения системной красной волчанки. Эти препаратом стал Бенлиста — коммерческое название антитела белимумаба, производством которого уже занимается компания GlaxoSmithKline. До того FDA одобряла для терапии СКВ гидроксихлорохин — лекарство от малярии; было это в 1956 году.
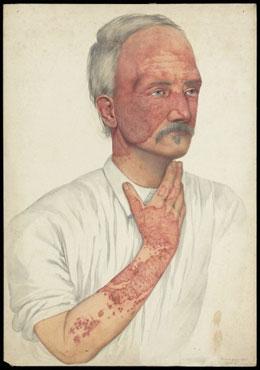
Рисунок 2. Человек, больной системной красной волчанкой (акварель 1902 года кисти Мэйбл Грин). Свое название заболевание получило ещё в средневековье, когда людям казалось, что характерная волчаночная сыпь на переносице напоминает волчьи укусы.
Целенаправленная терапия
Следующие на очереди
Читайте также:

