Волосистая лейкоплакия при какой стадии вич появляется
Обновлено: 18.04.2024
Кафедра болезней уха, горла, носа Белорусского государственного медицинского университета, Минск
Кафедра болезней уха, горла, носа Белорусского государственного медицинского университета, Минск
Кафедра болезней уха, горла, носа Белорусского государственного медицинского университета, Минск
Распространенность хронической патологии ЛОР-органов и слизистой оболочки полости рта у ВИЧ-инфицированных пациентов в зависимости от иммунного статуса
Кафедра болезней уха, горла, носа Белорусского государственного медицинского университета, Минск
Цель исследования - определить распространенность хронической патологии ЛОР-органов и слизистой оболочки полости рта у ВИЧ-инфицированных пациентов в зависимости от числа клеток, содержащих маркер CD4 в 1 мкл плазмы крови. Распространенность патологии ЛОР-органов и слизистой оболочки полости рта зависит от числа клеток, содержащих маркер CD4 в 1 мкл плазмы крови ВИЧ-инфицированных пациентов. На I иммунологической стадии вирусного иммунодефицита человека (CD4 более 500 в 1 мкл плазмы крови) указанная патология выявлена в 64,6% случаев, на II (CD4 200-499) - в 73,4%, на III (CD4 менее 200) - в 90,7%. Описана частота встречаемости отдельных нозологических форм на разных стадиях вирусного иммунодефицита человека. Выявлены патогномоничные для ВИЧ-инфицированных взрослых заболевания: аденоидные вегетации, хейлит, волосатая лейкоплакия языка, орофарингеальный кандидоз. Сочетанная хроническая воспалительная патология ЛОР-органов, а также определенные особенности течения заболеваний могут указывать на иммунологическую недостаточность и потребовать оценки ВИЧ-статуса.
Кафедра болезней уха, горла, носа Белорусского государственного медицинского университета, Минск
Кафедра болезней уха, горла, носа Белорусского государственного медицинского университета, Минск
Кафедра болезней уха, горла, носа Белорусского государственного медицинского университета, Минск
Иммунодефицитное состояние, обусловленное ВИЧ-инфекцией, создает условия для развития различных инфекционных процессов и оказывает значительное негативное влияние, в том числе и на состояние ЛОР-органов [1—3]. С клинической точки зрения разделяют воспалительные (инфекционные), неопластические и неврологические оториноларингологические проявления вирусного иммунодефицита человека [4—6]. Возможно развитие как типичных заболеваний, так и атипичных, экзотических [7, 8]. Особое значение приобретает условно-патогенная микрофлора, определяющая развитие так называемых оппортунистических заболеваний [9, 10]. Инфицирование организма человека банальной микрофлорой в большинстве случаев осуществляется воздушно-капельным или алиментарным путем. Поэтому первичная инвазия инфекционного агента чаще происходит в слизистую оболочку ЛОР-органов и полости рта. Данное обстоятельство и определяет наибольшее распространение воспалительных процессов указанной локализации. Актуальным является вопрос распространенности и особенности клинической картины патологии ЛОР-органов и слизистой оболочки полости рта у пациентов, страдающих вирусным иммунодефицитом человека [11, 12].
У ВИЧ-инфицированных лиц распространенность хронической патологии ЛОР-органов и слизистой оболочки полости рта значительно варьирует в зависимости от иммунного статуса. Основополагающим показателем, демонстрирующим напряженность иммунитета у ВИЧ-инфицированных лиц, является число клеток, содержащих маркер CD4 в 1 мкл плазмы крови. Этот показатель является иммунологическим критерием классификации ВИЧ-инфекции, разработанной экспертами Комитета по контролю за заболеваниями (США, 1993) [13]. В соответствии с этой классификацией выделяют три иммунологические стадии ВИЧ-инфекции: I соответствует числу клеток CD4 более 500 в 1 мкл плазмы крови, II стадия — 200—499, III — менее 200.
Цель исследования — определить распространенность хронической патологии ЛОР-органов и слизистой оболочки полости рта у ВИЧ-инфицированных пациентов в зависимости от числа клеток, содержащих маркер CD4 в 1 мкл плазмы крови.
Пациенты и методы
В исследовании приняли участие 647 пациентов, относящиеся к взрослой группе населения (старше 18 лет), состоящих на учете в диспансерном кабинете городской клинической инфекционной больницы Минска и Светлогорской центральной районной поликлинике (Республика Беларусь) по поводу ВИЧ-инфекции.
Исследование состояния ЛОР-органов и слизистой оболочки полости рта (осмотр, рентгенологическое, бактериологическое обследование) производили при очередном посещении указанными пациентами диспансерного кабинета. Обследованы 370 (57,2%) мужчин и 277 (42,8%) женщин. Средний возраст — 31,2±7,4 года, минимальный — 18 лет, максимальный — 67 лет. Интервал времени от момента регистрации ВИЧ-инфицированного пациента на диспансерном учете до оториноларингологического осмотра (стаж заболевания) в среднем составил 4,1±3,6 года.
В соответствии с иммунологическим критерием классификации Комитета по контролю за заболеваниями все пациенты были объединены в три группы. 127 (19,7%) человек имели I иммунологическую стадию заболевания (число лимфоцитов CD4 более 500), 252 (38,9%) пациента — II стадию (CD4 — 200—499), 286 (41,4%) — III (CD4 — менее 200).
Результаты и обсуждение
У большинства ВИЧ-инфицированных пациентов (510 человек, 78,8%) на момент оториноларингологического осмотра выявлены заболевания ЛОР-органов и слизистой оболочки полости рта.
Распространенность хронической патологии ЛОР-органов и слизистой оболочки полости рта оказалась обратно пропорциональна числу клеток, содержащих маркер CD4 в 1 мкл крови ВИЧ-инфицированного пациента. Чем ниже уровень клеток CD4, тем выше распространенность заболеваний. Так, на I иммунологической стадии вирусного иммунодефицита человека (CD4 более 500 в 1 мкл плазмы крови) указанная патология выявлена у 82 (64,6%) пациентов, на II стадии (CD4 200—499) — у 185 (73,4%), на III (CD4 менее 200) — у 243 (90,7%) человек.

Частота выявления конкретной хронической патологии ЛОР-органов и слизистой оболочки полости рта зависит от иммунологической стадии ВИЧ-инфекции. В таблице представлено распределение указанной патологии у ВИЧ-инфицированных пациентов при оториноларингологическом осмотре в зависимости от иммунологической стадии иммунодефицита.
Из представленных в таблице данных следует, что распространенность большинства заболеваний ЛОР-органов и слизистой оболочки полости рта увеличивается по мере уменьшения числа иммунокомпетентных клеток, содержащих маркер CD4 (обратно пропорциональная зависимость).
Достаточно интересная закономерность выявлена при изучении частоты встречаемости гипертрофии аденоидов у ВИЧ-инфицированных пациентов. Так, на I (CD4 более 500) и на III (CD4 менее 200) иммунологических стадиях ВИЧ-инфекции частота выявления гипертрофии глоточной миндалины сходна (4,7 и 5,2% соответственно). При II иммунологической стадии (CD4 200—499) вирусного иммунодефицита человека гипертрофию аденоидов выявили у 25 из 252 пациентов, что составило 9,9%. Таким образом, для II (CD4 200—499) иммунологической стадии ВИЧ-инфекции характерны пролиферативные изменения со стороны лимфоидной ткани, в том числе и миндалин, а для III, наоборот, — атрофия.
Частота выявления пациентов, у которых диагностирована волосатая лейкоплакия языка, увеличивается по мере прогрессирования ВИЧ-инфекции. Так, на I иммунологической стадии волосатая лейкоплакия языка выявлена у 2,4% пациентов, на II — у 4,8%, на III — у 9,3%. Распространенность указанной патологии среди всей популяции составляет менее 0,5% [3, 5]. Следовательно, выявление этого состояния у любого пациента требует оценки иммунного статуса.
У 6 (4,7%) пациентов на I стадии вирусного иммунодефицита человека диагностирован острый некротический гингивит, у 7 (2,8%) — на II, у 10 (3,7%) — на III. Следовательно, частота выявления острого некротического гингивита не имеет статистически достоверных отличий в зависимости от иммунологической стадии ВИЧ-инфекции. Однако сам факт обнаружения этой патологии указывает на иммунологическую недостаточность, так как распространенность этой патологии в популяции составляет менее 0,5% [5, 11].
У ВИЧ-инфицированных пациентов на I и II иммунологической стадии заболевания (CD4 более 200 в 1 мкл крови) частота выявления ангулярного хейлита сходна и составляет 4,7 и 4,0% соответственно. На III иммунологической стадии распространенность ангулярного хейлита возрастает — 7,8%. Учитывая низкую частоту выявления этой патологии в популяции, пациенты, у которых диагностирован ангулярный хейлит с хроническим характером течения этого заболевания, требуют оценки иммунного статуса [5, 12].
Хронический ларингит продемонстрировал более чем двукратный рост распространенности от I (2,4%) к III (6,0%) иммунологической стадии вирусного иммунодефицита человека. Частота выявления хронического воспаления гортани у ВИЧ-инфицированных пациентов превышает соответствующий показатель в популяции для аналогичной возрастной группы [3, 5, 12].
По мере снижения числа иммунокомпетентных клеток, содержащих маркер CD4 в крови ВИЧ-инфицированных пациентов, увеличилась частота выявления хронических воспалительных заболеваний уха (хронического диффузного наружного отита с 3,9 до 5,6% и хронического гнойного среднего отита с 1,6 до 2,6%), однако этот рост не имеет статистически достоверного характера.
У 9,7% ВИЧ-инфицированных пациентов, имеющих III иммунологическую стадию, выявлены рецидивирующие инфекции верхних дыхательных путей (5 и более эпизодов в течение года), что достоверно превышает распространенность этой патологии на I стадии заболевания (1,6%).
Частота выявления хронического ринита у ВИЧ-инфицированных пациентов достоверно не отличается в зависимости от иммунологической стадии заболевания (I стадия — 14,2%, II — 23,4%, III — 16,8%). Аналогичная закономерность выявлена для хронического синусита (I — 13,4%, II — 8,3%, III — 15,3%). Следовательно, даже незначительное снижение напряженности иммунитета, которое проявляется уменьшением числа иммунокомпетентных клеток, содержащих маркер CD4, приводит к росту распространенности этой патологии. Вместе с тем дальнейшее уменьшение числа иммунокомпетентных клеток не приводит к достоверному изменению распространенности указанной патологии.
Обобщая вышеизложенное, следует признать следующие оториноларингологические заболевания патогномоничными для ВИЧ-инфицированных взрослых: аденоидные вегетации, хейлит, волосатая лейкоплакия языка, орофарингеальный кандидоз. Кроме указанных заболеваний, у данной группы больных значительно более широко, чем в популяции, распространены банальные заболевания ЛОР-органов: хронический синусит, хронический ринит, хронический фарингит, хронический ларингит, хронический отит. Сочетание указанных патологических состояний может указывать на иммунодефицит и потребовать оценки ВИЧ-статуса.
Таким образом, на всех стадиях ВИЧ-инфекции встречается патология ЛОР-органов, как типичная, так и атипичная. Распространенность болезней уха, горла, носа увеличивается с прогрессированием иммунодефицита. Резистентность к проводимой терапии, атипичность клинической картины, тяжелое течение, частые рецидивы, высокая степень хронизации могут указывать на наличие иммунологической недостаточности и являются показанием к обследованию на ВИЧ. Учитывая все более широкое распространение ВИЧ-инфекции, каждый пациент должен рассматриваться как возможный носитель инфекции, что требует от медицинских работников тщательного соблюдения санитарно-эпидемических мероприятий. Указанное обстоятельство в первую очередь относится к оториноларингологам, так как патология ЛОР-органов может оказаться первым симптомом вторичного вирусного иммунодефицита человека.
Выводы
1. Иммунодефицитное состояние человека, обусловленное ВИЧ-инфекцией, определяет высокую распространенность патологии ЛОР-органов и слизистой оболочки полости рта (78,8%).
2. Распространенность патологии ЛОР-органов значительно варьирует в зависимости от числа клеток, содержащих маркер CD4 в 1 мкл плазмы крови ВИЧ-инфицированного пациента (64,6% — на I стадии, 73,4% — на II, 90,7% — на III стадии).
3. Патогномоничными для ВИЧ-инфицированных взрослых являются следующие заболевания: аденоидные вегетации, хейлит, волосатая лейкоплакия языка, орофарингеальный кандидоз.
4. Сочетанные банальные заболевания ЛОР-органов (хронический синусит, хронический ринит, хронический фарингит, хронический ларингит, хронический отит) и определенные особенности клинического течения могут указывать на состояние иммунологического дефицита и потребовать оценки иммунного статуса.
Первый МГМУ им. И.М. Сеченова
Федеральный научно-методический центр по профилактике и борьбе со СПИДом Роспотребнадзора, Москва, Россия, 105275
Московская медицинская академия им. И.М. Сеченова
Волосатая лейкоплакия как маркер ВИЧ-инфекции и СПИДа
Журнал: Клиническая дерматология и венерология. 2018;17(4): 114‑119
Первый МГМУ им. И.М. Сеченова
В статье описаны основные представления и клинические характеристики волосатой лейкоплакии, изложенные как по данным зарубежных и отечественных авторов, так и собственным наблюдениям. В преамбуле кратко сформулированы современные сведения о вирусе Эпштейна—Барр, в том числе обозначены преимущественные пути его передачи и механизмы участия вируса в развитии патологических проявлений. Дано описание клинико-лабораторных изменений, выявляемых при развитии инфекционного мононуклеоза. Обозначена инициирующая роль вируса Эпштейна—Барр в возникновении волосатой лейкоплакии в полости рта. Особое внимание уделено волосатой лейкоплакии как специфическому проявлению инфекции, вызываемой ВИЧ. Так, развитие этого заболевания свидетельствует о прогрессировании ВИЧ-инфекции и является достоверным клиническим маркером ее поздних стадий и СПИДа, а также служит ранним предвестником трагического исхода основной инфекции. Приведена корреляция между выраженностью волосатой лейкоплакии и количеством CD4-хелперов в 1 мм у ВИЧ-позитивных лиц. В статье описаны ключевые критерии диагностики заболевания, включая патогистологические признаки: гиперкератоз, паракератоз и акантоз, а также выступы кератина на поверхности эпителия, напоминающие волосы.
Первый МГМУ им. И.М. Сеченова
Федеральный научно-методический центр по профилактике и борьбе со СПИДом Роспотребнадзора, Москва, Россия, 105275
Московская медицинская академия им. И.М. Сеченова
Волосатая лейкоплакия (ВЛ) впервые описана в 1984 г. Д. Гриншпаном и соавт. у гомосексуалистов, страдавших СПИДом [1]. Она представляет собой доброкачественную пролиферацию эпителиальных клеток слизистой оболочки полости рта (СОПР) без склонности к злокачественному перерождению [2−6]. Вызывается активной репликацией повсеместно распространенного вируса Эпштейна−Барр (ВЭБ) [2,4,7−9]. Резервуаром вируса и источником заражения служит инфицированный человек с клиническими проявлениями или без них [7,9]. Пути передачи разнообразны: воздушно-капельный; контактный, при котором существенную роль играет слюна, богатая вирусом (при поцелуях, через игрушки и предметы обихода); сексуальный; гемотрансфузионный; интранатальный. Допускается возможность трансплацентарной передачи. Вирус выделили Майкл Эпштейн (Michael Epstein) и Ивонна Барр (Ivonne Barr) в 1964 г. из клеток лимфомы Беркитта, и он получил наименование в честь своих первооткрывателей.
ВЭБ избирательно поражает В-лимфоциты и эпителиальные клетки. Пораженные им клетки подвергаются не лизису, а активной пролиферации. После заражения ВЭБ вызываемая им инфекция во всех возрастных группах протекает или в клинической форме в виде инфекционного мононуклеоза, или в латентной форме, т. е. без клинических проявлений. Восприимчивость к вирусу высокая, контагиозность же инфекционного мононуклеоза низкая: ВЭБ-инфекция протекает главным образом латентно.
Инфекционному мононуклеозу присущи следующие клинические проявления [7,9]: лихорадка, поражение миндалин, полиаденит с превалированием в заднешейной области и подчас гепатоспленомегалия, а у взрослых — дополнительно желтушность склер, СОПР и кожных покровов. Нередко инфекционный мононуклеоз сопровождается пятнистыми и папулезными высыпаниями, которые спонтанно и бесследно исчезают спустя 2−3 дня после их появления. Лабораторным подтверждением является лейкоцитоз, при котором количество крупных мононуклеаров превышает 10%, достигая порой 80−90%. Установлено и общепризнано, что подобный симптомокомплекс может быть обусловлен и другими вирусами, в частности ВИЧ.
Чаще всего инфекционный мононуклеоз регистрируют у подростков, редко у детей и лишь изредка у взрослых. Латентная форма больше присуща взрослым: при очень редком мононуклеозе у абсолютного большинства взрослых выявляют антитела к ВЭБ. При латентной форме ВЭБ в неактивном состоянии сохраняется в В-лимфоцитах [6,10].
У ВИЧ-инфицированных и особенно у больных СПИДом ВЭБ, находившийся в неактивном состоянии, реактивируется, т. е. приобретает активные свойства, становясь таким образом патогеном. Теперь он обусловливает развитие ВЛ, поражающей СОПР, и в результате своего активного воздействия на пролиферацию клеток принимает участие в патогенезе крупноклеточной В-лимфомы и лимфомы Беркитта. Кроме того, ВЭБ может ускорять прогрессирование ВИЧ-инфекции, усиливая рост ВИЧ в лимфоцитах [6].
Ниже изложены представления о ВЛ согласно нашим наблюдениям и доступным публикациям.
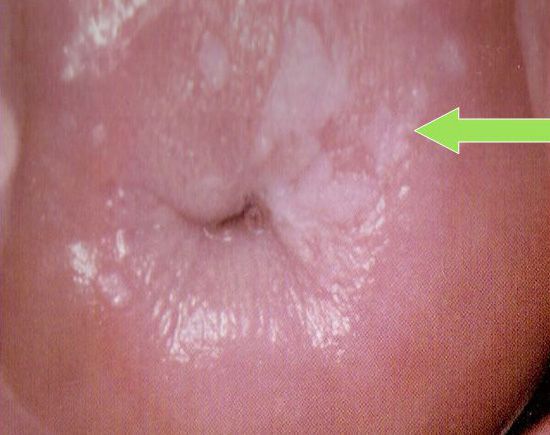
Первоначально ВЛ проявляется слегка выстоящими мелкими папулами белого цвета, округлых очертаний и с четкими границами, возникающими в результате инфицирования ВЭБ эпителиальных клеток СОПР. Внешне они похожи на волосы. Папулы расположены чаще всего на латеральных (одной или обеих) сторонах языка. Количество их вариабельно — от единичных до множественных. Ранними проявлениями ВЛ, помимо папул, считают рифления (тяжи), вертикально расположенные на латеральных сторонах языка (рис. 1) Рис. 1. Ранние проявления ВЛ (тяжи). * . Позже тяжи увеличиваются в размерах и в количестве, плотно прилегают друг к другу, образуя гофрированные бляшки (рис. 2). Рис. 2. Гофрированные бляшки при ВЛ. Цвет бляшек белый, границы четкие. Со временем их белый цвет темнеет до серого, границы становятся нечеткими, размытыми. И при бляшках, и при тяжах перифокально выявляются папулезные высыпания.
Латеральные стороны языка — типичная локализация ВЛ, но иногда это могут быть спинка языка (рис. 3) Рис. 3. ВЛ на спинке языка. и его нижняя поверхность, слизистая оболочка щек, мягкое и твердое небо (рис. 4), Рис. 4. ВЛ в области твердого неба. дно полости рта и глотка. ВЛ обычно не вызывает субъективных беспокойств, изредка больные предъявляют жалобы на легкую болезненность, жжение и затруднение при глотании. Она не поддается соскабливанию: удаляются лишь клетки поверхностных слоев. Антимикотическое лечение ВЛ в ряде случаев вызывает некоторое улучшение за счет подавления кандидозного осложнения.
ВЛ СОПР считается одним из самых специфических проявлений инфекции, вызываемой ВИЧ [6,11,12]: она выявляется главным образом у ВИЧ-инфицированных и больных СПИДом. Главным образом, но не исключительно. В редких наблюдениях ВЛ установлена и у других категорий больных с иммуносупрессией, в частности у реципиентов внутренних и других органов, и даже у здоровых лиц [2,6].
На фоне ВИЧ-инфекции ВЛ обычно возникает у взрослых, редко у подростков и детей; не описана у младенцев. Формируется она на любом уровне количества CD4-хелперов. Полное же ее формирование происходит при количестве CD4-хелперов ниже 200 в 1 мм 3 крови, т. е. при СПИДе [2,6,13].
ВЛ свидетельствует о прогрессировании ВИЧ-инфекции, является достоверным клиническим маркером ее поздних стадий и СПИДа, а также служит ранним предвестником трагического исхода основной инфекции.
К особенностям ВЛ при ВИЧ-инфекции следует отнести поражение десен (рис. 5), Рис. 5. Поражение десен при ВЛ у ВИЧ-инфицированного пациента. нередко с клиническими проявлениями, протекающими по типу язвенно-некротического гингивита (рис. 6). Рис. 6. ВЛ по типу язвенно-некротического гингивита у ВИЧ-инфицированного пациента.
В очагах ВЛ подчас обнаруживают грибы рода Candida. Это обстоятельство лежит в основе не таких уж редких диагностических ошибок: ВЛ принимают за кандидоз и наоборот [14]. Вместе с тем структуры этих двух заболеваний полости рта разные. ВЛ проявляется утолщением слизистой оболочки в виде папул, тяжей и бляшек за счет пролиферации ее клеток, а при кандидозе полости рта — микотическим налетом на этой оболочке [15]. Поэтому при соскабливании не удаляются клинические проявления ВЛ, но удаляются клинические проявления кандидоза полости рта.
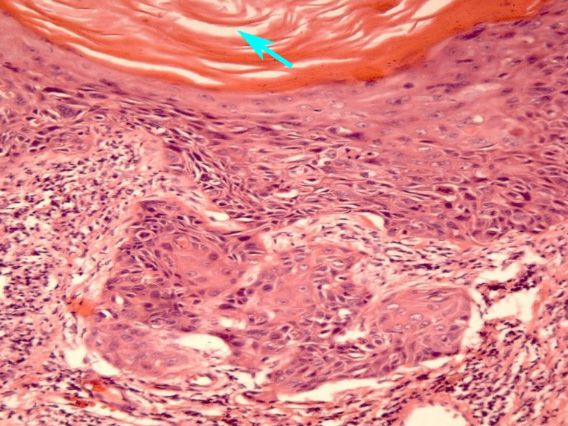
Патогистологические проявления при ВЛ сводятся к гиперкератозу, паракератозу и акантозу, а также к выступам кератина на поверхности эпителия, похожим на волосы. При необходимости подтверждения клинического диагноза ВЛ лучше прибегать не к гистологическому исследованию, а к методу гибридизации in situ. Он превосходит по надежности гистологическое исследование, а главное вполне приемлем при обследовании больного человека. Этим методом в соскобах с очагов ВЛ выявляют ДНК ВЭБ, что позволяет считать его высокоспецифическим.
В заключении отметим, что, по наблюдению Kreuter A. и Wieland U. [19], ВЛ может быть первым и единственным проявлением ВИЧ-инфекции у лиц без каких-либо отклонений в общем состоянии здоровья и самочувствии. Следовательно, в таких случаях ВЛ служит показанием к проведению тестов на ВИЧ-инфекцию.
Сведения об авторах
* Иллюстрации предоставлены зав. отделением заболеваний слизистой оболочки рта ЦНИИС и ЧЛХ, проф. О.Ф. Рабинович.
Свердловский областной центр профилактики и борьбы со СПИД, Екатеринбург, Россия, 620102
Свердловский областной центр профилактики и борьбы со СПИД, Екатеринбург, Россия, 620102
Свердловский областной центр профилактики и борьбы со СПИД, Екатеринбург, Россия, 620102
Клинические маркеры выраженной иммуносупрессии у больных ВИЧ-инфекцией в Cвердловской области (на примере волосатой лейкоплакии)
Журнал: Клиническая дерматология и венерология. 2017;16(6): 54‑61
Свердловский областной центр профилактики и борьбы со СПИД, Екатеринбург, Россия, 620102
Свыше 40% больных с впервые установленным диагнозом ВИЧ-инфекции в 2014 г. в России имели выраженный иммунодефицит. Cвоевременная диагностика заболеваний кожи и слизистых оболочек, свидетельствующих об иммуносупрессии, способствует выявлению и установлению стадии ВИЧ-инфекции у больных. Цель исследования — изучить проявления волосатой лейкоплакии (ВЛ) у инфицированных ВИЧ, оценить уровень концентрации РНК ВИЧ в плазме крови (ВН), абсолютное количество CD4+T-лимфоцитов и их процентное содержание у лиц с ВЛ, разработать алгоритм диагностики ВЛ. Материал и методы. В ретроспективное исследование включены 200 лиц, инфицированных ВИЧ, не принимающих антиретровирусную терапию (АРВТ). Пациенты разделены на две равные группы: в 1-ю группу вошли больные ВЛ, во 2-ю — лица без ВЛ. Сравнивали уровень ВН, абсолютное количество и процентное содержание CD4+на момент диагностики ВЛ (измерение в течение 120 дней до или после даты установления ВЛ). Результаты. У 94% больных ВЛ были поражены обе боковые поверхности языка, одностороннюю локализацию отметили в 6% случаев. Количество CD4+T-лимфоцитов менее 200 клеток/мкл достоверно чаще определяли у больных ВЛ (62%), более 350 клеток/мкл — в контрольной группе (46%). Менее 14% CD4+выявили у 65% больных ВЛ (31% во 2-й группе). Уровень ВН более 100 тыс. копий/мл преобладал у лиц с ВЛ (60%), во 2-й группе — у 31%. Одновременно выявлено менее 200 CD4+T-лимфоцитов/мкл с их процентным содержанием ниже 14% и ВН не менее 100 тыс. копий/мл у 45% больных 1-й группы и у 15% участников 2-й группы. Заключение. ВЛ у лиц, инфицированных ВИЧ, можно считать достоверным клиническим маркером выраженной иммуносупрессии (CD4+ниже 350 клеток/мкл и их процентное содержание до 14%) и/или высокого уровня концентрации РНК ВИЧ в плазме крови.
Свердловский областной центр профилактики и борьбы со СПИД, Екатеринбург, Россия, 620102
Свердловский областной центр профилактики и борьбы со СПИД, Екатеринбург, Россия, 620102
Свердловский областной центр профилактики и борьбы со СПИД, Екатеринбург, Россия, 620102
У больных с впервые установленным диагнозом ВИЧ-инфекции в 2014 г. в России 40,3% имели выраженный иммунодефицит (количество CD4 + T-лимфоцитов ниже 350 клеток в 1 мкл) и у 73,3% этот показатель составил менее 500 CD4±клеток в 1 мкл [1].
Сроки формирования у больных ВИЧ-инфекцией оппортунистических (вторичные) поражений непосредственно связаны с уровнем иммуносупрессии. Кандидоз слизистых оболочек — наиболее ранний клинический показатель прогрессирующего иммунодефицита. При дальнейшем углублении иммунных нарушений развиваются бактериальные пневмонии, генерализованный и внелегочный туберкулез, герпесвирусные поражения, локализованная и диссеминированная саркома Капоши, лимфомы, пневмоцистоз, тяжелые микозы, рецидивы пневмоцистной пневмонии, криптококкоз, токсоплазмоз, цитомегаловирусная инфекция, атипичные микобактериозы [2].
Одним из вторичных поражений, тесно связанных с нарушениями иммунитета, является волосатая лейкоплакия (ВЛ).
ВЛ — одна из клинических форм лейкоплакии. Впервые В.Л. была описана в 1984 г. D. Greenspan и соавт. [4], как белый налет на боковых поверхностях языка с гофрированной поверхностью, не удаляющийся при поскабливании, у мужчин Сан-Франциско, практикующих секс с мужчинами. При этом у многих из них были выявлены признаки иммуносупрессии.
Изначально ВЛ ассоциировали только с больными СПИДом, так как она возникает почти исключительно у ВИЧ-инфицированных пациентов и является предиктором развития СПИД [5, 6]. Впоследствии установлено, что ВЛ развивается не только у ВИЧ-инфицированных, но и у лиц с другими причинами ослабления иммунитета (реципиенты после трансплантации органов, костного мозга на фоне приема иммунодепрессантов, больные, принимающие системные и топические стероиды) [7—9]. В литературе [10] описаны немногочисленные случаи диагностики ВЛ рта у иммунокомпетентных больных без ВИЧ-инфекции.
В РРФ добровольному обследованию на ВИЧ по клиническим показаниям подлежат все лица с установленным диагнозом ВЛ языка с обязательным до- и послетестовым консультированием по вопросам профилактики ВИЧ-инфекции [11, 12].
Развитие ВЛ связывают с репликацией в клетках эпителия слизистой полости рта вируса Эпштейна—Барр (ВЭБ). Об этом свидетельствует выявление ВЭБ в эпителиальных клетках из очагов ВЛ и регресс высыпаний при приеме ацикловира или валацикловира [13, 14].
Наиболее типично поражение ВЛ обеих латеральных поверхностей языка, но возможна и односторонняя локализация процесса [15]. Частое поражение боковых поверхностей языка ряд авторов объясняют низким количеством клеток Лангерганса в эпителии на этих участках слизистой [16]. У некоторых больных возможно вовлечение других участков языка, слизистой оболочки полости рта (область щек, дно полости рта, мягкое небо), ротоглотки. Очаги В.Л. слизистой оболочки полости рта представлены налетом белого или серого цвета, плотно прилегающим и не снимаемым, размером от нескольких миллиметров до 2—3 см с неровной поверхностью за счет нитевидных разрастаний эпителия, напоминающих волосоподобные структуры. Субъективные ощущения при ВЛ обычно отсутствуют, иногда больные предъявляют жалобы на незначительную болезненность, чувство жжения. Диагноз устанавливается на основании характерной клинической картины, в трудных случаях проводится гистологическое и цитологическое исследование, ПЦР для выявления ДНК вируса Эпштейна—Барр [2, 6, 15].
Почти в половине случаев выявляется сочетание ВЛ слизистой оболочки полости рта с поражением дрожжеподобными грибами рода Candida [13].
Дифференциальный диагноз необходимо проводить с кандидозом полости рта, другими видами лейкоплакии, красным плоским лишаем. Поскольку В.Л. хорошо поддается лечению противовирусными препаратами (ацикловир, фоскарнет), а антимикотики неэффективны, для дифференциальной диагностики с кандидозом возможно назначение пробного лечения [15].
Среди лиц, получающих антиретровирусную терапию (АРВТ), частота ВЛ снижается [17—20]. ВЛ может рецидивировать при прерывании АРВТ или расцениваться как синдром восстановления иммунной системы. Появление клиники ВЛ на фоне АРВТ может указывать на низкую приверженность пациентов лечению или развитие резистентности ВИЧ к применяемым антиретровирусным препаратам [13].
Результаты исследований, проведенных в конце ХХ и начале ХХI ввеков, по установлению связи между развитием ВЛ у ВИЧ-инфицированных лиц и показателями CD4+ T-лимфоцитов, вирусной нагрузкой ВИЧ-1, противоречивы. В одних исследованиях установлено, что манифестация ВЛ у больных ВИЧ-инфекцией происходит при снижении показателей CD4+ T-лимфоцитов ниже 200 клеток в 1 мкл, в других наблюдениях указывается 200—500 клеток CD4+ в 1 мкл [6, 21]. В ряде исследований показано, что развитие ВЛ связано с высокой вирусной нагрузкой ВИЧ в крови и не зависит от количества CD4+ [22, 23].
Цель исследования — изучить клинические проявления ВЛ, уровень концентрации РНК ВИЧ в плазме крови, абсолютное количество CD4+ T-лимфоцитов и их процентное содержание у больных ВИЧ-инфекцией Свердловской области с проявлениями ВЛ, разработать алгоритм диагностики ВЛ.
Количество и долю субпопуляции CD4+ T-лимфоцитов в образцах крови определяли в лаборатории Центра методом проточной цитофлюориметрии на проточном цитомере BD FACS Calibur. Вирусную нагрузку измеряли методом ПЦР с регистрацией результатов в реальном времени на анализаторе Abbott m2000rt.
Результаты исследований вирусной нагрузки, CD4+ T-лимфоцитов представлены в виде медианы, нижнего (Q1) и верхнего (Q3) квартилей, прочие — в виде средней арифметической и ее стандартной ошибки (М±m).
Статистический анализ проводился с применением Excell 98 и пакета программ Statistica 6.0. Для оценки статистической достоверности частотных характеристик качественных показателей использовали непараметрический метод χ 2 Пирсона, при его неустойчивости — с поправкой Йетса на непрерывность. Сравнение количественных параметров в исследуемых группах осуществляли с использованием U-критерия Манна—Уитни. Различие величин считали достоверными при уровне значимости p
Результаты и обсуждение
Кумулятивное число ВИЧ-инфицированных в Свердловской области наибольшее в сравнении с другими субъектами Российской Федерации. Регион относится к одному из наиболее пораженных субъектов РФ (1528,6 на 100 тыс. населения по состоянию на 31.12.15).
Медиана возрастного распределения лиц, включенных в исследование, составила 33 года. Средний возраст пациентов 34,7±0,54 года (мужчины 35,73±0,68 года, женщины 33,04±0,86 года).
ВЛ установлена в среднем через 7,66±0,41 года после регистрации ВИЧ-инфекции (мужчины 7,81± 0,53 года, женщины 7,32±0,61 года; p>0,05). Возраст больных при установлении ВЛ 31,76±0,48 года (мужчины 32,84±0,58 года, женщины 29,35±0,63 года).
Потребители инъекционных наркотиков составили 56% от числа лиц, включенных в исследование.
Процентное содержание лимфоцитов, экспрессирующих CD4+, у 65% ВИЧ-инфицированных с проявлениями ВЛ составило менее 14% (соответствует 3-й стадии ВИЧ-инфекции по классификации Центра по контролю и профилактике заболеваний США — CDC) от всей популяции Т-лимфоцитов (31% больных в контрольной группе; p<0,01). От 14 до 28% CD4+ (2-я стадия ВИЧ-инфекции по классификации CDC) выявлено у 31% больных ВЛ и 53% без ВЛ (p<0,01). Всего ниже 29% CD4+ T-лимфоцитов было выявлено у 96% ВИЧ-инфицированных 1-й группы и 84% 2-й (p<0,01). Содержание CD4+ ≥29% обнаружено у 4% пациентов исследуемой группы и 16% больных 2-й группы (p<0,01).

В исследуемой группе достоверно чаще (p <0,01) регистрировали уровень ВН свыше 100 тыс. копий/мл и содержание CD4+ ниже 29% (59 больных в 1-й и 30 — во 2-й группе). Результаты представлены в таблице. Распределение больных по уровню ВН и процентному содержанию СD4+ Т-лимфоцитов, абс.
Одновременно выявлено менее 200 CD4+ T-лимфоцитов/мкл с их процентным содержанием ниже 14% и уровень концентрации РНК ВИЧ в плазме крови не менее 100 000 копий в 1 мл у 45% больных 1-й группы в сравнении с 15% во 2-й (p<0,01).
Заключение
В клинической картине ВЛ у больных ВИЧ-инфекцией превалировало двустороннее поражение боковых поверхностей языка.
Предложенный авторами алгоритм позволяет в оптимальные сроки провести дифференциальную диагностику и установить этиологический диагноз.
Наиболее часто ВЛ у ВИЧ-инфицированных Свердловской области, не принимающих АРВТ, манифестировала при снижении абсолютного количества CD4+ T-лимфоцитов ниже уровня 200 клеток в 1 мкл (62%) и/или уровне концентрации РНК ВИЧ в плазме крови более 100 тыс. копий в 1 мл (60%). Большинство больных ВЛ (83%) имели показатель CD4+ T-лимфоцитов менее 350 клеток в 1 мкл.
Результаты исследования констатируют, что ВЛ у лиц, инфицированных ВИЧ, можно считать достоверным клиническим маркером выраженной иммуносупрессии (CD4+ ниже 350 клеток в 1 мкл и их доля до 14%) и/или высокого уровня концентрации РНК ВИЧ в плазме крови.
Больным с установленным врачами лечебно-профилактических учреждений всех форм собственности диагнозом ВЛ необходимо настойчиво рекомендовать тестирование на наличие антител к ВИЧ.
Что такое лейкоплакия шейки матки? Причины возникновения, диагностику и методы лечения разберем в статье доктора Игнатенко Татьяны Алексеевны, гинеколога со стажем в 14 лет.
Над статьей доктора Игнатенко Татьяны Алексеевны работали литературный редактор Елена Бережная , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Лейкоплакия шейки матки — это утолщение и ороговение плоского эпителия слизистой оболочки шейки матки.
Очаг лейкоплакии может располагаться на слизистой оболочке нижней губы, угла рта, дна полости рта, щёк, в аногенитальной области, на вульве, клиторе, во влагалище, на шейке матки, реже — в области головки полового члена, в окружности заднепроходного отверстия. [11]
Согласно статистике, частота лейкоплакии шейки матки составляет всего 0.7 на 100 000 случаев гинекологической заболеваемости, среди заболеваний шейки матки — 5.2%. [11]
Лейкоплакия шейки матки наиболее часто встречается в возрастной группе 17-39 лет. [9]
В большинстве стран Европы и США, где проводится организованный скрининг рака шейки матки, лейкоплакия шейки матки не попадает в активный поиск, пока цитологические мазки не выявят начальные степени дисплазии (предрака) шейки матки. В нашей стране тактика наблюдения и ведения лейкоплакии шейки матки более активная.
Причины развития лейкоплакии шейки матки делят на:
- внутренние (эндогенные): нарушение гормонального фона, иммунные нарушения в организме;
- внешние (экзогенные): инфекционные, химические, травматические.
Под нарушением гормонального фона чаще подразумевают хроническое отсутствие овуляции, что приводит к дисбалансу эстрогена и прогестерона в организме с преобладанием первого. Относительно повышенные концентрации эстрогена, в свою очередь, действуют на органы-мишени (молочные железы, тело и шейка матки), приводя к гиперпластическим процессам (бесконтрольному увеличению числа клеток). [4] Часто у пациенток с лейкоплакией шейки матки диагностируют повышение уровня пролактина. Иммунные нарушения зачастую проявляются воспалительными процессами матки и ее придатков (вагиниты, сальпингоофориты, цервициты). [9] Отечественным исследованием выявлено повышение концентрации секреторного иммуноглобулина А (SIgA) у пациенток с такими фоновыми заболеваниями шейки матки, как эктопия цилиндрического эпителия и лейкоплакия шейки матки. [8]
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы лейкоплакии шейки матки
Зачастую заболевание протекает бессимптомно. Лишь около трети пациенток предъявляют жалобы на обильные бели и контактные кровяные выделения (после полового акта, использования тампонов, гинекологических осмотров).
Симптомы перерождения лейкоплакии в рак
Рак шейки матки — это заболевание, которое долго никак не проявляется. Симптомы возникают, когда опухолевый процесс уже зашёл далеко. Чаще всего пациентки жалуются на обильные бели, кровянистые выделения и боли внизу живота [18] . Выявить болезнь на ранних стадиях можно с помощью мазков-отпечатков с поверхности покровного эпителия шейки матки [19] .
Патогенез лейкоплакии шейки матки
Механизм развития лейкоплакии в точности не выяснен. Считается, что под влиянием причинных факторов включаются механизмы ороговения в норме неороговевающего многослойного плоского эпителия шейки матки. На поверхности шейки матки формируются роговые чешуйки, клетки с деформированным ядром и внутриклеточными компонентами. [2]
Классификация и стадии развития лейкоплакии шейки матки
Согласно классификации Я.Б. Бохмана (1976), лейкоплакия, наряду с псевдоэрозией, эктропионом, полипом, эндометриозом шейки матки, цервицитами, истинной эрозией шейки матки, входит в группу фоновых заболеваний шейки матки, при которых не обнаруживается клеток с атипичными признаками, но длительное существование которых может послужить фактором риска развития предрака.
За рубежом лейкоплакию шейки матки с клеточным атипизмом относят к группе предраковой патологии шейки матки — ЦИН (цервикальной интраэпителиальной неоплазии, или дисплазии, шейки матки). [2]
Осложнения лейкоплакии шейки матки
Чем опасна лейкоплакия шейки матки
Лейкоплакия может распространяться с шейки матки на своды влагалища. Злокачественное перерождение клеток лейкоплакии наблюдается у 31,6% больных по данным отечественных авторов, 4,9-9% — по зарубежным данным. [11]
Диагностика лейкоплакии шейки матки
Комплексное обследование при лейкоплакии включает:
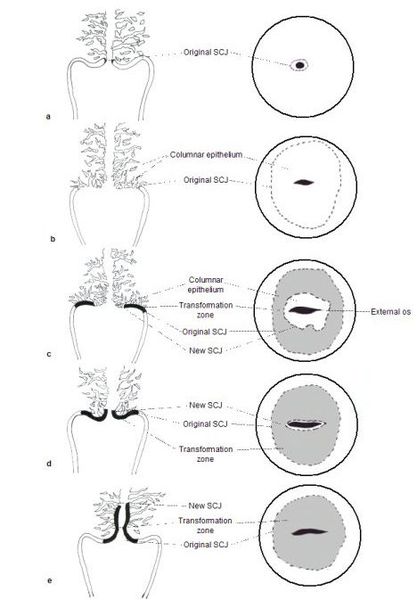
Кольпоскопия
При кольпоскопии устанавливается тип зоны трансформации (переходной зоны стыка двух видов покровного эпителия шейки матки — многослойного плоского и цилиндрического), место расположения лейкоплакии.
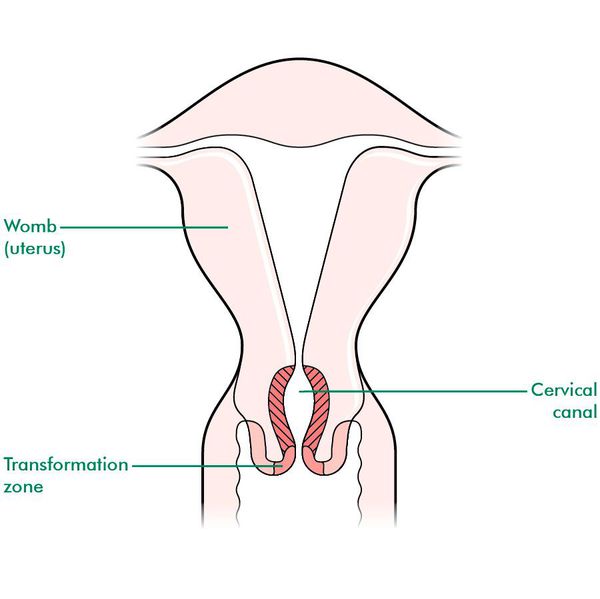
Влагалищная часть шейки матки (экзоцервикс) покрыта многослойным плоским эпителием. В канале шейки матки (цервикальном канале, эндоцервиксе) — цилиндрический эпителий. Место перехода цилиндрического эпителия цервикального канала в многослойный плоский эпителий поверхности шейки матки носит название зоны трансформации. Эта область имеет большое клиническое значение, поскольку именно в ней возникает более 80% случаев дисплазии и рака шейки матки.
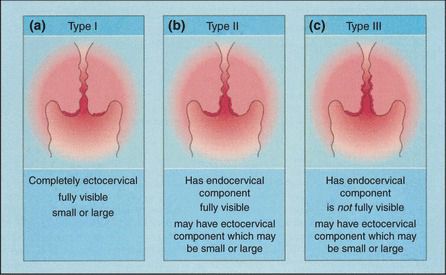
Зона трансформации 2 типа — переходная зона частично скрыта в канале шейки матки. Адекватно оценить такую картину сложно, так как наиболее измененные участки могут быть не видны и пропущены.
Зона трансформации 3 типа — переходная зона находится глубоко в канале шейки матки и оценить её кольпоскопически невозможно. Кольпоскопия в этом случае считается неинформативной, поскольку глубина залегания патологического очага остается неизвестной.
Цитологическое и гистологическое исследование
При лейкоплакии проводится цитологическое (РАР-тест) и гистологическое (полученное при биопсии) исследование клеток и тканей шейки матки. Биопсия шейки матки показана во всех случаях лейкоплакии. Если при гистологической диагностике выявлен доброкачественный гиперкератоз, то многие авторы, особенно зарубежные, считают, что лечить лейкоплакию необязательно [25] .
Сложность диагностики лейкоплакии при помощи простого цитологического соскоба с шейки матки заключается в невозможности оценки полноценного клеточного состава, так как из-за плотных роговых чешуек на поверхности многослойного плоского эпителия шейки матки в соскоб могут не попасть клетки из глубоких слоев. Таким образом может быть пропущена предраковая трансформация или даже рак шейки матки. [3] Именно поэтому основным методом диагностики лейкоплакии шейки матки является исследование ткани шейки матки, полученной при обязательно прицельной биопсии на фоне кольпоскопии. Зона трансформации 2 и 3 типа, определенные при кольпоскопии, могут послужить поводом для проведения не только биопсии, но и выскабливания слизистой канала шейки матки. Более щадящий метод оценки состояния слизистой канала шейки матки возможен при помощи микрокольпогистероскопии (офисная гистероскопия). Преимущество метода заключается в возможности нетравматичного прохождения канала шейки матки (цервикального канала) под визуальным контролем без анестезии. В процессе процедуры можно провести прицельную биопсию. При гистологическом исследовании лейкоплакия характеризуется терминами: кератоз, паракератоз, акантоз.
Бактериологическое исследование
Включает анализ влагалищного мазка и бактериальных посевов на флору и половые инфекции. Исследования важны тем, что при наличии воспаления шейки матки результаты цитологического и гистологического анализов могут быть искажены.
Анализ на ВПЧ
Исследование ДНК ВПЧ высокого онкогенного риска в соскобе с шейки матки и цервикального канала
В настоящее время изучают влияние вирусной инфекции на развитие лейкоплакии. Некоторые авторы считают, что процессы ороговения можно рассматривать как косвенный маркер папилломавирусной инфекции. Лейкоплакия, существующая вне инфицирования ВПЧ, зачастую не озлокачествляется. При сочетании с вирусом вероятность озлокачествления есть, но серьезных подтверждений этому факту пока нет. [12] [13]
Иммунограмма
В основе лейкоплакии шейки матки лежит множество предрасполагающих факторов: иммунные и гормональные нарушения, перенесённые инфекционные заболевания и травматические воздействия на шейку матки [20] . Доказана связь между заболеваниями шейки матки и нарушением местного иммунитета: степень нарушения иммунитета прямо пропорциональна тяжести патологии шейки матки [21] .
Иммунограмма проводятся по показаниям с последующей консультацией иммунолога [18] .
Контроль уровня гормонов
Доказано, что повышенный уровень эстрогенов играет важную роль в развитии лейкоплакии [36] . Поэтому при заболевании исследуют гормональный статус и при необходимости корректируют его [22] .
Лечение лейкоплакии шейки матки
Консервативное лечение
Медикаментозное лечение при лейкоплакии включает:
- этиотропную противовоспалительную терапию;
- коррекцию микробиоценоза влагалища, гормональных и иммунных нарушений [22] ;
- лечение ВПЧ иммуномодуляторами — оправдано лишь вместе с хирургическим вмешательством [23] .
Если у молодой нерожавшей женщины выявлена лейкоплакия шейки матки, но отсутствует ВПЧ, то можно пока не делать операцию, но нужно обязательно наблюдать за состоянием пациентки [24] .
В нашей стране лейкоплакию обычно подвергают деструкции — разрушению патологической ткани. Это обосновано, так как со временем лейкоплакия может трансформироваться, пациентка может заразиться ВПЧ и произойдёт перерождение ткани, что потребует новых биопсий и лишних визитов к врачу.
Хирургическое лечение
Наиболее часто применяемыми методами лечения лейкоплакии шейки матки являются:
- радиоволновая хирургия;
- лазеротерапия (высокоинтенсивное СО2-лазерное излучение);
- диатермокоагуляция (как нежелательный, ввиду большого количества потенциальных осложнений, но возможный метод лечения).
Подготовка к операции включает:
- гинекологический мазок, обследование на инфекции, передаваемые половым путём и бактериологический посев из цервикального канала, если есть воспаление;
- ВПЧ-тест с помощью полимеразной цепной реакции (ПЦР) с генотипированием;
- цитологическое исследование;
- кольпоскопию;
- УЗИ, чтобы выявить объёмные образования шейки матки неясного происхождения;
- гормональное обследование при подозрении на соответствующие нарушения;
- точечную биопсию при адекватной кольпоскопии;
- эксцизионную биопсию (исследуемая ткань удаляется целиком) при неадекватной кольпоскопии — из-за сильного воспаления, искажающего картину, выраженного кровотечения, тяжёлых рубцовых изменений, когда атипически изменённый эпителий распространяется вглубь цервикального канала;
- диагностическое выскабливание эпителия цервикального канала, чтобы исключить предраковые изменения и злокачественную трансформацию эндоцервикса [27] .
Если лейкоплакия шейки матки сочетается с воспалением вульвы и влагалища, то его необходимо устранить до операции [28] .
Как проходят гинекологические операции
При сочетании лейкоплакии с деформацией и гипертрофией шейки матки целесообразно проведение реконструктивно-пластических операций (пластика шейки матки) с целью восстановления анатомии цервикального канала. [14] [15]
Современные зарубежные исследователи расценивают лейкоплакию как доброкачественный физиологический процесс и в большинстве ситуаций рекомендуют профилактическое наблюдение.
Криодеструкция
Криодеструкция — это разрушение патологического очага с помощью низкой температуры. Осуществляется контактным способом, чаще всего однократно. Длительность процедуры зависит от характера и распространённости патологического процесса. В среднем при температуре минус 90 °С достаточно 10 минут [26] .
К достоинствам этого метода относятся безболезненность и возможность провести его в амбулаторных условиях. Эффективность такого лечения составляет от 54 до 96 %. Недостаток метода: повторные случаи лейкоплакии, особенно у пациенток с нарушениями менструального цикла [19] .
Химическая коагуляция
Химическими коагулянтами, например Солковагином, лейкоплакию лечили в 90-х годах ХХ века. Эффективность лечения простой лейкоплакии шейки матки у молодых нерожавших женщин составляла около 70 %. Сейчас этот метод не применяют.
Антибиотикотерапия
Перед операцией необходимо устранить сопутствующий воспалительный процесс в шейке матки. Выбор антибактериальных препаратов зависит от того, какие патогенные микроорганизмы выявлены при анализах [29] [30] [31] [32] . После операции антибиотики не требуются, так как хирургическое вмешательство проводится, только если нет инфекционных процессов.
Физиотерапия
Физиопроцедуры после операций на шейке матки, в том числе и при лейкоплакии, не проводятся.
Народные способы лечения
Не следует применять средства, которые влияют на тканевой обмен: облепиховое масло, масло шиповника, мазь с алоэ и др. Эти препараты могут способствовать разрастанию тканей и возникновению дисплазии шейки матки [23] .
Беременность и лейкоплакия
Во время беременности лечение лейкоплакии шейки матки как без атипии (кератоза или гиперкератоза), так и с атипией (дисплазией), не проводится. При изменениях шейки матки, включая цервикальные интраэпителиальные неоплазии II и III степени (CIN II–III), до родов показано наблюдение: цитологическое исследование и кольпоскопия один раз в 3 месяца [16] . Контрольное цитологическое исследование и кольпоскопию проводят не ранее чем через 6 недель после родов [17] .
При обнаружении лейкоплакии шейки матки у беременных обязательно лечат урогенитальную инфекцию, бактериальный вагиноз и восстанавливают микробиоценоз влагалища.
При обнаружении ВПЧ-инфекции применяют интерферонотерапию, например препарат Виферон (гель, ректальные суппозитории) после 14-ой недели беременности. Повторные курсы проводят на 22–24-ой и 32–34-ой неделях беременности [16] . Лейкоплакия на течение беременности и вынашивание плода не влияет.
Реабилитация
Сразу после процедуры пациентку могут беспокоить тянущие боли внизу живота, однако они быстро проходят. Выделения чаще всего светлые слизистые или водянистые, редко с прожилками крови.
Кровянистые выделения после операции возникают редко. Но если они появились, беспокоят дольше 5–10 дней и/или менструации становятся обильнее и выделяются кровяные сгустки, то следует немедленно обратиться к врачу.
Также должна насторожить температуры тела свыше 37,5 °C, сильные боли внизу живота и гноевидные выделения из половых путей с резким неприятным запахом.
После операции в течение месяца рекомендуется:
- воздержаться от половой близости;
- не принимать ванну, мыться можно только под душем;
- не спринцеваться и не пользоваться влагалищными тампонами;
- избегать перегревания, не посещать бани и сауны;
- не плавать в бассейне и не купаться в природных водоёмах;
- не заниматься спортом и не поднимать тяжести свыше 3 кг.
Через две недели после операции врач проводит гинекологический осмотр, чтобы удостовериться, что пациентка восстанавливается. Слизистая полностью приходит в норму за 4–6 недель.
Наблюдение после лечения
Частота посещения доктора зависит от формы заболевания, эффективности лечения и наличия факторов риска, которые могут осложнить выздоровление: курение, ВИЧ-инфекция, заболевания, передаваемые половым путём, носительство онкогенных типов ВПЧ и т. п.
Цитологический метод является самым оптимальным для наблюдения после операции, за рубежом иногда дополнительно используется ВПЧ-тест. Если результаты РАРР- и ВПЧ-тестов положительные, то проводят кольпосокпию [25] .
Диспансерное наблюдение после лечения лейкоплакии без атипии проводится один раз в полгода в течение двух лет. Включает кольпоскопическое и цитологическое исследования, анализ на ВПЧ [18] . Если лечение было эффективным, на кольпоскопии не выявлено патологий, в мазке на онкоцитологию нет атипичных клеток, тест на ВПЧ отрицательный, то пациентке можно посещать врача один раз в год.
Диета
После лечения лейкоплакии следует придерживаться принципов правильного питания, специфическая диета не требуется.
Прогноз. Профилактика
При лейкоплакии шейки матки прогноз, как правило, благоприятный.
Принципы профилактики развития лейкоплакии шейки матки включают:
- рациональное лечение патологических процессов шейки матки, исключающее необоснованные повторные травмирующие воздействия на шейку матки устаревших методов (диатермокоагуляция, химическая коагуляция). Пациентки, в прошлом имевшие диатермокоагуляцию или химическую коагуляцию шейки матки нуждаются в ежегодном контрольном наблюдении, особенно при наличии ВПЧ;
- своевременное выявление и лечение воспалительных процессов половых органов;
- устранение нарушений менструального цикла; [1]
- ежегодное исследование цитологического мазка (РАР-тест) достоверно тражает наличие связанных с ВПЧ изменений клеток и поражений-предшественников предраковой патологии шейки матки. [6]
Лейкоплакия ротовой полости является наиболее встречающимся предраковым состоянием. После 50-ти лет лейкоплакия диагностируется у 1% населения, при этом заболеваемость среди мужчин в два раза выше, чем среди женщин. Лейкоплакия полости рта проявляется распространенными или локальными очагами поражения, представляющими собой сероватые или белые бляшки самой различной локализации. Для лейкоплакии характерно малосимптомное и вялое течение с постепенным перерождением в раковое заболевание. Лечение лейкоплакии - это, прежде всего, устранение травматизации пораженного участка и коррекция причинной патологии.


Общие сведения
Лейкоплакия – поражение слизистой оболочки рта, сопровождающееся ее повышенным ороговением (гиперкератозом). Характеризуется возникновением очагов уплотнения на слизистой щек, языка, уголков рта, чувством легкого жжения, зуда и стягивания. При соблюдении гигиенических мероприятий и проведении санации полости рта, устранении раздражающих факторов лейкоплакия может исчезнуть. Некоторые формы лейкоплакии подвержены злокачественному перерождению и подлежат хирургическому иссечению.

Причины лейкоплакии полости рта
Люди, у которых на слизистую полости рта часто воздействуют различные раздражители, более подвержены развитию лейкоплакии. В основном это активные курильщики и люди, злоупотребляющие крепкими сортами алкогольных напитков. Лейкоплакия может возникнуть вследствие постоянного приема горячей и острой пищи, пряностей. При длительном приеме некоторых лекарственных препаратов лейкоплакия может проявиться как побочное действие, особенно часто это случается у пожилых пациентов, которые принимают препараты разных фармакологических групп.
То есть, любые раздражители, вызывающие замещение слизистой оболочки на ороговевший эпителий, могут стать причиной лейкоплакии полости рта. Лейкоплакия не является самостоятельным заболеванием, поэтому при появлении белесых пятен на слизистой рта следует провести детальное обследование, чтобы выяснить основную причину синдрома лейкоплакии.
Раздражение слизистой оболочки рта и десны острыми краями зубов или коронок является постоянным травмирующим фактором, что и может стать причиной лейкоплакии. Неправильно установленный или некачественный зубной протез особенно в сочетании с другими факторами, у многих пациентов старческого возраста является основным патогенетическим звеном в развитии лейкоплакии и других заболеваний полости рта. У пациентов с ВИЧ-инфекцией лейкоплакия диагностируется в несколько раз чаще, как и пациентов, которые в течение жизни подвергались длительному воздействию ультрафиолетового излучения.
Исследования подтверждают, что в этиологии лейкоплакии имеет значение наследственная предрасположенность и наличие вируса папилломы человека типа 11 и 16. Гиповитаминозы, железодефицитные анемии, сахарный диабет и болезни органов желудочно-кишечного тракта являются основными эндогенными причинами лейкоплакии.
Клинические проявления лейкоплакии

Синдром лейкоплакии может появиться на любом участке, где имеется слизистая оболочка. Различают лейкоплакию влагалища, пищевода, шейки матки, мочевого пузыря и полости рта. Лейкоплакия в полости рта диагностируется раньше, чем в других органах. Ранняя диагностика позволяет вовремя назначить лечение и предотвратить малигнизацию.
В зависимости от месторасположения пораженных клеток и от основной причины лейкоплакии степень и тип ороговения эпителия может быть различным.
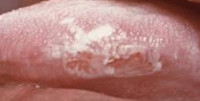
Очаг поражения лейкоплакией состоит из бляшек серого или белого цвета. Диаметр бляшек от 2-х до 4-х сантиметров, их количество вариабельно. Локализуются очаги лейкоплакии на слизистой оболочке щек, спайке губ, твердом нёбе, дёснах и дне рта. Обычно бляшки не возвышаются над поверхностью слизистой оболочки рта, кроме этого, сочетаясь с общей цианотичностью, участки лейкоплакии могут быть не заметны при невнимательном осмотре.
В тех случаях, когда очаги лейкоплакии возвышаются над поверхностью, они имеют неправильные фестончатые очертания, иногда острые неровные углы. Часто при таких лейкоплакиях поверхность очагов неоднородная и изъязвлена. На ощупь бляшки жесткие, шероховатые.
Формируются очаги лейкоплакии в течение нескольких месяцев, хотя в большинстве случаев они становятся заметными уже через две недели. Внешне участки лейкоплакии на перовом этапе возвышаются и выглядят слегка утолщенными. По прошествии времени они затвердевают и грубеют. Болезненность и другие субъективные ощущения отсутствуют, но иногда участки лейкоплакии более чувствительны к раздражителям, острее реагируют на горячую и холодную пищу.
Лейкоплакия является вялотекущей патологией, обычно ее симптомы то стихают, то нарастают на протяжении многих лет. Но однако, обратного развития лейкоплакия не принимает; со временем площадь поражения увеличивается, появляются трещины и изъязвления, бляшки буреют и становятся более плотными. Такое перерождение является неблагоприятным признаком и расценивается как предраковое состояние или же начало перерождения в раковое заболевание слизистой полости рта.
Волосистая лейкоплакия является атипичным вариантом течения заболевания и встречается в основном у ВИЧ-положительных пациентов и у пациентов со СПИДом, иногда волосистая лейкоплакия наблюдается у пациентов со СПИД-ассоциированным симптомокомплексом. Клинически ворсистая лейкоплакия характеризуется появлением белых бляшек, покрытых ворсинками. Поскольку участки лейкоплакии чаще располагаются на языке, то следует дифференцировать ее от кандидозного стоматита. Хотя у пациентов с ВИЧ-положительным статусом довольно часто волосистая лейкоплакия сочетается с кандидозным стоматитом.
Диагностика и лечение лейкоплакии полости рта
Во время визуального осмотра стоматолог может поставить предварительный диагноз, но для точной диагностики лейкоплакии необходимо проводить биопсию. Биопсию проводят под местным обезболиванием, и полученный материал исследуют в цитологической лаборатории.
Тактика лечения лейкоплакии полости рта сводится к устранению источника раздражения. Это минимизация или полный отказ от курения, коррекция зубных протезов, реставрация зубов при обломке их краев, обточка острых краев зуба. В тех случаях, когда причинами лейкоплакии явились внутренние заболевания, показана криодеструкция пораженных участков, коррекция основного заболевания и диспансерное наблюдение пациента.
Лейкоплакия является предопухолевым состоянием слизистой, и, если пятна лейкоплакии утрачивают блеск, поверхность становится шероховатой, покрывается разрастаниями и язвочками, то, как правило, прогноз в этих случаях неблагоприятный и лейкоплакия перерождается в рак полости рта. Примерно 10% случаев лейкоплакии слизистой оболочки рта заканчиваются малигнизацией.
Читайте также:

