Возбудители малярии и токсоплазмоза
Обновлено: 11.05.2024
Токсоплазмоз — хроническая протозойная инфекция, проявляющаяся поражениями нервной системы, печени, селезёнки, скелетных мышц и миокарда. Возбудитель токсоплазмоза — Toxoplasma gondii.
Впервые возбудителя токсоплазмоза выделили Ш. Николь и Л. Мансо (1908) у грызунов гунди (Ctenodactylus guncli). T. gondii— внутриклеточный паразит длиной 4-7 мкм, напоминающий дольку апельсина или вытянутую луковицу [от греч. toxon, лук, + plasma, имеющий форму].
По Романовскому-Гимзе цитоплазма токсоплазм окрашивается в голубой цвет, ядро — в красно-фиолетовый. Заражение человека происходит алиментарным путём при проникновении ооцист или тканевых цист (при употреблении сырых или полусырых мясных продуктов, немытых овощей и фруктов), реже через кожу (при разделке туш, работах с лабораторным материалом) или трансплацентарно.
Токсоплазмоз распространен повсеместно, инфицированность населения разных стран составляет 4-68%. Первичные и основные хозяева — домашние кошки и прочие представители семейства кошачьих. Промежуточные хозяева — человек, многие дикие и домашние животные и птицы.
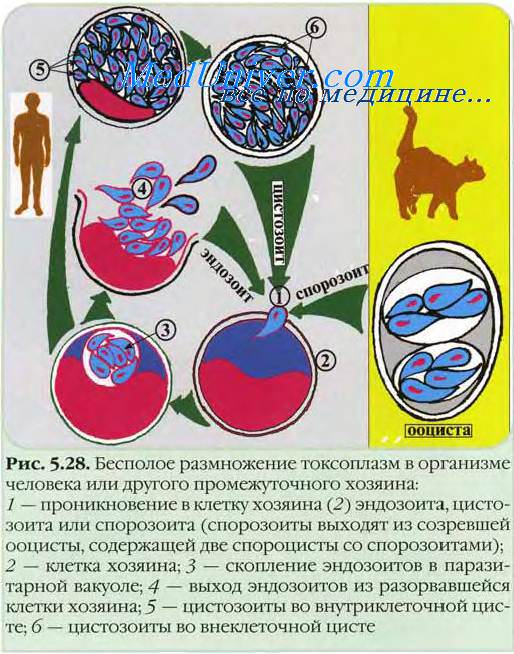
Жизненный цикл токсоплазмоза
Жизненный цикл токсоплазмоза состоит из стадий полового (гаметогония) и бесполого (шизогония, эдодиогения, спорогения) размножения. Половым путём токсоплазмы размножаются в организме кошачьих; бесполым путём — как у основных, так и промежуточных хозяев.
В организме любого теплокровного животного токсоплазмы могут достигать стадии тканевых псевдоцист, в которых бесполым путём образуются цистозоиты (мерозоиты). Первичное заражение кошачьих происходит при поедании мяса промежуточных хозяев. Паразиты проникают в клетки кишечника и превращаются в трофозоиты, размножающиеся бесполым путём. В клетках слизистой оболочки кишечника также происходит половое размножение паразита. Размножившиеся цистозоиты разрушают эпителиальные клетки и проникают в подлежащие слои кишечной стенки, где и трансформируются в гаметоциты. После слияния разнополых гаметоцитов образуется зигота-ооциста — округлое образование с плотной бесцветной двухслойной оболочкой диаметром 9-14 мкм. Из организма основных хозяев ооци-сты выделяются с испражнениями. Они хорошо сохраняются в почве, при их заглатывании происходит заражение промежуточных хозяев. Из ооцист выходят спорозбиты, активно поглощаемые макрофагами, но фагоцитоз носит незавершённый характер, благодаря чему спорозоиты диссеминируют по лимфотоку. В цитоплазме макрофагов начинается первый этап шизогонии. На более поздних этапах шизогонии макрофаги погибают, и высвободившиеся паразиты (тахизои-ты) инвазируют клетки организма (инвазии подвержены любые ядросодержащис клетки).
• В острой стадии токсоплазмоза в инфицированных клетках образуются псевдоцисты в виде скоплений токсоплазм. При их разрушении паразиты инвазируют соседние клетки, и происходит повторение цикла. Паразитемия развивается только в острой стадии.
• При хронических процессах возбудитель токсоплазмоза образует истинные цисты с плотной оболочкой (средний размер 100 мкм). Каждая циста содержит более сотни паразитов (брадизбиты), расположенных так плотно, что на препаратах видны одни ядра. В организме цисты сохраняются годами и десятилетиями.
Эта фаза конечная для паразита токсоплазмоза в организме всех животных, исключая окончательного хозяина, в котором завершается жизненный цикл.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Эволюционная линия приматов, впоследствии развившаяся в современного Homo Sapiens, малярией болеет, как минимум, 50 тысяч лет. Весьма интересна история формирования видовой иммунной защиты от возбудителя (к сожалению, врожденный иммунитет у человека не выработался, как не вырабатывается и приобретенный); не менее интересна история исследований в этой области, отмеченная несколькими Нобелевскими премиями – эти сведения есть, например, в Википедии.
Возбудитель
У некоторых видов паразитического плазмодия спорозоиты или, вернее, спящая гипнозоитная форма может оставаться в печени годами, сохраняясь способность к рецидивной активизации.
Инкубационный период от момента заражения до клинической манифестации может достигать 10 месяцев, но у неиммунных лиц развивается уже через две недели.
Симптоматика
Как следует из устаревшего названия (см. выше), доминирующим симптомом малярии выступает лихорадка, причем т.н. пирогенный порог, – минимальная концентрация паразитов в крови, при котором наступает сенсибилизация к чужеродному белку и развивается гипертермия, – у больного повышается с каждым рецидивом, то есть новые приступы требуют более многочисленного присутствия плазмодия в организме. Если при первичной инфекции бывает достаточно нескольких особей на один микролитр крови, то у частично иммунокомпетентных лиц (например, у жителей эндемичных по малярии регионов) пирогенный порог может достигать нескольких тысяч на 1 мкл.
Различают четыре клинических формы малярии: трех- и четырехдневная, овале-малярия и тропическая малярия. Каждая форма отличается определенной спецификой, но анемия (обусловленная массовой гибелью эритроцитов), увеличение селезенки и печени, а также приступообразная лихорадка присущи всем формам.
К очень тяжелым последствиям приводит малярия в период гестации, – как для беременной женщины, так и для плода. Тяжелые осложнения со стороны урогенитальной, нервной, дыхательной, билиарной, сердечнососудистой и других систем организма вообще присущи больным малярией, независимо от пола и возраста.
Диагностика
Наиболее информативным и распространенным методом диагностики малярии является микроскопия образца крови. Реже применяют иммунологические (иммуноферментные) методы; в отдельных случаях прибегают к дорогостоящему генетическому анализу ПЦР (полимеразная цепная реакция).
Лечение
С ХVII века и по настоящее время основным лечебным средством остается хинин – алкалоид, получаемый из коры хинного дерева. Попытки использовать альтернативные препараты, например, хлорохин, закончились плачевно из-за формирования резистентности у возбудителя. Та же ситуация может повториться с дорогим, но эффективным препаратом артемизинином, который сейчас служит хорошей альтернативой хинину.
Наилучшим средством борьбы с малярией по сей день остается уничтожение переносчика: это вполне реально и позволяет добиться кардинального сокращения заболеваемости. Однако у большинства эндемичных стран такой возможности нет, – в силу низкого социально-экономического развития, – как нет и возможности осуществлять широкомасштабные лечебно-профилактические мероприятия на государственном уровне.
В настоящее время активно ведется разработка противомалярийных вакцин и прививок, проходят клинические испытания некоторые экспериментальные препараты, однако до начала их серийного производства и повсеместного практического применения пройдет, по-видимому, еще несколько лет.
Возбудитель
На сегодняшний день общая распространенность носительства токсоплазмы в мире оценивается в пределах 40-70%; иногда приводятся и более высокие проценты. Однако статистика обнаруживает выраженную региональную зависимость, что отчасти обусловлено неравномерностью распределения самой токсоплазмы в земной экосистеме (в Южной Корее, например, ее почти совсем нет, а в Южной Америке очень много – в некоторых областях заражено до 90% населения). Частота встречаемости в России оценивается на уровне 20%, то есть каждый пятый из нас является, как минимум, носителем.
В течение активного, острого периода течения токсоплазмоза (2-3 недели) больная кошка с фекалиями выделяет порядка двух миллиардов цист.
Жизнеспособность их сохраняется, в зависимости от условий, до двух и более лет.
Заражение
Кроме того, возможно внутриутробное трансплацентарное заражение от первично инфицированной матери. Обратим на это особое внимание.
Патогенез
Опасность для человека, симптоматика
Крайне важно отметить: доля инфицированных токсоплазмой людей, у которых развивается клинически значимый токсоплазмоз, очень мала – по разным оценкам, она варьирует от долей процента до нескольких процентов. Животные и птицы болеют токсоплазмозом гораздо чаще (см. ниже). Человек же практически всегда переносит токсоплазменную инвазию бессимптомно, поскольку иммунная система мгновенно распознает этот микроорганизм как враждебный – и реагирует настолько мощно, что инфицированный обычно даже не узнаёт о том, что был чем-то заражен. Кроме того, исключена опасность заразиться от инфицированного, даже если он переживает острый период токсоплазмоза (как правило, не подозревая об этом).
Таким образом, нет никаких оснований создавать лепрозории для носителей, повсеместно истреблять диких кошек и избавляться от кошек домашних, а ребенка выпускать на улицу лишь в скафандре высшей эпидемиологической защиты. Можно сказать, что мы, взрослые люди, если и были когда-то инфицированы, то эта проблема давным-давно решена, причем раз и навсегда: к токсоплазме вырабатывается устойчивый пожизненный иммунитет, и даже если человек попадает в незначительный процент переболевших в клинически значимой степени (лихорадка, легкое общее недомогание, мышечные боли, лимфаденопатия, спленогепатомегалия), то это уже не повторяется ни при каких обстоятельствах.
Как показано выше, токсоплазма способна проникать через плаценту в организм плода. Единственный вариант и единственное стечение обстоятельств, при которых это представляет реальную угрозу, – первичное инфицирование токсоплазмой в период беременности, т.е. первое в жизни заражение женщины, у которой ранее не было иммунитета к возбудителю. В этом случае действуют следующие статистические риски и клинические закономерности.
Чем больше срок беременности, тем выше проницаемость плаценты и вероятность инфицирования плода: в зависимости от триместра, этот риск оценивается как 15%, 25% и 70%.
Если внутриутробное заражение все же произошло, то тяжесть последствий для плода тем больше, чем меньше срок беременности. Вероятности того, что внутриутробный токсоплазмоз в дальнейшем ничем себя не проявит, – не существует. Надеяться на то, что произойдет уникальное чудо и последствий удастся избежать, к несчастью, не приходится даже в том случае, когда инвазия сразу же диагностирована и подвергнута интенсивному квалифицированному лечению. На практике внутриутробный токсоплазмоз означает смерть плода со спонтанным абортом, рождение с гидро- либо микроцефалией, или же развитие, в дальнейшем, тяжелейших поражений центральной нервной, зрительной и других систем организма. Интеллектуальная недостаточность характеризуется глубокой степенью выраженности.
В подобной ситуации, – когда происходит первичное заражение беременной женщины, – приходится ставить вопрос об искусственном прерывании беременности.
На последующие беременности вышеописанные риски не распространяется: речь, повторим, идет лишь о ситуациях, когда первичная инвазия токсоплазмы приходится на гестационный период.
Частота врожденного токсоплазмоза на сегодняшний день варьирует в пределах от 1:1000 до 1:10000 новорожденных.
Диагностика
Стандартом диагностики токсоплазмоза, в том числе на этапе внутриутробного развития, является серологическое исследование: реакция непрямой флюоресценции или ИФА (иммуноферментный анализ). Дополнительно назначают УЗИ и другие исследования по показаниям.
Лечение
Профилактика
Учитывая вышесказанное, женщине при планировании или наступлении беременности чрезвычайно важно пройти все назначенные обследования, ни в коем случае не игнорируя какие бы то ни было анализы и процедуры. Если обнаружено отсутствие иммунитета к токсоплазме, или же имеет место выраженный иммунодефицит, необходимо принимать все меры предосторожности, особенно при наличии в доме кошки: животное не должно гулять на улице и питаться сырым мясом. Санитарную обработку туалетного лотка следует производить регулярно, и лучше бы к нему не прикасаться человеку, для которого токсоплазма представляет опасность. Кошку желательно обследовать в ветеринарной клинике и, если выявлен паразитоз, качественно пролечить. Возможно, наилучшим решением является, – как бы тяжело это ни было для большинства семей, – расстаться с домашним питомцем, по крайней мере временно, на период вынашивания беременности.
Овощи и фрукты необходимо тщательно отмывать; любые мясные продукты должны проходить достаточную термическую обработку, а столы и доски, на которых разделывается мясо, – очищаться с применением моющих средств. Все гигиенические процедуры, особенно после любого контакта с землей, овощами, фруктами, ягодами и т.д., лица из группы риска должны выполнять сразу же, с мылом, самым тщательным образом.
Странное дело: о мире простейших практически невозможно рассказать в двух словах – писать приходится много. Вопреки своему названию, эти микроорганизмы весьма сложны, разнообразны, неисчерпаемо интересны, а порой уникальны.
Некоторые смертельно опасны.
Но дело даже не в миграционных потоках. Сам мир изменился, став совсем маленьким, тесным и круглым. Расстояний больше нет. Приходится узнавать о болезнях, которые раньше не всякому-то специалисту были известны, и читать о возбудителях этих инфекций, уповая на всемогущество антибиотиков да на собственный иммунитет.
Иммунитет у Homo Sapiens хоть и силен, да не абсолютен; к тому же подрываем мы его сами, подрываем на каждом шагу, прекрасно зная, – чем. Жизнь у нас такая, и такая уж у нас цивилизация…
В подцарство простейших (protozoa) выделены одноклеточные эукариоты, т.е. микроорганизмы, имеющие в строении одно или несколько клеточных ядер. Этим они отличаются от бактерий (прокариотов, доядерных и безъядерных одноклеточных) и от вирусов, которые являются неклеточной формой органики (если считать органикой упакованные сгустки рибонуклеиновых молекул).
Большинство простейших отличается также:
- сложным многофазным жизненным циклом;
- способностью размножаться как бесполым делением с рекомбинацией ДНК (подобно бактериям), так и более совершенным, с генетической точки зрения, гаметогенезом (с образованием предзародышевых половых клеток-гамет);
- наличием органоидов (ложноножки-псевдоподии, жгутики, цитостомы, реснички, мембраны и т.д.);
- гетеротрофным питанием (могут паразитировать в макроорганизме, поглощая его клетки; или питаются детритными, разлагающимися органическими массами, т.е. ведут сапротрофный образ жизни; либо же охотятся и пожирают другие микроорганизмы);
- способностью как к одиночному, так и колониальному существованию;
- размерами (эта характеристика широко варьирует у всех мельчайших, но в среднем протозоа в тысячи раз больше вирусов и на порядок больше бактерий; некоторые простейшие видны невооруженным глазом, достигая нескольких миллиметров в размерах, а отдельные гигантские многоядерные виды вырастают до 10-15 см, оставаясь при этом одноклеточными и соответствуя всем критериям протозойного подцарства).
Впадать в тоскливо-обреченный ужас, конечно, не стоит. Все-таки Homo Sapiens неизмеримо сложнее (в этом его слабость), изобретательнее и умнее – в этом сила. Знать, понимать, соблюдать разумную осторожность и принимать адекватные меры – необходимо. Ниже перечислены и очень кратко описаны лишь самые распространенные протозойные паразитозы. Большинству из них на сайте Лахта Клиники посвящены также отдельные статьи; остальные заболевания этой категории, если понадобится, подробно рассмотрим в будущем.
Малярия, она же болотная лихорадка. Исторически первое заболевание, в отношении которого была установлена протозойная этиология. По уровню летальности занимает пятое место среди всех инфекционных болезней и первое место среди паразитарных (от малярии погибает примерно три миллиона человек в год). Вызывается плазмодиями класса Sporozoa; на сегодняшний день патогенность обнаружена у пяти видов из более чем двухсот.
Распространяется промежуточными хозяевами, – комарами-анофелесами; передается также через зараженный шприц, при переливании крови и трансплацентарно (плоду от инфицированной матери). Помимо собственно лихорадки, приводит к тяжелым, жизнеугрожающим полиорганным осложнениям. Иммунитет вырабатывается лишь частично. Вакцины и средства профилактики в настоящее время находятся на стадии разработки, лабораторных экспериментов и клинических испытаний.
Амебиаз. Вызывается несколькими видами внутритканных паразитов рода амеб. Встречается в тяжелых церебральных, легочных, печеночных, кожных и других клинических формах, однако наиболее распространенным является кишечный амебиаз (амебная дизентерия, амебный колит), вызываемый Entamoeba histolytica. Второе по летальности протозойное заболевание. Распространяется фекально-оральным путем, через зараженную воду и немытые руки. Иммунитет к амебным инвазиям не формируется. Инфицировано не менее полумиллиарда человек, у каждого десятого из заражаемых развивается клинически значимая симптоматика.
Токсоплазмоз. Вызывается единственным известным на сегодняшний день представителем рода токсоплазмы – Toxoplasma Gondii, мелким внутриклеточным паразитом. Окончательный хозяин, в организме которого токсоплазма размножается гаметогенезом и образует способные к активизации цисты, – семейство кошачьих. Человечество как один из промежуточных носителей инфицировано на 40-70%. Подавляющее большинство случаев острого токсоплазмоза протекает бессимптомно, с формированием стойкого пожизненного иммунитета. Вместе с тем, для лиц с выраженным иммунодефицитом токсоплазма смертельно опасна. Кроме того, при первичном заражении беременной женщины инфицируется и плод: в этом случае со стопроцентной вероятностью нарушается внутриутробное развитие, что приводит к тяжелейшим поражениям центральной нервной и других систем организма, – либо врожденным, либо проявляющимся в детском возрасте. Даже в случае своевременной диагностики на этапе гестации – лечение малоэффективно.
Трихомониаз. Вызывается видом Trichomonas vaginalis, урогенитальным паразитом из рода трихомонад класса жгутиковых. Реальная распространенность неизвестна, оценивается на уровне трехсот миллионов человек, однако с учетом пассивного носительства мужчинами доля инфицированных, по-видимому, гораздо больше. Передается половым путем или от беременной матери к плоду. Является наиболее частым ЗППП в мире, при этом наиболее контагиозным и наиболее вирулентным. Чаще всего обнаруживается в составе комбинированных инфекций, потенцирует патогенность папилломавируса и других вирусных инвазий. При хронизации и длительном течении вызывает ряд тяжелых осложнений со стороны репродуктивной системы. Повышает риск рака шейки матки, преждевременных родов и, даже если роды происходят в срок, дефицита массы тела у новорожденного.
Условным патогеном является также кишечная трихомонада, способная при определенных условиях вызывать соответствующую симптоматику.
Лямблиоз (гиардоз, жиардоз). Вызывается кишечным паразитом Giardia intestinalis из класса жгутиковых. Распространяется преимущественно фекально-оральным путем, а также бытовым и через воду, в том числе водопроводную (поскольку возбудитель устойчив к хлору). Инфицирована, как минимум, треть человечества, в большинстве бессимптомно или малосимптомно. Иммунитет не вырабатывается. Лямблии (жиардии) колонизируют тонкий кишечник, вызывая клинику гастроэнтерита, астенический синдром, снижение массы тела. Способы паразитирования изучены не полностью, равно как не до конца прояснены этиопатогенетические механизмы: способность вызывать осложнения в желчевыводящих путях опровергнута, риск осложнений со стороны кожи, иммунной системы и т.д. в настоящее время изучается и обсуждается.
Бабезиоз (бабезиеллёз). Вызывается внутриклеточным паразитом Babesia из отряда пироплазмид (в той или иной степени патогенны более 100 видов). Клинически проявляется лихорадочным симптомокомплексом, нарушениями состава крови, поражением печени. Инфицируется, в основном, крупный рогатый скот, однако во второй половине ХХ века стали регистрироваться случаи заболевания у человека. Точная распространенность неизвестна, этиопатогенез изучен недостаточно. Распространяется через укусы клещей.
Лейшманиоз. Эндемичное (регионально-зависимое) протозойное заболевание, распространенное в тропиках и субтропиках. Вызывается более чем 20 видами внутриклеточного паразита Leishmania, передается, в основном, через укусы москитов. Инфицировано не менее 12 млн человек. Встречается в кожной, кожно-слизистой и висцеральной (поражение внутренних органов) формах; при осложненном хроническом или тяжелом остром течении заболевание результирует фатально.
Малярию выявляют в регионах от 45° северной до 40° южной широты, чаще в тропиках и субтропиках. В странах с умеренным климатом основной возбудитель малярии — P. vivax, в тропиках — P. falciparum.
Резервуар возбудителя малярии — больной человек; основной механизм заражения — трансмиссивный. Переносчики малярии — самки комаров рода Anopheles; этиологическую роль комаров доказал Р. Росс (1897). Человек— промежуточный, а комар — окончательный хозяин паразита. Также возможно вертикальное заражение от матери к плоду.
В 104 эндемичных малярии странах регистрируют около 250 млн новых случаев заболевания; смертность от малярии достигает 1-2 млн ежегодно. Заболеваемость напрямую зависит от размеров популяции комаров и количества больных, служащих резервуаром инфекции. В связи с развитием индустрии туризма заболевание стали выявлять в странах, лежащих за пределами естественного ареала.
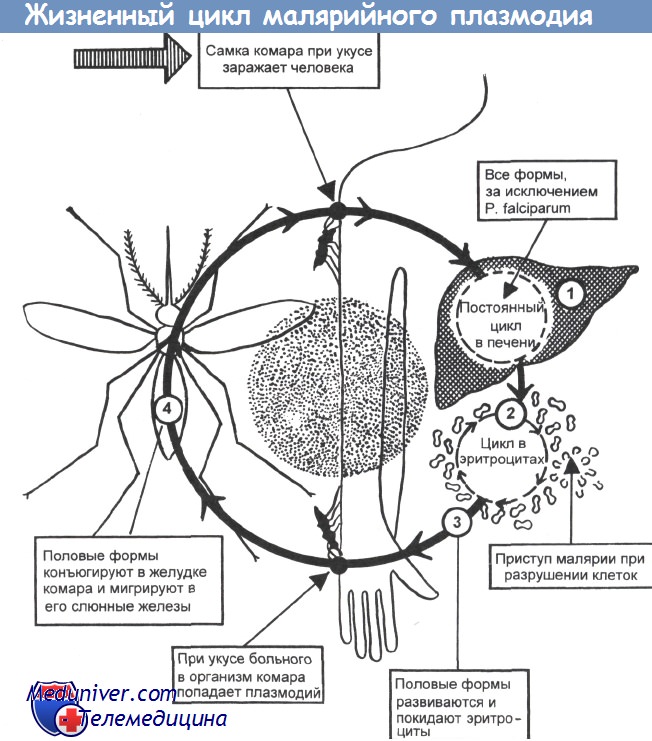
Жизненный цикл малярийных плазмодиев
У различных видов малярийных плазмодиев жизненный цикл практически одинаков, а основные различия связаны с характером поражений эритроцитов. В организме человека происходит бесполая стадия (шизогония), в организме комаров — половая стадия (спорогония).
• Спорогония малярийных плазмодиев происходит в клетках эпителия ЖКТ комара; её продолжительность 1 -3 нед. С кровью больного в организм комара проникают мужские и женские гаметы (гамонты), попарно сливающиеся в зиготы, проникающие в стенку кишки и образующие там ооцисты. Содержимое ооцист претерпевает процесс спорогонии, то есть многократного деления с образованием веретенообразных спорозоитов. Спорозоиты — подвижные клетки длиной 11-15мкм, диссеминирующие по всему организму насекомого. Часть из них проникает в слюнные железы комара, в результате чего он становится переносчиком болезни.
• Тканевая (экзоэритроцитарная) шизогония малярийных плазмодиев происходит в гепатоцитах и продолжается 1-2,5 нед. Уже через час после укуса комара спорозоиты проникают с кровотоком в клетки печени, где происходит их размножение и деление. В результате деления образуются мерозоиты (каждый спорозоит может образовать от 2000 до 40 000 мерозоитов), разрушающие гепатоциты и проникающие в кровоток.
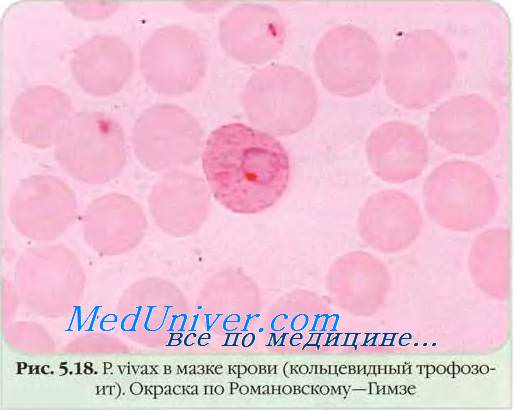
• Эритроцитарная шизогония малярийных плазмодиев происходит после проникновения мерозоитов в эритроциты путём эндоцитоза, где образуется паразитоформная псевдовакуоль. Затем мерозоиты превращаются в трофозбиты (бесполые формы), утилизирующие гемоглобин. В ходе развития паразитов в эритроцитах происходит накопление пигмента. Юные трофозои-ты содержат ядро с одним хроматиновым зерном и внешне напоминают перстень или кольцо. Незрелые трофозоиты имеют амёбовидную форму, а трофозоиты P. vivax способны передвигаться внутри эритроцитов [от лат. vivax, живой]. У зрелых трофозоитов ядра делятся; образуются многоядерные шизонты (делящиеся формы), дающие новое поколение мерозоитов. Выход мерозоитов из эритроцита сопровождается его разрушением. Цикл развития для P. malariae составляет 72 ч, для других видов — 48 ч. В некоторых эритроцитах развиваются мужские (микрогаметоциты) и женские (макрогаметоциты) гамонты, завершающие своё развитие только в организме комара в течение 7-45 сут.
• С наступлением эритроцитарной шизогонии малярийных плазмодиев размножение P. malariae и Pj. falciparum в печени прекращается, однако у P. vivax и P. ovale часть спорозоитов (гипнозоиты) остаётся в гепатоцитах, образуя дремлющие очаги, дающие отдалённые рецидивы.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Читайте также:

