Возвратная пиодермия синдром джоба бакли
Обновлено: 25.04.2024
Суммарные иммуноглобулины Е (IgE) сыворотки человека – это гамма-глобулины, вырабатываемые В-лимфоцитами. Их основная функция – участие в реакциях немедленного (реагинового) типа, а также противопаразитарная защита.
Синонимы русские
Иммуноглобулины класса Е.
Синонимы английские
Immunoglobulin E, IgE, total (serum).
Метод исследования
Твердофазный хемилюминесцентный иммуноферментный анализ ("сэндвич"-метод).
Диапазон определения: 0,1 - 50000 МЕ/мл.
Единицы измерения
МЕ/мл (международная единица на миллилитр).
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
- Не принимать пищу в течение 2-3 часов перед сдачей анализа, можно пить чистую негазированную воду.
- Исключить физическое и эмоциональное перенапряжение в течение 30 минут до исследования.
- Не курить в течение 3 часов до исследования.
Общая информация об исследовании
Иммуноглобулины сыворотки человека (Ig, антитела) – это гамма-глобулины, производимые бета-лимфоцитами. Их основная функция – распознавание и уничтожение антигенов. Иммуноглобулины состоят из 2 тяжелых (Н) и 2 легких (L) цепей, связанных дисульфидными мостиками. В зависимости от строения Н-цепей они подразделяются на классы: G, M, A, D и E.
Иммуноглобулины класса Е (реагины) участвуют в развитии атопических аллергических реакций (бронхиальной астмы, ринита, крапивницы, атопического дерматита и др.). Они способны быстро присоединяться к поверхности тучных клеток и базофилов кожи и слизистых оболочек. Поэтому повторный контакт реагиновых IgE с антигеном (аллергеном) происходит на поверхности этих клеток, что приводит к высвобождению из них вазоактивных веществ (гистамина, серотонина, гепарина и др.) и развитию клинических проявлений реакции гиперчувствительности 1-го типа.
У 75 % детей, родители которых страдают аллергическими заболеваниями, уровень IgE повышен. Среди здоровых детей повышенный уровень общего IgE связан с 10-кратным увеличением риска развития аллергических заболеваний в течение ближайших 18 месяцев по сравнению с детьми, у которых уровень общего IgE в крови в пределах нормы. Тест на общие IgE в плазме крови используется в качестве скрининга для выявления аллергии, однако для поиска причинного аллергена необходимо выявление специфических к нему IgE.
Кроме того, IgE играют существенную роль в формировании антипаразитарного иммунитета к аскаридам, токсоплазмам, нематодам, эхинококкам, трихинеллам и другим паразитам, что обусловлено способностью IgE взаимодействовать с антигенами гельминтов. Поэтому повышение содержания в плазме крови общего IgE может свидетельствовать о наличии паразитарной инвазии.
Пиодермии объединяют в себе гнойно-воспалительные кожные болезни, причиной которых является гноеродная микрофлора – пиококки, стафилококки и стрептококки. Примерно треть всех кожных заболеваний составляют различные пиодермии; первичные пиодермии возникают при поражении здоровой кожи, а вторичные являются осложнением заболеваний, при которых возможны повреждения кожи из-за зуда. Пиодермиями осложняется чесотка, экзема, а так же сахарный диабет и хроническая почечная недостаточность. Если пиодермия протекает с вовлечением глубоких слоев кожи, то после нее остаются стойкие рубцовые и пигментные изменения.
МКБ-10



Общие сведения
Пиодермии объединяют в себе гнойно-воспалительные кожные болезни, причиной которых является гноеродная микрофлора – пиококки, стафилококки и стрептококки. Примерно треть всех кожных заболеваний составляют различные пиодермии; первичные пиодермии возникают при поражении здоровой кожи, а вторичные являются осложнением заболеваний, при которых возможны повреждения кожи из-за зуда. Пиодермиями осложняется чесотка, экзема, а так же сахарный диабет и хроническая почечная недостаточность.
При неосложненных пиодермиях поражения кожи неглубокие и после выздоровления кожный покров полностью восстанавливается; если пиодермии принимают хроническое или затяжное течение, в процесс вовлекаются глубокие слои кожи, то остаются рубцы и пигментные пятна.
Причины пиодермий
На коже человека постоянно присутствует большое количество микроорганизмов, какие-то из них являются нормальной микрофлорой кожи, какие-то сапрофитной и транзиторной микрофлорой, которая при снижении защитных функций кожи способна вызывать пиодермии. В результате жизнедеятельности микроорганизмы выделяют ферменты, эндо- и экзотоксины, что и вызывает местную реакцию в виде пиодермий.
В патогенезе пиодермий важное место занимают условия труда и особенности кожи человека, возраст и состояние иммунной системы; снижение иммунологической реактивности человека и несоблюдение личной гигиены увеличивает вероятность возникновения пиодермий. В большинстве случаев пиодермии вызывает сапрофитная микрофлора, а потому пациенты не представляют опасности для окружающих.
Микротравмы, стрессовые ситуации, перегревание или переохлаждения являются факторами, которые снижают защитные функции кожи и повышают вероятность пиодермий; в группу риска попадают люди, страдающие сахарным диабетом, патологиями пищеварительной системы, нарушениями функции кроветворения и витаминного баланса, ожирение и истощение также угнетают местный иммунитет.
Кожа, склонная к выработке излишнего количества кожного сала, что случается при нарушениях ЦНС, наиболее уязвима для пиококков, так как изменение химического состава кожного сала снижает стерилизационные свойства кожи. Изменение гормонального фона или прием корткостероидов приводят к общим заболеваниям, которые являются предрасполагающими к пиодермиям.
Классификация пиодермий

Пиодермии классифицируют в зависимости от глубины и тяжести поражения, а так же в зависимости от возбудителя. Поверхностные пиодермии проявляющиеся остиофолликулитами, сикозами кожи – это чаще всего стафилодермии. Поверхностные стрептодермии и смешанные пиодермии клинически проявляются в виде импетиго вульгарного.
Глубокие стафилодермии проявляются в виде глубоких фолликулитов, гидраденитов, фурункулеза и карбункулеза. Глубокие воспаления кожи стрептококковой инфекцией заканчиваются язвенными поражениями кожи, протекающими по типу эктимы вульгарной. Язвенно-вегетатирующие хронические формы глубоких пиодермий чаще всего вызываются смешанной микрофлорой.
Лечение пиодермии

Лечением пиодермии занимается дерматолог. При пиодермиях волосы в очаге инфекции и вокруг него состригают, но не бреют, чтобы не допустить обсеменения патогенной микрофлорой участки здоровой кожи; если пиодермия носит генерализованный характер, то запрещаются водные процедуры, в том числе и мытье. Контакт с водой крайне не желателен, особенно в острой фазе заболевания.
Кожу вокруг пораженного участка обрабатывают спиртовыми растворами анилиновых красителей и дезинфектантами, хороший эффект оказывает салициловая кислота и раствор перманганата калия. Несмотря на то, что контакт с водой запрещен, ежедневно нужно тщательно мыть руки и обрабатывать ногти 2% раствором йода, чтобы предотвратить распространение инфекции, а также протирать здоровую кожу влажной губкой.
Питание в период лечения должно быть сбалансированным, лучше перейти на молочно-растительную диету, полностью исключить из меню экстрактивные вещества и алкоголь, ограничить употребление соли и простых углеводов. Если пациент ослаблен, имеет сопутствующие заболевания или пиодермия принимает затяжной или хронический характер течения, при присоединении симптомов интоксикации, медикаментозное лечение пиодермии целесообразно проводить антибактериальными препаратами. Перед назначением антибиотика проводят бакпосев отделяемого или соскоба, определяют возбудителя и его чувствительность к препаратам. Антибиотики пенициллинового ряда практически не назначают из-за их низкой эффективности, макролиды и тетрациклины дают хороший терапевтический эффект, но эритромицин и тетрациклин нежелательно применять для лечения детей и беременных.
Лечение комбинированными антибактериальными препаратами и цефалоспоринами (цефотаксим и др) назначают при инфицировании смешанной микрофлорой, так как эти препараты обладают широким спектром действия и устойчивы к изменчивости бактерий. Курс и дозировка препаратов назначаются индивидуально, исходя из тяжести течения пиодермий, обычно прием антибиотиков не должен быть меньше недели. Сульфаниламидные препараты менее эффективны при пиодермиях, но если у пациента непереносимость антибиотиков, то назначают сульфаметоксазол+триметоприм, сульфомонометоксин в нужных дозировках.
Активная специфическая иммунотерапия в сочетании с антибиотикотерапией и местным лечением дает хорошие результаты, особенно при хронических и вялотекущих процессах. Подкожное введение анатоксинов, специфических антигенов, стафилопротектинов два раза в неделю проводят в условиях поликлиники или в стационаре, если пациент находится на госпитальном лечении.
Для стимуляции неспецифического иммунитета прибегают к аутогемотрансфузии, переливанию компонентов крови, ультрафиолетовому облучению крови (УФОК); такие препараты как метилурацил, настойка лимонника и экстракт элеутерококка тоже стимулируют иммунную систему. Если имеются иммунные нарушения, то лечение пиодермий целесообразно проводить с назначением иммуностимуляторов группы препаратов тимуса; препаратов гамма-глобулинов и стимуляторов выработки интерферона. Витаминотерапия показана при всех видах пиодермий.
Профилактика пиодермий
Профилактика как для лиц, у которых нет в анамнезе гнойничковых заболеваний, так и для лиц с рецидивами пиодермий в анамнезе, заключается в соблюдении правил личной гигиены, в организации предупреждающих мер в быту и на производстве. Соблюдение санитарно-технических и санитарно-гигиенических норм на производстве существенно снижают заболеваемость пиодермиями в отдельно взятом учреждении. Кроме того своевременная обработка травм и микротравм позволяет исключить дальнейшее инфицирование ран и развитие пиодермий.
Регулярные профилактические медицинские осмотры с целью выявления хронических заболеваний пищеварительной системы, ЛОР-органов позволяют назначить лечение и не допустить развитие вторичных пиодермий. Для больных сахарным диабетом профилактика пиодермий заключается в более тщательном уходе за кожей, в своевременном ее увлажнении, чтобы не допускать мацерации и образования микротравм, так как при сахарном диабете даже небольшая царапина зачастую становится причиной обширных и глубоких пиодермий.
Синдром Джоба — это мультисистемное наследственное заболевание, в основе которого лежит первичный иммунодефицит. Возникает вследствие мутаций в генах STAT3, TYK2, DOCK8. Классическая триада симптомов включает экзематозный дерматит, рецидивирующие кожные инфекции, инфекционные поражения легких. Также отмечаются деформации черт лица, костные аномалии, нарушения формирования зубов. Для диагностики синдрома Джоба проводится иммунологическое исследование крови, генетическое тестирование. Пациентам назначается поддерживающее лечение, включающее антибиотики, антимикотики, противоаллергические средства.
МКБ-10

Общие сведения

Причины
Синдром Джоба имеет два типа наследования. При аутосомно-доминантном варианте болезнь вызвана мутацией в гене STAT3. В таком случае риск рождения больного ребенка составляет 50% независимо от пола, если один из родителей болен. Аутосомно-рецессивный вариант характеризуется дефектами генов TYK2 или DOCK8. Для развития патологии требуется, чтобы оба родителя были носителями мутантных аллелей, при этом вероятность наследования синдрома существует у 25% детей.
Патогенез
Ген STAT3 выполняет роль индуктора сигналов для нескольких видов интерлейкинов, которые участвуют в формировании иммунного ответа. Этот сигнальный путь контролирует активность провоспалительных и противовоспалительных молекул. При мутации гена нарушается дифференцировка Т-лимфоцитов Th-17, изменяется течение иммунологических реакций, в результате чего иммунитет неэффективно борется с микозами, бактериальными инфекциями.
Частые поражения кожи и легких при синдроме Джоба объясняются тем, что эти ткани наиболее сильно зависят от наличия Th-17, без которых они не могут реализовать свои местные антибактериальные механизмы. Как следствие, повышается восприимчивость к инфекциям, наблюдается их затяжное, рецидивирующее течение. Неиммунологические аспекты синдрома обусловлены нарушением ремоделирования тканей, сосудистыми патологиями.
Симптомы
Клинические проявления синдрома Джоба возникают в младенческом возрасте. Сразу после рождения выявляются типичные аномалии строения черепа: у детей грубые черты лица, выступающие нос и подбородок, широкие крылья носа. Пор мере взросления становятся заметнее асимметрия лица, грубая кожа. Патологии опорно-двигательного аппарата дополняются гиперрастяжимостью связок, остеопенией, дегенеративными поражениями суставов.
Патогномоничный признак синдрома Джоба — множественные гнойничковые или экзематозные высыпания, возникающие в первые недели жизни. Сначала они локализованы на коже лица и волосистой части головы, позже распространяются по телу. Со временем сыпь трансформируется в экзематозный дерматит, ассоциированный с золотистым стафилококком. Специфично формирование холодных абсцессов, при которых отсутствует покраснение кожи, не повышается местная температура.
Гипериммуноглобулинемия Е также проявляется рецидивирующими инфекциями придаточных пазух носа, бронхов, легких. Их вызывают золотистые стафилококки, пневмококки, гемофильные палочки, а наибольшую опасность представляет инфицирование синегнойной палочкой. Пневмонии трудно поддаются лечению стандартными антибиотиками, вследствие постоянной иммуносупрессии возможно присоединение грибковой инфекции с развитием аспергиллеза легких.
Осложнения
Синдром Джоба отличается тяжелым течением, в патологический процесс вовлекаются все системы организма. Для аутосомно-доминантного типа заболевания характерны разрушение зубов, нарушения сроков смены зубного ряда, гипоплазия эмали. Поражения костно-мышечной системы представлены сколиозом, повышенной хрупкостью костей и риском переломов. Часто возникают сосудистые аномалии — аневризмы.
Основной причиной смертности пациентов с синдромом Джоба остаются тяжелые бактериальные легочные инфекции, которые чреваты сепсисом, септицемией, легочным кровотечением. Хронические пневмонии зачастую сопровождаются образованием пневматоцеле — воздушных кист, нарушающих процессы газообмена. Поражение бронхов завершается бронхоэктатической болезнью с частыми обострениями, которая также чревата генерализацией инфекции и смертельным исходом.
Диагностика
Обследованием больного занимается врач-неонатолог или педиатр. При внешнем осмотре обращают на себя внимание многочисленные высыпания, фурункулы, холодные абсцессы. Большое значение имеет выяснение семейной истории, определение степени риска болезни Джоба у ребенка. Для точной диагностики синдрома применяются следующие лабораторно-инструментальные методы:
- Иммунологические анализы. Стандартный анализ крови показывает высокую эозинофилию, а при углубленном исследовании иммунной системы уровень сывороточного IgE повышен до более чем 2000 МЕ/мл (4800 мкг/л). В иммунограмме возможны отклонения в соотношении фракций лимфоцитов. Показатели других иммуноглобулинов в норме.
- Генетическая диагностика. Секвенирование генома, флуоресцентную гибридизацию производят в специализированных центрах для уточнения молекулярных механизмов мутации, определения варианта наследования синдрома. В рутинной практике подтвердить диагноз можно и без результатов генетической экспертизы.
- Рентгенография легких. Исследование выполняется для выявления признаков хронического бронхита, бронхоэктазов, пневмонии. Чтобы детальнее визуализировать пневматоцеле, очаги деформации бронхов, назначается КТ легких. По показаниям используются инвазивные методики: бронхоскопия, бронхография, биопсия легочной ткани.
- Исследование кожи. При гистологическом анализе биоптатов обнаруживается эозинофильный инфильтрат. Для идентификации возбудителя дерматологических инфекций осуществляется микроскопия отделяемого пустул, посев биоматериала на питательные среди, тест на антибиотикочувствительность.
Лечение синдрома Джоба
Консервативная терапия
Профилактическое лечение включает долгосрочный прием противостафилококковых антибиотиков (диклоксациллина, триметоприма-сульфаметоксазола), чтобы снизить риск кожных и респираторных инфекций. Для предупреждения микозов на фоне иммуносупрессии, усугубленной антибиотикотерапией, показаны противогрибковые препараты. С учетом клинической симптоматики используются:
- Дополнительные антибиотики. Антибактериальные средства из группы гликопептидов назначаются при развитии стафилококковой пневмонии. Для лечения воспаления легких, вызванного гемофильной палочкой, рекомендованы цефалоспорины.
- Гамма-интерферон. Лекарство эффективно при тяжелых рекуррентных инфекциях, которые представляют угрозу для жизни, плохо поддаются стандартным протоколам антибиотикотерапии.
- Стероиды. Применяются в качестве местных препаратов (мази, кремы) для борьбы с экзематозными высыпаниями, уменьшения кожных симптомов, купирования зуда. Терапию дополняют ингибиторами кальциневрина, Н1-гистаминоблокаторами.
Экспериментальное лечение
Прогноз и профилактика
При адекватной комплексной терапии удается продлить срок и повысить качество жизни пациентов. Однако, несмотря на совершенствование протоколов лечения синдрома, большинство больных погибают в возрасте 20-40 лет от вторичных инфекционных осложнений. Первичная профилактика не разработана ввиду редкости заболевания. Вторичные превентивные меры включают раннюю диагностику, комплексную терапию, диспансерное наблюдение страдающих синдромом Джоба.
1. Выявление и лечение пациентов с аллергическими заболеваниями: актуальные вопросы/ М.В. Колесник// УМЖ. — 2019.
3. Синдром Иова/ Е.В. Баторов// КатренСтиль. Онлайн-журнал для фармацевтов и медицинских работников. — 2013. — №124.
4. Редкий первичный иммунодефицит — гипер-IgE-синдром: презентация случая и обзор литературы/ Н.В. Соботюк, Е.А. Потрохова, С.А. Голочалова, С.В. Бочанцев и др.// Педиатрическая фармакология. — 2013. — №10.
Стафилодермия – группа пиодермий бактериальной этиологии, вызываемых микроорганизмами из группы стафилококка. Симптомы этого состояния и их выраженность различаются в зависимости от формы кожного поражения, типа реактивности организма, наличия сопутствующих нарушений (снижения активности иммунитета, повреждений кожи). Диагностика различных форм стафилодермии осуществляется на основании результатов дерматологического осмотра, микробиологических исследований кожи и гноя. Вспомогательную роль могут играть общеклинические анализы крови и мочи. Лечение стафилодермии производится разнообразными местными и системными антибактериальными средствами, поддерживающими препаратами, физиотерапией.
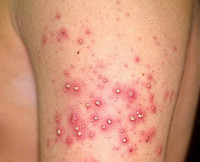
Общие сведения
Стафилодермия (стафилококковая пиодермия) – совокупность гнойно-воспалительных поражений кожи, вызванных стафилококками. Является очень широко распространенным дерматологическим состоянием – практически у каждого человека в течение жизни возникают гнойные воспаления кожи различной степени тяжести, вызванные этими бактериями. Столь частая встречаемость обусловлена тем, что стафилококки довольно широко представлены в окружающей среде – они могут долго находиться в воздухе и на предметах быта, входить в состав микрофлоры кожных покровов и слизистых оболочек человека. Кроме того, стафилодермия иногда провоцируется заносом болезнетворных бактерий из других гнойных очагов в организме. Поражение может возникать в любом возрасте, но у детей стафилодермия протекает иначе, чем у взрослых (эпидемическая пузырчатка новорожденных) вследствие определенных анатомических особенностей строения кожи. Из-за бактериальной природы заболевания и устойчивости стафилококков во внешней среде подобные состояния обладают выраженной контагиозностью, способны передаваться при прикосновении или через общие предметы (полотенца, постельное белье, мочалки), что необходимо учитывать при лечении патологии.

Причины стафилодермии
Причиной развития всех форм стафилодермии является проникновение стафилококков (как правило, золотистого или белого) в ткани кожи через микротрещины, протоки сальных и потовых желез или открытые раны (ссадины и порезы). Реже наблюдается гематогенный или лимфогенный метастатический занос возбудителя из других очагов гнойной инфекции (кариозных зубов, абсцессов внутренних органов, лимфаденитов). При этом от глубины проникновения стафилококков, их активности (особенно в плане выделения протеолитических ферментов и экзотоксинов) и типа реактивности организма зависит форма стафилодермии.
Если гнойное воспаление имеет обширный характер, в кровь проникает значительное количество токсинов, что приводит к развитию общих симптомов – слабости, повышения температуры, головной боли. В большинстве случаев стафилодермии рано или поздно естественным путем формируется дренаж для оттока гноя (прорыв абсцесса), воспалительные проявления постепенно угасают. Если патологический процесс затронул базальную мембрану эпидермиса, на месте патологического очага формируется более или менее заметный рубец. При поверхностных формах стафилодермии базальная мембрана остается неповрежденной, что способствует полному заживлению и восстановлению нормального кожного покрова.
Классификация и симптомы стафилодермии
Разные формы стафилодермии имеют достаточно много различий в своем клиническом течении, что позволяет дерматологу по одной только симптоматике заболевания определить его тип. Именно на этих различиях построена классификация данного гнойно-воспалительного состояния. Стафилодермия может быть поверхностной, глубокой и детской. К поверхностным формам относят различные разновидности фолликулитов (остиофолликулит, поверхностный и глубокий фолликулиты), а также вульгарный сикоз. Глубокие типы стафилодермии объединяют в себе фурункулы, карбункулы и стафилококковые гидрадениты. Детская форма этого поражения кожи представлена эпидемической пузырчаткой новорожденных, которая патоморфологически относится к поверхностным типам, но имеет ряд особенностей, обусловленных строением кожных покровов маленьких детей.
Остиофолликулит (стафилококковое импетиго Бокхарта) – достаточно легкая разновидность поверхностной стафилодермии. Чаще всего она поражает мужчин, возникает на лице в зоне роста усов и бороды, всегда поражает область вокруг стержня волоса, может иметь множественный или одиночный характер. Начало патологического процесса характеризуется появлением пустулы красного цвета диаметром около 1 миллиметра, на месте которой со временем формируется полушаровидный желтоватый гнойник. Через 2-3 дня он трансформируется в грязно-желтую корочку диаметром 2-3 миллиметра. Еще через 2-3 дня корочка отпадает, на ее месте около недели может сохраняться розовое пятнышко, которое затем полностью исчезает.
Поверхностный фолликулит условно можно назвать осложненной формой предыдущего варианта стафилодермии, поскольку он характеризуется более глубоким поражением волосяных фолликулов. Клиническая картина напоминает остиофолликулит, но при этом является более выраженной – размер папулезных элементов достигает 2-3 миллиметров в диаметре, а полное заживление может занимать до 2-3 недель. Вокруг очагов поражения, как правило, наблюдается воспалительный валик и покраснение кожи, нередко отмечается местная болезненность, но общих симптомов (слабости, повышения температуры) при поверхностном фолликулите не наблюдается.
Глубокий фолликулит – выраженная форма поверхностной стафилодермии, при которой гнойно-воспалительный процесс охватывает всю толщу волосяного фолликула. Проявляется одиночными или множественными гнойничками диаметром до 10-15 миллиметров различной локализации. В некоторых случаях наблюдается значительное по площади поражение кожи, обусловленное множественными фолликулитами, что может свидетельствовать о наличии иммунодефицита, сахарного диабета и других общих заболеваний. При этом варианте стафилодермии отмечается умеренная болезненность кожи, при обширных поражениях могут регистрироваться общие симптомы: слабость, головная боль, повышение температуры.
Вульгарный сикоз – это хроническая разновидность стафилодермии, чаще всего имеющая рецидивирующий характер течения. Преимущественно поражает мужчин, возникает на лице и шее, иногда в области лобка или на спине. В развитии вульгарного сикоза можно выделить несколько стадий. Первоначально на коже образуются единичные поверхностные фолликулиты, самопроизвольно исчезающие через несколько дней. После этого появляются более глубокие гнойные поражения дисковидной формы, которые сливаются между собой, формируя обширные зеленовато-желтые корки. При их отделении на коже определяются болезненные эрозивные поверхности с длительным периодом заживления.
Фурункул – вариант глубокой стафилодермии, особенностью которой является гнойно-некротический характер воспаления. Чаще всего он образуется на лице, шее, плечах, иногда возможно появление фурункулов на спине и ягодицах. Длительность развития этой формы стафилодермии составляет около 14-ти дней, процесс включает в себя три стадии. Сначала возникает выраженный воспалительный инфильтрат, сопровождающийся покраснением, болезненностью, уплотнением кожи в области поражения. Затем начинается формирование гнойника с некротическим стержнем посередине, размер абсцесса может достигать 5 сантиметров, наблюдается повышение температуры тела и ухудшение общего состояния организма. Третья стадия данной формы стафилодермии (заживление) характеризуется развитием грануляций и рубцеванием. В некоторых случаях может иметь место множественное образование фурункулов, которое носит название фурункулез – обычно данный процесс выявляется при общем ослаблении организма.
Карбункул – разновидность стафилодермии, напоминающая фурункул, но отличающаяся от него поражением сразу нескольких близко расположенных фолликулов с вовлечением обширного объема тканей кожи. Процесс характеризуется более выраженными симптомами – инфильтрация может достигать в диаметре 10-20 сантиметров, размер гнойников составляет 2-6 сантиметров. После формирования воспалительного очага и абсцесса происходит его размягчение с выделением большого количества гноя и нескольких некротических стержней. Эта форма стафилодермии всегда сопровождается значительным ухудшением общего состояния (повышенной температурой, ознобом) и регионарным лимфаденитом.
Эпидемическая пузырчатка новорожденных – форма стафилодермии, поражающая исключительно детей в первые недели их жизни. Может быть следствием заноса стафилококков из половых путей матери, внутрибольничной инфекции, иногда – первичного иммунодефицита. Симптомом пузырчатки новорожденных является развитие на теле многочисленных папул с прозрачным содержимым. Нередко папулы сливаются между собой и могут захватывать почти всю поверхность тела ребенка. После разрушения папул остается сильно эрозированная поверхность кожных покровов.
Диагностика
В дерматологии для определения стафилодермии используют методы дерматологического осмотра и бактериологического исследования гноя, вспомогательную роль играет общий анализ крови. При осмотре врач может определить глубину и характер гнойно-воспалительного поражения, а также его стадию, на основании чего принимает решение о характере дальнейшего лечения. Бактериологическое исследование основано на посеве гнойного отделяемого и дальнейшей идентификации возбудителя – в первую очередь это необходимо для исключения стрептококковых пиодермий. Также в рамках этого исследования может определяться чувствительность возбудителя стафилодермии к антибиотикам для дальнейшей терапии. Общие анализы могут характеризовать тяжесть воспалительного процесса – в крови обнаруживается нейтрофильный лейкоцитоз, резкое увеличение скорости оседания эритроцитов.
Лечение стафилодермии
Лечение большинства форм поверхностной стафилодермии, как правило, местное, основывается на применении мазей с антибиотиками, антисептиками и другими противомикробными средствами. При хронических типах заболевания, таких как вульгарный сикоз, также применяют ультрафиолетовое облучение и другие физиотерапевтические методики. При глубоких формах стафилодермии практически всегда назначают системные антибиотики из группы макролидов или тетрациклинов – это делается не только для скорейшего выздоровления больного, но и для профилактики осложнений (метастатического распространения инфекции или сепсиса). В тех случаях, когда стафилодермия обусловлена общими заболеваниями (иммунодефицитом, сахарным диабетом), их терапия также вносит свой вклад в скорейшее выздоровление.
Прогноз и профилактика
Прогноз стафилодермии, особенно ее поверхностных форм, чаще всего благоприятный – после разрешения гнойно-воспалительного очага на коже не остается следов. При глубоких формах заболевания возможно формирование грануляций, более или менее заметных рубцов и длительно существующих инфильтратов. Потенциально любой тип стафилодермии может привести к тяжелым осложнениям, таким как сепсис, гнойный лимфаденит, абсцессы внутренних органов, что создает угрозу жизни человека. Крайне редко при обширных поражениях возникает токсический шок, обусловленный продуктами жизнедеятельности стафилококков и распада тканей. Избежать таких проявлений поможет только своевременно начатая антибактериальная терапия. Для профилактики стафилодермии необходимо поддерживать иммунитет на должном уровне, сохранять чистоту кожных покровов, обрабатывать кожные повреждения антисептиками, избегать использования чужих бритв, полотенец, мочалок.

В 1972 году другой педиатр — Ребекка Бакли (доктор медицины из Медицинского центра университета Дьюка в Дареме, США) — описала с соавторами два клинических случая со схожей склонностью к инфекциям, дерматитом, характерными чертами лица и экстремально высоким уровнем IgE (был открыт через год после выхода первой статьи о синдроме Иова). Этот набор симптомов впоследствии был назван в честь исследовательницы (Buckley syndrome). Наконец, в 1974 году клинический иммунолог Гарри Хилл (профессор медицины университета Юты, США) с коллегами расставил точки над i, повторно обследовав героинь первой публикации Старки Дэвиса и выявив у них повышенные уровни IgE, а также дефект хемотаксиса нейтрофилов, чем доказал тождественность синдромов Иова и Бакли.
В специальной литературе синдром Иова имеет следующие синонимы: синдром гипериммуноглобулинемии Е, гипер-IgE синдром, синдром гиперпродукции IgE, синдром Бакли. В последнее время в отечественных изданиях можно встретить и такой предельно ономастический перевод, как синдром Джоба. В англоязычных публикациях название болезни обычно дополняется типом наследования: аутосомно-доминантный или аутосомно-рецессивный (autosomal dominant / recessive hyperimmunoglobulin E syndrome).
В 2007 году две группы исследователей под руководством Стивена Холланда (из Национального института аллергических и инфекционных заболеваний, США) и Ёсиюки Минэгиси (Токийский университет медицины и стоматологии, Япония) независимо друг от друга установили ключевую роль дефекта гена STAT3 (signal transducer and activator of transcription 3) в развитии аутосомно-доминантного гипер-IgE синдрома. Мутации в гене STAT3 определяются у более чем 95 % обследованных пациентов с аутосомно-доминантным типом синдрома.
В 2009 Карин Энгельгардт (доктор медицины из лондонского королевского колледжа) с международной командой соавторов доказала связь мутаций в гене DOCK8 (dedicator of cytokinesis 8) и аутосомно-рецессивным вариантом болезни. Частота проявления мутации, как и в случае с аутосомно-доминантной формой, приближается к 100 %.
Белок STAT3 отвечает за передачу провоспалительных (от ИЛ-6) и противовоспалительных сигналов (от ИЛ-10). В норме через STAT3 происходит регуляция миелопоэза, генерация Т-хелперов 17‑го типа, играющих важную роль в защите организма от внеклеточных бактерий и патогенных грибов, и подавление активности остеокластов. Описано больше 30 мутаций, которые приводят к экспрессии белка, малопригодного для выполнения своих функций, в результате чего развивается запоздалый и неадекватный, при этом вовремя не прекращающийся иммунный ответ. Аномально высокая продукция IgE, вероятно, опосредуется через усиление влияния ИЛ-4 на В-клетки в отсутствие регулирующего действия ИЛ-10.
Белок DOCK8 (dedicator of cytokinesis 8) участвует в клеточной миграции, клеточной адгезии, фагоцитозе, развитии и функционировании Т- и В-клеток. Недостаточность DOCK8 приводит к снижению резистентности к грибковому, бактериальному и в особенности вирусному инфицированию. DOCK8 также обеспечивает один из путей активации STAT3 в В-клетках. Видимо, увеличение уровня IgE происходит по описанному выше механизму, только за счет дефекта функционирования STAT3.
Подросток, которому в России поставят этот диагноз, будет иметь за плечами солидный опыт общения с врачами.
Щедрость синдрома Иова на всякого рода дополнительные признаки выгодно отличали бы это заболевание от других первичных иммунодефицитов, если бы не его исключительная редкость.
Течение аутосомно-рецессивного гипер-IgE синдрома имеет свои особенности. При нем не образуются пневматоцеле, не бывает аномалий скелета (в том числе лицевого) и зубов, однако отмечается, пожалуй, еще большая предрасположенность и упорное течение всевозможных инфекций (тех же пневмоний). Характерно хроническое течение инфекции Molluscum contagiosum (контагиозный моллюск) с дальнейшим образованием обезображивающих рубцов, а также кожных форм инфекций Herpes simplex (простой герпес) и Herpes zoster (опоясывающий лишай). Чаще встречаются выраженные неврологические нарушения вплоть до гемиплегии.
У пациентов с гипер-IgE синдромом риск развития онкологии выше обычного, в особенности, если речь идет о лимфопролиферативных заболеваниях. В целом течение аутосомно-рецессивного гипер-IgE синдрома считается более агрессивным.
Лечение синдрома, как и любого первичного иммунодефицита, симптоматическое. Прием антибиотиков широкого спектра действия и противогрибковых препаратов, в том числе и с профилактической целью. Хирургическое лечение абсцессов кожи и мягких тканей. Терапия экзематозных высыпаний — по принципам общего и местного лечения аллергодерматозов (антигистаминные препараты, системные и топические глюкокортикостероиды, уход за кожей). В ходе клинических испытаний показана некоторая эффективность препарата анти-IgE моноклональных антител, омализумаба.
Также известно о четырех попытках аллогенной трансплантации костного мозга при аутосомно-доминантном гипер-IgE синдроме: первая — в США в 1997 году (пациент умер через 6 месяцев от инфекционных осложнений), вторая — в Англии, пациентка имела рецидив синдрома через 4 года, несмотря на полный донорский химеризм (все форменные элементы крови имели генотип донора), еще двое греков пребывали в ремиссии со сроками наблюдения 10 и 14 месяцев (данные 2010 года).
При аутосомно-рецессивном типе заболевания проведено 12 трансплантаций костного мозга, все за последние 5 лет: восемь — в Турции, три — в Германии, одна — во Франции, максимальный срок наблюдения — 4 года (в 2012 году), данных о рецидивах пока не было.
В педиатрическое отделение одной из больниц Сеула поступила 16‑летняя пациентка с жалобами на кровохарканье. Девочка с рождения страдала генерализованной экземой, в течение всей жизни ее беспокоили рецидивирующие фурункулез с исходом в кожные абсцессы, средние отиты, синуситы, пневмонии. На протяжении трех месяцев, предшествовавших описываемой госпитализации, она дважды находилась на стационарном лечении в связи с пневмонией, вызванной Pseudomonas aeruginosa Staphylococcus aureus.
При осмотре врачи обратили внимание на широкий крупный нос, следы расчесов по всему телу, а также запущенный кандидоз полости рта. При аускультации — жесткое дыхание и хрипы над всей поверхностью легких, ослабленное дыхание в нижних отделах правого легкого. При рентгенологическом и КТ-исследовании были диагностированы бронхоэктазы в легких и плевральный выпот справа. Анализ крови позволил выявить лейкоцитоз до 15,5×109/л со сдвигом лейкоцитарной формулы влево, абсолютную эозинофилию (0,75×109/л), СОЭ=120 мм/ч и повышение концентрации общего IgE (>5000 ЕД/мл).
Неизвестно, кто именно из солидного списка соавторов (9 человек) вспомнил о первичных иммунодефицитах, но следующим шагом была подсчитана сумма баллов по шкале Национального института здоровья (США), созданная для диагностики гипер-IgE синдрома (набралось 44 балла). В довершение, окончательно убивая всю прелесть диагностического поиска (нам такое, к несчастью, пока не грозит), подключили генетиков, те провели прямое секвенирование гена STAT3 — и вот она, мутация, а с ней и окончательный диагноз: аутосомно-доминантный гипер-IgE синдром, он же синдром Иова (J. M. Kang, J. G. Suh, J. H. Kim, et al. A case of Hyper-IgE syndrome with a mutation of the STAT3 gene. Korean Journal of Pediatrics, 2010, Vol. 53, № 4). После двухнедельного курса антибактериальной терапии имеющиеся инфекции отступили, пациентке был рекомендован профилактический прием ко-тримоксазола и уход за кожей.
Согласно современным толкованиям Ветхого Завета, считается, что Бог, в конце концов, проникся непротивлением страдальца Иова, терпеливо принимающего все посылаемые ему несчастья, и, вознаграждая за стойкость, первым делом вылечил. Я не встречал данных об исцелении синдрома Иова, но вполне допускаю, что в будущем медицина одолеет и эту болезнь.
Читайте также:

