Вторичные инфекции при иммуносупрессии
Обновлено: 11.05.2024
Токсичность иммуносупрессоров и их побочные эффекты
Иммуносупрессия означает генерализованное снижение иммунореактивности, что чревато повышенной чувствительностью к инфекциям и новообразованиям, в частности лимфоме, раку кожи и губ, а также лейкемии. Лекарства, психоактивные вещества, пестициды и другие химикаты способны разрушать или угнетать врожденные и приобретенные механизмы устойчивости у человека и животных.
Например, у пациентов с подтвержденными иммунными нарушениями воздействие полибромированных дифенилов, похоже, чаще приводит к возникновению опухолей. Загрязнители воздуха, в частности озон, диоксид азота и сернистый газ, вероятно, повышают чувствительность к инфекциям. Для изучения потенциальных иммунотоксинов использовалась именно подверженность инфекционным болезням.
Наконец, для определения иммунотоксичности полезны проводимые in vitro и in vivo исследования устойчивости к опухолям.
а) Механизм действия иммуносупрессоров. Наиболее часто применяемые иммуносупрессорные средства разделяются на 4 основные категории: алкилирующие средства, глюкокортикостероиды, антиметаболиты и природные продукты. Алкилирующие средства (например, циклофосфамид) нарушают клеточные функции, особенно митоз, и высокотоксичны для быстро размножающихся клеток, включая лимфоидные.
Глюкокортикостероиды нарушают фагоцитоз и угнетают функцию Т- и В-лимфоцитов. Антиметаболиты (например, азатиоприн) действуют главным образом путем ингибирования белкового синтеза. Природные продукты, в частности циклоспорин А, по-видимому, модулируют механизмы регуляции иммунореактивности. Они подавляют функцию Т-клеток, но не влияют на В-клетки.
б) Иммуносупрессоры при беременности. Иммуносупрессориые лекарственные средства (например, азатиоприн, кортикостероиды) вводили одной пациентке на протяжении всего периода беременности для профилактики отторжения пересаженной почки. Лимфопения, пониженная выживаемость лимфоцитов в культуре, отсутствие IgM и уменьшение титра IgG при рождении свидетельствуют о супрессии тимусзависимой и тимуснезависимой систем у младенца и матери.
О восстановлении обеих этих систем примерно к 15-недельному возрасту говорят появление тимусовой тени и пальпируемых лимфатических узлов при почти нормальных сывороточных концентрациях IgG и IgM. Отсутствие IgA в первый год жизни встречается нередко. Трансплацентарный перенос супрессоров иммунной системы развивающегося плода, возможно, повышает его чувствительность к злокачественному росту.
Детям матерей, получавших иммуносупрессоры, необходимо провести полное иммунологическое исследование, а также сделать эндокринологические и генетические анализы. Если дефицит иммуноглобулинов значителен, некоторую пассивную иммунизацию в течение восстановительного периода может обеспечить антигеннегативная ассоциированная с гепатитом плазма. Поскольку возможна недостаточность надпочечников, в первые месяцы жизни бывает полезен гидрокортизон. Анализ кариотипа необходим для исключения из диагноза хромосомных аномалий. Некоторые дети матерей, получавших высокие дозы азатиоприна и преднизона, были здоровы на протяжении нескольких лет после рождения.
в) Иммуносупрессоры при трансплантации. Применение иммуносупрессоров при пересадке органов, возможно, ведет к увеличению послепересадочного риска новообразований, инфекций и тяжелых неврологических осложнений. Несмотря на то что у 6 % реципиентов аллотрансплантатов развивается рак, только 1 % умирает от него.

Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Инфекционные заболевания у пациентов со сниженным иммунитетом. Инфекции при иммунодефиците
Различные методы лечения или наследственная патология иммунной системы могут способствовать развитию инфекционного заболевания, обусловленного слабовирулентными штаммами микроорганизмов, или возникновению тяжёлых инфекций, связанных с патогенными возбудителями.
Недостаточность иммунной системы обычно возникает в результате воздействия нескольких факторов. Например, при нейтропении, развивающейся у пациентов, перенёсших пересадку костного мозга, повышена восприимчивость организма к бактериальным инфекциям, в то время как внутривенная катетеризация способствует развитию инфекции, вызванной Staphylococcus epidermidis.
Медицинские манипуляции часто нарушают физические барьеры на пути инфекции (например, катетеризация).
Нейтропения как причина инфекции при иммунодефиците
Гранулоцитопению обычно наблюдают при острой лейкемии или её лечении. Риск развития инфекции зависит от длительности и тяжести нейтропении. Бактериемию у таких больных обнаруживают в 40—70% случаев. Наиболее часто выделяют гра-мотрицательные бациллы (бактерии семейства Enterobacteriaceae и рода Pseudomonas). Они распространяются по организму в результате повреждения кишечника противоопухолевыми препаратами и облучением.
Кроме того, в этиологии сепсиса важную роль играют фамположительные микроорганизмы (S. epidermidis, S. mitis, S. oralis, S. aureus, Corynebacterium jeikeium и представители рода Enterococcus).
Несмотря на то что в большинстве случаев развитие кандидоза обусловлено приёмом антибактериальных препаратов, у пациентов с нейтропенией грибковые инфекции могут возникать de novo. В последнее время всё чаше сообщают о микозах, вызванных дрожжевыми грибами, такими как Candida krusei (характерна природная устойчивость к действию противогрибковых средств), различными видами родов Aspergillus (вызывают инвазивные заболевания) и Fusarium, а также Pseudallescheria boydii и Trichosporon beigelii.
Лечение лихорадки у пациентов с нейтропенией. Эмпирическая терапия включает карбапенем (или цефтазидим) и амикацин. Если лихорадка не исчезает, то дополнительно назначают гликопептидный антибиотик. Позже, если лихорадка сохраняется, высока вероятность развития микозов, поэтому для лечения используют амфотерицин В и итраконазол.
Профилактика инфекции у пациентов с нейтропенией. Вероятность развития инфекции у пациентов с нейтропенией заметно снижается, если в больнице их помещают в индивидуальный бокс и снабжают стерилизованной пищей и водой. Большое значение имеет соблюдение стерильного режима не только медицинским персоналом (мытьё рук и использование одноразовых резиновых перчаток), но и посетителями (ношение халатов и масок). Воздух, поступающий в палату, необходимо пропускать сквозь фильтр специальной очищающей от грибковых спор системы.
Приём нистатина и амфотерицина В внутрь позволяет снизить вероятность развития грибковой инфекции. Достаточно эффективные препараты — флуконазол и итраконазол. В некоторых медицинских центрах применяют профилактическую терапию 4-фторхинолонами, действие которых направлено против факультативных анаэробов кишечника (при сохранении анаэробной флоры).
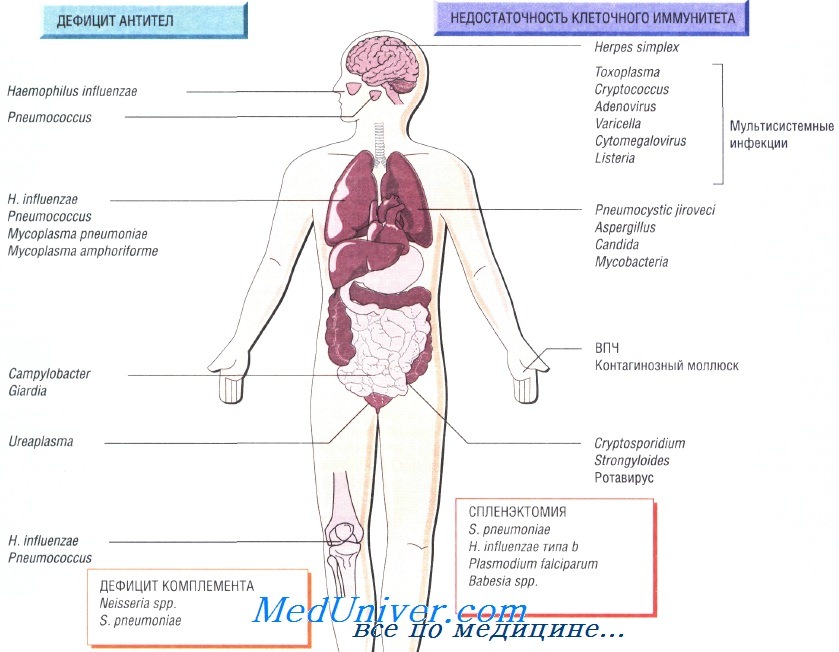
Причины инфекций при иммунодефиците
Недостаточность Т-клеточного иммунитета как причина инфекции при иммунодефиците
Недостаточность Т-клеточного иммунитета может быть обусловлена ВИЧ-инфекцией, противоопухолевой химиотерапией, приёмом глюкокортикоидных препаратов или трансплантацией органов. Врождённый дефицит обнаруживают достаточно редко. Он может быть связан только с недостаточностью функции Т-лимфоцитов или сопровождаться гипогаммаглобулинемией.
Возбудители инфекции при недостаточности Т-клеточного иммунитета. Основные возбудители — внутриклеточные патогенные микроорганизмы и паразиты:
• Toxoplasma gondii, Strongyloides stercoralis;
• Mycobacterium tuberculosis, M. avium-intracellulare;
• Listeria monocytogenes, Cryptococcus neoformans, Pneumocystis jiroveci;
• вирусы простого герпеса, цитомегаловирус, вирус опоясывающего герпеса и кори.
При осложнении кори гигантоклеточной пневмонией и энцефалитом у таких больных заболевание может приобрести угрожающий жизни характер.
Диагностика инфекции при недостаточности Т-клеточного иммунитета. Для диагностики инфекционных заболеваний применяют различные методы исследования. Для посева у пациентов отбирают не менее, чем два образца крови, взятых из разных мест.
Гиппогаммаглобулинемия как причина инфекции при недостаточности Т-клеточного иммунитета
Пациенты, страдающие сцепленной с Х-хромосомой агамма-глобулинемией, входят в группу повышенного риска заражения различными инфекциями в первые 6 мес своей жизни, в то время как люди с другим иммунодефицитом имеют повышенный риск на протяжении всей жизни. Функциональная гипогаммаглобулинемия возникает у больных с множественной миеломой.
Возбудителями рецидивирующих респираторных заболеваний у таких людей считают Streptococcus pneumoniae, недавно открытую Mycoplasma amphoriforme и не имеющего капсулы Haemophilus influenzae (вызывает бронхоэктазию). Персистирующие инфекции вызывают представители родов Giardia, Cryptosporidium и Campylobacter. Снизить частоту возникновения рецидивирующих инфекций помогает внутривенное введение иммуноглобулина.
Недостаточность комплемента как причина инфекции при недостаточности Т-клеточного иммунитета
Врождённую недостаточность комплемента наблюдают достаточно редко. Недостаточность последних компонентов системы комплемента (С7—С9) вызывает потерю способности лизировать грамотрицательные бактерии, в связи с чем повышается восприимчивость пациента к рецидивирующим инфекциям, вызванным микроорганизмами рода Neisseria. Недостаточность альтернативного пути системы комплемента приводит к развитию тяжёлых стрептококковых инфекций (S. pneumoniae), например менингита.
Приобретённая недостаточность системы комплемента часто возникает при системной красной волчанке.
Маннозасвязывающий лектин путь активации комплемента. Широкий спектр бактерий, грибов, вирусов и простейших прикрепляются к клеткам организма хозяина посредством маннозасвязывающего лектина. Есть данные, что при некоторых видах его недостаточности именно эти микроорганизмы вызывают наиболее частые и тяжёлые заболевания у людей с определёнными генотипами.
Инфекции возникающие после спленэктомии
Ежегодно после удаления селезёнки в 1% случаев наблюдают развитие тяжёлого сепсиса, при этом чаще всего заболевание возникает у младенцев и детей. Самую высокую смертность отмечают после спленэктомии, выполненной по поводу лимфомы и талассемии. У пациентов с серповидно-клеточной анемией развивается функциональная аспления. Риск развития сепсиса может со временем снизиться, но никогда не исчезнет окончательно.
Наиболее распространённый возбудитель инфекций (две трети всех случаев) — Streptococcus pneumoniae, но Н. influenzae и Е. coli также играют важную роль в этиологии инфекционных заболеваний у таких пациентов. Кроме того, спленэктомия повышает восприимчивость организма к инфекции, вызванной Capnocytophaga canimorsis (особенно после укусов собак). Малярия также может протекать крайне неблагоприятно (фульминантная форма).
Профилактика инфекции после спленэктомии. После удаления селезёнки всем пациентам необходимо провести вакцинацию, направленную против S. pneumoniae, менингококков и Н. influenzae типа В. Более эффективна иммунизация с использованием белковых конъюгированных вакцин. В некоторых случаях для профилактики применяют пенициллин V (в низких дозах).
Пациентов следует предупреждать о том, чтобы они сообщали своему лечащему врачу о любых признаках лихорадки, а также проинструктировать их относительно приёма антибиотиков (во избежание задержки лечения).
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Оппортунистические инфекции – это большая группа инфекционных заболеваний, которые развиваются у пациентов с различными типами иммунодефицитов и нехарактерны для людей с нормальным иммунным статусом. Патологии поражают любую систему органов и вызывают соответствующую симптоматику. К общим клиническим проявлениям относят длительный субфебрилитет, лимфаденопатию, астенический синдром. Диагностика оппортунистических инфекций включает серологические, молекулярно-генетические, бактериологические и другие методы детекции патогенных возбудителей. Программы лечения сочетают длительную этиотропную терапию с методами иммунокоррекции.
МКБ-10


Общие сведения
Проблема оппортунистических инфекций (ОПИ) становится все более актуальной, что вызвано ростом числа ВИЧ-инфицированных людей, разработкой эффективных, однако агрессивных методов лечения онкопатологии. При этом многие люди являются бессимптомными носителями возбудителей ОПИ: 60% инфицированы цитомегаловирусом, 90% – герпесвирусами 1 и 2 типов, около 30% – токсоплазмой. Учитывая клинический полиморфизм и отсутствие специфических симптомов, диагностика и лечение оппортунистических болезней представляет серьезную мультидисциплинарную проблему.

Причины
Для манифестации оппортунистических инфекций необходимо заражение патогенным микроорганизмом: вирусом, бактерией, грибком или простейшим. Известно более 20 типичных возбудителей ОПИ, в современной инфектологии этот перечень постоянно дополняется. Болезнь возникает при активации латентного очага, реже выступает следствием текущего заражения. Первостепенную важность играет нарушение иммунного статуса вследствие следующих патологий:
- ВИЧ-инфекция. Самая частая причина, поскольку на определенном этапе снижения числа CD4-клеток ОПИ развиваются у каждого больного. Инфекционные болезни используются для диагностики заражения ВИЧ и определения стадии заболевания, поэтому в данном контексте они называются СПИД-ассоциируемыми или СПИД-индикаторными патологиями.
- Злокачественные новообразования. Патофизиология любого опухолевого процесса предполагает угнетение собственной иммунной системы пациента и снижение ее ответа на чужеродные агенты. При этом уменьшается число Т-клеток, угнетаются процессы фагоцитоза. Проблема наиболее выражена при гемобластозах – лейкозах и лимфомах.
- Хроническая соматическая патология. Угнетение активности клеточного и гуморального иммунитета происходит при эндокринных заболеваниях (сахарный диабет, гипотиреоз), почечной недостаточности, тяжелых воспалительных патологиях ЖКТ.
- Ятрогенные факторы. Применение цитостатиков и других видов иммуносупрессоров является важным предиктором развития оппортунистических инфекций. Подобная ситуация наблюдается в группе пациентов после лучевой терапии, трансплантации органов и костного мозга.
- Первичные иммунодефициты. В эту группу относят все виды иммунной недостаточности, которые имеют генетический характер или возникают внутриутробно под влиянием тератогенов. Они манифестируют в раннем детском возрасте, проявляются затяжными оппортунистическими болезнями, которые с трудом подаются терапии.
Патогенез
Хотя возбудители оппортунистических инфекций таксономически неоднородны, в развитии заболеваний большую роль имеют общие особенности их патогенности и вирулентности. К свойствам микроорганизмов, вызывающих ОПИ, относят возможность длительного и даже пожизненного персистирования в организме человека, внутриклеточное паразитирование, склонность к поражению клеток моноцитарно-макрофагальной системы.
Инфекции активизируются при иммунодефицитах любой этиологии и склонны к хроническому течению с периодическими обострениями, поражением жизненно важных органов. Для оппортунистических болезней характерна лимфогенная и гематогенная диссеминация микроорганизмов, образование эктопических очагов. Собственный иммунитет пациента не способен оказать должное сопротивление инфекционному агенту, лекарственные средства не всегда эффективны.
Сложность и опасность оппортунистических инфекций заключается еще и в том, что они способны подавлять естественный иммунитет. В последние годы говорят о возможности пожизненной иммуносупрессии при персистировании герпесвирусов. Таким образом, формируется порочный круг, когда иммунодефицит провоцирует активацию возбудителей ОПИ, которые усугубляют явления иммунной недостаточности и потенциируют дальнейшие полиорганные нарушения.

Классификация
Единой систематизации оппортунистических инфекций на сегодня не существует. Условно возбудителей объединяют в 3 группы: патогены, которые поражают лиц с нарушениями иммунитета и здоровых людей; микробы, встречающиеся только при иммунодефицитах; вакцинные штаммы микроорганизмов. Общепринятой является классификация ОПИ согласно типу возбудителя:
Симптомы оппортунистических инфекций
В инфектологии выделяют общую группу клинических признаков, которая встречается при любом варианте ОПИ. Наиболее типичным симптомом признан длительный субфебрилитет, которые возникает без видимой причины и беспокоит пациента больше 1 месяца. Нередко повышение температуры возникает после перенесенного ОРВИ или кишечной инфекции, которые выступают пусковым фактором активации оппортунистического заболевания.
Вторым настораживающим симптомом считается лимфаденопатия – увеличение лимфатических улов. Чаще всего в процесс вовлекается лимфоидная ткань шейно-подчелюстной, подмышечной и паховой зоны. Лимфоузлы достигают диаметра около 1 см, имеют плотноэластическую консистенцию, не спаяны с окружающими тканями и безболезненны при ощупывании.
Третью группу общей симптоматики оппортунистических инфекций составляет астенический синдром. Он включает слабость, повышенную утомляемость, снижение переносимости умственных и физических нагрузок. Зачастую пациенты жалуются на ночную потливость, головокружения и головные боли, нарушения сна. При длительном существовании таких признаков наблюдается когнитивная дисфункция, эмоциональная подавленность, стойкое снижение работоспособности.
Пациента с иммуносупрессией должен насторожить кашель и одышка – типичные признаки туберкулеза и пневмоцистной пневмонии (ПЦП), снижение остроты зрения – возможное проявление цитомегаловирусного ретинита, длительно сохраняющаяся диарея – признак криптоспоридиоза, микроспоридиоза. Жжение и сухость полости рта в комбинации с эрозиями и белыми налетами на слизистых указывают на орофарингеальный кандидоз.
Оппортунистические болезни не имеют четко выраженного тропизма. Один и тот же вид возбудителя может вызывать миокардит, плеврит, артрит, менингит и другие нозологические формы. Зачастую они имитируют симптомы хронических соматических заболеваний, с которыми пациенты длительно и безрезультатно посещают врачей разных специальностей. Исключение составляет пневмоцистоз, который в основном поражает легкие с развитием ПЦП.
Осложнения
Оппортунистические инфекции – тяжелые и потенциально смертельные заболевания. Среди пациентов с терминальными стадиями ВИЧ-инфекции ОПИ составляют 90% в структуре летальности, оставшиеся 10% приходятся на саркому Капоши, лимфомы и прочие неинфекционные последствия СПИДа. Смертность при церебральном токсоплазмозе составляет около 33%, при криптококковом менингите – 20-30%, при пневмоцистной пневмонии – 10-20%.
Особую тревогу вызывает сочетание нескольких видов оппортунистических заболеваний у одного пациента. Микробные ассоциации более характерны для позднего периода и хронического течения основной патологии, вызвавшей иммунодефицит. Сочетанное инфицирование типично для иммунокомпрометированных пациентов, пребывающих на стационарном лечении: у 40-50% больных в послеоперационном периоде, у 70-80% при перитонитах и плевритах.
Распространение оппортунистических инфекций негативно сказывается на репродуктивном здоровье населения. Они обуславливают многие случаи самопроизвольного прерывания беременности, эмбриопатий и фетопатий, задержки внутриутробного развития. Дети, рожденные от матерей с ОПИ, находятся в группе риска развития заболеваний новорожденных, перинатальных энцефалопатий.

Диагностика
Обследование пациентов проводится мультидисциплинарной командой врачей, в которую входят врач-инфекционист, иммунолог, онколог и другие узкопрофильные специалисты. Большое клиническое значение имеет выяснения времени и условий появления симптоматики, характера течения заболевания, наличия факторов риска иммунодефицитных состояний. Для подтверждения оппортунистических инфекций проводятся следующие методы диагностики:
Лечение оппортунистических инфекций
В процессе лечения практикующие инфекционисты сталкиваются с такими нюансами, как множественная лекарственная устойчивость патогенов, гетерогенность популяции возбудителей, низкая активность естественных иммунных факторов. Основу терапии составляет прием этиотропных противомикробных препаратов: антибиотиков, антимикотиков, противопротозойных и противовирусных. Лечение ОПИ имеет ряд особенностей:
- в основном назначаются комбинации из 2-3 препаратов для повышения их эффективности;
- продолжительность противомикробной терапии повышается в 1,5-2 раза и более в сравнении с лечением инфекционных болезней у иммунокомпетентных лиц;
- при подборе терапии ориентируются не только на клиническую картину болезни, но и на текущий иммунный статус пациента;
- при вирусных инфекциях обязательно назначаются этиотропные препараты, тогда как у людей без иммуносупрессии противовирусные средства используют только по показаниям.
Для успешного лечения ОПИ требуется максимально возможное восстановление иммунной функции. В группе пациентов с ВИЧ-инфекцией назначаются протоколы антиретровирусной терапии (ВААРТ), чтобы повысить число CD4-клеток и улучшить отдаленные прогнозы. При ведении онкологических больных используются персональные схемы иммуномодуляторов, экспериментальные направления иммунотерапии и регенеративной медицины с применением стволовых клеток.
Прогноз и профилактика
Течение любой инфекции на фоне иммуносупрессии является сложным и непредсказуемым, однако усовершенствованные протоколы лечения позволяют достичь стойкой ремиссии или даже полного излечения. К прогностически неблагоприятным факторам относят пожилой и старческий возраст, неправильно подобранную терапию, невозможность проведения иммунокоррекции основного заболевания.
При иммунодефицитах показана первичная медикаментозная профилактика оппортунистических инфекций. Применяют сульфаниламиды, макролиды‑азалиды, противогрибковые средства. При положительной пробе Манту или недавнем контакте с больным туберкулезом назначается химиопрофилактика сроком на 6 месяцев. Также пациентам рекомендовано строго соблюдать противоэпидемические меры, в периоде резкой иммуносупрессии необходимо пребывание в стерильных боксах.
3. Клинические особенности сочетанных оппортунистических инфекций (обзор)/ В.В. Шкарин, Н.В. Саперкин// Медицинский альманах. – 2017. – №4.
4. Оппортунистические инфекции: проблемы и перспективы/ Под общ. ред. проф. Ю.В. Редькина, О.А. Мирошника, В.В. Лобова. – 2002.
Вторичные иммунодефициты – это болезни иммунной системы, возникающие у детей и взрослых, не связанные с генетическими дефектами и характеризующиеся развитием повторных, затяжных инфекционно-воспалительных патологических процессов, плохо поддающихся этиотропному лечению. Выделяют приобретенную, индуцированную и спонтанную форму вторичных иммунодефицитов. Симптоматика обусловлена снижением иммунитета и отражает конкретное поражение того или иного органа (системы). Диагностика основана на анализе клинической картины и данных иммунологических исследований. В лечении используется вакцинация, заместительная терапия, иммуномодуляторы.

Общие сведения
Вторичные иммунодефициты – нарушения иммунитета, которые развиваются в поздний постнатальный период и не связаны с генетическими дефектами, возникают на фоне исходно нормальной реактивности организма и обусловлены конкретным причинным фактором, вызвавшим развитие дефекта иммунной системы.
Причинные факторы, приводящие к нарушению иммунитета, многообразны. Среди них - длительное неблагоприятное воздействие внешних факторов (экологических, инфекционных), отравления, токсическое действие лекарственных препаратов, хронические психоэмоциональные перегрузки, недоедание, травмы, оперативные вмешательства и тяжелые соматические заболевания, приводящие к нарушению работы иммунной системы, снижению сопротивляемости организма, развитию аутоиммунных расстройства и новообразований.
Течение заболевания может быть скрытым (жалобы и клиническая симптоматика отсутствует, наличие иммунодефицита выявляется только при лабораторном исследовании) или активным с наличием признаков воспалительного процесса на коже и в подкожной клетчатке, верхних дыхательных путях, легких, мочеполовой системе, пищеварительном тракте и в других органах. В отличие от преходящих сдвигов в иммунитете, при вторичном иммунодефиците патологические изменения сохраняются и после ликвидации возбудителя заболевания и купирования воспаления.

Причины
Привести к выраженному и стойкому снижению иммунной защиты организма могут самые разнообразные этиологические факторы – как внешние, так и внутренние. Вторичный иммунодефицит нередко развивается при общем истощении организма. Длительное недоедание с дефицитом в рационе белка, жирных кислот, витаминов и микроэлементов, нарушения всасывания и расщепления питательных веществ в пищеварительном тракте приводят к нарушению процессов созревания лимфоцитов и снижают сопротивляемость организма.
Тяжелые травматические повреждения опорно-двигательного аппарата и внутренних органов, обширные ожоги, серьезные оперативные вмешательства, как правило, сопровождаются кровопотерей (наряду с плазмой теряются белки системы комплемента, иммуноглобулины, нейтрофилы и лимфоциты), а выброс кортикостероидных гормонов, предназначенных для поддержания жизненно-важных функций (кровообращения, дыхания и др.) еще больше угнетает работу иммунитета.
Ведущую роль в развитии вторичных иммунодефицитов играют хронические вирусные инфекционные заболевания (ВИЧ, цитомегаловирусная инфекция, вирусы Эпштейна-Барр и другие герпес-вирусы, реже корь, краснуха, вирусные гепатиты и т. д.), вызывая подавление клеточного и гуморального иммунитета. Неблагоприятное влияние на иммунный статус оказывает бактериальная и грибковая инфекция, паразитарные заболевания.
Выраженное нарушение обменных процессов в организме при соматических заболеваниях (хронические гломерулонефриты, почечная недостаточность) и эндокринных расстройствах (диабете, гипо- и гипертиреозе) приводит к угнетению хемотаксиса и фагоцитирующей активности нейтрофилов и, как следствие, к вторичному иммунодефициту с возникновением воспалительных очагов различной локализации (чаще это пиодермии, абсцессы и флегмоны).
Снижается иммунитет при длительном приеме некоторых лекарственных препаратов, обладающих подавляющим действием на костный мозг и кроветворение, нарушающих формирование и функциональную активность лимфоцитов (цитостатики, глюкокортикоиды и пр.). Схожий эффект оказывает и лучевое воздействие.
При злокачественных новообразованиях происходит продукция опухолью иммуномодулирующих факторов и цитокинов, в результате чего снижается количество T-лимфоцитов, увеличивается активность клеток-супрессоров, угнетается фагоцитоз. Ситуация усугубляется при генерализации опухолевого процесса и метастазировании в костный мозг. Вторичные иммунодефициты нередко развиваются при аутоиммунных заболеваниях, острых и хронических отравлениях, у людей старческого возраста, при длительных физических и психоэмоциональных перегрузках.
Симптомы вторичных иммунодефицитов
Клинические проявления характеризуются наличием в организме затяжного, устойчивого к этиотропной терапии хронического инфекционного гнойно-воспалительного заболевания на фоне снижения иммунной защиты. При этом изменения могут быть преходящими, временными или имеют необратимый характер. Выделяют индуцированную, спонтанную и приобретенную формы вторичных иммунодефицитов.
К индуцированной форме относят нарушения, возникающие вследствие конкретных причинных факторов (рентгеновское излучение, длительный прием цитостатиков, кортикостероидных гормонов, тяжелые травмы и обширные хирургические операции с интоксикацией, кровопотерей), а также при тяжелой соматической патологии (сахарный диабет, гепатиты, циррозы, хроническая почечная недостаточность) и злокачественных опухолях.
При спонтанной форме видимый этиологический фактор, вызвавший нарушение иммунной защиты, не определяется. Клинически при этой форме отмечается наличие хронических, трудно поддающихся лечению и часто обостряющихся заболеваний верхних дыхательных путей и легких (синуситы, бронхоэктазы, пневмонии, абсцессы легких), пищеварительного тракта и мочевыводящих путей, кожи и подкожной клетчатки (фурункулы, карбункулы, абсцессы и флегмоны), которые вызваны условно-патогенными микроорганизмами. В отдельную – приобретенную форму выделен синдром приобретенного иммунодефицита (СПИД), вызванный ВИЧ-инфекцией.
О наличии вторичного иммунодефицита при всех стадиях можно судить по общим клиническим проявлениям инфекционно-воспалительного процесса. Это может быть длительный субфебрилитет или лихорадка, увеличение лимфатических узлов и их воспаление, боли в мышцах и суставах, общая слабость и утомляемость, снижение работоспособности, частые простудные заболевания, повторные ангины, часто рецидивирующие хронические гаймориты, бронхиты, повторные пневмонии, септические состояния и т. п. При этом эффективность стандартной антибактериальной и противовоспалительной терапии невысока.
Диагностика
Выявление вторичных иммунодефицитов требует комплексного подхода и участия в процессе диагностики различных врачей-специалистов – аллерголога-иммунолога, гематолога, онколога, инфекциониста, оториноларинголога, уролога, гинеколога и др. При этом учитывается клиническая картина заболевания, свидетельствующая о наличии хронической инфекции, трудно поддающейся лечению, а также выявление оппортунистических инфекций, вызванных условно-патогенными микроорганизмами.
Необходимо изучение иммунного статуса организма с использованием всех доступных методик, применяемых в аллергологии и иммунологии. Диагностика основана на исследовании всех звеньев иммунитета, участвующих в защите организма от инфекционных агентов. При этом изучается фагоцитарная система, система комплемента, субпопуляции T- и B-лимфоцитов. Исследования выполняются путем проведения тестов первого (ориентировочного) уровня, позволяющего выявить грубые общие нарушения иммунитета и второго (дополнительного) уровня с идентификацией конкретного дефекта.
При проведении скрининговых исследований (тесты 1 уровня, которые можно выполнить в любой клинико-диагностической лаборатории) можно получить информацию об абсолютном количестве лейкоцитов, нейтрофилов, лимфоцитов и тромбоцитов (встречается как лейкопения, так и лейкоцитоз, относительный лимфоцитоз, повышенная СОЭ), уровне белка и сывороточных иммуноглобулинов G, A, M и E, гемолитической активности комплемента. Кроме того, можно выполнить необходимые кожные пробы для выявления гиперчувствительности замедленного типа.
При углубленном анализе вторичного иммунодефицита (тесты 2 уровня) определяется интенсивность хемотаксиса фагоцитов, завершенность фагоцитоза, субклассы иммуноглобулинов и специфические антитела к конкретным антигенам, продукция цитокинов, индукторов T-клеток и другие показатели. Анализ полученных данных должен проводиться только с учетом конкретного состояния данного пациента, сопутствующих заболеваний, возраста, наличия аллергических реакций, аутоиммунных расстройств и других факторов.
В процессе обследования проводится дифференциальная диагностика с первичными иммунодефицитами, затяжными инфекционными заболеваниями вирусной, бактериальной, грибковой и паразитарной природы, соматическими заболеваниями, эндокринными расстройствами, новообразованиями.
Лечение вторичных иммунодефицитов
Эффективность лечения вторичных иммунодефицитов зависит от правильности и своевременности выявления этиологического фактора, вызвавшего появление дефекта иммунной системы и возможности его устранения. Если нарушение иммунитета возникло на фоне хронической инфекции, применяются меры по ликвидации очагов воспаления с использованием антибактериальных препаратов с учетом чувствительности к ним возбудителя, проведением адекватной противовирусной терапии, использованием интерферонов и т. п. Если причинный фактор – недостаточное питание и авитаминоз, проводятся мероприятия по разработке правильного рациона питания со сбалансированным сочетанием белков, жиров, углеводов, микроэлементов и необходимой калорийности. Также устраняются имеющиеся нарушения обмена веществ, восстанавливается нормальный гормональный статус, проводится консервативное и оперативное лечение основного заболевания (эндокринная, соматическая патология, новообразования).
Важный компонент лечения больных вторичным иммунодефицитом – иммунотропная терапия с использованием активной иммунизации (вакцинации), заместительного лечения препаратами крови (внутривенное введение плазмы, лейкоцитарной массы, человеческого иммуноглобулина), а также использованием препаратов иммунотропного действия (иммуностимуляторов). Целесообразность назначения того или иного лечебного средства и подбор дозировки осуществляется врачом аллергологом-иммунологом с учетом конкретной ситуации. При преходящем характере иммунных нарушений, своевременном выявлении вторичного иммунодефицита и подборе правильного лечения, прогноз заболевания может быть благоприятным.
Вирусные инфекции нервной системы у детей при ослабленном иммунитете
Оппортунистические инфекции ЦНС могут возникать у иммуноослабленных детей, и спектр инфекций зависит от особенностей нарушения клеточного иммунитета, врожденных или ятрогенных (Cunha, 2001). Все большее число детей появляется с ятрогенной этиологией иммунной недостаточности различной степени выраженности — от тяжелого иммунного подавления при трансплантации органов до хронического применения стероидов при воспалительных состояниях.
Инфицирование оппортунистическими возбудителями, обычно непатогенными для человеческого организма, может быть необычным нарушением, вторичным при обычных вирусных патогенах. В целом большему риску подвержены дети с Т-клеточной лимфоцитарной недостаточностью, у которых может встречаться широкий спектр вирусных, бактериальных, грибковых и протозойных инфекций. Дети с В-клеточным дефицитом в меньшей степени повержены риску инфицирования ЦНС, однако возможен общеизвестный синдром хронической энтеровирусной инфекции.
а) Замедленный тип острого коревого энцефалита при ослабленном иммунитете. Острый замедленный коревой энцефалит наблюдался в основном у пациентов с ослабленным иммунитетом (Murphy и Yunis, 1976), хотя изредка он встречается у детей с явно нормальными иммунными механизмами. В отличие от обычного постинфекционного энцефаломиелита, вирус кори в большом количестве выявляется в тканях мозга, а нуклеокапсиды видны при электронной микроскопии в ядрах глии и нейронах. Воспалительная реакция выражена в различной степени, но чаще слабая (Lacroix et al, 1995). Заболевание развивается через 2-6 месяцев после кори или контакта со случаями кори. Наиболее явным симптомом часто являются эпилептические припадки и во многих случаях первыми проявлениями является epilepsia partialis continua (Aicardi et al., 1977; Luna et al., 1990; Barthez Carpentier et al., 1992).
Быстро развивается прогрессирующее ухудшение с оглушенностью и комой и характерными очаговыми симптомами, особенно гемиплегией.
Продолжают появляться новые неврологические симптомы разной продолжительности. У некоторых пациентов отмечается ретинопатия (Haltia et al., 1977). Диагностика может быть затруднена, в связи с нормальными или слегка измененными показателями ликвора. В большинстве случаев отмечают интратекальный синтез специфических противокоревых антител и высокий титр антител против вируса кори в плазме крови и СМЖ. У детей с наиболее тяжелым подавлением иммунитета выработка антител, однако, может быть ослаблена.
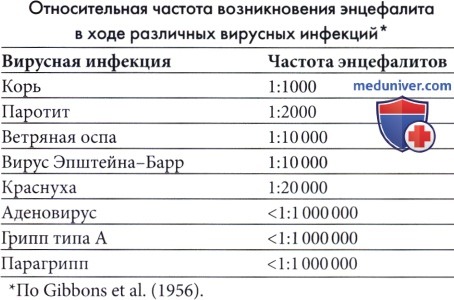
б) Герпесвирусные инфекции человека. Все герпесвирусные инфекции могут стать причиной тяжелого заболевания у иммунодефицитных детей с ослабленной функцией Т-лимфоцитов, включая реципиентов органов при трансплантации, ВИЧ-инфицированных детей и детей с врожденным иммунодефицитом. Заболевание может возникать в результате первичной инфекции у неиммуннизированных детей или как результат реактивации латентной инфекции в период иммунной недостаточности. Болезнь может ограничиваться одним органом или распространяться, вовлекая многие органы с высоким уровнем вирусемии в плазме. Несмотря на доступность противовирусной терапии, полное выздоровление часто зависит от улучшения функции иммунной системы.
Нарушающие зрение вирусные ретиниты вызываются в первую очередь представителями семейства вирусов герпеса; в клинические синдромы входят острый ретинальный некроз (ОРН) (Bonfioli и Eller, 2005), прогрессирующий наружный ретинальный некроз (ПНРН) (Purdy et al., 2003), мультифокальный хориоидит, серпигинозный хориоидит и другие вирусные ретинопатии (ЦМВ ретинит, смотри ниже). При активном иммунитете наиболее распространенным считается ВПГ ретинит, тогда как вирус ветряной оспы в равной степени поражает пациентов с нормальным и ослабленным иммунитетом.
В связи с плохим проникновением лекарственных форм в ткани глаза при системной терапии из-за ограниченного кровоснабжения, при лечении тяжелых заболеваний необходимы как системные назначения, так и прямое внутриглазное введение противовирусных препаратов (Scott et al., 2002).
• Цитомегаловирус. При тяжелой иммунной депрессии может развиваться диссеминированная форма цитомегаловирусной инфекции. Обычно наблюдается высокий уровень вирусемии в крови. Инфекция может поражать головной мозг, сетчатку глаза, легкие, костный мозг, печень и кишечник. При лечении могут быть эффективны ганцикловир, фоскарнет или цидофовир; однако из-за их токсичности требуется тщательный метаболический контроль. Ганцикловир относится к средствам первого выбора после фоскарнета и цидофовира; для более долгосрочной поддерживающей иммуносупрессивной терапии подходит пероральный прием валганцикловира (Kimberlin, 2002; Griffiths, 2004).
ЦМВ ретинит хорошо распознается при прогрессировании ВИЧ-инфекции; при ее наличии у новорожденных, в отличие от взрослых или более старших детей, в первую очередь поражается макула, а не периферическая сетчатка, тем самым непосредственно угрожая центральному зрению (Wren et al., 2004). Другие проявления ЦМВ инфекции в центральной нервной системе у детей с иммунодефицитом включают очаговый или генерализованный энцефалит, паралич черепных нервов, поперечный миелит, радикулит и синдром Гийена-Барре. Успех терапии зависит от ответа вовлеченного органа, также как от уровня вирусемии. У ВИЧ-инфицированных пациентов цитомегаловирусное заболевание ЦНС, включая ретинит, может принять остро симптоматическое течение, в момент начала противовирусной терапии, как проявление синдрома восстановления воспалительного иммунитета (IRIS). IRIS наиболее характерен для пациентов, которые начали лечение в стадии прогрессирующей болезни и с очень низким уровнем CD4, что требует тщательного наблюдения при лечении ЦМВ, ВИЧ и иммунной перестройке для уменьшения симптомов (Griffiths, 2004).
• Вирус простого герпеса. Тяжелая инфекция ВПГ может иметь место у детей с ослабленным иммунитетом. Чаще всего поражаются ротовая полость, кожа, легкие и кишечник, в то время специфическое поражение ЦНС редко. Высокие дозы внутривенного ацикловира должны иметь эффект, хотя возможно развитие резистентности при повторной экспозиции, особенно при низких оральных дозах. ПЦР-исследование ликвора на ВПГ имеет важное значение в постановке диагноза и контроле лечения у иммуносупрессивных пациентов (Cinque et al., 1998).
• Вирус герпеса человека 6 и 7 типов. Реактивация ВГЧ-6 встречается приблизительно в 50% всех пересадок костного мозга и у 20-30% реципиентов паренхиматозных органов через 2-3 недели после процедуры. Клинические симптомы заключаются в лихорадке, кожной сыпи, пневмонии, подавлении костного мозга, энцефалите и отторжении трансплантата (Yoshikawa, 2003). Развитие лимбического энцефалита связано с высокой вирусной нагрузкой в крови ДНК ВГЧ-6 после трансплантации (Ogata et al., 2006). ВГЧ-7 виремия после пересадки стволовых клеток также была ассоциирована с энцефалитом (Chan et al., 2004). Эффект может быть от применения ганцикловира.
• Вирус Эпштейна-Барр. Инфекция ВЭБ способна вызывать тяжелые, часто заканчивающиеся смертью заболевания в некоторых семьях с потенциально фатальной чувствительностью к ВЭБ, передаваемой по наследству как Х-сцепленный ген. Это заболевание, известное как Х-сцепленный лимфопролиферативный синдром (ХЛС) (Grierson и Purtilo, 1987), может принимать форму смертельного инфекционного мононуклеоза, злокачественной лимфомы, приобретенной гипо- и агаммаглобулинемии и вирус-ассоциированного гемофагоцитарного синдрома (Tiab et al., 2000, Gilmour и Gaspar, 2003). Поврежденный ген XLP был определен и обозначен SH2D1A; он кодирует адаптерный белок SAP (белок сигнальной лимфоцитарной молекулосвязанной активации — SLAM-ассоциированный); измерение этого белка может быть использовано в диагностике состояния (Gilmour et al., 2000).
С XLP связан высокий уровень заболеваемости, и во всех случаях исход неблагоприятный. В настоящее время аллогенная трансплантация стволовых клеток остается единственным лечебным мероприятием (Lankester et al., 2005).
Похожий синдром моно- и поликлональной лимфоцитарной пролиферации, обусловленный ВЭБ, известный как посттрансплантационное лимфопролиферативное заболевание (ПТЛЗ), может развиваться при ослабленном иммунитете, особенно у реципиентов пересаженных органов (Randhawa et al., 1992). ПТЛЗ может проявляться полиорганными поражениями, нечасто вовлекая ЦНС. Поражение мозга у реципиентов с ПТЛЗ дает неблагоприятный прогноз; однако изолированное вовлечение ЦНС имеет лучший прогноз, чем одновременное поражение ЦНС и внечерепных органов (Buell et al., 2005). Исследование детей после трансплантации печени показало, что мониторинг вирусной нагрузки ВЭБ при раннем вмешательстве может уменьшить количество случаев ПТЛЗ (Lee et al., 2005).
Комбинированное лечение с иммунной модуляцией, противовирусными средствами и анти-В-клеточными моноклональными антителами ритуксимаба обеспечивает определенный эффект (Nozzoli et al., 2006).
У пациентов с более прогрессирующей ВИЧ-иммуносупрессией ВЭБ может привести к развитию лимфомы. Это может быть изолированная лимфома ЦНС или же поражение ЦНС при более распространенном заболевании (Nadal et al., 1994). В настоящее время проводится разработка более эффективного лечения вызываемой ВЭБ лимфомы у пациентов с ВИЧ, включая противовирусную терапию, химиотерапию и иммуномодулирующее лечение.
в) Полиомавирусная инфекция человека. JC-вирус — это человеческий нейротропный полиомавирус, который вызывает прогрессивную мультифокальную лейкоэнцефалопатию (ПМЛ), смертельное демиелинизирующее заболевание у иммунодефицитных пациентов. Сообщалось о случаях у детей с ВИЧ, после лечения злокачественных новообразований и у детей с врожденной иммунной недостаточностью (Redfearn et al., 1993; Bezrodnik et al., 1998; Angelini et al., 2001; Nuttall et al., 2004; Demir et al., 2005). Заболевание может начинаться медленно как расстройство с когнитивным нарушением или быстро прогрессировать с припадками, гемипарезом, нарушениями двигательных функций или с утратой зрения. На МРТ черепа могут быть распространенные повреждения белого и серого вещества. Исход без лечения и восстановления иммунитета обычно смертельный через несколько месяцев. Пациенты с прогрессирующей формой ВИЧ могут развить острую симптоматику ПМЛ вскоре после начала противовирусной терапии, что рассматривается как еще одно проявление синдрома воспалительного восстановления иммунитета (Nuttall et al., 2004).
г) Полиовирусная инфекция (дикий и поствакцинальный тип). Полиовирус у пациентов с ослабленным иммунитетом может вызвать развитие типичной картины паралитического полиомиелита. Имеются описания случаев при Х-сцепленной гипогаммаглобулинемии (Wright et al., 1977) и нарушении Т-клеточного звена иммунитета. В качестве исключения может иметь место более диффузное заболевание с вовлечением головного мозга и очагами кальцификации в зрительном бугре после вакцинации живым аттенуированным вирусом (Davis et al., 1977).
д) Хроническая энтеровирусная инфекция у детей с Х-сцепленной гипогаммаглобулинемией. Дети с Х-сцепленной гипогаммаглобулинемией (болезнью Брутона) часто страдают от вирусных инфекций ЦНС в сочетании с бактериальными осложнениями (гнойным менингитом). Наиболее распространенными возбудителями этих инфекций являются энтеровирусы (Cooper et al., 1983). Характерным клиническим проявлением является хронический лимфоцитарный менингит с различными признаками поражения мозга, такими как нарушение сознания и очаговые припадки или неврологический дефицит. Другие симптомы включают в себя прогрессирующую миелопатию, миелопатию, прогрессирующую до энцефалопатии, простую энцефалопатию, ретинопатию, нейросенсорную тугоухость и дерматомиозит (Rudge et al., 1996). Течение хроническое, нередко с летальным исходом. Диагностика по результатам ПЦР-исследования ликвора или же по биопсии ткани в некоторых случаях, а для контроля эффективности можно использовать количественную оценку ПЦР (Quartier et al., 2000).
Интратекальное и внутрижелудочковое введение гаммаглобулинов может помочь уменьшить симптомы, но не выводит инфекцию (Erlendsson et al., 1985; Johnson et al., 1985).
Читайте также:

