Выпадения волос при цитомегаловирусе
Обновлено: 15.04.2024
Цитомегаловирусная инфекция у детей (ЦМВИ) – типичный представитель оппортунистических инфекционных заболеваний, клинически проявляющихся только на фоне иммунодефицитных состояний.
Цитомегалия — это вирусное заболевание, которое проявляется множеством симптомов, которые возникаюь из-за образования гигантских клеток с типичными внутриядерными и цитоплазматическими включениями в слюнных железах, висцеральных органах и центральной нервной системе.
Цитомегаловирусная инфекция, согласно международной классификации, бывает таких видов:
- цитомегаловирусный панкреатит
- цитомегаловирусный гепатит
- цитомегаловирусная пневмония
- другие цитомегаловирусньте болезни
- неуточненная цитомегаловирусная болезнь.
Также существует врожденная цитомегаловирусная инфекция и цитомегаловирусный мононуклеоз.
Цитомегалия бывает врожденной или приобретенной. При врожденной могут быть поражены многие органы и системы ребенка, такую форму болезни называют генерализированной.
Приобретенная цитомегалия у детей раннего возраст протекает по типу мононуклеозоподобного синдрома. В некоторых случаях вирус преимущественно поражает желудочно-кишечный тракт, легкие, печень. Или же болезнь может принять генерализированную форму. Обе формы (врожденная и приобретенная) могут проходить бессимптомно. Согласно классификации по признаку течения, цитомегалия бывает острой и хронической.
Что провоцирует / Причины Цитомегаловирусной инфекции у детей:
Возбудитель – ДНК-содержащий вирус семейства Herpes-viriae – Cytomegalovirus hominis. Источником цитомегаловирусной инфекции у детей является мать. Механизмы передачи: вертикальный и интранатальный.
Пути передачи – гематогенный (трансплацентарный), восходящий, контактный, аспирационный (при заглатывании инфицированных околоплодных вод). У детей первого года жизни возможно инфицирование через грудное молоко. Дети раннего возраста могут инфицироваться контактно-бытовым, воздушно-капельным, трансфузионным путем.
Эпидемиологические особенности ЦМВИ (широкое распространение цитомегаловируса в человеческой популяции, различные механизмы и пути передачи, преобладание субклинических форм инфекции), а также особенности иммунитета у беременных и плода способствуют повышенному риску внутриутробного инфицирования вирусом цитомегалии.

У больных цитомегаловирусной инфекцией клетки, зараженные вирусом, обнаруживают в осадке мочи, слюне, спинномозговой жидкости и пораженных органах. Вирус сохраняет жизнедеятельность в среде, имеющей комнатную температуру. Он имеет чувствительность к дезинфицирующим средствам и эфиру. Вирус устойчив к антибиотикам.
Патогенез (что происходит?) во время Цитомегаловирусной инфекции у детей:
У новорожденных детей встречается в 0,2-2,5% случаев. Клинические формы врожденной цитомегаловирусной инфекции у детей: бессимптомная, генерализованная. У 80% детей, перенесших генерализованную ЦМВИ, в дальнейшем отмечается неврологическая симптоматика, у 17% детей при бессимптомном течении заболевания отмечается минимальная мозговая дисфункция, задержка развития, неврозоподобные расстройства.
Скорость репликации и инфицирования дочерними вирусами незараженных клеток зависит от функционального состояния иммунной системы. Неспецифические факторы иммунитета – система интерферона, комплемента, естественные киллеры – на первых этапах инфекционного процесса замедляют скорость распространения возбудителя, а в дальнейшем потенцируют активность специфического иммунитета и препятствуют инфицированию непораженных клеток. Однако наиболее действенной защитой от ЦМВИ является создание специфического иммунитета (образование специфических антител и специфических Т-лимфоцитов). Специфическая иммунная защита может формироваться только в том случае, если вирусы расположены и неклеточно. Внутриклеточное расположение вируса защищает его от иммунного воздействия.
Клинические проявления: риск инфицирования плода, тяжесть заболевания новорожденного ребенка и дальнейший прогноз при внутриутробной ЦМВИ зависят от характера течения инфекционного процесса у матери в период беременности. Если женщина, не имеющая иммунитета к вирусу цитомегалии, впервые инфицируется им в период беременности, то это приводит к развитию у нее первичной ЦМВИ. Частота передачи цитомегаловируса при первичной инфекции от серонегативной беременной плоду составляет от 30 до 50%. Следует отметить, что в большинстве случаев отмечается бессимптомное течение инфекции у женщин. При вторичной цитомегаловирусной инфекции риск внутриутробного инфицирования плода значительно ниже (2%).
Симптомы Цитомегаловирусной инфекции у детей:
Клинические проявления внутриутробной ЦМВИ:
- петехиальная сыпь (мелкие кожные кровоизлияния) – 60-80%
- тромбоцитопеническая пурпура – 76%;
- желтуха – 67%;
- гепатоспленомегалия – 60%;
- микроцефалия – 53%;
- гипотрофия – 50%;
- недоношенность – 34%;
- гепатит – 20%;
- энцефалит –15%;
- хориоретинит – 12%.
Клиническая картина приобретенной цитомегалии. Инкубационный период может длиться минимум 15 дней, максимум 3 месяца. Всё это время ребенок является носителем инфекции.
При приобретенной цитомегалии ребенок заражается от матери или медперсоналав роддоме в том случае, если данные взрослые – носители вируса. Если малышу делают переливание плазмы/крови от доноров, и кровь недостаточно проверена, возможно заражение.
Болезнь может проявиться в изолированном поражении слюнных желез, либо инфекция поражает, помимо слюнных желез, еще и висцеральные органы. Приобретенная цитомегалия редко бывает генерализированной. У ребенка постепенно повышается температура. Среди симптомов отмечают такие: боли в горле, увеличение шейных лимфатических узлов, печени и селезенки. Могут быть головные боли, боли в животе, анорексия, ощущение слабости в теле.
Слизиста оболочка ротоглотки чуть красновата, можно наблюдать увеличение небных миндалин.
В других случаях могут проявляться симптомы интерстициальной пневмонии, такие как цианоз, одышка и пр. Не исключены желудочно-кишечные расстройства, проявляющиеся в учащении стула и рвоте. Может наблюдаться также нарушение печеночных функций, например, потемнение мочи, желтуха и т. д., а также изменения в мочи.
Болезнь длится долго. Температура может ежедневно повышаться до уровня 39—40 ˚ С. Ребенок во время подъемов температуры ощущает озноб, что может длиться от 2 до 4 недель, редко – более длительный срок.
Если заражение возникло вследствие переливания крови, через 5-6 недель после процедуры возникает цитомегаловирусный мононуклеозоподобный синдром.
Генерализированная форма приобретенной цитомегаловирусной инфекции отличается тем, что вирус постепенно поражает многие органы и системы в организме ребенка. Лихорадка длительная, проявляется общеинфекционный токсикоз. Вирус поражает легкие, что приводит к интерстициальной пневмонии. Поражение желудочно-кишечного тракта проявляется в повторяющихся приступах рвоты и жидком многократном стуле. Вирус при генерализированной форме поражает сердечно-сосудистую систему. Фиксируются явления паренхиматозного гепатита, энцефалита. Течение генерализированной формы длительное.
Диагностика Цитомегаловирусной инфекции у детей:
Чтобы диагностировать наличие цитомегаловирусной инфекции у детей проводиться лабороторное исследование крови на специфические антитела к цитомегаловирусу – иммуноглобулинов М и G.
Обнаружение иммуноглобулинов М может указывать на первичное заражение цитомегаловирусами либо на реактивацию хронической цитомегаловирусной инфекции. Высокие титры IgМ у беременных могут способствовать инфицированию плода. Повышение IgМ определяется в крови через 4-7 недель после заражения вирусом и наблюдается в течение16-20 недель.
Повышенные иммуноглобулины G развиваются в период снижения активности цитомегаловирусной инфекции. Их наличие в крови указывает на цитомегаловирус в организме, но не показывает активности инфекционного процесса.
С помощью ПЦР-диагностики определяется ДНК цитомегаловируса в клетках крови и слизистых – соскобы из уретры и цервикального канала, мокроты, слюна и т.д. Эффективным способом диагностики является проведение количественной ПЦР, которая показывает активность цитомегаловируса и вызываемого им инфекционного процесса. Диагноз ставится, когда выделение цитомегаловируса в забранном материале пошается.
Зависимо от того, какой орган пострадал от инфекции, пациент проходит осмотр гинеколога, гастроэнтеролога, андролога или других докторов. Дополнительно может назначаться проведение УЗИ органов брюшной полости, гастроскопия, кольпоскопия, МРТ головного мозга и другое.
Лечение Цитомегаловирусной инфекции у детей:
В настоящее время существует два основных направления терапии и профилактики вирусных инфекций. Это виростатические препараты и специфические иммуноглобулины. Эти два вида терапии имеют принципиальные отличия в механизме противовирусного действия.
Ганцикловир назначают внутрь во время еды, а также вводят внутривенно. Биоусвоение из желудочно-кишечного тракта равно 15-20%, тем не менее этого достаточно для оказания эффекта. У препарата высокая активность и он обладает способностью избирательно накапливаться в клетках, инфицированных вирусом, но не в интактных клетках. Его концентрация в инфицированных клетках может в 30-120 раз быть больше, чем в плазме крови. Это важное обстоятельство объясняет большую широту терапевтического действия данного препарата по сравнению с другими и меньшую опасность осложнений. Связывание с белками плазмы крови всего 9-30%, поэтому препарат хорошо проникает в различные ткани и жидкости (включая ликвор). Большая часть препарата (80-90%) в неизмененном виде и в виде метаболита 9-карбоксиметоксиметилгуанина выводится почками. Период полувыведения примерно 3,3 ч, однако при почечной недостаточности он может увеличиваться до 20 ч, поэтому необходимо корректировать дозирование. Так, при скорости клубочковой фильтрации (СКФ) менее 70 мл/мин — дозу препарата снижают в 2 раза; при СКФ менее 50 мл/мин – дозу уменьшают еще на треть; при СКФ менее 25 мл/мин еще на '/2 и при СКФ менее 10 мл/мин – в 3 раза.
Нежелательные эффекты ганцикловира: гематотоксичность (нейтро-, лейко-, тромбоцитопения); энцефалопатические реакции; иммунодепрессия; повреждение репродуктивной функции у мужчин и женщин; мутагенное, тератогенное и канцерогенное действие.
Фоскарнет (фосфоноформат) вводят внутривенно. Период его полувыведения от 2 до 4 ч. Экскретируется в неизмененном виде почками. Фоскарнет может вызывать костномозговую депрессию, иммунодепрессию, нарушения функции печени и почек; он обладает тератогенным, мутагенным и канцерогенным свойством.
При использовании ганцикловира и фоскарнета необходимо каждые 2 дня анализ крови. При выраженной нейтропении (меньше 500/мкл) и тромбоцитопении (менее 25 000/мкл) препараты срочно отменяют.
Ганцикловир и фоскарнет являются цитостатиками, поэтому при лечении ЦМВИ их иногда комбинируют с иммуностимуляторами или с интерфероногенами (например, с циклофероном и др.), а также со стимуляторами кроветворения (например, с филграстимом и др.) и с иммуноглобулинами (цитотект).
Цитотект – иммуноглобулин с повышенным содержанием специфических антител к цитомегаловирусу. Его применяют как средство заместительной терапии.
Индивидуальная непереносимость препарата проявляется головной болью, тошнотой, головокружением, рвотой, диареей, тахикардией, цианозом, одышкой, гипертермией, ознобом, повышенным потоотделением, болью в спине, миалгией. Перечисленные симптомы могут появиться уже через 30 мин после начала инфузии и наблюдаться в течение первых суток. Тяжелая анафилактическая реакция может наблюдаться у больных с отсутствием или выраженным дефицитом IgA, что примерно в 30% случаев связано с наличием у них антител против названного иммуноглобулина. Когда такие больные получают иммуноглобулиновый препарат, у них образуются макромолекулярный комплекс IgA – анти-IgA, приводящий к анафилаксии. Целесообразно у всех больных определять IgA в сыворотке крови перед введением цитотекта.
Профилактика Цитомегаловирусной инфекции у детей:
К методам профилактики принадлежат неспецифические: соблюдение личной гигиены, к специфическим относятся медикаментозный метод препаратами – ганцикловир, ацикловир, фоскарнет.
Чтобы исключить возможность инфицирования цитомегаловирусом пациентов при пересадке органов и тканей необходимо проводить тщательный подбор доноров и контроль донорского материала на наличие цитомегаловирусной инфекции.
Особую опасность цитомегаловирусная инфекция представляет для беременных женщин, так как может спровоцировать выкидыш, мертворождение или вызвать тяжелые врожденные уродства у ребенка. Поэтому цитомегаловирус, наряду с токсоплазмозом, герпесом и краснухой принадлежит к числу инфекций, обследоваться на которые женщины должны еще на этапе планирования беременности.
К каким докторам следует обращаться если у Вас Цитомегаловирусная инфекция у детей:
Вас что-то беспокоит? Вы хотите узнать более детальную информацию о Цитомегаловирусной инфекции у детей, ее причинах, симптомах, методах лечения и профилактики, ходе течения болезни и соблюдении диеты после нее? Или же Вам необходим осмотр? Вы можете записаться на прием к доктору .
Цитомегаловирусная инфекция (ЦМВИ) – хроническая инфекционная болезнь вирусной этиологии, характеризующаяся многообразием форм патологического процесса от латентной инфекции до клинически выраженного генерализованного заболевания (цитомегаловирусная болезнь). Тяжесть и спектр проявлений ЦМВИ весьма разнообразны.
Продолжительность инкубационного периода при заражении ЦМВ составляет 4-12 недель. Клиническая картина приобретенной ЦМВИ у взрослых зависит от формы инфекции (первичное заражение, реинфекция, реактивация латентного вируса), путей и механизмов заражения (аспирация инфицированной слюны, гемотрансфузии, половой путь, трансплантация инфицированного органа), состояния иммунной системы (отсутствие или наличие иммуносупрессии и степень ее выраженности).
Первично латентная цитомегалия – самая частая форма инфекции. Латентная цитомегаловирусная инфекция продолжается пожизненно и клинически не проявляется, однако под влиянием каких-либо причин может активизироваться и переходить в манифестную клинически выраженную форму.
Первичное инфицирование ЦМВ иммунокомпетентных лиц обычно протекает бессимптомно или с нерезко выраженным мононуклеозоподобным синдромом. Данным синдромом острая ЦМВИ проявляется лишь у 5% взрослых (соответственно, не более, чем у 3-5% беременных). Основные отличительные признаки — высокая лихорадка, слабость, утомляемость, сильное недомогание, выраженный и длительный астенический синдром, в крови — относительный лимфоцитоз, атипичные лимфоциты.
Острая форма ЦМВИ чаще всего наблюдается у лиц, зараженных вирусом при переливании крови от больного человека или половым путем. Обычно ее течение похоже на простуду и сопровождается такими симптомами, как слабость, общее недомогание, головные боли и насморк. Часто возникает воспаление и увеличение слюнных желез с обильным отделением слюны и белесоватыми налетами на деснах и языке.
Характерны высокая лихорадка длительностью более двух недель, общее недомогание, выраженная утомляемость, лимфаденопатия. Отмечаются головная боль, миалгии, артралгии, гепатоспленомегалия, повышение активности аминотрансфераз и щелочной фосфатазы. Возможно развитие гепатита и пневмонии. Большинство больных выздоравливает полностью, хотя астенический синдром сохраняется длительное время. При отсутствии выраженных иммунологических нарушений острая ЦМВИ переходит в латентную с пожизненным присутствием
Острая ЦМВИ у беременных протекает бессимптомно или с умеренно выраженными признаками фарингита, незначительного повышения температуры тела, признаками астении. Заражение вирусом в первые 20 недель беременности может быть причиной самопроизвольного выкидыша, внутриутробной гибели плода, мертворождения, пороков развития. При заражении в более поздние сроки у ребенка может быть врожденная цитомегалия, симптомы которой обнаруживаются с первых дней внеутробной жизни.
У людей с нормальным иммунитетом (иммунокомпетентных) ЦМВИ, как правило, протекает латентно. Однако на фоне имеющихся иммунологических нарушений резко повышается риск развития клинически выраженных (манифестных) форм заболевания. Например, манифестная ЦМВИ занимает одно из первых мест в структуре оппортунистических заболеваний у ВИЧ-инфицированных пациентов. Кроме того, клинически выраженная ЦМВИ — одно из самых частых и серьёзных инфекционных осложнений при трансплантации органов или в случае проведения длительной иммуносупрессивной терапии.
Развитие тяжёлой ЦМВИ описано у онкогематологических больных, пациентов, страдавших пневмоцистной пневмонией, туберкулёзом, лучевой болезнью, ожоговой травмой, у лиц, находящихся на длительной кортикостероидной терапии, перенёсших различные стрессовые ситуации.
Развитие манифестной ЦМВИ в этом случае может быть обусловлено первичным инфицированием ЦМВ, повторным попаданием вируса в организм (реинфекцией) или реактивацией вируса в заражённом организме . Вероятность возникновения и тяжесть течения ЦМВИ связывают со степенью иммуносупрессии.
Через 1-3 месяца при наличии выраженной иммуносупрессии наступает тяжелая органная патология с тенденцией к генерализации процесса.
При генерализованной форме чаще наблюдается поражение легких, почек и кишечника, реже - печени и других органов. Один из тяжёлых признаков ЦМВИ — ретинит. Потеря зрения необратима, поскольку данный процесс развивается в результате воспаления и некроза сетчатки. Как возможные клинические симптомы ЦМВИ диагностируют также восходящий миелит и полиневропатию (подострого течения); энцефалит, характеризующийся деменцией; цитомегаловирусный гепатит с одновременным поражением жёлчных путей и развитием склерозирующего холангита; адреналит, проявляющийся резкой слабостью и снижением АД. Иногда возникает эпидидимит, цервицит, панкреатит.
По оценкам специалистов, только в США ежегодно рождается 30—40 тысяч детей с врожденной ЦМВ-инфекцией, т. е. она далеко опережает по частоте и значимости все остальные врожденные инфекции. Важно отметить, что врожденная цитомегаловирусная инфекция всегда имеет генерализованный характер, тогда как приобретенная может быть локализованной с изолированным поражением слюнных желез.
Для врожденной цитомегалии характерна внутриутробная задержка развития, желтуха, увеличение печени и селезенки, уменьшение числа тромбоцитов, ретикулоцитоз и прогрессирующая анемия. Врожденная генерализованная ЦМВИ характеризуется также геморрагическими высыпаниями на коже и слизистых оболочках, кровоизлияниями во внутренние органы и головной мозг, значительной анемией, развитием очагов миелоэритробластоза в печени и почках.
Самое тяжелое проявление данной формы — энцефалит, который практически не встречается при приобретенной цитомегаловирусной инфекции. Часто развиваются микроцефалия, расширение желудочков мозга, нейросенсорная тугоухость. Отмечается поражение глаз - увеит, помутнение хрусталика и субатрофия радужной оболочки.
Цитомегаловирус (ЦМВ) — это широко распространенный вирус, встречающийся у людей на всех континентах и вызывающий цитомегалию или, другими словами, цитомегаловирусную инфекцию (ЦМВИ). Для ЦМВИ характерно многообразие клинических проявлений — от бессимптомного течения до генерализованного процесса с поражением внутренних органов и нервной системы.
Морфология и структура вируса довольно сложные. Особенностью ЦМВ являются крупный ДНК-геном, представленный двуспиральной ДНК. Диаметр вирусной частицы (нуклеокапсида), имеющей овальную или круглую форму, составляет 100 – 120 нм.
Для этого вируса характерны возможность репликации без повреждения клетки, малая цитопатогенность в культуре ткани, медленная репликация, сравнительно низкая вирулентность и способность существенно подавлять клеточный иммунитет. Вирус неустойчив в тепловому воздействию и теряет активность при нагревании до температуры +56 С. Кроме того, ЦМВ может длительно сохраняться при комнатной температуре, быстро инактивируется при замораживании до –20 °C.
В отличие от вируса герпеса, цитомегаловирус является вирусом с медленным развитием цитопатогенного эффекта и часто не вызывает видимых симптомов болезни. ЦМВ может активироваться только при благоприятных для себя условиях у людей с подавленной или несформированной системой иммунитета. При этом цитомегаловирус способен блокировать и обходить многие уровни иммунной защиты, ускользая от иммунной атаки.
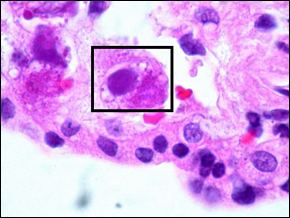
Окрашенный гистологический образец. Клетка, пораженная цитомегаловирусом.
После заражения вирус, поступивший в организм ранее неинфицированного человека, проникает внутрь клеток и начинает активно реплицироваться. Проникая в кровь, ЦМВ репродуцируется в лимфоцитах и в системе мононуклеарных фагоцитов.
В результате миграции лимфоцитов происходит инфицирование вирусом слюнных желез, где цитомегаловирус может длительно циркулировать, проходя своеобразную тренировку вирулентности. Эпителиальные клетки слюнных желез, преимущественно околоушных – хорошая питательная среда для вируса, в которой его активность, а значит, и способность проникать в клетки, достаточно высоки. Поражая ткани слюнных желез, ЦМВ при локализованных формах обнаруживается только в этих железах.
На сегодняшний момент вакцина против цитомегаловируса не разработана. ЦМВ после первичного инфицирования сохраняется в латентной форме в тканях инфицированного человека пожизненно, периодически реактивируясь. Медикаментозная терапия позволяет увеличить период ремиссии и воздействовать на рецидив инфекции, но не позволяет элиминировать вирус из организма.
Что такое очаговая алопеция? Причины возникновения, диагностику и методы лечения разберем в статье доктора Ерёмина Т. А., дерматолога со стажем в 14 лет.
Над статьей доктора Ерёмина Т. А. работали литературный редактор Юлия Липовская , научный редактор Сергей Федосов и шеф-редактор Лада Родчанина
Определение болезни. Причины заболевания
Выпадение волос (алопеция) — это патология, которая характеризуется воспалением в волосяных фолликулах и иногда ногтевых пластинах, а также стойкой или временной нерубцовой потерей волос.
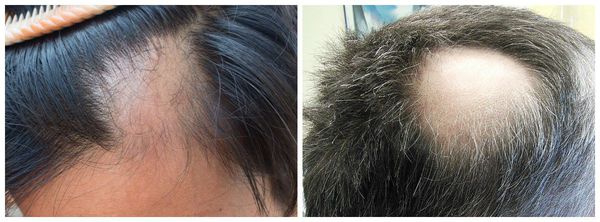
Алопеция по актуальности не уступает многим дерматологическим проблемам. Волосы — придаток кожи, они придают человеку определённый эстетический вид, из-за отсутствия волос возникает косметический дефект, который влечёт за собой снижение качества жизни пациента и проблемы с социальной адаптацией.
Выпадение волос бывает врождённым и приобретённым. Наиболее часто регистрируется приобретённая форма выпадения волос — очаговая, или гнёздная, алопеция (ГА). Гнёздная алопеция также известна как частичное или точечное облысение, волосы могут выпадать не только на голове, но и на теле, бровях и ресницах [1] . Как правило, она возникает спонтанно на фоне полного здоровья.

Алопеция развивается у обоих полов. Определённая роль в развитии патологии отводится факторам риска, к ним относятся:
- заболевания пищеварительного тракта: синдром нарушенного кишечного всасывания, хронический гастрит, ассоциированный с бактерией Helicobacter pylori ;
- инфекции: ОРВИ, грипп, кишечные инфекции и т. д.;
- приём медикаментов: антибиотиков, противовирусных препаратов, нестероидных противовоспалительных препаратов, витаминов группы В и т. д.);
- наследственность, хронические патологии (хронический синусит, тонзиллит, гайморит, хронический кариес и т. д.);
- вредные привычки, недостаток витаминов и микроэлементов (цинка, селена, меди, железа, молибдена и т. д);
- стрессы, депрессия, изменение в мочеполовой системе (воспалительные гинекологические заболевания, приводящие к изменению гормонального обмена): эндометриоз, поликистоз яичников, мультифолликулярные яичники;
- плохое питание, аутоиммунные заболевания (эутериоз, аутоиммунный токсический зоб, заболевания соединительной ткани) [2] .
Очаговая алопеция не заразна. Семейные случаи возможны, если у кого-то из первой линии родства было данное заболевание [6] . Убедительные доказательства взаимосвязи генетики и повышенного риска развития генёздной алопеции были найдены при изучении семей, где двое или более родственников страдали от выпадения волос. Это исследование выявило, по крайней мере, четыре области в геноме, которые, вероятно, содержат эти гены [7] .
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы очаговой алопеции
Клиническая картина специфична и имеет непосредственную связь с клиническими разновидностями форм очаговой алопеции. Типичными первыми симптомами являются небольшие залысины в виде одного или нескольких чётко очерченных очагов, которые чаще появляются в затылочной области. Количество очагов и их величина могут быть самыми различными (от одного небольшого очага до полной потери волос). На поредевших участках кожа не повреждена и внешне выглядит здоровой. Пятна могут быть различной формы, обычно они круглые или овальные [8] .
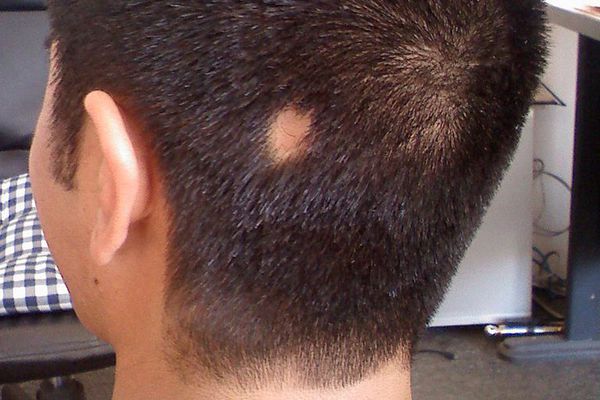
Следующие очаги возникают в отдалении от первого и нередко носят симметричный характер. Они имеют склонность к периферическому росту (увеличению очага по краям), очаги сливаются и образуют большие участки облысения. Выпадение чаще всего наблюдается на коже головы и бороды, но может возникать на любой части тела с волосами [9] .
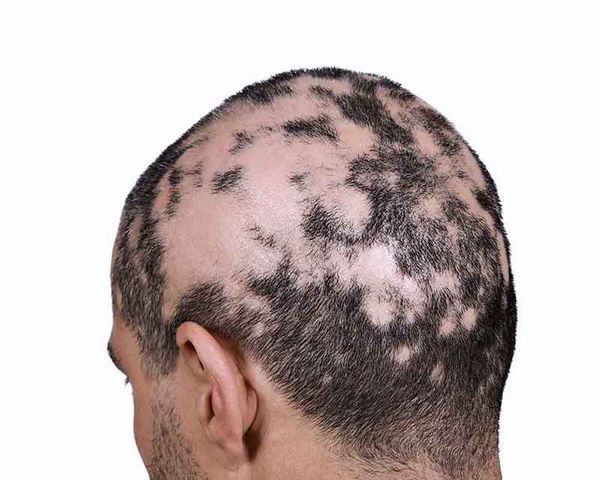
Область выпадения волос иногда сопровождается субъективными симптомами: покалыванием или болезненностью [10] . Волосы обычно выпадают в течение короткого периода времени, причём обычно с одной стороны выпадает больше волос, чем с другой. В очагах часто присутствуют так называемые "конические волоски" с более узким стержнем у корня, этот трихоскопический симптом еще называют "восклицательный знак" [9] . Такие волосы очень короткие (3-4 мм) и могут находиться вокруг проплешин [10] .
Болезнь может перейти в ремиссию на некоторое время или может быть постоянной. Патология имеет доброкачественное волнообразное течение (обратимый характер), волосы, как правило, отрастают на фоне лечения. Но при длительном существовании очагов без терапии волосяные фолликулы (луковицы) атрофируются и процесс приобретает злокачественную затяжную форму (необратимый характер). Зачастую выпадение волос появляется в тандеме с дистрофическими изменениями ногтевых пластин и носит название "трахионихия".
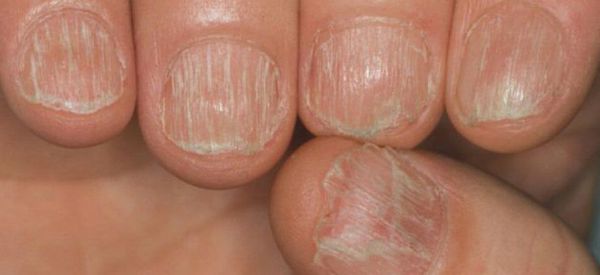
Патогенез очаговой алопеции
Основной механизм патогенеза очаговой алопеции включает разрушение луковиц волоса собственными иммунными клетками [2] . Организм ошибочно атакует собственные анагенные (находящиеся в фазе роста) волосяные фолликулы и подавляет или останавливает рост волос [9] . Например, Т-клеточные лимфоциты (клетки, отвечающие за защитную функцию организма) скапливаются вокруг поражённых фолликулов и в дерме, вызывая воспаление и последующее выпадение волос.
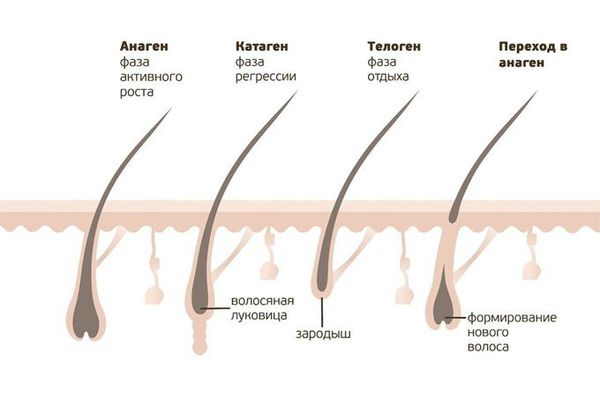
Запускается каскад цепных реакций: нарушение процессов кератинизации (шелушения), деструкция и гибель стержней волос, истощение репаративного (восстановительного) потенциала, затем при длительном течении алопеции (более двух лет) процесс репарации волосяного фолликула сопровождается его атрофией с развитием склеротических изменений (заменой нормальной ткани на соединительную) и склерозированием микрососудов. Было высказано предположение, что волосяные фолликулы в здоровом состоянии защищены от иммунной системы так называемой "иммунной привилегией" [4] [19] .
Развитие алопеции также связано с нарушением усвоения организмом серосодержащих соединений, которые изменяют процесс кератинизации волос и приводят к патологическим изменениям в их структуре [11] .
Классификация и стадии развития очаговой алопеции
Как правило, гнёздная потеря волос включает в себя следующие клинические разновидности:
- Локальная (ограниченная) форма описывает облысение только в одном месте [9][12] . Это может произойти на любом участке волосистой части головы.
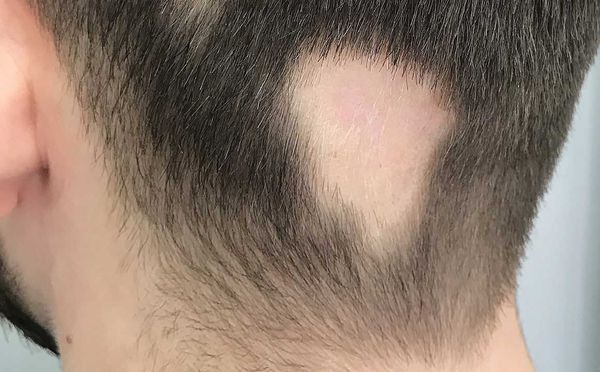
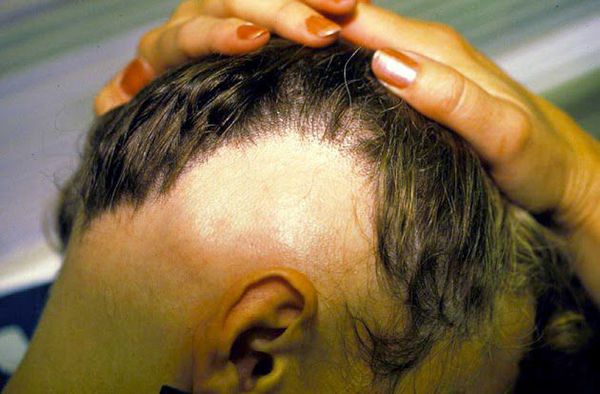
- Субтотальная форма — на голове отсутствует более 40 % волос. При офиазисе (отсутствии волос полностью по краевой зоне роста волос) очаги имеют лентовидную форму, затрагивают всю краевую зону роста волос в затылочных и височных областях по форме волны. При инверсном офиазисе очаги лентовидной формы распространяются на лобно-теменную и затылочные области.
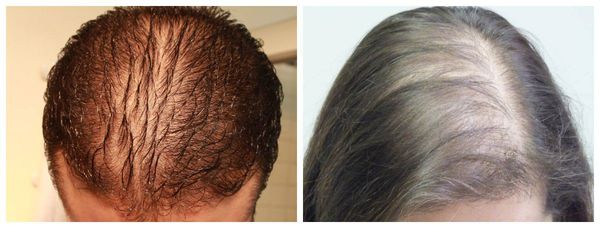
- Диффузная алопеция — волосы выпадают более рассеянно, рассредоточено по всей коже головы [9] .
- Alopecia areata barbae — форма заболевания, при которой выпадение волос ограничивается только бородой [9] .

- Тотальная алопеция (areata totalis, или облысение) — характеризуется полной потерей терминальных (тёмных, жёстких и длинных) волос на волосистой части головы [2] .

- Alopecia areata universalis (универсальная) — такой диагноз ставится, если выпадают все волосы на теле, включая лобковые волосы [2] .
Тотальная и универсальная формы встречаются редко [13] .
Заболевание имеет несколько стадий.
- Активная стадия (проградиентная, прогрессирующая). Во время активной стадии типичные очаги поредения представляют собой участки нерубцового облысения округлой или овальной формы с неизменённым цветом кожи. Для оценки состояния волос проводится тест на натяжение волос. Н еобходимо захватить небольшой пучок волос (50-60 волос) между большим и указательным пальцами и с некоторым усилием, но не очень резко, потянуть волосы. Если в руках остаётся больше 10 % волос (более 6 волос), тест свидетельствует о наличии патологического выпадения волос (положительный тест). Меньшее количество извлечённых волос (до 2 шт.) свидетельствует о физиологическом выпадении волос. Процедуру следует провести в 4 зонах: в теменной области слева и справа, в лобной и затылочной области. В активной фазе заболевания на границах поражений тест на натяжение волос может быть положительным — это зона "расшатанных волос" . На начальном этапе выпадение не затрагивает седые волосы.
- Стационарная стадия — просуществовав 4–6 месяцев, процесс слияния мелких очагов в крупные приостанавливается.
- Стадия регресса — в очагах облысения восстанавливается нормальный рост волос.
Осложнения очаговой алопеции
На сегодняшний день гнёздная алопеция имеет доброкачественное течение. Она не влечёт за собой потерю работоспособности, нарушения общего состояния, инвалидизацию, не требует длительного нахождения в стационарах, но значительно сказывается на качестве жизни и психоэмоциональном состоянии пациентов. Необходимо понимать, что процесс обратим, так как волосяные фолликулы остаются жизнеспособными [15] .
Чаще всего врач трихолог-дерматолог сталкивается с нозогенными реакциями (психогенными расстройствами) своих пациентов: людей с алопецией беспокоит изменение своего внешнего вида и потеря собственной привлекательности, жалость в глазах окружающих; пациенты часто страдают депрессивными, тревожными, социофобическими расстройствами и сенситивными (фобическими) идеями. Чаще всего депрессивные расстройства у пациентов с алопецией проявляются лёгкими формами. Кроме того, у больных могут наблюдаться тревожные расстройства с опасениями возможного прогрессирования облысения и суицидальными наклонностями [16] . Все эти состояния не зависят напрямую от степени выраженности облысения, однако они заслуживают внимания специалистов.
Диагностика очаговой алопеции
Очаговая алопеция обычно диагностируется на основании клинических признаков.
Трихоскопия (исследование волос при помощи трихоскопа, который многократно увеличивает волосы) является основным методом установления данного диагноза. Трихоскопия показывает регулярно распределённые "жёлтые точки" (гиперкератотические пробки), небольшие "восклицательные знаки" и "чёрные точки" (поражённые волоски в отверстии волосяного фолликула) [17] . Для клинической диагностики ГА часто достаточно клинических проявлений в виде очагов выпадения волос и наличия волос, обломанных по типу "восклицательных знаков". Иногда в области облысения может появиться покраснение кожи (эритема) [5] . При эффективном лечении и возобновлении роста волос появляются пушковые волосы.

В редких случаях для постановки диагноза и помощи в лечении облысения требуется биопсия. Она применяется в спорных ситуациях для дифференциальной диагностики с другими заболеваниями и когда лечение не приносит результата. Биопсия позволяет определиться с тактикой лечения и прогнозом заболевания.
Результаты гистологических исследований показывают наличие перибульбарного лимфоцитарного инфильтрата (скопления лимфоцитов) по типу "рой пчёл". Иногда в неактивных зонах облысения воспалительные инфильтраты не обнаруживаются. Ещё одним характерным признаком является недержание пигмента в луковице волоса и фолликулярных стелах (анатомической структуре волосяного фолликула), а также сдвиг в соотношении анаген-телоген в сторону телогена (стадии выпадения волос).
Определённая роль отводится клиническим лабораторным и инструментальным методам исследования. Клинический минимум должен содержать:
- Общий анализ мочи.
- Биохимический анализ крови (АЛТ, АСТ, ГГТ, щелочная фосфатаза, глюкоза, билирубин общий, билирубин прямой, общий белок, холестерин (ЛПВН, ЛПНП), триглецириды, мочевина, креатинин, мочевая кислота, коэфициент атерогенности, гликированный гемоглобин, С-реактивный белок, ревматоидный фактор, С-пептид).
- Определение антител классов M, G (IgM, IgG) к вирусу иммунодефицита человека.
- Определение антигена HBsAg (позволяет выявить гепатит Б).
- Определение антител классов M, G к вирусу гепатита С.
- Проведение реакции Вассермана (анализ крови на сифилис).
- Анализ крови на волчаночный антикоагулянт (специфический маркер такого заболевания, как дискоидная красная волчанка).
- Определение антинуклеарных антител.
- Анализ крови на железо, ферритин, трансферрин, гомоцистеин, фолиевую кислоту, цинк, селен, медь, магний, витамин В12, витамин Д.
- Анализ крови на гормоны: инсулин, гормоны щитовидной железы (ТТГ, Т3 свободный, Т4 свободный, антитела к тиреопераксидазе, антитела к тиреоглобулину).
Такой большой список показателей нужен для того, чтобы разобраться, что именно вызывает потерю волос. Необходимо исследовать каждый обмен веществ: липидный, углеводный, гормональный, белковый и исключить все метаболические нарушения.
По показаниям проводятся:
- Трихологический генетический тест (делается соскоб эпителиальных клеток слизистой полости рта с области щеки в специальную пробирку, где анализируется геном).
- Спектральный анализ волоса на микроэлементы (производится забор волоса с области затылка и отправляется в лабораторию на исследование нехватки или переизбытка микроэлементов).
- Соскоб на грибы с кожи волосистой части головы.
- УЗИ щитовидной железы.
- УЗИ сосудов шеи.
- МРТ головного мозга.
По мере необходимости для исключения очагов хронической инфекции пациент направляется на консультации к смежным специалистам [14] .
Лечение очаговой алопеции
При отсутствии на голове более 25 % волос необходимо осматривать состояние волосяного покрова на туловище и конечностях. Если в данных областях тоже наблюдается выпадение, это необходимо учитывать при выборе метода лечения. Также выбор терапии формируется с учётом формы, стадии, длительности процесса и возраста больного.
Сложность патологии в том, что ни один из существующих терапевтических вариантов не является на 100 % эффективным [18] , но если назначена адекватная терапия, то волосы во многих случаях могут самопроизвольно отрасти.
В некоторых случаях выпадения волос успеха можно достичь при помощи стероидных препаратов (кортикостероидов) в виде крема, мази, лосьона клобетазол, мометазон фуроат и инъекций кортикостероидов. Применение только кортикостероидных кремов на коже в области выпадения не так эффективно и требует больше времени для получения результатов. Стероидные вещества топического (местного) применения обычно используются на небольших зонах выпадения волос. Раствор биматопроста 0,03 % применяется только для бровей и ресниц. Препарат хорошо переносятся, он безопасен и эффективен при выпадении бровей и ресниц [20] [21] .
У применения кортикостероидов есть и недостатки: они часто не могут проникнуть в кожу достаточно глубоко, чтобы повлиять на луковицы волоса [7] . Пероральные кортикостероиды могут уменьшить выпадение волос, но только на период, в течение которого они принимаются, кроме того, эти препараты могут вызвать серьёзные побочные эффекты [7] .
При выпадении волос применяют также миноксидил, различные раздражители (пентоксифиллин, раствор никотиовой кислоты, красный перец), пептидные комплексы, средства стимулирующие рост волос, но только не в прогрессирующую стадию. В более тяжёлых случаях и при отсутствии эффективности лечения топическими стероидами назначают иммунотерапию циклоспорином и/или метотрексатом, иногда их применяют в различных комбинациях.
Физиотерапевтические методы лечения имеют определённую роль в лечении гнёздной алопеции, их применяют для лучшего проникновения лекарственных препаратов к волосяному сосочку. С этой целью назначают электрофорез (лечение микротоками), лазерную терапию, узкополосную фототерапию (лечение узкополосным светом).
Необходимо отметить, что ни одно лечение не является эффективным во всех случаях, и иногда ответа на лечение вообще может не быть. С чем это связано неизвестно.
Прогноз. Профилактика
В большинстве случаев, когда болезнь начинается с небольшого количества участков выпадения волос, волосы отрастают через несколько месяцев, иногда в течение года [8] . Если поражения более обширные, волосы либо отрастают в ответ на лечение, либо продолжают выпадать, вплоть до тотальной или, в редких случаях, универсальной алопеции [8] .
Особенность патологии в том, что спустя какое-то время после успешного лечения, волосы снова могут выпадать. У 85 % больных отмечается более одного эпизода заболевания, периоды ремиссии различны. Эпизоды очаговой алопеции до наступления полового созревания предрасполагают к хроническому течению заболевания [7] . Алопеция иногда становится причиной психологического стресса. Поскольку выпадение волос может привести к значительным изменениям во внешности, люди могут испытывать социальную фобию, тревогу и депрессию. Пациенты с выпадением волос требуют немедленного назначения лечения.
Специфической профилактики алопеции не существует. Рекомендуется вести здоровый образ жизни, правильно питаться, своевременно лечить хронические заболевания. По показаниям следует принимать витаминно-минеральные комплексы. Важно подобрать качественные средства для ухода за волосами, также в качестве метода профилактики можно посоветовать отказаться от плетения тугих косичек.
Читайте также:

