Животные зараженные малярией для эксперимента
Обновлено: 24.04.2024
На слуху сейчас все больше вакцины молекулярного дизайна: мРНК, вирусные векторы. Но это только против бактерий и вирусов, а если вам угрожают эукариоты, выбирать пока не из чего — одобренных вакцин от таких болезней до сих пор нет. Принцип, на котором строится новая многообещающая вакцина от малярии, придумали и проверили на мышах еще в 1967 году. Ждать, пока она заработает, пришлось больше 50 лет. А для того, чтобы она вышла в люди, понадобится еще какое-то время, бочки донорской крови, роботизированная гильотина и, конечно, немного генетического редактирования.
Поэтому, когда в 1940-х годах, после вакцин от туберкулеза, столбняка и дифтерии, дело дошло до малярии, было ясно, что с проверкой новой вакцины проблем не возникнет. Заражать людей мы умеем, лечить — тоже, возбудитель давно известен. Оставалось лишь подобрать удобный способ его обезвредить.
Союз с комаром
Тот, кого мы называем малярийным плазмодием — это не вирус, не бактерия, а группа близких видов одноклеточных эукариот. И все они крайне привередливы. Пять видов плазмодиев, которые вызывают малярию у людей, отказываются размножаться даже во многих приматах, не говоря уже о других отрядах млекопитающих. Поэтому найти модельный организм для разработки вакцины от малярии сразу не получилось. Пара десятков лет ушли на то, чтобы найти и выделить плазмодия, который инфицирует мышей (но не человека), и отработать протокол заражения мышей малярией в лаборатории.
В 1967 году, наконец, состоялись первые испытания вакцины от мышиной малярии. Американские ученые взяли зараженных комаров, вырезали у них слюнные железы вместе с плазмодиями и подставили под рентгеновские лучи. Облученные паразиты сохранили способность заражать клетки, но уже не могли в них размножаться. Больше половины мышей, которые получили дозу ослабленных радиацией плазмодиев, приобрели устойчивость к малярии. С тех пор мы знаем, что вакцина от малярии все-таки возможна.
Напрямую воспроизводить эту технологию на людях опасно — никто не гарантировал, что может начисто отделить плазмодиев от остатков слюнной железы комара. А если частички комариных тканей окажутся в кровотоке человека — это чревато как минимум аллергией, а то и закупоркой сосудов, или даже заражением крови.

В каких частях комара Anopheles stephensi живут разные стадии малярийного плазмодия. Желтым обозначены слюнные железы
Alison T. Isaacs et al. / Proceedings of National Academy of Science, 2012
С вирусами и бактериями, вакцины от которых уже давно поставили на поток, таких проблем не возникало. Первые можно вырастить в клеточной культуре, вторые — на питательной среде. Но малярийный плазмодий, как истый эукариот, прихотлив и своенравен. Он не растет в культурах — он живет только в комаре. Причем только в его слюнной железе (та стадия, которая заражает людей). Полвека спустя мы знаем, что подобная привередливость свойственна всем одноклеточным эукариотическим паразитам, будь то лямблия, бабезия или токсоплазма. Разбираться со всеми их особенностями и умениями сложно, долго, неудобно. Поэтому и вакцин от вызываемых ими болезней нет.
Но зачем, казалось бы, выделять плазмодиев из комара, если комар и без посторонней помощи отлично умеет доставлять паразитов внутрь человека? Почему бы не облучить комара целиком, вместе с плазмодиями в его слюнной железе? В 1970-м году выяснилось, что такой метод облучения тоже работает — а в 1973-м удалось с его помощью вызвать иммунитет к малярии у одного добровольца (на этот раз настоящего, давшего согласие на процедуру).
Этот результат, однако, решительно невозможно масштабировать. Одно дело — держать несколько клеток с комарами при больнице, а другое — возить за собой по городам и весям фургоны, забитые клетками с тысячами облученных насекомых. В эксперименте 1973 года добровольцу потребовалось выдержать 379 укусов, чтобы обрести иммунитет к малярии. Сложно представить, сколько пришлось бы запасти комаров, чтобы их аппетита хватило на все население Африки.
Трехглавый враг
Можно было бы, конечно, попробовать подкрасться к плазмодию с другой стороны — и атаковать его на другой стадии жизненного цикла. Их у него несколько. Тот плазмодий, что попадает в кровь человека с укусом комара, выглядит как длинное тонкое каноэ с ядром посередине и зовется спорозоитом. Он прячется в клетки печени, размножается там и выходит наружу тысячами мелких шарообразных или грушевидных клеток — мерозоитов. Мерозоиты проникают в эритроциты, размножаются там и снова выходят наружу, разрушая их (с этого момента у человека, собственно, начинаются приступы малярийной лихорадки). Какая-то часть плазмодиев после этого продолжает заражать новые эритроциты, а некоторые приобретают форму банана. Это гаметоциты, их задача — вернуться в тело комара для полового размножения.

Цикл жизни малярийного плазмодия и варианты атаки на него при помощи вакцин
Patrick E. Duffy et al. / npj Vaccines, 2020
Вакцина, которая сработала на мышах и укушенном 379 раз пациенте, знакомила иммунитет со спорозоитами — чтобы не дать плазмодию пробраться в печень. Но цена промаха у такой вакцины высока. Плазмодий проводит в форме спорозоита совсем немного времени, и если хотя бы несколько из них ускользнут от иммунного надзора и доберутся до печени, то выйдут оттуда уже мерозоитами — невидимыми для иммунитета (потому что прививка учила его охотиться на предыдущую форму плазмодия) и разрушительными для эритроцитов.
Наконец, можно догнать плазмодия на последней стадии — когда он уже приготовился мигрировать обратно в тело комара. Такая вакцина не будет ни защищать людей от инфекции, ни облегчать течение болезни, — лишь затормозит распространение малярии. И если окажется достаточно эффективной, то может и вовсе избавить человечество от этой болезни. Но такую вакцину будет невероятно сложно испытать. Даже если бы удалось вакцинировать больных малярией в какой-нибудь деревне — непонятно, что делать дальше: отлавливать всех комаров в округе и проверять их на наличие плазмодия? Или считать число новых зараженных малярией? С учетом того, что отдельные популяции комаров то растут, то сокращаются, то мигрируют, эти данные получились бы сильно искаженными.
Поэтому в поисках малярийной вакцины ученые снова и снова возвращались к тому, что попроще: вакцинам на спорозоитах. Оставалось только научиться их добывать.
Разделяй и синтезируй
С тех пор так поступили с гепатитом В, папилломавирусом и гриппом — но не смогли поступить с малярией. Возможно, дело в том, что одиночные белки плазмодия не способны сами по себе вызвать достаточно сильный иммунный ответ. Кроме того, плазмодий оказался не только капризен, но и изменчив. Сотни миллионов людей, которые болеют им ежегодно — это огромный полигон для эволюции. Каждый из пяти видов плазмодия, опасный для человека, делится на сотни линий — и все они продолжают меняться, приобретая устойчивость к лекарствам, инсектицидам и вакцинам.
Поэтому даже те идеи, что казались эффективными в лаборатории, одна за другой проваливались. Только одна дошла до широкого применения среди африканских детей, хотя предотвращает лишь треть случаев тяжелой малярии: ВОЗ рассудила, что лучше такая защита, чем никакой. Найти универсальный антиген, который создавал бы у иммунитета образ всех плазмодиев на свете, никому за полвека так и не удалось.
Возвращение на ферму
И вот в начале 2000-х годов, разочаровавшись в синтетических методах, группа американских исследователей основала компанию Sanaria, чтобы разобраться с малярией старым, сложным — но понятным путем.
Время для этого было, впрочем, куда более благоприятное, чем в 1970-х. Но и с современной технологической базой малярийному стартапу потребовался десяток лет на то, чтобы научиться полностью очищать спорозоитов от тканей комара и замораживать их в жидком азоте для транспортировки. Компания сделала ставку на тяжелый ручной труд — и только к 2010-м годам отчиталась о том, что поставила производство плазмодиев на поток.
В хорошей вакцине, по их расчетам, должно быть от полутора до трех с половиной миллионов ослабленных спорозоитов. Если бы их доставляли в организм комары, потребовалось бы около десятка тысяч укусов. Но если выделять спорозоитов из слюнных желез напрямую, то одного насекомого оказывается достаточно, чтобы набрать нужную дозу. Сейчас команда из шести сотрудников компании за час успевает обработать около 500 комаров — то есть получает по меньшей мере 500 доз вакцины.

Сотрудники Sanaria на рабочем месте, обезглавливают комаров и извлекают спорозоитов
Малярия у животных — заболевания позвоночных, вызываемые разными видами паразитических простейших рода Plasmodium, насчитывающего свыше 60 видов.
Возбудителей малярии у птиц и млекопитающих переносят разные виды комаров, относящихся к родам Aedes, Culex, Mansonia, Anopheles и др. Переносчики возбудителей малярии у амфибий и рептилий не известны.
Возбудители малярии у птиц открыты и описаны В. Я. Данилевским в Харькове в 1885—1896 гг.
Позже они изучались многими учеными у нас и за рубежом. В 1898 г. Кох (В. Koch) обнаружил возбудителей малярии у обезьян.
Винкке и Лине (J. Н. Vincke, M. Lips, 1948) установили возбудителя малярии (P. berghei) у мышевидного грызуна Thamnomys surdaster; Брумпт (Е. Brumpt, 1935) выделил у кур на Цейлоне P. gallinaceum.
Интенсивное изучение возбудителей малярии у животных, особенно у птиц, а в последние 15 лет у грызунов и обезьян, связано с тем, что птицы, зараженные возбудителями птичьей малярии, особенно P. gallinaceum, P. lophurae, P. relictum и др., оказались весьма удобными моделями для отыскания эффективных химиотерапевтических препаратов, а также для изучения цикла развития возбудителей малярии, в частности экзоэритроцитарного цикла, вопросов обмена и физиологии этих паразитов, иммунитета при малярии и т. д.
В последние годы подобные исследования проводятся на лабораторных грызунах, зараженных P. berghei, обезьянах, инфицированных P. cynomolgi, P. knowlesi и др.; особенно детально изучено несколько видов возбудителей малярии у птиц.
Возбудители малярии птиц отличаются по циклу развития (экзоэритроцитарная и эритроцитарная стадии, рис. 8 и 9) от возбудителей малярии человека и млекопитающих животных. Спорозоиты возбудителей малярии птиц, попав в организм восприимчивого к данному виду возбудителя животного, проникают в клетки ретикулоэндотелиальной системы на месте укуса в коже и внутренних органах. В них происходит развитие первой, второй и последующих генераций экзоэритроцитарного цикла развития. Образовавшиеся после второй или третьей генерации мерозоиты проникают в эритроциты и в них происходит эритроцитарный цикл развития с образованием гаметоцитов.

Рис. 8. Схема цикла развития Plasmodium gallinaceum: 1 — спорозоит; 2—4 — образование первой генерации мерозоитов (криптозоитной); 5—8 — образование второй генерации мерозоитов; 9—11 — образование микромерозоитов (метакриптозоитная генерация); 12 — 15 — бесполый цикл развития в эритроцитах; 16 и 17 — гаметоциты.

Рис. 9. Малярийные плазмодии животных: 1—5 — Plasmodium minasense — паразит ящериц (1 — 4 — шизонты, 5 — гаметоцит); 6 — 10 — Plasmodium circumflexum — паразит птиц (6—8 — шизонты, 9—10 — гаметоциты); 11—15 — Plasmodium vaughani — паразит птиц (11 — 13 — шизонты, 14—15 — гаметоциты); 16—20 — Plasmodium cynomolgi — паразит обезьян (16—18 — шизонты, 19 — 20 — гаметоциты); 21—26 — цикл развития Plasmodium gallinaceum в коже кур (21 — спорозоиты, 22—26 — развитие паразита в клетках кожи от шизонта до мерозоита первой генерации).
У млекопитающих спорозоиты возбудителей малярии проникают в клетки печени, где и происходит экзоэритроцитарный цикл развития.
Возбудителей малярии птиц переносят комары родов Aedes, Culex, Mansonia и др.
Переносчиками возбудителей малярии у млекопитающих являются разные виды комаров рода Anopheles.
Возбудители малярии животных строго специфичны по отношению к своим хозяевам.
К некоторым видам возбудителей малярии животных восприимчив и человек. Так, паразиты обезьян — P. cynomolgi, P. knowlesi, P. brasilianum, P. rodhaini, P. inui — могут заражать человека.
В некоторых районах Юго-Восточной Азии, Африки и Южной Америки люди, живущие в лесах, где обитают обезьяны, могут заражаться возбудителями малярии обезьян.

После окончания пилотного эксперимента исследователи натренировали определять малярию по запаху еще одну собаку — спрингер спаниеля Фрейю.
Durham University/Medical Detection Dogs/London School of Hygiene & Tropical Medicine
Собаки могут диагностировать малярию у детей с точностью 70 процентов, понюхав носки больного. Британские медики представили результаты исследования на 67-й ежегодной конференции Американского общества тропической медицины и гигиены, которая проходит в Новом Орлеане.
Сейчас малярию чаще всего диагностируют микроскопически, определяя присутствие плазмодиев в мазках крови. Однако далеко не везде есть оборудование для диагностики, кроме того, оптимальная чувствительность метода 75-90 процентов, но иногда она не превышает 50 процентов. Недавно швейцарские исследователи предложили новый метод диагностики по химическому составу летучих веществ с кожи больных. Но пока он находится на стадии разработки.
Британские медики под руководством Стива Линдси (Steve Lindsay) из Даремского университета решили проверить, можно ли натренировать собак различать больных и здоровых людей по запаху. В пилотном эксперименте участвовали школьники из Гамбии в возрасте от 5 до 14 лет. У них диагностировали наличие или отсутствие малярии, а у зараженных детей проверили наличие или отсутствие симптомов болезни. Затем 145 здоровых и 30 зараженных детей, у которых заболевание протекало бессимптомно, попросили надеть на ночь носки. Утром их собрали и позднее использовали для тестирования собак-нюхачей — двух животных из британского центра Medical Detection Dogs — ретривера и золотистого ретривера. Животных тренировали нюхать образцы тканей с летучими веществами, собранными у больных и здоровых людей. Их приучили останавливаться, после того, как они почуют запах зараженного человека, и проходить мимо здорового человека.
Эксперимент показал, что собаки правильно определяли запахи больных детей в 70 процентах случаев, и запах здоровых — в 90 процентах случаев. По словам Стивена Линдси, собаки определяли запах больных с еще большей точностью — 78 процентов, если дети были заражены одним и тем же видом плазмодия.
До недавнего времени шли дискуссии о том, является ли тропическая малярия эндемичной (местной) болезнью для Южной Америки или она завезена из Африки вместе с черными рабами. Как вы думаете, какие данные можно использовать, чтобы решить этот спор?
Подсказка 1
Сейчас этот спор считается решенным. Подумайте, какие данные (полученные с помощью новых методов) появились за последние 20 лет и позволили поставить в этом споре точку.
Подсказка 2
Род Plasmodium (возбудители малярии) включает около 200 видов, из которых пять паразитируют на человеке, а остальные — на других видах позвоночных. Тропическая малярия, о которой идет речь в задаче, вызывается одним из видом плазмодиев. Человеческую малярию переносят многие виды комаров рода Anopheles. Подумайте, как можно использовать эти сведения, чтобы найти подход к решению нашей задачи.
Решение
В наши дни тропическая малярия (возбудитель которой — Plasmodium falciparum) во многих районах Южной Америки, несомненно, является эндемичным (или эндемическим) заболеванием, то есть сохраняется в местных популяциях без притока больных извне. Надеюсь, из условия было понятно, что речь идет о времени проникновения малярии в Южную Америку: произошло ли оно после открытия Нового Света европейцами и начала работорговли или до этих событий?
Все считают, что родина тропической малярии — Африка. В пользу этого говорит множество фактов.

2. Генетическое разнообразие человеческих линий P. falciparum (как и генетическое разнообразие людей) наибольшее в Африке и постепенно падает по мере удаления от нее. Обычно самое большое генетическое разнообразие характерно для центра происхождения вида, где он существует наиболее длительное время (хотя на него, конечно, могут влиять и другие факторы).
3. Многие вредные мутации, защищающие гетерозиготных носителей от тропической малярии, достигают высокой частот в Африке и/или ближайших к ней районах Азии. Это означает, что и здесь эта болезнь длительное время действовала как важный фактор отбора.
Многим археологам и историкам почему-то хотелось найти малярию в доколумбовой Америке (видимо, как свидетельство доколумбовых контактов со Старым светом). Но свидетельств о ее наличии на самом деле было очень мало. В некоторых работах, правда, сообщалось о наличии возбудителей малярии (не тропической) в мумиях доколумбовой эпохи возрастом 1700 лет. Их выявляли с помощью антител. Работ, подтверждающих это с помощью современных молекулярных методов, мне найти не удалось (может быть, одна из причин — труднее стало изучать мумии из-за политкорректности).
Возможно, главный аргумент против раннего проникновения малярии в Америку, который можно было предъявить до недавнего времени, — это практически полное отсутствие среди местных (индейских) этнических групп генетических вариантов, повышающих устойчивость к малярии. Но сейчас точку в споре поставила генетика самих плазмодиев. В недавнем обширном исследовании были изучены популяции P. falciparum из разных районов Африки, откуда везли рабов, и из разных районов Южной Америки — тех, куда их везли (см. E. Yalcindag et al., 2012. Multiple independent introductions of Plasmodium falciparum in South America). Удалось установить, что почти наверняка все американские популяции недавно отделились от африканских. Интересный новый результат — что было два заноса. Одна линия плазмодиев проникла из Африки в бывшую испанскую империю (через Вест-Индию и территорию современной Мексики и Колумбии), а другая — в бывшую португальскую империю, на территорию современной Бразилии. Никаких следов древних изолированных популяций плазмодиев найти не удалось. Итак, все-таки рабы.
Послесловие
Вторая крайность — предположение, что все паразиты (включая вирусы и бактерии) эволюционировали совместно с их хозяевами. Согласно этой концепции, расхождение между видами плазмодиев, например, бонобо и шимпанзе должно было произойти около 2–3 млн лет назад (в период обособления этих близких видов), а плазмодиев человека и шимпанзе — 5–6 млн лет назад.
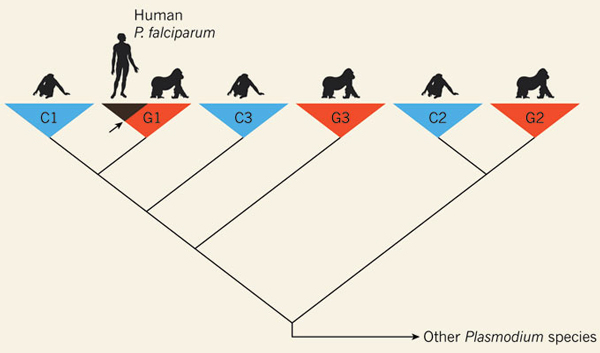
Тропическую малярию люди тоже получили не от домашних животных, а от своих ближайших родичей — но не путем дивергенции предкового паразита, а путем однократной смены хозяина. Происхождение и история распространения человеческих болезней — бурно развивающаяся область. По мере усовершенствования молекулярных методов в этой области быстро накапливаются факты и столь же быстро сменяются теории. Около 2010 года, с интервалом буквально в несколько месяцев, последовательно вышли статьи, в которых обосновывалась передача P. falciparum человеку от шимпанзе, бонобо и горилл. Последняя точка зрения восторжествовала, так как была обоснована лучше всего — в частности, количеством изученного материала (см. рис. 2).

Жители Тропической Африки с мутацией в гене белка-транспортера железа ферропортина реже болеют малярией и болезнь у них протекает не так тяжело, рассказывается в статье в Science. Ферропортин убирает ионы железа из эритроцитов и, таким образом, уменьшает в них количество гемоглобина, которым питаются возбудители заболевания. А замена глутамина на гистидин в 248 положении белковой цепи (Q248H) препятствует деградации белка и уменьшает вредоносный эффект малярии.
На одной из стадий своего жизненного цикла одноклеточные паразиты малярийные плазмодии (Plasmodium) попадают в кровь, а затем в эритроциты. Там они размножаются и, разрушая клетку, снова проникают в кровеносное русло в поисках незараженных эритроцитов. Пока плазмодии находятся внутри эритроцита, они питаются гемоглобином, нарушая гомеостаз железа. При этом паразиты не могут добраться до иона железа, который связан с белком; по-видимому, они потребляют только свободные ионы, появившиеся при автоокислении гемоглобина. Более того, известно, что если давать заболевшим малярией препараты железа, болезнь усугубляется. Однако до сих пор неясно, как происходит регуляция железа в эритроцитах, так как большинство белков-регуляторов железа в этих клетках отсутствует.
Чтобы это выяснить, исследователи из Национального института здоровья (США) под руководством Трейси Руо (Tracey Rouault) решили исследовать белок-транспортер железа ферропортин. Он переносит ионы железа из эпителиальных клеток кишечника, клеток печени и селезенки в кровь. В одном из своих предыдущих исследований авторы статьи обнаружили, что ферропортин экспрессируется в клетках-предшественниках эритроцитов, и предположили, что он содержится и в зрелых эритроцитах, переносит ионы железа из клеток в плазму, и таким образом предохраняет клетки от избытка токсичного железа (которое инициирует выработку свободных радикалов) и от малярии.
Исследователи проверили экспрессию ферропортина в человеческих и мышиных эритроцитах и убедились, что она действительно есть. После этого ученые сконструировали генномодифицированных мышей, не способных вырабатывать ферропортин в клетках-предшественниках эритроцитов (эритробластах). Соответственно, в зрелых эритроцитах этих животных белок-транспортер практически отсутствовал. Зато в них стало накапливаться избыточное количество железа, что в конечном итоге приводило к гемолизу (разрушению эритроцитов). Затем исследователи заразили генномодифицированных и обычных мышей малярийными плазмодиями Plasmodium yoelii YM, которые вызывают у мышей летальную инфекцию, и убедились, что у животных, неспособных вырабатывать в эритроцитах ферропортин, было на 60 процентов больше паразитов, чем у обычных мышей. К тому же все они погибли через шесть дней после заражения, а обычные животные дольше по ввремени не заболевали, и 20 процентов из них выжили.
Кроме того, исследователям удалось понять, почему избыток железа не ослабляет болезнь, а наоборот ее усиливает. У мышей, которых кормили пищей с высоким содержанием железа, в эритроцитах уменьшалось количество ферропортина, но увеличивалась концентрация его ингибитора — белкового гормона гепсидина. Он уменьшает экспрессию ферропортина в эритробластах, а в зрелых клетках белки связываются, и гепсидин блокирует транспорт железа.
В заключение авторы работы проверили еще одну свою гипотезу. Так как люди и малярийные плазмодии тысячелетиями сосуществуют друг с другом, наверняка в человеческом геноме образовались мутации, которые способствуют увеличению экспрессии ферропортина, и препятствуют развитию малярии. Одна такая мутация в гене ферропортина, замена глутамина на гистидин в 248 положении белковой цепи (Q248H), встречается у жителей Тропической Африки с частотой от двух до 20 процентов, в зависимости от региона. Мутация предотвращает распад ферропортина в эритробластах, который запускается гепсидином. У носителей мутантного варианта белка концентрация гемоглобина в эритроцитах ниже, чем у людей с обычной версией ферропортина. Это согласуется с предположением исследователей, что белок-транспортер удаляет ионы железа из эритроцитов и тем самым снижает синтез гемоглобина. Исследователи проанализировали 66 малярийных больных из Замбии, 20 процентов которых оказались носителями мутантного гена ферропортина, и выяснили, что количество паразитов у них в крови в пять раз ниже, чем у зараженных с обычной версией белка. Кроме того, они дольше не обращались за медицинской помощью и болезнь у них протекала не так тяжело, как у людей с нормальным ферропортином.
Ранее британские исследователи разработали метод, позволяющий блокировать малярийных плазмодиев в эритроцитах, тем самым нарушая их цикл размножения.
Читайте также:

