Золотистый стафилококк прогресс или регресс
Обновлено: 24.04.2024
Материалы предназначены исключительно для врачей и специалистов с высшим медицинским образованием. Статьи носят информационно-образовательный характер. Самолечение и самодиагностика крайне опасны для здоровья. Автор статей не дает медицинских консультаций: клинический фармаколог — это врач только и исключительно для врачей.
Автор: Трубачева Е.С., врач – клинический фармаколог
Темой сегодняшнего разговора будет группа зеленящих стрептококков – наименование не очень легитимное, но прочно вошедшее в практику, как и обзывательство антибактериальной терапии – антибиотикотерапией, а кто мы такие, чтобы отменять традиции.
Рассмотрим основных представителей семейства, на которых больше всего шансов наткнуться в антибиотикограммах.
- Streptococcussanguis – воистину могуч и вездесущ. Обнаруживается в зубных отложениях с самого прорезывания зубов и до конца жизни, где и есть основное место его обитания. Иногда может быть обнаружен на слизистой глотки и в фекалиях, куда попадают транзитом. При этом надо помнить, что этот микроб вносит существенный вклад в процессы, связанные с кариесом, занимая в последующем ведущее место в ассоциациях микроорганизмов, выделяемых из гнойного экссудата при воспалительных процессах в челюстно-лицевой области, включая одонтогенные абсцессы мозга и других органов. Кроме того, они же могут быть выделены их крови и сердечных клапанов больных инфекционным эндокардитом.
- Streptococcussalivarius – также является одним из основных компонентов нормальной микрофлоры полости рта, а также, но в меньшем количестве, может быть выделен со слизистых дыхательного, желудочно-кишечного и урогенитального тракта. Особенно часто выделяются при анализе микрофлоры языка, слюны и фекалий. И крайне редко из крови при менингитах, септицимии и эндокардитах.
- Streptococcusmutans – выделяется с поверхности зубов и фекалий. Этот микроб является кариесогенным, а значит, может в дальнейшем вызывать бактериемию и бактериальный эндокардит у пациентов, не занимающихся регулярной санацией кариозных очагов в полости рта.
- Streptococcusmitis – в норме выделяется из слюны, мокроты фекалий, при этом может выделяться из верхних дыхательных путей и крови при нозокомиальном инфицировании.
- Совсем неверно упоминать в этом блоке стрептококки группы Anginosus -Streptococcusintermedius/S.anginosus/S.constellatus, но так как мы обсуждаем в основном орофарингеальную флору, способную вызвать инфекционные эндокардиты (и чтобы не писать еще один, совсем малюсенький блок), мы упомянем их здесь. В норме они являются представителями пародонтогенной группы. Но стоит представителю группы S.intermedius оттуда выбраться, как он может вызывать абсцессы печени, мозга и эндокардиты, так как проявляет высокую тропность к их тканям.
Диагностические аспекты
Освоив вышеприведенный материал, мы видим, что только обнаружение данных микроорганизмов в стерильных средах может указывать на них как на потенциальных возбудителей. Почему все-таки потенциальных? Да потому, что в 80% случаев это может оказаться банальной контаминацией в связи с несоблюдением техники забора материала (все мы дышим, и если материал забирается с нарушением правил асептики и антисептики и без использования закрытых систем, то налететь в пробирку может много чего и не только из наших рта и носов). Таким образом, посевы нужно повторять.
Обнаружение этого же зоопарка в местах естественного его обитания не говорит нам практически ничего, если только пациент совсем не следит за полостью рта, и тогда ему можно настоятельно рекомендовать посещение стоматолога.
Аспекты антибактериальной терапии
Группа зеленящих стрептококков природно резистентна к тетрациклинам, макролидам и клиндомицину (до 50% штаммов), к биссептолу резистентно более 75%. Таким образом об этих группах мы даже не вспоминаем.
Само лечение должно быть комплексным и часто в сочетании с хирургическим. Выбор конкретных препаратов будет зависеть от локализации процесса, тяжести состояния пациента и выделенного возбудителя
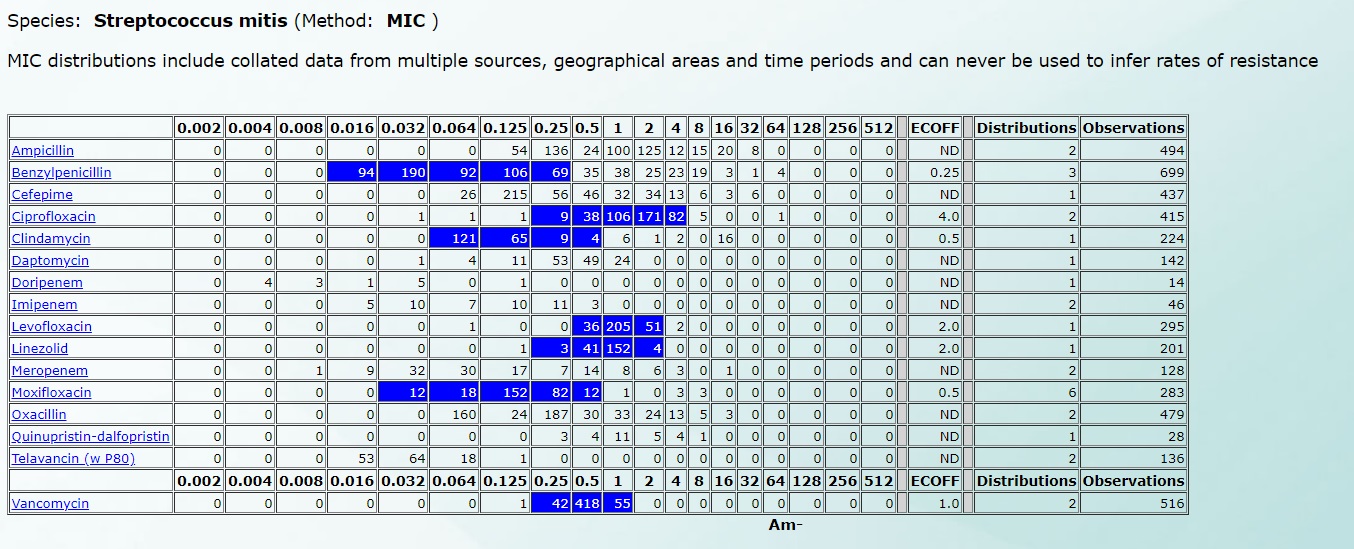
Например, чувствительность Streptococcus mitis будет выглядеть так (нажмите на картинку для увеличения):
А чувствительность к Streptococcus mutans – вот так (нажмите на картинку для увеличения):
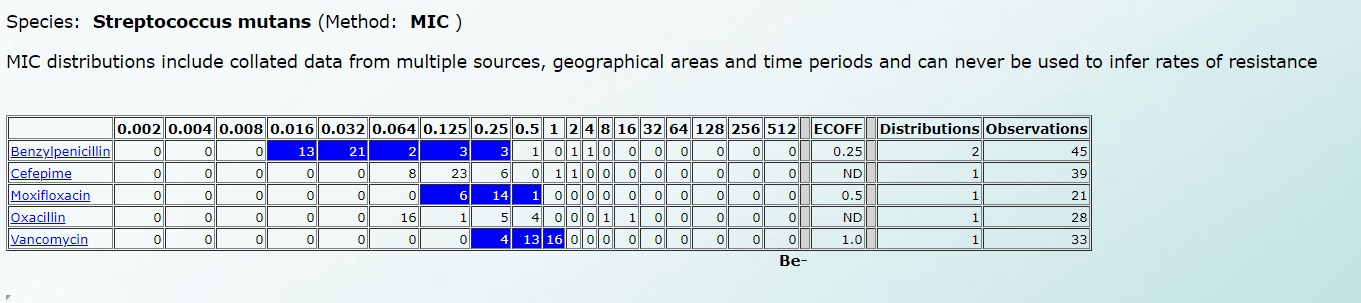
Подробнее все рассмотреть можно по этой ссылке, ведь именно на этой базе данных работают автоматические и полуавтоматические анализаторы в микробиологических лабораториях.
Препаратами выбора будут являться:
- Пенициллин в высоких дозировках (до 24 млн ЕД в сутки), возможно, в сочетании с аминогликозидами
- Цефтриаксон
- Ванкомицин
Как и в случае с любым стрептококком, крайне важно соблюдать длительность лечения, и она должна быть не менее 10-14 дней. Исключение составляет бактериальный эндокардит, там сроки лечения как минимум удваиваются.
В заключение хотелось бы сказать, что как ни прискорбно это сознавать, но недоступность, в первую очередь финансовая, адекватной стоматологической помощи вновь привела к всплеску заболеваний связанных с неблагополучием в полости рта, таким образом, мы вновь вынуждены вспоминать, что инфекционный эндокардит – это не только болезнь наркоманов и лиц со сниженным иммунным статусом, но и тех, у кого недостаточно средств на хорошего стоматолога, а потому и нам не лишне иногда осматривать полость рта у пациентов с инфекциями кровотока или абсцессами в головном мозге или печени.

Обзор
Автор
Редакторы

Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.

Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.
Немного о VR
В видео есть часть, где представлена VR-работа. Чтобы лучше понять, что где находится — прочитайте, пожалуйста, описание ниже:
- Для удобства рассмотрения внутренних процессов, происходящих в бактериальной клетке, клеточная стенка и цитоплазматическая мембрана сделаны прозрачными.
- В цикле репродукции вируса рассматривается один вид бактериофага. Это стафилококковый бактериофаг 80α (альфа).
- Процессы репликации, трансляции и транскрипции упрощены, и для лучшего ви́дения этих процессов они немного разнесены в пространстве.
Золотистый стафилококк
Стафилококки — грамположительные и не спорообразующие кокки, которые образуют пары, короткие цепочки или гроздья. Род Staphylococcus содержит много видов, которые отделяются друг от друга на основе продукции фермента коагулазы [1].
Золотистый стафилококк (Staphylococcus aureus) — коагулазоположительный вид, является одним из самых вирулентных видов.
Золотистый стафилококк — часто безвредный обитатель эпителия кожи и слизистых оболочек человека, но также связан с серьезными системными и местными инфекциями [2] и является одной из наиболее распространенных причин пищевых инфекций во всем мире. S. aureus производит 15 энтеротоксинов.
Энтеротоксины бактериальные токсины, которые вызывают секрецию жидкости из клеток кишечника.
Борьба с золотистым стафилококком
Борьба с бактериями велась издавна. Люди пробовали лечить раны растениями. И методом проб и ошибок подбирали нужные противомикробные лекарства [3].
Уже в 1940 году появились первые сведения об устойчивости бактерий к пенициллину.
Бактериофаг
В 1919 году, еще до обнаружения пенициллина, Феликс Д’Эрелль открыл совершенно другой метод борьбы с бактериями. Но потом он так и не смог конкурировать с антибиотиками. Речь идет о бактериофаговой терапии.
Бактериофаги (фаги) — это вирусы, которые используют для размножения только прокариотические клетки. Эти вирусы встречаются в природе повсеместно [6]. S. aureus был одним из первых организмов, использованных для демонстрации существования бактериофага [2].
В 1920–1940-е годы проводили множество исследований по клиническому применению бактериофагов, но стабильных результатов получено не было. На Западе от бактериофаговой терапии начали отказываться [7].
Борьба золотистого стафилококка и бактериофага
Сейчас фаговые препараты представляют собой смеси нескольких бактериофагов. Мы остановимся на одном из стафилококковых фагов.
Фаг 80α — умеренный бактериофаг лямбда семейства Siphoviridae с геномом в виде двухцепочечной ДНК. 80α способен к генерализованной трансдукции, а также может выступать в качестве помощника для мобилизации островков патогенности SaPI [2], которые, как было показано, кодируют такие факторы вирулентности, как токсины синдрома токсического шока и коагулаза [1].
Как и у других бактериофагов, капсид 80α собирается в виде пустого предшественника — прокапсида. Горсти фаговой ДНК упаковываются в прокапсиды через портальную вершину в АТФ-зависимом процессе, который требует малых и больших субъединиц фермента терминазы. Упаковка ДНК сопровождается расширением капсида и структурной перестройкой оболочки.
Для бактериофаговой терапии рекомендуется использовать те бактериофаги, которые идут по литическому пути развития (с разрывом клетки).
Бактериофаговые препараты
Сейчас с развитием современных методов генной инженерии и молекулярной биологии бактериофаговая терапия оживает в новых исследованиях. И на данный момент бактериофаговая терапия применяется очень осторожно и строго контролируемо, во избежание повторения истории с антибиотиками.
Однако не везде соблюдаются такие строгие стандарты. В Западной Европе после открытия антибиотиков от использования бактериофагов довольно быстро отказались. В Восточной Европе, несмотря на отсутствие крупных и контролируемых клинических испытаний, они оставались относительно популярным лечением в XX веке [8].
Приглашение от авторов проекта
Мы хотим, чтобы у всех была возможность окунуться в микромир. Поэтому приглашаем жителей Санкт-Петербурга лично посетить виртуальную реальность. Чтобы сделать это, напишите Надежде в Instagram (irreal.art) или Ярославе в VK.

Новость
Структурная формула нового пептидного антибиотика.
Автор
Редакторы
- Антибиотики
- Биомолекулы
- Биотехнологии
- Здравоохранение
- Микробиология
- Фармакология
Немецкие ученые обнаружили новое оружие для борьбы с больничным монстром — мультирезистентным золотистым стафилококком. Долгие годы оно скрывалось не в вечной мерзлоте или Марианской впадине, а прямо под нашим носом. Вернее — в нём.
В последние годы во всем мире увеличилось количество инфекционных заболеваний, вызванных устойчивыми к антибиотикам бактериями. Организмы с множественной лекарственной резистентностью (multidrug-resistant organisms, MDRO), такие как метициллин-резистентный золотистый стафилококк, нечувствительные к ванкомицину энтерококки или резистентные к цефалоспоринам третьего поколения грамотрицательные бактерии, в ближайшие десятилетия могут стать более частыми причинами смерти, чем рак [1].
Несколько лет назад удалось обнаружить, что представители человеческой микробиоты способны производить бактериоцины, поражающие близкородственных бактерий [2]. Например, в 2014 году из человеческого комменсала Lactobacillus gasseri выделили и описали новый синтезируемый рибосомами тиопептидный антибиотик — лактоциллин [3].
Семейные разборки
Немецкий исследователь Александр Ципперер со своими сотрудниками в июле 2016 года сообщил о том, что обнаружил в человеческом носу бактерию Staphylococcus lugdunensis IVK28, которая подавляет рост метициллин-резистентного золотистого стафилококка (methicillin-resistant Staphylococcus aureus, MRSA) [1].
Золотистый стафилококк
Стафилококки относятся к типичным бактериям-комменсалам, колонизирующим кожу и поверхности слизистых оболочек. Staphylococcus aureus — шаровидные грамположительные бактерии, вырабатывающие каротиноидный пигмент, который придает их клеткам золотистый цвет (рис. 1). Эти микроорганизмы чрезвычайно устойчивы к внешним воздействиям и выживают в воздухе, пыли, почве, продуктах питания, на оборудовании пищевых производств и предметах быта [6], [7].

Рисунок 1. Staphylococcus aureus и лейкоциты.

Рисунок 2. Метициллин-резистентные золотистые стафилококки.
Staphylococcus aureus — бактерия условно-патогенная, проявляющая свои патологические свойства только в благоприятных условиях, а создает их, как правило, ослабление иммунитета носителя. Активная жизнедеятельность стафилококка может привести к разнообразным заболеваниям [5], [7], [8]:
- кожи (прыщи, фурункулы, синдром ошпаренной кожи);
- органов дыхания (плеврит, пневмония);
- костной и соединительной тканей (артрит, остеомиелит);
- нервной системы и органов чувств (отит, менингит);
- сердечно-сосудистой системы (эндокардит, флебит, стафилококковая бактериемия).
Факторы патогенности S. aureus — это микрокапсула, компоненты клеточной стенки, ферменты агрессии и токсины. Микрокапсулы защищают клетки бактерий от фагоцитоза, способствуют их адгезии и распространению по организму хозяина. Составляющие клеточной стенки (например пептидогликан, тейхоевые кислоты и белок А) вызывают развитие воспаления, обездвиживают фагоциты и нейтрализуют иммуноглобулины. Коагулаза, главный фермент агрессии, вызывает свертывание плазмы крови [7], [9].
Наиболее опасны метициллин-резистентные стафилококки (methicillin-resistant S. aureus, MRSA) (рис. 2). Метициллин — это модифицированный пенициллин, с помощью которого еще недавно успешно боролись со стафилококковой инфекцией. MRSA устойчивы не только к метициллину, но и к другим антибиотикам пенициллиновой группы (диклоксациллину, оксациллину, нафциллину и др.), а также к цефалоспоринам. В последнее время выявлены штаммы и с более широким спектром устойчивости: ванкомицин-резистентные (VRSA) и гликопептид-резистентные (GISA) [6], [9], [10].
Штамм S. lugdunensis IVK28 эффективно боролся со своим вредоносным родственником лишь в условиях недостатка железа и только на твердых агаризованных средах (рис. 3, слева). Механизм противостояния был неясен, а потому Ципперер провел транспозонный мутагенез клеток выделенного штамма — чтобы выявить ген, ответственный за синтез смертельного для S. aureus вещества.

В итоге удалось получить мутанта IVK28, который не мог подавлять рост MRSA. Анализ места встройки транспозона показал, что тот нарушил структуру гена предполагаемой нерибосомной пептидсинтетазы (НРПС). Оказалось, что этот ген вместе с другими последовательностями, связанными с биосинтезом антибиотиков, входит в состав оперона размером 30 т.п.н. Это указывало на то, что предполагаемая молекула ингибитора может быть комплексом нерибосомных пептидов.
Оперон методом ПЦР обнаружили во всех культурах S. lugdunensis, а значит, он характерен для всего вида, а не только для штамма IVK28. Однако GC-состав оперона (26,9%) отличался от GC-состава остального генома S. lugdunensis (33,8%), что свидетельствовало о возможном заимствовании этого полезного генетического кластера у других видов бактерий — путем горизонтального переноса .
Оперон состоит из генов lugA, B, C и D, кодирующих пептидсинтетазные белки (см. врезку ниже), а также из других генов, чьи продукты необходимы для синтеза и транспорта нерибосомного пептида.
Чтобы окончательно вменить оперону участие в антибактериальной деятельности S. lugdunensis, наименьший ген (lugD) удалили. Мутант ΔlugD, как и ожидалось, не мог подавлять рост золотистого стафилококка, но когда в него ввели плазмиду с работающим геном lugD, агрессивный фенотип восстановился (рис. 3, в центре и справа).
Секретное оружие
Выделенный Ципперером продукт lug-оперона оказался нерибосомным циклическим пептидом, состоящим из пяти аминокислот (двух D-валинов, L-валина, D-лейцина и L-триптофана) и тиазолидинового гетероцикла (рис. 4). Назвали антибиотик лугдунином.

Химическим синтезом удалось получить продукт с идентичными природному лугдунину химическими свойствами и антибактериальным эффектом. Ученые предположили, что этот антибиотик ингибирует синтез бактериальных биополимеров — белков, ДНК и пептидогликанов [5].
Нерибосомные пептиды
Этот класс пептидов синтезируется в клетках низших грибов и бактерий без участия рибосом. Нерибосомные пептиды (НРП) также встречаются и у высших организмов, которые имеют бактерий-комменсалов [12].
НРП подразделяются на несколько функциональных групп [13]:
- антибиотики (ванкомицин);
- предшественники антибиотиков (ACV-трипептид — предшественник пенициллина и цефалоспорина);
- иммуносупрессоры (циклоспорин);
- противоопухолевые пептиды (блеомицин);
- сидерофоры (пиовердин);
- токсины (HC-токсин);
- сурфактанты (сурфактин).
Строение
Синтез
Каждый модуль состоит как минимум из трех доменов:
- конденсирующего (принимающего пептидную цепь из предыдущего модуля);
- аденилирующего (выбирающего нужную аминокислоту);
- пептидильного (образующего пептидную связь).
Нередко модули включают и другие домены, в том числе эпимеризующий, который преобразует L-аминокислоты в D-формы [14].
По аналогии с триплетным рибосомным кодом для синтеза белка существует и нерибосомный, код НРПС, определяемый 10 остатками аминокислот в субстрат-связывающем кармане аденилирующего домена. От комбинации этих остатков зависит то, какая аминокислота будет встроена в пептид конкретным модулем НРПС. Зная этот код, можно предсказывать субстратную специфичность аденилирующих доменов и даже произвольно изменять ее посредством замены аминокислот в домене [14].
В экспериментах немецких ученых лугдунин действовал не только на метициллин-резистентных стафилококков, но и на гликопротеин-резистентных, и даже на других грамположительных бактерий типа листерии и ванкомицин-резистентного энтерококка (табл. 1). Минимальная ингибирующая концентрация (МИК) нового бактериоцина — 1,5–12 мкг × мл −1 , что говорит о высокой активности вещества. При этом такие концентрации никак не влияли на человеческую сыворотку, не вызывали лизис нейтрофилов или эритроцитов и не ингибировали метаболическую активность моноцитов. Бактериальные же клетки под действием лугдунина в концентрации даже ниже МИК прекращали синтезировать ДНК, РНК, белки и компоненты клеточной стенки. В этом отношении лугдунин напоминает даптомицин, дающий такой же эффект, но способ действия которого пока не изучен. Не было отмечено возникновения резистентности клеток S. aureus к лугдунину даже после их месячного выращивания на малых концентрациях.
| Виды и штаммы | Резистентность | МИК лугдунина (мкг × мл −1 ) |
|---|---|---|
| Staphylococcus aureus USA300 (LAC) | MRSA | 1,5 |
| + 50% человеческой сыворотки крови | 1,5 | |
| Staphylococcus aureus USA300 (NRS384) | MRSA | 1,5 |
| Staphylococcus aureus Mu50 | GISA | 3 |
| Staphylococcus aureus SA113 | 3 | |
| Staphylococcus aureus RN4220 | 3 | |
| Enterococcus faecium BK463 | VRE | 3 |
| Enterococcus faecalis VRE366 | VRE | 12 |
| Listeria monocytogenes ATCC19118 | 6 | |
| Streptococcus pneumoniae ATCC49619 | 1,5 | |
| Bacillus subtilis 168 (trpC2) | 4 | |
| Pseudomonas aeruginosa PAO1 | >50 | |
| Escherichia coli DH5α | >50 | |
| Условные обозначения: MRSA — метициллин-резистентные S. aureus; GISA — устойчивые к гликопротеинам S. aureus; VRE — ванкомицин-резистентные Enterococcus. Таблица из [1]. | ||
Испытания в боевых условиях
Как и полагается, способность лугдунина лечить стафилококковые инфекции продемонстрировали in vivo на мышиной модели (рис. 5). У шести мышей сбрили шерсть на спине и, повредив кожу многократным приклеиванием/отклеиванием пластыря, нанесли на это место золотистого стафилококка. Затем кожу обработали мазью, содержащей 1,5 мкг лугдунина, и спустя шесть часов оценили результат. Обработка новым антибиотиком сильно сокращала или даже полностью уничтожала популяцию S. aureus. Причем не только на поверхности кожи, но и в более глубоких ее слоях.

Рисунок 5. Общая схема подхода к идентификации природного антибиотика. Из бактериальных популяций человеческого тела отбирают представителей, которые не могут сосуществовать с интересующими патогенными бактериями. Этих возможных конкурентов тестируют по отдельности на средах с инфекционным агентом. Из культуры, успешно подавляющей рост патогенов, выделяют антибиотик, действие которого проверяют на животных моделях.
[5], рисунок модифицирован и адаптирован
Чтобы понять, может ли S. lugdunensis помешать колонизации носовой полости позвоночных животных золотистым стафилококком в естественных условиях, ученые провели следующий эксперимент. В носы хлопковых хомяков ввели два вида смешанных культур (S. aureus + S. lugdunensis IVK28 и S. aureus + S. lugdunensis IVK28ΔlugD) и каждую по отдельности. В контрольных случаях, когда вводили по одному штамму, все три культуры стабильно колонизировали носовую полость. Однако при введении смеси S. aureus + S. lugdunensis IVK28 количество золотистого стафилококка через 5 дней значительно уменьшилось по сравнению со смесью S. aureus + S. lugdunensis IVK28ΔlugD. Этот эксперимент показал, что продукция лугдунина позволяет штамму IVK28 эффективно конкурировать с золотистым стафилококком in vivo.
Оставалось разобраться, предотвращает ли присутствие S. lugdunensis в носу человека колонизацию бактериями S. aureus. Ципперер и его коллеги исследовали мазки из носовых ходов 187 госпитализированных больных. Из них у 60 человек (32,1%) обнаружили золотистого стафилококка и у 17 человек (9,1%) — S. lugdunensis. И только у одного пациента с S. lugdunensis в носу обитал S. aureus. У всех выделенных штаммов S. lugdunensis ПЦР-анализ продемонстрировал наличие lug-оперона, а все обнаруженные штаммы S. aureus оказались восприимчивы к лугдунину.
Перспективы
Лугдунин оказался первым обнаруженным бактериоцином нового класса — макроциклических тиазолидиновых пептидных антибиотиков. Все проверенные штаммы S. aureus (как природные, так и лабораторные) не смогли выработать резистентности к нему. Это дает надежду на то, что лугдунин в будущем станет коммерческим препаратом для борьбы с золотистым стафилококком.
И наконец, сам факт обнаружения нового антибиотика у представителя человеческой микробиоты должен послужить стимулом для активизации поиска других продуцентов бактериоцинов в составе именно таких сообществ. В дальнейшем это поможет медикам успешнее сдерживать наступление мультирезистентных патогенов.
Прошло много лет после написания первой статьи, посвященной лечению инфекций, вызванных золотистым стафилококком. За это время автор, будем надеяться, немного помудрела и приобрела кое-какой опыт в более детальной диагностике вышеупомянутых состояний, чем и хотела бы поделиться с многоуважаемой аудиторией в надежде, что, возможно, поможет каждому из вас в рутинной ежедневной работе, так как с этой зверюшкой сталкивается буквально каждый, кто надел белый халат и уж тем более хирургический костюм.
Материалы предназначены исключительно для врачей и специалистов с высшим медицинским образованием. Статьи носят информационно-образовательный характер. Самолечение и самодиагностика крайне опасны для здоровья. Автор статей не дает медицинских консультаций: клинический фармаколог — это врач только и исключительно для врачей.
Автор: Трубачева Е.С., врач – клинический фармаколог
Прошло много лет после написания первой статьи, посвященной лечению инфекций, вызванных золотистым стафилококком. За это время автор, будем надеяться, немного помудрела и приобрела кое-какой опыт в более детальной диагностике вышеупомянутых состояний, чем и хотела бы поделиться с многоуважаемой аудиторией в надежде, что, возможно, поможет каждому из вас в рутинной ежедневной работе, так как с этой зверюшкой сталкивается буквально каждый, кто надел белый халат и уж тем более хирургический костюм.
Сначала повторим общеизвестные факты: S.aureus относится к грамположительным коккам и являются чуть ли не основной причиной большого количества инфекций кожи и мягких тканей, а так же ведущей причиной послеоперационных раневых инфекций.
Выделяют следующие разновидности золотистого стафилококка:
- Дикий S.aureus
- MSSA – метициллин-чувствительные стафилококки
- MRSA – метициллин-резистентные, которые обладают устойчивостью ко всему бета-лактамному ряду, сохраняя клинически важную чувствительность к ванкомицину, линезолиду и тигециклину
- VRSA и VISA – ванкомицин-устойчивые штаммы, к счастью, крайне редко встречающиеся и в основном наблюдающиеся в отделениях онкогематологии научно-исследовательских центров у пациентов, проходящих курс полихимиотерапии с последующей трансплантацией костного мозга
И сейчас обсудим первые три более подробно, так как именно они являются той причиной, ради которой повторно поднята данная тема, в том числе и по просьбам читателей (за что выражаем отдельную признательность).
Первое, что необходимо не просто запомнить, а буквально зазубрить наизусть – золотистый стафилококк, он же S.aureus, является нормальным жителем на неповрежденной коже и слизистых оболочках. Еще раз – нормальным, но только на неповрежденной коже и вне зависимости от антибиотикочувствительности пойманных экземпляров. Если кожа по тем или иным причинам поражается (например, сахарным диабетом) или повреждается, стафилококк тут же из милого соседа превращается в злейшего врага. Все как у людей – стоит дать слабину, и ближайшие соседи начнут добивать с ласковой улыбкой.
Таким образом, когда вы получаете результат микробиологического исследования образца, взятого с кожи (или из носоглотки), и видите там золотистого стафа, то должны понимать, кто перед вами, и насколько этот кто-то имеет отношение к текущему процессу.
Второе: если клиника отсутствует, а стафилококк посеялся, надо сделать что? Правильно, повторить посев еще раз. Золотистый стафилококк – это один из немногих микробов, чье наличие в отделяемом материале надо проверять дважды. Единственное исключение – это кровь, взятая непосредственно из сосудистого русла, чаще всего из вены. Наличие стафилококка в крови является поводом к немедленному назначению антибактериальной терапии, так как прямо указывает на наличие инфекции кровотока, а уж какого она генеза, спонтанного или ятрогенного, разбираться будете позже. Во всех остальных ситуациях проводится пересев с тщательным соблюдением техники забора материала (со стенок раны, а не гной, состоящий из дохлых нейтрофилов и нападавших сверху стафилококков) и правил асептики и антисептики, чтобы собственными стафилококками с кожи вновь забранный материал не контаминировать.
Чтобы понять, друг перед нами или враг, познакомимся со стафилококками более подробно.
- Дикий S.aureus, не видавший ни одного антибиотика, выглядит так
.jpg)
.jpg)
И нет, автор не сошла с ума – резистентность к ванкомицину у природных диких золотистых стафилококков – совершенно нормальное явление. Более того, попытка лечить такого возбудителя ванкомицином считается грубейшей ошибкой и закончится полным провалом в силу природной устойчивости к данному препарату. Это третье, о чем помнить необходимо.
Где мы встречаем таких S.aureus чаще всего? В носоглотках грудных младенцев или в их же кале, если придумали посеять. Почему? Потому что это представитель нормальной микрофлоры кожи, и ребенок сглатывает то, что живет в его носоглотке или слизывает с кожи матери. Надо лечить? В данной ситуации – ни в коем случае, иначе побьете нормальную микрофлору кожи и слизистых, и если очень повезет, то для ребенка это пройдет без последствий, но, скорее всего, получим стафилококка, вооруженного пенициллиназами, или MSSA. Повторимся еще раз – только в случае отсутствия клинической картины можно принимать такого рода решения. Во всех иных случаях необходима антибактериальная терапия, причем на длительный (до 28 суток) период времени.
.jpg)
.jpg)
При каких состояниях мы можем увидеть подобных возбудителей?
- Практически при всех инфекциях кожи и мягких тканей
- При внутрибольничных раневых инфекциях
- При диабетической стопе
- У внутривенных наркоманов
Типичным для клинической картины будет довольно агрессивное течение заболевания с яркими клиническими проявлениями ввиду того, что именно такой вид стафилококка обладает определенным набором ферментов, очень быстро расплавляющим окружающие ткани с образованием полостей и большим количеством гнойного отделяемого.
на антибиотикограмме будет выглядеть приблизительно так, оксациллин-резистентный, но ванкомицин-чувствительный (хотя при таком значении МПК уже возможны варианты)
.jpg)
Когда встречается? Все многообразие ятрогенных ВБИ к вашим услугам – почти все раневые инфекции и послеоперационные гнойные осложнения вне зависимости от их локализации. Повторимся в очередной раз – руки надо мыть, и мыть правильно. А еще закрывать маской не только рот, но и нос всем, кто хоть как-то касается открытых ран вне зависимости от причин их образования, так как стоит ране появиться, как стафилококк мгновенно превращается в зверя, осложняющего течение любого послеоперационного периода, особенно после операций, связанных с установками импланта. Более подробно о лечении предлагаем почитать в первой статье.
- В последнем пункте автор, по идее, должна была бы предложить испугаться самыми страшными ванкомицин-резистентными стафилококками и предложить схватиться за голову, но глядя на следующий набор антибиотикограмм, мы предлагаем посмотреть на то, что обычно сваливается с рук медицинского персонала в раны пациентов или контаминирует их биологический материал, который собран или хранится неправильно. Слава микробиологии, что подобные возбудители для пациентов, которые сохранили хоть какие-то остатки неспецифического иммунитета, не опасны, так как проходя эволюционные пути борьбы с ванкомицином, они почти полностью теряют факторы вирулентности. Но так как такие находки – это будни любой микробиологической лаборатории, то и вы о них тоже должны иметь представление. Уточним еще раз – это результаты посевов при полном отсутствии клинической картины бактериальной инфекции.
.jpg)
.jpg)
.jpg)
.jpg)
А теперь, тихо-тихо прошепчем, что иногда так может выглядеть приболевший микробиологический анализатор, который все, что в него не поставят, может определять как подобную страшную зверюгу. Хотя у вашего анализатора может быть какая-то своя болячка, и эти болячки лучше все-таки знать. Именно такого рода антибиотикограммы, как ничто другое наглядно показывают необходимость развития клинического мышления для умения отличать истинного возбудителя от контаминанта или нормального жителя человеческого организма, а также необходимости понимания, как работают методы микробиологической диагностики и варианты их ограничения.
Подведем краткие итоги нынешнего разговора:
- Стафилококк на неповрежденной коже и в носоглотке является нормальным представителем микромира, и лечить его не надо, более того, это может наносить прямой вред (как минимум кошельку)
- Существует целый перечень профессий, где носительство стафилококка строго нежелательно, и именно для этого проводятся контролирующие посевы среди медицинского персонала и работников пищевой отрасли
- Необходимо уверенно различать не только дикие и внутрибольничные штаммы, но и градацию по MRSA и MSSA, так как это прямо влияет на решение о применении конкретных препаратов при проведении эрадикационной терапии
- Антибиотикотерапия стафилококковых инфекций должна быть длительной, а не прерываться через 7-10 дней, даже если пациент демонстрирует положительную динамику. Недобитые золотистые стафилококки умеют метастазировать. Более подробно смотрим предыдущую статью
- Так как S.aureus занимает одно из ведущих мест в структуре внутрибольничных инфекций, особенно связанных с установкой имплантов, правила асептики и антисептики при работе с оными должны соблюдаться максимально жестко, иначе можно повторить дело Хабаровского кардиоцентра
Надеемся, что наш сегодняшний разговор был полезен и прояснил наиболее частые вопросы, связанные с микробиологическими особенностями S.aureus.
История применения антибактериальных препаратов переживает определенную цикличность. В доантибиотиковую эру среди возбудителей тяжелых инфекций преобладали Гр(+) возбудители, потом пришли антибиотики, и во время второй мировой основными возбудителями стали Гр(-) возбудители (по принципу «свято место пусто не бывает), но тут Гр(+) опять подняли голову, т.к. выяснилось, что свыше 80% штаммов стафилококков продуцируют пенициллиназу и разрушают бензилпенициллин и аминопенициллины.
Материалы предназначены исключительно для врачей и специалистов с высшим медицинским образованием. Статьи носят информационно-образовательный характер. Самолечение и самодиагностика крайне опасны для здоровья. Автор статей не дает медицинских консультаций: клинический фармаколог — это врач только и исключительно для врачей.
Автор: врач – клинический фармаколог Трубачева Е.С.
Staphylococcus aureus делится на две группы – мецитиллинчувствительные (MSSA) и мецитиллинрезистентные (MRSA):
1. MSSA вырабатывают беталактамазы – пенициллиназы, которые разрушают незащищенные пенициллины, но сохраняют высокую чувствительность к оксациллину и цефазолину. Кроме того они обладают лейкоцидином Пантона-Валентайна, который вызывает распад тканей практически в любом очаге, что служит косвенным подтверждением стафилококковой инфекции еще до получения микробиологического анализа.
2. MRSA в свою очередь подразделяются на госпитальные, которые характеризуются тем, что:
- являются полирезистентными, т.е. нечувствительные ко всему классу бета-лактамов, включая карбапенемы;
- у них отсутствует лейкоцидин Пантона-Валентайна, поэтому реже возникают деструктивные процессы (пациенты просто тихо и долго гниют, в отличие от инфекций, вызванных дикими штаммами)
- вызывают нозокомиальные пневмонии, инфекции кожи, ран, сепсис, бак эндокардит протезированных клапанов, инфекции имплантов.
и внебольничные MRSA, характеризующиеся:
- полирезистентностью;
- наличием лейкоцидина Пантона-Валентайна, благодаря которому они более агрессивны и вызывают некротизирующие заболевания кожи, сосудов и легких (особенно четко роль лейкоцидина Пантона-Валентайна видна в развитии некротизирующей пневмонии);
- в основном характерны для наркоманов и лиц без определенного места жительства.
Факторами риска MRSA инфекций являются
- назофарингеальная колонизация MRSA;
- лечение бета-лактамами (выбивается чувствительная флора и ее место занимает MRSA;
- нахождение в ОРИТ;
- повреждение кожи при длительной госпитализации более 2-х недель (п/о раны, ожоги, язвы);
- внутрисосудистые катетеры и импланты;
- мед. работники и члены их семей (соседи – реаниматологи или хирурги, если семьи между собой общаются)
Для чего мы все это вспоминаем? Дело в том, что основные проблемы, связанные со стафилококковой инфекцией, это:
- Широкое распространение в медицине и как следствие недооценка проблемы.
- Назначение эмпирической терапии без учета риска MRSA, и как следствие – отсрочка адекватной терапии, что в случае золотистого стафилококка в прямом смысле смерти подобно.
- Клиническая эффективность антибиотика in vitro не всегда тоже самое что in vivo (мы все таки отличаемся от чашки Петри).
- Неадекватное дозирование и длительность терапии (недостаточные дозы и короткие курсы) – отсюда осложнения и рецидивы.
- Высокая летальность при неадекватной терапии
Проводить антистафилококковую терапию меньше 3-х, а то и 4-х недель нельзя, так как для этого возбудителя характерно развитие метастатических очагов и весь процесс пойдет по новому, только с учетом еще и того, что возбудитель окажется резистентным к ранее проводимой терапии.
Когда можно лечить 2 недели стафилококковую инфекцию?
- В/в катетер или другой источник инфекции удален (хорошо если катетер, а если речь об импланте – его же не удалишь).
- Инфекционный эндокардит исключен по данным чрезпищеводной ЭХО-КГ.
- Отсутствуют импланты (протезированный клапан, кардиостимулятор, А-В фистула).
- Нормализация температуры и отрицательная гемокультура в течение 72 ч после удаления источника инфекции.
- Нет признаков метастатических очагов на других органах и тканях.
Во всех остальных случаях лечим 21-28 дней. А что происходит у нас? Максимум 10-14 дней пролечили и отпустили.
Антистафилококковые препараты мы обязаны назначить сразу как только получили положительную гемокультуру на стафилококк однократно! И только потом проводим повторную проверку, так как максимально раннее начало антибактериальной терапии в 2-3 раза снижает летальность.
Итак, как уже стало понятно, основную проблему представляют устойчивые формы S.aureus. Для их эрадикации были синтезированы и предлагаются к использованию следующие препараты
- Гликопептиды – Ванкомицин (1958 год) – категория доказательств IА
- Стрептогранины – Синерцид (в РФ отсут)
- Оксазолиндиноны – Линезолид – категория доказательств IА
- Липопептиды – Даптомицин – категория доказательств IА – Тигециклин – категория доказательств IIВ
1. Ванкомицин
Внедрен в практику в 1958 году, а первый устойчивый штамм стафилококка поймали только в 1996 году. Проблема с ванкомицинустойчивыми штамма стафилококка в том, что до сих пор нет отработанных схем преодоления этой самой устойчивости. Помимо прочего у возбудителей непрерывно нарастает МПК (минимальная подавляющая концентрация) к ванкомицину и сейчас при МПК 2 мы говорим о резистентном штамме.
Еще одна проблема – это плохо очищенные формы препарата. Если ванкомицин плохо очищен, то риск токсических нефропатий достигает 20%. К сожалению надо констатировать тот факт, что Ванкомицин отечественного разлива относится к плохо очищенным формам.
Основным и самым грозным осложнением является развитие острой почечной недостаточности, а она развивается у 40% пациентов, если дозировка препарата составляет более 4 гр/сут. А потому вводить данный препарат можно только под контролем клиренса креатинина (КК). То есть первый анализ мы проводим до введения препарата, второй через 2-3 дня и смотрим, если имеет место падение КК: если он падает на 25% – это говорит о нефротоксичном действии препарата, если на 50%, то препарат следует немедленно отменить.
Ванкомицин является бактериостатическим антибиотиком, эффективность действия мы оцениваем не ранее чем через 72 часа, а то и на 5-е сутки от начала терапии. Доза должна подбираться в соответствии с МПК возбудителя и под постоянным контролем клиренса креатинина. То есть для использования этого препарата нам необходимы хорошая клиническая и микробиологическая лаборатории.
Современные рекомендации по дозированию препарата выглядят следующим образом:
У Вас есть возможность это делать? У меня такой возможности не было и нет до сих пор, а потому мы до сих пор используем этот препарат как саперы на минном поле, где ошибиться можно только один раз.
Активность против MSSA у Ванкомицина сопоставима с плацебо, а значит применять его можно только при верифицированной MRSA, либо комбинировать с препаратами, активными против MSSA (цефазолином, например)
Следует так же помнить о том, что Ванкомицин, в виду строения его молекулы, а особенно ее размера, плохо проникает в ткани и проблемными его локализациями будут дыхательные пути, ЦНС, клапаны сердца и кости. А потому быстрого действия там не дождешься и терапия требуется очень и очень длительная.
В заключении хотелось бы сказать, что препарат хорош, но будет лучше, если вы его не будете назначать в самостоятельном режиме, а вызовете врача – клинического фармаколога, ибо назначение и дозировка таких вот препаратов входит в его непосредственные обязанности.
Что делать если клин. фарма нет, а пациент есть. И что надо соблюсти, чтобы безопасно применять ванкомицин?
- Использовать хроматографически очищенные препараты – Ванкоцин, Эдицин (в настоящих условиях это практически невозможно, торги они не выигрывают)
- Требуется коррекция гиповолемии, сердечной недостаточности (перфузия почек должна быть нормальное, иначе усугубим нефротоксический эффект)
- Избегать комбинаций с нефро- или ототоксичными препаратами (аминогликозидами, НПВС и т.д.)
- Коррекция режима дозирования по клиренсу креатинина. Если в течение 2-3-х дней он снизился вдвое от изначального, а данных за то, что он мог рухнуть не только от Ванко нет – это проявление нефротоксичности препарата.
2. Линезолид
Является чистым бактериостатиком. Производителем неоднократно заявлялось, что препарат эффективнее Ванкомицина, однако проведенные независимые метаанализы клинических исследований хорошего качества рандомизированных и с двойным слепым контролем показали, что единственное, где Линезолид имеет преимущество – это вентилятор-ассоциированный пневмонии, вызванные MRSA. В других случаях, в т.ч. и стафилококковой пневмонии, преимуществ нет никаких. Зато стоимость лечения повышается в разы.
Еще один момент, о котором умалчивается – это безопасность применения Линезолида. Да, нефротоксичности нет, но по данным того же метаанализа частота возникновения тромбоцитопений при его использовании в 11,72 раза выше чем в группе плацебо.
Таким образом, Линезолид является препаратом выбора при нозокомиальной вентилятор-ассоциированной MRSA пневмонии, где при его использовании летальность ощутимо ниже, чем при использовании ванкомицина.
3. Тигециклин (или тайгециклин)
Давайте разберемся и с ним, тем более к вам будут часто приходить и рассказывать про него как про самый препаратистый антибиотик в мире.
- Препарат позиционируется как новый класс антибиотиков, на деле это производный тетерациклина со всеми исходящими отсюда последствиями.
- Он является бактериостатиком, как все тетрациклины
- Имеет хорошую тканевую фармакокинетику, но при этом крайне низкие концентрации в плазме крови (ангиогенные инфекции из его показаний выпадают сразу)
А теперь о том, куда его следует применять:
- В качестве средства целенаправленной этиотропной терапии НИ, вызванных полирезистентными бактериями:
- БРЛС: альтернатива карбопенемам
- Ацинетобактер – альтернатива сульбактаму
- Клебсиела и E.coli – устойчивые к карбопенемам
- Stenotrophomonas maltophilia
Повторюсь еще раз, место его применения это ЦЕЛЕНАПРАВЛЕННАЯ ЭТИОТРОПНАЯ ТЕРАПИЯ, т.е. когда микроб четко установлен в результате бактериологического исследования вместе с чувствительностью к антибиотикам.
Повторюсь еще раз – место этого препарата в лечении грам-отрицательной инфекции, но никак не стафилококков. Да и вообще это препарат крайне глубокого резерва, как по характеристикам, так и по цене, т.к. в ближайшие 10 лет не будет ни одного нового препарата с Гр(-) активностью, так как их просто нет даже в проекте (медицина традиционно не успевает за возбудителями, а только пытается их догонять, о чем мы в самом начале и говорили, прослеживая эволюцию возбудителей)
4. Даптомицин.
Препарат появился у нас недавно, хотя во всем мире применяется уже очень давно (в Штатах с 2003 года)
Препарат относится к классу липопептидов и от всех имеющихся на данный момент антиMRSA препаратов отличается тем, что является бактерицидным. И этот самый эффект развивается у него очень быстро и нам не надо ждать нескольких дней. То есть антибактериальный эффект мы можем оценивать как и у всех бактерицидных препаратов через 48 часов от начала применения, а это очень важно у больных в тяжелом состоянии. Еще одним несомненным плюсом является то, что не происходит лизиса клеток и не увеличивается интоксикация.
Основными показаниями к применению являются:
- Эндокардит,
- Менингит,
- Остеомиелит,
- Инфекции у больных с нейтропенией,
- Сепсис стафилококковой этиологии
Также препарат может использоваться в эмпирической терапии (кстати, единственный из всех имеющихся на данный момент) Гр(+)инфекций, так как активность против MSSA и MRSA одинаковая.
Кроме того, препарат проявляет активность против MRSA в биопленках, а значит нет необходимости в удалении протезов и имплантов. А значит Даптомицин показан при ангиогенных инфекциях (бактериемиях), остеомиелите, бактериальном эндокардите.
- Препарат откровенно дорог
- В связи с крупным размером молекулы имеются проблемы с тканевой кинетикой, а потому пневмонии и инфекции ЦНС на данный момент мы им не лечим.
- Побочные эффекты – миалгии, производитель говорит о необходимости следить за КФК и обращать пристальное внимание на пациентов уже имеющих подобные проблемы.
- Описано несколько случаев эозинофильных пневмоний, а потому и на это следует обращать внимание, так как при своевременной диагностике и вовремя назначенной терапии, данный вид пневмонии проходит без следа.
Итак, сводя все к общему знаменателю:
Ванкомицин мы используем тогда, когда у нас верифицирован MRSA стафилококк, имеется хорошая микробиологическая лаборатория, которая нам даст его МПК и это МПК не будет больше 2 (иначе он уже резистентен), в наличие есть клинический фармаколог, который посчитает дозу, будет ее контролировать и корригировать согласно изменениям клиренса креатинина. Но при этом мы помним о том, что препарат не работает на MSSA. И конечно же мы продолжаем помнить о его высокой нефротоксичности, если не имеем возможности пользоваться высокоочищенными формами.
Тигециклину нечего делать антистафилококковой терапии, этот препарат предназначен только для этиотропной терапии Гр(-)инфекции.
В связи с высокой активностью против MRSA и MSSA, быстрым бактерицидным эффектом является препаратом выбора при ангиогенных инфекциях, сепсисе и инфекционном эндокардите, а также препаратом выбора при эмпирической терапии MRSA+MSSA. Не использовать при лечении нозокомиальных пневмоний и инфекций ЦНС.
Читайте также:

