Золотистый стафилококк в позвоночнике лечение
Обновлено: 24.04.2024
Прошло много лет после написания первой статьи, посвященной лечению инфекций, вызванных золотистым стафилококком. За это время автор, будем надеяться, немного помудрела и приобрела кое-какой опыт в более детальной диагностике вышеупомянутых состояний, чем и хотела бы поделиться с многоуважаемой аудиторией в надежде, что, возможно, поможет каждому из вас в рутинной ежедневной работе, так как с этой зверюшкой сталкивается буквально каждый, кто надел белый халат и уж тем более хирургический костюм.
Материалы предназначены исключительно для врачей и специалистов с высшим медицинским образованием. Статьи носят информационно-образовательный характер. Самолечение и самодиагностика крайне опасны для здоровья. Автор статей не дает медицинских консультаций: клинический фармаколог — это врач только и исключительно для врачей.
Автор: Трубачева Е.С., врач – клинический фармаколог
Прошло много лет после написания первой статьи, посвященной лечению инфекций, вызванных золотистым стафилококком. За это время автор, будем надеяться, немного помудрела и приобрела кое-какой опыт в более детальной диагностике вышеупомянутых состояний, чем и хотела бы поделиться с многоуважаемой аудиторией в надежде, что, возможно, поможет каждому из вас в рутинной ежедневной работе, так как с этой зверюшкой сталкивается буквально каждый, кто надел белый халат и уж тем более хирургический костюм.
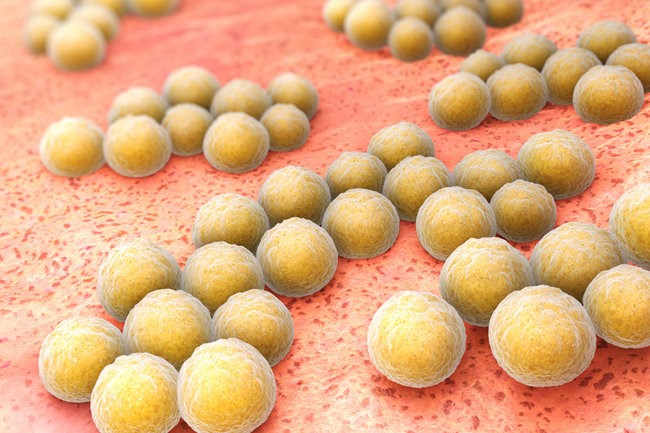
Сначала повторим общеизвестные факты: S.aureus относится к грамположительным коккам и являются чуть ли не основной причиной большого количества инфекций кожи и мягких тканей, а так же ведущей причиной послеоперационных раневых инфекций.
Выделяют следующие разновидности золотистого стафилококка:
- Дикий S.aureus
- MSSA – метициллин-чувствительные стафилококки
- MRSA – метициллин-резистентные, которые обладают устойчивостью ко всему бета-лактамному ряду, сохраняя клинически важную чувствительность к ванкомицину, линезолиду и тигециклину
- VRSA и VISA – ванкомицин-устойчивые штаммы, к счастью, крайне редко встречающиеся и в основном наблюдающиеся в отделениях онкогематологии научно-исследовательских центров у пациентов, проходящих курс полихимиотерапии с последующей трансплантацией костного мозга
И сейчас обсудим первые три более подробно, так как именно они являются той причиной, ради которой повторно поднята данная тема, в том числе и по просьбам читателей (за что выражаем отдельную признательность).
Первое, что необходимо не просто запомнить, а буквально зазубрить наизусть – золотистый стафилококк, он же S.aureus, является нормальным жителем на неповрежденной коже и слизистых оболочках. Еще раз – нормальным, но только на неповрежденной коже и вне зависимости от антибиотикочувствительности пойманных экземпляров. Если кожа по тем или иным причинам поражается (например, сахарным диабетом) или повреждается, стафилококк тут же из милого соседа превращается в злейшего врага. Все как у людей – стоит дать слабину, и ближайшие соседи начнут добивать с ласковой улыбкой.
Таким образом, когда вы получаете результат микробиологического исследования образца, взятого с кожи (или из носоглотки), и видите там золотистого стафа, то должны понимать, кто перед вами, и насколько этот кто-то имеет отношение к текущему процессу.
Второе: если клиника отсутствует, а стафилококк посеялся, надо сделать что? Правильно, повторить посев еще раз. Золотистый стафилококк – это один из немногих микробов, чье наличие в отделяемом материале надо проверять дважды. Единственное исключение – это кровь, взятая непосредственно из сосудистого русла, чаще всего из вены. Наличие стафилококка в крови является поводом к немедленному назначению антибактериальной терапии, так как прямо указывает на наличие инфекции кровотока, а уж какого она генеза, спонтанного или ятрогенного, разбираться будете позже. Во всех остальных ситуациях проводится пересев с тщательным соблюдением техники забора материала (со стенок раны, а не гной, состоящий из дохлых нейтрофилов и нападавших сверху стафилококков) и правил асептики и антисептики, чтобы собственными стафилококками с кожи вновь забранный материал не контаминировать.
Чтобы понять, друг перед нами или враг, познакомимся со стафилококками более подробно.
- Дикий S.aureus, не видавший ни одного антибиотика, выглядит так
.jpg)
.jpg)
И нет, автор не сошла с ума – резистентность к ванкомицину у природных диких золотистых стафилококков – совершенно нормальное явление. Более того, попытка лечить такого возбудителя ванкомицином считается грубейшей ошибкой и закончится полным провалом в силу природной устойчивости к данному препарату. Это третье, о чем помнить необходимо.
Где мы встречаем таких S.aureus чаще всего? В носоглотках грудных младенцев или в их же кале, если придумали посеять. Почему? Потому что это представитель нормальной микрофлоры кожи, и ребенок сглатывает то, что живет в его носоглотке или слизывает с кожи матери. Надо лечить? В данной ситуации – ни в коем случае, иначе побьете нормальную микрофлору кожи и слизистых, и если очень повезет, то для ребенка это пройдет без последствий, но, скорее всего, получим стафилококка, вооруженного пенициллиназами, или MSSA. Повторимся еще раз – только в случае отсутствия клинической картины можно принимать такого рода решения. Во всех иных случаях необходима антибактериальная терапия, причем на длительный (до 28 суток) период времени.
.jpg)
.jpg)
При каких состояниях мы можем увидеть подобных возбудителей?
- Практически при всех инфекциях кожи и мягких тканей
- При внутрибольничных раневых инфекциях
- При диабетической стопе
- У внутривенных наркоманов
Типичным для клинической картины будет довольно агрессивное течение заболевания с яркими клиническими проявлениями ввиду того, что именно такой вид стафилококка обладает определенным набором ферментов, очень быстро расплавляющим окружающие ткани с образованием полостей и большим количеством гнойного отделяемого.
на антибиотикограмме будет выглядеть приблизительно так, оксациллин-резистентный, но ванкомицин-чувствительный (хотя при таком значении МПК уже возможны варианты)
.jpg)
Когда встречается? Все многообразие ятрогенных ВБИ к вашим услугам – почти все раневые инфекции и послеоперационные гнойные осложнения вне зависимости от их локализации. Повторимся в очередной раз – руки надо мыть, и мыть правильно. А еще закрывать маской не только рот, но и нос всем, кто хоть как-то касается открытых ран вне зависимости от причин их образования, так как стоит ране появиться, как стафилококк мгновенно превращается в зверя, осложняющего течение любого послеоперационного периода, особенно после операций, связанных с установками импланта. Более подробно о лечении предлагаем почитать в первой статье.
- В последнем пункте автор, по идее, должна была бы предложить испугаться самыми страшными ванкомицин-резистентными стафилококками и предложить схватиться за голову, но глядя на следующий набор антибиотикограмм, мы предлагаем посмотреть на то, что обычно сваливается с рук медицинского персонала в раны пациентов или контаминирует их биологический материал, который собран или хранится неправильно. Слава микробиологии, что подобные возбудители для пациентов, которые сохранили хоть какие-то остатки неспецифического иммунитета, не опасны, так как проходя эволюционные пути борьбы с ванкомицином, они почти полностью теряют факторы вирулентности. Но так как такие находки – это будни любой микробиологической лаборатории, то и вы о них тоже должны иметь представление. Уточним еще раз – это результаты посевов при полном отсутствии клинической картины бактериальной инфекции.
.jpg)
.jpg)
.jpg)
.jpg)
А теперь, тихо-тихо прошепчем, что иногда так может выглядеть приболевший микробиологический анализатор, который все, что в него не поставят, может определять как подобную страшную зверюгу. Хотя у вашего анализатора может быть какая-то своя болячка, и эти болячки лучше все-таки знать. Именно такого рода антибиотикограммы, как ничто другое наглядно показывают необходимость развития клинического мышления для умения отличать истинного возбудителя от контаминанта или нормального жителя человеческого организма, а также необходимости понимания, как работают методы микробиологической диагностики и варианты их ограничения.
Подведем краткие итоги нынешнего разговора:
- Стафилококк на неповрежденной коже и в носоглотке является нормальным представителем микромира, и лечить его не надо, более того, это может наносить прямой вред (как минимум кошельку)
- Существует целый перечень профессий, где носительство стафилококка строго нежелательно, и именно для этого проводятся контролирующие посевы среди медицинского персонала и работников пищевой отрасли
- Необходимо уверенно различать не только дикие и внутрибольничные штаммы, но и градацию по MRSA и MSSA, так как это прямо влияет на решение о применении конкретных препаратов при проведении эрадикационной терапии
- Антибиотикотерапия стафилококковых инфекций должна быть длительной, а не прерываться через 7-10 дней, даже если пациент демонстрирует положительную динамику. Недобитые золотистые стафилококки умеют метастазировать. Более подробно смотрим предыдущую статью
- Так как S.aureus занимает одно из ведущих мест в структуре внутрибольничных инфекций, особенно связанных с установкой имплантов, правила асептики и антисептики при работе с оными должны соблюдаться максимально жестко, иначе можно повторить дело Хабаровского кардиоцентра
Надеемся, что наш сегодняшний разговор был полезен и прояснил наиболее частые вопросы, связанные с микробиологическими особенностями S.aureus.
Статья - Инфекции позвоночника (спинальные инфекции) - расскажет Вам о причинах возникновения болезни, ее лечении, симптомах. Узнайте, как правильно диагностировать Инфекции позвоночника (спинальные инфекции) | Центр Дикуля
Инфекции позвоночника бывают разнообразными, и включают в себя как спонтанно возникающие, так и вторичные инфекции из других очагов в организме. Инфекции позвоночника достаточно редко встречаются, особенно в развитых странах. По оценкам, ежегодно встречается 0,037 промилле инфекций диска, 0,037 бактериального остеомиелита позвоночника и столько же встречается эпидуральный абсцесс. Послеоперационные инфекции в среднем составляют от 1% после обычной дискэктомии и до 6-8% после операций с применением фиксаторов.
Определенные группы людей находятся в большей группе риска заболеть спинальными инфекциями. Это люди злоупотребляющие курением, страдающие ожирением, недостаточностью питания, с ослабленным иммунитетом, либо с синдромом приобретенного иммунодефицита возникшим в результате лечения онкозаболеваний, страдающие артритом, после трансплантации органов, наркоманы, больные сахарным диабетом, или те, подвергся инвазивным процедурам на мочевых путях. Достаточно редко встречается как туберкулез, так и сифилитическое поражение позвоночника.
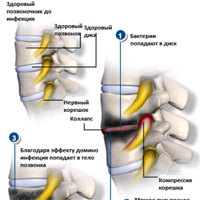
Симптомы варьируют в зависимости от конкретной инфекции, но в первую очередь заслуживают внимания постоянные боли в спине без наличия в анамнезе травмы. Нередко диагностика бывает запоздалой из-за не всегда выраженной симптоматики или трудности идентификации болевого синдрома, и отсутствие системных признаков, таких как повышение температуры. Лабораторное исследования также могут ввести в заблуждение так, как например может быть нормальное количество лейкоцитов, рентгенограммы часто не выявляют никаких отклонений на ранних стадиях заболевания, и даже более чувствительные диагностические методы, такие как сканирование костей (КТ) может быть вначале без патологических признаков в течение первой недели заболевания. На сегодняшний день при подозрении на спинальную инфекцию единственным достоверным методом диагностики является МРТ. Кроме того, скрининг-тестом является анализ крови на скорость оседания эритроцитов (СОЭ).
Дисцит или инфекция дискового пространства, это воспалительное поражение межпозвонкового диска, которое возникает чаще у детей, чем у взрослых. Причина дисцита до сих пор является предметом дискуссий,но большинство исследователей считают это заболевание инфекционным. Инфекция, вероятно, начинается в одной из концевых пластин, и диск заражается вторично. Сильная боль в спине, которая возникает неожиданно является характерным симптомом дисцита. И хотя большинство детей будет продолжать ходить, несмотря на боль, маленькие дети могут отказываться двигаться. Характерный признаком является также расширение позвоночника на рентгенографии и полный отказ ребенка сгибать позвоночник.У детей с дисцитом,как правило, нет системных заболеваний. У них редко повышенная температура и количество лейкоцитов в крови часто в норме. Тем не менее, скорость оседания эритроцитов(СОЭ), как правило, увеличена.
Боковые рентгенограммы позвоночника обычно визуализируют сужение дискового пространства с эрозией позвоночных концевых пластин смежных позвонков. КТ может быть полезным для локализации поражения, которые достаточно трудно диагностировать клинически. В некоторых случаях томография может быть ложно отрицательна, но это не является поводом исключения инфекции диска. Магнитно-резонансная томография (МРТ) может оказаться необходима для диагностики локализации инфекции диска. Лечебные мероприятия при дисцитах до сих пор являются темой для дискуссий. Большинство медиков рекомендуют иммобилизацию с помощью гипса и,как правило, во многих случаях такая тактика оправдана.Кроме того рекомендуется антибиотикотерапия из-за инфекционного генеза дисцита (в организме человека это чаще всего золотистый стафилококк). При лечении дисцита у детей, биопсия обычно не требуется. Биопсия может быть назначена подросткам или взрослым, особенно если есть подозрение на употребление наркотиков так,как в таких случаях будут другие микроорганизмы, а не золотистый стафилококк.
Остеомиелит позвоночника представляет собой инфицирование тела позвонка. Причиной остеомиелита могут быть как бактерии,так и грибки. Наиболее часто возникает бактериальный или пиогенный остеомиелит. Проявления остеомиелита отличаются от инфекции дискового пространства. Это могут быть инфекции из других частей тела, занесенные в позвоночник гематогенно. У этих пациентов присутствуют системные признаки такие,как повышение температуры, увеличение количества лейкоцитов и СОЭ. Среднее время от начала симптомов до постановки окончательного диагноза, как правило, колеблется от 8 недель до 3 месяцев. Начало заболевания, как правило, острое, и с боль в спине является наиболее частым симптомом. Боль локализуется вначале на уровне вовлеченной области с постепенным увеличением интенсивности. Боль в конце концов становится настолько интенсивной, что не проходит даже в положении лежа.
Обычно неврологических симптомов не бывает до тех пор, пока в ходе процесса не происходит разрушение и распад тела позвонка. Другие симптомы включают: периодические ознобы,снижение веса, расстройство мочеиспускания(дизурия), светобоязнь, и выделения из послеоперационной раны (если проводилось оперативное вмешательство). Возбудителем заболевания, как правило, является золотистый стафилококк. При остеомиелите требуется длительная антибиотикотерапия — как правило в течение шести недель антибиотики вводятся внутривенно и потом еще в течение шести недель прием антибиотиков перорально. Оперативное лечение может быть необходимо при хронических инфекциях таких, как туберкулез позвоночника. Чаще всего такие инфекции встречаются встречаются в слаборазвитых странах.
Эпидуральный абсцесс - это инфекция, которая возникает в пространстве вокруг твердой мозговой оболочки(дуральной оболочкой), которая окружает спинной мозг и нервные корешки. Эти очаги с содержанием гноя могут окружать спинной мозг и / или нервные корешки и оказывать компрессионное воздействие с нарушением функций нервных структур. Симптомы могут быть незначительными (парестезии — ощущение покалывания булавкой) или незначительная общая слабость.Необходим осмотр спины для оценки наличия асимметрии, паравертебрального отека и болезненности позвонков,а также изучение неврологического статуса. В диагностическом плане имеет значение СОЭ также, как и при других спинальных инфекциях. Количество лейкоцитов в крови и посев крови используются в качестве базовых параметров. Обычная рентгенограмма не информативна. Магнитно-резонансная томография (МРТ) является методом диагностики для выбора тактики лечения. МРТ исследование позволяет определить наличие компрессии спинного мозга и состояние спинного мозга, определить наличие и размер абсцесса, позволяет диагностировать сопутствующий остеомиелит, и исключить образование паравертебрального набора жидкости. Показаниями к хирургической декомпрессии спинного мозга являются увеличение неврологического дефицита, стойкие сильные боли, высокая температура и увеличение лейкоцитов.
Послеоперационные инфекции. Увеличение частоты послеоперационных раневых инфекций связано с увеличением использования фиксаторов. Преимущества жесткой фиксации позвоночника с помощью специальных (металлических) фиксаторов заключаются в возможности ускорить регенерацию и уменьшить внешнюю иммобилизацию в послеоперационном периоде, чтобы увеличить скорость слияния и снижения послеоперационной внешней иммобилизации -результаты этого очевидны. Но инфекция является одним из основных недостатков имплантации инородных тел в позвоночник. Профилактическое применения антибиотиков имеет определенный эффект, но небольшой процент осложнений избежать не удается. В основном риск инфекции зависит от исходного состояния организма. Недавно было определено, что, в частности, курильщики находятся в очень высокой группе риска послеоперационного заражения. Диагноз послеоперационной инфекции, как правило, выставляется на основе выделения из раны или неожиданного появления болей. Другими симптомами являются повышенная температура, формирование гематомы покраснение и отек в области раны, повышенная СОЭ и повышение количества лейкоцитов в крови. После того, как возникло подозрение на инфекцию необходимо оперативное исследование раны, которое выполняется в операционной и под наркозом. Это необходимо для активной хирургической санации всей раны. Диагностическая визуализация имеет ограниченное применение. Лечение инфицированных ран включает санацию, антибиотики широкого спектра, введение антибиотиков в рану,орошение раны или открытое лечение. Возможно можно потребоваться удаление омертвевших тканей. Если же такое лечение не дает результат может потребоваться удаление имплантатов. Наиболее распространенной инфекцией являются бактерии золотистого стафилококка. Продолжительность внутривенного введения антибиотиков зависит от инфекции. Лечение послеоперационных инфекций может быть длительным и дорогостоящим, но всегда оптимальным.
Использование материалов допускается при указании активной гиперссылки на постоянную страницу статьи.
1 Научно-исследовательский института травматологии и ортопедии Министерства здравоохранения Республики Казахстан
В связи с применением новых технологий в травматологии и ортопедии во всех странах мира увеличивается количество проведенных операций по их сложности и количеству с применением металлических конструкций, поэтому не уменьшается количество осложнений, таких как остеомиелит и перипротезные инфекции. Этиология остеомиелита Республики Казахстан приведена за два года наблюдения, золотого стафилококка в 2017–2018 гг. в среднем было выделено 47 %. Изучив чувствительность золотистого стафилококка, сделали вывод о том, что она сохранена у цефалоспоринов III-IV поколения, фторхинолонов, аминогликозидов, карбапенемов. При выявлении метициллин-резистентного Staphylococcus aureus (MRSA) для лечения используются резервные антибиотики, чаще других группа гликопептидов, которые представлены в наших исследованиях ванкомицином. Все вышеупомянутые препараты могут использоваться в качестве эмпирической терапии. Успех лечения этой патологии напрямую зависит от своевременного микробиологического исследования. Сходством с международными литературными данными и проведенными нами исследованиями в Республике Казахстан явилось выделение золотистого стафилококка в 50 % случаев, как наиболее частого этиологического фактора. Различие наших исследований выявлено в обнаружении метициллин-резистентных штаммов золотистого стафилококка в 15 % случаев, что в 3 раза меньше международных данных и более чем в 2 раза российских.

1. Винклер Т., Трампуш А., Ренц Н., Перка К., Божкова С.А. Классификация и алгоритм диагностики и лечения перипротезной инфекции тазобедренного сустава // Травматология и ортопедия России. 2016. № 1. С. 33–45.
2. Божкова С.А., Тихилов Р.М., Краснова М.В., Рукина А.Н. Ортопедическая имплант-ассоциированная инфекция: ведущие возбудители, локальная резистентность и рекомендации по антибактериальной терапии // Травматология и ортопедия России. 2013. № 4. С. 5–15.
3. Corvec S., Portillo M.E., Pasticci B.M., Borens O., Trampuz A. Epidemiology and new developments in the diagnosis of prosthetic joint infection. Int. J. Artif Organs. 2012. Vol. 35. № 10. Р. 923–934.
4. Тихилов Р.М., Шубняков И.И., Коваленко А.Н., Тотоев З.А., Лю Б., Билык С.С. Структура ранних ревизий эндопротезирования тазобедренного сустава // Травматология и ортопедия России. 2014. № 2. C. 5–13.
5. Alsaba F. Raja, Furqan Ali, Inshad Ali Khan, Abdul Sami Shawl, Daljit Singh Arora, Bhahwal Ali Shah, Subhash Chandra Taneja. Antistaphylococcal and biofilm inhibitory activities of acetyl-11-keto-β-boswellic acid from Boswellia serrate. BMC Microbiology. 2011. Vol. 11. P. 1–9. DOI: 10.1186/1471-2180-11-54.
6. Thomas Fintan Moriarty, Sebastian A. J. Zaat, Henk J. Busscher. Biomaterials-associated infection: a perspective from the clinic In: Biomaterials Associated Infection: Immunological Aspects and Antimicrobial Strategies; Moriarty. Springer. London, 2013. Р. 3–24.
7. Приказ МЗ СССР 535 от 22.04.1985 г. Об унификации микробиологических методов исследования, применяемых в клинико-диагностических лабораториях лечебно-профилактических учреждений.
8. Полякова Е.М., Божкова С.А. Сравнительная характеристика фенотипической и генотипической устойчивости к аминогликозидам штаммов Staphylococcus aureus, выделенных в травматолого-ортопедическом стационаре // Клиническая лабораторная диагностика. 2015. Т. 60. № 11. С. 50–53.
9. Привольнев В.В., Родин А.В., Каракулина Е.В. Местное применение антибиотиков в лечении инфекций костной ткани // Клиническая микробиология и антимикробная химиотерапия. 2012. Т.14. № 2. С. 118–131.
10. Розова Л.В., Годовых Н.В. Сравнительная характеристика видового состава микроорганизмов при хроническом посттравматическом и гематогенном остеомиелите // Гений Ортопедии. 2014. Т. 2. С. 56–59.
11. Божкова С.А. Профиль резистентности возбудителей как основа выбора эффективного антибиотика при стафилококковых инфекциях протезированных суставов // Клиническая микробиология и антимикробная химиотерапия. 2013. Т. 15. № 2. С. 115–123.
12. Божкова С.А., Разоренов В.Л., Петрова Т.М. Микробиологический мониторинг – основа рациональной стратегии и тактики антибактериальной терапии инфекции костей и протезированных суставов // Тольяттинский медицинский консилиум. 2011. Т. 3–4. С. 33–42.
14. Определение чувствительности микроорганизмов к антимикробным препаратам. Клинические рекомендации Министерства здравоохранения РФ. М., 2014. 154 с.
Инновационные технологии, применяемые в медицинской практике при лечении травм опорно-двигательного аппарата, в частности при переломах длинных костей, привели к появлению новых различных методов оперативного лечения. С каждым годом повышается количество хирургической помощи при получении пациентами различных переломов. Надежная стабилизация, ранняя активация и укорочение сроков нетрудоспособности сегодня возможны только с использованием металлоконструкций, которые повышают риск инфекционных осложнений. Частота последних достигла 5,9–13,6 %, что является основной и наиболее затратной медицинской проблемой с социально значимыми потерями и возникновением инвалидизации. Генерализация остеомиелитной инфекции может привести к сепсису и летальному исходу [1–3]. Стоимость лечения пациента с остеомиелитом в Великобритании составляет 30 до 50 тысяч долларов [4]. На лечение больных с осложнениями в травматологии и ортопедии, в том числе больных с остеомиелитом, в США в текущем 2020 г. планируется потратить 1,620 млрд долларов [5].
Среди возбудителей остеомиелитов по частоте на первом месте стоят Staphylococcus aureus и коагулазонегативные стафилококки (КНС), главным образом это Staphylococcus epidermidis [6; 7]. В случаях выделения из очага остеомиелита метициллинорезистентных штаммов стафилококков, частота которых в отделениях ОРИТ может достигать 88,9 %, возникает проблема подбора антибиотиков [8]. Резистентность к антибактериальным препаратам возникает по разным причинам, в том числе из-за нерационального назначения препаратов, снижения иммунного ответа макроорганизма [9; 10]. Чаще всего наблюдается нарушение сроков применения, число которых доходит до 35 % [11; 12].
Целью данного исследования явилось изучение основного возбудителя остеомиелита и его чувствительности к некоторым группам антимикробных препаратов в Республике Казахстан.
Материалы и методы исследования
Исследование проведено с соблюдением этических принципов медицинских исследований согласно Хельсинкской декларации Всемирной медицинской ассоциации.
Биоматериал исследовался общепринятыми методами, обязательно его подвергали количественному бактериологическому исследованию. Бактериологическое исследование проводили согласно протоколу исследования (окраска мазков по Граму, посев на твердые пластинчатые среды с дальнейшей идентификацией выделенных микроорганизмов проводили классическим бактериологическим методом по изучению морфологических, культуральных и биохимических свойств. Антибиотикочувствительность выделенных штаммов определяли методом стандартных дисков в соответствии с клиническими рекомендациями [13]. Полученные данные обработаны методом вариационной статистики.
Результаты исследования и их обсуждение
Проведенное нами в течение данного времени исследование этиологии инфекций остеомиелитов после оказания травматологической и ортопедической помощи пациентам показало следующее. В 2017 г. проведено 966 исследований биоматериала с данной нозологической формой, из них отрицательных результатов получено 13, что составляет 1,3 %. В 2018 г. проведено 967 исследований, выявлено 310 (32 %) отрицательных результатов. В 2017 г. стафилококков выделено – 722 (75,7 %), в 2018 г. – 464 (70,6 %) от общего количества всей идентифицированной микрофлоры. За два исследуемых года в раневом отделяемом был выделен 21 вид микроорганизмов, однако ведущую роль в послеоперационных осложнениях играли 4 основных вида: Staphylococcus аureus, Staphylococcus epidermidis, Pseudomonas aeruginosa, E. сoli, что представлено в табл. 1.
За два исследуемых года из раневого отделяемого пациентов, страдающих остеомиелитом, наиболее часто высевался стафилококк (в 77,88 % посевов), из которых лидирующее место занимает Staphylococcus аureus (табл. 1). Выделение этого возбудителя из раневого отделяемого пациентов в 2017 г. составило 44,7 %, в 2018 г. – 50,5 %. Наши исследования подтвердили ведущее значение золотистого стафилококка в этиологии возникновения хронических остеомиелитов у взрослых.
Анализ чувствительности основных антибиотиков, которые были использованы в работе лаборатории, показал высокий уровень чувствительности Staphylococcus аureus к большинству антимикробных препаратов. Самая низкая чувствительность установлена к группе пенициллинов, так, чувствительность к амоксиклаву выявлена у только 31,9 % штаммов в 2017 г. и у 28 % в 2018 г. К оксациллину наблюдали значительно большую чувствительность: 81 % – в 2017 г. и 79 % – в 2018 г. Вместе с тем чувствительность к амоксиклаву и оксациллину за исследуемый период незначительно снизилась (на 3,9 % и 2 % соответственно) (табл. 2).
К группе цефалоспоринов в наших исследованиях проявилась более высокая чувствительность, чем к первой группе антибиотиков (пенициллины). Так, к цефазолину (I поколение) в 2017 г. были чувствительны 85,3 % штаммов и в 2018 г. – 83,4 %. К цефтриаксону (III поколение) чувствительность в 2017 г. проявили 92,3 % штаммов и 91,1 % соответственно в 2018 г. В этой группе антибиотиков самая высокая чувствительность проявилась к цефепиму (IV поколение цефалоспоринов): 98 % – в 2017 г. и 97,5 % – в 2018 г. В данной группе антибиотиков также прослеживается незначительное динамичное снижение чувствительности (цефазолин на 1,9 %, цефтриаксон на 1,2 % и цефепим на 0,5 %) в среднем на 1,2 % в год.
Инфекции позвоночника одни из самых распространенных симптомов, возникновение которых происходит спонтанно или вторично от разных заболеваний в организме пациента. В успешных странах инфекция позвоночника очень редкое явление.

ДОСТУПНЫЕ ЦЕНЫ НА КУРС ЛЕЧЕНИЯ

Мягко, приятно, нас не боятся дети


ДОСТУПНЫЕ ЦЕНЫ НА КУРС ЛЕЧЕНИЯ

Мягко, приятно, нас не боятся дети

В результате каждый год выявляется 0,037 промилле с инфекцией диска и только 0,037 бактериальный остеомиелит, что сопровождается эпидуральным абсцессом. Только 1% приходится на послеоперационные инфекции дискэктомии и до 6-8% это операция с использованием фиксаторов.
Опасность заболеть спинальными инфекциями очень велик у людей, злоупотребляющих курением, недостатком питания, со слабым иммунитетом, которые страдают ожирением, зачастую есть признаки приобретённого иммунодефицита в ходе лечения онкологических заболеваний у многих людей, при наличии артрита, после пересадки органа, наркоманы или подвергшиеся инвазийными процедурами в мочевыводящих путях. Иногда встречается у больных туберкулезом или сифилитическими изменениями в позвоночнике.
Наличие или присутствие болевых ощущений в спине без присутствия анамнеза травмы, характерных инфекций, но иногда диагностика случается запоздавшей и не всегда проявляется в этих симптомах, инфекции болевого синдрома, сопровождающиеся отсутствием увеличения температуры. Исследования в лабораторных условиях еще не настолько точные, при нормальном уровне лейкоцитов рентгенограммы не полностью показываются изменение на ранней стадии болезни, есть более точные способы, например, сканирование костной системы (КТ) на начальной стадии без патологий в первые дни болезни. В наше время самой точной диагностикой на выявление спинальной инфекции является диагностирование через МРТ, с помощью которого получение анализа крови на скорость оседания эритроцитов будет более точным.
Воспалительное поражение межпозвоночного диска называется дисцитом или инфекцией в дисковом пространстве, возникновение его наблюдается у ребенка чаще, чем у взрослого. Дисцит до сих пор у исследователей стал предметом обсуждения, но ряд ученых выделяют эту болезнь как инфекционную. Возможное инфекционное заболевание появляется на концевых пластинах, при этом диски заражены вторично. Дисцит сопровождается сильными болевыми ощущениями в спинном отделе позвоночника.
При этом большинство детей будут продолжать двигаться, несмотря на боли в позвоночнике, но слишком маленькие при этой боли не смогут передвигаться из-за боли в позвоночнике. Основным признаком считают расширение в позвоночнике на рентгенографии, сопровождается отказом ребенка сгибаться, в большей степени заболеваний дисцитом у детей системных нет. Уровень лейкоцитов нормальный, температура нормальная, что сопровождается увеличением СОЭ.
Визуально можно наблюдать сужение дисков пространства с эрозией позвонка в концевых пластинках соседних позвонков боковыми рентгенограммами позвонка. Очень сложно диагностировать локализацию поражения позвоночника, с применением КТ все локализации поражений будут выявлены и диагностированы в лучший результат. В результате несколько случаев томография возможна как отрицательной, что обосновывается отсутствием инфекции диска.
Наиболее распространенным способом выявления локализации инфекций является диагностирование с помощью магнитно-резонансной томографии, при этом диагностировании лечебные мероприятия дисцита еще пока являются темой множества обсуждений. Многие медики советуют и применяют в лечение больных иммобилизацию с применением гипса, что зачастую оправдывает свое применение на практике. Все эти мероприятия сопровождаются антибиотикотерапией, потому что в организме пациента присутствует золотистый стафилококк, поражающий инфекционный генезис диска дисцита. Обычно при лечении детей биопсия не нужна. В подозрение на употребление наркотиков у подростков или у взрослых будет назначена биопсия, потому что есть наличие на присутствие других микроорганизмов, и не выявляется золотистый стафилококк.
Остеомиелит позвоночника – зачастую является инфицированием тела позвоночника, сопровождая за собой появление бактерий и грибка в ряде частого возникновения бактериального или пиогенного остеомиелита. Это проявление остеомиелита не похоже на инфекцию в дисковом пространстве, сопровождающееся инфекцией частей тела и присутствующее в позвоночнике гематогенно. Больной зачастую чувствует увеличенную температуру, растут лейкоциты и СОЭ.
Окончательный диагноз проявления всех симптомов можно считать полностью готовым от восьми недель до трех месяцев. На начальной стадии у больного проявляется боль в спине, это самая распространённая симптоматика. На начальной стадии лечения присутствие боли уменьшается вовлеченной области с периодической интенсивностью, а в самом конце приобретает продолжительный характер с переходом пациента в лежачее состояние.
Невралгический симптом может быть до тех пор, пока нет разрушения тела позвоночника. Такое сопровождается: снижением массы тела, частым ознобом, расстройством мочеиспускания (дизурией), боязнью света, появлением выделений из раны пациента (с оперативным вмешательством), причиной которого служит золотистый стафилококк. Лечение остеомиелита сопровождается продолжительной терапией в течение 6 недель, лекарства вводят внутривенно, и продолжается повторение курса еще на 6 недель перорально. Лечение туберкулеза позвоночника с сопровождением хронической инфекции требует быстрого вмешательства со стороны медиков, и зачастую такое вмешательство распространено в менее развитых странах.
Эпидуральный абсцесс
Инфекционное заболевание, возникающее в окружающем спинном мозге и нервных корешках пространства, вокруг твёрдой мозговой оболочки (дуральная оболочка). Очаги этой инфекции содержат гнойные выделения, они окружают спинной мозг и нервные окончания, при этом оказывают сдавливающее воздействие, которое приводит к нарушению функций в нервных структурах.
Признаки эпидурального абсцесса проявляются слабо в виде парестезии (ощущение лёгкого покалывания иголкой), или небольшой общей слабости всего организма. Для выявления и диагностирования заболевания необходимо проведение ряда процедур, включающих в себя: общий осмотр спины, позволяющий определить наличие асимметрии, паравертебрального отёка и болезненности позвонков; исследование общего неврологического статуса. Кроме того, большое значение в диагностике эпидурального абсцесса, как и при других инфекциях позвоночника, имеет исследование анализа крови, в частности, показатель СОЭ.
К сожалению, проведение рентгенологического исследования не даёт полной картины заболевания, ввиду малой информативности обычной рентгенограммы. К современным методам исследования, позволяющим более точно диагностировать заболевание и выбрать необходимую тактику лечения, является метод магнитно-резонансной томографии. Исследование с применением МРТ даёт возможность установить, как наличие сдавливания спинного мозга, а также его состояние, так и определить присутствие абсцесса.
Кроме этого, МРТ помогает выявить возможные сопутствующие заболевания, в частности, остеомиелит, а также даёт возможность исключить образование паравертебрального набора жидкости. Наличие у человека устойчивых болей в спине, высокой температуры тела, повышение уровня лейкоцитов в крови, а также повышение неврологического дефицита, могут быть показаниями к операционному вмешательству с целью декомпрессии спинного мозга.
Послеоперационные инфекции
В послеоперационный период необходимо уделять большое внимание профилактике возникновения послеоперационных инфекций. Любая операция несёт с собой значительные нагрузки на организм пациента, его иммунитет. В послеоперационных период возрастает риск возникновения и развития различных инфекций, связанных как с общим ослаблением организма, так и с применением различного рода имплантатов, вживляемых в организм пациента, а также использование разнообразных фиксаторов, применение которых направленного на скорейшее заживление и выздоровление.
Так, с одной стороны, очевидна польза жёсткой фиксации позвоночника в послеоперационных период при помощи специальных фиксаторов, изготовленных из различных металлов, применение которых даёт возможность ускорить процесс заживления, восстановления и уменьшает внешнюю иммобилизацию (фиксацию). С другой стороны, частота использования имплантат и особых металлизированных фиксаторов неизбежно приводит к росту числа послеоперационных инфекций, что является одной из важных проблем при проведении операций на позвоночнике. К симптомам послеоперационной инфекции относятся: высокую температуру, наличие отёчности вокруг раны, гематому, повышение СОЭ и количество лейкоцитов в крови, боль в области раны, а также выделения из раны.
При наличии данных симптомов проводятся дополнительные исследования, в том числе, повторное оперативное вмешательство с целью выявления и устранения очага инфекции. При проведении оперативного вмешательства для устранения причин инфекции проводится санация раны, в случае необходимости производится замена или удаление имплантат. В послеоперационный период применяются различные виды антибиотиков и иные лекарственные препараты. Проведение повторного хирургического вмешательства несёт с собой дополнительные затраты, а также связано с увеличением общего периода выздоровления, но даёт нужный положительный эффект.
История применения антибактериальных препаратов переживает определенную цикличность. В доантибиотиковую эру среди возбудителей тяжелых инфекций преобладали Гр(+) возбудители, потом пришли антибиотики, и во время второй мировой основными возбудителями стали Гр(-) возбудители (по принципу «свято место пусто не бывает), но тут Гр(+) опять подняли голову, т.к. выяснилось, что свыше 80% штаммов стафилококков продуцируют пенициллиназу и разрушают бензилпенициллин и аминопенициллины.
Материалы предназначены исключительно для врачей и специалистов с высшим медицинским образованием. Статьи носят информационно-образовательный характер. Самолечение и самодиагностика крайне опасны для здоровья. Автор статей не дает медицинских консультаций: клинический фармаколог — это врач только и исключительно для врачей.
Автор: врач – клинический фармаколог Трубачева Е.С.
Staphylococcus aureus делится на две группы – мецитиллинчувствительные (MSSA) и мецитиллинрезистентные (MRSA):
1. MSSA вырабатывают беталактамазы – пенициллиназы, которые разрушают незащищенные пенициллины, но сохраняют высокую чувствительность к оксациллину и цефазолину. Кроме того они обладают лейкоцидином Пантона-Валентайна, который вызывает распад тканей практически в любом очаге, что служит косвенным подтверждением стафилококковой инфекции еще до получения микробиологического анализа.
2. MRSA в свою очередь подразделяются на госпитальные, которые характеризуются тем, что:
- являются полирезистентными, т.е. нечувствительные ко всему классу бета-лактамов, включая карбапенемы;
- у них отсутствует лейкоцидин Пантона-Валентайна, поэтому реже возникают деструктивные процессы (пациенты просто тихо и долго гниют, в отличие от инфекций, вызванных дикими штаммами)
- вызывают нозокомиальные пневмонии, инфекции кожи, ран, сепсис, бак эндокардит протезированных клапанов, инфекции имплантов.
и внебольничные MRSA, характеризующиеся:
- полирезистентностью;
- наличием лейкоцидина Пантона-Валентайна, благодаря которому они более агрессивны и вызывают некротизирующие заболевания кожи, сосудов и легких (особенно четко роль лейкоцидина Пантона-Валентайна видна в развитии некротизирующей пневмонии);
- в основном характерны для наркоманов и лиц без определенного места жительства.
Факторами риска MRSA инфекций являются
- назофарингеальная колонизация MRSA;
- лечение бета-лактамами (выбивается чувствительная флора и ее место занимает MRSA;
- нахождение в ОРИТ;
- повреждение кожи при длительной госпитализации более 2-х недель (п/о раны, ожоги, язвы);
- внутрисосудистые катетеры и импланты;
- мед. работники и члены их семей (соседи – реаниматологи или хирурги, если семьи между собой общаются)
Для чего мы все это вспоминаем? Дело в том, что основные проблемы, связанные со стафилококковой инфекцией, это:
- Широкое распространение в медицине и как следствие недооценка проблемы.
- Назначение эмпирической терапии без учета риска MRSA, и как следствие – отсрочка адекватной терапии, что в случае золотистого стафилококка в прямом смысле смерти подобно.
- Клиническая эффективность антибиотика in vitro не всегда тоже самое что in vivo (мы все таки отличаемся от чашки Петри).
- Неадекватное дозирование и длительность терапии (недостаточные дозы и короткие курсы) – отсюда осложнения и рецидивы.
- Высокая летальность при неадекватной терапии
Проводить антистафилококковую терапию меньше 3-х, а то и 4-х недель нельзя, так как для этого возбудителя характерно развитие метастатических очагов и весь процесс пойдет по новому, только с учетом еще и того, что возбудитель окажется резистентным к ранее проводимой терапии.
Когда можно лечить 2 недели стафилококковую инфекцию?
- В/в катетер или другой источник инфекции удален (хорошо если катетер, а если речь об импланте – его же не удалишь).
- Инфекционный эндокардит исключен по данным чрезпищеводной ЭХО-КГ.
- Отсутствуют импланты (протезированный клапан, кардиостимулятор, А-В фистула).
- Нормализация температуры и отрицательная гемокультура в течение 72 ч после удаления источника инфекции.
- Нет признаков метастатических очагов на других органах и тканях.
Во всех остальных случаях лечим 21-28 дней. А что происходит у нас? Максимум 10-14 дней пролечили и отпустили.
Антистафилококковые препараты мы обязаны назначить сразу как только получили положительную гемокультуру на стафилококк однократно! И только потом проводим повторную проверку, так как максимально раннее начало антибактериальной терапии в 2-3 раза снижает летальность.
Итак, как уже стало понятно, основную проблему представляют устойчивые формы S.aureus. Для их эрадикации были синтезированы и предлагаются к использованию следующие препараты
- Гликопептиды – Ванкомицин (1958 год) – категория доказательств IА
- Стрептогранины – Синерцид (в РФ отсут)
- Оксазолиндиноны – Линезолид – категория доказательств IА
- Липопептиды – Даптомицин – категория доказательств IА – Тигециклин – категория доказательств IIВ
1. Ванкомицин
Внедрен в практику в 1958 году, а первый устойчивый штамм стафилококка поймали только в 1996 году. Проблема с ванкомицинустойчивыми штамма стафилококка в том, что до сих пор нет отработанных схем преодоления этой самой устойчивости. Помимо прочего у возбудителей непрерывно нарастает МПК (минимальная подавляющая концентрация) к ванкомицину и сейчас при МПК 2 мы говорим о резистентном штамме.
Еще одна проблема – это плохо очищенные формы препарата. Если ванкомицин плохо очищен, то риск токсических нефропатий достигает 20%. К сожалению надо констатировать тот факт, что Ванкомицин отечественного разлива относится к плохо очищенным формам.
Основным и самым грозным осложнением является развитие острой почечной недостаточности, а она развивается у 40% пациентов, если дозировка препарата составляет более 4 гр/сут. А потому вводить данный препарат можно только под контролем клиренса креатинина (КК). То есть первый анализ мы проводим до введения препарата, второй через 2-3 дня и смотрим, если имеет место падение КК: если он падает на 25% – это говорит о нефротоксичном действии препарата, если на 50%, то препарат следует немедленно отменить.
Ванкомицин является бактериостатическим антибиотиком, эффективность действия мы оцениваем не ранее чем через 72 часа, а то и на 5-е сутки от начала терапии. Доза должна подбираться в соответствии с МПК возбудителя и под постоянным контролем клиренса креатинина. То есть для использования этого препарата нам необходимы хорошая клиническая и микробиологическая лаборатории.
Современные рекомендации по дозированию препарата выглядят следующим образом:
У Вас есть возможность это делать? У меня такой возможности не было и нет до сих пор, а потому мы до сих пор используем этот препарат как саперы на минном поле, где ошибиться можно только один раз.
Активность против MSSA у Ванкомицина сопоставима с плацебо, а значит применять его можно только при верифицированной MRSA, либо комбинировать с препаратами, активными против MSSA (цефазолином, например)
Следует так же помнить о том, что Ванкомицин, в виду строения его молекулы, а особенно ее размера, плохо проникает в ткани и проблемными его локализациями будут дыхательные пути, ЦНС, клапаны сердца и кости. А потому быстрого действия там не дождешься и терапия требуется очень и очень длительная.
В заключении хотелось бы сказать, что препарат хорош, но будет лучше, если вы его не будете назначать в самостоятельном режиме, а вызовете врача – клинического фармаколога, ибо назначение и дозировка таких вот препаратов входит в его непосредственные обязанности.
Что делать если клин. фарма нет, а пациент есть. И что надо соблюсти, чтобы безопасно применять ванкомицин?
- Использовать хроматографически очищенные препараты – Ванкоцин, Эдицин (в настоящих условиях это практически невозможно, торги они не выигрывают)
- Требуется коррекция гиповолемии, сердечной недостаточности (перфузия почек должна быть нормальное, иначе усугубим нефротоксический эффект)
- Избегать комбинаций с нефро- или ототоксичными препаратами (аминогликозидами, НПВС и т.д.)
- Коррекция режима дозирования по клиренсу креатинина. Если в течение 2-3-х дней он снизился вдвое от изначального, а данных за то, что он мог рухнуть не только от Ванко нет – это проявление нефротоксичности препарата.
2. Линезолид
Является чистым бактериостатиком. Производителем неоднократно заявлялось, что препарат эффективнее Ванкомицина, однако проведенные независимые метаанализы клинических исследований хорошего качества рандомизированных и с двойным слепым контролем показали, что единственное, где Линезолид имеет преимущество – это вентилятор-ассоциированный пневмонии, вызванные MRSA. В других случаях, в т.ч. и стафилококковой пневмонии, преимуществ нет никаких. Зато стоимость лечения повышается в разы.
Еще один момент, о котором умалчивается – это безопасность применения Линезолида. Да, нефротоксичности нет, но по данным того же метаанализа частота возникновения тромбоцитопений при его использовании в 11,72 раза выше чем в группе плацебо.
Таким образом, Линезолид является препаратом выбора при нозокомиальной вентилятор-ассоциированной MRSA пневмонии, где при его использовании летальность ощутимо ниже, чем при использовании ванкомицина.
3. Тигециклин (или тайгециклин)
Давайте разберемся и с ним, тем более к вам будут часто приходить и рассказывать про него как про самый препаратистый антибиотик в мире.
- Препарат позиционируется как новый класс антибиотиков, на деле это производный тетерациклина со всеми исходящими отсюда последствиями.
- Он является бактериостатиком, как все тетрациклины
- Имеет хорошую тканевую фармакокинетику, но при этом крайне низкие концентрации в плазме крови (ангиогенные инфекции из его показаний выпадают сразу)
А теперь о том, куда его следует применять:
- В качестве средства целенаправленной этиотропной терапии НИ, вызванных полирезистентными бактериями:
- БРЛС: альтернатива карбопенемам
- Ацинетобактер – альтернатива сульбактаму
- Клебсиела и E.coli – устойчивые к карбопенемам
- Stenotrophomonas maltophilia
Повторюсь еще раз, место его применения это ЦЕЛЕНАПРАВЛЕННАЯ ЭТИОТРОПНАЯ ТЕРАПИЯ, т.е. когда микроб четко установлен в результате бактериологического исследования вместе с чувствительностью к антибиотикам.
Повторюсь еще раз – место этого препарата в лечении грам-отрицательной инфекции, но никак не стафилококков. Да и вообще это препарат крайне глубокого резерва, как по характеристикам, так и по цене, т.к. в ближайшие 10 лет не будет ни одного нового препарата с Гр(-) активностью, так как их просто нет даже в проекте (медицина традиционно не успевает за возбудителями, а только пытается их догонять, о чем мы в самом начале и говорили, прослеживая эволюцию возбудителей)
4. Даптомицин.
Препарат появился у нас недавно, хотя во всем мире применяется уже очень давно (в Штатах с 2003 года)
Препарат относится к классу липопептидов и от всех имеющихся на данный момент антиMRSA препаратов отличается тем, что является бактерицидным. И этот самый эффект развивается у него очень быстро и нам не надо ждать нескольких дней. То есть антибактериальный эффект мы можем оценивать как и у всех бактерицидных препаратов через 48 часов от начала применения, а это очень важно у больных в тяжелом состоянии. Еще одним несомненным плюсом является то, что не происходит лизиса клеток и не увеличивается интоксикация.
Основными показаниями к применению являются:
- Эндокардит,
- Менингит,
- Остеомиелит,
- Инфекции у больных с нейтропенией,
- Сепсис стафилококковой этиологии
Также препарат может использоваться в эмпирической терапии (кстати, единственный из всех имеющихся на данный момент) Гр(+)инфекций, так как активность против MSSA и MRSA одинаковая.
Кроме того, препарат проявляет активность против MRSA в биопленках, а значит нет необходимости в удалении протезов и имплантов. А значит Даптомицин показан при ангиогенных инфекциях (бактериемиях), остеомиелите, бактериальном эндокардите.
- Препарат откровенно дорог
- В связи с крупным размером молекулы имеются проблемы с тканевой кинетикой, а потому пневмонии и инфекции ЦНС на данный момент мы им не лечим.
- Побочные эффекты – миалгии, производитель говорит о необходимости следить за КФК и обращать пристальное внимание на пациентов уже имеющих подобные проблемы.
- Описано несколько случаев эозинофильных пневмоний, а потому и на это следует обращать внимание, так как при своевременной диагностике и вовремя назначенной терапии, данный вид пневмонии проходит без следа.
Итак, сводя все к общему знаменателю:
Ванкомицин мы используем тогда, когда у нас верифицирован MRSA стафилококк, имеется хорошая микробиологическая лаборатория, которая нам даст его МПК и это МПК не будет больше 2 (иначе он уже резистентен), в наличие есть клинический фармаколог, который посчитает дозу, будет ее контролировать и корригировать согласно изменениям клиренса креатинина. Но при этом мы помним о том, что препарат не работает на MSSA. И конечно же мы продолжаем помнить о его высокой нефротоксичности, если не имеем возможности пользоваться высокоочищенными формами.
Тигециклину нечего делать антистафилококковой терапии, этот препарат предназначен только для этиотропной терапии Гр(-)инфекции.
В связи с высокой активностью против MRSA и MSSA, быстрым бактерицидным эффектом является препаратом выбора при ангиогенных инфекциях, сепсисе и инфекционном эндокардите, а также препаратом выбора при эмпирической терапии MRSA+MSSA. Не использовать при лечении нозокомиальных пневмоний и инфекций ЦНС.
Читайте также:

